Диагностикум эритроцитарный дифтерийный антигенный жидкий для микрометода
1.1. В методических рекомендациях (далее - МР) представлена рациональная и эффективная тактика использования серологических методов диагностики и мониторинга иммунитета к дифтерийной инфекции.
1.2. В настоящих МР описаны используемые в последние годы международные и отечественные методы определения противодифтерийных антител, а также предложен наиболее надежный и перспективный метод иммуноферментного анализа (далее - ИФА) для определения суммарных и высокоавидных антител, его стандартное применение, в том числе предложены надежные критерии оценки защитных уровней, необходимые для выявления среди детей и взрослых групп повышенного риска и оценки напряженности индивидуального и коллективного иммунитета к дифтерийной инфекции.
1.3. Настоящие МР предназначены для врачей-эпидемиологов и микробиологов и носят рекомендательный характер.
2.1. Несмотря на высокие показатели привитости населения от дифтерии в разных регионах России периодически регистрируются случаи заболевания дифтерией или носительства Corynebacterium diphtheria, особенно среди лиц в закрытых коллективах [3, 4, 8].
2.2. В настоящее время, спустя 15 лет после прошедшей эпидемии дифтерии, повсеместно отмечается снижение внимания клиницистов к этой инфекции. Профилактические и диагностические обследования проводятся, но не в полном объеме [12].
2.3. Как известно, защищенность от дифтерии в нашей стране определяется с помощью реакции прямой гемагглютинации (РПГА) [13]. Однако результат реакции, выражаемый в титрах, не позволяет точно определить количество антитоксических антител (АТ-АТ), а, значит, и оценить состояние иммунитета против дифтерии. Разработка и повсеместное внедрение в практику оценочной шкалы защищенности от дифтерии на основании определения количества АТ-АТ позволили контролировать качество вакцинации 1 [14]. Однако информация о количестве вырабатываемых противодифтерийных антител не всегда дает достоверный ответ на вопрос о степени защищенности от дифтерии. Это было продемонстрировано во время последней эпидемии дифтерии в России и после нее, когда у заболевших (до 40 % случаев) находили в крови АТ-АТ зашитых уровней [9, 10]. Проведенными исследованиями установлена определяющая роль высокоавидных АТ-АТ в защите от дифтерии, которые могут быть определены наряду с количеством суммарных АТ-АТ в иммуноферментном анализе [2, 5, 6, 16]. При этом была показана динамика формирования и утраты АТ-АТ, равно как и показателя их авидности, изучены особенности специфического иммунитета к дифтерии среди различных групп населения [1, 7, 11, 15]. Тем не менее, отсутствие программ и схем исследования при диагностике дифтерии и изучении напряженности иммунитета у населения, содержащих новые аргументированные данные, не позволяют полноценно и качественно проводить бактериологический и иммунологический контроль в отношении защищенности к дифтерии на местах.
0,01 МЕ/мл - минимальная степень защиты,
0,01 - 0,09 МЕ/мл - некоторая степень защиты,
0,1 - 0,9 МЕ/мл - защитный уровень антител,
1,0 и > МЕ/мл - стойкая длительная невосприимчивость к дифтерии.
3.2. Список оборудования и материалов, необходимых для проведения исследования, представлен в прилож. 1.
4.1. Серологический контроль состояния иммунитета
у детей и подростков
4.1.1. Серологический контроль иммунитета в различных группах позволяет представить иммунологическую структуру населения и выявить группы повышенного риска, определить состояние вакцинального иммунитета как в ранние, так и в отдаленные сроки после вакцинации.
4.1.2. Серологический контроль состояния и длительности сохранения вакцинального иммунитета необходимо осуществлять систематически методом выборочного серологического обследования (мониторинга) различных групп населения в городах и сельских районах каждой области, края.
4.1.3. Обследованию подлежат привитые против дифтерии дети и подростки от 3 до 18 лет каждой возрастной группы (3 года, 4 года, 5 лет и т.д., особое внимание следует обратить на детей 9 - 13 лет).
4.1.4. Серологический контроль следует проводить, начиная с групп детей 3 лет не ранее, чем через 6 месяцев после последней прививки. К этому возрасту должен быть закончен первичный вакцинальный комплекс против дифтерии, включающий вакцинацию и первичную ревакцинацию (V и RV).
4.1.5. В случае отсутствия материально-технических возможностей обследования каждой возрастной группы детей и подростков можно отобрать возрастные группы, подлежащие очередной ревакцинации (4 - 5 лет, 9 - 10 лет, 14 - 15 лет).
4.1.6. При получении неудовлетворительных иммунологических показателей в этих группах контроль за иммунитетом следует провести в каждой возрастной группе.
4.2. Серологический контроль состояния иммунитета у взрослых
4.2.2. Особое внимание должно уделяться лицам в закрытых коллективах.
5.1. Реакция пассивной гемагглютинации (РПГА)
Для постановки реакции используется диагностикум дифтерийный эритроцитарный антигенный. Поскольку срок годности эритроцитарных диагностикумов составляет 1 год, необходимо перед каждым проведением серологического исследования сывороток проверять активность препарата. Проверка проводится с контрольным антитоксином, приложенным к комплекту, либо используется национальный препарат дифтерийного антитоксина, очищенного ферментолизом и специфической сорбцией, диагностический сухой. Допускается исследование контрольной сыворотки (лабораторный образец) с известным титром дифтерийных антител. Если диагностикум выявляет в сыворотке антитела в концентрации на 2 - 3 разведения ниже, чем они в ней содержатся, то такой препарат не пригоден для дальнейшего исследования.
РПГА ставят в два этапа согласно инструкции, прилагаемой к препарату: 1-й - подготовка к реакции; 2-й - основной опыт. Ответ может быть получен на 2-е сутки с момента получения исследуемого материала лабораторией.
Однако ряд зарубежных исследователей отмечает возможность получения ложноположительных данных и несовпадение результатов, полученных в реакции нейтрализации in vivo и методах in vitro. По данным ряда авторов коэффициент корреляции между результатами, полученными в РПГА и PH, составляет всего 0,6.
5.2. Реакция нейтрализации (PH) в культуре клеток Vero
Поэтому в качестве второго стандарта была принята реакция нейтрализации (PH) в культуре клеток Vero, поскольку она лишена недостатков биологического теста, более стандартна и наглядна. Коэффициент корреляции результатов, полученных в PH в культуре клеток Vero, с результатами, полученными в классическом методе (на лабораторных животных), составляет 0,98. Этот метод гораздо экономичнее, быстрее и проще в постановке. Однако достоверность результатов PH во многом определяется стандартностью культуры клеток и всех контролей (токсинов и антитоксинов).
В реакции используется цветная проба, основанная на способности токсина изменять метаболическую активность зараженных клеток, что определяют по цвету индикатора, содержащегося в питательной среде. В не пораженных токсином культурах клеток под влиянием выделяющихся продуктов клеточного метаболизма pH питательной среды сдвигается в кислую сторону, вызывая изменение цвета индикатора. В пораженных токсином культурах в результате дегенерации клеток их метаболическая активность подавляется, и цвет фенолового красного не изменяется или изменяется частично.
В реакции используется токсин 0,0002 Lf/мл и антитоксин 0,032 МЕ/мл (National Collection of Type Cultures Diphtheriae Reference Laboratory, Central Health Laboratory (CPHL), London, UK). При постановке реакций применяют культуру клеток Vero, получаемую из лаборатории детских вирусных инфекций НИИЭМ им. Пастера, в концентрации 2,5 ⋅ 10 5 клеток/мл. Содержание антитоксических антител определяют от 0,000125 МЕ/мл и выше,
5.3. Иммуноферментный анализ (ИФА)
Тест-система для ИФА представляет собой набор, предназначенный для определения суммарных антитоксических антител, и включает следующие реагенты: иммуносорбент 1-96-луночный полистироловый или хлорвиниловый планшет для иммунологических реакций, в лунках которого сорбирован анатоксин дифтерийный очищенный; конъюгат - иммуноглобулины (F(аb')2-фрагменты) диагностические против IgG человека, аффинноочищенные, меченные пероксидазой; контрольный положительный образец (К+) - сыворотка или плазма крови человека с известным титром дифтерийных антител; контрольный отрицательный образец (К-) - сыворотка или плазма крови человека, не содержащая дифтерийных антител; концентрат фосфатно-солевого буферного раствора с твином (ФСБ-Т×25); блокатор - белково-солевой раствор (Б); цитратно-фосфатный буферный раствор с перекисью водорода (ЦФБР); хромоген - тетраметилбензидин (ТМБ); стоп-реагент (СР) - 5 %-ый раствор серной кислоты. Специальная компьютерная программа, прилагаемая к набору, дает возможность производить перерасчет показателей оптической плотности в показатели антитоксических международных единиц.
Для определения индекса авидности противодифтерийных антитоксических антител в сыворотке (плазме) крови человека разработано дополнение к набору, которое включает в себя следующие ингредиенты: контрольный положительный образец высокоавидных антител (КА+) - сыворотка крови человека с известным индексом авидности противодифтерийных антитоксических антител (индекс авидности сыворотки указан на этикетке флакона); контрольный отрицательный образец низ-коавидных антител (КА-) - сыворотка крови человека, содержащая противодифтерийные антитоксические антитела низкой авидности; фосфатно-солевой буфер, содержащий 3М калия роданистого для определения авидности противодифтерийных антитоксических антител (ФСБ-3МКрод). Набор рассчитан на исследование 29 образцов сыворотки (плазмы) крови для определения индекса авидности противодифтерийных антитоксических антител.
Тест-система укомплектована национальным стандартом антитоксина, измеряемым в МЕ/мл. Расчет концентрации АТ проводится с учетом коэффициента по калибровочной кривой, что делает результаты более достоверными. Сравнительный анализ нейтрализующего эффекта испытуемых сывороток людей в клеточной культуре Vero и других линиях показал хорошую корреляцию (r = 0,91) с результатами, полученными в модифицированных вариантах ИФА, что подтверждает адекватность применения ИФА для измерения уровня антитоксического иммунитета к дифтерии у здоровых людей.
5.3.1. Определение уровня противодифтерийных АТ
с помощью тест-системы ИФА
1. Приготовить разведения исследуемых сывороток 1:20, 1:200, 1:2000 на буферном растворе № 1 (содержимое флакона концентрата ФСБ-Т×25 развести в 600 мл дистиллированной вода, содержимое флакона с блокатором растворить в 5,0 мл дистиллированной воды, полученный раствор добавить в емкость с раствором ФСБ-Т и тщательно перемешать) в макропланшете непосредственно перед использованием.
2. Приготовить непосредственно перед использованием рабочие разведения: отрицательной сыворотки - 1:20, добавляя в содержимое флакона (0,2 мл) 3,8 мл буферного раствора; положительной сыворотки - 1:200 (отмерить 0,01 мл растворенного К+ и добавить 2,0 мл раствора № 1), из которого затем приготовить отдельно каждое разведение - 1:2, 1:4, 1:8 и 1:16 (в итоге получить пять разведений К+ - 1:200, 1:400, 1:800, 1:1 600 и 1:3200).
3. Полистироловые планшеты с иммунобилгоированным антитоксином трижды отмыть буферным раствором (в объеме 0,3 мл в каждую лунку), удалить буферный раствор, постукивая по сложенной в несколько слоев фильтровальной бумаге, помещенной на поддон.
7. Удалить жидкость из лунок, планшеты промыть, как указано в пункте 5.
8. Внести в каждую лунку планшета по 0,2 мл раствора ТМБ (готовят непосредственно перед внесением в лунки планшетов). Для этого содержимое флакона с ТМБ перенести во флакон с ЦФБР и тщательно перемешать. Раствор готовить в защищенном от прямых солнечных лучей месте. Планшет выдержать при температуре (20 ± 2) °С в течение 20 мин в защищенном от света месте.
9. Реакцию остановить добавлением в каждую лунку по 0,1 мл стоп-реагента (СР).
5.3.2. Определение индекса авидности противодифтерийных
антитоксических антител
1. Внести контрольные и исследуемые образцы. После внесения контролем К+, К- и раствора № 1 добавить КА+, КА- и все испытуемые сыворотки в двух повторностях (одну повторность КА+, КА- и рабочие сыворотки промыть раствором № 1, а вторую - 3М раствором калия роданистого). Планшет герметично закрыть и выдержать (60 ± 5) мин при температуре (37 ± 1) °С. следуя инструкции к набору дата ИФА. Затем содержимое лунок собрать в сосуд с дезинфицирующим раствором (5 - 6 % раствор монохлорамина).
2. Первая промывка планшета.
Контроли К+, К- и первую повторность КА+, КА- и рабочих сывороток промыть 5 раз раствором № 1, вторую повторность КА+, КА- и рабочих сывороток промыть 4 раза 3МКрод, а 5-й раз - раствором № 1.
3. Далее все этапы реакции выполнить согласно основной инструкции к набору.
Регистрация и оценка результатов
Результаты ИФА регистрируют на спектрофотометре при двух длинах волн 450/620 нм.
Индекс авидности (ИА) рассчитывают по формуле:
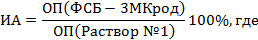
ОП(ФСБ - 3МКрод) - оптическая плотность в лунках, обработанных раствором детергента (ФСБ-3МКрод), ОП(Раствор № 1) - оптическая плотность в лунке, обработанной обычным промывочным раствором, используемым в тест-системе (раствор № 1).
КА+ должен содержать высокоавидные противодифтерийные антитоксические антитела с индексом авидности не менее 90 %. КА- должен содержать низкоавидные противодифтерийные антитоксические антитела с индексом авидности не более 10 %.
Индекс авидности рабочих сывороток более 30 % соответствует вероятности защиты от заболевания дифтерией на 95 %, а индекс авидности 10 % является показателем критического уровня, ниже которого вероятность заболевания возрастает до 99 %.
1. Показатель ОП рабочей сыворотки в лунке, обработанной ФСБ-3МКрод, равен 0,24, а в лунке, обработанной раствором № 1, равен 0,37. Индекс авидности, рассчитанный по приведенной формуле, равен 65 %, что соответствует высокой степени защиты от дифтерии (более 30 %).
2. Показатель ОП рабочей сыворотки в лунке, обработанной ФСБ-3МКрод, равен 0,05, а в лунке, обработанной раствором № 1, равен 0,62. Индекс авидности, рассчитанный по приведенной формуле, равен 8 %, что соответствует низкой степени защиты от дифтерии (менее 10 %).
6.1. Оценка индивидуальной защищенности
от дифтерийной инфекции
Этап 1. Отобрать кровь у обследуемого в пробирку с активатором свертывания. Внести в систему баз данных информацию об обследуемом по форме (табл. 1).
Профессия или учебное заведение
Наличие хронического или острого заболевания
Есть или нет подозрение на дифтерию
Этап 2. Определить с помощью ИФА тест-системы и 3М роданистого калия количество противодифтерийных антитоксических антител, выраженное в МЕ/мл, и индекс авидности антител, выраженный в %. Количество антител рассчитать по данным оптической плотности в лунках планшета с помощью компьютерной программы, входящей в качестве приложения к тест-системе. Индекс авидности (ИА) антител рассчитать по формуле;
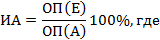
ОП(Е) - оптическая плотность в лунке, обработанной детергентом, ОП(А) - оптическая плотность в лунке, обработанной обычным промывочным раствором, используемым в тест-системе.
Этап 3. Сделать прогноз защищенности обследуемого на будущее. Поскольку авидность антител, защищающая от заболевания дифтерией, снижается быстрее, чем количественный показатель суммарных антител, то в прогнозе необходимо ориентироваться на индекс авидности антител. Для этого найти на графике (рис. 1) значение, наиболее приближенное к полученному индексу авидности антител (с учетом прошлой вакцинации, если она была проведена в ближайший год), и определить по графику, через сколько месяцев индекс авидности снизится до критической отметки (10 %). Очередную ревакцинацию (или повторное исследование) рекомендуется пройти до этой даты.
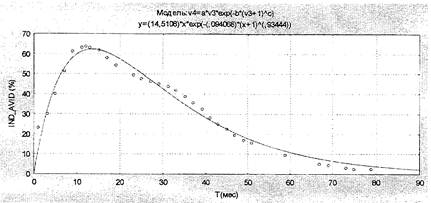
Рис. 1. Математическая модель из исходных данных
о динамике индексов авидности после ревакцинации
Примечания. IND_AVID (%) - индексы авидности (%), Т (мес.) - время после ревакцинации (месяцы). Средняя погрешность модели = 5 %.
6.2. Оценка коллективной защищенности
от дифтерийной инфекции
Этап 1. Определить контингент для изучения напряженности иммунитета к дифтерии с учетом групп риска. Исследование лучше проводить спустя 3 - 5 лет после очередной ревакцинации. Отобрать кровь для исследования. Заполнить индивидуальную информацию в базе данных для каждого обследуемого
Этап 2. Определить индивидуальные показатели защищенности от дифтерии и рассчитать вероятность заболевания на момент обследования. Затем определить средние показатели для всей группы обследованных.
Этап 3. Определить прогноз для всего коллектива в отношении динамики авидности антитоксических антител. Рассчитать сроки очередного обследования или вакцинации.
Все рекомендуемые мероприятия не идут в разрез с нормативными документами по вакцинопрофилактике и контролю иммунитета, а предполагают индивидуальный подход ко всем обследуемым лицам и повышенное внимание к представителям из групп риска.
1. Стандартное оборудование клинических лабораторий для взятия крови.
2. Стандартное оборудование для проведения серологических реакций.
3. Ламинарный или настольный бокс, ТУ 9452003-215-04087-5.
4. Фотометр микропланшетный (ридер).
1. Алексеева Е.А. Оптимизация мониторинга противодифтерийного иммунитета детей в Вологодской области/Е.А. Алексеева, Д.А. Краева, Г.Я. Ценева, Г.И. Беспалова//Материалы X Съезда ВНПОЭМП, Инфекция и иммунитет. Москва, 2012. № 2. С. 77 - 78.
2. Алексеева Е.А. Эффективность высокоавидных антитоксических антител в оценке невосприимчивости к дифтерийной инфекции/Е.А. Алексеева, Л.А. Краева. Г.Я. Ценева, А.М. Николаева//Профилактическая и клиническая медицина. 2011. № 1. С. 38.
4. Краева Л.А. Качественные показатели антитоксических антител в оценке противодифтерийного иммунитета/Л.А. Краева, Ф.С. Носков, Г.Я. Ценева//Ж. мед. иммунол. С.-Пб., 2005. Т. 7. № 2 - 3. С. 274.
7. Краева Л.А. Роль высокоавидных антитоксических антител в оценке невосприимчивости к дифтерийной инфекции/Л.А. Краева, Г.Я. Ценева, А.М. Николаева, Е.А. Алексеева//Эпидемиология и инфекционные болезни. 2011. № 4. С. 20 - 24.
12. Ценева Г.Я. Уровень антитоксического противодифтерийного иммунитета у населения Северо-Западного окрута РФ и пути оптимизации мониторинга инфекции/Г.Я. Ценева, Л.А. Краева, Е.Е. Щедеркина//Эпидемиология и вакцинопрофилактика. 2010. № 5 (54). С. 51 - 54.
14. Efsltatiou A., Maple Р.А.С. Manual for the laboratory diagnosis of diphtheria. Copenhagen//The Expanded Programme on Immunization in the European Region of WHO. 1994 (ICP/EPI038).
Изобретение относится к медицине, в частности к микробиологии, и может быть использовано для диагностики дифтерии. Сущностью изобретения является получение диагностикума путем выращивания дифтерийных микробов на плотной питательной среде, приготовления из них суспензии густотой 1000 ОЕ/мл, прогревания ее при 56. 58 o С в течение 40 мин, обработки формалином и мертиолятом, отмывания 0,15М раствором хлорида натрия, дезинтеграции, выделения из нее посредством диализа через мембрану с порами 40-60 нм дифтерийного диализатного антигена (ДДА), разведения его до концентрации 250-400 мкг/мл по белку и соединения его в объеме 1 мл с 3 мл 50%-ных формалинизированных эритроцитов барана, отмытых 0,15М раствором хлорида натрия, 5 мл 20%-ного раствора полиэтиленгликоля с мол. массой 6000 кД и 4 каплями формалина. После этого полученную взвесь выдерживают 2 ч при 22. 24 o С и 1 сутки при 4. 8 o С. Техническим результатом является сокращение сроков получения диагностикума и повышение его эффективности. 3 табл.
Изобретение относится к области медицины, а точнее - к микробиологии, и может быть использовано для диагностики дифтерии.
В настоящее время актуальность дифтерийной инфекции сохраняется несмотря на широко проводимую специфическую профилактику (В.В. Краснов, И.В. Орлов. Особенности дифтерии у детей на современном этапе //Современные проблемы педиатрии. Материалы YIII съезда педиатров России, - Москва, 24-26 февраля 1998, -с.150-151; С.С. Маркина, А.А. Монисов. Дифтерия в России в 1990-1994 годах// Проблемы эпидемиологии, микробиологии и клиники капельных и кишечных инфекций. - М., 1996,-с.18-20). Регистрируются случаи заболевания дифтерией и среди привитых, имеющих защитные уровни противодифтерийных антитоксических антител, а также перенесших дифтерию (А.Г. Рахманова, В.К. Пригожина. Смертельные исходы дифтерии у взрослых, привитых против дифтерии// Клиническая медицина, - 1996.- N9.- с.67-69). Дифтерийная инфекция характеризуется большим разнообразием клинических форм. Различают дифтерию ротоглотки, носа, гортани, трахеи, бронхов, глаз, кожи. а также возможно формирование носительства токсигенных C.diphtheriae (М.Х. Турьянов, Н.М. Беляев, А.Д. Царегородцев и др. Дифтерия. - М.,- 1996.-254 с.). Ведущую роль в возникновении дифтерии играет дифтерийный токсин, который является политропным ядом, поражающим клетки нервной системы, почек, миокарда, надпочечников, легких (Ж.И. Возианова, А. К. Дуда, Е.Н. Амисова. Диагностические критерии дифтерийного миокардита// Врачебное дело.-1999,- N4,-с.22-27; В.А. Капустян, В.В. Болдырев, Е. Ф. Седак. Осложнения дифтерии// Терапевтический архив.-1993,-том 65. -N3, -с. 75-77). Однако важную роль в патогенезе дифтерии играют и бактериальные антигены, входящие в состав клеточных стенок C.diphtheriae и обусловливающие прикрепление возбудителя на эпителиальных клетках организма человека (Л.А. Фаворова, Н.Ф. Астафьева, М.П. Корженкова и др. Дифтерия. - М.,- 1998. - 208 с.) В связи с этим в организме человека при дифтерийной инфекции идет выработка как антитоксических, так и антибактериальных антител, определение уровня которых может быть использовано с целью диагностики дифтерии. Определение противодифтерийных антител осуществляют с помощью эритроцитарных дифтерийных антигенных диагностикумов.
Проведенными исследованиями по патентной и научно-медицинской литературе выявлены различные методы приготовления дифтерийных диагностикумов.
Н.М. Булатова (Н.М. Булатова. К методике получения антимикробных антигенов коринебактерий дифтерии и изучение их антигенных и иммуногенных свойств в эксперименте// Вопросы эпидемиологии и прикладной иммунологии. - часть 1.- Казань,-1975.- с.63-69) предложила способ получения дифтерийного антигенного диагностикума на основе антигена коринебактерий дифтерии, выделенного путем экстракции хлороформом и дезоксихолатом натрия. Однако полученный диагностикум обладал сниженной антигенной активностью, так как для его приготовления авторы использовали химические вещества (хлороформ и дезоксихолат натрия), которые обладали повреждающим действием на белковые антигены коринебактерий дифтерии.
В работе В.А. Шмелевой с соавт. (Е.А. Шмелева, С.И. Лещук, С.М. Попкова. Использование эритроцитарного диагностикума для выявления антибактериальных противодифтерийных антител// Состояние и перспективы разработки препаратов для диагностики вирусных гепатитов и инфекций, управляемых средствами массовой профилактики. - Пермь, -1993.- с.137-138) описан способ получения эритроцитарного дифтерийного диагностикума на основе антигена, выделенного из клеточных стенок коринебактерий дифтерии по методике Н.Н. Кондрашиной (Н.Н. Кондрашина, С.Ф. Берестень, Е.А. Шмелева. Способ получения антигена коринебактерий дифтерии//а.с. N 1471857, МПК G 01/N 33/531). Однако данный способ не получил широкого распространения, так как для получения целевого продукта требовалась дорогостоящая аппаратура (ультрацентрифуги, установки для гель-фильтрации).
Н. Н. Басова с соавт. (Н. Н. Басова, О.И. Ивченко, Г.И. Коростылева. Способ определения состояния иммунитета при дифтерийной инфекции//а.с.N 1534401, МПК G 01 N/33/53) предложили способ определения состояния иммунитета для диагностики дифтерии с помощью дифтерийного антигенного эритроцитарного диагностикума. Однако данный диагностикум мог быть использован только при обследовании больных, которым не вводили с целью лечения противодифтерийную сыворотку (ПДС).
Наиболее близким техническим решением, принятым в качестве прототипа, является опубликованный в ЖМЭИ, 1967, 1, с. 133-134 в статье М.И. Леви, Г.А. Фоменко, Ф. Е. Крацова "Стойкий эритроцитарный диагностикум для обнаружения столбнячного и дифтерийного анатоксинов и антител к ним" способ получения диагностикума эритроцитарного дифтерийного антигенного (анотоксинного) (регистрационный номер 97/306/1, Государственный реестр лекарственных средств, МЗ России, Москва, 1998, с.194) на основе антигена (дифтерийного анатоксина), который получают по методу, описанному в сборнике "Вакцины и сыворотки", Москва, вып.21, 1974, с. 113-114.
Этот способ предусматривает культивирование дифтерийных микробов (С.diphtheriae, биовар gravis) в реакторе с питательной средой при 34. 35 o С в течение 36-40 ч. После завершения культивирования микробную взвесь сливают в стерильные емкости-сборники и подают на суперцентрифугу ОГО-100 для отделения токсина от микробной массы. После центрифуги токсин поступает в стерильный герметически закрытый сборник, откуда под давлением подается на 3-7 рамные фильтры Сальникова со стерилизующими пластинами. После стерилизации токсин поступает в реакторы-детоксикаторы для перевода его в анатоксин. При повторном помешивании туда добавляют 0,65% формалина, инкубируют при 39. 40 o С в течение 5 суток. Затем частично обезвреженный токсин очищают, стерилизуют, добавляют 0,15% формалина и инкубируют при 39. 40 o С в течение 15 суток. Полученный таким образом дифтерийный анатоксин (ДА) используют для приготовления дифтерийного диагностикума. Для этого смесь равных объемов 2,5% взвеси формализированных эритроцитов барана и раствора танина (1:20000) оставляют при комнатной температуре на 15-30 мин, после чего эритроциты 2-3 раза отмывают физиологическим раствором. Затем к 2,5% взвеси формалинизированных танинизированных эритроцитов добавляют очищенный анатоксин и фосфатный буфер, с тем, чтобы в смеси установилась рН 6,4 и определенная концентрация дифтерийного анатоксина (10-20 Lf в 1 мл). Смесь дифтерийных компонентов выдерживают в термостате при 37 o С 2 ч при периодическом встряхивании. За 1-1,5 ч до окончания сенсибилизации добавляют 1%-ный раствор формалина. После сенсибилизации эритроциты трижды отмывают на холоду 5-6 объемами физиологического раствора (по 5 мин) при 2000 об./мин, ресуспендируют до 2,5% взвеси в 0,4%-ном растворе нормальной кроличьей сыворотки, прогретой в течение 30 мин при 56 o С, и добавляют формалин до 1%-ной его концентрации. Полученный таким образом продукт используют в качестве эритроцитарного дифтерийного антигенного (анатоксинного) диагностикума.
Существенным недостатком данного способа является длительный срок получения целевого продукта (порядка 522 ч) и его недостаточная эффективность. Это связано с тем, что больным с подозрением на дифтерию при поступлении в стационар вводят противодифтерийную антитоксическую сыворотку (ПДС), содержащую антитела к ДА. При исследовании крови с помощью данного диагностикума у больных выявляют как собственные антитела к ДА, так и антитела к ДА, входящие в состав ПДС, тогда как для диагностики дифтерии необходимо определять только собственные противодефтерийные атитела.
Целью настоящего изобретения является сокращение сроков получения диагностикума и повышение его эффективности.
Эта цель достигается путем выращивания дифтерийных микробов на плотной питательной среде, приготовления из них суспензии густотой 1000 ОЕ/мл, прогревания ее при 56. 58 o С в течение 40 мин, обработки формалином и мертиолятом, отмывания 0.15М раствором хлорида натрия, дезинтеграции, выделения из нее посредством диализа через мембрану с порами 40-60 нм дифтерийного диализатного антигена (ДДА), разведения его до концентрации 250-400 мкг/мл по белку и соединения его в объеме 1 мл с 3 мл 50%-ных ФЭБ, отмытых 0.15М раствором хлорида натрия, с 5 мл 20%-ного раствора полиэтиленгликоля с мол. массой 6000 кД и 4 каплями формалина. После этого полученную взвесь выдерживают 2 ч при 22. 24 o С и 1 сутки при 4. 8 o С.
Предлагаемый способ осуществляется следующим образом.
Микробные штаммы С. diphtheriae, биовар gravis, серотип 2, полученные из Государственного НИИ стандартизации и контроля медицинских биологических препаратов им. Л. А.Тарасовича, предварительно выращивают на плотной питательной среде с добавлением 20. 25% сыворотки крупного рогатого скота в течение 24 ч, суспендируют в стерильном 0,5M растворе хлорида натрия, доводя густоту микробной взвеси до 1000 ОЕ/мл, контролируя ее с помощью стандартного образца мутности (Государственный НИИ стандартизации и контроля медицинских биологических препаратов им. Л.А.Тарасевича), прогревают при 56. 58 o С в течение 40 мин, добавляют формалин до концентрации 0,5% и мертиолят до концентрации 0,001% и выдерживают в термостате при 37 o С в течение 24 ч. После этого взвесь отмывают 0,15М раствором хлорида натрия при 3000 об/мин с помощью центрифуги лабораторной клинической ОПН-3 в течение 20 мин. Полученный осадок ресуспендируют в исходном объеме хлорида натрия и дезинтегрируют воздействием низкочастотного ультразвука в течение 15 мин с помощью низкочастотной ультразвуковой установки ДБУ-1. Полученный дезинтеграт диализуют через мембрану с размерами пор 40-60 нм (диализ проводят против 0,15М раствора хлорида натрия, содержащего 0,001% мертиолята, в шуттель-аппарате при 3. . . 5 0 С в течение 6 дней) и выделяют дифтерийный диализатный антиген (ДДА).
ДДА разводят 0,15М раствором хлорида натрия до концентрации по белку (Лоури) - 250-400 мкг/мл. Затем 1 мл полученного раствора ДДА соединяют с 3 мл отмытых в 0,15М растворе хлорида натрия коммерческих 50%-ных формалинизированных эритроцитов барана (ФЭБ), с 5 мл 20%-ного раствора полиэтиленгликоля с мол. массой 6000 кД и 4 каплями формалина. Взвесь выдерживают 2 ч при 22. 24 0 С и 1 сутки при 4. 8 o С в холодильнике.
Весь процесс приготовления диагностикума занимает порядка 219 ч.
Эффективность полученного дифтерийного антигенного диагностикума была проверена с использованием стандартных сывороток (Таблица 1).
Исходя из данных, приведенных в таблице, видно, что дифтерийный антигенный диагностикум обладал высокой активностью при исследовании агглютинирующих дифтерийных сывороток. Специфичность диагностикума подтвердили отрицательные результаты исследования стандартных недифтерийных сывроток (столбнячной, коклюшной, эшерихиозной, сальмонелпезной), а также отрицательный результат исследования стандартной дифтерийной антитоксической сыворотки, свидетельствующий о том, что данный диагностикум не выявляет антител к дифтерийному анатоксину, входящих в состав ПДС.
Применение полученного антигенного диагностикума. приготовленного согласно предлагаемому способу, и сопоставительный анализ его активности по сравнению с прототипом поясняется примерами из клинической практики VI инфекционного отделения БСМП N 1 г. Ростова-на-Дону.
Пример 1. У 50 больных с диагнозом "дифтерия" забрали кровь на 1-2 день заболевания (после введения ПДС) и 7-10 день заболевания (после введения ПДС) и исследовали ее с дифтерийным антигенным диагностикумом на основе ДА и с дифтерийным антигенным диагностикумом на основе ДДА с целью подтверждения диагноза. (Таблица 2).
Результаты исследования крови больных дифтерией (50 чел.) с диагностикумом на основе ДДА в 88% случаев совпали с диагнозом "дифтерия", что было подтверждено нарастанием уровня антител у них в динамике заболевания. При исследовании крови этих же больных (50 чел.) с диагностикумом на основе ДА диагноз "дифтерия" не был подтвержден ни в одном случае, так как нарастания уровней антител ни у кого из обследуемых обнаружено не было. Это можно объяснить тем, что после введения ПДС уровень антител к ДА у обследуемых не изменяется в течение заболевания и диагностикум на основе ДА не позволяет проводить подтверждение диагноза "дифтерия".
У 20 больных с подозрением на дифтерию забрали кровь на 1-2 день заболевания (до введения ПДС) и на 7-10 день заболевания (после введения ПДС) и исследовали ее с дифтерийным антигенным диагностикумом на основе ДА и с дифтерийным антигенным диагностикумом на основе ДДА с целью подтверждения диагноза "дифтерия". (Таблица 3).
Результаты исследования крови больных (20 чел.) с диагностикумом на основе ДДА в 90% случаев совпали с окончательным диагнозом, тогда как при использовании диагностикума на основе ДА процент совпадений с окончательным диагнозом составил 70%. Это связано с тем, что у всех больных после введения ПДС, независимо от наличия у них дифтерии, выявляли нарастание уровней антител к ДА, а уровень антител к ДДА не зависел от введения ПДС и возрастал только у больных дифтерией.
Таким образом, предлагаемый способ получения дифтерийного антигенного диагностикума имеет следующие преимущества перед прототипом: позволяет сократить сроки приготовления диагностикума с 523 до 219 ч и повысить эффективность диагностикума, с помощью которого практически в 90% случаев независимо от введения ПДС возможно подтверждать диагноз "дифтерия" исключительно посредством определения собственных противодифтерийных антител, не входящих в состав ПДС.
Способ получения дифтерийного антигенного диагностикума путем выращивания дифтерийных микробов, соединения формалинизированных эритроцитов барана и дифтерийного антигена, отличающийся тем, что дифтерийные микробы выращивают на плотной питательной среде (питательный агар с добавлением 20. . . 25% сыворотки крупного рогатого скота), готовят из них суспензию густотой 1000 ОЕ/мл, прогревают при 56. . . 58 o С в течение 40 мин, добавляют формалин до концентрации 0,5% и мертиолят до концентрации 0,001%, выдерживают в термостате при 37 o С 24 ч, отмывают 0,15 М раствором хлорида натрия, дезинтегрируют, выделяют дифтерийный диализатный антиген путем диализа через мембрану с порами 40-60 нм, разводят антиген до концентрации 250-400 мкг/мл по белку и соединяют его в объеме 1 мл с 3 мл 50%-ных формалинизированных эритроцитов барана, отмытых 0,15 М раствором хлорида натрия, с 5 мл 20%-ного раствора полиэтиленгликоля с молекулярной массой 6000 кД и 4 каплями формалина и выдерживают 2 ч при 22. . . 24 o и 1 сутки при 4. . . 8 o С.
Читайте также:


