Дисфункция иммунной системы при сепсисе
Согласно современным концепциям этиологии инфекционного процесса, при нарушении специфического защитного механизма возникает инфекция, тип которой зависит от природы иммунного дефекта. Если ранее иммунная недостаточность рассматривалась как редкое событие, то сейчас считается, что она встречается довольно часто: в неонатальном периоде, при недостатке белка или витаминов в пище при различного рода интоксикациях, злокачественных опухолях и в процессе их лечения, при различного рода стрессах, нарушениях обмена и др. Существуют и генетические поздно проявляющиеся дефекты.
Реализм сменил эйфорию, продолжавшуюся несколько десятилетий и связанную с успешным применением антибиотиков. Возникли проблемы, связанные с инфекциями микроорганизмами, являющимися частью нормальной микрофлоры, с которыми больной еще несколько дней назад поддерживал мирное сосуществование. При нарушении иммунной защиты происходят быстрый рост и распространение безвредной в норме микрофлоры дыхательных путей, кожи, желудочно-кишечного тракта, мочевыводящих путей.
Сепсис представляет собой тяжелейшую форму генерализованной инфекции, являющуюся следствием несостоятельности защитных реакций. В механизмах его возникновения и патогенезе в определенные периоды на первый план могут выступать различные факторы: снижение фагоцитоза, обусловленное недостаточностью или потреблением антител, появление в крови блокирующих субстанций и вторичный иммунный дефицит, смена или присоединение другого возбудителя, интоксикация и поражение внутренних органов, нарушение в свертывающей системе крови и др.
Нарушение иммунной защиты при сепсисе. В системе противоинфекционной защиты организма существуют три функциональных уровня. Первый — это барьеры на пути инвазии. Они включают кожу, слизистые оболочки, секрет, который нередко оказывает бактерицидное или бактериостатическое действие, механически выводит микроорганизмы или стимулирует рост одних микробов, препятствующих размножению других. В большинстве случаев клиническим проявлениям сепсиса предшествуют механические, физические или трофические нарушения целости кожных покровов или слизистых оболочек. Входными воротами инфекции могут быть локальные очаги воспаления, места инъекций, введения катетера и др. Тщательно собранный анамнез и клиническое обследование в большинстве случаев позволяют выявить места повреждения.
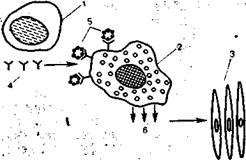
Рис. 9.1.Аллергическая атоническая реакция с участием клеток иммунной системы, гуморальных факторов и клеток-мишеней (схема).
1 — Ig Е — образующая клетка; 2 — лаброцит; 3 — клетки-мишени; 4 — lg Е-антитела; 5 — аллергены; 6 — медиаторы.
Кроме антител, главным опсонином является комплемент, особенно его третий компонент — С3b. Например, антитела к пневмококку типа 7 не инициируют фагоцитоз нейтрофильными гранулоцитами, выделенными из крови человека. Только после того, как С3b фиксируется на стенке бактерий, происходит иммунное прилипание и фагоцитоз становится эффективным. Инкапсулированные стафилококки могут быть опсонизированы как антителами, так и С3b-компонентом комплемента. В ряде случаев опсонизация может быть нарушена и ничто не сдерживает лавинообразного нарастания концентрации патогенного фактора и продуктов его метаболизма. Сказанное можно проиллюстрировать следующими примерами.
1. При изучении плевральной жидкости у больных тяжелым гнойным плевритом определялись продукты расщепления IgG. Протеазы Streptococcus pneumoniae разрушают иммуноглобулины (антитела) у человека. Аналогичным образом могут действовать и протеазы Pseudomonas aeruginosa [Doring G. et al, 1984].
3. Процесс фагоцитоза может быть нарушен в самом начале и привести к непредсказуемым осложнениям. Так, циркулирующие антитела класса IgA, не активирующие систему комплемента и не инициирующие фагоцитоз, могут своим присутствием на бактериальной стенке блокировать начальный период иммунного эффекторного механизма фагоцитоза, что может привести к генерализации инфекции. Такой опосредованный IgA-ингибирующий эффект может представлять большую опасность при менингите. Этим феноменом объясняются слабая опсонизация менингококка и нередкий летальный исход при менингите.
В то же время свободно циркулирующие в крови иммунные комплексы независимо от их природы могут блокировать рецепторы к Fc IgG на поверхности фагоцитов и снижать их бактерицидную активность. Эта ситуация нередко встречается при уже развившейся инфекции. При уточнении анамнеза в таких случаях выясняется, что сепсису предшествовало заболевание, протекавшее с повышением температуры и клиническими проявлениями нарушения функций легких, кишечника или мочеполовых органов.
Диагностика иммунной недостаточности. Современная лаборатория клинической иммунологии имеет довольно широкий набор диагностических тестов. Существуют тесты общего порядка: Т- и В-лимфоциты, бласттрансформация, уровень иммуноглобулинов в сыворотке крови. При необходимости выполняются дополнительные исследования [Зимин Ю. И. и др., 1982].
У детей, родившихся преждевременно (срок беременности: 30—37 нед), обнаруживается выраженная гипогаммаглобулинемия. Она является следствием незрелости плаценты и ее неспособности транспортировать IgG, а также отсутствия синтеза антител у плода. У детей, рожденных в срок, сохраняется довольно высокий уровень IgG в сыворотке. Однако данный белок имеет материнское происхождение и концентрация его понижается в течение первых недель жизни. Частота тяжелых генерализованных инфекций у новорожденных составляет от 0,2 до 1,5%. Следует помнить, что в 35% случаев смерть в течение первого года жизни является следствием сепсиса или септической пневмонии. Иммунологическая незрелость плода является важнейшим фактором возникновения перинатальных инфекций. Даже в настоящее время, несмотря на антибиотики, летальность новорожденных при сепсисе очень высока.
По мере инволюции органов иммунной системы у лиц пожилого или старческого возраста первичный иммунный ответ может существенно не изменяться. Однако снижение разнообразия иммуноглобулинов (антитела) прогрессирует. Их концентрация в сыворотке может оставаться нормальной, а за счет избыточной моноклональной пролиферации даже увеличиваться.
Врожденная недостаточность антител проявляется как аномальная подверженность инфекциям, особенно рецидивирующим инфекциям респираторного или желудочно-кишечного тракта. Нередко начало септицемии связано с локальным воспалительным процессом. Врожденные нарушения проявляются клинически в раннем детском возрасте или позже, особенно в 20—30 лет. Диагностика этой формы недостаточности антител основывается обычно на определении иммуноглобулинов сыворотки крови. Происходит снижение уровня всех иммуноглобулинов или отдельных классов, или субклассов. Селективный врожденный дефект, проявляющийся отсутствием или снижением синтеза одного из субклассов IgG или отсутствием антител определенной специфичности, возможен и при нормальном уровне иммуноглобулинов.
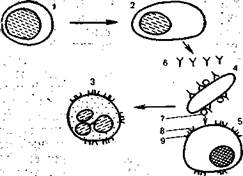
Рис. 9.2. Клеточный и гуморальный иммунные ответы (схема).
1 — В-лимфоцит; 2 — плазматическая клетка: 3— нейтрофильный гранулодит; 4 — бактерия; 5 — звездчатый ретику-лоэндотелиоцит; 6 — иммуноглобулины (антитела); 7 — С3b-компонент комплемента; 8 —рецептор к С3b; 9 —рецептор к Fc иммуноглобулина.
Приобретенный (симптоматический) синдром недостаточности антител встречается довольно часто при многих заболеваниях. Не всегда можно установить, является недостаточность антител вторичной для данного заболевания или она была причиной и вызвала его. Нарушения этого типа наиболее характерны при опухолях лимфоретикулярных тканей, особенно имеющих В-клеточную природу: хроническом лимфолейкозе, лимфомах, доброкачественной и злокачественной парапротеинемии и др. Происходит уменьшение числа или полное исчезновение нормальных поликлональных, секретирующих иммуноглобулины плазматических клеток в костном мозге и лимфоидной ткани. Нормальные клетки замещаются злокачественными, внешне имеющими интактную структуру. В некоторых случаях ткани, участвующие в формировании иммуноглобулинов, могут быть разрушены лимфотропным вирусом (в частности, при инфекционном мононуклеозе).
В большинстве случаев при сепсисе изменяются многие иммунологические показатели. Характеризуя состояние иммунной системы при сепсисе в целом, можно говорить о глубоком иммунном дефиците, который, несомненно, является причинным и осложняющим фактором в течении заболевания. Сепсис, начавшись на фоне иммунной недостаточности, усугубляет ее, нередко до фатального состояния. Этим можно объяснить присоединение другой инфекции, смену возбудителя, появление аллергических процессов, нарушение регенерации.
На рис. 9.3 в виде радиусов в системе полярных координат отложены иммунологические показатели, конкретных людей в процентах к норме (группа из 25 здоровых людей), представленной в виде окружности. Результаты отдельных тестов, характеризующих функционирование иммунной системы, представлены в виде векторов: лимфоциты в 1 мм 3 крови (Лф), Т-лимфоциты в абсолютных значениях на 1 мм 3 крови и в процентах (Т, Т%), вспомогательные клетки (Т4 и Т4%), супрессорные Т-клетки (Т8 и Т8%), реакция бласттрансформации in vitro под влиянием КонА (Is), IgM, IgA, IgG, IgE —иммуноглобулины в сыворотке крови, В-лимфоциты (В), фагоцитоз (Фг), соотношение к- и А,-цепей иммуноглобулинов в сыворотке. Иммунологические показатели интактного донора (см. рис. 9.3) отличаются не более чем на 10% от средних значений нормы. Площадь многоугольника, в определенной степени характеризующая иммунный статус человека, приближается к площади круга (норма).
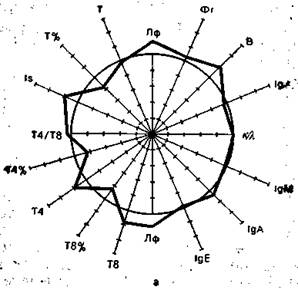
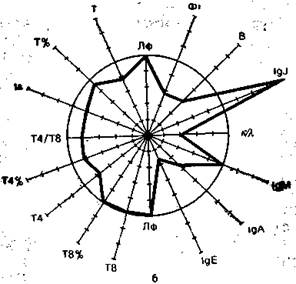
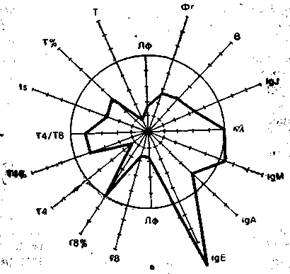
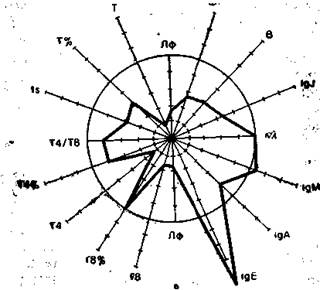
Рис. 9.3. Иммунный статус интактного донора (а), больного в предсептиче-ском состоянии (б) и при сепсисе (в). Объяснение в тексте.
Принципы профилактики и терапии септических состояний. Адекватная терапия заболеваний, вызывающих недостаточность иммунитета, компенсация сопутствующих нарушений микроциркуляции, водно-солевого баланса, потери белка, а также хирургическая санация абсцесса, флегмоны или эмпиемы, детоксицирующая терапия и др. являются важными моментами эффективной профилактики и терапии сепсиса.
К основным принципам терапии и профилактики сепсиса необходимо отнести: уход, применение антибиотиков, выведение ингибирующих факторов (плазмаферез, гемосорбция, гемодиализ, селективная плазмафильтрация), заместительную терапию (препараты иммуноглобулинов для внутривенного введения, тимопептиды, свежезамороженная плазма, гипериммунная сыворотка, лейкоцитная масса), стимуляцию эффекторного звена клеточного иммунитета.
Независимо от природы иммунной недостаточности (гипопротеинемия, облучение, интоксикация, кровопотеря и др.) у больных выявляется повышенная чувствительность к инфекции. В соответствии с этим и строится режим. В особо тяжелых случаях (агаммаглобулинемия, агранулоцитоз) больного помещают в палату, где обеспечивается стерильное содержание.
Антибиотики были и остаются эффективным средством лечения инфекционных осложнений при иммунной недостаточности. Следует указать на два важных аспекта. Во-первых, антибиотики эффективны только при сохранившихся иммунных реакциях. Многолетний опыт лечения больных с врожденным иммунодефицитом свидетельствует, что без иммунного ответа не удается достигнуть положительных результатов. Во-вторых, при нарушении фагоцитоза рекомендуется использовать антибиотики, избирательно накапливающиеся в макрофагах (например, рифампицин). Некоторые микроорганизмы способны выживать в фагоцитах и даже размножаться в них, следствием чего нередко бывает хроническая инфекция. Антибиотики, накапливающиеся в фагоцитах, усиливают функцию инактивирования бактерий.
Успех лечения антибиотиками зависит от ряда факторов: 1) идентификации возбудителя, что является крайне сложной задачей, если лечение сепсиса уже начато; 2) чувствительности микроорганизма к антибиотику; 3) транспорта антибиотика к месту инфекции в достаточной терапевтической концентрации.
Опыт показывает, что необходимы дополнительные знания, касающиеся взаимоотношений между организмом, антибиотиком и микробом. Антибиотики сами по себе недостаточно эффективны при лечении септических состояний. В лучшем случае они помогают выиграть время для проявления защитных реакций и для иммунологической ликвидации инфекции. В тех нередких случаях, когда защитные системы организма не работают, ан-тибиотикотерапия безуспешна.
При многих септических состояниях в сыворотке крови появляются блокирующие факторы макромолекулярной природы, препятствующие нормальному течению иммунных реакций. Это могут быть иммунные комплексы, продукты жизнедеятельности микроорганизмов, эндо- и экзотоксины, разного рода протеазы, продукты распада тканей. Применение плазмафереза, гемосорбции или гемодиализа может способствовать восстановлению иммунного реагирования (рис. 9.3). На фоне детоксикационной терапии, достигаемой экстракорпоральными методами, повышается эффективность всех последующих вмешательств.
Классическим показанием к заместительной терапии препаратами иммуноглобулинов для внутривенного введения является гуморальная иммунная недостаточность. Этот вид лечения рекомендуется при тяжелых бактериальных или вирусных инфекциях у больных со сниженным или нормальным уровнем иммуноглобулинов в сыворотке. При назначении препаратов этой группы исходят из того, что в основе тяжелых инфекций лежит либо первичная, либо вторичная недостаточность (потребление) антител. Поливалентные препараты иммуноглобулинов (иммуноглобулин внутривенный, гипериммунная сыворотка) содержат по крайней мере 10 млн различных типов антител.
Стимуляция эффекторного механизма клеточного иммунитета позволяет усилить, иммунный ответ при профилактике бактериальных и вирусных инфекций. Результат зависит от дозы и времени применения, а также от возраста больного и генетических факторов. Препараты иммуноглобулинов эффективны при хронических рецидивирующих инфекциях и при вспомогательной терапии у больных различными видами опухолей. Их используют с целью компенсации иммунодепрессии, вызванной облучением, химио- или стероидной терапией, а также при различного рода стрессах. К стимуляторам эффекторного механизма иммунных реакций относят левамизол, диуцифон, цимети-дин, интерферон и его индукторы.
Таким образом, достижения клинической иммунологии и иммунофармакологии и накопленный в последние годы опыт коррекции иммунодефицитных состояний позволяют сделать вывод, что современная клиническая медицина располагает средствами диагностики, профилактики и лечения иммунной недостаточности, предшествующей сепсису или усугубляющейся на фоне era течения.

Американские ученые под руководством специалистов из Бостонской детской больницы расшифровали ранее неизвестные молекулярные механизмы развития сепсиса. Они нашли молекулу, которая является одним из игроков иммунного ответа, ингибировав активность которой, можно остановить развитие этого опасного для жизни состояния.
Это открытие, надеются авторы, приведет к созданию препаратов, которые помогут спасать как пациентов, у которых развился сепсис, так и больных с формами инфекций, устойчивых к антибиотикам.
Сепсис – одна из самых тяжелых проблем в современной медицине. Удивительный факт: в мире каждый год от сепсиса умирает больше людей, чем от онкологических заболеваний. Примерно у 27 миллионов людей каждый год развивается это состояние, когда в кровь попадают возбудители инфекции, и воспалительный процесс развивается во всем организме. Примерно 8 миллионов человек ежегодно от этого умирают.
Казалось бы, сепсис должен хорошо лечиться антибиотиками. Почему же тогда от него погибает так много людей?
Причин здесь несколько. Во-первых, инфекцию не всегда удается определить быстро и подобрать нужные антибиотики. Кроме того, сепсис часто вызывают штаммы бактерий, нечувствительные к антибиотикам, а чтобы провести анализ на устойчивость и чувствительность к антибиотикам, необходимо опять же время. Которого всегда недостаточно – сепсис обычно развивается очень быстро.
Другая причина тяжелого исхода при сепсисе – неправильная работа иммунитета, когда он дает сбой.
Современные исследования показывают, что при попадании бактериальной инфекции в организм в нейтрофилах и макрофагах активируются белковые комплексы – так называемые инфламмосомы (они входят в состав врожденного иммунитета). И это запускает целый каскад иммунной реакции: активизируются протеазы каспазы, которые разрезают молекулу гасдермина D на две части, что вызывает пироптоз – гибель инфицированных клеток, когда они как бы взрываются, изливая все содержимое наружу в межклеточное пространство. Это служит сигналом для активации иммунной системы. Но здесь может возникнуть ошибка – слишком сильный сигнал может привести к чрезмерной активации иммунитета и гибели слишком большого количества клеток.
Как раз детально изучить этот процесс и решили авторы. Им удалось выяснить, что, когда каспаза разрезает гасдермин D, то образуется активный его фрагмент гасдермин-D-NT. С одной стороны, именно гасдермин-D-NT убивает патогенные бактерии, которые находятся внутри клетки. Но проникая в клетку в погоне за бактериями, гасдермин-D-NT повреждает клеточную мембрану, проделывая в ней дыру, и в результате содержимое самой клетки с убитой бактерией выливается наружу. Вместе с бактерией наружу выходят и цитокины - которые и приводят иммунную систему в состояние тревоги. Если цитокинов выделяется слишком много, то иммунитет дает сбой.
Гасдермин-D-NT, действительно, хорошо умеет уничтожать бактерии. Как показал эксперимент, он прекрасно справлялся с кишечной палочкой, золотистым стафилококком и листерией.
Как надеются авторы, результат их исследования поможет в создании новых способов лечения тяжелых инфекционных заболеваний и сепсиса. Правда, исходя из этих же результатов, стратегии для этих случаев должны быть разными. Для лечения локализованной инфекции, вызванной формами бактерий, устойчивыми к антибиотикам, может подойти инъекция препаратов на основе гасдермина-D-NT.
А вот, чтобы справиться с сепсисом, наоборот, образование гасдермина-D-NT необходимо ингибировать или даже полностью блокировать. Сделать это можно, воздействовав на каспазу, полагают авторы.
В ближайшее время они планируют подготовиться к проведению первой фазы клинических испытаний этих подходов.
Пока же о результатах своих исследований ученые сообщают в свежем выпуске журнал Nature.
В. Б. Белобородов
Российская медицинская академия последипломного образования, Москва
Статья опубликована в журнале "Вестник интенсивной терапии", 2010 г, №4. Сепсис
Клиническое значение тяжелого сепсиса определяется его распространенностью и высокой летальностью. Несмотря на существенные достижения в развитии медицинских технологий, в частности, расширение диагностических и терапевтических возможностей, существенного снижения летальности не достигнуто. В значительной степени это связано с недостаточной изученностью механизмов иммунологических нарушений, возникающих в процессе развития инфекции и полиорганной недостаточности, и отсутствием эффективных методов их коррекции.
К настоящему времени в качестве иммунной коррекции в лечении сепсиса клиническими исследованиями доказана эффективность только заместительной терапии иммуноглобулинами (lg) для внутривенного введения. Показано снижение летальности при применении иммуноглобулинов, содержащих в своем составе иммуноглобулины классов G, М и A (IgGMA), в отличие от иммуноглобулинов класса G (IgG) и специфических моноклональных антител против фактора некроза опухолей (ФНО-α) и растворимых рецепторов интерлейкина-1 (ИЛ-1). В современных рекомендациях имеются показания только для IgGMA.
Клеточные повреждения, связанные с медиаторами воспаления
Около 30 лет назад были проведены первые экспериментальные и клинические исследования, показавшие ключевую роль медиаторов в процессе развития сепсиса. Грамположительные и грамотрицательные бактерии способны быть причиной синтеза и выделения провоспалительных медиаторов (в том числе, цитокинов). Цитокины играют важнейшую роль в развитии сепсиса и септического шока. Компонентами клеточной стенки, которые способствуют образованию цитокинов, являются липополисахарид (ЛПС - грамотрицательные бактерии), пептидогликан (грамположительные и грамотрицательные бактерии) и липотейхоевая кислота (грамположительные бактерии). Кроме того, грамположительные бактерии способны к секреции суперантигена — белковой субстанции, которая связывается напрямую с рецепторами главного комплекса гистосовместимости и Т-рецепторами, что приводит к массивной продукции цитокинов.
На начальных этапах активации врожденного иммунитета происходит синтез небольших пептидов (провоспалительных цитокинов), которые являются активаторами многих типов клеток: от иммунных эффекторных клеток до клеток гладкой мускулатуры сосудов и клеток паренхимы различных органов.
Некоторые цитокины (фактор некроза опухолей — ФНО-α и интерлейкин-1 — ИЛ-1) сами являются стимуляторами выделения других цитокинов. ФНО-α и ИЛ-1 способствуют ограничению распространения инфекции, однако в случае ее генерализации их эффект может становиться негативным.
Уровень другого провоспалительного цитокина (ИЛ-6) коррелирует с исходом генерализованной инфекции. Высокий уровень ИЛ-6 связан с высокой летальностью, однако до настоящего времени не ясно, принимает ли он участие в танатогенезе?
ИЛ-8 является важным регулятором функции нейтрофилов, синтезируется и выделяется в процессе развития сепсиса. Его активацию связывают с поражением легких и дисфункцией других органов.
Некоторые хемокины (хемоаттрактантный белок-1 моноцитов) регулируют процесс миграции лейкоцитов. Менее важную роль в процессе генерализованного воспаления играют другие цитокины (ИЛ-10, ИЛ-12, фактор ингибирования миграции макрофагов, гранулоцит-колониестимулирущий фактор).
Активация системы комплемента ответственна за клиренс возбудителей. В условиях высокой концентрации циркулирующей ЛПС в крови и связывания его компонента — липида А с эндотелием сосудов, на поверхности эндотелия формируется множество мембранатакующих комплексов комплемента (МАК). Это приводит к образованию пор на поверхности эндотелиальных клеток и их повреждению. Одновременное поражение обширных полей эндотелиальных клеток приводит к образованию тромбов на их поверхности и нарушению трансмембранного обмена, что является причиной снижения или прекращения доставки кислорода и нутриентов клеткам органов, кровоснабжаемых этими сосудами. Другой стороной активации системы комплемента является выделение брадикинина, который участвует в индукции выделения оксида азота. Последний играет важнейшую роль в гемодинамических нарушениях, характерных для септического шока, которые вначале имеют гипердинамический характер.
Нейтрофилы при сепсисе являются важнейшей системой, ограничивающей распространение возбудителей инфекции в органах и тканях. Их роль заключается в поиске и разрушении живых возбудителей с помощью механизма фагоцитоза. С другой стороны, переваренные и выброшенные во внешнюю среду фрагменты бактерий являются, по своей сути, дополнительной нагрузкой, т.к. представляют собой липополисахариды, липотейхоевые кислоты и пептидогликан, которые способствуют дальнейшей активации макрофагов и усилению генерализованного воспаления, способствуют повреждению тканей и органной дисфункции.
Кроме того, при сепсисе происходит выделение других биологически активных веществ: липидных медиаторов (эйкозаноидов), фактора активации тромбоцитов, фосфолипазы А2, однако их роль в патогенезе сепсиса остается недостаточно установленной.
Тканевые повреждения в результате активации системы свертывания
Дисбаланс гомеостатических механизмов в результате генерализованного воспаления приводит к диссеминированному внутрисосудистому свертыванию и возникновению тромбов в микрососудах, что является причиной органной дисфункции, полиорганной недостаточности и гибели пациентов. Активаторы воспаления способны приводить к прямому повреждению сосудистого эндотелия и выделению из эндотелиальных клеток тканевого фактора, который запускает коагуляционный каскад и усиливает продукцию тромбина, который превращает растворимый фибриноген в фибрин, который вместе с агрегированными тромбоцитами образуют внутрисосудистые тромбы.
Провоспалительные цитокины (ИЛ-1, ФНО-α) активируют тканевой фактор и запускают процесс коагуляции. Этот феномен при сепсисе подтверждается наличием высокого уровня комлексов тромбин-антитромбин, наличием D-димеров в плазме, что указывает на активацию системы свертывания и фибринолиза. Появление тканевого активатора плазминогена приводит к превращению плазминогена в плазмин, который является мощным фибринолитиком.
Эндотоксин увеличивает активность ингибиторов фибринолиза за счет активатора ингибитора плазминогена-1 и ингибитора фибринолиза активированного тромбином. Уровень протеина С и эндогенно активированного протеина С при сепсисе снижается. Эндогенный активированный протеин С является мощным протеолитическим ингибитором коагуляции. Тромбин посредством тромбомодулина активирует протеин С, который работает в качестве антитромболитика в микрососудах. Эндогенный активированный протеин С повышает фибринолиз, нейтрализуя активатор ингибитора плазминогена-1 и усиливая лизис сгустков. Дисбаланс между воспалением, коагуляцией и фибринолизом приводит к распространенной коагулопатии, тромбозу в микрососудистом ложе и подавлению фибринолиза — основным причинам, приводящим к полиорганной дисфункции и гибели пациентов.
Тканевые повреждения в результате других причин
Очень трудно представить совокупность причин тканевых повреждений у конкретного пациента в определенный момент течения сепсиса. Синдром полиорганной недостаточности связан с распространенным поражением эндотелиальных и паренхиматозных клеток. Нарушение микроциркуляции и обширные тромбозы на поверхности поврежденного эндотелия нарушают доставку кислорода и метаболитов, создавая условия для формирования органной дисфункции. Выделение атомарного кислорода, литических ферментов, вазоактивных веществ (оксид азота) и факторов роста эндотелиальных клеток создают условия для формирования микроциркуляторных повреждений и нарушения нормальной циркуляции эритроцитов.
Эндотоксин, ФНО-α и оксид азота могут обладать прямым цитоксическим эффектом, быть причиной повреждения транспорта электронов в митохондриях и нарушениях энергетического метаболизма. Этот процесс называют цитопатической или гистотоксической аноксией, когда даже при наличии кислорода нарушается его утилизация.
Апоптоз (программированная клеточная смерть) является важным механизмом нормальной элиминации клеток, имеющих функциональные нарушения. Провоспалительные цитокины способны тормозить апоптоз активированных макрофагов и нейтрофилов. Однако в других тканях, таких как эпителий кишечника, процессы апоптоза могут усиливаться. Поэтому нарушения регуляции апоптоза рассматриваются как важный механизм тканевых повреждений у пациентов с сепсисом.
Клинические рекомендации по иммунотерапии сепсиса
Обоснованность клинических рекомендаций.
Метаанализ клинических исследований считается одним из доказательств наиболее высокого уровня целесообразности применения препаратов или методов лечения. Самый последний метаанализ, посвященный эффективности применения иммуноглобулинов для внутривенного введения (ИГВВ), был опубликован в 2007 году [2]. В него были включены 14 рандомизированных клинических исследований (РКИ), опубликованных с 1988 по 2006 год. Большинство из них не являются крупными, в которых применялись низкие дозы ИГВВ, большинство пациентов имели хирургические инфекции, вызванные грамотрицательной флорой. Основным результатом метаанализа было достоверное снижение летальности, связанной с применением IgGAM с отношением рисков 0,66 (95% CI 0,53-0,83; р 2 = 0,009), что подтверждалось уровнем L² (53,8%). При оценке только исследований высокого качества, отношение рисков летальности составило 0,96 (95% confidence interval 0,71-1,3; р = 0,78), т.е. отсутствовало достоверное снижение летальности.
При проведении систематического обзора литературы отмечается достоверное снижение летальности у взрослых пациентов в критическом состоянии с тяжелым сепсисом и септическим шоком, которым применяли поликлональные IgGAM. Это заключение основано на результатах 14 опубликованных и неопубликованных рандомизированных клинических исследований, которые различались по качеству методического проведения.
Достоверная гетерогенность исследований была связана только с одним исследованием высокого качества, кроме того в метаанализе были использованы неопубликованные ранее исследования, которые также оказывали достоверное влияние на результаты в целом. Данные регрессионного анализа показали, что на гетерогенность оказывают влияние такие показатели, как год публикации, качество исследования и общая доза ИГВВ.
При графическом сравнении результатов исследований была выявлена асимметрия показателей, обычно такая асимметрия не бывает связанной с одной причиной [3]. Ее причинами могут быть гетерогенность и небольшое количество пациентов, включенных в исследования. Имеются подтверждения того, что почти всегда исследования, включенные в метаанализ, обладают определенной гетерогенностью [4]. Гетерогенность данного исследования была подтверждена статистически с помощью исследования L² Это свидетельствует о том, что реальное влияние ИГВВ на летальность может быть различным в разных популяциях пациентов с разными источниками инфекции, разными возбудителями или разной степенью иммунных нарушений. Кроме того, свой вклад в гетерогенность могут вносить различия в определении тяжелого сепсиса. Риск летального исхода, связанный с хронической патологией, также может оказывать эффект и модифицировать результаты лечения, однако провести точную оценку таких влияний очень сложно [5].
Другой проблемой исследований является качество методической мощности клинического исследования. Имеются общепринятые правила оценки мощности исследований, однако они не описывают все аспекты проведения рандомизированных клинических исследований, что может оказывать влияние на надежность полученных результатов [6]. Некоторые работы, включенные в метаанализ, хотя и считаются исследованиями высокого качества, однако включали неопубликованные исследования с коротким периодом последующего наблюдения (9 суток), что затрудняет оценку их доказательности [7, 8]. При выделении исследований только высокого качества не было получено достоверного эффекта применения ИГВВ, что в определенном плане противоречит выявленному снижению летальности, связанной с применением ИГВВ в этой группе. Данные метаанализа описывают определенную популяцию пациентов, и в целом его результаты соответствуют описанным в предшествующих обзорах 11.
Публикация рекомендаций по лечению тяжелого сепсиса и септического шока, основанных на принципах доказательной медицины, резко повысила интерес к доказательствам высокого уровня, одним из которых является метаанализ 20. Широко известные рекомендации включают разделы, касающиеся применения кортикостероидов, инсулина, ранней целенаправленной терапии, активированного протеина С на основании результатов однократно проведенных исследований 22. ИГВВ обладают сходным, если не сказать, более высоким эффектом в отношении исхода тяжелого сепсиса и септического шока, десятилетиями доказана безопасность их применения при различных заболеваниях [26]. Сегодня выглядит аномальным, что в широко распространенных международных рекомендациях недостаточно обсуждается применение ИГВВ, поэтому они редко включаются в национальные рекомендации и, следовательно, применяется во многих странах для лечения пациентов с тяжелым сепсисом и септическим шоком [19, 26].
Метаанализ сам по себе не направлен на оценку качества РКИ. Появление информации о сложностях, которые испытали исследователи при проведении методически несложных исследований (SAFE и CRASH), посвященных важным проблемам интенсивной терапии, становится понятным, что и метаанализ может не дать надежных рекомендаций 29. Для окончательного решения об эффективности ИГВВ в лечении сепсиса и септического шока было бы хорошо иметь результаты статистически мощного, хорошо спланированного прозрачного клинического исследования у взрослых.
Таким образом, метаанализ выявил общее снижение летальности при применении ИГВВ в качестве дополнительного метода лечения тяжелого сепсиса и септического шока у взрослых. Однако ввиду определенной гетерогенности включенных в него исследований не получено статистического подтверждения снижения летальности в подгруппе исследований высокого качества. Эффективность ИГВВ существенно повышалась при увеличении дозы препарата (> 1 г/кг) и при сравнении препарата с плацебо.
Заключение
Тяжелый сепсис и, особенно, септический шок до настоящего времени остаются одной из актуальных проблем медицины критических состояний. Принятие согласительной классификации сепсиса в 1991 году и ее быстрое клиническое внедрение оказало существенное влияние на возможности получения актуальных данных по эпидемиологии, этиологической структуре, летальности и экономическим затратам. Описательная классификация способна только в общих чертах создать портрет пациента с сепсисом и не способствует индивидуализации лечения. Дополнительную информацию состояния пациентов могут давать системы балльной оценки (APACHE и SAPS). Однако ни один из этих методов не предполагает оценки иммунологического состояния пациента. Широко бытует мнение о том, что в основе сепсиса лежат иммунологические проблемы, однако степень доказательств таких утверждений не очень высока. Это связано с тем, что иммунная система при сепсисе испытывает те же самые влияния, что и другие системы и органы, и умирает вместе с ними. Поэтому степень обратимости иммунологических нарушений на разных стадиях септического процесса еще предстоит выяснить.
Однако методы получения доказательств далеки от совершенства. Невозможно встать на формальную точку зрения и применять в интенсивной терапии только те препараты и методы, которые имеют высокую доказательную базу, т.к. таковых до настоящего времени крайне недостаточно.
Читайте также:


