Эндотелиальная дисфункция при сепсисе
(методические рекомендации)
Организация-разработчик:
Днепропетровская государственная медицинская академия
Днепропетровская областная клиническая больница им. И.И. Мечникова
Авторы:
Мосенцев Н.Ф., Усенко Л.В., Мальцева Л.А., Мосенцев Н.Н. , Коломоец А.В.
Рецензенты:
Чепкий Л.П. – профессор кафедры анестезиологии и интенсивной терапии Киевского национального медицинского университета им. А.А. Богомольца, заслуженный деятель науки и техники Украины, лауреат Государственной премии Украины, д.мед.н., профессор.
Клигуненко Е.Н. – зав. кафедрой анестезиологии, интенсивной терапии и медицины неотложных состояний ФУВДГМА, лауреат Государственной премии Украины, д.мед.н., профессор.
Введение
В основе патогенеза тяжёлого сепсиса и септического шока лежит регионарный тканевой дистресс, вызванный микроциркуляторной дисфункцией и митохондриальной депрессией. Несмотря на восстановление системной гемодинамики и общей доставки кислорода, тканевая гипоксия и сниженная экстракция кислорода сохраняются. Это состояние определяется в настоящее время, как микроциркуляторно-митохондриальный дистресс-синдром (ММДС). Множественные патогенетические факторы, которые наблюдаются при сепсисе, воздействуют на каждый клеточный компонент микроциркуляции, включая эндотелиальные и гладкомышечные клетки, лейкоциты, эритроциты и тканевые клетки. Микрососудистые нарушения приводят к клеточно-респираторному дистрессу и в каскаде патогенетических механизмов к органной недостаточности. Микроциркуляторный дистресс, сохраняющийся более 24 часов, представляется, как независимый фактор неблагоприятного исхода и рассматривается, как водитель патогенетических нарушений, приводящих к органной недостаточности.
Нарушение тканевой экстракции кислорода у больных с сепсисом выявлено более 40 лет назад, но лишь современные исследования рассматривают микроваскулярную дисфункцию, как центральный механизм патофизиологии при сепсисе, приводящей к развитию органных нарушений. Разработка новых методов прямой визуализации микроциркуляторных сосудов, как прижизненная вазомикроскопия, ортогональная поляризационная спектроскопия позволяют исследовать микроциркуляторное русло как в экспериментальных моделях, так и непосредственно у постели больного.
Мириады возможных патогенетических механизмов при сепсисе, приводящих к микроциркуляторной дисфункции, включают: 1) общую тканевую гипоксию; 2) распространённое эндотелиально-клеточное повреждение; 3) активацию коагуляционного каскада и угнетение фибринолиза; 4) микроциркуляторно-митохондриальный дистресс-синдром. Эти факторы как в отдельности, так и в различных сочетаниях, являются определяющими в развитии острой органной дисфункции при сепсисе 5.
Эта новая парадигма полиорганной недостаточности (ПОН) определяет микроциркуляторно-митохондриальную дисфункцию, как универсальное звено поражения всех органов и тканей, включая головной мозг, почки, печень, кишечник, когда ПОН не является просто суммой недостаточности различных органов человека, а представляет собой совершенно новый тяжёлый вид патологии с временным преобладанием симптомов той или иной органной недостаточности (рис. 1).
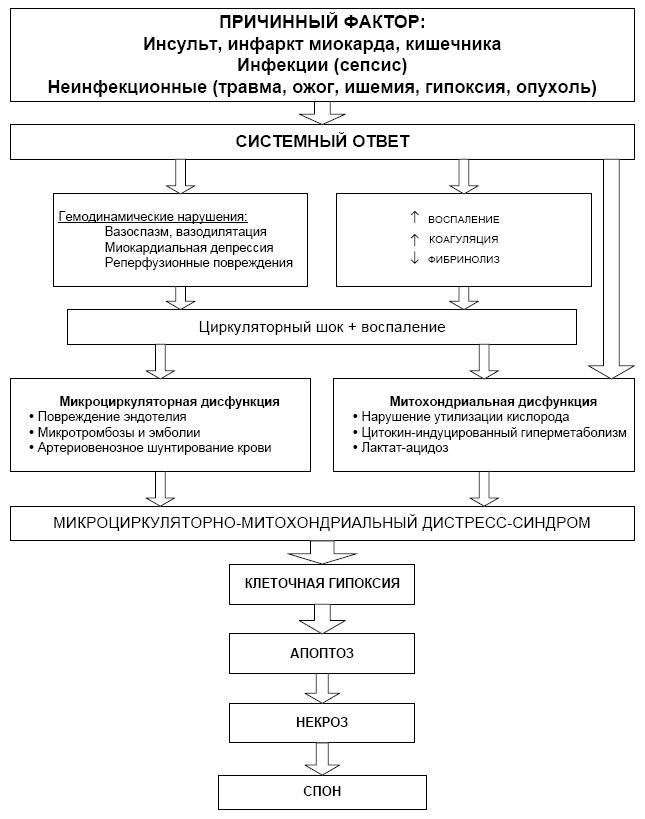
Рис. 1. Схема патогенеза полиорганной дисфункции-недостаточности (Ince C. 2005).
Продолжая цикл публикаций по проблемам сепсиса, коллектив авторов считает своим долгом информировать медицинскую общественность о современных представлениях по данной теме и новых достижениях медицинской науки, включая собственный опыт, в лечении тяжёлого сепсиса и септического шока.
Микроциркуляторная дисфункция при сепсисе
Основной функцией микроциркуляторной системы является обеспечение адекватной тканевой оксигенации и клеточного метаболизма путём транспорта кислорода и нутриентов в ткани и обратного транспорта метаболитов, обеспечение иммунной защиты, а также доставки лекарственных препаратов во время болезни.
Микроциркуляторное русло состоит из мелких кровяных сосудов (менее 100 мкм в диаметре), где осуществляется диффузия кислорода в ткани, представляя комплекс из артериол, капилляров и венул. Микроциркуляторный коллектор представляют эндотелиальные, гладкомышечные клетки, эритроциты, лейкоциты, тромбоциты и компоненты плазмы крови. Структура и функции микроциркуляции в различных органах и тканях отличаются, но определяющими характеристиками периферического кровообращения являются кровяное давление, тонус артериол и венул, эластичность эритроцитов, капиллярная проницаемость, коллоидно-онкотическое давление плазмы и вязкость крови.
Регуляторные механизмы, контролирующие микроциркуляторную перфузию, определяются, как миогенные, нейрогуморальные и метаболические (зависящие от концентраций О2 , СО2 и Н+). Эта система контроля использует аутокринные и паракринные механизмы для регуляции микроциркуляторного кровотока в зависимости от реальных потребностей тканевых клеток.
Эндотелиальные клетки играют центральную роль в этой системе контроля, откликаясь на гемодинамические, метаболические и другие регулирующие сигналы для управления артериальным гладкомышечным тонусом и капиллярным наполнением. Эндотелиальные межклеточные сигналы передают информацию о состоянии микроциркуляторной гемодинамики в центральные регуляторные системы. Эндотелий контролирует также коагуляцию и иммунную функцию, влияющих на микроциркуляцию.
Повреждение эндотелиальных клеток лежит в основе нарушений микроциркуляторного кровотока. Активация эндотелия циркулирующими воспалительными цитокинами ведёт к повышенной экспрессии эндотелиальных адгезивных молекул, включая р-селектин и внутриклеточные адгезивные молекулы-1 (ICAM-1). Активированные лейкоциты имеют повышенную адгезивную способность к эндотелию, что приводит к нарушению ламинарного кровотока и активации воспаления с высвобождением провоспалительных цитокинов, свободных радикалов, протеаз и других медиаторов воспаления. Повышается продукция оксида азота и нарушается функция свёртывающей системы крови, включая нарушение выделения тромбомодулина и повреждение эндотелиальных рецепторов протеина-С, нарушение сигнальной связи между активирующим протеиназу рецептором-1 и другими механизмами. Повреждение барьерной функции эндотелия с повышением капиллярной проницаемости ведёт к тканевому отёку и нарушению экстракции кислорода вследствие снижения парциального давления кислорода и капиллярно-венозного градиента О2 в результате функционального шунтирования крови.
Взаимосвязь между общими гемодинамическими параметрами и тканевой перфузией при тяжёлом сепсисе
Шок обычно определяется, как неспособность кардиоваскулярной системы обеспечить эффективную тканевую перфузию, что приводит к респираторнометаболическому дистрессу паренхиматозных клеток и органной дисфункции.
Септический шок может нарушать эффективную тканевую перфузию вследствие расстройств кровообращения (несмотря на нормальный или повышенный сердечный выброс) в результате микроциркуляторной дисфункции или путём снижения потребления субстратов при дефектах клеточной утилизации кислорода.
При шоках другой этиологии коррекция общих гемодинамических параметров обычно приводит к восстановлению адекватной перфузии и оксигенации тканей, но при септическом шоке регионарные гипоперфузионные нарушения персистируют даже после оптимизации общих гемодинамических и кислородтранспортных параметров.
В клинических условиях признаки гипоперфузии определяются при наличии артериальной гипотензии, тахикардии, олигурии, энцефалопатии, снижения температуры конечностей, исчезновения кожного капиллярного рельефа и метаболического (лактатного) ацидоза.
Артериальное давление само по себе является нечувствительным индикатором тканевой ипоперфузии при сепсисе. В экспериментальных и клинических исследованиях многократно документировано, что локальное перфузионное давление при тяжёлом сепсисе не зависит прямо от системного артериального давления. Степень разобщения между макро- и микроциркуляцией определяет перспективы восстановления адекватной регионарной перфузии при использовании терапевтических стратегий, направленных на поддержание системного артериального давления.
Диагностика шока при септическом синдроме
Одной из наиболее важных задач при лечении больных с тяжёлым сепсисом является ранняя диагностика нарушений тканевой перфузии. Артериальное давление (АД) не является чувствительным индикатором для проведения агрессивной кардиоваскулярной поддержки, нередко улучшение тканевой перфузии наблюдается при поддержании субоптимального уровня АД. В исследовании Rivers E. et al (2001) установлено, что у пациентов с тяжёлым сепсисом и исходными показателями: САД > 100 мм. рт. ст. и лактат сыворотки >4 ммоль/л наблюдалось существенное повышение летальности по сравнению с пациентами, поступающими с гипотензией (САД Ключевые рекомендации по лечению тяжёлого сепсиса и септического шока включают определение сывороточного лактата для выявления пациентов с нормотензией в состоянии шока (cryptic shock), требующих проведения интенсивной терапии. Лактат не является специфическим маркером анаэробного метаболизма, нарушение микроциркуляции представляется одним из возможных механизмов гиперлактатемии при тяжёлом сепсисе. Выраженное и продолжительное повышение уровня лактата является маркером неблагоприятного исхода и должно побуждать к проведению ранней целенаправленной гемодинамической терапии (Early Goal-directed Therapy – EGDT).
Надёжными маркерами тканевой перфузии и эффективности EGDT являются показатели регионарной капнометрии (гастральный интрамукозный рН, сублингвальное рСО2), сатурация смешанной венозной крови (SvO2). Системные и регионарные маркеры эффективности EGDT представлены на рис. 2.
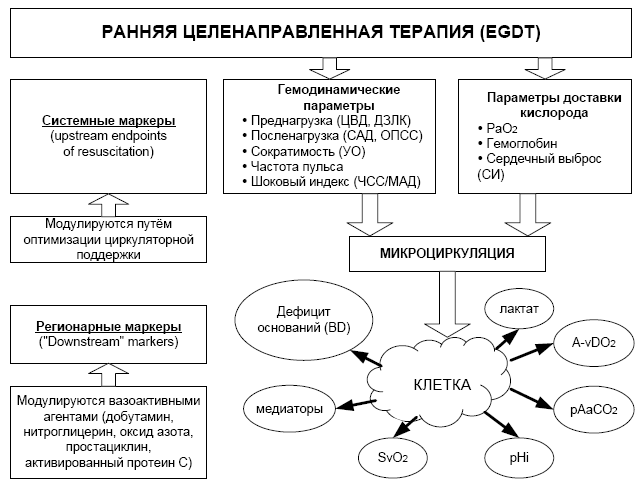
Рис. 2. Системные и регионарные маркеры эффективности EGDT (Trzeciak S., Rivers E.P., 2005)
В 2004 году Spronk P.E. et al. [5] предложили рейтинговую систему для выявления больных в состоянии шока (табл. 1).
Таблица 1.
Интегральная клиническая шкала для определения состояния шока (Spronk P.E. et al., 2005)
| Параметры для оценки | Баллы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Повышение тонометрической разницы СО2 или повышение сублингвальной разницы СО2 или нарушение подъязычной микрососудистой перфузии | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Частоту развития органных нарушений через 72 часа регистрировали с использованием шкалы SOFA. Конечными точками для оценки эффективности проводимого лечения являлись: длительность лечения в ОИТ, дни; летальность, %; выздоровление до 28-го дня болезни, %; наличие признаков персистирующей органной дисфункции, %; восстановление качества жизни до 36-го дня болезни по критериям European quality of life questionnaire (EQ-5D). Статистическая обработка полученных данных проведена с использованием методов вариационной статистики. Для сравнения частотных характеристик использовали функцию распределения Лапласа. Результаты и их обсуждение После проведенной РЦТ в первые 12 часов конечные гемодинамические точки достигнуты в большинстве случаев у больных обеих групп (табл. 3), но существенные различия в средствах обеспечения заданных пунктов заключались в уменьшении потребности вазопрессорной терапии и применение малых доз кортикостероидов, общего объёма инфузионно-трансфузионных средств в группе больных, получавших перфторан и реамберин. Таблица 3.
Примечание: * - р 38,5°С или 90 уд/мин;
Шаг 2. Координация действий персонала на этапах неотложной помощи с обеспечением своевременности и преемственности мероприятий. Он включает:
Шаг 3. Начало ранней целенаправленной терапии (EGDT):
Шаг 4. Определить показания для назначения активированного протеина С (АПС) по следующим критериям:
Критериями органной дисфункции являются:
Шаг 5. Определить показания для эмпирического назначения низких доз кортикостероидов по следующим критериям:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


