Ифа для диагностики лепры
Данная диссертационная работа должна поступить в библиотеки в ближайшее время
Уведомить о поступлении
480 руб. | 150 грн. | 7,5 долл. ', MOUSEOFF, FGCOLOR, '#FFFFCC',BGCOLOR, '#393939');" onMouseOut="return nd();"> Диссертация, - 480 руб., доставка 1-3 часа, с 10-19 (Московское время), кроме воскресенья
Автореферат - бесплатно , доставка 10 минут , круглосуточно, без выходных и праздников
Сухенко, Людмила Тимофеевна. Иммуноферментный анализ с использованием синтетических антигенов в диагностике лепры : автореферат дис. . кандидата биологических наук : 14.00.36.- Москва, 1995.- 24 с.: ил.
Введение к работе
- Актуальность проблемы. Общее снижение уровня заболеваемости лепрой еще не говорит о полном ее исчезновении. Существуют регионы в мире с высоким риском заражения лепрой. Так, по данным всемирной организации здравоохранения, в настоящее Ере-мл в мире зарегистрировано 3,7 млн больных лепрой и 1,4 млрд человек подвержены риску заболевания этим недугом.
Лепра, как и туберкулез - хронические гранулемзтаэные инфекции человека, в ізьшаеі.іі.г кислотоустойчивыми микобактериями.
Несмотря на усіехи в области химиотерапии лепры и контроля за ее распростр-кённостыо, лепра остается первостепенной ыедико-социальной лроблемой в странах Юго-Восточной Азии, Африки, Латинской Америки. Такое положение связано с отсутствием способов ее специфической профилактики, несовершенством биологических моделей, недоступностью культивирования возбудителя на искусственных питательных средах, а отсюда, трудностями наработки бактериальной массы для методов микробиологической и серологической диагностики М.leprae.
Единственным источником биомассы М.leprae, в настоящее время, являются экспериментально зараженные девятипоясные броненосцы, на которых удается воспроизводить лепрозную инфекцию (Kircheimer W.F. et al.y 1971), а в дальнейшем и бактериальную массу, необходимую для разработки диагностических препаратов и ' вариантов специфической протиьолепроэной вакцины.
Методы диагностики и профилактики лепры, основанные на применении очищенных ,ог тканей организма-хозяина U.leprae, оказались недостаточно совершенными для раннего прогнозирования и борьбы с лепрой. Эти методы также не совершенны для «оценки.иммунологического состояния больных лепрой и экспериментально зараженных М.leprae животных,- определения антигенов М.leprae, и антител к ним в органах и тканях Сольного организма (Ющенко А.А. с coast.,- 1978; Abe М, . et al., 1985). Поэтому эпидемиологические исследования при лепре основаны до сих пор на поиске клинически выраженных случаев заболевания и подтверждении : - данными бактериологических и гистологических исследований при достаточно запущенном процессе.
Необходимость разработки новых высокочувствительных мето--дов иммунодиагностики лепры диктуется задачами,.стоящими перед современной лепрологией. Иммунологические методы могут Сыть использованы для раннего выявления больных, оценки иммунологи-" ческой реактивности контактных лиц, изучения механизма патогенеза при лепре, прогнозирования клинических форм заболевания, оценки эффективности химиотерпии и решения других задач.
В области иммунодиагностики лепры неоднократно изучались возможности использования различных методов, основанных на фе- , номене связывания антигена с антителами] это такие .методы как радиоиммунологический анализ (РИА),' гель-иммунодиффузия, перекрестный иммуноэлектрофорег. метод флуоресцентных лепроэных антител (FLA-ABS) (Harboe М. et al., 1978; Abe М. et al., 1980, 1985, 1987;, ; Однако эти методы,' основанные на применении антигенов-экстрактов из М. leprae, имели рядсущественных недостатков, -связанных с низкой чувствительностью или специфичностью, ограничением количественной регистрации антигенов и антител и необходимостью использования специального, часто дорогостоящего, оборудования. '
Подобных недостатков лиаен метод иммуноферментного анализа (ИФА), который кроме высокой чувствительности и специфич-. ности обладает экономичностью, возможностью количественной оценки биологических проб, стабильностью применяемых реагентов, возможностью полной автоматизации - процесса . (Stek М., 1978; Stanford J.L. et al., 1980; Сухенко Л.Т. с соавт., і982, 1984, 1S85; Дячина М.Н. с соавт. 1235). В сообщениях ряда авторов публикуются сведения об использовании ИФА для выделения антител к М.leprae, комплексов антиген-антитело, антител к сульфонам, к мурамилдилептиду у больных лепрой (Alonso J.M. et , al., 1978; Валг G.M. et al., 1986). С помощью'теста'ИФА проведены сероэпидемиологические исследования,больных- и ик семей на наличие антител к юыплексу внутриклеточных" цитоплазматических антигенов из М. leprae и к поверхностным антигенам целой шко-бактериальной клетки (Douglas J.Т., 1984, 1987). Известно также об использовании ЛСА для. идентификации, и изучения серологи-ческой активности специфичесясго фенольного глпкслипзда -1 - и ионоклональных антител кз этст иммукодсмкнакгнь. антигенный
.-4-зпитоп в М.leprae (Aquado Sanchez G. et al., 1986; Mitchison N. et al., 19S3; Douglas J.T. et al., 1987; Agis F. et al., 1988).
Новые возможности в разработке иммунсдиагкостических
тестов открылись после обнаружения и выделения в 1982 голу Фе-
. нолыгого гликодгашда І (ФГЛ-І), представляющего собой трисаха-
. рид, соединенный через фенольное кольцо с дипидным компонентом
клеточной стенки микобактерий лепры (Hunter S.W. et al., 1981,
Опубликованы сообщения о синтезе его аналогов - три, ди или моносахаридов ФГЛ-І, ,;;ммобидизироваяных на белковые носители (ЕСА, БІТ). Сої/'иалооь о перспективности этих полусинте-тических конъюгатов, имитирующих ФГЛ-І, для применения в серодиагностике лепры (Fijiwara Т. et al., 1S84, 1986; Hasan R. et al., 1989).
Учитывая достижения в области иммунодиагностики лепры, представляется перспективным разработка новых эффективных подходов к использованию в ишуноферментной диагностике антигенов природного и искусственного происхождения, особенно для раннего распознавания различных форм лепры.
ЦЕЛЬ НАСТОЯЩЕГО ИССЛЕДОВАНИЯ Разработка на основе твердофазного ИФА, с использованием искусственных моноспецифеских и природных полиспецифических антигенов, эффективных диагностических тест-систем для раннего обнаружения противолепроэных антител, и бактериальной насыщенности организма М.leprae, а также для контроля за развитием лепроэного процесса, у больных лепрой и экспериментальных животных, эффективностью химиотерапии, стабильностью регресса заболевания, контроля эффективности вакцинопрофилактики лепры.
Разработать иммуноферменткый метод диагностики лепры на основе искусственных антигенов со специфичностью природного ФГЛ-І из М.leprae.
Изучить чувствительность и специфичность методов ИФА о использованием искусственных антигенных препаратов в сравнении с природны. антигенами иа М. leprae.
Использовать методы ИФА на основе искусственных 'антигенов для исследования динамики изменения уровня антител у иммунизированных животных и больных лепрой лиц.
Изучить возможности использования методов ИФА, ОСНО-' ванных на природных и искусственных антигенах, для диагностики и сероэпидемиологии микобактериозов (лепры).
Апробировать диагностические ЙФА тест-системы, при се-роэпидемшлогяческих обследованиях населения в' эндемичных по лепре зонах.
Изобретение относится к области медицины, а именно к лабораторной диагностике лепры и может быть использовано, в частности, для выявления лиц, инфицированных микобактериями лепры. Сущность изобретения скринингового обследования населения на лепру состоит в том, что со слизистой оболочки полости носа берут соскоб и далее посредством проведения полимеразной цепной реакции (ПЦР) с использованием внешних и внутренних праймеров: 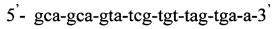
и 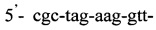
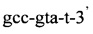
и флуоресцентного зонда 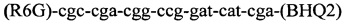
проводят идентификацию возбудителя лепры. Способ позволяет подтвердить факт носительства и/или инфицированности микобактериями лепры. Данный способ может применяться в диагностических лабораториях, в противолепрозных учреждениях, в лечебных учреждениях для обследования мигрантов.
Несмотря на значительное снижение распространенности лепры после внедрения комбинированной химиотерапии, частота выявления новых случаев заболевания лепрой в мире остается высокой. В последние годы в нашей стране отмечается значительное увеличение потока мигрантов из эндемичных по лепре стран. В этой связи, на основании постановления Правительства РФ от 3 апреля 2003 г. №168 все лица, въезжающие в Россию, должны обследоваться, в том числе и на лепру. В настоящее время данное обследование включает клинический осмотр, и только при подозрении на лепру, проводят бактериоскопические исследования, предварительно окрашенных по Циль-Нильсену мазков с соскобов из носа и скарификатов с кожи.
Однако недостатками бактериоскопического метода являются:
- малая чувствительность (в мазке должно быть 10 4 и более бактерий/мл);
- невозможность провести под микроскопом идентификацию видов микобактерий.
Учитывая, что основной путь передачи инфекции воздушно-капельный, и у многих контактных с больными лепрой лиц, особенно проживающих в эндемичных регионах, в назальном секрете обнаруживаются M.leprae без явных симптомов болезни [1], т.е. они могут являться потенциальным источником распространения заболевания, существует необходимость совершенствования скринингового обследования населения на лепру. Причем для такого обследования актуальным остается неинвазивный способ идентификации M.leprae с высокой чувствительностью и специфичностью.
Существенным недостатком данного способа является использование в качестве антигенов - M.lufu, не являющейся аналогом M.leprae. Обнаружение антител к M.lufu может только косвенно свидетельствовать о наличии антител к M.leprae. Это не дает возможности получить конкретный технический результат - повышение эффективности способа.
С развитием амплификационных методов, в частности полимеразноцепной реакции (ПЦР), появились широкие возможности в диагностике инфекционных заболеваний, особенно тех, где возбудителя трудно или невозможно культивировать. Помимо основных достоинств ПЦР - высокой чувствительности и специфичности, применение ПЦР позволяет значительно снизить время детекции возбудителя. В основе данного метода, состоящего из трех стадий (денатурация, отжиг, синтез), лежит амплификация (многократная репликация) специфического участка ДНК. Выбор подходящей ДНК-мишени для амплификации очень важен для создания высокоспецифичного ПЦР-теста. Правильно подобранные праймеры к соответствующим участкам ДНК-мишени обеспечивают специфичность и чувствительность тест-системы. Однако на результаты определения может повлиять ряд факторов, связанных с особенностями анализируемого клинического материала, т.е. создание высокоспецифичного и высокочувствительного ПЦР-теста связано с методами экстракции ДНК M.leprae в зависимости от источника биологического образца (сыворотка крови, биоптат, скарификаты с кожи, соскобы со слизистой оболочки носа). Основной задачей на этом этапе является получение максимального количества ДНК возбудителя с наименьшими экономическими затратами.
Изложенное определяет актуальность предлагаемого изобретения и необходимость разработки скринингового обследования населения на лепру с помощью полимеразной цепной реакции.
Известен способ по выявлению M.leprae в носовой полости авторами Klaster P.R., van Beers S., Madjit В. et al. (Detection of Mycobacterium leprae nasal carriers in population for which leprosy endemic // J. Clin. Microbiol. 1993, 2947-2951), проводившими обследование населения в эндемичном по лепре регионе. Используя праймеры к 531-bp фрагменту pra гена M.leprae, детекцию продуктов амплификации проводили либо в агарозном геле, либо в дальнейшей гибридизации, либо в ELISA. Показано, что в 2,9% случаев при использовании данных праймеров идентифицировать M.leprae не представлялось возможным.
Недостатком этого способа является отсутствие возможности идентифицировать M.leprae в некоторых образцах при проведении ПЦР, для чего требовалась постановка или повторной реакции, или проведение гибридизации, или иммуноферментного анализа. Кроме того, недостатком известного способа является использование в качестве детекции продуктов амплификации электрофореза, что может способствовать контаминации образцов. Эти недостатки не позволяют получить конкретный технический результат - повышение эффективности способа.
Известен способ идентификации Mycobacterium leprae с помощью теста GenoType Leprae DR, основанный на DNA-стрип технологии фирмы Hain Lifescience (Германия). Для идентификации используют мультиплексную амплификацию с биотинилированными праймерами и реверс-гибридизацией.
Недостатком данного метода является необходимость использования специализированного дорогостоящего оборудования и реактивов, совместимых только с данным оборудованием и, как следствие этого, высокая стоимость анализа, что не обеспечивает возможности получения конкретного технического результата - повышение эффективности способа.
С целью обнаружения ДНК M.leprae применяют праймеры к различным участкам ДНК. Одним из видов таких праймеров являются, так называемые, RLEP праймеры. Хромосома Mycobacterium leprae содержит семейство из 29 мультикопийных повторов (RLEP) с переменной структурой и неизвестной функцией [2], каждая из которых содержит инвариантный фрагмент в 545 bp, фланкирующих в некоторых случаях дополнительные фрагменты от 44 до 100 bp. Использование RLEP в качестве ДНК-мишеней для ПЦР имеет преимущество по чувствительности по сравнению с другими мишенями ДНК, поскольку они присутствуют в нескольких местах геномной ДНК [3].
Известен способ идентификации M.leprae в носовой полости с использованием праймеров к 372 bp фрагменту RLEP M.leprae (Patrocinio L.G., Goulart I.M.B., Goulart L.R. et al. Detection of Mycobacterium leprae nasal mucosa biopsies by the polymerase chain reaction // FEMS Immunol, and Med Microbiol. 2005, 44: 311-316) и к 455-bp фрагменту RLEP (Jadhav R.S., Macdonald M, Bjune L. et al. Simplified PCR detection method for nasal Mycobacterium leprae // Int. J. Lepr. 2001, 4: 299-307) с хорошей степенью чувствительности.
Недостатками этого способа являются - инвазивность метода (взятие биопсии со слизистой поверхности носа, а не соскоба), что подразумевает особые условия для взятия анализа и не может быть использовано при скрининговом обследовании. Кроме того, этот метод был применен только у больных лепрой и не проверялся на здоровых лицах. Эти недостатки не обеспечивают возможности получения конкретного технического результата - повышение эффективности способа.
Известен способ идентификации M.leprae, разработанный Truman R.W., Andrews Р.K., Robins N.Y. et al. (Enumeration of Mycobacterium leprae using realtime PCR // PLOS Negl. Trop.Dis., 2008, 2(11), doi:10.1371/joumail.pntd.0000328), где в качестве праймеров и зонда использовали сиквенс из 1, 2, 3 и 4 RLEP M.leprae. Недостатком данного способа является использование данных праймеров только для обнаружения Mycobacterium leprae в экспериментальной модели лепрозной инфекции на мышах.
В качестве прототипа изобретения взят способ, предложенный Martinez N.A., Lahiri R., Pittman L.T. et al. (Molecular determination of Mycobacterium leprae viability by use of real-time PCR // J. Clin. Microbiol. 2009, 47: 2124-2130), при котором для обнаружения M.leprae применяется метод ПЦР с обратной транскрипцией с использованием в качестве праймеров sodA mRNA, 16S rRNA и RLEP M.leprae.
Общим существенным признаком является то, что в обоих способах в качестве одного из праймеров используются последовательности RLEP M.leprae и амплификация проходит в режиме реального времени (Real time) в течение 40 циклов.
Сущность способа по прототипу состоит в обнаружении в биоптатах больных лепрой жизнеспособной ДНК M.leprae при использовании двух пар праймеров, а именно sodA/RLEP и 16SrRNA/ RLEP.
Недостатками известного способа являются:
- длительность метода выделения, состоящего из многих этапов с использованием дорогостоящих готовых зарубежных наборов реагентов, включающих гомогенизацию на льду, обработку реагентом TRIzol, осаждение ДНК изоамиловым спиртом, многократные отмывки;
- проведение экстракции ДНК и РНК только из биоптатов и скарификатов кожи больных лепрой и из подушечек лап атимусных мышей, зараженных M.leprae по методу Shepard и McRae [4]. Авторы не проводили экстракцию ДНК, полученной из соскобов со слизистой носа как от больных лепрой, так и контактных лиц, что необходимо при создании скринингового теста;
- применение только для диагностирования клинических проявлений болезни и для контроля эффективности лечения у больных лепрой;
- выявление преимущественно жизнеспособных M.leprae, что не является определяющим при скрининговом обследовании;
- использование несколько пар праймеров.
Таким образом, перечисленные недостатки не обеспечивают повышение точности, скорости, информативности, неинвазивности и удешевления способа, т.е. эффективности способа.
Целью изобретения является повышение скорости, точности, информативности, неинвазивности, а также удешевление способа идентификации ДНК микобактерий лепры с помощью полимеразной цепной реакции в режиме реального времени.
Цель достигается путем обнаружения Mycobacterium leprae в носовой полости обследуемых лиц с помощью неинвазивного способа взятия материала, простотой и сокращением времени выделения ДНК, использованием одной пары праймеров с применением отечественного оборудования и реактивов.
Сущность способа состоит в следующем:
Соскоб со слизистой оболочки полости носа проводят с помощью стерильных одноразовых зондов. Зонд переносят в пластиковую пробирку объемом 1,5 мл со стерильным физиологическим раствором (300 мкл), аккуратно перемешивают, извлекают зонд, прижимая к стенке пробирки и отжимая избыток жидкости. Пробирку плотно закрывают, центрифугируют при 13000 об/мин в течение 10 мин и удаляют надосадочную жидкость, оставив в пробирке примерно 100 мкл (осадок + жидкая фракция). К 100 мкл исследуемого образца добавляют 100 мкл физиологического раствора и 40 мкл 5% раствора сывороточного бычьего альбумина (СБА), пробирка встряхивается, образец отстаивается в течение 2-5 мин и затем инкубируется при температуре 95° 1 мин и охлаждается 1 мин при температуре -20°С. Эту процедуру повторяют 4 раза. После чего образец термостатируют 20 мин при 95°С и центрифугируют 1 мин при 13000 об/мин. Далее 5 мкл выделенной ДНК отбирают на дальнейшую постановку ПЦР, оставшийся материал хранят при температуре -20°С.
Выделенные 5 мкл ДНК добавляют в амплификационную смесь (25 мкл). Состав амплификационной смеси: 50 мМ KCl, 10 мМ Трис HCl (pH 8,8), 6,25 мМ MgCl2, Taq-полимераза (5 ед/мкл), смесь dNTP, концентрация каждого нуклеотида 25 мМ, глицерол, Tween 20, по 10 пкмоль/мкл каждого праймера и флуоресцентного зонда, 25 мМ MgCl2 и деионизированная вода. Затем вносят в пробирку 20 мкл минерального масла.
Последовательность праймеров и зондов к RLEP M.leprae:
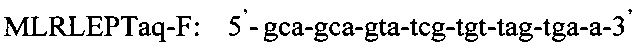
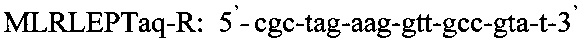
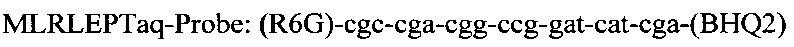
Использование в предлагаемом способе флуоресцентного зонда позволяет проводить ПЦР в реальном времени и избежать контаминации, что возможно при детекции результатов с помощью электрофореза. Отработка условий амплификации включает в себя: отработку времени и температуры денатурации при 94°-95°С от 1 мин до 10 мин, температуры отжига праймеров - 60°, 62°, 64°С, концентрации ионов Mg ++ от 0,8 до 10,5 мМ, время циклов каждой стадии амплификации от 1 минуты до 15 сек и, наконец, количество циклов от 30 до 45. Критерием правильности режима для каждого этапа проводимой реакции служит показатель результата - наличие ДНК M.leprae из заведомо положительного биоптата кожи больного лепрой. Отработанный режим амплификации представляет из себя следующее:

Проверку специфичности проводили на кожных биоптатах, полученных от больных лепрой. Во всех биоптатах M.leprae обнаружены как с помощью ПЦР-анализа, так и при гистологическом исследовании. Кроме того, специфичность оценивалась на музейных штаммах микобактерий: M.avium, M.kansasii, M.scrofulaceum, M.marinum, M.vaccae, M.intracellulare, M.clegg, M.duvalii, M.phlei, M.gastri, M.gordonae, M.lufu, M.smegmatis, M.bovis, M.paratuberculosis, M. Кедровский. Все изоляты исследовались в пределах 100 клеток в образце. Ни один из изолятов не показал реактивности в ПЦР.
В качестве примеров своевременного выявления микобактерий лепры приводятся выписки из карт больных.
При обследовании у пациента взят соскоб со слизистой оболочки полости носа для проведения бактериоскопического исследования и постановки ПЦР. При бактериоскопическом исследовании Mycobacterium leprae в соскобе со слизистой носа не обнаружены. В результате ПЦР исследования, проведение которого описано выше, у больного в соскобе со слизистой оболочки носа выявлены микобактерии лепры. В дальнейшем расширенное обследование больного с привлечением бактериоскопических исследований скарификатов кожи и гистологического анализа кожных биоптатов подтвердило эти результаты. Больному поставлен диагноз многобациллярной лепры, являющейся наиболее контагиозной формой заболевания. Данный больной, проживавший в эндемичном по лепре регионе, длительное время обращался в различные медицинские учреждения по поводу трофической язвы стопы. Проведение скринингового обследования на лепру, по предлагаемому нами способу, позволило бы своевременно установить правильный диагноз и вовремя начать специфическое лечение, тем самым прервать эпидемиологическую цепочку болезни, снизив риск инфицирования M.leprae лиц, с которыми больной контактировал.
Для характеристики чувствительности предлагаемой тест-системы проведено сравнительное изучение выявления микобактерий лепры с помощью предлагаемого способа и с использованием теста GenoType Leprae DR фирмы Hain Lifescience (Германия). Результаты представлены в таблице:
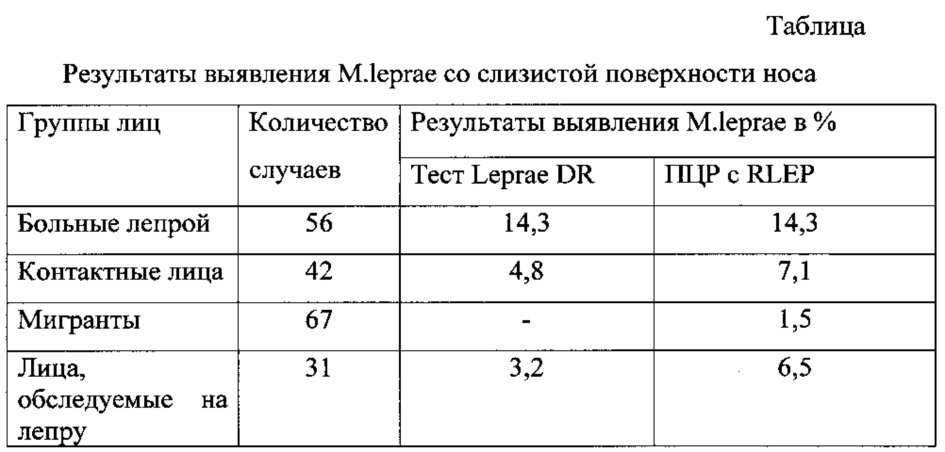
Полученные результаты подтверждают, что предлагаемый способ идентификации микобактерий лепры прост в исполнении, неинвазивен, информативен и значительно дешевле импортных тест-систем, выполняется на отечественном оборудовании и отличается повышенной чувствительностью, точностью и скоростью выполнения.
Приведенные примеры применения предлагаемого способа показывают его полезность для выявления инфицированных микобактериями лепры лиц, на основании чего проводится дальнейшее обследование с целью установления диагноза лепры. Таким образом, применение данного способа способствует выявлению заболевания на ранней стадии, когда лечение наиболее эффективно, проводится с наименьшими экономическими затратами и с наименьшим ущербом для здоровья пациентов. Предлагаемое изобретение удовлетворяет критериям новизны т.к. при определении уровня исследований по данному вопросу не обнаружено способа, которому присущи признаки, идентичные всем признакам, перечисленным в формуле изобретения, включая характеристику назначения.
Способ идентификации микобактерий лепры имеет изобретательский уровень, поскольку не выявлены технические решения, имеющие признаки, совпадающие с отличительными признаками предлагаемого изобретения.
Таким образом, предлагаемое изобретение решает основную задачу - повышение эффективности способа, а именно точности, скорости, информативности, неинвазивности, а также удешевление процедуры идентификации ДНК микобактерий лепры, что немаловажно при массовом обследовании, в частности мигрантов.
Авторами предложен новый, никем ранее незаявленный способ идентификации микобактерий лепры со слизистой оболочки носа при обследовании населения на лепру.
Предлагаемый способ может быть рекомендован к клиническому использованию в противолепрозных учреждениях, в диагностических лабораториях, в лечебных учреждениях для обследования населения на лепру.
1. Rupendra S., Macdonald М., Bjune L. et al. Simplified PCR detection method for nasal Mycobacterium leprae // Int. J. Lepr., 2001, 69: 299-308.
2. Woods S.A., Cole S.T. A family of dispersed repeats of Mycobacterium leprae // Mol. Microbiol., 1990, 4: 1745-1751.
3. Kang T.J., Kim S.K., Lee S.B. et al. Comparison of two different PCR amplification products (the 18-kDA protein gene vs. RLEP repetitive sequence) in the diagnosis of Mycobacterium leprae // Clin. Exp. Dermatol., 2003, 28: 420-424.
4. Shepard S.S., McRae D.H. A method for counting acid-fast bacteria // Int. J. Lepr., 1968, 36: 78-82.
а) Антигенная структура. Разработка метода исследования при помощи моноклональных антител (мАТ) позволила охарактеризовать иммуногенные компоненты М. leprae и привела к открытию в составе стенки микроорганизма специфического гликолипида — фенольного гликолипида-1 (ФГЛ-1). Дальнейшие исследования показали, что терминальный дисахарид ФГЛ-1 является иммунодоминантной видоспецифической детерминантой М. leprae. Другой мишенью антительного ответа при лепроматозном типе лепры является белок М. leprae с мол. массой 65 кД.
Антигликолипидные антитела классов IgM и IgG удалось идентифицировать и определить количественно при помощи методов иммунодиффузии и ИФА в сыворотках крови больных лепрой. Антитела к гликолипиду, особенно класса IgM, были обнаружены у больных туберкулоидным (60%) и лепроматозным (90%) типами лепры, тогда как у больных туберкулезом и лиц, инфицированных М. kansasii, М. avium, М. intracellulare, они не выявляются. Эти результаты подчеркивают видовую специфичность гликолипида.
R. Young и соавт. (1985), используя мАТ, идентифицировали 5 иммунодоминантных белков М. leprae с мол. массой 28 (два), 36, 65 и 70 кД. Позднее был описан белковый комплекс 85 или а-антиген, который является иммунодоминантным антигеном М. leprae. Были выделены два основных мембранных белка. Показано, что один из них состоит из 20 субъединиц по 18 и 22 кД, т.е. близок к бактериоферритинам других микобактерий.
В работах ряда зарубежных авторов описаны три основных цитоплазматических протеина (ОЦП) М. leprae. ОДП-1 имеет мол. массу 10,8 кД. Он сходен с белком 10,8кД М. tuberculosis, но отличается от последнего по аминокислотному составу, что свидетельствует о его иммунологической специфичности. ОЦП-2 имеет мол. массу 18 кД. Белок ОДП-3 — супероксид-дисмутаза.
В состав клеточной стенки М. leprae входят липоарабиноманнан, фосфатидилинозитолгексаманнозид и липоманнан, играющие существенную роль в патогенезе лепры. Некоторые авторы считают, что липоарабиноманнан участвует в процессе иммуносупрессии при лепре, подавляя генерализованную активацию макрофагов.
Исследованиями ряда авторов было установлено, что в структуре М. leprae имеются антигены, общие с М. tuberculosis, М. bovis, М. lepraemurium (перекрестно реагирующие антигены).
Идентификация видоспецифических эпитопов различных антигенов М. leprae, таких как ФГЛ-1, белки с мол. массой 35 и 36 кД, привела к созданию специфических серологических тестов для диагностики лепры. Несмотря на то, что цель ранней диагностики лепры не была достигнута из-за низкой специфичности и чувствительности тестов, роль этих исследований высока, так как они позволили сделать большой шаг вперед в понимании механизма иммунного ответа при лепре.
б) Генетическая характеристика. Полная последовательность генома М. leprae содержит 3268203 пар оснований (base-pair, bp, пар нуклеотидов) и имеет 1700 открытых считываемых рамок (ORF — open reading frame, англ.), в то время как геном М. tuberculosis — 4411532 bp и 4000 ORF, т.е. функциональная плотность у генома М. leprae значительно ниже, чем у генома М. tuberculosis.
Детальное попарное сравнение последовательностей обоих геномов и протеомов показало, что только 49,5% генома Mycobacterium leprae содержит гены, кодирующие белки, в то время как 27% включает псевдогены — неактивные считывающие рамки с функциональными двойниками в Mycobacterium tuberculosis. Остальные 23,5% генома не являются кодирующими и могут соответствовать регуляторным последовательностям или даже остаткам мутировавших генов. Распределение 1116 псевдогенов в основном носит произвольный (случайный) характер, и если их исключить, останется 1604 потенциально активных гена, из которых 1439 являются общими для обоих возбудителей.
Из 165 генов, которые не имеют ортолога в Mycobacterium tuberculosis, функции 29 могут быть описаны. Многие из оставшихся 136 кодирующих последовательностей в М. leprae, которые не имеют сходства с известными генами, возможно, также представляют собой псевдогены, поскольку они короче средних размеров и встречаются в регионах пониженной плотности генов.
Установлено, что около 2% генома М. leprae состоит из повторяющихся ДНК. Имеется более 20 молчащих инсерционных последовательностей (insertion sequences, IS, англ.) с 4 семействами разбросанных повторов (RLEP, REPLEP, LEPREP, LEPRPT).
в) Внутривидовое разнообразие. Между геномами различных штаммов микобактерий лепры практически нет различий, что не позволяло характеризовать образцы, выделяемые из разных источников. Постоянство и сохранность такого массива псевдогенов при отсутствии объяснимой необходимости в этом остаются загадкой для исследователей. Учитывая особенности биологических свойств возбудителя лепры (длительность генерации и способность к жизни и размножению в макрофагах), исследователи высказывают предположение, что в процессе эволюции М. leprae выработали неординарную способность восстанавливать любые генетические повреждения и сохранять постоянство генома.
Анализ рестрикционных фрагментов показал, что в геномах штаммов М. leprae, полученных от больных лепрой, броненосцев и обезьян мангобей, различаются менее 0,3% нуклеотидов. Микобактерии лепры из различных источников имеют идентичные по 16S рРНК межгенные спейсерные области, считающиеся причиной видовой и штаммовой вариабельности некоторых бактерий.
Исследование генетического разнообразия штаммов М. leprae, выделенных от больных лепрой из 12 географически удаленных регионов мира и от животных, продемонстрировало различие в последовательности 6-bp в двух аллелях гроТ-гена. Показано, что по этому признаку изоляты М. leprae, выделенные в Корее и Японии (кроме о. Окинава), принадлежат к одному генотипу, а из других стран Азии (Бангладеш, Индия, Индонезия, Непал, Пакистан, Филиппины и Таиланд), а также из Бразилии, Гаити и о. Окинава — к другому генотипу.
Микобактерии лепры, полученные от животных (броненосца и обезьяны мангобей), отличались и от первого, и от второго генотипов. Вторым достижением стала идентификация вариабельного числа тандемных повторов тринуклеотидного триплета GAA/TTC в интергенном регионе генома. Значение этого локуса очень важно, так как аллели с различным числом повторов (от 10 до 37) были выявлены в изолятах от больных лепрой в Бразилии и на Филиппинах. Эти результаты свидетельствуют о генетическом разнообразии микобактерий лепры и о генотипоспецифическом распространении заболевания в мире.
г) Факторы патогенности. Факторы патогенности М. leprae не известны. Предварительные результаты ПЦР в присутствии протеазоспецифичных праймеров, предназначенных для амплификации генов на полную длину, показали, что М. leprae экспрессирует ген 2659, который гомологичен гену сывороточной протеазы рерА фактора вирулентности Pseudomonas aeruginosa.
Редактор: Искандер Милевски. Дата публикации: 6.12.2019
Читайте также:


