Исследование воды на туляремию
Возникновение заболеваний среди людей определяется эпизоотическим состоянием очагов. Разлитые эпизоотии туляремии наблюдаются обычно в годы высокой численности мелких млекопитающих (ММ). Повышение численности ММ является важной характеристикой состояния очага и признаком возможного неблагополучия.
В поисках туляремийных эпизоотий лабораторному исследованию подвергают отловленных разными методами диких ММ или их трупы, собранные в природе, подснежные гнезда грызунов, продукты жизнедеятельности ММ, погадки птиц (ПП), помет хищных млекопитающих (ПXM), а также солому, мякину, талую воду и другие объекты, воду из естественных водоемов и колодцев, гидробионтов и др. Среди членистоногих переносчиков основное внимание уделяют иксодовым клещам. Кроме того, исследуют мелких эктопаразитов, собранных с ММ. При трансмиссивных вспышках исследуют кровососущих двукрылых (комаров, слепней и др.). Серологические исследования домашних животных проводят при соответствующих эпизоотологических и эпидемиологических показаниях.
а) Бактериоскопия. Ввиду мелких размеров туляремийный микроб может быть достоверно обнаружен в окрашенных мазках-отпечатках только из обильно обсемененного патологического материала. Четко положительные результаты получают при содержании в 1 г ткани более 1 млрд, микробов. Поэтому бактериоскопия эффективна при исследовании павших диких или биопробных животных, но обычно безуспешна при исследовании зверьков на ранних стадиях заболевания. Метод не используется при исследовании воды, смывов с объектов внешней среды, где концентрация возбудителя может быть незначительной.
б) Люминесцентная микроскопия (РИФ) является эффективным методом обнаружения как живых, так и погибших бактерий туляремии при концентрации 1 млн. микробных клеток в 1 мл. При меньших концентрациях — 100 тыс., 10 тыс., 1 тыс. микробных клеток в 1 мл возбудитель может быть обнаружен, но его выявление не носит закономерного характера. Объектами исследования могут быть бактериальные взвеси, отпечатки и гомогенаты органов и тканей животных, беспозвоночные переносчики. Метод прост и не имеет себе равного по быстроте получаемого ответа (1,5-2 ч), поэтому рекомендуется для ускоренного выявления и идентификации возбудителя туляремии.
Все процедуры постановки реакции и учета ее результатов проводят в соответствии с инструкцией по применению иммуноглобулинов диагностических флуоресцирующих туляремийных сухих.
в) Бактериологический метод. Посев на питательные среды применяют для выделения культуры возбудителя туляремии из органов павших или забитых диких животных, павших или убитых лабораторных животных, а также зверьков, у которых обнаружены патологоанатомические изменения, характерные для туляремии. Иксодовых клещей, воду, почву, смывы с объектов внешней среды не исследуют посевом ввиду их контаминации посторонней микрофлорой. Для бактериологического исследования применяют специальные питательные среды для культивирования туляремийного микроба, подробное описание которых изложено выше.
г) Биологический метод является самым эффективным; он применяется для обнаружения туляремийных бактерий в любом исследуемом материале. Биологическим методом можно исследовать органы павших или убитых диких млекопитающих, кровососущих членистоногих, гидробионтов, воду, смывы с различных субстратов, т.е. материалы, в которых могут содержаться живые туляремийные бактерии. Для биологической пробы обычно используют беспородных белых мышей, которые заболевают и гибнут от туляремии при подкожном введении суспензии, содержащей единичные бактерии. При массивном инфицировании исследуемых объектов животные погибают уже на 3-4-е сутки, при меньшей обсемененности материала гибель мышей может затянуться до 7-9 сут., иногда до 15-20.
В большинстве случаев у погибших животных обнаруживаются характерные для туляремии патологоанатомические изменения: воспаление ткани на месте заражения (плотный инфильтрат), увеличение, уплотнение и гиперемия лимфатических узлов, особенно близлежащих к месту введения, резкая гиперемия сосудов подкожной клетчатки, уплотнение и увеличение селезенки, печени, увеличение и гиперемия надпочечников, гиперемия тонкого кишечника. В мазкахотпечатках из селезенки, печени и крови при окраске по Романовскому-Гимзе или путем люминесцентной микроскопии обнаруживают большое количество туляремийных бактерий, а в посеве на специальные питательные среды селезенки и печени уже через 18-24 ч появляется рост культуры возбудителя. Для биологической пробы могут быть использованы и морские свинки, обладающие такой же высокой чувствительностью к туляремии, как и белые мыши, а также дикие грызуны первой группы (обыкновенные полевки, домовые мыши), отловленные на неэпизоотичных территориях и выдержанные в карантине 30 сут.
Биопробных животных выдерживают следующие сроки: белых мышей — до 15-20 сут., морских свинок — до 25 сут.
д) Серологические методы исследования в ряде случаев являются основным методическим приемом, позволяющим выявить туляремийные эпизоотии благодаря возможности исследовать материал, не пригодный для бактериологического исследования. Серологические методы эффективны при поисках антигена в трупах грызунов, ПП, ПХМ, субстратах гнезд и других объектах внешней среды.
При исследовании трупов диких или лабораторных животных готовят суспензию из кусочков органов животных (селезенка, печень) путем растирания с добавлением 0,9% раствора натрия хлорида из расчета 1:5 или 1:10. Полученную суспензию обеззараживают, фильтруют для получения относительно прозрачного фильтрата. При исследовании субстрата гнезда грызунов следует брать его целиком вместе с прилегающими слоями почвы. Материал заливают 0,9%-ным раствором натрия хлорида (примерно 10 мл), выдерживают 1-6 ч; надосадочную жидкость обеззараживают, фильтруют, после чего используют в серологических реакциях. Для серологического исследования бактериальной культуры последнюю выращивают 2 сут. при 37°С на желточной или агаровой среде, готовят взвесь на 0,9%-ном растворе натрия хлорида (pH 7,0-7,2) с концентрацией 1x10я микробных клеток в 1 мл, обеззараживают, разводят в 10 раз до концентрации 100 млн. микробных клеток в 1 мл и используют в серологических реакциях.
Наиболее эффективной и специфичной серологической реакцией для выявления туляремийного антигена при исследовании органов животных, ПП, ПХМ, субстрата гнезд, почвы и т.п. является реакция нейтрализации антител (РНАт) с туляремийным антигенным эритроцитарным диагностикумом. При массовых исследованиях различных объектов внешней среды за диагностический титр принимают разведение фильтрата 1:20 и выше. Результаты в более низких титрах расценивают как сомнительные. При анализе некоторых объектов (бактериальные суспензии, органы животных и др.) помимо РНАт можно применять иммуноферментный анализ (ИФА), реакцию объемной агломерации (РОА), реакцию коагглютинации (РК) и некоторые другие тесты, используемые в отдельных регионах и учреждениях.
ИФА используют для выявления туляремийного антигена в органах животных, ПП, ПХМ, других объектах внешней среды, а также для идентификации изолированных культур возбудителя туляремии. Метод отличается высокой чувствительностью, специфичностью, возможностью количественной и автоматизированной оценки результатов, воспроизводимостью и стандартностью основных ингредиентов анализа. При помощи ИФА можно обнаружить 10 3 -10 4 туляремийных бактерий в 1 мл или 1-5 нг/мл антигена. Для постановки ИФА используют диагностическую иммуноферментную тест-систему для определения туляремийного антигена.
Для выявления антител у животных наиболее эффективными методами являются реакция агглютинации (РА) и реакция непрямой гемагглютинации (РИГА). Используют сыворотку, плазму крови животных или смывы из грудной полости. Титры антител у переболевших диких животных колеблются в пределах 1:10-1:320, редко выше, в зависимости от давности переболевания. У сельскохозяйственных животных они могут достигать 1:320 — 1:640, но чаще бывают низкими. Выявление антител у животных указывает на их контакт с возбудителем и наличие эпизоотии туляремии.
е) Исследование методом ПЦР. В ряде случаев для определения ДНК возбудителя туляремии в различных объектах используют ПЦР. Метод превышает по чувствительности серологические тесты и применяется для индикации и ускоренной диагностики туляремии. Подготовку материала и проведение анализа осуществляют в соответствии с инструкцией по применению тест-системы ПЦР для выявления ДНК возбудителя туляремии.
Выделенная культура должна иметь характерный для микроба туляремии рост на свернутой желточной среде в виде извилистого слегка блестящего (не сухого) почти бесцветного налета не сильно выраженной слизистой консистенции, хорошо снимающегося петлей. Культура легко суспендируется. Для изучения морфологии и тинкториальных свойств готовят мазок на предметном стекле, который фиксируют и окрашивают по Граму. В мазке туляремийный микроб представляет собой мелкую грамотрицательную коккобактерию. В окрашенных мазках из культуры с плотной среды обнаруживается обильная слизь. Присутствие в мазке окрашенной слизи характерно для возбудителя туляремии. Для проверки отсутствия роста на простых питательных средах используют слабощелочные питательные агар и бульон.
Антигенную специфичность изолированной культуры проверяют при помощи реакции агглютинации с лошадиной (коммерческой) иммунной сывороткой. Для этого испытуемую культуру выращивают в течение 2 сут. при 37°С на свернутой желточной среде в количестве 2 -3 пробирок. Чистоту посева контролируют бактериоскопией. Реакцию агглютинации ставят обычным способом в пробирках. В качестве антигена используют живую испытуемую культуру, суспендированную в 0,9%-ном растворе натрия хлорида (pH 7,0-7,2) до концентрации 1х10 9 микробных клеток в 1 мл по оптическому стандарту мутности 10 единиц ГИСК им. Л.А.Тарасевича. После добавления антигена к разведениям сыворотки пробирки выдерживают 2 ч при 37°С, затем 12-18 ч при комнатной температуре, после чего проводят учет результатов. Культура должна агглютинироваться до разведения сыворотки, указанного в инструкции по применению препарата.
При этом должна иметь место четкая реакция, сопровождающаяся полным просветлением жидкости и выпадением на дно пробирки плотного агглютината. При встряхивании пробирки агглютинат разбивается на крупные хлопья, а жидкость остается прозрачной. Специфичность выделенной культуры может быть подтверждена также при помощи РИФ. При обработке культуры туляремийной люминесцирующей сывороткой обнаруживают специфическое яркое зелено-желтое свечение бактерий.
При возможности проводят проверку вирулентности культуры, но не позднее месячного срока после изоляции. Ориентировочное определение вирулентности проводят, как правило, на одном из двух видов животных (белые мыши или морские свинки). Для заражения используют 2 дозы — 1 и 10 микробных клеток по 2-3 животных на каждую. Свежевыделенные туляремийные культуры при подкожном введении вызывают гибель животных с обнаружением характерных для туляремии изменений в органах и выделением чистой культуры.
На территории Российской Федерации циркулируют и выделяются культуры голарктического подвида возбудителя туляремии — F.tularensis subspecies holarctica, различающиеся по чувствительности к эритромицину (и другим макролидам). Для определения этого свойства используют диски с эритромицином, содержащие 15 мкг антибиотика. Эта концентрация позволяет дифференцировать штаммы туля-ремийного микроба на два биологических варианта — биовар 1 Ery s и биовар 11 Ery r . Для определения принадлежности к тому или другому биовару готовят суспензию испытуемой культуры в концентрации 1х10 9 микробных клеток в 1 мл по оптическому стандарту мутности 10 единиц ГИСК им. Л.А.Тарасевича. Суспензию культуры в объеме 0,5 мл вносят в чашку с агаровой средой, равномерно распределяя ее по поверхности, после чего накладывают в центральную часть чашки диск с эритромицином. Чашку помещают в термостат при 37°С. Учет и оценку результатов проводят через 1-2 сут.
Чувствительная к эритромицину культура образует вокруг диска выраженную зону задержки роста диаметром 2-3 см; резистентная к эритромицину культура дает равномерный рост по всей поверхности чашки.
Редактор: Искандер Милевски. Дата публикации: 30.1.2020
При проведении лабораторной диагностики исследуют:
– от больных людей: содержимое бубона, материал из зева, коньюнктивы глаза, отделяемое язвы, мокроту, кровь и сыворотку крови;
– от умерших людей: увеличенные лимфатические узлы, измененные участки легких и селезенки;
– при эпизоотологическом обследовании: диких млекопитающих или их трупов, подснежные гнезда грызунов, продукты жизнедеятельности млекопитающих, погадки птиц, помет хищных млекопитающих, а также солому, мякину, талую воду и другие объекты, загрязненные выделениями грызунов, воду из естественных водоемов и колодцев, гидробионтов, членистоногих (преимущественно иксодовых клещей), мелких эктопаразитов, собранных с млекопитаюих (вшей, гамазовых и краснотелковых клещей, блох). При трансмиссивных вспышках исследуют кровососущих двукрылых (комаров, слепней и др.). Серологические исследования сывороток крови домашних животных проводят при соответствующих эпизоотологических и эпидемиологических показаниях.
При исследовании на туляремию в лабораторию поступает патологический материал от больных или переболевших людей, домашних животных, погадки хищных птиц, кровососущие членистоногие (клещи, блохи, вши, комары, слепни и т.д.), объекты окружающей среды (вода, пищевые продукты, зерно, фураж и т.д.).
Лабораторная диагностика туляремии базируется на серологических (МФА, ИФА, реакция агглютинации, реакция непрямой гемагглютинации, реакция нейтрализации антител), молекулярно-генетических (ПЦР), бактериологических (бак бактериоскопия, посевы на питательные среды), биологических (заражение биопробных животных) и аллергических методах исследования.
Лабораторная диагностика туляремии у людей базируется, главным образом, на сероаллергических методах. Из аллергических методов используют накожную и внутрикожную пробу с тулярином, реакцию лейкоцитолиза. Из серологических реакций ставят реакцию агглютинацию (РА), микрореакцию агглютинации с цветным туляремийным диагностикумом, реакцию непрямой гемагглютинации (РНГА), кровяно-капельную реакцию. Бактериологические методы не всегда эффективны, что определяется особенностями течения инфекции у человека, малой обсемененностью органов и тканей возбудителем. Выделение возбудителя наиболее вероятно в течение первых 2–3 недель от начала заболевания и реже в более поздние сроки. В эти же сроки с материалом от больного человека ставят ПЦР.
Домашних животных на туляремию исследуют иммунологическими методами.
Животных, у которых на вскрытии обнаружены характерные для туляремии патологоанатомические изменения, исследуют индивидуально. Просматривают окрашенные по Романовскому-Гимза и обработанные люминесцентной сыво сывороткой мазки-отпечатки из органов. Производят посевы органов на плотные питательные среды. Забирают материал для серологического исследования на обнаружение туляремийного антигена (РНГА, РНАт реакция кольцепреципитации) и на обнаружениие специфической ДНК (ПЦР). Ставят индивидуальную биопробу.
Животных, погибших в природе, исследуют индивидуально. Органы трупа, если они не подверглись сильному разложению, засевают на плотные питательные среды с антибиотиками, готовят мазки-отпечатки и заражают биопробных животных. Параллельно ставят серологические реакции на обнаружение туляремийного антигена, ПЦР на обнаружение специфической ДНК. Если на исследование поступает труп грызуна, с выраженными процессами гниения, посевы на питательные среды не делают, а ограничиваются накожным или подкожным заражением белых мышей. В некоторых случаях от трупа исследуют только костный или головной мозг. Павших биопробных животных немедленно вскрывают. Выживших – хлороформируют (белых мышей на 15 сутки, морских свинок на 25 сутки) и делают посев селезенки на свернутую желточную среду.
Кроме грызунов, биологическим методом исследуют добытых в природе и снятых с грызунов кровососущих членистоногих и других беспозвоночных животных. Иксодовых клещей объединяют до 50 экземпляров в одну биологическую пробу. Гамазовых клещей, блох, вшей сортируют по родам, видам и группируют в отдельные пробы. Комаров объединяют до 100, мошек до 250, слепней по 25–50 экземпляров на одну биопробу.
Объекты окружающей среды также исследуют биологическим методом. Непосредственный посев материала на питательные среды не эффективен в виду его незначительной обсемененности возбудителем и загрязнением посторонней микрофлорой, подавляющей рост микроба туляремии. В этом случае можно использовать высокоселективные среды с антибиотиками. Идентификацию возбудителя туляремии проводят на основании следующих признаков:
§ морфологии и окраски микроба в мазках;
§ специфического свечения в МФА;
§ характера роста на плотных питательных средах;
§ отсутствия роста на простых питательных средах (МПА, МПБ);
§ РА со специфической туляремийной сывороткой;
§ выявление родоспецифичной ДНК в ПЦР;
§ патогенности для лабораторных животных (белые мыши, морские свинки).
Культура должна иметь характерный для микроба туляремии рост на плотных питательных средах (Мак-Коя, Анциферова, FT–агаре и др.), не расти на простых питательных средах (кроме F. tularensis subsp. novicida), агглютинироваться диагностической туляремийной сывороткой до титра или до 1/2 титра, вызывать гибель биопробных животных. Выделенные штаммы желательно типировать до подвида и дифференцировать на биологические варианты.
К серологическим методам диагностики туляремии относятся:
- реакции, направленные на выявление антител к туляремийному микробу (кровяно-капельная, РА, РНГА, РТНГА и др.);
- реакции, направленные на выявление антигенов туляремийного микроба (РНАт, кольцепреципитации, МФА, РА, РНГА, РТНГА и др.).
Серологические реакции используют для обследования и выявления природных очагов туляремии, для диагностики туляремии у людей. С целью рекогносцировочного обследования значительных территорий используют реакции, направленные на выявление антигенов туляремийного микроба в исследуемом материале.
Серологически исследуют материал, который не содержит живых туляремийных бактерий и непригоден для бактериологического исследования: от диких позвоночных животных, погадки хищных птиц, помет хищных млекопитающих, субстраты гнёзд грызунов, почву и т. д.
На антитела к туляремийному микробу исследуют сыворотки грызунов, добытых при эпизоотологическом обследовании территории, сельскохозяйственных животных, больных или переболевших туляремией людей.
К аллергическим методам относится:
- реакции in vivo – внутрикожная и накожная туляриновые пробы;
- реакции in vitro – лейкоцитолиза, показатель повреждения нейтрофилов (ППН), бласттрансформации и др.
Экспрессные и ускоренные методы поиска антигена (РА, РHГА, РТHГА, реакции кольцепреципитации, МФА, ИФА) в исследуемом материале или антител к нему (РНАт, РА, РНГА, РТНГА, кровяно-капельная реакция, МФА, ИФА), а также обнаружение специфической ДНК возбудителя (ПЦР) позволяют получить результат в течение 2–5 ч.
При использовании экспрессных и ускоренных методов диагностики получают лишь предварительный результат, который должен быть подтвержден выделением чистой культуры возбудителя туляремии.
Современные методы исследования позволяют быстро и в определенной степени надежно поставить диагноз туляремии у человека и осуществить выявление возбудителя при обследовании территорий.
ПРАКТИЧЕСКИЕ ЗАНЯТИЯ
Занятие 3
Исследование грызунов:
- изучение патологоанатомических изменений внутренних органов;
- приготовление и исследование мазков-отпечатков из органов трупа грызуна, обработанных туляремийной люминесцирующей сывороткой;
- исследование в реакции кольцепреципитации суспензии органов (печень, селезенка) трупа грызуна;
- постановка из суспензии внутренних органов трупа грызуна индивидуальной биологической пробы (п/к заражением белых мышей);
- Вскрытие отловленного грызуна с патологоанатоми патологоанатомическими изменениями во внутренних органах, характерных для туляремии:
- изучение патологоанатомических изменений во внутренних органах грызуна;
- приготовление и просмотр мазков-отпечатков из органов грызуна, окрашенных по Романовскому-Гимза;
- посев на среды Мак-Коя и Анциферова лимфатического узла, крови, печени, селезенки;
- постановка из суспензии внутренних органов грызуна индивидуальной биологической пробы (п/к заражением белых мышей);
- Вскрытие отловленных грызунов без патологоанатомических изменений во внутренних органах:
- постановка из суспензии внутренних органов грызунов биологической пробы (п/к заражением белых мышей).
- работа по заражению и вскрытию животных проводится курсантами в лаборатории экспериментальных животных;
- методы исследования диких грызунов отрабатываются на заранее зараженных возбудителем туляремии белых мышах;
- павших биопробных животных вскрывают немедленно.
Исследование воды:
Вскрытие морской свинки, зараженной подкожно исследуемой водой:
- изучение патологоанатомических изменений во внутренних органах;
- приготовление и исследование мазков-отпечатков из внутренних органов морской свинки, обработанных туляремийной люминесцирующей сывороткой;
- посев печени, селезенки и пахового лимфатического узла на среды Мак-Коя и Анциферова.
Примечание: морскую свинку курсанты заражают исследуемой водой заранее с учетом сроков гибели.
Занятие 4
Последнее изменение этой страницы: 2016-12-30; Нарушение авторского права страницы
Что такое туляремия?
Очаги туляремии встречаются во многих странах северного полушария; в России они располагаются преимущественно на территории Европейской части и Западной Сибири.
Причины туляремии
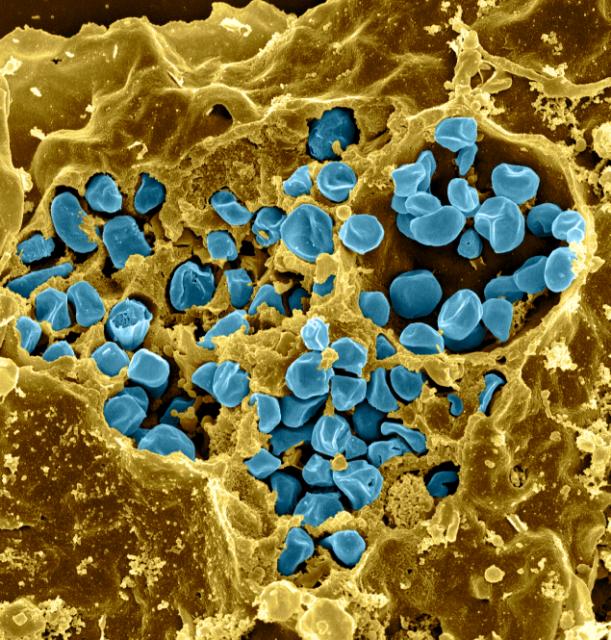
Возбудитель заболевания — неподвижные грамотрицательные аэробные капсулированные бактерии F. tularensis рода Francisella семейства Brucellaceae. Проявляют выраженный полиморфизм; наиболее часто имеют форму мелких коккобацилл.
У бактерий выделяют три подвида:
- неарктический (африканский);
- среднеазиатский;
- голарктический (европейско-азиатский).
Последний, голарктический включает три биологических варианта:
- японский биовар;
- эритромицин-чувствительный;
- эритромицин-устойчивый.
Внутривидовая дифференциация возбудителя туляремии основывается на различиях подвидов и биоваров по ряду фенотипических признаков:
- биохимической активности;
- составу высших жирных кислот;
- степени патогенности для человека и животных;
- чувствительности к определённым антибиотикам, а также особенностям экологии и ареалу возбудителя.
У бактерий обнаружены О- и Vi-антигены. Бактерии растут на желточных или агаровых средах с добавлением кроличьей крови или других питательных веществ. Из лабораторных животных к заражению чувствительны белые мыши и морские свинки. Вне организма хозяина возбудитель сохраняется долго. Так, в воде при 4°С он сохраняет жизнеспособность 1 мес, на соломе и зерне при температуре ниже О°С — до 6 мес, при 20-30°С — до 20 дней, в шкурах животных, павших от туляремии, при 8-12°С — более 1 мес.
Бактерии неустойчивы к высокой температуре и дезинфицирующим средствам. Для дезинфекции применяют 5% раствор фенола, раствор сулемы 1:1000 (убивает бактерии в течение 2-5 мин), 1-2% раствор формалина (уничтожает бактерии за 2 ч), 70° этиловый спирт и др. Для полного обеззараживания трупов инфицированных животных их следует выдерживать не менее 1 сут в дезинфицирующем растворе, после чего подвергать автоклавированию и сжиганию.
Эпидемиология

Резервуар и источник инфекции — многочисленные виды диких грызунов, зайцевидные, птицы, собаки и др. Бактерии выделены от 82 видов диких, а также от домашних животных (овцы, собаки, парнокопытные). Основная роль в поддержании инфекции в природе принадлежит грызунам (водяная крыса, обыкновенная полёвка, ондатра и др.). Больной человек не опасен для окружающих.
Человек заражается туляремией в результате прямого контакта с животными (снятие шкур, сбор павших грызунов и др.), а также алиментарным путём через инфицированные грызунами пищевые продукты и воду. Часто заражение происходит через кровососущих переносчиков (клещи, комары, блохи, слепни и другие членистоногие). Возможно заражение и респираторным путём (при вдыхании инфицированной пыли от зерна, соломы, овощей).
Естественная восприимчивость людей высокая (практически 100%).
Туляремия — распространённое природно-очаговое заболевание, встречающееся преимущественно в ландшафтах умеренного климатического пояса Северного полушария.
Широкое распространение возбудителя в природе, вовлечение в его циркуляцию большого числа теплокровных животных и членистоногих, обсеменённость различных объектов окружающей среды (воды, пищевых продуктов) определяют и характеристику эпидемического процесса.
Выделяют различные типы очагов (лесной, степной, лугово-полевой, поименно-болотный, в долине рек и др.). Каждому типу очагов соответствуют свои виды животных и кровососущих членистоногих, принимающих участие в передаче возбудителя.
Среди заболевших преобладают взрослые; часто заболеваемость связана с профессией (охотники, рыбаки, сельскохозяйственные рабочие и др.). Мужчины болеют в 2-3 раза чаще, чем женщины.
Антропургические очаги туляремии возникают при миграции заражённых грызунов из мест обитания в населённые пункты, где они контактируют с синантропными грызунами.
Туляремия остаётся болезнью сельской местности, однако в настоящее время отмечают устойчивое нарастание заболеваемости городского населения. Туляремию регистрируют на протяжении всего года, но более 80% случаев приходится на лето и осень. В последние годы заболеваемость спорадическая. В отдельные годы отмечают локальные трансмиссивные, промысловые, сельскохозяйственные, водные вспышки, реже вспышки других типов.
Трансмиссивные вспышки обусловлены передачей возбудителя инфекции кровососущими двукрылыми и возникают в очагах эпизоотии туляремии среди грызунов. Трансмиссивные вспышки обычно начинаются в июле или июне, достигают максимума в августе и прекращаются в сентябре-октябре; подъёму заболеваемости способствуют сенокос и уборочные работы.
Промышленный тип вспышек обычно связан с отловом водяной крысы и ондатры. Промысловые вспышки возникают весной или в начале лета в период половодья, и длительность их зависит от периода заготовки. Заражение происходит при контакте с животными или шкурами; возбудитель проникает через повреждения на коже, в связи с чем чаще возникают подмышечные бубоны, часто без язв в месте внедрения.
Водные вспышки определяет попадание возбудителей в открытые водоёмы. Основным загрязнителем воды являются водяные полёвки, обитающие по берегам. Заболевания обычно возникают летом с подъёмом в июле. Заболевания связаны с полевыми работами и использованием для питья воды из случайных водоёмов, колодцев и др. В 1989-1999 гг. доля изолятов возбудителя туляремии из образцов воды достигла 46% и более, что свидетельствует о важном эпидемиологическом значении водоёмов как длительных резервуаров инфекции.
Сельскохозяйственные вспышки возникают при вдыхании воздушно-пылевого аэрозоля при работе с соломой, сеном, зерном, кормами, контаминированными мочой больных грызунов. Преобладают лёгочная, реже абдоминальная и ангинозно-бубонная формы. Бытовой тип вспышек характеризует заражение в быту (дома, на усадьбе). Заражение также возможно во время подметания пола, переборке и сушке сельскохозяйственных продуктов, раздаче корма домашним животным, употреблении в пищу контаминированных продуктов.
Патогенез (что происходит?) во время туляремии
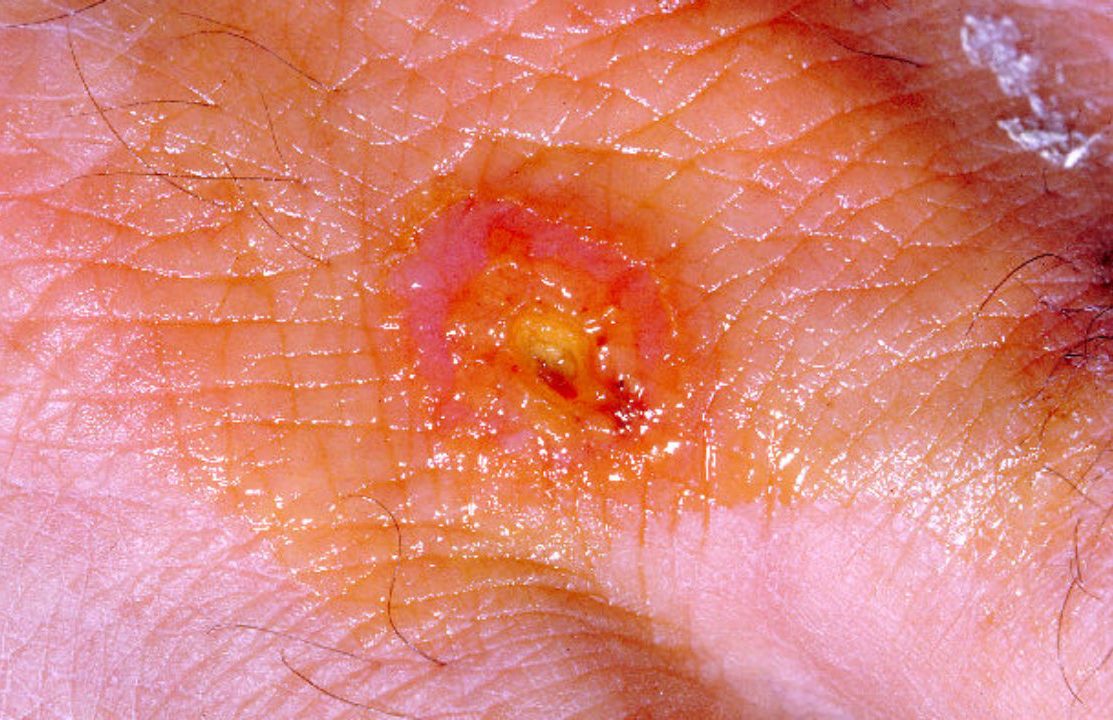
Бактерии проникают в организм человека через кожу (даже неповреждённую), слизистые оболочки глаз, дыхательных путей и желудочно-кишечный тракт. В области входных ворот, локализация которых во многом определяет клиническую форму заболевания, нередко развивается первичный аффект в виде последовательно сменяющих друг друга пятна, папулы, везикулы, пустулы и язвы.
В дальнейшем туляремийные палочки попадают в регионарные лимфатические узлы, где происходят их размножение и развитие воспалительного процесса с формированием так называемого первичного бубона (воспалённого лимфатического узла). При гибели бактерий F. tularensis высвобождается липополисахаридный комплекс (эндотоксин), усиливающий местный воспалительный процесс и при поступлении в кровь вызывающий развитие интоксикации.
Бактериемия при заболевании возникает не всегда. В случае гематогенного диссеминирования развиваются генерализованные формы инфекции с токсико-аллергическими реакциями, появлением вторичных бубонов, поражением различных органов и систем (прежде всего лёгких, печени и селезёнки).
В лимфатических узлах и поражённых внутренних органах образуются специфические гранулёмы с центральными участками некроза, скоплением гранулоцитов, эпителиальных и лимфоидных элементов. Формированию гранулём способствует незавершённость фагоцитоза, обусловленная свойствами возбудителя (наличием факторов, препятствующих внутриклеточному киллингу). Образование гранулём в первичных бубонах зачастую приводит к их нагноению и самопроизвольному вскрытию с последующим длительным заживлением язвы. Вторичные бубоны, как правило, не нагнаиваются. В случае замещения некротизированных участков в лимфатических узлах соединительной тканью нагноение не происходит, бубоны рассасываются или склерозируются.
Симптомы туляремии
В соответствии с клинической классификацией, выделяют следующие формы туляремии:
- по локализации местного процесса: бубонная, язвенно-бубонная, глазо-бубонная, ангинозно-бубонная, лёгочная, абдоминальная, генерализованная;
- по длительности течения: острая, затяжная, рецидивирующая;
- по степени тяжести: лёгкая, среднетяжёлая, тяжёлая.
Инкубационный период. Длится от 1 до 30 дней, чаще всего он равен 3-7 сут.
Признаки заболевания, общие для всех клинических форм, выражаются в повышении температуры тела до 38-40°С с развитием других симптомов интоксикации:
Лихорадка может быть ремиттирующей (наиболее часто), постоянной, интермиттирующей, волнообразной (в виде двух-трёх волн). Длительность лихорадки различна, от 1 нед до 2-3 мес, чаще всего она продолжается 2-3 нед.
При осмотре больных отмечают гиперемию и пастозность лица, а также слизистой оболочки рта и носоглотки, инъекцию склер, гиперемию конъюнктивы. В ряде случаев появляется экзантема различного характера: эритематозная, макуло-папулёзная, розеолёзная, везикулярная или петехиальная. Пульс урежен (относительная брадикардия), артериальное давление снижено. Через несколько дней от начала заболевания развивается гепатолиенальный синдром (сочетанное увеличение печени (гепатомегалия) и увеличение селезенки (спленомегалия)).
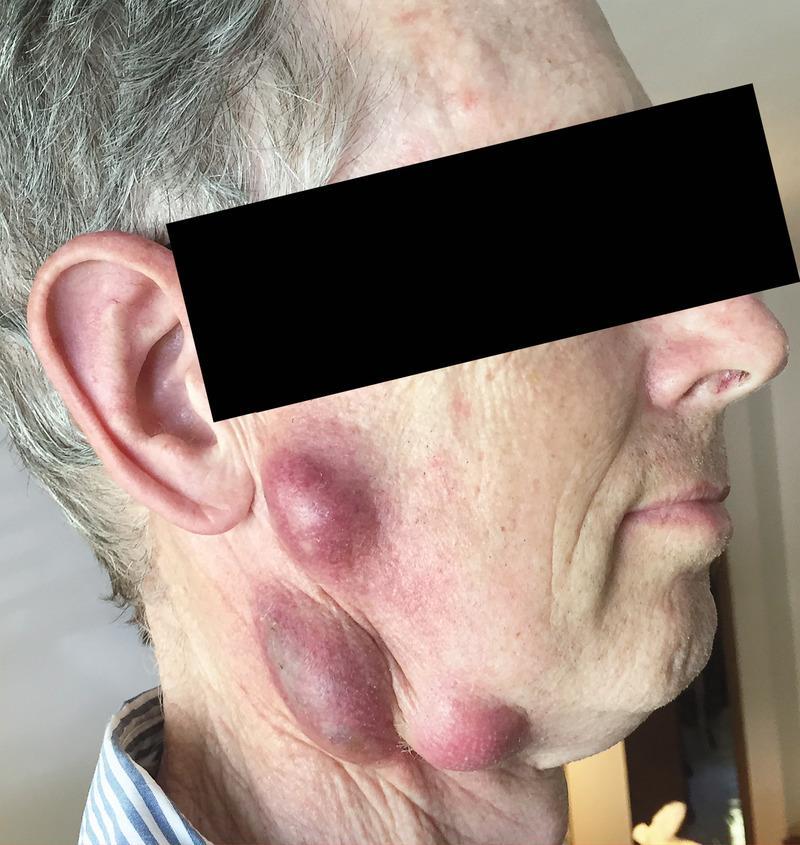
Развитие различных клинических форм заболевания связано с механизмом заражения и входными воротами инфекции, определяющими локализацию местного процесса. После проникновении возбудителя через кожу развивается бубонная форма в виде регионарного по отношению к воротам инфекции лимфаденита (бубона). Возможно изолированное или сочетанное поражение различных групп лимфатических узлов — подмышечных, паховых, бедренных.
Кроме того, при гематогенной диссеминации возбудителей могут формироваться вторичные бубоны. Возникают болезненность, а затем увеличение лимфатических узлов до размеров лесного ореха или мелкого куриного яйца. При этом болевые реакции постепенно уменьшаются и исчезают. Контуры бубона остаются отчётливыми, явления периаденита незначительны. В динамике заболевания бубоны медленно (иногда в течение нескольких месяцев) рассасываются, нагнаиваются с образованием свища и выделением сливкообразного гноя или склерозируются.
Формы заболевания
В зависимости от способа заражения и последующих симптомов заболевания, существуют различные клинические формы туляремии.
Осложнения
Осложнения в большинстве случаев развиваются при генерализованной форме. Наиболее часты вторичные туляремийные пневмонии. Возможен инфекционно-токсический шок. В редких случаях наблюдают менингит и менингоэнцефалит, миокардит, полиартрит и пр. осложнения.
Диагностика
У врача возникает подозрение на туляремию у пациентов, у которых внезапно возникает жар, опухают лимфатические узлы и появляются характерные язвы после контакта с клещами, оленьими мухами или даже малейшего контакта с дикими млекопитающими (особенно кроликами).
Врач берет на анализ образец инфицированного материала, например, кровь, жидкости из лимфатических узлов, гной из язв или мокроту. Они направляются в лабораторию для бактериологического исследования (посев на флору) и идентификации возбудителя, если таковой присутствует. Также выполняется анализ крови на антитела к бактериям.
Врачи могут использовать метод полимеразной цепной реакции(ПЦР) для увеличения количества ДНК бактерии для их скорейшего распознавания.
Лечение туляремии
Больных туляремией не требуется изолировать.
Обычно лечение туляремии включает внутримышечные инъекции стрептомицина в течение 7–10 дней. Альтернативными вариантами антибиотиков могут быть:
- гентамицин;
- хлорамфеникол;
- ципрофлоксацин;
- доксициклин.
В редких случаях большие абсцессы могут требовать хирургического дренирования.
Прикладывание теплого компресса к воспаленному глазу, ношение темных очков и применение рецептурных глазных капель может помочь справиться с симптомами.
Сильные головные боли обычно купируют болеутоляющими средствами.
Прогноз
При надлежащем лечении выздоравливают практически все заболевшие. При отсутствии лечения показатели смертности варьируются от 6% у людей с язвенно-железистой туляремией до 33% у заболевших тифоидной, легочной или септической формами. Смерть обычно наступает из-за тяжелой инфекции, пневмонии, менингита или перитонита.
Рецидивы случаются редко, но все же случаются в случае ненадлежащего лечения. Люди, болевшие туляремией, обладают иммунитетом против повторного заражения.
Профилактика туляремии
Эпизоотолого-эпидемиологический надзор.
Включает постоянное отслеживание заболеваемости людей и животных в природных очагах туляремии, циркуляции возбудителя среди животных и кровососущих членистоногих, контроль за состоянием иммунитета у людей. Его результаты составляют основу для планирования и осуществления комплекса профилактических и противоэпидемических мероприятий.
Эпидемиологический надзор предусматривает эпизоотологическое и эпидемиологическое обследование природных очагов туляремии, обобщение и анализ полученных при этом данных, обусловливающих эпидемические проявления в природных очагах туляремии в виде спорадической, групповой и вспышечной заболеваемости людей.
Профилактические мероприятия.
Основу профилактики туляремии составляют мероприятия по обезвреживанию источников возбудителя инфекции, нейтрализации факторов передачи и переносчиков возбудителя, а также вакцинация угрожаемых контингентов населения. Устранение условий заражения людей (общие санитарные и гигиенические мероприятия, включая санитарно-просветительную работу) имеет свои особенности при различных типах заболеваемости.
При трансмиссивных заражениях через кровососущих применяют репелленты, защитную одежду, ограничивают доступ непривитого населения на неблагополучные территории.
Большое значение имеет борьба с грызунами и членистоногими (дератизационные и дезинсекционные мероприятия).
Для профилактики алиментарного заражения следует избегать купания в открытых водоёмах, а для хозяйственно-питьевых целей еледует применять только кипячёную воду. На охоте необходимо дезинфицировать руки после снятия шкурок и потрошения зайцев, ондатр, кротов и водяных крыс.
Вакцинацию проводят в плановом порядке (среди населения, проживающего в природных очагах туляремии, и контингентов, подвергающихся риску заражения) и по эпидемиологическим показаниям (внеплановая) при ухудшении эпидемиологической и эпизоотологической ситуации и возникновении угрозы заражения определённых групп населения. Для иммунопрофилактики применяют живую аттенуированную вакцину. Вакцинация обеспечивает формирование стойкого и длительного иммунитета у привитых (5-7 лет и более). Ревакцинацию проводят через 5 лет контингентам, подлежащим плановой вакцинации.
Мероприятия в эпидемическом очаге.
Каждый случай заболевания человека туляремией требует подробного эпизо-отолого-эпидемиологического обследования очага с выяснением пути заражения. Вопрос о госпитализации больного туляремией, сроках выписки из стационара решает лечащий врач сугубо индивидуально. Больных с абдоминальной, лёгочной, глазо-бубонной и ангинозно-бубонной, а также средней тяжести или тяжело протекающие случаи язвенно-бубонной и бубонной форм необходимо госпитализировать по клиническим показаниям.
Больных выписывают из стационара после клинического выздоровления. Длительно не рассасывающиеся и склерозированные бубоны не являются противопоказанием для выписки. Диспансерное наблюдение за переболевшим осуществляют в течение 6-12 мес при наличии остаточных явлений. Разобщение других лиц в очаге не проводят.
В качестве меры экстренной профилактики можно провести антибиотикопрофилактику назначением рифампицина по 0,3 г 2 раза в сутки, доксициклина по 0,2 г 1 раз в сутки, тетрациклина по 0,5 г 3 раза в сутки. В жилище больного проводят дезинфекцию. Обеззараживанию подлежат только вещи, загрязнённые выделениями больных.
Читайте также:


