Как осуществляется микробиологическая диагностика газовой гангрены
Глава 35. Возбудители газовой гангрены
Газовая гангрена - это полимикробная инфекция, т. е. вызывается группой микроорганизмов. Они относятся к семейству Bacillaceae, роду Clostridium.
Основные представители: C. perfringens, C. novyi, C. septicum, C. histolyticum, C. sordellii. Обычно заболевание возникает в результате попадания в рану одного или нескольких представителей рода Clostridium и часто в сочетании с аэробами - стафилококками и стрептококками.
C. perfringens открыт в 1892 г. Уэлчем и Неттолмом.
Морфология. C. perfringens - крупные полиморфные палочки в среднем 3-9 × 0,9-1,2 мкм. Неподвижны. Свежевыделенные из организма культуры имеют капсулу. При попадании в неблагоприятные условия образуют споры овальной формы, располагающиеся центрально или субтерминально. Грамположительны. Старые культуры утрачивают способность окрашиваться по Граму.
Культивирование. C. perfringens - анаэробы, но не очень чувствительны к кислороду воздуха. Они хорошо и быстро растут на питательных средах, приготовленных из гидролизатов мяса или казеина: 3-8 ч при температуре 37-42° С и рН среды 7,2-7,4. Рост сопровождается бурным газообразованием и снижением рН в кислую сторону. На плотных питательных средах C. perfringens образуют шероховатые R, гладкие S и слизистые М колонии. В некоторых условиях появляются колонии смешанного О-варианта. В глубине агара столбиком колонии имеют вид чечевичных зерен. В жидких средах рост характеризуется равномерным помутнением и газообразованием. На кровяных средах C. perfringens образуют зону гемолиза.
Ферментативные свойства - C. perfringens сбраживают лактозу, глюкозу, сахарозу, мальтозу с образованием кислоты и газа. Протеолитические свойства - свертывают молоко, медленно (2-7 дней) разжижают желатин. Свертывают лакмусовое молоко с образованием сгустка кирпичного цвета и полного просветления молочной сыворотки. Восстанавливают нитраты в нитриты, индол не образуют.
C. perfringens продуцируют лецитиназу, гиалуронидазу, желатиназу, коллагеназу и другие ферменты патогенности.
Токсинообразование. C. perfringens выделяют сложный токсический комплекс, состоящий из нескольких токсинов, которые обозначаются греческими буквами α, θ, β и др. Кроме того, они образуют энтеротоксин. Основным токсическим комплексом является α-токсин, обладающий большой и всесторонней биологической активностью.
Антигенная структура. C. perfringens разделяют на пять сероваров, которые обозначаются большими латинскими буквами А, В, С, D и Е. Эти серовары отличаются друг от друга по антигенным и биохимическим свойствам своих токсинов.
Серовар А является обитателем кишечника в естественных условиях, но может вызвать пищевые токсикоинфекции у людей. Серовар В вызывает кишечные явления у ягнят. Серовар С вызывает некротический энтерит у людей и заболевания у крупного рогатого скота. Серовар D вызывает энтеротоксемию у животных.
Устойчивость к факторам окружающей среды. Вегетативные формы C. perfringens не очень устойчивы: на них губительно действуют дезинфицирующие вещества в обычных, применяемых в лабораториях концентрациях.
Споры некоторых штаммов выдерживают кипячение в течение нескольких минут. Наиболее устойчивы микробы серовара А.
Восприимчивость животных. В естественных условиях C. perfringens вызывают заболевания у домашних животных. Из экспериментальных животных к ним чувствительны морские свинки, кролики, голуби, мыши. У зараженных животных на месте введения токсина возникает некроз ткани. В крови могут находиться клостридии.
C. novyi обнаружен Нови в 1884 г.
Морфология. C. novyi - крупные, прямые или слегка изогнутые палочки 4-22 × 1,4-1,6 мкм. Часто располагаются цепочками. Подвижны - перитрихи. Во внешней среде образуют овальные споры, располагающиеся субтерминально (ширина спор может быть несколько шире клетки). Капсул не имеют. Грамположительны. Старые культуры могут быть грамотрицательными.
Культивирование. C. novyi - строгие анаэробы. Высокочувствительны к кислороду воздуха. Растут на казеиновых, углеводных и мясопептонных средах при температуре 37-43° С и рН среды 7,4-7,6. На плотных питательных средах через 48 ч вырастают круглые, полупрозрачные колонии с зернистой поверхностью и бахромчатыми краями. В агаровом столбике они образуют хлопьевидные, в виде комка колонии с компактным центром. На жидких питательных средах растут с накоплением газа и выпадением пленок в осадок. На кровяном агаре вокруг колоний наблюдается зона гемолиза.
Ферментативные свойства. C. novyi менее активны, чем C. perfringens. Они сбраживают только глюкозу и мальтозу с образованием кислоты и газа. Протеолитические свойства: молоко медленно свертывают, желатин медленно разжижают. Индол и сероводород не образуют.
Из ферментов патогенности обнаружена фосфолипаза.
Антигенная структура. C. novyi подразделяют на четыре серовара: А, В, С, D, различающихся по антигенным свойствам и синтезируемых ими токсинам.
Токсинообразование. C. novyi синтезируют несколько токсинов, обозначаемых греческими буквами α, β, γ и др.
Экзотоксины обладают некротическим, гемолитическим и летальным действиями. Кроме того, они нарушают проницаемость стенок кровеносных сосудов, что приводит к образованию желеобразного отека.
Устойчивость к факторам окружающей среды. Вегетативные формы C. novyi малоустойчивы. Споры сохраняются во внешней среде в течение многих (25-30) лет. Кипячение убивает их через 40-60 мин, прямые солнечные лучи - через сутки. Обычные концентрации дезинфицирующих растворов губят их через 15-20 мин.
Восприимчивость животных. К C. novyi чувствительны млекопитающие и птицы (голуби). Из экспериментальных животных: морские свинки, кролики, мыши. При подкожном введении культуры C. novyi у них возникает студенистый желеобразный отек, иногда с газообразованием. Животное погибает через 24 ч.
Clostridium septicum обнаружены Л. Пастером в 1877 г.
Морфология. С. septicum - полиморфная палочка величиной 3-4 × 1,1-1,6 мкм (встречаются нитевидные формы до 50 мкм в длину). Палочки подвижны - перитрихи. Споры располагаются субтерминально, иногда центрально. Капсулу не образуют. Грамположительны. Старые культуры могут окрашиваться грамотрицательно.
Культивирование. C. septicum - строгие анаэробы. Хорошо растут на мясных и казеиновых средах с добавлением 0,5% глюкозы при температуре 37-43° С и рН среды 7,4-7,6. На глюкозокровяном агаре образуют колонии в виде переплетающихся нитей, вокруг которых имеется небольшая зона гемолиза. В глубине столбика сахарного агара - колонии с уплотненным центром и отходящими от краев нитями. В МПБ образуют равномерное помутнение с последующим выпадением рыхлого осадка и газообразования.
Ферментативные свойства. C. septicum обладают сахаролитическими свойствами: расщепляют глюкозу, лактозу, мальтозу с образованием кислоты и газа. Не ферментируют маннит и глицерин. Протеолитические свойства: разжижают желатин, молоко свертывают медленно. Переводят нитраты в нитриты, расщепляют белки с выделением сероводорода и аммиака. Не образуют индол (см. табл. 51).
Антигенная структура. C. septicum имеют О- и Н-антигены. По Н-антигенам при помощи реакции агглютинации у них установлено 6 сероваров.
Токсинообразование. Экзотоксин C. septicum состоит из нескольких субстанций: β, θ, γ и др. Основная субстанция - α-токсин обладает летальным, некротическим и гемолитическим свойством. Кроме того, в фильтратах культур C. septicum обнаружен фибринолизин и коллагеназа. Все эти факторы играют большую роль в патогенезе.
Устойчивость к факторам окружающей среды. Вегетативные формы быстро погибают в присутствии кислорода воздуха. Споры менее устойчивы, чем споры других клостридий.
Восприимчивость животных. В естественных условиях болеют домашние животные: крупный и мелкий рогатый скот.
Из экспериментальных животных болеют морские свинки. После внутримышечного введения в лапку культуры C. septicum на месте инъекции развивается интенсивный отек, который распространяется по всей передней стенке живота и животное через 24-48 ч погибает. Из пораженной ткани при надавливании выделяется кровянисто-пенистая жидкость.
C. histolyticum выделен Вейнбергом в 1916 г.
Морфология. Небольшие палочки 1,6-3,1 × 0,6-1 мкм. Подвижны - перитрихи. Образуют споры, расположенные субтерминально. Грамположительны.
Культивирование. С. histolyticum - факультативные анаэробы. Растут на мясных и казеиновых средах. На кровяном агаре они образуют небольшие блестящие колонии с ровными краями. Вокруг колоний небольшая зона гемолиза.
Ферментативные свойства. C. histolyticum не обладают сахаролитическими свойствами. Протеолитические свойства выражены: разжижают желатин, лизируют кусочки мяса, помещенные в жидкую питательную среду, при этом образуется сероводород (см. табл. 51).
Токсинообразование. В фильтратах C. histolyticum обнаруживают α-токсин, обладающий летальным и некротическим свойствами. Кроме того, в фильтратах обнаружен β-фактор, разрушающий коллаген (коллагеназа). Этот токсин избирательно действует на клетки поджелудочной железы. Значение C. histolyticum в патологии человека окончательно не выяснено.
C. sordellii впервые выделены и изучены Сорделли в 1922 г.
Морфология. C. sordellii - палочки 3-4 × 1,1-1,5 мкм. Подвижны - перитрихи. Споры - овальные, располагаются субтерминально или овально. Грамположительны.
Культивирование. C. sordellii - факультативные анаэробы. На поверхности плотных питательных сред образуют серовато-белые, несколько выпуклые колонии. На кровяном агаре дают узкую зону гемолиза. В глубине агара колонии имеют форму чечевиц. В жидких мясных и казеиновых питательных средах быстро растут, образуя слизь.
Ферментативные свойства. C. sordellii обладают сахаролитическими свойствами: расщепляют глюкозу, мальтозу, фруктозу, не расщепляют лактозу и сахарозу. Протеолитические свойства выражаются в медленном разжижении желатина и свернутой сыворотки, они образуют индол, сероводород и уреазу (см. табл. 51).
C. sordellii образуют лецитиназу, гиалуронидазу, гемолизин, фибринолизин.
Токсинообразование. C. sordellii выделяют высокоактивный токсин, обладающий летальными свойствами, похожими по действию на α-токсин C. novyi.
Устойчивость к факторам окружающей среды. Вегетативные формы не обладают устойчивостью. Споры устойчивы и длительно сохраняются в почве.
Восприимчивость животных. У экспериментальных животных C. sordellii вызывает заболевание, похожее на газовую гангрену.
Источники инфекции. * В окружающую среду клостридии газовой гангрены попадают из кишечника животных, чаще травоядных (при плохих санитарно-гигиенических условиях их можно обнаружить на коже человека).
* ( Нижеизложенный материал относится ко всем рассмотренным представителям рода Clostridium.)
Пути передачи и входные ворота. При повреждении тканей, особенно при обширных рваных ранах, и попадании в рану комков земли, обрывков одежды, осколков снарядов может развиться заболевание. В мирное время газовая гангрена может возникнуть после операции, инъекций лекарств, внебольничных абортов и т. д.
Патогенез. Попавшие в рану споры или вегетативные формы клеток размножаются и выделяют экзотоксин. В процессе размножения клостридии некротизируют здоровую ткань. Особенно интенсивно процесс развивается в мышечной ткани, так как там находится большое количество гликогена, который является хорошей средой для развития анаэробов. Наиболее часто инфекция возникает при глубоких ранах, когда образуются "слепые карманы", которые плохо снабжаются кислородом и создаются благоприятные условия для развития клостридии. Выделяющиеся экзотоксины вызывают явления интоксикации.
Клостридии часто бывают в ассоциации: совместное действие токсинов C. perfringens и C. novyi вызывает более тяжелую реакцию, чем действие раздельных токсинов. В патогенезе анаэробной инфекции большое значение имеет сопутствующая флора (стафилококки, стрептококки и др.), а также реактивность макроорганизма.
Иммунитет. Антитоксический и антибактериальный, однако ведущая роль принадлежит антитоксину. У человека имеется естественный иммунитет, который возникает в результате наличия в кишечнике клостридии. После перенесенного заболевания остается непрочный иммунитет. Более стойкий иммунитет создается при иммунизации анатоксином.
Профилактика осуществляется хирургической обработкой раны (иссечение, разрезы). Для специфической профилактики используют адсорбированный полианатоксин, содержащий анатоксины всех представителей газовой гангрены. Для серопрофилактики при ранениях (чаще в военное время) вводят противогангренозную сыворотку: по 10000 ME C. perfringens, C. novyi, C. septicum, т. е. всего 30000 ME. Используют также смесь анаэробных фагов.
Лечение. Для специфического лечения применяют антитоксическую сыворотку по 50000 ME каждого из клостридии, т. е. всего 150000 ME. Сыворотку вводят внутривенно. Используют также антибиотики: пенициллин и сульфамидные препараты и оксигенотерапию.
Цель исследования: выявление анаэробных возбудителей, их токсина.
Раневую анаэробную инфекцию у человека вызывают как спорообразующие анаэробные бактерии (Clostridium perfringens, Clostridium novy, Clostridium oedematiens, Clostridium septicum, Clostridium sordelli, Clostridium histolyticum), так и неспорообразующие анаэробные микроорганизмы родов Bacteroides, Peptococcus, Peptostreptococcus, Veilonella и др.
Методы микробиологических исследований при анаэробной инфекции представлены в схеме 3.
Бактериоскопический метод. Проводится микроскопия окрашенных по Граму, Цилю-Нильсену и Гинсу-Бурри мазков, приготовленных из раневого отделяемого, отечной жидкости, некротизированной ткани. Обнаружение в препаратах крупных прямых грамположительных палочек, образующих капсулы и центрально или субтерминально расположенные споры (рис. 3), дает основание поставить предварительный диагноз газовой гангрены. Для экспресс-диагностики применяют прямой метод иммунофлюоресценции.
Бактериологический метод.Производят посев исследуемого материалана среды Цейсслера (анаэробный кровяной МПА), Китт-Тароцци, железо-сульфитный агар (ЖСА) и молоко. В молоке через 3-4 часа образуется губкообразный сгусток, погруженный в прозрачную жидкость. На среде Китт-Тароцци через сутки регистрируется помутнение и образование газа, на ЖCA - черные колонии в глубине агарового столбика, на среде Цейсслера – шероховатые (реже – гладкие), крупные, плоские сероватые колонии с зоной гемолиза. В глубине плотных питательных сред образуются колонии в виде чечевичек, дисков, комочков ваты и т.д. В мазках из колоний обнаруживают крупные грамположительные палочки (рис. 5). Для выделения чистой культуры возбудителей газовой гангрены типичные колонии пересевают на среду Китт-Тароцци и идентифицируют до вида в соответствии с таблицами 4 и 5.
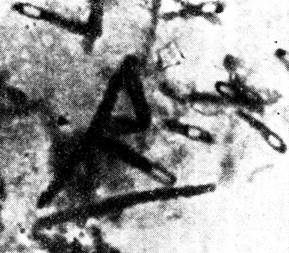 | 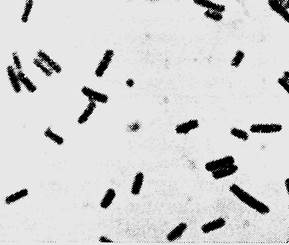 |
| Рис. 4. Возбудитель газовой гангрены (Clostridium perfringens) в материале от больного. Окраскапо Граму. х 900 | Рис. 5. Возбудитель газовой гангрены. Чистая суточная культура Clostridium perfringens. Окраскапо Граму. х 900 |
Таблица 4. Биологические свойства неспорообразующих и спорообразующих анаэробов
| Свойства | Бактерии | ||||||||
| Peptococcus | Peptostreptococcus | Veilonella | Bacteroides | C.perfringens | C.novy | C.septicum | C.sordelli | C.histolyticum | |
| Морфология | кокки | кокки | кокки | палочки | палочки | палочки | палочки | палочки | палочки |
| Подвижность | - | - | - | ± | - | + | + | + | + |
| Споры | - | - | - | - | + | + | + | + | + |
| Окраска по Граму | + | + | - | - | + | + | + | + | + |
| Ферментация углеводов | + | + | - | + | + | + | + | + | - |
| Свертывание молока | - | - | + | + | + | v | - | + | + |
| Продукция H2S | + | - | + | ± | - | - | - | v | v |
| Продукция индола | - | - | - | ± | - | - | - | - | - |
| Разжижение желатины | - | - | - | ± | + | + | + | + | + |
| Редукция нитратов | ± | - | + | ± | ± | ± | ± | - | - |
| Гемолиз эритроцитов | - | - | ± | + | + | + | + | + | |
| Образование токсина | - | - | - | - | + | + | + | + | + |
Обозначения:(+) - постоянный признак, (±) - непостоянный признак, (-) – отсутствие признака, V- вариабельный признак
Таблица 5.Биологические свойства основных возбудителей газовой гангрены и столбняка
| Виды клостридий | Капсула | Подвижность | Лецитиназа | Индол | Ферментация | ||
| лактозы | сахарозы | маннита | |||||
| Clostridium perfringens | + | - | + | - | + | + | + |
| Clostridium Novy | - | + | + | - | - | - | - |
| Clostridium septicum | - | + | _ | - | + | - | - |
| Clostridium Tetani | - | + | _ | + | - | - | - |
Обозначения:(+) - постоянный признак, (-) – отсутствие признака,
Определение лецитиназной активности. Положительная реакция на лецитиназу проявляется в виде помутнения взвеси лецитина. При отрицательной реакции, которая наблюдается при нейтрализации фермента соответствующей антисывороткой, жидкость остается прозрачной.
Окончательную идентификацию выделенных клостридий газовой гангрены проводят с помощью биопробы (см. ниже) путем постановки реакции нейтрализации с поливалентными и моновалентными сыворотками для выявления и типирования экзотоксинов клостридий.
Биопроба. Смесь исследуемого материала с моновалентными антитоксическими сыворотками против различных видов клостридий вводят подкожно морским свинкам. Контролем служит морская свинка, которой вводят исследуемый материал без сывороток. При наличии токсина контрольная морская свинка погибает через 30 минут – 4 часа после инъекции материала. В опытах нейтрализации токсина антитоксическими сыворотками выживает одна морская свинка, при этом вид сыворотки соответствует виду токсина.
Исследование проб на наличие патогенных клостридий.
| Посев на среды: | Посев по 1 мл в жидкие питательные среды - мясные или казеиновые (5 пробирок): 1-я пробирка - непрогретая, 2-я - прогрев при 80° - 15 минут, 3-я - прогрев при 100º - 5 минут, 4-я - прогрев при 100º - 10 минут, 5-я - прогрев при 100º - 20 минут. Инкубация при 37º 1-15 суток. | |
| в чашках | в пробирке | |
| Кровяной МПА | Среда Виллиса-Хоббс | Среда Вильсон-Блера |
| Анаэробные условия | ||
| Инкубация при 37ºС 1-7 суток | ||
| Микроскопия, изоляция и пересев на мясную или казеиновую среду колоний, вызывающих гемолиз, опалесценцию или почернение на одной из указанных выше сред и состоящих из грамположительных палочек. | Выросшие культуры, содержащие массу грамположительных палочек, подвергают дальнейшему изучению. | |
| Изучение свойств выделенных культур. | Проверка токсичности фильтратов или центрифугатов на мышах или морских свинках. | Посев на плотные питательные среды: чашки с кровяным МПА, со средой Виллиса-Хоббс, с бензидиновым МПА, столбик агара Вильсон-Блера. |
| Реакция нейтрализации с сыворотками: C.perfringens типа А, С. novyiтипа А, В, C. septicum, C. sordellii, C.histolyticum. | Инкубация при 37° 1-4 суток. Изоляция колоний, вызывающих гемолиз, опалесценцию или почернение на питательных средах. Изучение свойств выделенных культур. |
Для обнаружения токсина и его типа в реакции нейтрализации.
Для обнаружения токсина двум мышам вводят исследуемый фильтрат в количестве 0,5 мл внутрибрюшинно, другим двум мышам вводят смесь, состоящую из 0,5 мл фильтрата и 0,2 мл смеси диагностических моновалентных противоботулинических сывороток типа А,В,С,Е (соединяют по 0,5 мл сыворотки каждого типа). Перед введением смесь испытуемого материала и сывороток выдерживают при комнатной температуре в течение 30 минут. Наблюдение за животными ведут в течение 4 дней. При наличии токсина погибают первые две мыши, остальные остаются живы.
Рисунок 3. Ускоренный метод обнаружения C.perfringens.
Одна пробирка каждой среды после внесения материала прогревается при 80°С 20 минут.
Почернение среды Вильсон-Блера в течение 3-х часов и бурное створаживание молока в течение 6 часов характерны для C.perfringens.
При обнаружении токсина ставят развернутую реакцию нейтрализации для определения типа токсина. Для этого в 5 пробирок разливают по 2,4 мл испытуемого фильтрата и в каждую пробирку прибавляют по 0,6 мл сыворотки раздельно типа А, типа B, типа С и типа Е. В 5-ю пробирку прибавляют 0,6 мл физиологического раствора. Смесь после 30 минут выдерживания при комнатной температуре вводят внутрибрюшинно по 1 мл 2 мышам из каждой пробирки отдельными шприцами. Наблюдают за животными в течение 4 дней. При наличии токсина выживают мыши, получившие смесь токсина и гомологичной сыворотки, остальные мыши гибнут. Тип сыворотки, нейтрализующей токсин, указывает на типовую принадлежность токсина.
В. Ускоренные методы диагностики ботулизма:
а) обнаружение токсина с помощью РПГА (на эритроцитах адсорбируют антитоксин)
б) обнаружение токсина с помощью реакции угнетения фагоцитоза. Ботулинический токсин резко угнетает фагоцитарную способность лейкоцитов в связи с наличием у токсина лейкотоксических свойств. При этом фагоцитарный показатель уменьшается в 3,5, 10 и даже 20 раз. При добавлении к крови, содержащей токсин, гомологичной антитоксической сыворотки фагоцитарная способность лейкоцитов восстанавливается.
Контрольные вопросы.
Каковы основные биологические свойства анаэробных бактерий?
Какова роль анаэробных бактерий в патологии человека?
Какие заболевания вызывают анаэробные бактерии?
Каков механизм заражения при газовой гангрене?
Что является средой обитания анаэробных бактерий в естественных условиях?
Какие возбудители чаще всего вызывают газовую гангрену?
Какие токсины образуют возбудители газовой гангрены и на что они действуют?
Каковы особенности патогенеза газовой гангрены?
Какие условия способствуют развитию газовой гангрены?
По каким основным признакам различаются между собой c.perfringens, C.novyi, C.septicum, C.histolyticum?
Какие ускоренные методы применяются для обнаружения c.perfringens?
Какие микробиологические методы используются для диагностики анаэробных инфекций?
Каковы основные морфологические, культуральные и биохимические особенности возбудителя столбняка?
Какова природа токсина столбнячной палочки и на что он действует?
Чем отличается картина столбняка у человека и у мелких лабораторных животных?
Что является средой обитания для столбнячной палочки?
Чем объясняется высокая обсемененность почвы столбнячной палочкой в Краснодарском крае?
Каковы основные морфологические и биологические свойства возбудителя ботулизма?
Какова природа токсина палочки ботулизма? Какие типы токсина продуцирует возбудитель и что поражает токсин?
Какие условия способствуют размножению возбудителя ботулизма и накоплению токсина в пищевом продукте?
Какой материал берется для исследования при подозрении на ботулизм?
Какие методы применяются для обнаружения токсина возбудителя ботулизма и определения его типа?
Какие продукты чаще всего являются причиной отравления при ботулизме?
Как осуществляется специфическая профилактика и лечение ботулизма? Какие препараты применяются для этой цели?
Что представляет собой прототоксин?
Какова природа и структура столбнячного токсина?
Как активируется столбнячный токсин?
Что поражает столбнячный токсин?
Каковы функции тяжелой и легкой цепей столбнячного токсина?
Как продвигается столбнячный токсин к ядрам двигательных нервов?
Каков защитный уровень антитоксина против столбнячного токсина?
Как осуществляется специфическое лечение и специфическая профилактика столбняка?
Как обеспечивается формирование коллективного иммунитета против столбняка и какие препараты применяют для этой цели?
Что такое прогенитарные токсические комплексы, образуемые палочкой ботулизма?
Какие структурные варианты прогенитарных токсических комплексов Вы знаете? Каков их состав?
Как происходит активация ботулинического токсина?
Какая разница между протеолитическими и непротеолитическими вариантами возбудителя ботулизма? Каким образом осуществляется у них активация токсина?
В чем заключается механизм активации ботулинического токсина?
Какие функции выполняют нетоксические белки в составе белковых комплексов?
Каковы физико-химические свойства токсина ботулизма? Какие токсины, кроме нейротоксина, образует возбудитель ботулизма?
Ботулизм - интоксикация или токсикоинфекция?
Что поражает ботулинический токсин?
Какой синдром чаще всего наблюдается у больных ботулизмов?
ЗАНЯТИЕ 12.
Тема: МИКРОБИОЛОГИЧЕСКИЙ ДИАГНОЗ АНАЭРОБНЫХ ИНФЕКЦИЙ
(окончание).
A. Микробиологический диагноз анаэробных инфекций.
Регистрация результатов посева материала, содержащего анаэробные микробы, макро- и микроскопия выросших культур.
Б. Микробиологический диагноз дифтерии.
1. Изучение морфологии и культуральных свойств дифтерийной палочки. Макро- и микроскопия культур бактерий.
2. Типы дифтерийных бактерий. Демонстрация роста культур соответствующих типов на теллуритовых средах и их биохимических свойств.
3. Биохимические свойства коринебактерий. Дифференциация истинных дифтерийных бактерий от псевдодифтерийных и дифтероидов по биохимическим свойствам. Демонстрация и разбор.
4. Правила взятия и пересылки материала от больного дифтерией для бактериологического исследования. Разбор.
5. Бактериологическая диагностика дифтерии. Исследование дифтеритической пленки (или материала от бактерионосителя). Посев на теллуритовые среды.
6. Определение токсигенности дифтерийных бактерий методом преципитации в агаре и биопробой на морской свинке. Разбор и демонстрация.
B. Ми-кробиологический диагноз коклюша.
Изучение морфологии и культуральных свойств коклюшной палочки.
Микробиологическая диагностика коклюша. Разбор схемы.
Г. Знакомство с иммунопрепаратами, применяемыми для профилактики и лечения дифтерии и коклюша.
А. Микробиологический диагноз анаэробных инфекций.
1. Зарегистрировать результаты посева материала, содержащего анаэробные микроорганизмы. Приготовить препарат-мазок, окрасить по Граму и зарисовать.
Б. Микробиологический диагноз дифтерии.
§1. Готовые фиксированные мазки из чистой культуры дифтерийной палочки окрасить синькой Леффлера и по Нейссеру. Дифтерийные бактерии окрашиваются неравномерно, более интенсивно окрашиваются зерна волютина. При окраске метиленовым синим .наблюдается явление метахромазии. По способу Нейссера зерна окрашиваются в темно-коричневый цвет. Дифтерийные палочки располагаются под углом друг к другу в виде римской цифры V. Препараты промикроскопировать и зарисовать.
Знакомство с характером роста возбудителя дифтерии на свернутой сыворотке, на таллуритовых средах.
§2. Демонстрация роста различных типов дифтерийной палочки на теллуритовой среде. Разбор биохимических свойств различных типов дифтерийной палочки по демонстрационным наборам.
§3. Знакомство с биохимическими свойствами дифтерийной палочки по биохимическим наборам. Демонстрация и разбор. Заполнить таблицу.
§ 4. Исследованию подвергаются слизь или пленка из зева, носа, носоглотки, миндалин. Реже исследуется материал с конъюнктивы глаза, со слизистой оболочки половых органов или с поверхности ран. Материал берут стерильным тампоном. Тампон погружают в стерильную пробирку с этикеткой, на которой указаны фамилия, имя, отчество, возраст больного и из какого места (полости) взят материал. Пробирки с материалом помещают в металлические пеналы и с нарочным отправляют в лабораторию для доследования. Разбор методики взятия материала из зева, носа и других мест и посева его при дифтерии.
§5. С помощью стерильного ватного тампона произвести друг у друга забор материала со слизистой зева или носа и сделать посев на сывороточную среду с теллуритом.
§6. Методика определения токсигенных свойств возбудителя дифтерии преципитацией в агаре заключается в следующем. Полоски фильтровальной бумаги размером 1,5x8 см, простерилизованные в автоклаве, смачивают антитоксической противодифтерийной сывороткой, разведенной стерильным физиологическим раствором до содержания 500 АЕ в 1 мл. Смоченную сывороткой бумажку стерильным пинцетом переносят на поверхность питательной среды в чашку Петри. Чашку подсушивают в термостате 15-20 минут. Испытуемые культуры засевают бляшками по обе стороны от фильтровальной бумажки. На одну чашку засевают несколько штаммов, один из которых заведомо токсигенный и служит контролем. Чашки с посевом помещают в термостат при температуре 37°С. Результат учитывают в течение 48 часов. В месте взаимодействия антитоксина с токсином образуется линия преципитации. Если исследуемая культура образует токсин, то ее линия преципитации сливается с линией преципитации контрольного штамма, образуя сплошную белую полоску. При неспецифической преципитации линия, образуемая исследуемым штаммом, пересекает или имеет тенденцию к пересечению с линией контрольного штамма.
Демонстрация чашек с культурами токсигенной и нетоксигенной дифтерийной палочки. Зарисовать схему определения токсигенных свойств возбудителя дифтерии.
Определить токсигенные свойства дифтерийной палочки можно также методом биопробы. Для опыта берут двух морских свинок, накануне одной из них вводят 500-1000 АЕ антитоксической противодифтерийной сыворотки. Затем свинкам вводят подкожно (0,2 мл) или внутрикожно (0,1 мл) исследуемую культуру. Если испытуемая культура токсигенна, то при подкожном введении опытная свинка через 2-5 дней погибает. При вскрытии обнаруживается отек в месте введения культуры, экссудат в брюшной и грудной полостях и в перикарде. Особенно характерным симптомом является увеличение и гиперемия надпочечников. Контрольная свинка остается живой. При внутрикожном введении токсигенной культуры у опытной свинки в месте инъекции наблюдается покраснение, отечность, а в дальнейшем - некроз. У контрольной морской свинки никаких изменений не отмечается.
В. Микробиологический диагноз коклюша.
§1. Промикроскопировать готовые препараты-мазки из культуры коклюшной палочки с окраской по Граму и зарисовать.
Ознакомиться с ростом коклюшной и паракоклюшной палочек на средах Борде-Жангу, казеиново-угольной и средах "пестрого ряда". Демонстрация.
§2. Разбор методов микробиологической диагностики коклюша: бактериологического и серологического. Дифференциация коклюшной и паракоклюшной палочек.
Г. Знакомство с иммунопрепаратами: адсорбированный дифтерийный анатоксин, дифтерийный токсин для реакции Шика, противодифтерийная сыворотка, адсорбированный дифтерийно-столбнячный анатоксин, адсорбированная коклюшно-дифтерийно-столбнячная вакцина и др.
Читайте также:


