Кровяной агар для бактероидов
БАКТЕРОИДЫ (греческий bakterion палочка + eidos вид) облигатноанаэробные, не образующие спор, грамотрицательные бактерии палочковидной формы, относящиеся к роду Bacteroides семейства Bacteroidaceae. Бактероиды — одни из наиболее частых возбудителей неклостридиальных анаэробных и смешанных анаэробно-аэробных инфекций у человека.
Впервые грамотрицательные бесспоровые анаэробы были выделены Вейоном и Зюбером (A. Veillon, H. Zuber) в 1898 году у больного с абдоминальным абсцессом, о писаны как Bacillus fragilis; эти анаэробы вызывали абсцессы при экспериментальном заражении подопытных животных. В 1912 году Дистазо (A. Distaso) обнаружил подобные микробы в испражнениях здоровых людей. Кастеллани (A. Castellani) и Чалмерс (A. J. Chalmers) в 1919 году предложили для этих бактерий родовое название Bacteroides.
Семейство Bacteroidaceae состоит из трех родов; Bacteroides, насчитывающий 22 вида, Fusobacterium, объединяющий 16 видов, и Leptotri-chia, включающий 5 видов. В 1979 году Колли (J. G. Collee) предложил разделить род Bacteroides на три группы на основе их устойчивости к 20% желчи в питательной среде, пигментообразовании и сахаролитической активности в отношении глюкозы, мальтозы, сахарозы, маннита, рамнозы, трегаллозы (табл. 1).
Бактероиды — палочки с биполярной окрашиваемостью, размером 0,5—0,8 X 1 —3 мкм, морфологически сходные или с выраженным полиморфизмом, неподвижные или движущиеся с помощью перитрихиально расположенных жгутиков, нередко имеют полисахаридную капсулу, являющуюся важным фактором вирулентности (см.). Различные виды варьируют по своей чувствительности к окислительно-восстановительному потенциалу. Окисленные среды тормозят рост бактероидов. В пределах вида рост бактероидов зависит также от величины посевной дозы.
При росте на кровяном агаре бактероиды образуют округлые, слабо выпуклые, полупрозрачные сероватые или черно-коричневые колонии, часто имеющие внутри включения в форме концентрических колец, диаметр колоний 1—3 мм, менее 1% штаммов бактероидов вызывают гемолиз. При росте бактероидов на жидкой питательной среде происходит равномерное помутнение бульона и образование осадка. Основными компонентами питательных сред для культивирования бактероидов являются пептон, мясной экстракт, дрожжевой экстракт, глюкоза и кровь. Стимулируют рост бактероидов гемин, витамин Кх (менадион), для некоторых видов — бычья желчь. Рост бактероидов улучшается также, если в окружающей анаэробной атмосфере содержится углекислый газ (5—10%). Бактероиды растут в значительном диапазоне температур (от 25 до 45°), оптимум роста при t 37°. Оптимальное значение pH питательных сред 7,0.
При росте на глюкозопеитонном бульоне бактероиды продуцируют в качестве конечного продукта метаболизма смесь жирных кислот: большое количество янтарной и небольшое количество уксусной, пропионовой, изовалериановой, изомасляной и масляной. Бактероиды образуют протеолитические ферменты, некоторые виды продуцируют нейраминидазу, действующую как фактор распространения бактерий. Устойчивые к Р-лактамным антибиотикам бактероиды продуцируют Р-лак-тамазы, разрушающие пенициллины и цефалоспорины.
Антигенные свойства бактероидов изучены недостаточно. Общий родовой антиген для бактероидов не описан. Bacteroides fragilis — пока единственный вид бактероидов, для которого доказано наличие видоспецифического антигена; в диагностических целях используют капсульный полисахаридный антиген.
Бактероиды —одни из основных представителей нормальной микрофлоры человека (см.) и животных. В наибольшем количестве бактероиды содержатся в толстой кишке (около 30% всех микробов), значительно преобладая над аэробной микрофлорой, в том числе в сотни раз превышая количество кишечных палочек. Среднее количество бактероидов в 1 г фекалий взрослого здорового человека составляет св. 10 млрд. и зависит от физиологического состояния организма и диеты. У лиц, находящихся на смешанной диете, обнаруживается больше бактероидов, чем у людей, в диете которых преобладают углеводы. Более интенсивному размножению и метаболизму бактероидов способствует диета, богатая животными продуктами. При стрессовых состояниях содержание В. thetaiotaomicron в толстой кишке может быть повышено и составлять 20—30% всей микрофлоры (при норме 2—4%). Наиболее часто в микрофлоре фекалий здорового взрослого человека встречаются В. vulgatus (12%), В. thetaiota-omicron (до 4,5%), В. fragilis (0,5%). Из бактероидов, являющихся условно-патогенными микробами (см.), наиболее частым возбудителем анаэробных и смешанных анаэробно-аэробных инфекций является В. fragilis.
Физиологическое значение бактероидов во многом не ясно, однако известно, что они проявляют антагонистическую активность по отношению к шигеллам, сальмонеллам и некоторым эшерихиям.
Бактероиды проявляют патогенные свойства при изменении иммунитета. Они выступают в качестве инфекционных агентов при самых разнообразных заболеваниях гнойного и септического характера, могут поражать любые органы и ткани организма человека или животного, в очагах инфекции находятся в ассоциации с другими анаэробными и аэробными микробами. Бактероиды выделяют при гнойном перитоните, аппендиците, эндометрите, аднексите, кольпите, септическом аборте, абсцессе внутренних органов, плеврите, пневмонии, при поражениях костей и суставов, при пародонтозе и воспалительных заболеваниях ротовой полости, кожи, подкожной клетчатки. Бактероидный инфекционный процесс любой локализации может осложниться эндокардитом (см.) или сепсисом (см.).
Для эффективного лечения болезней, вызванных бактероидами, большое значение имеет микробиологическая диагностика. Успешное выделение бактероидов во многом зависит от правильного забора и доставки материала в лабораторию. Если есть возможность получить патологический материал с помощью пункции, его следует доставить в шприце, вытеснив из него воздух. Доставка материала на обычном тампоне малоэффективна. Тампоны лучше доставлять в транспортной среде либо забирать материал тампоном, имнрегнированным 10% раствором гемоглобина. Вместо гемоглобина можно использовать лизированную донорскую кровь (10% лизированной крови, 10% глицерина, 80% изотонического раствора хлорида натрия).
Посев материала производят на плотные и жидкие питательные среды. Плотные среды содержат лизированную кровь и при необходимости канамицин или неомицин — ингибиторы сопутствующей факультативно-анаэробной микрофлоры. Посевы инкубируют не менее 2 суток (из-за медленного роста бактероидов) в анаэробных условиях при t° 37°. Одновременно с посевом производят микроскопию окрашенного по Граму мазка из патологического материала.
Посевы просматривают с помощью лупы с 6—8-кратным увеличением или стереоскопического микроскопа (см.). Описывают морфологию каждого вида колоний, пересевают их на жидкую питательную среду и инкубируют в анаэробных условиях в течение 48—72 часов (для получения чистой культуры), а также пересевают на кровяной агар и инкубируют в аэробных условиях в течение 24—48 часов (для определения аэротолерантности). Из этих же колоний готовят мазки для окраски по Граму. Выросшие на кровяном агаре в аэробных условиях колонии расцениваются как факультативно анаэробные бактерии. Чистую культуру грамотрицательных анаэробных бактерий, полученную на жидкой питательной среде, исследуют на подвижность (с помощью фазовоконтрастного микроскопа) и на чувствительность к антимикробным препаратам.
До уровня семейства бактероиды можно идентифицировать на основании отрицательной окраски по Граму, отсутствия роста в аэробных условиях, отсутствия спорообразования, установления перитрихиально расположенных жгутиков, если бактерии подвижны. Способность к спорообразованию проверяют прогреванием пятисуточной культуры на жидкой питательной среде с крахмалом (1 г на 1 i среды) при t° 80° в течение 10 минут. Выжившие клетки свидетельствуют о их спорогенности. Тип жгутиков определяют соответствующим методом окраски (см. Леффлера методы).
До рода и вида бактероиды идентифицируют на основании определения продуктов метаболизма (состав жирных к-т Ci—Св, а также янтарной и молочной кислот) с помощью газожидкостной хроматографии (см.) и изучения ферментативной активности. В таблице 2 представлены данные Бартлетта (J. G. Bartlett) с сотр. (1975), позволяющие ориентировочно идентифицировать бактероиды группы В. fragilis.
Предпринимаются попытки ускоренной идентификации бактероидной группы
В. fragilis и В. melaninogenieus с помощью реакции иммунофлюоресценции (см.) в прямой и непрямой модификациях. Для обнаружения бактероидов непосредственно в патологическом материале необходимы соответствующие специфические диагностические сыворотки. Для подтверждения этиологической роли бактероидов при различных воспалительных заболеваниях (например, при поражениях тазовых органов у женщин) используют серологическую диагностику. При этом применяют радиоиммунологический метод (см.) и иммуно-ферментный метод выявления антител, а также определяют титры антител против В. fragilis в парных сыворотках.
Бактероиды наиболее чувствительны к метранидазолу, левомицетину, некоторым цефалоспоринам и др. Некоторые виды бактероидов, за исключением В. fragilis, могут быть чувствительны к пенициллину, но необходимо учитывать, что бактероиды могут продуцировать бета-лактамазы. Бактероиды устойчивы к стрептомицину, гентамицину, канамицину, мономицину. Для успешной антибактериальной терапии необходимо определение чувствительности выделенных бактерий к химиопрепаратам. При лечении инфекций, вызываемых бактероидами, также необходимо помнить, что эти инфекции носят смешанный характер: бактероиды чаще всего выделяются в ассоциации с другими микроорганизмами.
Специфическая профилактика бактероидных инфекций — вакцины и сыворотки — пока не разработана.
Таблица 1. КЛАССИФИКАЦИЯ НЕКОТОРЫХ ВИДОВ БАКТЕРОИДОВ ПО ГРУППАМ В ЗАВИСИМОСТИ ОТ ИХ ОТНОШЕНИЯ К САХАРАМ, УСТОЙЧИВОСТИ К ЖЕЛЧИ И ОБРАЗОВАНИЮ ПИГМЕНТА (по Колли, 1979)
Признаки, отличающие различные виды бактероидов
В. fragilis, В. thetaiotaomicron, В. ovatus, В. distasonis, В. vulgatus, В. splan-chnicus, В. eggerthii, В. hypermegas, В. multiacidus
Сахаролитические, не образуют пигмента, устойчивы к желчи
В. melaninogenicus subsp. melaninogenicus, subsp. intermedius, subsp. levii B. bivius, B. disiens, B. oralis, B. rumini-cola
Сахаролитические, образуют пигмент, чувствительны к желчи Сахаролитические, не образуют пигмента, чувствительны к желчи
B. asaccharolyticus, B. putredinis, B. praeacutus, B. pneumosint.es, B. corrodens*, B. nodosus
H e с а х а р о литические
* Новое название В. ureolyticus.
Таблица 2. ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ НЕКОТОРЫХ ВИДОВ БАКТЕРОИДОВ, НАИБОЛЕЕ ЧАСТО ВЫДЕЛЯЕМЫХ ИЗ ПАТОЛОГИЧЕСКОГО МАТЕРИАЛА (по Бартлетту, 1975)
| Название питательной среды | Аббревиатура или иное название среды | Назначение питательной среды |
| Сердечно-мозговая плотная среда | BHI-agar | Среда общего назначения. Должна быть обогащена гемином и витамином К. Обеспечивает рост облигатно- и факультативно анаэробных бактерий. |
| Бруцелла-агар с кровью | –– | То же |
| Анаэробный кровяной агар | CDC anaerobe agar | Среда общего назначения (см.выше). Особо выделяется, как оптимальная для грамположительных анаэробных бактерий. |
| Агар Шедлера с кровью | Schаedler¢s agar | Среда общего назначения, обогащенная (см.выше). Считается оптимальной для выделения требовательных анаэробных бактерий. |
| Канамицин-ванкомицин кровяной агар | LKV-agar KLVB-agar | Для изоляции и селекции бактероидов и обнаружения пигментообразующих грам-отрицательных палочек. Обогащена гемином, витамином К1 и лаковой кровью. |
| Фенилэтилалкоголь агар | РЕА | Селективная среда. Подавляет рост факультативно анаэробных грамотрицательных палочек |
| Бактероидный желчно-эскулиновый агар | BBE-agar | Для селективного выделения и предварительной идентификации бактерий группы B.fragilis |
| Яично-желточный агар (вар.яично-желточный агар с неомицином) | EYA (NEYA) | Селективная и диагностическая среда для клостридий, а также для других анаэробов (некоторые виды превотелл и фузобактерий), образующих липазу и лецитиназу. |
| Бруцелла агар с цефокситином, циклоспорином и фруктозой | CCFA | Селективная и диагностическая среда для Clostridium difficile |
| Тиогликолевая среда, обогащенная | THIO medium | Среда с малым количеством агара, обогащенная гемином, витамином К, а также сывороткой крови (по показаниям). Для многих видов анаэробных бактерий. |
В зарубежной практике для выделения и культивирования неспорообразующих облигатно анаэробных бактерий в качестве базовых питательны сред часто называют агар Шедлера (Schaеdler agar), среду для бруцелл, обогащенную кровью, витамином К и гемином (ее пропись приведена в разделе питательных сред для определения чувствительности микроорганизмов к антибиотикам), анаэробный кровяной агар (СDС anaerobic agar).
Агар Шедлера включает (на литр)
Казеиновый пептон 5,7 г
Соевый пептон 1,0 г
Мясной пептон 2,5 г
Дрожжевой экстракт 3,0 г
Натрия хлорид 5,7 г
Дикалия гидрофосфат 0,8 г
Витамин К1 0,01 г
Баранья кровь 50,0 мл
Кровь добавляют стерильно в приготовленную, расплавленную и охлажденную до 45 о С среду перед разлитием в чашки Петри. Среда имеет несколько не отличающихся принципиально прописей, что не меняет ее назначения.
Для выделения и первичной идентификации B.fragilis и других представителей близкой к ней группы бактероидов нашла применение агаризованная желчно-эскулиновая среда (ВВЕ-agar) следующего состава (на литр).
Панкреатический перевар казеина 15,0 г
Перевар соевой муки 5,0 г
Желчь сухая 20,0 г
Натрия хлорид 5,0 г
Цитрат аммонийный железа 0,5 г
Витамин К1 0,01 г
Гентамицин 0,1 г
Гемин, витамин К1 и гентамицин вводят в готовую и охлажденную до 45 – 50 о С среду. Желчь выполняет селекционирующую функцию (B.fragilis дает рост на средах с желчными солями). Гидролиз эскулина (с образованием эскулетина) в сочетании с солью железа придает черно-коричневую окраску среде вокруг колоний. Сами колонии B.fragilis и представителей ее группы округлые, имеют серую окраску и достигают диаметра 1 мм или более.
Имеется несколько других прописей, декларируемых как среды для бактероидов, которые, однако, не имеют в своем составе селективных или диагностических компонентов, а представляют собой обогащенные варианты сред обязательно с гемином и витамином К1.
В качестве среды, обеспечивающей рост широкого круга анаэробных бактерий, включая бактероиды, и, в то же время, обладающей селективными свойствами, предложена среда, содержащая фенилэтиловый спирт в качестве селекционирующего агента. Последний подавляет рост факультативно анаэробных микроорганизмов, в т.ч. энтеробактерий. Среда известна как фенилэтилалкоголь агар или РЕА-аgar. Ее состав на литр.
Перевар соевой муки (папаиновый) 23,0 г
Дрожжевой экстракт 2,0 г
Натрия хлорид 5,0 г
Гемин (1% раствор) 10,0 мл
Витамин К1 (1% раствор) 1,0 мл
Фенилэтиловый спирт 2,7 мл
Кровь баранья 50,0 мл
Два последних компонента добавляют в готовую, расплавленную и охлажденную до 45 – 50 о С среду непосредственно перед приготовлением чашек.
Для выделения фузобактерий предложена селективная среда с антибиотиками, FAA-среда (в некоторых работах она помечена как среда для требовательных анаэробов). Ее состав на литр
Натрия хлорид 5,0 г
Натрия пируват 1,0 г
Крахмал растворимый 1,0 г
L-цистина гидрохлорид 0,5 г
Натрия сукцинат 0,5 г
Натрия гидрокарбонат 0,4 г
Натрий фосфорнокислый пиро 0,25 г
Витамин К1 0,01 г
Ванкомицин 0,005 г
Джозамицин 0,003 г
Кровь баранья дефибринированная 50,0 мл
Эта же среда без антибиотиков предложена для культивирования широкого круга анаэробных бактерий. Некоторые авторы считают достаточно вводить в среду только неомицин (0,1 г/л) и ванкомицин (0,0075 г/л) для селективного выделения фузобактерий.
Селективными и, одновременно, диагностическими свойствами обладает среда для Fusobacterium necrophorum следующего состава (на литр).
Панкреатический перевар казеина 32,0 г
Магний сернокислый 5,0 г
Динатрия гидрофосфат 5,0 г
Кристаллический фиолетовый 0,023 г
Эмульсия яичного желтка (50%) 90,0 мл
Раствор фенилиэтолового спирта (0,27%) 1,35 мл
Эмульсия яичного желтка готовится следующим образом. Обрабатывают антисептиком 24 яйца. У 22 из них отделяют яичный желток и смешивают его с содержимым 2 других яиц. Добавляют 100 мл 0,9% раствора хлорида натрия. Тщательно смешивают.
Аналогичный принцип заложен в пропись еще одной селективной и диагностической среды, рекомендованной к использованию Американским микробиологическим обществом. Среда известна как яично-желточный агар с неомицином (Egg Yolk Agar) или как агар Lombard-Dowell (LD agar) с неомицином. Среда рекомендована для выделения Fusobacterium necroрhorum, Prevotella intermedia, клостридий. LD agar является основой для многих вариантов питательных сред, используемых при работе с облигатно анаэробными бактериями. Состав ее на литр следующий.
Панкреатический перевар казеина 5,0 г
Дрожжевой экстракт 5,0 г
Натрия хлорид 2,5 г
L-триптофан 0,2 г
Натрий сернистокислый 0,1 г
Витамин К1 0,01 г
Натрия гидроокись (1 N) 5,0 мл
Селективный и диагностический вариант среды, приведенной выше, включает
LD агар 900,0 мл
Яично-желточная эмульсия 10,0 мл
Магний сернокислый (5% раствор) 0,02 мл
Динатрия гидрофосфат 0,5 г
Неомицина сульфат 0,01 г
Приготовление яичной эмульсии: смешивают содержимое 1 яйца с яичным желтком 11 яиц.
Эмульсию яичного желтка и неомицин вносят асептично в расплавленную и охлажденную до 45 – 50 о С среду перед ее разлитием в чашки Петри.
Дифференциация анаэробов идет по их способности продуцировать липазу, лецитиназу и протеазы (образование преципиата вокруг колоний –– лецитиназа, перламутовая переливающаяся окраска колоний –– липаза, зона просветления вокруг колоний –– протеаза).
Среди других вариантов LD агара значительным диагностическим потенциалом обладает также т.н. LD эскулин агар, имеющий следующий состав на литр.
Панкреатический перевар казеина 5,0 г
Дрожжевой экстракт 5,0 г
Натрия хлорид 2,5 г
Железа цитрат 0,5 г
L-триптофан 0,4 г
Витамин К1 0,01 г
Натрия гидроокись (1 N) 1,0 мл
Микроорганизмы, гидролизующие эскулин, меняют окраску среды вокруг колоний от красно-коричневой до темно-коричневой. Бактерии, продуцирующие H2S образуют колонии черного цвета.
Для бактерий, дающих рост в присутствии желчи (B.fragilis и ее группа), предложен вариант этой же среды, содержащий сухую желчь или соли желчных кислот. Он имеет много общего с составом среды, уже приведенной ранее. Жидкий вариант (бульон LD) предложен для культивирования различных облигатно анаэробных бактерий.
В отечественных методических рекомендациях, названных в начале этой главы, также дано несколько прописей диагностических питательных сред. Для определения лецитиназной (лецитовителлазной) и липазной активности рекомендована среда следующего состава.
(120 мг% аминного азота) 1000,0 мл
Динатрия гидрофосфат 5,0 г
Калия дигидрофосфат 1,0 г
Натрия хлорид 2,0 г
Магний сернокислый 0,1 г
Гемин (1% раствор) 1 мл
Взвесь желтка 200,0 мл
Взвесь желтка рекомендовано готовить, используя 1 желток на 200 мл физиологического раствора.
Для определения протеолитической активности анаэробных бактерий предложено использовать среду с желатином.
(120 мг% аминного азота) 1000,0 мл
Натрия хлорид 5,0 г
Желатин 100,0 – 150,0 г
L-цистеин солянокислый 0,25 г
Гемин (1% раствор) 1,0 мл
Витамин К1 (0,01% раствор) 1,0 мл
Для определения сахаролитических свойств анаэробов рекомендовано пользоваться пептонно-дрожжевым бульоном с добавлением необходимого углевода. Пропись бульона следующая (на литр).
Дрожжевой экстракт 10,0 г
Глюкоза или др.углевод 10,0 г
L-цистеин солянокислый 0,5 г
Гемин (1% раствор) 1,0 мл
К среде может быть добавлен резазурин как показатель редокс-потенциала. Подчеркивается необходимость вести работы в токе бескислородного газа. Прокипяченная (восстановленная) среда не должна иметь розовой окраски – резазурин в процессе кипячения должен быть обесцвечен.
В заключение приведем селективную и диагностическую среду, предложенную для выделения Clostridium difficile, которая имеет следующий состав (на литр).
Изобретение относится к медицинской микробиологии. Цель изобретения повышение чувствительности среды. Питательная среда включает следуквдие ингредиенты, г/л: питательный бульон 20,9-22,1; глюкоза 0,475-1,275; эритрит 0,0057-0,017; тиаьп1н-бромид 0,0019-0,0085; магний серно-кисльй 0,285-0,765; калий хлористый 0,038- 0,34 аммоний хлористый 0,665-1,275, агар-агар 9,5-11,475; гентамицин 0,0001-0,00015; лизированная кровь 50- 150; вода дистиллированная до 1л. Првьппекие чувствительности среды достигается подбором питательной основы и дополнительным введением в ее состав стимуляторов роста бактероидов и ее селективности. Среда может быть приготовлена в сухом виде. 1 табл. с € (Л
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
ГОСУДАРСтЕЕННЫЙ КОМИтат CCCP
БАКТЕР ОИДОВ (57) Изобретение относится к медицинской микробиологии. Цель изобретения 511 4 C 12 N I/20 С 12 q 1/04 повышение чувствительности среды.
Питательная среда включает следуюшие ингредиенты, г/л: питательный бульон
20,9-22,1; глюкоза 0,475-1,275, эритрит 0,0057-0,017., тиамин-бромид
0,0019-0,0085; магний серно-кислый
0,285-0,765; калий хлористый 0,0380,34, аммоний хлористый 0,665-1,275; агар-агар 9,5-11,475; гентамицин
0,0001-0,00015; лизированная кровь 50150; вода дистиллированная до 1 л.
Повышение чувствительности среды достигается подбором питательной основы и дополнительным введением в ее состав стимуляторов роста бактероидов и ее селектнвности. Среда может быть приготовлена в сухом виде. 1 табл.
Изобретение относится к медицинской микробиологии и может быть использовано при бактериологической диагностике заболеваний, вызванных б акт ер оидами.
Цель изобретения — повышение чувствительности среды.
Пример I. Для приготовления среды минимального состава в колбу 10 с 950 мл дистиллированной воды вносят, r: питательный бульон 20,9, глюкозу
0,475, эритрит 0,0057, тиамин-бромид
0,0019, магний серно-кислый 0,285, калий хлористый 0,038, аммоний хло- 15 ристый 0,665, агар-агар 9.5. Все тщательно перемешивают и на огне, не допускания подгорания, доводят до кипения, кипятят 1-2 мин. Среду разливао ют во фчаконы, стерилизуют при 120 С 20 в течение 15 мин. рН готовой среды должен быть в пределах 7,0 -0,2;
Перед употреблением среду регенерируют на кипящей водяной бане 10 мин. Затем в охлажденную до 45-50 С 25 среду добавляют 50 г лизированной крови и 0,0001 r гентамицина, взбалтыьают и разливают в чашки Петри.
После застывания агарового студня производят посев исследуемого мате- 30
Пример 2. Для приготовления среды оптимального состава в колбу с 900 мп дистиллированной воды вносят, r: питательный бульон 21,6, глюкоза 0,9, эритрит 0,011, тиаминбромид 0,0045, магний серно-кислый
0,54, калий хлористый 0,081, аммоний хпористый 1,125, агар-агар 10,8. Все тщательно перемешивают и на огне, не 40 допуская пригорания, доводят до кипения, кипятят 1-2 мин. Среду разливают во флаконы, стерилизуют при
120 С в течение 15 мин. рН готовой среды должен быть в пределах 7,0+0,2. 45
Перед употреблением среду регенерируют на кипящей водяной бане 10 мин.
Затем в охлажденную до 45-50 С среду добавляют 100 г лизированной крови и
0,0001 r гентамицина, взбалтывают 50 и разливают в чашки Петри. После застывания агарового студня производят посев исследуемого материала.
Пример 3. Для приготовления среды максимального состава в колбу с 850 мл дистиллированной воды вносят, г: питательный бульон 22,1, глюкоза 1.275, эритрит 0,017, тиаминбромид 0,0085, магний серно-кислый
0,765, калий хлористый 0,34, аммоний хлористый 1,275, агар -агар 11,475.
Все тщательно перемешивают и на огне, не допуская пригорания, доводят до кипения, кипятят 1-2 мин. Среду разливают во флаконы, стерилизуют при о
120 С в течение 15 мин. рН готовой среды должен быть в пределах 7,0 ;0,2.
Перед употреблением среду регенерируют на кипящей водяной бане 10 мин.
Затем в охлажденную до 45-50 С среду добавляют 150 г лизированной крови и
0,00015 г гентамицина, взбалтывают и разливают в чашки Петри. После застывания агарового студня производят посев исследуемого материала.
Посев исследуемого материала на среду в чашки Петри производят петлей или шпателем, равномерно раслреде ляя его по всей поверхности среды. о
Посевы инкубируют при 37 С в течение
48-72 ч в условиях анаэростата, заполненного трехкомпонентной газовой смесью путем трехкратного вакуум— заместительного промывания.
Результаты испытаний питательной среды в экспериментах с чистыми куЛьтур ами р аз личных видов б актер оидов показывают высокую чувствительность среды по сравнению с контрльными (см. таблицу)
Скорость роста на опытной и контрольной средах варьирует от 48 ч инкубации — для быстрорастущих культур, до 72 ч — для культур наиболее требовательных по своим питательным потребностям.
Из данных таблицы видно, что чувствительность предлагаемой среды находится на уровне среды Шедлера фирма
"Libco" но значительно выше среды
Питательная среда для выделения б актера идо в, содержащая пит ат ел ьную основу, источник углерода, стимулятор роста, агар-агар, лизированную кровь и дистиллированную воду, о т л и ч а ю щ а я с я тем, что, с целью повышения чувствительности среды, она дополнительно содержит маг" ний серно-кислый, калий хлористый, аммоний zëoðèñòûé, гентамицин, в качестве питательной основы она содер1440918
кровяной агар это обогащенная твердая среда, дифференциальная, но не селективная. Он используется для восстановления и роста большого разнообразия микроорганизмов из клинических образцов или субкультур..
Классический кровяной агар должен быть включен для посева большинства клинических образцов, полученных в лаборатории; за исключением образцов кала, где это бесполезно, если только они не подготовлены с определенными модификациями.
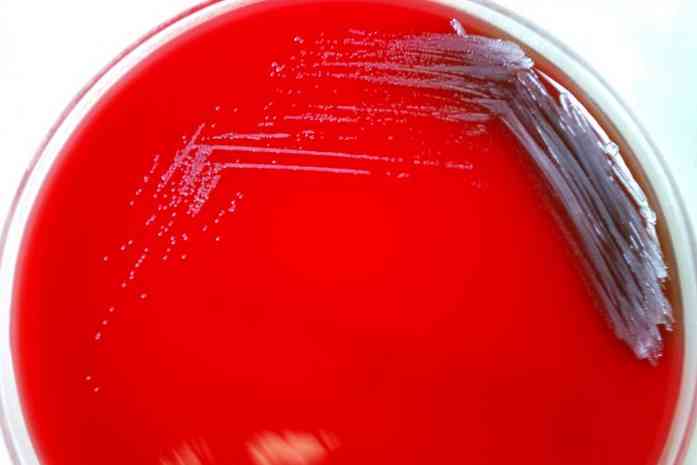
Эта культуральная среда в основном состоит из обогащенного базового агара и 5% крови. Основа агара может варьироваться в зависимости от потребностей, но в основном будет состоять из пептонов, аминокислот, витаминов, мясного экстракта, хлорида натрия, агара и других..
Что касается крови, обычно требуется контакт с биотерием для получения крови от животных, таких как овцы, кролики или лошади. Однако это не всегда возможно, и иногда используется человеческая кровь.
Среда с кровяным агаром может быть приготовлена в лаборатории или приобретена для компаний, которые ей посвящены. Приготовление этой среды является одним из самых деликатных, любая небрежность при ее приготовлении приведет к загрязнению партии.
Вот почему должны быть приняты все возможные меры предосторожности, и, в конце концов, должен быть проведен контроль качества инкубирования при 37 ° С на 1 чашку на каждые 100 приготовленных.
- 1 фундамент
- 2 использования
- 2.1 Выбор группы крови
- 2.2 Выбор типа базового агара
- 2.3 Использование кровяного агара в соответствии с базовой средой, использованной для его приготовления
- 3 Подготовка
- 3.1 Взвешивать и растворять
- 3.2 Стерилизовать
- 3.3 Агрегация крови
- 3.4 Разлить в чашки Петри
- 4 Ссылки
фундамент
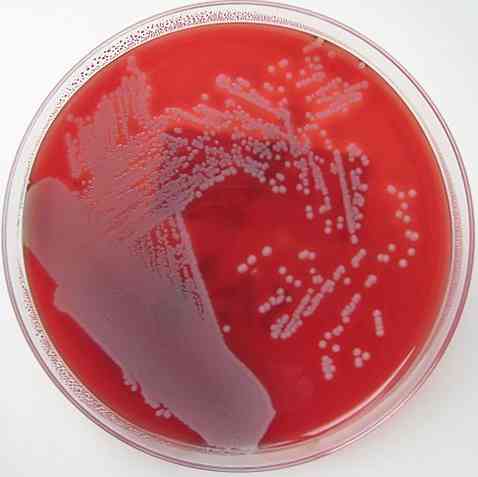
Уже упоминалось, что кровяной агар обладает характеристикой обогащенной, дифференцированной и неселективной среды. Основание каждого из этих свойств объясняется ниже.
Кровяной агар является обогащенной средой, поскольку он содержит в качестве основной добавки 5-10% крови на основе агара. Оба соединения содержат много питательных веществ, и это свойство позволяет большинству пригодных для культивирования бактерий расти в нем..
Этот рост происходит без ограничений; по этой причине это неселективно. Однако, если в эту среду добавляются соединения, которые предотвращают рост некоторых микроорганизмов и способствуют росту других, он становится селективным. Это тот случай, если определенные типы антибиотиков или противогрибковых добавляются.
Точно так же кровяной агар является дифференциальной средой, поскольку он позволяет различать 3 типа бактерий: бета-гемолитические, альфа-гемолитические и гамма-гемолитические..
Бета-гемолитики - это те, которые обладают способностью лизировать или полностью разрушать эритроциты, образуя прозрачный ореол вокруг колоний, таким образом вызывая β или β гемолиз - гемолиз, а микроорганизмы называются β-гемолитическими..
Примерами ß-гемолитических бактерий являются Streptococcus pyogenes и Streptococcus agalactiae.
Альфа-гемолитики - это те, которые выполняют частичный гемолиз, где гемоглобин окисляется до метгемоглобина, создавая зеленоватую окраску вокруг колоний. Это явление известно как гемолиз α или α-гемолиз, а бактерии классифицируются как α-гемолитические..
Примером α-гемолитических бактерий являются Streptococcus pneumoniae и стрептококк группы viridans.
Наконец, существуют бактерии, называемые гамма-гемолитическими или негемолитическими. Они растут на агаре, не вызывая изменений на нем, эффект, известный как γ-гемолиз, а микроорганизмы являются γ-гемолитическими..
Пример γ-гемолитических бактерий: некоторые штаммы Streptococcus группы D (Streptococcus bovis и Enterococcus faecalis).
приложений
Культуральная среда с агаром крови является одной из наиболее часто используемых в лаборатории микробиологии..
Среди микроорганизмов, способных расти на агаризованной среде крови: строгие, факультативные, микроаэрофильные, анаэробные, грамположительные или грамотрицательные аэробные бактерии, быстрорастущие или медленнорастущие бактерии..
Некоторые бактерии, которые требуют или мешают с точки зрения питания, а также грибки и дрожжи, также растут. Аналогично, это полезно для субкультуры или реактивации штаммов, которые очень слабо метаболически.
Однако выбор типа крови и основного агара будет варьироваться в зависимости от вероятного микроорганизма, который подозревается в выздоровлении, и от использования бляшки (культура или антибиограмма)..
Кровь может быть ягнёнком, кроликом, лошадью или человеком.
Наиболее рекомендуемой является кровь ягненка, за некоторыми исключениями. Например, для выделения видов Haemophilus, где рекомендуемой кровью является лошадь или кролик, поскольку в крови ягненка содержатся ферменты, которые ингибируют фактор V.
Наименее рекомендуемым является человек, однако он наиболее часто используется, возможно, потому, что его легче всего получить..
Кровь должна быть дефибринирована, получена без каких-либо добавок и от здоровых животных. Для использования человеческой крови необходимо учитывать несколько факторов:
Если кровь поступает от людей, перенесших бактериальные инфекции, у них будут специфические антитела. В этих условиях рост некоторых бактерий, вероятно, будет подавлен.
Если он получен из банка крови, он содержит цитрат, и возможно, что некоторые бактерии не развиваются в его присутствии. С другой стороны, если кровь поступает от пациентов, принимающих антибиотики, рост чувствительных бактерий может быть замедлен.
И если кровь от диабетика, избыток глюкозы мешает правильному развитию паттернов гемолиза..
Базовый агар, используемый для приготовления кровяного агара, может быть очень широким. Среди них: питательный агар, агар для инфузии мозга, соевый агар с триптиказой, агар Müeller Hinton, агар Thayer Martin, агар Columbia, агар Brucella, агар Campylobacter и т. Д..
Эта база используется реже всего, потому что на ней будут расти в основном нетребовательные бактерии, такие как кишечные палочки, Pseudomonas sp, S. aureus, Bacillus sp., среди других. Не рекомендуется выделять стрептококк.
Он является одним из наиболее используемых в качестве основы кровяного агара, поскольку в нем содержатся необходимые питательные вещества для роста большинства бактерий, в том числе Streptococcus sp и другие требовательные бактерии. Хотя не следует соблюдать закономерности гемолиза.
Кровь ягненка обычно используется с этой основой.
Также могут быть приготовлены варианты с кровяным агаром, где добавляются другие соединения для выделения определенных микроорганизмов. Например, инфузионный агар мозга с добавлением кроличьей крови, цистина и глюкозы служит для выделения Francisella tularensis.
Принимая во внимание, что с цистином теллурит полезен для выделения Corynebacterium diphteriae. Вы можете использовать кровь человека или ягненка.
В первом случае бета-гемолиз будет выглядеть как узкое гало, а во втором гало будет гораздо шире.
Аналогично, эта основа вместе с бацитрацином, кукурузным крахмалом, лошадиной кровью и другими добавками для обогащения (IsoVitaleX), используется для выделения рода Haemophilus sp из дыхательных проб.
Кроме того, если вы добавляете комбинацию антибиотиков хлорамфеникол - гентамицин или пенициллин - стрептомицин с лошадиной кровью, это идеально подходит для выделения требовательных патогенных грибов, даже с более высоким выходом, чем глюкозный агар Сабура. Это особенно полезно в изоляции Histoplasma capsulatum.
Эта база является наиболее рекомендуемой для лучшего наблюдения за характером гемолиза и выполнения диагностических тестов, таких как таксоны оптохина и бацитрацина. Это классический кровяной агар, который обычно используется.
С помощью этой базы вы также можете приготовить специальный кровяной агар для Corynebacterium diphteriae, с теллур цистином и кровь ягненка.
Аналогично, комбинация этого агара с кровью ягненка плюс канамицин-ванкомицин идеальна для роста анаэробов, особенно Bacteroides sp.
Эта основа с добавлением крови используется для выполнения антибиограммы требовательных микроорганизмов, таких как Streptococcus sp.
Это также полезно для выделения таких бактерий, как Legionella pneumophila.
Эта среда идеально подходит в качестве основы для кровяного агара, когда подозревается род Neisseria, особенно Neisseria meningitidis, в качестве N. gonorrhoeae не растет на кровяном агаре.
Он также служит для проведения тестов на чувствительность к Neisseria meningitidis.
Эта база отлично подходит для посева образцов желудочной биопсии в поисках Helicobacter pylori.
Среду готовят путем добавления 7% крови ягненка, дефибринированной антибиотиками (ванкомицин, триметоприм, амфотерицин В и цефсулодин), чтобы ограничить рост других типов бактерий, которые могут присутствовать.
Эта же основа с добавлением крови человека или ягненка, налидиксовой кислоты и колистина полезна для выделения Gardnerella vaginalis. Он также идеально подходит для оценки чувствительности к антимикробным препаратам к антибиотикам того же микроорганизма..
Кроме того, он используется для приготовления кровяного агара для выращивания анаэробов, добавления аминогликозидов и ванкомицина.
Эта база позволяет нам правильно наблюдать закономерности гемолиза.
Эта среда, используемая в качестве основы кровяного агара вместе с добавлением витамина К, идеально подходит для выращивания анаэробных бактерий. В этом случае рекомендуется использовать кровь ягненка.
Агар Кампилобактер, дополненный 5% овечьей крови и 5 антибиотиками (цефалотин, амфотерицин В, триметоприм, полимиксин В и ванкомицин), является средой, используемой для выделения Campylobacter jejuni в образцах стула.
подготовка
Каждый коммерческий дом несет на обратной стороне упаковки инструкции по приготовлению литра питательной среды. Соответствующие расчеты могут быть сделаны для приготовления желаемого количества, в соответствии с выбранным базовым агаром.
Базовый агар поставляется обезвоженным (порошок), поэтому его необходимо растворить в дистиллированной воде, доведенной до pH 7,3.
Количество, указанное выбранным базовым агаром, взвешивают и растворяют в соответствующем количестве воды в фиоле, затем нагревают до умеренного нагрева и перемешивают вращательными движениями до тех пор, пока весь порошок не растворится..
После растворения стерилизовать в автоклаве при 121 ° С в течение 20 минут..
Покидая автоклав, дайте фиоле остыть, пока температура не будет колебаться между 40 и 50 ° C; температура, которую поддерживает человеческая кожа, и в то же время агар еще не затвердел.
Для этого к фиолле прикасаются рукой, и если тепло терпимо, это идеальная температура для добавления соответствующего количества дефибринированной крови (50 мл на литр агара). Аккуратно перемешать до гомогенизации.
Прохождение скопления крови имеет решающее значение, потому что, если это происходит, когда среда очень горячая, красные кровяные клетки будут разрушаться, и среда не будет служить для наблюдения гемолиза..
Если его добавить слишком холодным, образуются комочки, и поверхность среды не будет гладкой, чтобы сделать флейту правильно.
Подавать в стерильных чашках Петри сразу после гомогенизации крови. Приблизительно 20 мл наливают в каждую чашку Петри. Эта процедура выполняется в вытяжном шкафу или рядом с горелкой..
При подаче кровяного агара в чашки Петри на поверхности тарелки не должно оставаться пузырьков воздуха. Если это происходит, пламя горелки Бунзена быстро проходит над пластиной, чтобы устранить их..
Пластинам дают затвердеть и хранят в холодильнике (2-8 ° С) в перевернутом виде до использования. Перед использованием кровяного агара пластины следует закалить (дать им принять комнатную температуру) для посева.
Читайте также:


