Лабораторные показатели при сепсисе
Диагноз синдрома системной воспалительной реакции ставится на основании перечисленных выше признаков. Этот диагноз не может звучать самостоятельно, а только лишь вместе с той или иной нозологической формой (пневмония ССВР-III – что означает наличие пневмонии, сопровождающейся тремя из четырех признаков ССВР). ССВР является важным признаком, свидетельствующим о возможности перехода процесса в более тяжелые формы и требующим принятия адекватных мер по лечению.
Диагноз сепсиса ставится в соответствии с указанными выше критериями. Для него необходимо наличие как минимум трех признаков системной воспалительной реакции на фоне явного местного инфекционного процесса или верифицированной бактериемии (фунгемии, вирусемии и т.д.), сохраняющиеся на протяжении как минимум трех суток, несмотря на проводимую терапию
Диагноз сепсис-синдрома формулируется при наличии указанных выше симптомов системной воспалительной реакции, манифестирующих на фоне верифицированного источника инфекции и лабораторных данных, свидетельствующих о развитии несостоятельности того или иного органа (приложение 1) при отсутствии других явных причин, объясняющих это состояние (крайние стадии хронических заболеваний и т.д.).
Септический шок – снижение артериального давления ниже 90 мм.рт.ст. на фоне септического процесса, несмотря на адекватную инфузионную терапию и проводимое лечение.
Лабораторная диагностика: обязательная и желательная.
К обязательным методам относятся: трехчасовое измерение температуры; анализ крови общий, включая тромбоциты; анализ мочи; почасовой диурез; биохимический анализ крови, включающий К+, Na+, КОС, билирубин, АСТ, АЛТ, креатинин, мочевину, общий белок и протеинограмму, протромбин, фибриноген, фибринолиз; бактериоскопия мазка из раны; микробиологическое исследование крови (2 пробы) на стерильность, мочи, отделяемого из раны, при ИВЛ – посевы бронхиального отделяемого, удаляемого катетера и дренажа; исследование кишечной флоры на дисбиоз.
К желательным методам относятся: иммунный статус; прокальцитонин; С-реактивный белок (численная методика).
Аппаратные методы: УЗИ органов брюшной полости; УЗИ сердца (патология клапанов); R-графия груди; КТ и другие.
6. Первичная лечебная тактика при хирургическом сепсисе.
Обследование и лечение больного с хирургическим сепсис-синдромом и септическим шоком должно проводиться в условиях отделения (палаты) интенсивной терапии совместно хирургом и реаниматологом. Оперативное вмешательство (как правило, вторичная хирургическая обработка) при наличии показаний выполняется в неотложном порядке. Вмешательство может быть отложено лишь при нестабильных показателях гемодинамики, до выполнения мероприятий, ведущих к ее стабилизации.
Объем оперативного вмешательства должен включать в себя: максимально полную некрэктомию, адекватное дренирование очага, преимущественно двухпросветными трубками. Целесообразна установка внутрисосудистых катетеров для регионарной терапии.
7. Эмпирическая антибактериальная терапия. Иммунокоррекция.
Антибактериальная терапия начинается после забора проб для выполнения микробиологических исследований и носит, в подавляющем большинстве, эмпирический характер. Путь введения, в основном, внутривенный. После стабилизации состояния целесообразен переход на другие пути введения. Выбор антибиотиков определяется, во-первых, локализацией очага, обусловившего развитие генерализованного процесса, и, во-вторых, тяжестью состояния больного, оцененной по шкале SAPS (Le Gall). В соответствии с этим рекомендуются следующие варианты.
А) посттравматический сепсис. SAPS 15: фторхинолоны (ципрофлоксацин) + цефалоспорины III - IV (цефоперазон, цефтазидим или цефепим) + метронидазол; карбапенемы;
B) Интраабдоминальный сепсис SAPS
Г) Интраабдоминальный сепсис SAPS>15: цефепим + метронидазол; карбапенемы, при множественных очагах и при деструктивном панкреатите - предпочтительно меропенем Д) Воспалительные заболевания мягких тканей SAPS 15: ванкомицин или фторхинолоны + аминогликозиды III (в случае отсутствия ОПН)+ метронидазол; карбопенемы; при верифицированной стрептококковой природе - пенициллины или амоксиклав.
Заключение
Сепсис - общее инфекционное заболевание, возникающее в связи с существованием в организме очага инфекции и имеющее ряд отличий от других инфекционных болезней , с точки зрения диагностики и лечения - это недостаточная или извращенная общебиологическая реакция макроорганизма в ответ на внедрение неспецифического микробного возбудителя, сопровождающаяся его генерализацией и протекающая в виде стадийного процесса различной протяженности, при которой самостоятельная способность организма бороться с инфекцией.
Взгляды на этиологию и патогенез сепсиса на протяжении XX века претерпевали серьезные изменения: они эволюционировали от признания первостепенной роли микроба как главной причины развития сепсиса (теория Шоттмюллера о септическом очаге) до утверждения решающего значения состояния макроорганизма.
Список литературы
1.Антибактериальная терапия: Практическое рукодство/ Под ред. Л.С. Страчунского,Ю.Б.Белоусова, С.Н.Козлова.-М.: Фарммединфо, 2000.- 357с.
2.Брюсов П.Г., Нечаев Э.А. Военно-полевая хирургия / Под ред. М. Геотара.
3.Раны и раневая инфекция. Под ред. Кузина М.И. М.: Медицина, - 1981, - 688с.
4.Стручков В.И. Хирургическая инфекция. М.: Медицина, - 1991, - 560с.
5.Хирургические инфекции: руководство/ Под ред. И.А. Ерюхина и др. – СПб: Питер, 2003. – 864с.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Диагностика сепсиса производится на основании согласованных критериев, которые легли в основу шкалы SOFA (Sepsis oriented failure assessment) - табл. 23-3.
В некоторых случаях, когда нет уверенности в наличии инфекционного очага (панкреонекроз, внутрибрюшной абсцесс, некротизирующие инфекции мягких тканей и т.д.), существенную помощь в диагностике сепсиса может оказать прокальцитониновый тест. По данным ряда исследований, сегодня он характеризуется максимально высокой чувствительностью и специфичностью, значительно превосходя по последнему параметру такой широко распространённый показатель, как С-реактивный белок. Использование полуколичественного метода определения уровня прокальцитонина должно, по мнению ряда специалистов, стать рутинным исследованием в клинической практике в тех случаях, когда возникают сомнения в наличии очага инфекционного процесса.
Качество обследования играет решающую роль в выборе адекватного объема оперативного вмешательства и исходе заболевания.
Основными клиническими симптомами сепсиса у гинекологических больных является наличие гнойного очага в сочетании со следующими симптомами: гипертермией, ознобами, изменением цвета кожи, высыпаниями и трофическими изменениями, резкой слабостью, изменением функций нервной системы, нарушением функций желудочно-кишечного тракта, наличием полиорганной недостаточности (дыхательной, сердечно-сосудистой, почечной и печеночной).
Специфичных для сепсиса лабораторных критериев нет. Лабораторная диагностика сепсиса основана на данных. которые отражают факт тяжелого воспаления и степень полиорганной недостаточности.
Продукция эритроцитов при сепсисе снижена. Анемия при сепсисе наблюдается во всех случаях, причем у 45% больных содержание гемоглобина ниже 80 г/л.
Для сепсиса характерен нейтрофильный лейкоцитоз со сдвигом влево, в отдельных случаях может отмечаться лейкемоидная реакция с количеством лейкоцитов до 50-100 тыс. и выше. Морфологические изменения нейтрофилов при сепсисе включают токсическую зернистость, появление телец Доле и вакуолизацию. Тромбоцитопения при сепсисе встречается в 56% случаев, лимфопения - в 81,2%.
Степень интоксикации отражает лейкоцитарный индекс интоксикации (ЛИИ), который рассчитывают по формуле:
ЛИИ = (С+2П+ЗЮ+4Ми)(Пл-1) / (Мо+Ли) (Э+1)
где С - сегментоядерные нейтрофилы, П - палочкоядерные лейкоциты, Ю - юные лейкоциты, Ми - мелоциты, Пл - плазматические клетки, Мо - моноциты, Ли - лимфоциты, Э - эозинофилы.
ЛИИ в норме равен примерно 1. Повышение индекса до 2-3 свидетельствует об ограничении воспалительного процесса, повышение до 4-9 - о значительном бактериальном компоненте эндогенной интоксикации.
Лейкопения с высоким ЛИИ является плохим прогностическим признаком для больных с септическим шоком.
Определение параметров кислотно-основного состояния (КОС), и особенно уровня лактата, позволяет определить стадию и тяжесть септического шока. Считают, что для больных в ранних стадиях септического шока характерен компенсированный или субкомпенсированный метаболический ацидоз на фоне гипокапнии и высокого уровня лактата (1,5-2 ммоль/л и выше). В поздних стадиях шока метаболический ацидоз становится некомпенсированным и по дефициту оснований может превышать 10 ммоль/л. Уровень лактацидемии достигает критических пределов (3-4 ммоль/л) и является критерием обратимости септического шока. Выраженность ацидоза в значительной степени коррелирует с прогнозом.
Хотя нарушение агрегационных свойств крови в той или иной степени развивается у всех больных с сепсисом, частота синдрома диссеминированного внутрисосудистого свертывания составляет всего 11%. Гемостазиологические показатели у больных септическим шоком свидетельствуют о наличии, как правило, хронической, подострой или острой формы ДВС-синдрома. Подострая и острая формы его у больных септическим шоком характеризуются выраженной тромбоцитопенией (менее 50-10 9 г/л), гипофибриногенемией (менее 1,5 т/л), повышенным потреблением антитромбина и плазминогена, резким повышением содержания дериватов фибрина и фибриногена, увеличением хронометрического показателя тромбоэластограммы, времени свертывания крови, уменьшением структурного показателя тромбоэластограммы.
При хроническом ДВС-синдроме отмечены умеренная тромбоцитопения (менее 150-10 9 г/л), гиперфибриногенемия, усиленное потребление антитромбина III, а также гиперактивность системы гемостаза (снижение хронометрического показателя и увеличение структурного показателя на тромбоэластограмме).
Определение концентрации электролитов сыворотки, уровня белка, мочевины, креатинина, печеночных показателей помогает выяснить функцию важнейших паренхиматозных органов - печени и почек.
Для больных сепсисом характерна выраженная гипопротеинемия. Так, гипопротеинемия менее 60 г/л наблюдается у 81,2-85% больных ).
Хотя отсутствие положительных данных посевов крови не снимает диагноза у больных с клинической картиной сепсиса, больным с сепсисом необходимо проведение микробиологического исследования. Исследованию подлежат кровь, моча, отделяемое из цервикального канала, отделяемое из ран или свищей, а также материал, полученный интраоперационно непосредственно из гнойного очага. Существенное значение имеет не только идентификация обнаруженных микроорганизмов (вирулентность), но и их количественная оценка (степень обсемененности), хотя результаты таких исследований из-за длительности их проведения оцениваются чаще ретроспективно.
Бактериологическое подтверждение бактериемии сложно и требует соблюдения определенных условий. Для выявления бактериемии посев крови предпочтительно осуществлять либо как можно раньше после начала подъема температуры тела или озноба, либо за 1 ч до ожидаемого подъема температуры, желательно до начала антибиотикотерапии. Целесообразно производить от 2 до 4 заборов крови с интервалом не менее 20 мин, так как увеличение частоты посевов повышает вероятность выделения возбудителя. Забор крови осуществляется из периферической вены (не из подключичного катетера). Как правило, рекомендуется брать по 10-20 мл крови в 2 флакона для аэробной и анаэробной инкубации в течение 7 дней при каждом заборе, у детей до 12 лет - 1-5 мл.
Инструментальные диагностика сепсиса (УЗИ, рентгенологические, в том числе КТ; ЯМР) направлены на уточнение степени тяжести и распространения гнойного поражения в первичном очаге, а также на выявление возможных вторичных гнойных (метастатических) очагов.
В настоящее время для объективной оценки тяжести состояния больных при сепсисе, адекватности проводимой терапии, а также прогноза пользуются шкалой APACHE II. Проведенные исследования у больных с абдоминальным хирургическим сепсисом показали практически прямую зависимость летальности от тяжести состояния (суммы баллов по шкале APACHE II). Так, при сумме менее 10 баллов по данной шкале смертельных исходов не было. При сумме баллов от 11 до 15 летальность составила 25%, при сумме от 16 до 20 баллов летальность была 34%; у больных с суммой баллов от 21 до 25 летальность составила 41%, при сумме баллов от 26 до 33 летальность достигла 58,9%; при сумме баллов более 30 она была максимально высокой - 82,25%.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]

Когда нужно сдать анализ крови на сепсис?
Врач может заподозрить, что у пациента развивается сепсис, и назначить анализы, если:
- У больного возникли соответствующие симптомы.
- Лабораторные исследования, которые были проведены ранее, дают повод заподозрить это состояние.
Иногда симптомы сепсиса бывают выражены слабо, их легко спутать с признаками других заболеваний. У пациента повышается температура тела до 38° C, учащаются сердечные сокращения и дыхание, он сильно потеет, при этом имеются симптомы инфекции, из-за которой развилась системная воспалительная реакция в организме. Возникают признаки нарушений работы различных органов.
В тяжелых случаях возникает спутанность сознания, больной становится вялым, снижается артериальное давление, ноги, руки и губы холодные, синюшные, на коже появляются пятна, как при менингите.
Для того чтобы вовремя распознать сепсис и назначить необходимые анализы, традиционно врачи используют критерии шкалы quick SOFA (qSOFA). Если есть все три критерия, скорее всего, это сепсис:
Более точно установить диагноз помогают критерии по шкале SOFA, в них учитываются данные лабораторных анализов:
| Показатели | Баллы | ||||
| 0 | 1 | 2 | 3 | 4 | |
| Индекс оксигенации (измеряется в отделении интенсивной терапии) | Более 400 мм рт. ст. | 300–399 мм рт. ст. | 200–299 мм рт. ст. | 100–199 мм рт. ст. | Менее 100 мм рт. ст. |
| Уровень тромбоцитов | Более 150×109/л | Менее 150×109/л | Менее 100×109/л | Менее 50×109/л | Менее 20×109/л |
| Уровень билирубина в крови (функция печени) | Менее 20 мкмоль/л | 20–30 мкмоль/л | 33–101 мкмоль/л | 102–204 мкмоль/л | Более 204 мкмоль/л |
| Снижение артериального давления | Нет | Менее 70 мм рт. ст. | Удается удерживать лишь с помощью медикаментозных препаратов. | ||
| Оценка по шкале комы Глазго | 15 | 13–14 | 10–12 | 6–9 | Менее 6 |
| Уровень креатинина в крови (функция почек) | Менее 110 мкмоль/л | 110–170 мкмоль/л | 171–299 мкмоль/л | 300–440 мкмоль/л | Более 440 мкмоль/л |
| Количество мочи в сутки | Менее 500 мл в день | Менее 200 мл в день | |||
Процедура проведения анализа крови при сепсисе
Исследование нового поколения в Европейской клинике
Анализ активности эндотоксина (Endotoxin Activity Assay — EAA) — единственный метод количественного определения бактериального токсина, который одобрен Управлением по контролю качества пищевых продуктов и медикаментов США (Food and Drug Administration — FDA).
Что такое эндотоксин? Вещество, по химической природе липополисахарид, встроенное в клеточную мембрану грамотрицательных бактерий. Это мощный медиатор воспаления, и его уровень в крови повышается уже на ранних этапах развития сепсиса.
Для того чтобы определить уровень эндотоксина, у пациента берут кровь и добавляют в нее специфические антитела. Они связываются с бактериальным липополисахаридом, и эти комплексы поглощают нейтрофилы (особая разновидность лейкоцитов). В этих клетках происходят некоторые биохимические реакции, они начинают быстро поглощать и расходовать кислород. В присутствии люминофора возникает свечение, которое можно зарегистрировать с помощью особого инструмента — люминометра. По интенсивности свечения судят об уровне эндотоксина в крови.
Результат измеряется от 0 до 1:
- 0 — отсутствует;
- менее 0,4 — низкий уровень;
- 0,4–0,59 — промежуточный уровень;
- 0,6 и более — высокий уровень;
- 1 — максимальный уровень.
Эритроциты — красные кровяные клетки, которые содержат гемоглобин и отвечают за транспорт кислорода, углекислого газа. При тяжелом сепсисе с ними происходят следующие изменения:
- Анемия — снижение уровня гемоглобина. Она встречается не только при сепсисе, но и вообще при многих тяжелых заболеваниях. Примерно у 77% пациентов, которые поступают в отделение реанимации и интенсивной терапии, выявляют анемию разной степени тяжести. Также при сепсисе уменьшается количество эритроцитов, некоторым больным требуется переливание эритроцитарной массы.
- Свободный гемоглобин образуется в результате разрушения эритроцитов. Он усиливает выработку некоторых веществ, связанных с воспалением, из-за этого повышается риск смерти. Организм пытается справиться с опасностью путем повышения в крови уровня гаптоглобина — белка, который связывает гемоглобин.
- Снижение деформируемости эритроцитов. В итоге они хуже проходят через мелкие капилляры, нарушается доставка кислорода к органам, и ухудшается их функция. Механизмы нарушения деформируемости эритроцитов в настоящее время до конца не известны, считается, что это происходит из-за повреждения их мембраны свободными радикалами.
Скорость оседания эритроцитов, сокращенно СОЭ, характеризует скорость оседания эритроцитов под действием силы тяжести в крови, в которой искусственно заблокированы процессы свертывания (образования тромба). У мужчин этот показатель в норме составляет 2–15 мм/час, у женщин — 1–10 мм/час. При сепсисе СОЭ повышается, что является признаком воспалительного процесса в организме.
При сепсисе количество белых кровяных телец в крови увеличивается — возникает лейкоцитоз. Причины вполне объяснимы, ведь в организме развивается воспалительный процесс. В некоторых случаях уменьшается количество нейтрофилов — особого вида лейкоцитов. Это состояние называется нейтропенией, и оно связано с худшим прогнозом.
Снижение количества тромбоцитов в крови — тромбоцитопения — один из симптомов и критериев диагностики сепсиса по шкале SOFA. Риск смерти пациента напрямую зависит от того, насколько сильно у него снижено число тромбоцитов, и как долго сохраняется это состояние. При тромбоцитопении менее 100×109/л риск кровотечения больше не повышается, но уровень смертности продолжает расти.
Как определить заражение крови?
Сепсис характеризуется смертностью от 10 до 40%. На этот показатель влияет вид возбудителя, состояние организма пациента и, что немаловажно, время, в течение которого установлен точный диагноз и начато лечение. Иногда патология протекает в виде септического шока: нарушается кровообращение, обменные процессы в клетках, резко падает артериальное давление, и поддерживать его на цифрах больше 65 мм рт. ст. удается только с помощью лекарств. Среди больных септическим шоком смертность значительно выше.
Анализ активности эндотоксина помогает выявить больных из группы повышенного риска в максимально короткие сроки. В Европейской клинике доступны все виды лечения сепсиса: антибиотики, препараты для поддержания жизненно важных функций, инфузионной терапии, современные аппараты для плазмафереза, искусственной вентиляции легких, мониторинга всех важных показателей организма.
Кроме того, мы применяем инновационный метод очистки крови от эндотоксина — селективную сорбцию на картриджах для экстракорпоральной гемоперфузии Toramyxin PMX-20R. Эта процедура действует как плазмаферез: кровь больного пропускают через специальный аппарат, в котором задерживается эндотоксин — один из главных виновников системной воспалительной реакции. Фильтр аппарата состоит из волокон, к которым прикреплены молекулы антибиотика полимиксина Б. Он связывается с эндотоксином и образует с ним стабильный комплекс.
Сорбция эндотоксина на картриджах помогает эффективно бороться с тяжелым сепсисом, вызванным грамотрицательными бактериями и смешанной флорой.
Врачи Европейской клиники постоянно тщательно контролируют состояние каждого пациента, особенно больных, которые перенесли серьезные операции, находятся в нестабильном состоянии в отделении интенсивной терапии и реанимации. У нас есть все необходимое, чтобы вовремя диагностировать сепсис и другие тяжелые осложнения, немедленно оказать все необходимые виды помощи, провести реанимационные мероприятия.
Первый этап – выявление очагов инфекции. Необходимо учитывать такую особенность раннего сепсиса новорожденных, как возможность анте- или интранатального инфицирования плода. На основании анализа данных анамнеза, физикального обследования, соответствующей лабораторной и инструментальной диагностики, динамики патологических симптомов следует исключить или подтвердить развитие у ребенка менингита, пневмонии, энтероколита, пиелонефрита, артрита, остеомиелита, перитонита, кардита, абсцессов и флегмоны мягких тканей и т.д.
Второй этап диагностики – оценка функциональной активности важнейших систем поддержания гомеостаза и диагностика органной недостаточности. В таблице 1 приведены основные клинические, лабораторные и инструментальные характеристики полиорганной недостаточности, которые могут сопровождать сепсис новорожденного и определяют его исход. Мониторирование этих показателей необходимо для проведения адекватной этиотропной и посиндромной терапии.
Третий этап диагностики – оценка системной воспалительной реакции организма новорожденного ребенка. К критериям системной воспалительной реакции у новорожденных детей относят:
1. Аксиллярную температуру >37,5оС или
Повышение уровня С-реактивного белка (СРБ) в сыворотке крови более 6 мг/л.
Повышение уровня прокальцитонина (ПКТ) в сыворотке крови более 2 нг/мл у доношенного ребенка старше 48 часов жизни и старше 96 часов – у недоношенного с очень низкой массой тела при рождении (ОНМТ).
5. Повышение уровня интерлейкина-8 (ИЛ-8) в сыворотке крови более 100 пг/мл. При возможности дополнительной лабораторной диагностики информативными показателями системного воспаления являются увеличение сывороточных уровней других провоспалительных цитокинов (ИЛ-1β, ФНО-α, ИФН-γ, Г-КСФ, ИЛ-6), изменения уровней белков острой фазы воспаления, как позитивных реактантов (увеличиваются при наличии системного воспаления; например, гаптоглобин, орозомукоид, С3-компонент комплемента и др.), так и негативных реактантов (уменьшаются при воспалении, например, С4-компонент комплемента, преальбумин).
Обязательным этапом в диагностике сепсиса является микробиологическое исследование, т.е. посев крови, спинномозговой жидкости (по клиническим показаниям), аспирата из трахеи, мочи, отделяемого из гнойных очагов.
Следует строго соблюдать правила забора крови для микробиологического исследования. Необходимо осуществлять забор крови в асептических условиях при пункции интактной периферической вены или первой пункции центральной вены для постановки катетера. Недопустимо проводить забор крови для посева из длительно функционирующего катетера (это целесообразно лишь при изучении эпидемиологической ситуации в отделении). Оптимальный объем крови для посева – 1 мл или более. При технических трудностях и получении меньшего объема крови увеличивается риск получения отрицательных результатов посева крови при наличии низкой концентрации бактерий в кровотоке, особенно на фоне эффективной антибактериальной терапии 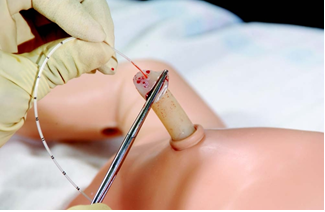
Бактериемия - не абсолютный диагностический признак сепсиса.
Ложноотрицательные результаты посева крови можно получить при заборе материала после начала антибактериальной терапии. Кроме того, ложноотрицательные результаты посева крови могут определяться малым объемом крови при небольшой степени бактериемии и несовершенством лабораторной диагностики на современном этапе, так как целый ряд возбудителей требует особых, специфических питательных сред и не может быть определен при стандартном исследовании. Ложноположительные результаты посева крови также возможны, поскольку бактериемию можно транзиторно наблюдать при любом инфекционном заболевании бактериальной природы.
Наряду с исследованием гемокультуры, этиологическая диагностика сепсиса включает микробиологическое исследование отделяемого из первичного и метастатических очагов. Дифференциальный диагноз. Сепсис следует дифференцировать с врожденными генерализованными формами вирусных инфекций. Дифференциальная диагностика основывается на проведении микробиологического, молекулярно-биологического или вирусологического исследования крови, спинномозговой жидкости, мочи, аспирата из трахеи или слюны методом полимеразной цепной реакции (ПЦР) и/или культуральным методом, серологических исследований уровней специфических IgM и IgG в сыворотке крови, а также их авидности.
Сепсис необходимо дифференцировать с генерализованными микозами, в первую очередь, кандидозом и значительно реже - аспергиллезом. Дифференциальный диагноз основывается на результатах микроскопического и микологического (посев на среду Сабуро) исследований крови, ликвора, отделяемого пиемических очагов.
Наконец, у новорожденных детей сепсис необходимо дифференцировать с наследственной патологией обмена веществ. Так, при наследственных дефектах обмена аминокислот характерны быстрое ухудшение состояния новорожденного после рождения, прогрессирующая одышка, легочно-сердечная недостаточность, угнетение функций ЦНС, гипотермия, лейкопения, тромбоцитопения, анемия. Отличительный признак - стойкий и выраженный метаболический ацидоз, в ряде случаев – появление стойкого запаха. В связи с тяжестью состояния у ребенка можно обнаружить бактериемию, отражающую выраженныйдисбиоз и снижение резистентности организма.

Сепсис — наиболее частая причина смерти в некоронарных отделениях интенсивной терапии. На сегодняшний день в мире ежегодно регистрируется более 18 млн случаев сепсиса. В развивающихся странах случаи сепсиса составляют 2 % всех госпитализаций и 6–30 % госпитализаций в отделения реанимации и интенсивной терапии. Летальность при сепсисе, по данным литературы, достигает 30–50 %.
За последние 10 лет значительно улучшились методы диагностики, что позволило начинать лечение сепсиса раньше, но летальность продолжает увеличиваться. G. Martin и соавт. (2009) проанализировали более 11 000 пациентов с тяжелым сепсисом, среди которых 57 % страдали от грамотрицательной, 44 % — от грамположительной и 11 % — от грибковой инфекции. Легкие были первичным источником инфекции у 47 % больных, абдоминальная инфекция — у 23 %, инфекция мочевыводящих путей — у 8 %. Общая смертность достигала почти 50 %.
Приоритетом продолжают быть ранняя диагностика и наблюдение за больными с риском развития сепсиса.
Первым шагом к пониманию патогенеза сепсиса стало определение таких понятий, как синдром системной воспалительной реакции (ССВР), сепсис, тяжелый сепсис, септический шок и синдром полиорганной недостаточности, которое впервые было дано на Конференции American College of Chest Physicians / Society of Critical Care Medicine Consensus в 1991 г.
ССВР развивается в результате взаимодействия про- и антивоспалительных медиаторов воспалительного ответа. Термин ССВР соответствовал широкому спектру этиологических факторов, помимо инфекции. Неинфекционные причины ССВР — лихорадка, хирургическое вмешательство, травма, панкреатит и др. Клиническая практика показала, что концепция ССВР была слишком чувствительна и недостаточно специфична. Группа пациентов с диагнозом ССВР была гетерогенна для выработки критериев диагностики и лечения.
В 2003 г. была предложена новая концепция условий для определения сепсиса — PIRO (Р — predisposition (предрасположение), I — infection (инфекция), R — response (ответ), О — organ dysfunction (органная дисфункция)). Данная концепция позволила более точно определять пациентов с сепсисом и оценивать степень тяжести заболевания.
Однако изменения концепции сепсиса не позволяют окончательно решить существующие проблемы ранней постановки диагноза.
Более того, из-за применения антибиотиков, предшествовавшего взятию крови, гемокультура часто дает ложноотрицательный результат. Отсутствует возможность оценки вклада некультивируемых микроорганизмов в инфекционно-воспалительный процесс, что ограничивает диагностические возможности метода.
Существуют более современные высокоточные методики диагностики инфекций, такие как полимеразная цепная реакция (ПЦР), которые позволяют идентифицировать микроорганизмы за счет многократного копирования специфических последовательностей генетического материала.
Методом ПЦР можно обнаружить бактериальную и грибковую ДНК намного быстрее и с более высокой чувствительностью. Более того, не требуется предшествующая инкубация или получение чистой культуры, вследствие чего лаборатория может выдать результат в течение нескольких часов (1—6 ч) с момента взятия образца на исследование. Кроме этого, именно генетический код определяет резистентность микроорганизмов к действию антибиотиков, например, ген mec для метициллин-резистентного золотистого стафилококка.
Дополнительным преимуществом диагностики является независимость от проводимой антимикробной терапии, а также большая вероятность получения достоверного результата в случае микст-инфекции по сравнению с классическим исследованием крови на стерильность. К сожалению, эта методика еще не получила должного распространения в связи со своей относительно высокой стоимостью.
Данные проблемы привели к поиску лабораторных маркеров, которые могут быть связаны с наличием инфекции в организме, уровнем воспалительной реакции и сепсисом. На настоящий момент основными из этих маркеров являются С-реактивный белок (СРБ), интерлейкин-6 (ИЛ-6), прокальцитонин (РСТ), пресепсин (P-SEP) и новый биологический маркер neutrophil CD64.
С-реактивный белок, открытый в 1930 г., — белок, относящийся к пентраксинам, синтез которого происходит в печени под влиянием ИЛ-6 и других цитокинов. При воспалении концентрация СРБ в плазме крови увеличивается в сотни раз, и существует прямая связь между изменением уровня СРБ, тяжестью и динамикой клинических проявлений воспаления. Однако данный механизм делает его крайне неспецифичным маркером, уровни которого могут повышаться при ССВР без наличия инфекции.
Такая же проблема характерна для измерения уровня ИЛ-6, который синтезируется активированными макрофагами и Т-клетками. Как показывает исследование J. Schrode и соавт. (1999), повышение его уровня может быть связанно с тяжелым течением заболевания без инфекционных осложнений.
Прокальцитонин, который был открыт в 1984 г., является предшественником кальцитонина, пептидного гормона парафолликулярных клеток щитовидной железы, не имеющим собственной функции. При массивном воспалительном инфекционном процессе, вызванном бактериальной и грибковой микрофлорой, уровень РСТ повышается без дальнейшего повышения уровня кальцитонина.
Также было доказано, что при обширной воспалительной реакции инфекционного генеза РСТ вырабатывается разными типами клеток вне щитовидной железы. Этот процесс запускается после появления в крови большого количества провоспалительных цитокинов, в особенности ИЛ-6 и фактора некроза опухоли альфа, на фоне эндотоксемии.
За 30 лет использования РСТ как маркера ССВР накопился большой опыт как ложноположительных, так и ложноотрицательных результатов. Как показывают работы В. Uzzan и соавт. (2006) и S. Hunziker и соавт. (2010), уровень РСТ может повышаться без наличия инфекции при массовой гибели клеток. В частности, после тяжелой травмы и хирургического вмешательства уровень РСТ быстро повышается, а затем, при отсутствии инфекции, снижается и приходит к норме через 3—5 дней.
Также в работе М. Christ-Crain и соавт. (2005) было отмечено, что повышение РСТ при генерализации инфекции и развитии сепсиса часто происходит со значительной задержкой, что ведет к ложноотрицательным результатам.
Пресепсин, или sCD14-ST, — относительно новый высокоэффективный маркер сепсиса, который был открыт 10 лет назад. CD14 — это поверхностный мембранный гликопротеин моноцитов/макрофагов, являющийся рецептором для комплексов липополисахарида и липополисахаридсвязывающего белка (LPS—LPB). Он активирует Toll-подобный рецептор 4 провоспалительного каскада для презентации антигена.
Существуют 2 формы CD14: мембранная (mCD14) и растворимая (sCD14). Комплекс LPS— LPBP—sCD14 циркулирует с потоками крови, где расщепляется катепсином D и другими протеазами плазмы с высвобождением N-терминального фрагмента молекулярной массой 13 кДа — молекулы sCD14-subtype (sCD14-ST), названной P-SEP. Данному маркеру в последнее время уделяется особое внимание в связи с его высокой чувствительностью, специфичностью и малым временем реакции для появления в крови.
По сравнению с другими маркерами P-SEP более чувствителен и специфичен в диагностике сепсиса. Проведенные исследования показали, что концентрация P-SEP в плазме значительно выше у инфицированных пациентов, чем у неинфицированных.
Shozushima и соавт. (2011) обнаружили, что концентрация P-SEP составляла 333,5 + 130,6 пг/мл в группе ССВР, 721,0 + 611,3 пг/мл в группе с ограниченной инфекцией, 817,9 + 572,7 пг/мл в септической группе и 1992,9 + 1509,2 пг/мл в группе с тяжелым сепсисом. Концентрация P-SEP в крови между группами возрастала последовательно.
Spanuth и соавт. (2011) изучали концентрацию P-SEP у больных, поступающих в приемный покой, и обнаружили, что она была значительно выше при тяжелом сепсисе, чем у септических пациентов средней тяжести. Более того, концентрация P-SEP коррелировала со шкалами APACHE II и SOFA.
Для оценки значения 4 маркеров в диагностике сепсиса была использована ROC-кривая. AUC P-SEP составила 0,845. P-SEP был предпочтительнее РСТ (0,652), ИЛ-6 (0,672), и СРБ (0,815). При пороговом значении концентрации P-SEP 399 пг/мл чувствительность диагностики сепсиса была равна 80,3 %, а специфичность — 78,5 %, в то время как при пороговом значении 600 пг/мл чувствительность диагностики сепсиса составила 87,8 %, специфичность — 81,4 %, позитивная прогностическая величина — 88,6 %, негативная прогностическая величина — 80,3 %. Чувствительность P-SEP для диагностики сепсиса была равна 91,9 %, РСТ — 89,9 %, ИЛ-6 — 88,9 %, культуры крови — 35,4 %. Результаты проведенных исследований позволяют считать, что маркер P-SEP перспективен при диагностике сепсиса.
P-SEP как биомаркер подходит не только для ранней диагностики сепсиса, но также для оценки его тяжести и прогноза. В исследовании ALBIOS у 100 пациентов с тяжелым сепсисом и септическим шоком определяли концентрацию P-SEP и РСТ. Средняя концентрация P-SEP в 1-й день мониторинга составила 2268 (1145—4305) пг/мл у умерших пациентов, что существенно выше, чем у выживших (1184 (855—2158) пг/мл; р = 0,001). На 7-й день у выживших пациентов уровень P-SEP существенно снизился — до 974 (674—1927) пг/мл, а у умерших он составлял 2551 (1438—5624) пг/мл (р = 0,02). Более того, уровень P-SEP коррелировал со шкалами SOFA, MOF и стабильностью гемодинамики. Девяностодневная смертность пациентов с высоким уровнем P-SEP была существенно выше, чем у больных с низким его уровнем (75 и 42 % соответственно). P-SEP опережал РСТ в оценке прогноза (AUC 0,69 и 0,56; р = 0,07).
Другое исследование показало, что уровень P-SEP существенно различался в группах выживших и умерших пациентов, среди групп пациентов с сепсисом, тяжелым сепсисом и септическим шоком. P-SEP был точнее, чем ИЛ-6, СРБ и РСТ, в оценке риска смерти в течение 30 дней с момента начала развития сепсиса. Когда пороговое значение P-SEP составляло 1622 пг/мл, а пороговое значение РСТ — 13,43 нг/мл, в группе РСТ 23 % выживших пациентов и 40 % умерших не попадали в соответствующие группы.
Основные принципы терапии сепсиса — это ранняя диагностика очага инфекции и раннее начало интенсивной терапии, в том числе антибактериальной (в течение 1 ч). Анализ на приборе PATHFAST (Япония) занимает 21 мин для обнаружения P-SEP, в качестве образцов в этом исследовании могут использоваться как цельная кровь с антикоагулянтами гепарином или этилендиаминтетраацетатом, так и сыворотка крови.
В нескольких исследованиях показано, что циркулирующие уровни P-SEP повышаются при развитии системных инфекций и сепсиса, вызываемых грамположительными, грамотрицательными и грибковыми инфекциями. P-SEP имеет 100 % чувствительность к инфекциям, подтвержденным гемокультурами. Исследования показали, что чувствительность P-SEP, РСТ, и ИЛ-6 составляет 95,5; 95,5 и 100 % у пациентов с грамположительной бактериальной инфекцией и 77,8; 86,1 и 88,9 % соответственно при грамотрицательной микрофлоре.
Чувствительность P-SEP существенно не различается между пациентами с грамположительной и грамотрицательной бактериальной инфекцией. Уровень P-SEP возрастал у больных с грибковой инфекцией, но не у пациентов с вирусной инфекцией. При вирусных инфекциях и при воспалительных процессах, не связанных с системными инфекциями, уровень P-SEP не повышался.
При развитии сепсиса повышение циркулирующих концентраций P-SEP происходит раньше и быстрее, чем других маркеров сепсиса, а именно в течение 1,5—2,0 ч после начала системного ответа на инфекцию — раньше, чем повышение цитокина ИЛ-6, РСТ и СРВ. Время полужизни P-SEP в крови составляет 0,5—1,0 ч. Поэтому при мониторинге его уровень быстро и надежно отражает степень эффективности терапии, что позволяет оперативно принимать объективные клинические решения.
Neutrophil CD64 — мембранный белок, гликопротеин, Fc-рецептор к мономерным иммуноглобулинам изотипа IgG с высокой аффинностью. CD64 постоянно экспрессирован только на макрофагах и моноцитах. Может экспрессироваться на гранулоцитах после активации клеток цитокинами, такими как интерферон-гамма и гранулоцитарный колониестимулирующий фактор. Наличие CD64 на поверхности нейтрофилов является признаком инфекции и сепсиса.
Метаанализы по клиническому применению данного маркера продемонстрировали уровни его чувствительности и специфичности 85 и 76 % соответственно. Открытым остается вопрос о возможности применения биологических маркеров в контроле эффективности эмпирически назначенной антибиотикотерапии ж у больных сепсисом.
В работе V. Nobre и соавт. (2008) сравнивали стандартный алгоритм назначения и отмены антибиотиков у больных сепсисом и алгоритм, ориентированный на уровень РСТ. Результаты демонстрируют, что при применении алгоритма, ориентированного на уровень РСТ, длительность антибиотикотерапии снижалась в среднем на 3,5 дня, время нахождения в отделении реанимации и интенсивной терапии уменьшалось в среднем на 2 дня. Различий в летальности в контрольной и основной группах не наблюдалось.
По результатам ретроспективного рандомизированного исследования A. Hohn и соавт. (2013), за исследуемый период времени с появления РСТ в клинической практике — с 2005 по 2009 г. — средняя продолжительность антибиотикотерапии у больных с хирургическим сепсисом снижалась на 24 ч, а продолжительность искусственной вентиляции легких — на 48 ч за год.
Хотя более высокая чувствительность и специфичность P-SEP по сравнению с РСТ у различных групп больных была продемонстрирована неоднократно, работы по клиническому использованию P-SEP при контроле эффективности антибиотикотерапии в доступной литературе не найдены.
Сепсис является жизнеугрожающей проблемой, на решение которой приходится значительная часть расходов здравоохранения. Это гетерогенный процесс с выраженной индивидуальной вариабельностью, что усложняет его диагностику и лечение. Биологические маркеры и их комбинации помогают верифицировать диагноз вовремя и контролировать эффективность процесса лечения. Определение алгоритма практического применения маркеров сепсиса является перспективной клинической задачей.
Читайте также:


