Липополисахарид связывающий белок сепсис
Кардиохирург, ученый, педагог и организатор науки, доктор медицинских наук (1973 г.), профессор (1982 г.), академик РАМН (1994 г.), академик РАН (2011 г.), заслуженный деятель науки РФ (1994 г.), лауреат Ленинской премии (1976 г.), Государственной премии СССР (1986 г.), Государственной премии РФ (2002 г.), Премии Правительства РФ (2003 г.).
В 1994 г. Л.А. Бокерия избран по конкурсу на должность директора НМИЦССХ им. А.Н. Бакулева. В 1998 г. одновременно становится директором Центра хирургической и интервенционной аритмологии МЗ РФ.
С 1994 г. является заведующим кафедрой сердечно-сосудистой хирургии Российской медицинской академии последипломного образования (РМАПО) МЗ РФ. С 1995 г. заведует созданной им кафедрой сердечно-сосудистой хирургии № 2 Московской медицинской академии (ныне Первого МГМУ) им. И.М. Сеченова МЗ РФ.
С 2003 г. возглавляет кафедру сердечно-сосудистой хирургии и интервенционной кардиологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова МЗ РФ.
Л.А. Бокерия выполняет весь известный арсенал операций на сердце при самой разнообразной патологии: от 3 до 6 операций в день, то есть от 700 до 900 операций с использованием искусственного кровообращения в год.
С 1996 г. он является главным кардиохирургом МЗ РФ.
Л.А. Бокерия – автор и соавтор свыше 3700 научных публикаций, в том числе более 250 книг, более 100 изобретений и полезных моделей, более 300 программ и баз данных для ЭВМ, ряд которых зарегистрированы за рубежом, по различным проблемам сердечно-сосудистой хирургии, кардиологии, медицинского образования и организации медицинской науки.
Л.А. Бокерия принадлежат уникальные работы по теоретическому обоснованию и клиническому использованию метода гипербарической оксигенации в хирургии сердца и сосудов. Он крупнейший специалист в области диагностики и хирургического лечения нарушений ритма и проводимости сердца (особенно тахиаритмий), включая различные сочетания сердечных аритмий с врожденными и приобретенными пороками и аномалиями развития сердца, коронарной болезнью.
Л.А. Бокерия является инициатором развития и другого нового раздела кардиохирургии в нашей стране – минимально инвазивной хирургии сердца. Большой вклад внес Л.А. Бокерия в решение проблемы хирургического лечения ИБС.
Велика роль Л.А. Бокерия в разработке новых подходов к хирургическому лечению терминальной сердечной недостаточности. Его заслугой является разработка новых операций у тяжелой категории кардиохирургических больных с различными формами кардиомиопатий. Он первым развил концепцию динамической кардиомиопластики, в том числе и у детей. Л.А. Бокерия выполнил первую в нашей стране имплантацию искусственного желудочка сердца и после большого перерыва инициировал возобновление в Центре выполнения операций по трансплантации сердца.
По инициативе Л.А. Бокерия в клиническую практику внедрены передовые технологии диагностики и реконструктивной хирургии заболеваний восходящего отдела и дуги аорты.
Он генерировал развитие и другого направления современной медицинской науки – креативной кардиологии, которая определяет необходимость созидательного сотрудничества врачей разных специальностей: кардиологов, кардиохирургов, специалистов по функциональной диагностике, фундаментальным и прикладным дисциплинам.
Под руководством Л.А. Бокерия в Центре разрабатываются и внедряются в клиническую практику новые высокотехнологичные принципы профилактики и лечения больных с сердечно-сосудистой патологией – использование методов генной и клеточной терапии.
Л.А. Бокерия активно занимается методологией медицинской науки и педагогической деятельностью. Он является создателем крупнейшей в стране кардиохирургической школы, воспитавшим не одно поколение врачей – кардиохирургов, кардиологов, реаниматологов и специалистов других смежных специальностей.
Л.А. Бокерия – действительный член Американской ассоциации торакальных хирургов (1991 г.), член правления (1992 г.) и член Президиума (с 2003 г., консул) Европейского общества грудных и сердечно-сосудистых хирургов, член правления Европейского общества сердечно-сосудистых хирургов, член научного правления Международного кардиоторакального центра Монако (1992 г.), член Сербской академии наук (1997 г.), почетный член Американского колледжа хирургов (1998 г.), академик АМН Украины, почетный профессор МГУ им. М.В. Ломоносова (2011 г.), иностранный член Национальной Академии наук Грузии (2012 г.).
Полезная информация для каждого
Пресепсин (sCD14-ST) - укороченный sCD14.
В 2005 г. в крови септических пациентов была обнаружена ранее неизвестная форма sCD14. Было показано, что при бактериальной инфекции в составе комплекса sCD14–ЛПС–ЛСБ под действием циркулирующей протеазы от sCD14 отщепляется пептидный фрагмент. В результате образуется укороченная форма sCD14 из 64 аминокислотных остатков, первоначально названная субтипом sCD14 (subtype sCD14-ST) и затем переименованная в пресепсин. Пресепсин (ПСП) – это белок с молекулярной массой 13 кДа, содержащий N-терминальный фрагмент CD14 и не содержащий С-терминальный участок, ответственный за связывание с ЛПС. Неожиданно было обнаружено, что у кроликов с индуцированным сепсисом и у септических пациентов уровни ПСП резко повышены, что указывало на перспективность ПСП как маркера сепсиса.
Механизм образования ПСП.
Специальные эксперименты показали, что воспаление, индуцированное у кроликов с помощью препаратов ЛПС, не содержащих бактерий, не сопровождалось повышением уровня ПСП в крови, а сепсис, вызваный перевязкой и пункцией слепой кишки (cecal ligation and puncture – CLP) и инфицированием жизнеспособными бактериями, вызывал существенный рост концентрации ПСП (рис.1). Это привело к пониманию того, что для образования ПСП лейкоцитами одного лишь действия эндотоксина недостаточно, необходима активация фагоцитоза. Дальнейшие исследования показали, что факторы, стимулирующие фагоцитоз, активируют и образование ПСП, а ингибирующие факторы, напротив, подавляют его образование. Таким образом – ПСП – это гуморальный фактор, специфичный для фагоцитоза.
Актуальность ранней и точной диагностики сепсиса.
Каждый год в мире регистрируется 18 миллионов случаев сепсиса, 30% из них закачиваются летальным исходом. Надежды, что с развитием санитарно-гигиенических мер динамика сепсиса пойдет вниз, оказались тщетными. Только в США с 1979 по 2000 гг. среди 750 млн. случаев госпитализации зарегистрировано 10 319 418 случаев сепсиса. Ежегодный прирост частоты сепсиса — 8,7%, от 164 000 в 1979 г. (82,7 на 100 000 человек) до 660 000 в 2000 г. (240,4 на 100 000 человек). 50% летальных исходов в американских отделениях интенсивной терапии происходят именно из-за сепсиса (2). Одна из основных причин этой удручающей картины – трудности своевременной и точной постановки диагноза сепсиса.
Пресепсин достаточно высокоэффективный маркер сепсиса, что подтверждается следующими случаями:
Наблюдалось 140 септических пациентов, поступивших в отделение неотложной терапии (ОНТ), контрольная группа включала 119 здоровых лиц. Уровень ПСП и ПКТ определяли при поступлении, через 24 и 72 ч. Для оценки тяжести сепсиса фиксировались 30-дневная летальность, необходимость интенсивной терапии, искусственной вентиляции легких (ИВЛ), диализа. Среднее значение ПСП (пг/мл) составило: в контрольной группе — 159 (148-171), у пациентов — 2563 (1458-3669). В течение 72 ч у пациентов с будущими неблагоприятными исходами уровни ПСП возрастали, а у пациентов, у которых таких исходов не было – снижались.
Уровень ПСП, соответствующий 99-й процентили, не зависел от пола и возраста и составил 320 (238-335) пг/мл. Значения ROС AUC (receiver operating characteristics curve) при оценке тяжести сепсиса составляли: для ПСП — 0,71 (0,62-0,78), для ПКТ — 0,64 (0,55-0,72). Дискриминирующая способность ПСП по отношению к нетяжелому сепсису (n=85), тяжелому сепсису или септическому шоку
(n=55) хорошо соответствовала значениям шкалы APACHE II и оказалась выше таковой для ПКТ (APACHE II — Acute Physiology And Chronic Health Evaluation шкала оценки острых и хронических функциональных изменений). 30-дневная летальность при нетяжелом сепсисе составила 3,5%, при тяжелом – 25%, при септическом шоке — 67%. Она возрастала от 2,7% в первой квартили ПСП до 39,4% в четвертой (табл. 1)
Весьма интересным оказался следующий клинический случай. Пациент Н., возраст 51 год, поступил с обширными ожогами (76% поверхности тела). При поступлении отмечался лейкоцитоз — 38880/мкл, гемокультура отрицательная, уровни ПСП и ПКТ — ниже пограничных (281 пг/мл и 0,98 нг/мл соответственно). Был поставлен диагноз ССВО.
При развитии грамположительного сепсиса ПСП начинает повышаться на 6-й день, а ПКТ – лишь на 14-ый.
Научный обзор пресепсина.
Научный обзор, посвященный пресепсину (ПСП) — новому и весьма перспективному маркеру сепсиса. Рассматриваются патофизиологический механизм образования пресепсина при активации макрофагов и при фагоцитозе и связь уровней ПСП с тяжестью сепсиса. Основная цепь событий, ведущих к синтезу ПСП, такова;
а) мембранный рецептор моноцитов / макрофагов mCD14 после связывания с эндотоксинами активирует провоспалительный ответ и затем,
б) отщепляется от макрофагов и в растворимой форме (как sCD14) выходит в циркуляцию,
в) после активации фагоцитоза лизосомальные протеиназы расщепляют sCD14 с образованием фрагмента sCD14-ST, который получил название пресепсин.
Многочисленные исследования показывают, что ПСП является специфическим маркером сепсиса и быстро повышается в ответ на повышение его тяжести. При воспалительных процессах, не связанных с фагоцитозом, ПСП не повышается. Поскольку ПСП – это гуморальный фактор, выделяемый фагоцитами при фагоцитозе, его использование весьма перспективно не только для диагностики и мониторинга сепсиса, но и для научных исследований, включающих выявление факторов, стимулирующих или ингибирующих фагоцитоз при различных патологиях, а также для поиска (скрининга) препаратов, влияющих на фагоцитоз.
Лабораторная диагностика сепсиса: успехи и проблемы.
ССВО (синдром системного воспалительного ответа) диагностируется при наличии 2-х или более признаков из 4-х:
· 1) лейкоцитоз >12000 или 10%;
· 2) частота сердечныхсокращений > 90 в мин;
· 3) частота дыхания > 20 в мин;
· 4) температура тела >38°или ПРОКАЛЬЦИТОНИН
Больные пневмогенным сепсисом (2)
Больные абдоминальным сепсисом (3)
ПКТ при поступлении
ПКТ у всех больных
ПКТ при поступлении у больных ВП, пневмогенным, абдоминальным сепсисом и другими воспалительными заболеваниями не различался.
ПКТ через 5 и более дней после поступления у больных ВП составил 0,2 ± 0,04; n = 9, что было ниже, чем у больных с другими воспалительными заболеваниями — 3,4 ± 1,43; n = 9 (р прокальцитонин -> кальцитонин). Кроме этой, другой биологической функции он не имеет и норме в крови не практически не обнаруживается.
ПКТ при воспалительных процессах – маркер сепсиса. Если суммировать результаты многочисленных исследований, то текущая картина такова: при воспалительном процессе, вызванном бактериальными и грибковыми инфекциями, а также простейшими, уровень ПКТ в крови возрастает в течение 6-12 часов. При этом концентрация кальцитонина не повышается, то есть в данном случае ПКТ
прогормоном кальцитонина не является.
Существенно, что при инфекции:
КЛИНИЧЕСКАЯ ЦЕННОСТЬ ПРОКАЛЬЦИТОНИНА
Определение уровней РСТ в сыворотке и плазме крови по данным разных авторов может быть полезным в следующих ситуациях :
• В качестведиагностики сепсиса, септического шока и тяжелых бактериальных инфекций. Для дифференциального диагноза инфекционной и неинфекционной этиологии лихорадки неясного генеза.
• Для мониторинга состояния больных с сепсисом, шоком; оценки эффективности проводимого лечения; оценки прогноза для данного больного.
• PCT подходит для ранней диагностики инфекционных осложнений :
1. Хирургических пациентов
2. Пациентов интенсивной терапии
3. Реципиентов после пересадки
4. Пациентов на искусственной вентиляции
5. Пациенты с иммуносуперссией
6. Пациенты с нейтропенией
7. Пациенты с заболеваниями неясного генеза
• PCT можно ииспользовать для дифференциального диагноза:
1. Инфекционной и неинфекционной этиологии (например. ОРДСВ, острого панкреатита)
2. Бактериальных и вирусных инфекционных заболеваний (например острого менингита, сепсиса новорожденных)
3. Острых бактериальных инфекций и хронических воспалительных процессов например аутоиммунных заболеваний
4. Реакций против трансплантанта и инфекционных осложнений бактериальной и грибковой природы
• Уровни РСТ повышаются также при тяжелой пневмонии, перитоните, бактериальном менингите.
• Кроме того, уровни РСТ могут повышаться при малярии, мелиодозе, системных грибковых инфекциях.
Прокальцитонин был впервые описан в 1984 году как белок, состоящий из 116 аминокислот и имеющий молекулярную массу 14.5 кDa. Первоначально РСТ привлек внимание исследователей в качестве возможного маркера злокачественных новообразований. Bohuon с соавторами в институте G. Roussy изучали кальцитонин как маркер медуллярного рака щитовидной железы и параллельно начали изучать информативность предшественников кальцитонина, для чего были получены моноклональные антитела к РСТ и разработан радиоиммунометрический тест для определения его концентрации. Эта же группа исследователей выявила, что концентрации прокальцитонина повышены у больных с мелко-клеточной карциномой легкого, что свидетельствовало о том, что РСТ вырабатывается не только в щитовидной железе.
С начала 1990-х к прокальцитонину приковано внимание исследователей, которые пытаются выяснить – является ли он специфическим маркером инфекции. Впервые данные о повышении концентрации РСТ в крови при воспалении были получены группой французских военных врачей (Dr. Carsin и др.), которые изучали маркеры острого повреждения легкого, у больных с обширными ожогами. В качестве потенциально полезного маркера в исследовании также изучался РСТ и было выявлено, что концентрации его были во многих случаях значимо повышены и часто были во много раз выше, чем концентрации при новообразованиях. Ретроспективный анализ выявил, что у больных с наиболее высокими уровнями РСТ в крови, развились инфекционные осложнения, в том числе сепсис и септический шок. Такие результаты впервые позволили установить взаимосвязь между уровнем РСТ в крови и наличием системного воспаления.
Следующим было исследование уровней РСТ в крови у детей с менингитом. Было обнаружено, что уровень РСТ заметно повышен у детей с бактериальным, а не вирусным менингитом, после чего данные были опубликованы. В дальнейшем большое количество исследователей в разных странах изучали роль прокальцитонина в качестве маркера тяжелой инфекции, а также как медиатора системного воспаления.
Первоначально, РСТ мог быть получен только в небольших количествах путем сложного синтетического процесса. В настоящее время на материале E. Coli получен рекомбинантный РСТ, разработаны чувствительные и специфичные методы измерения концентрации РСТ.
ФУНКЦИИ ПРОКАЛЬЦИТОНИНА В НОРМЕ И ПРИ ПАТОЛОГИИ
В нормальной физиологии, единственная роль, установленная для PCT – это роль предшественника кальцитонина. Кальцитонин, как известно, регулирует метаболизм костей и кальция, а также ингибирует резорбцию кости остеокластами. Ранее предполагали, что кальцитонин (CT), названный так за гипокалиемический эффект, имеет исключительно тиреоидное происхождение и играет важную роль в скелетном гомеостазе. Однако было выявлено, что при тиреоидектомии у людей не происходит никаких значительных патологических последствий в отношении гомеостаза кальция, и плотность костей в большинстве случаев остается прежней. Таким образом, физиологические функции зрелого CT у человека пока еще остаются неизвестными, не были также до сих пор определены нарушения, которые возникают в организме при избытке или дефиците зрелого кальцитонина.
По традиционным представлениям в эндокринологии, предшественники кальцитонина вырабатываются главным образом в нейроэндокринных C-клетках щитовидной железы. В отсутствие инфекции, экстратиреоидная транскрипция CALC-I гена подавлена и огранивается селективной экспрессией в нейроэндокринных клетках, обнаруживаемых главным образом в щитовидной железе и легком. В этих нейроэндокринных клетках синтезируется зрелый гормон и запасается в секреторных гранулах.
При тяжелой системной инфекции, прокальцитонин продуцируется тканями вне щитовидной железы. Это подтверждается тем, что у пациентов, которые предварительно подверглись тотальной тиреоидектомии все равно, продуцируются высокие уровни прокальцитонина в течение тяжелой инфекции. Кроме тканей щитовидной железы РСТ продуцируется атипичными клетками мелкоклеточной карциномы легкого.
Кальцитонин и родственные пептиды обнаруживаются у человека в нейроэндокринных клетках легкого. Было выявлено, что м-РНК прокальцитонина экспрессируется у человека в мононуклеарах периферической крови, а липополисахарид оказывает на эту экспрессию заметный стимулирующий эффект. Моноциты, выделенные из крови больных с септическим шоком показывали более высокий базальный уровень и увеличение содержания РСТ в ответ на стимуляцию липополисахаридом. Примерно треть нестимулированных лимфоцитов содержат иммунологически демонстрируемые количества РСТ, однако в данном случае было отмечено лишь незначительное индуцирование синтеза бактериальным липополисахаридом. В других исследованиях периферические мононуклеары крови не демонстрировали выработки РСТ в ответ на стимуляцию липополисахаридом. Причины таких расхождений пока не известны. Инкубация срезов человеческой печени с интерлейкином-6 и фактором некроза опухоли альфа демонстрировали увеличение концентрации РСТ более чем в 2 раза, в то время, как концентрации протеина сывороточного амилоида А (SAA) и С-реактивного протеина (CRP) увеличивались лишь умеренно и только в ответ на стимуляцию ФНО-?. Возможно также острофазовое происхождение в печени.
Некоторые авторы считают, что микробная инфекция стимулирует повсеместное увеличение экспрессии CALC-I гена и индукцию CTпр во всех тканях и типах клеток организма. Таким образом, при септических состояниях весь организм может рассматриваться как эндокринная железа. Установлено, что транскрипционная экспрессия CT-мРНК более стабильно индуцируется при сепсисе, чем м-РНК классических цитокинов (например. TNF-a и IL-6). Наибольшая индукция СТпр м-РНК и выделение CTпр пептидов происходит в паренхиматозных клетках, а не в циркулирующих клетках, что возможно указывает скорее на тканевые механизмы защиты, чем на лейкоцитарные, поэтому была предложена гипотеза, что продукты CALC-генов являются прототипами гормокиновых медиаторов и могут индуцироваться как классической гормональной экспрессией так и, альтернативно, путем цитокино-подобной экспрессии. Продукция гормокинов индуцируется неизвестными пока еще факторами и может быть вызвана как непосредственно воздействием микробных токсинов так и косвенно, через гуморальный или клеточный ответ хозяина. При сепсисе, Спр являются продуктом физиологичного синтеза, а доминирование CTпр по отношению к зрелому CT является следствием преобладания клеток, испытывающих недостаток секреторных гранул и следовательно требующих значительной ферментной обработки. Следовательно, как и большинство цитокинов, СТпр накапливаются внутриклеточно лишь в очень небольшом количестве при сепсисе.
Weglohner и др. исследовали первичную структуру сывороточного PCT у пациентов с сепсисом. Были собраны сыворотки, содержащие высокие концентрации PCT (> 100 ng/ml) от 22 пациентов с тяжелым сепсисом и были объединены для дальнейшей очистки. Объединенный PCT был очищен на CT 21-иммуноаффинной колонке, затем очищен обратной фазой HPLC, и полученный чистый PCT был обработан эндопротеиназой Asp-N. Отщепление N-терминала показало, что первые две аминокислоты (Ala-Pro) в изучаемом пропептиде отсутствовали. Было продемонстрировано, что PCT в сыворотке пациентов с сепсисом является пептидом, состоящим только из 114 аминокислот, вместо 116 аминокислот, что связано с недостатоком в N-терминале дипептида Ala-Pro.
Также как и у людей, у хомяков при сепсисе увеличиваются уровни CTпр. В исследовании Nylen с соавт. сепсис индуцировался у хомяков внутрибрюшинным введением шариков, содержащих 5 x l08 кфе Escherichia coli. Во время внедрения шарика, животным вводилось также 3 мг человеческого РСТ или эквивалентный объем альбумина сыворотки. Они наблюдались в течение 72 часов. При этом исследовалась смертность в качестве первичного показателя исхода. В результате, у контрольных животных с перитонитом и получивших альбумин смертность через 48 часов составила 50 %, а смертность к 72 часам — 56 %. У экспериментальных животных с перитонитом, которым ввели РСТ смертность через 48 часов составила 87 % (p
Первая частная лаборатория, выполняющая полный спектр микробиологических исследований на территории Перми и Пермского края. Лаборатория оснащена современным оборудованием, персонал лаборатории – врачи и лаборанты высшей квалификационной категории, что позволяет нам гарантировать высокий уровень и качество выполнения анализов.
Подпишитесь на рассылку, чтобы получать новости сайта
Пресепсин: новый биомаркер для прогнозирования и диагностики сепсиса
Пресепсин: новый биомаркер
для прогнозирования и диагностики сепсиса
Иошиказу Окамура, Ральф Томэ
Департамент исследований и разработок Митсубиси Кемикл Медиенс Корпорэйшн,
Yoshikazu Okamura, Ralf Thomae, R&D Department, Research and Development Division, Mitsubishi Chemical Medience Corporation,
Сепсис – это крайне серьезное заболевание, характеризующееся синдромом
системного воспалительного ответа (ССВО), связанным с инфекцией. Сепсис
регистрируется у 1-2% всех госпитализированных пациентов и у 25% пациентов
отделений интенсивной терапии (ОИТ). Смертность при сепсисе составляет 20%, при
тяжелом сепсисе – 40%, при септическом шоке – более 60%. Диагностика сепсиса
основана на международных согласованных критериях [1, 2]. Прогнозирование
течения и исходов сепсиса оценивается по шкале MEDS (Mortality in Emergency
Department Sepsis) [3]. 20-35% пациентов с тяжелым сепсисом и септическим шоком
умирают в течение 30 дней после начала его развития. Шкала прогностической
стратификации критических пациентов APACHE II позволяет оценивать риск
смертности при тяжелом сепсисе. Септический шок – сильный предиктор смертности,
как в краткосрочном, так и в долгосрочном масштабе. Лечение сепсиса базируется на
антибиотикотерапии, хирургическом дренировании инфицированных жидкостей и на
мероприятиях по снижению дисфункции органов, которые могут включать гемодиализ
при почечной недостаточности, искусственную вентиляцию при легочной
недостаточности, трансфузию продуктами крови, мероприятия по нормализации
кровообращения и др.
Серьезной проблемой в лечении сепсиса является задержка начала
адекватной антибиотикотерапии. Результаты многочисленных исследований
показывают, что каждый час задержки начала введения адекватных антибиотиков
приводит к повышению смертности на 7% [4, 5].
Биомаркеры сепсиса. Различные методы идентификации микроорганизмов,
связанных с развитием сепсиса (микроскопия мочи, люмбальная пункция,
гемокультуры, высевы мокроты и др.) могут занимать несколько дней, что может
приводить к опасной задержке проведения жизненно важных мероприятий. Для
решения этой проблемы необходимы новые тесты, которые были бы способными
сразу при поступлении пациента с подозрением на сепсис давать врачу точную
информацию о наличии сепсиса, о его тяжести и о текущем прогнозе его развития.
Идеальный маркер сепсиса должен также обеспечивать надежный мониторинг
эффективности терапии и оперативно менять ее тактику.
Традиционные маркеры сепсиса, такие как С-реактивный белок,
прокальцитонин, лактат, эндотоксин и др. не отвечают вышеперечисленным
требованиям. Однако недавние клинические исследования нового биомаркера,
названного пресепсином, показали, что он является многообещающим ранним и
прогностическим маркером сепсиса [6, 7].
Пресепсин (ПСП) – это белок (мол. масса 13 КДа) являющийся N-концевым
фрагментом рецептора макрофагов CD14. CD14 – это белок, существующий в двух
формах: 1) связанной с мембраной (mCD14) и присутствующей на поверхности
макрофагов, моноцитов и гранулоцитов и 2) в растворимой (sCD14, s – soluble,
растворимый), циркулирующей в кровотоке. mCD14 – рецептор, ответственный за
трансдукцию эндотоксинового сигнала внутрь клеток. Выход mCD14 в кровоток и
образование sCD14 связаны с инфекцией и с некоторыми другими патологическими
состояниями. При активации бактериального фагоцитоза sCD14 и mCD14
расщепляются лизосомальными протеиназами с образованием фрагмента, исходно
названного sCD14-subtype (sCD14-ST), а потом переименованного в пресепсин [6, 7].
Один из механизмов образования ПСП связан с бактериальным фагоцитозом и
расщеплением mCD14 лизосомальными ферментам (рис. 1) [8].
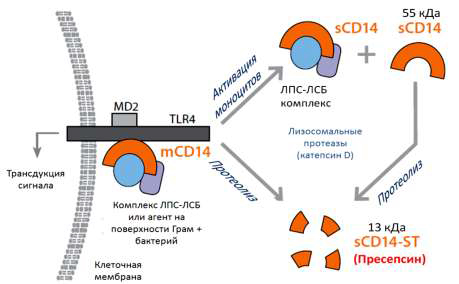
Рис. 1. Механизм образования ПСП.
mCD14 – СD14, связанный с мембраной, sCD14 – растворимый CD14, sCD14-ST – пресепсин, ЛПС –
липополисахарид, ЛСБ – липополисахарид связывающий белок, TLR4 – толл-подобный рецептор 4; MD2 – белок,
связанный с TLR4. Подробности в тексте.
Показано, что ПСП повышается в связи с инфекцией и специфически
продуцируется при сепсисе, связанном с грамотрицательными и
грамположительными бактериями, с грибками, при вирусных инфекция ПСП не
продуцируется [9, 10]. Недавно был разработан новый диагностический инструмент –
хемилюминесцентный иммуноферментный анализатор PATHFAST, который _______за 17
мин проводит полностью автоматические измерения важнейших биомаркеров
различных критических состояний и в особенности – пресепсина.
Эффективность ПСП для диагностики сепсиса. Измерения уровней ПСП при
разных патологических состояниях помощью экспресс-анализатора PATHFAST
показали, что этот маркер является высоко специфическим по отношении к сепсису
[7]. Анализ чувствительности и специфичности ПСП, проведенный в различных
исследованиях, продемонстрировал, что он обеспечивает: 1) раннюю диагностику
сепсиса непосредственно при поступлении пациента, 2) прогнозирование течения
заболевания и 3) оценку риска неблагоприятных исходов. Согласно результатам
клинических исследований уровни ПСП имеют сильную связь со степенью тяжести
сепсиса и 30-дневной смертностью.
В недавнем проспективном исследовании 859 пациентов с ССВО, поступивших
в отделения неотложной терапии (ОНТ) подтверждено, что ПСП – высоко
эффективный биомаркер, действительно пригодный для ранней диагностики сепсиса,
стратификации риска, мониторинга терапии и прогнозирования исходов у септических
пациентов [11]. Данное исследование показало, что одновременное измерение
уровней ПСП и оценка тяжести пациентов с помощью шкал MEDS и APACHE II
значительно улучшает точность прогнозирования развития тяжелого сепсиса.
Предварительные исследования показали также, что ПСП – весьма
перспективный маркер неонатального и педиатрического сепсиса [12].
К сожалению, несмотря на широкое применение современных антибиотиков и
высокотехнологичных методов реанимации, сепсис все еще является главной
причиной смертности пациентов в ОНТ и в ОРИТ, поэтому ранняя диагностика
сепсиса сразу при поступлении пациентов – ключевой момент для повышения
выживаемости таких больных. ПСП - многообещающий маркер для решения этой
Эффективность ПСП для прогнозирования сепсиса. При сепсисе
повышение ПСП сильно связано с повышением риска неблагоприятного исхода, а
снижение – с повышением шансов выживания. Более того, как показано в
специальном исследовании, именно ПСП, по сравнению с другими маркерами
сепсиса, наилучшим образом отражает динамику тяжести сепсиса (рис. 2) [13].
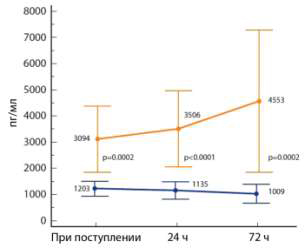
Рис. 2. Динамика ПСП у септических пациентов
с благоприятным исходом (внизу) и у не выживших (вверху).
Недавнее многоцентровое ретроспективное рандомизированное исследование,
в котором наблюдались пациенты, поступившие в ОИТ с сепсисом и септическим
шоком, показало, что уровни ПСП адекватно отражают изменение тяжести патологии
у впоследствии выживших и не выживших пациентов [14].
1.Согласно существующей практике, измерение широко используемых
маркеров сепсиса проводится в центральной лаборатории, что ведет к существенной
задержке получения срочной и жизненно важной диагностической информации.
2. Ни один из ныне широко используемых маркеров сепсиса не сочетает в себе
возможности для ранней диагностики сепсиса, стратификации рисков, с ним
связанных, прогнозирования и мониторинга течения сепсиса.
3. Пресепсин – новый, многообещающий маркер, который позволяет через 17
минут после взятия крови проводить:
а) раннюю и точную дифференциальную диагностику ССВО и сепсиса,
б) оценку тяжести сепсиса,
в) оперативный мониторинг эффективности его терапии,
г) прогнозирование его исхода, особенно эффективное при параллельной
оценке тяжести пациента согласно шкалам APACHEII, SOFA и MEDS.
4. Измерение уровней ПСП возможно оперативно проводить непосредственно
при поступлении пациента в ОНТ, ОИТ, ОРИТ и в операционном блоке (тестирование
Point-of-Care), что обеспечит своевременное принятие обоснованных клинических
Диагностические уровни пресепсина, пг/мл
| Уровень ПСП, пг/мл | Клинический диагноз |
| Сепсис может быть исключен. | |
| ≥300 | Системная инфекция (сепсис) возможны. |
| ≥500 | |
| ≥1000 | Высокий риск развития системной инфекции (тяжелого
сепсиса / септического шока). Высокий риск 30-дневной смертности, сравнимый с таковым 1. Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003;31(4):1250-6. 2. Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101(6):1644-55. 3. Shapiro NI, Wolfe RE, Moore RB, et al. Mortality in Emergency Department Sepsis (MEDS) score: A prospectively derived and validated clinical prediction rule. Crit Care Med. 2003;31(3):670-5. 4. Kumar A, Roberts D, Wood KE, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006;34(6):1589-96. 5. Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41(2):580-637. 6. Shozushima T, Takahashi G, Matsumoto N, et al. Usefulness of presepsin (sCD14-ST) measurements as a marker for the diagnosis and severity of sepsis that satisfied diagnostic criteria of systemic inflammatory response syndrome. J Infect Chemother. 2011;17(6):764-9. 7. Spanuth E, Wilhelm J, Loppnow H, et al. Diagnostic and Prognostic Value of Presepsin (Soluble CD14 Subtype) in Emergency Patients with Early Sepsis Using the New Assay PATHFAST Pesepsin. IFCC World Lab/EuroMedLab. 2011 May. 8. Naitoh K, Shirakawa K, Hirose J, et al. The new sepsis marker, sCD14-ST (PRESEPSIN), induction mechanism in the rabbit sepsis models. SEPSIS 2010; poster:P-19. 9. Yaegashi Y, Shirakawa K, Sato N, et al. Evaluation of a newly identified soluble CD14 subtype as a marker for sepsis. J Infect Chemother. 2005;11(5):234-8. 10. Kojika M, Takahashi G, Matsumoto N, et al. Serum levels of soluble CD14 subtype reflect the APACHE II and SOFA Scores. Medical Postgraduates 2010;48(1):46-50. 11. Liu B, Chen YX, Yin Q, et al. Diagnostic value and prognostic evaluation of Presepsin for sepsis in an emergency department. Crit Care. 2013;17(5):R244. 12. Mussap M, Puxeddu E, Burrai P et al. Soluble CD14 subtype (sCD14-ST) presepsin in critically ill preterm newborns: preliminary reference ranges. J Matern Fetal Neonatal Med. 2012;25(Suppl 5):51-3. 13. Endo S, Suzuki Y, Takahashi G, et al. Presepsin as a powerful monitoring tool for the prognosis and treatment of sepsis: A multicenter prospective study. J Infect Chemother. 2013, 14. Masson S, Caironi P, Spanuth E, et al. Presepsin (soluble CD14 subtype) and procalcitonin levels for mortality prediction in sepsis: data from the Albumin Italian Outcome Sepsis trial. Crit Care. 2014;18(1):R6. Читайте также:
|


