Набор для твердофазной иммуноферментной диагностики африканской чумы свиней








ЛАБОРАТОРНАЯ ДИАГНОСТИКА АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ
Отбор проб для вирусологических исследований. Для обнаружения вируса африканской чумы свиней, антигена или генома от павших или убитых с диагностической целью свиней отбирают массой 5-10 г - селезёнку (1/3 часть), портальные, желудочные и подчелюстные (или мезентериальные) лимфоузлы (целиком), лёгкое (5х5 см) и почку (1/3 часть), 3-5 мл крови (или сгусток). Кроме того, рекомендуется в случае аутолизиса трупа отбирать грудинную или трубчатую кость.
Отбор проб для серологических исследований. Минимальное количество проб, которые должны быть отобраны для серологических исследований, рассчитывают с учётом 10%-ой серопревалентности заболевших с 95%ой достоверностью для обследования каждого помещения.
Пробы крови отбирают их полой вены не менее 10 мл от каждой свиньи [3].
Для лабораторных исследований применяют следующие методы: реакцию гемадсорбции (РГАд) в культурах клеток, реакцию прямой иммунофлюоресценции (РПИФ), полимеразную цепную реакцию (ПЦР) в формате электофорезной детекции, ПЦР в формате реального времени, применяют твёрдофазный иммуноферментный анализ (ТФ – ИФА) (сэндвич-вариант). В сомнительных случаях окончательный диагноз устанавливают заражением подозрительным материалом (кровь, суспензия селезенки и лимфатических узлов) свиней, вакцинированных против классической чумы. Заражение свиней (биопроба) проводят в специализированной лаборатории с соблюдением особых мер предосторожности. Серологические типы вируса определяют в реакции преципитации (РП), реакции связывания комплемента (РСК), реакции задержки геамадсорбции (РЗГАд) и другими методами. [2]
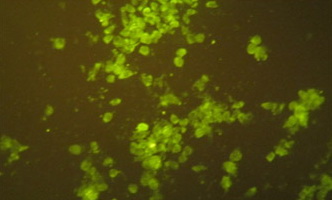
Реакция прямой иммунофлуоресценции (РПИФ) ставят в вирусологических лабораториях для прямого обнаружения вирусного антигена в клетках органов свиней, подозреваемых в заражении вирусом африканской чумы свиней. Внутриклеточный антиген обнаруживают люминесцентной микроскопией препаратов мазков-отпечатков, окрашенных ФИТЦ-иммуноглобулинами (специфические антитела к вирусу африканской чумы свиней, меченные флуоресцеинизотиацианатом). Лучшими органами для РПИФ являются селезёнка и лимфоузлы. Исследование может быть выполнено в течение 2-4 час [2].
Оценку результатов микроскопии проводят по условной четырех крестовой шкале при окуляре 10х20-объективе 10. В положительных случаях наблюдают сверкающую, желто-зеленого цвета флуоресценцию клеток с включениями или очаговыми флуоресцирующими комплексами диффузного и гранулярного антигена, в одном из 10-50 полей зрения.
При визуальном учёте реакцию считают положительной при окрашивании хромогенного субстратного раствора в лунках, в которых предварительно инкубировали исследуемые и специфический антиген в сине-зеленый цвет и отсутствии окрашивания субстрата в лунках, в которых предварительно инкубировали нормальный антиген.
Анализ по выявлению вируса АЧС включает выделение ДНК и амплификации специфического фрагмента в полимеразной цепной реакции и электрофорез в агарозном геле [3].
Реакция считается положительной, если полоса в соответствующем треке располагается в геле точно на таком же расстоянии от старта, что и полоса положительного контроля амплификации. Размер апликонов после проведения ПЦР- 485 п.н.
Реакция считается отрицательной, если в соответствующих треках полос не обнаружено или полосы не соответствуют по размеру фрагменту в контрольной пробе (т. е. располагаются на другом расстоянии от старта) [4].
Для обнаружения антигена вируса африканской чумы свиней применяют ПЦР в формате реального времени. Реакции заключается в использовании специфического флюоресцентно-меченного зонда, сайт гибридизации которого лежит между сайтами связывания основных диагностических праймеров. В случае присутствия в исследуемом образце генома возбудителя, зонд будет связываться с его ДНК и прибор регистрирует накопление флуоресцентного сигнала в ходе реакции. Регистрация сигнала происходит через стенки пробирки в режиме реального времени [1].
Учёт результатов проводят по анализу кривых накопления флуоресцентного сигнала по каналу FAM с помощью программного обеспечения используемого прибора.
Положительными считают результаты реакции при значениях Ct, не превышающих 35.
Образцы, для которых не определено значение Ct (кривая флуоресценции не пересекает пороговую линию) – результаты считают отрицательными [4].
Белоусова Л.В., Троценко Н.И., Преображенская Э.А. Практикум по ветеринарной вирусологии. М.: КолосС, 2006. — 248 с [Текст] с.131-140.
Госманов Р.Г., Колычев Н.М. Ветеринарная вирусология М.: KoлoсC, 2006. — З04 c. [Текст] с.151-153.
Инфекционные болезни животных / Б.Ф. Бессарабов, А.А., Е.С. Воронин и др.; Под ред. А.А. Сидорчука. - М.: Колосс, 2007.-671с [Текст] с.206-275.
Шевченко А.А., Шевченко Л.В., Черных О.Ю., Шевкопляс В.Н. Лабораторная диагностика инфекционных болезней животных. Учебное пособие. Краснодар. – 2009. – 575 С. [Текст] с.340-402
Вид животного: Свиньи
Тип оборудования: Тесты
Область применения: Диагностика животных
Производитель: НИИ ДПБ
Оставить заявку
или проконсультироваться по телефону:
Набор предназначен для определения антигенов вируса африканской чумы свиней (АЧС) в сыворотке крови, цельной крови, селезенке, печени и лимфатических узлах от инфицированных, больных и павших животных, а также в инфицированных культурах клеток.
Бесплатное обучение Использованию прибора
Сервисное обслуживание Диагностика, калибровка, поверка, расходные материалы
Доставка по РФ Транспортная компания, самовывоз, транспорт нашей компании
Наглядные пособия:
Видео обзор:
Описание
Оплата
Доставка
Сервис
1. Планшет для иммуноферментного анализа с адсорбированными в лунках моноклональными антителами к белку VP 73 вируса АЧС — 1 штука.
2. Положительный контроль (К+) – рекомбинантный белок VP 73 вируса АЧС, жидкость от розового до красного цвета, 1,0 см 3 -1 флакон.
3. Отрицательный контроль (К-) — буферный раствор, не содержащий антиген вируса АЧС, жидкость от голубого до синего цвета, 1,0 см 3 — 1 флакон.
4. 20-кратный концентрат фосфатно-солевого буфера с Твином 20 для промывания планшетов (ФСБТ), прозрачная жидкость, бесцветная или с желтоватым оттенком, 25,0 с м³ — 2 флакона.
5. Буфер для разведения образцов и конъюгата (БР), жидкость розового цвета, 25,0 см 3 – 1 флакон.
6. Конъюгат — моноклональные антитела к белку VP 73 вируса АЧС, меченные пероксидазой хрена, 50-кратный концентрат, прозрачная жидкость зеленого цвета, 0,3 с м³ — 1 флакон;
7. Субстратный раствор с перекисью водорода для разведения хромогена (СР), бесцветная прозрачная жидкость, 5,1 см 3 -1 флакон.
8. Хромоген, тетраметилбензидин (ТМБ), бесцветная прозрачная жидкость, 5,1 см 3 — 1 флакон.
9.1 М серная кислота (Стоп-раствор), бесцветная прозрачная жидкость, 5,1 см 3 — 1 флакон.
Набор рассчитан на проведение одновременного анализа 46 исследуемых проб биоматериала (в 2 повторах) и контрольных проб (в 2 повторах). Компоновка набора допускает возможность дробного использования компонентов для проведения нескольких серий анализов по мере поступления биоматериала.
3–3,5 часа (не учитывая время подготовки материалов для исследования).
Специфические моноклональные антитела к белку VP 73 вируса АЧС, адсорбированные в лунках иммунологического планшета, образуют комплекс с антигеном вируса АЧС, содержащимся в пробе. Образующийся комплекс взаимодействует с конъюгатом (меченые пероксидазой хрена моноклональные антитела к белку VP 73 вируса АЧС). Связанная пероксидаза вызывает разложение находящейся в хромоген-субстратном растворе перекиси водорода и окисление хромогена. В лунках развивается окраска, интенсивность которой прямо пропорциональна количеству антигена в определяемой пробе.
Набор хранить в защищенном от света месте при температуре от 20 до 8°С. Не допускается замораживание компонентов набора.
12 месяцев от даты изготовления при соблюдении условий хранения.
Мы работаем как с физическими, так и с юридическими лицами, в том числе бюджетными организациями. Принимаем участие в тендерах и государственных закупках.
Для всех наших клиентов предусмотрена гибкая система скидок. Условия предоставления скидок и их размер вы можете уточнить у наших менеджеров.
| Контрагент | Способы оплаты | Комиссия | Комментарий |
| Юридические лица и ИП | Безналичный расчет | Не взимается | Оплата производится путем предоплаты. Для получения счета необходимы реквизиты организации |
| Бюджетные организации | Безналичный расчет | Не взимается | Предусмотрены следующие формы оплаты: предоплата 30%, остаток 70% по факту поставки; отсрочка платежа в течение 15-30 календарных дней согласно договору поставки. Для получения счета необходимы реквизиты организации |
| Физические лица | Наличными в магазине, расположенном по адресу: г. Воронеж, Пирогова 87Б | Не взимается | При условия самовывоза и наличие товара на складе. |
| Оплатой банковской картой в магазине, расположенном по адресу: г. Воронеж, Пирогова 87Б | Не взимается | При условия самовывоза и наличие товара на складе. Мы принимаем пластиковые карты международных платежных систем МИР, VISA, MasterCard и т.д. | |
| Безналичный расчет | Сбербанк – 3% |
Другой банк – ставка за перевод уточняйте в банке
Отправка заказа при безналичной оплате производится после поступления денег на наш расчетный счет, о чем мы известим вас по e-mail или по телефону.
1. Выберите товар в ассортименте на нашем сайте.
2. Закажите счет у менеджера, предварительно предоставив ему реквизиты Вашей компании.
Для выставления счета необходимы:
Юридическим лицам/ИП: Точное наименование организации, ИНН, КПП, банковские реквизиты.
Физ. лицо: ФИО, адрес, телефон и e-mail, скан паспорта РФ.
3. Счет обязательно подписывается главным бухгалтером и генеральным директором и передается покупателю в электронном виде. Счета могут быть выставлены как с НДС, так и без НДС.
4. Получив счет, проверьте, пожалуйста, нужный ли Вам товар отражен в счете и реквизиты Вашей компании.
Счет действителен в течение 5-х банковских дней. Если в течение этого времени вы не направили средства в оплату счета, он становится недействительным и Вам необходимо получить новый счет. Датой оплаты заказа считается дата зачисления средств на банковский счет компании.
6. Для оперативной отгрузки заказа рекомендуем сразу после оплаты выслать по электронной почте копию платежного поручения, либо позвонить и проинформировать об оплате, сообщив дату и номер оплаченного счета, сумму оплаты.
Все платежные документы необходимо сохранять до момента получения товара.
Получение заказа производится после оплаты счета при наличии:
Для юридических лиц и ИП: оригинал доверенности с синей печатью или печать. Генеральный директор (руководитель) может получить груз без доверенности при наличии печати организации, паспорта и документа, подтверждающего его полномочия (приказ о назначении на должность, решение учредителя или участников общества).
Если индивидуальный предприниматель работает без печати, доверенность должна быть заверена нотариально. При условии предоставления заранее письма с образцом подписи ИП, доверенность заверяется личной подписью Индивидуального предпринимателя.
Физ.лицо: паспорт РФ, платежное поручение
В случае, если плательщик и получатель разные лица необходимо предоставить копию паспорта плательщика и заполненную доверенность на получение заказа с данными получателя. При получении заказа получателю необходимо предъявить паспорт.
- – оригинал счёта,
- – товарная накладная,
- – счет–фактура при расчете в НДС
- – гарантийный талон,
- – инструкция по применению.
Доставка заказа осуществляется со склада в Воронеже. Оплата стоимости доставки осуществляется в ТК по факту получения товара. Отгрузка товара для физ. лиц осуществляется на условиях 100% оплаты, для юр. лиц согласно условиям договора.
Отправка со склада осуществляется 2 раза в неделю ВТ и ЧТ
Африканская чума свиней — АЧС
Африканская чума свиней (сокращенно АЧС) является высоко заразительной болезнью, которая проявляется у животных в виде лихорадки, геморрагического диатеза, воспалительных процессов в организме, дистрофических и некротических признаков в различных органах. Заболевание имеет высокий процент смертностиживотных (до 98-100%).
Что такое африканская чума свиней
Заболевание — африканская чума свиней — является вирусным. Его возбудитель — двадцатигранный цитоплазматический ДНК с представителем иридовирусов. Это сложный многоструктурный вирус, который накапливается во всех органах больного животного, проникая даже в клетки костного мозга и крови (в лейкоциты).
Вирус АЧС имеет очень высокую устойчивость и способен до полугода выживать, находясь в почве, на деревьях и даже на кирпичах! Также этот вирус может обитать в сыром мясе, костном мозге животных и остается в тех местах, где находились зараженные животные, то есть в свинарниках. Вирус практически не боится таких дезинфицирующих средств как формалин и щелочь, поэтому дезинфекция осуществляется посредством хлорсодержащих веществ, а также различных кислот и окислителей (уксусная, молочная, карболовая кислоты).
Объекты заражения африканской чумой свиней и пути передачи (эпизоотология)
Африканская чума опасна для диких и домашних свиней любого возраста. При этом наиболее тяжело заболевание переносят породы европейских животных. В то время, как непосредственно африканские свиньи переносят заболевание без каких-либо симптомов.
Основной способ заражения АЧС — это уже заболевшие, а также переболевшие животные. При этом даже после выздоровления животного вирус сохраняется в организме до двух и более лет. Заражение происходит при нахождении животных в непосредственной близости друг к другу. Также вирус может проникнуть в ранку на коже, а еще его переносят клещи.
Распространение на географической территории происходит через транспорт, рабочий инвентарь для обслуживания животных, воду, навоз и так далее. Повышенную опасность имеют продукты убоя зараженных животных и пищевые и боенские отходы.
Вирус АЧС переносят люди, другие виды животных и насекомые.
Основным источником возбудителя заболевания являются дикие африканские свиньи. В странах Европы и США вирус переносят аргасовые клещи, сохраняющие его в своем организме на многие годы.
Вспышки африканской чумы возможны в любое время года, однако периодом особого риска является вторая половина лета и первая половина осени. Периодичность возникновения крупных очагов вируса в Европе составляет около пяти лет.
Диагностика АЧС
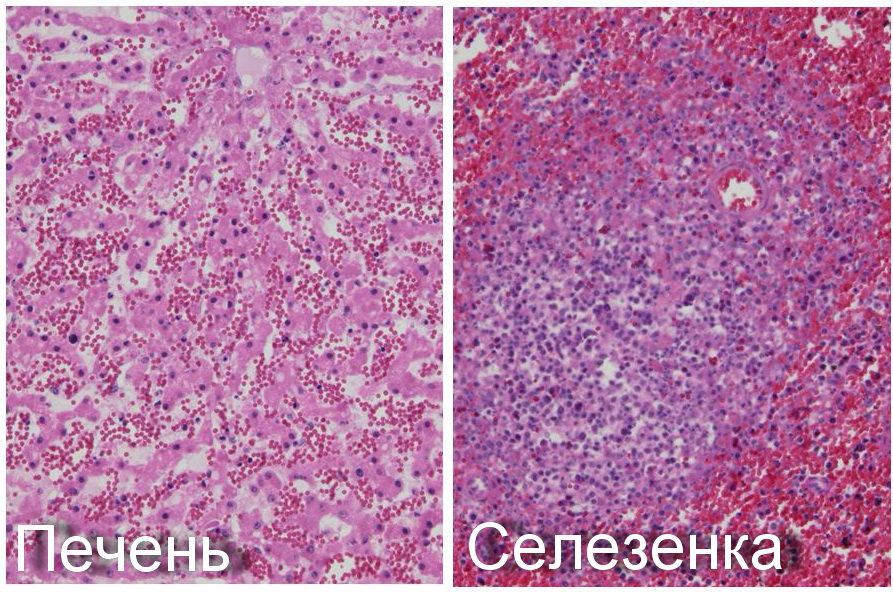
Диагностику африканской чумы свиней производят комплексно, основываясь на анализе эпизоотических показателей, клинических результатах, патологоанатомических сведениях и лабораторных исследованиях.
Лабораторную диагностику выполняют специальные аккредитованные учреждения и ветеринарные лаборатории, специализирующиеся на особо опасных инфекционных заболеваниях животных.
В России лабораторные исследования по идентификации африканской чумы производят Всероссийский научно-исследовательский институт ветеринарной вирусологии и микробиологии в Покрове и Федеральный центр охраны здоровья животных во Владимире.
Методы лабораторной диагностики африканской чумы свиней в соответствии с ГОСТ 28573-90
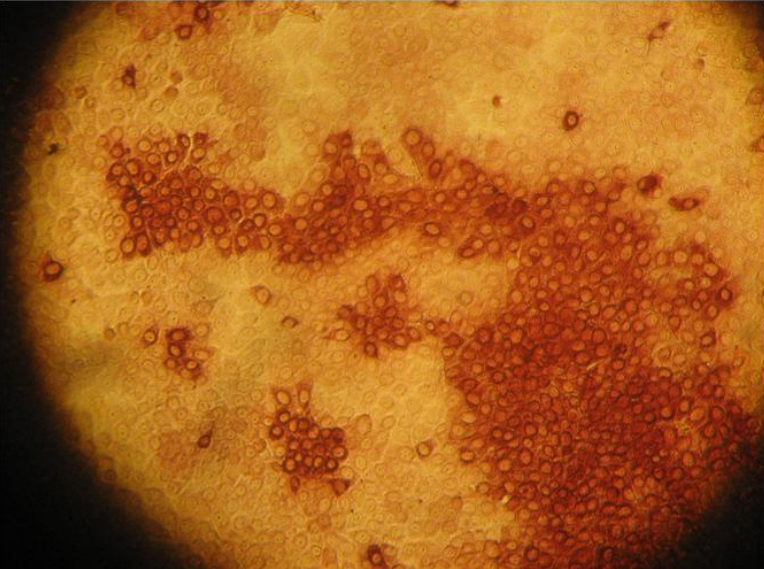
В России разработаны современные средства и методы лабораторной диагностики африканской чумы свиней. Во Всероссийском научно-исследовательском институте вирусологии и микробиологии предложены схемы и методы индикации (обнаружения) возбудителей этих болезней в объектах ветеринарного надзора и окружающей среды на основе достижений молекулярной биологии и генной инженерии.
Диагноз на АЧС устанавливается следующими лабораторными методами:
- Метод прямой иммунофлуоресценци и (РПИФ). Определение антигена вируса в мазках-отпечатках реакцией прямой иммунофлуоресценции на базе микроскопа Olympus CX41 в специальной комплектации.
- Метод иммуноферментного анализа (ИФА). Прижизненная диагностика – выявление специфических антител всыворотке крови больных животных методом иммуноферментного анализа.
Цибезов В.В., Терехова Ю.О., Баландина М.В., Латышев О. Е.,
Гребенникова Т. В., Верховский О.А. АНО "Научно-исследовательский
институт диагностики и профилактики болезней человека и животных"
Алипер Т.И. НПО "НАРВАК"
Шевкопляс В.Н. Кубанский госагроуниверситет
Африканская чума свиней (АЧС) - вирусная болезнь свиней, характеризующаяся высокой контагиозностью. Возбудителем заболевания является ДНК-содержащий вирус семейства Asfarviridae с размером вириона 175—215 нм [8]. В естественных условиях к АЧС восприимчивы домашние и дикие свиньи всех возрастов. Скорость распространения и степень патогенности вируса АЧС таковы, что эта инфекция способна в короткие сроки (3-5 месяцев) привести к огромным экономическим потерям или даже полной утрате поголовья свиней [1, 6].
Эпизоотологическая особенность АЧС заключается в чрезвычайно быстром изменении форм течения инфекции среди домашних свиней от острого со 100%-ной летальностью до хронического и бессимптомного носительства и непредсказуемого распространения.
Для эффективного использования различных методов диагностики АЧС. направленных на выявление возбудителя или специфических антител, следует учитывать особенности протекания болезни и ее формы. При сверхострой и острой формах выявление вирусоспецифических антител возможно только в пробах селезенки, так как специфические антителопродуцирующие клетки и. следовательно, антитела появляются там на 2-3 сутки после инфицирования, в то время как животные гибнут уже на 3-7 сутки [5]. При подостром и хроническом течении болезни виру-соспецифические антитела в крови появляются на 7-10 сутки, до этого времени целесообразно проводить выявление вирусного антигена или генома в крови, так как данный период течения АЧС характеризуется виремией [7] .
В более поздний срок прижизненная идентификация вирусного антигена возможны только при наличии устойчивой ви-ремии. которая характерна для циркуляции высокопатогенных штаммов и изолятов. Вирус умеренно вирулентных изолятов вызывает перемежающуюся виремию. невысокий уровень смертности при высоком уровне заболеваемости, поэтому в этом случае диагностика АЧС. в основном, базируется на обнаружении антител в сыворотке крови [5. 7]. Таким образом, для эффективной диагностики АЧС необходимы методы специфического определения, как возбудителя, так и антител, образующихся после заражения вирусом.
Одним из перспективных методов определения вирусных антигенов и антител к ним является иммуноферментный анализ (ИФА). Преимущества ИФА заключаются в высокой специфичности, скорости и простоте постановки реакции, сравнительна невысокой стоимости и универсальности применяемого оборудования, возможности автоматизации процедуры анализа. За последнее десятилетие произошли значительные изменения в технологии производства ИФА-наборов. обусловленные результатами научно-практических разработок, связанных с применением моноклональных антител (МкА). которые практически полностью вытеснили поликлональные не только в "сэндвич"-вариантах ИФА. предназначенных для обнаружения антигена, но и в большинстве тест-систем, направленных на выявление антител, где они используются либо в качестве конъюгатов или для адсорбции антигена [9. 10]. Помимо этого, в качестве компонентов ИФА эффективно используются рекомбинантные антигены, обладающие иммунохимическими свойствами нативных белков и представляющие собой хорошо охарактеризованные и стандартизированные препараты [2. 3. 4].
Целью настоящей работы являлась разработка современных иммуноферментных тест-систем для выявления как антител к вирусу АЧС. так и самого вируса АЧС в биологическом материале.
Материалы и методы исследования. Для создания высокоспецифичных иммуноферментных тест-систем необходимо было разработать методику синтеза рекомбинантного белка vp73 вируса АЧС. а также, используя в качестве антигена полученный рекомбинантный белок, получить и охарактеризовать специфические моноклональные антитела к вирусу АЧС. Часть работы была проведена в сотрудничестве с сотрудниками фирмы INGENASA (Испания).
Получение рекомбинантного белка vp73. Для получения рекомбинантного белка фрагмент гена B646L размером 485 п.о., кодирующий конформационный эпитоп белка vp73. был амплифицирован с рекомбинантной плазмидной ДНК pSG72a, несущей полную последовательность этого гена. Экспрессию рекомбинантного белка проводили в клетках E.coli штамма BL21(DE3)pLysS (Novagen). Белок очищали из микробной массы Е. coli BL21(DE3)pLysS на NI-NTA агарозе (Qiagen. USA).
Идентификацию и степень чистоты полученного препарата проверяли методом SDS- электрофореза в 12% полиакриламид-ном геле, его активность и специфичность - в непрямом ИФА и иммуноблоттинге с использованием МкА и референтных положительных и отрицательных сывороток крови свиней.
Получение МкА к рекомбинантному белку vp73. Для получения МкА мышей линии BALB/c 3 раза иммунизировали ре-комбинантным белком vp73 (200 мкг/мышь) с двухнедельным интервалом между иммунизациями. Бустерную дозу (200 мкг/ мышь) вводили за 3 дня до выделения селезенки.
Гибридомные клеточные линии получали путем слияния спленоцитов с перевиваемой клеточной линией миеломы Sp2/0.
Скрининг и оценку иммунологической активности МкА в сыворотке крови или культуральной жидкости проводили методом непрямого ИФА. Позитивные гибридомы реклонировали и наращивали в культуральных флаконах, увеличивая объем (Greiner. Германия). Асцитные жидкости, содержащие МкА, получали после введения гибридомных клеток в брюшную полость праймированных пристаном мышей линии BALB/c. Очистку МкА из асцитных жидкостей осуществляли методом аффинной хроматографии с использованием Белок-А-агарозы (Sigma. США).
Конъюгаты МкА с пероксидазой хрена получали периодатным методом.
Иммуноферментный метод выявления антител к вирусу АЧС в формате конкурентного ИФА. Очищенный рекомбинантный белок vp73 сорбировали в лунках микропланшета в 0.1 М карбонатном буфере. рН=9.5 (концентрация 5 мкг/мл) по 100 мкл в лунку в течение ночи при 4°С. После 4-кратной отмывки планшета в лунки вносили по 100 мкл исследуемой сыворотки. Инкубировали планшет 1 час при +37°С. После отмывки планшета в лунки вносили по 100 мкл пероксидазного конъюгата МКА. Инкубировали планшет 1 час при +37°С. После промывания планшета вносили по 0.1 мл субстратного раствора с тетраметилбензидином (МДЛ. Россия). Инкубировали 15 мин при комнатной температуре в темноте и добавляли 0.1 мл 1 М H2S04 для остановки реакции. Оптическую плотность при 450 нм (А450) измеряли на спектрофотометре с вертикальным лучом Multiscan EX (Thermo, США).
Иммуноферментный метод выявления антигена вируса АЧС в формате "сэндвич"-ИФА. Для "сэндвич"-ИФА очищенные МкА сорбировали в лунках микропланшета в 0.1 М карбонатном буфере. рН=9.5 (концентрация 10 мкг/мл) по 100 мкл в лунку в течение ночи при 4°С. После 4-кратной отмывки планшета в лунки вносили по 100 мкл очищенного рекомбинантного vp73 в серийных разведениях (от 5 нг/мл до 320 нг/мл) или подготовленные образцы биоматериала. Инкубировали планшет 1 час при +37°С. После 4-кратной отмывки планшета в лунки вносили по 100 мкл пероксидазного конъюгата детектирующих МкА в рабочих разведениях на ФСБТ. Инкубировали планшет 1 час при +37°С. После промывания планшета вносили по 0.1 мл субстратного раствора с тетраметилбензидином и определяли оптическую плотность как описано выше.
Полимеразная цепная реакция в реальном времени для выявления ДНК вируса АЧС. Выделение ДНК вируса АЧС из биологических образцов проводили с использованием набора для выделения ДНК на колонках ("Ветбиохим". Россия).
ПЦР в реальном времени проводили на приборе ДТ-96 ("ДНК-Технология". Россия) в конечном объеме 25 мкл. Реакционная смесь содержала 5 мкл ДНК. 10 пмоль каждого прайме-ра. 5 пмоль зонда. 0.25 мМ каждого dNTP. 1.25 ед. Taq-полиме-разы, 10 мМ Tris-HCI (рН=9.0). 50 мМ KCI. 0.1% Triton Х-100. 1.5 мМ MgCI2.
Результаты и обсуждение. Рекомбинантный фрагмент конформационного эпитопа белка vp73 вируса АЧС был охарактеризован биохимическими и иммунохимическими методами (электрофорез, иммуноблоттинг. ИФА). Показано, что полученный продукт обладает электрофоретической гомогенностью и детектируется АЧС-специфическими сыворотками. Неспецифические сыворотки не взаимодействуют с полученным продуктом. Рекомбинантный белок был использован в качестве антигена для получения МкА.
После проведения гибридизации было получено 523 гибридных клеточных линий, устойчивых к селективной среде HAT. При первичном тестировании культуральных жидкостей было отобрано 67 клонов реагировавших с рекомбинантным белком vp73.
После повторного клонирования были отобраны 2 клона, обладающих максимальной активностью по отношению к vp73 в непрямом ИФА. Полученные МкА были использованы в дальнейшей работе.
При разработке тест-системы для выявления антител к вирусу АЧС был использован принцип конкурентного ИФА. применяемый в наборе для определения антител к вирусу АЧС INGEZIM РРА СОМРАС (INGENASA. Испания). INGEZIM РРА СОМРАС на основе белка vp73 вируса АЧС обладает 100% чувствительностью и специфичностью и используется в Европе в качестве основного для первичного исследования сывороток при диагностике АЧС. Набор INGEZIM РРА СОМРАС успешно применялся в Испании в рамках национальной программы по искоренению АЧС.
В результате проведенных исследований с использованием полученных рекомбинантного белка vp73 и МкА была разработана тест-система для определения антител к вирусу АЧС "АЧС-CEPOTECT/INGEZIM РРА СОМРАС". Оценка диагностической чувствительности и специфичности тест-системы проводилась в компании INGENASA на широкой панели референтных сывороток крови сывороток крови, полученных от экспериментально зараженных животных и сывороток крови свиней, охарактеризованных референтными методами в соответствии со стандартами OIE (иммуноблоттинг. реакция непрямой иммунофлуорес-ценции. РИФ) [10] .
При исследовании в системе "АЧС-CEPOTECT/INGEZIM РРА СОМРАС" 120 сывороток, показавших негативный результат методами непрямого ИФА и иммуноблоттинга. АЧС-позитивных 21 сывороток не выявлено, т.е. специфичность тест-системы составила 100%.
23 сыворотки, положительные в непрямом ИФА, но отрицательные в иммуноблоттинге были определены как отрицательные. Поскольку иммуноблоттинг является официальным референтным методом по рекомендации OIE. специфичность системы "АЧС-CEPOTECT/INGEZIM РРА СОМРАС" в данном случае также составляет 100%.
30 сильноположительных в непрямом ИФА и иммуноблоттинге сывороток и 5 слабоположительных в непрямом ИФА и сильноположительных в иммуноблоттинге сывороток определены как положительные, т.е. чувствительность системы составила 100%.
Тест-система не выявила перекрестных реакций с антителами к вирусам болезни Ауески. болезни Тешена. КЧС и РРСС.
Диагностическая чувствительность системы была определена при исследовании сывороток свиней, экспериментально зараженных вирулентным штаммом вируса АЧС Ug03H (табл. 1) и слабовирулентными штаммами Е75 и Е70 (табл. 2).
Таблица 1. Результаты анализа сывороток крови свиней после экспериментального заражения штаммом Ug03H в системе "АЧС-CEPOTECT/INGEZIM РРА СОМРАС
Изобретение относится к области ветеринарной вирусологии, в частности, к штаммам вируса африканской чумы свиней (АЧС), и может быть использовано в научно-исследовательских институтах и диагностических центрах в качестве штамма для приготовления специфического антигена, для получения серотипоспецифической сыворотки при проведении вирусологических, диагностических, молекулярно-генетических и мониторинговых исследований.
На настоящий момент выделено более 500 штаммов и изолятов вируса африканской чумы свиней, различающихся по культурально-биологическим, молекулярно-генетическим и серологическим свойствам.
Для классификации имеющихся штаммов и изолятов вируса АЧС используют результаты филогенетического анализа нуклеотидной последовательности гена B646L (р72), которые позволили разделить их на 23 генотипа, подразделяющихся на подтипы [13].
Для сероиммунотиповой классификации используют перекрестное заражение свиней и реакцию задержки гемадсорбции (РЗГАд) в культуре клеток костного мозга свиньи (KMC) или альвеолярных макрофагов свиньи (АМС) [3, 15].
Согласно разработанной во ВНИИВВиМ классификации, на настоящий момент изоляты вируса АЧС с четко выраженными антигенными свойствами объединены в девять самостоятельных сероиммунологических типов, в десятую группу включены новые нетипированные изоляты вируса АЧС [5, 6].
На настоящий момент одновременно отмечается как значительное изменение вирулентности циркулирующего среди диких кабанов вируса и появление животных вирусоносителей, в крови которых выявляются и антитела, и вирусный геном, так и распространение среди домашнего поголовья свиней в ряде областей Сибирского региона высоковирулентного варианта вируса АЧС, близкого по своим характеристикам к изоляту Georgia 2007/1 [7, 10, 12]. Изолят вируса АЧС Georgia 2007/1, исходный вариант вируса, положивший начало эпизоотии в Грузии и сопредельных странах, таких как Армения. По данным В.М. Балышева, а также согласно анализу генома Gallardo С. et al., циркулирующий на территории РФ вирус АЧС относится ко II генотипу VIII серотипу [2, 11, 16].
Вирулентные изоляты и штаммы вируса используются для детального изучения патогенеза болезни, биологических свойств вируса и наработки антигенного сырья при изготовлении диагностических наборов, но они имеют ограниченное использование при получении типоспецифических сывороток. Штаммы вируса АЧС, с отличающимися от изолята Georgia 2007/1 свойствами: вирулентность, контагиозность, выраженность клинических признаков [1], необходимы как для определения основ патогенности вируса АЧС, так и при разработке диагностических препаратов, в том числе на основе гипериммунных сывороток.
Все вышеперечисленные факты делают актуальным получение штаммов со сниженной вирулентностью.
Наиболее близким аналогом (прототипом) предлагаемого штамма является естественно аттенуированный изолят OURT88/3, который обладает низкой вирулентностью и индуцирует защиту у животных при контрольном заражении гомологичным вирулентным вирусом. Однако, у некоторых свиней после инокуляции наблюдаются побочные реакции, включая лихорадку и опухлость суставов. Он был выделен более тридцати лет назад, генетически и антигенно отличается отныне существующих вариантов вируса АЧС, циркулирующего на территории Европы. Он принадлежит к I генотипу и IV серотипу, поэтому применение его в дальнейшем в качестве компонента диагностических систем является нецелесообразным [8, 14].
В связи с этим возникла необходимость получить новый, обладающий стабильными культурально-биологическими свойствами, штамм АЧС, адаптированный к росту в перевиваемой культуре клеток CV-1, аттестованной и лицензированной для производства вакцин, т.е. разрешенной для использования в производстве иммунодиагностических и иммунопрофилактических средств и высокой продуктивностью антигена вируса АЧС.
Наружный слой вириона представлен липопротеидной оболочкой, приобретаемой почкованием в процессе выхода из клетки. Под ней находится икосаэдрический капсид, далее расположена внутренняя липидная оболочка, в которую заключен кор вируса. Кор окружает электронно-плотный нуклеоид, содержащий геном, который представлен двуспиральной, линейной ковалентно замкнутой на концах молекулой ДНК, состоящей из 170-190 тыс. пар нуклеотидов.
Вирусспецифические антигены выявляются в иммуноферментном анализе, в реакциях прямой иммунофлуоресценции и задержки гемадсорбции.
Контаминация бактериями, грибами, микоплазмами и посторонними вирусами.
Штамм не контаминирован бактериями, грибами, микоплазмами и гетерологичными вирусами.
Способ получения и условия хранения.
Штамм хранят при минус 40°С в виде лиофилизированной вируссодержащей суспензии, которую получают путем культивирования вируса в монослое клеток CV-1 при 37°С в течение 5-6 суток и смешивают с равным количеством обезжиренного молока. Периодичность освежения штамма один раз в 10 лет.
Дополнительные признаки и свойства.
Вирулентность - вирулентен для 37,5% естественно восприимчивых животных при контактном, аэрозольном и парентеральном заражении.
Антигенная активность - введение антигена свиньям индуцирует образование вирусспецифических антител, которые выявляются в иммуноферментном анализе и иммуноблоттинге.
Иммуногенная активность - контрольное заражение выживших свиней позволило определить, что 100% животных приобрели стойкий протективный иммунитет.
Стабильность - стабильно активен при репродукции на первичных (KMC, АМС) и перевиваемой (CV-1) культурах клеток, сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 10 последовательных пассажей (срок наблюдения).
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Размножение вируса в культуре клеток АМС сопровождалось феноменом гемадсорбции при внесении в питательную среду 0,01% эритроцитов свиньи.
18 кг/гол. Животных в количестве 6 голов заражали вируссодержащей суспензией внутримышечно в дозе 10 ГАдЕ/гол, а 2 головы оставляли совместно с инфицированными свиньями для контактного заражения.
В ходе эксперимента 3 из 8 зараженных свиней пали с проявлением клинических признаков, характерных для АЧС.
Затем сыворотку помещали в холодильник и отстаивали 24 ч при +4°С. Далее отделившуюся сыворотку отбирали, дополнительно осветляли центрифугированием при 1000-15000 об/мин в течение 30 мин и расфасовывали по флаконам. Исследование полученных сывороток и определение титра вирусспецифических антител проводили методом ТФ ИФА.
Определение уровня вирусспецифических антител в полученной сыворотке показало, что после контрольного заражения наблюдалось увеличение титра до значений 4,01 lg/см 3 .
Таким образом, полученная гипериммунная сыворотка содержит специфические к вирусу АЧС антитела и может быть использована в серологических реакциях для диагностических исследований.
Первичную культуру клеток (KMC, АМС) выращивали на 96-луночных панелях в посадочной концентрации 6-7×10 6 /мл. После сорбции клеток неприкрепленные клетки и избыток эритроцитов удаляли, а в лунки вносили 200 мкл ростовой среды и инкубировали 48 часов при 37°С и 3-5%CO2. Реакцию ставили в объеме 250 мкл поддерживающей среды, из которой 200 мкл среда Дюльбекко MEM, 25 мкл вируссодержащей суспензии и 25 мкл специфической или контрольной сыворотки. Учет реакции проводили через 24-72 часа при хорошо выраженной ГАд в контроле. Результаты реакции представлены в таблице 2.
Клетки, находящиеся в осадке ресуспендировали в 2 см 3 дистиллированной воды и обрабатывали ультразвуком в течение 2 минут трехкратно при частоте звуковой волны 20 кГц.
Для липолиза внутриклеточных комплексов добавляли 1,1,2-трифтортрихлорэтан (фреон-113) в соотношении 1:1, центрифугировали при 6000 об/мин в течение 20 минут и отбирали водную фазу, которую концентрировали в 5 раз.
Полученным антигеном в разведениях на КББ сенсибилизировали плашки при 4°С в течение 12 часов, и определяли его рабочее разведение в непрямом твердофазном иммуноферментном анализе (ТФ ИФА) с референс-сывороткой к АЧС CISA INIA в рабочем разведении (1:80) (IV серотип). Результаты, полученные в ходе опыта, представлены в таблице 3.
Результаты исследований, приведенные в таблице 3, свидетельствуют о том, что полученный диагностический антиген может быть использован для серологических исследований.
1. Белянин С.А. и др. Патоморфологические изменения у домашних свиней при остром и подостром течении африканской чумы свиней //Российский ветеринарный журнал. Сельскохозяйственные животные. - 2012. - №. 1.
2. Биологические свойства вируса африканской чумы свиней, выделенного в российской федерации / В.М. Балышев [и др.] // Ветеринария. - 2010. - №7. - С. 25-27.
3. Диагностика африканской чумы свиней. И.Ф. Вишняков, Н.И. Митин, А.Н. Курносов, В.М. Колосов, Ф.А. Бадаев, И.В. Федортщев, В.А. Бурлаков // Материалы научной конференции ВНИИВВиМ. - Покров, 1992. - С. 57-70.
4. Патент РФ №2439152, C12N 7/00, G01N 33/53, 30.06.2010
5. Селянинов Ю.О. Вирус африканской чумы свиней: физическое картирование генома штаммов /Ю.О. Селянинов, В.М. Балышев, С.Ж. Цыбанов / Вестник Российской академии сельскохозяйственных наук. - 2000. - №5. - С. 75-76.
6. Сероиммунологическая классификация природных изолятов вируса африканской чумы свиней. И.Ф. Вишняков, Н.И. Митин, Ю.И. Петров и др. // Актуальные вопросы ветеринарной вирусологии: материалы науч. - практ. конф. ВНИИВВиМ. - Покров, 1995. - С. 141-143.
7. Biological characterization of African swine fever (ASF) moderate virulent isolates associated to wild boar cases occurred in Southern Estonia in 2015 / Gallardo C. [et al]. // Workshop on Laboratory Diagnosis and Control of CSF and ASF” // Madrid, Spain- 19h June 2017.
8. Boinas,F.S., Hutchings, G.H., Dixon,L.K., Wilkinson,P.J., 2004. Characterizationof pathogenic and non-pathogenic African swine fever virus isolates from Ornithodoros erraticus in habiting pig premisesin Portugal.J.Gen.Virol. 85, 2177-2187.
9. Breese, S.S., and C.J. De Boer. 1966. Electron microscope observations of ASFV in tissue culture cells. Virology 28:420-428.
10. Current of ASF situation in Latvia / Cvetkova S. [et al] // Workshop on Laboratory Diagnosis and Control of CSF and ASF. Hannover, Germany, 2016. - P. 11.
11. Gallardo C. [et al]. Genetic Variation among African Swine Fever Genotype II Viruses, Eastern and Central Europe. Emerging Infectious Diseases. 2014; 9:1544-7.
12. Gallardo C. [et al]. Experimental Infection of Domestic Pigs with African Swine Fever Virus Lithuania 2014 Genotype II Field Isolate // Transboundary and Emerging Diseases.
13. Genotyping fielstraing of African swine fever by partial p72 gene characterization. A.D.S. Bastos [et al.] // Arch. Virol - 2003, vol. 148, - P. 693-706.
14. King, K., Chapman,D., Argilaguet,J.M., Fishbourne,E., Hutet,E., Cariolet,R., Hutchings, G., Oura, C.A., Netherton,C.L., Moffat,K., Taylor,G., LePotier, M.F., Dixon,L.K., Takamatsu,H.H., 2011. Protection of European domestic pigs from virulent African isolates of African swine fever virus by experimental immunisation. Vaccine29, 4593-4600.
15. Malmguist W.A. Serologic and immunologic studies with African swine fever virus / W.A. Malmguist // Amer. J. Vet. Res. 1963. - P. 24.
16. Rowlands R. J. et al. African swine fever virus isolate, Georgia, 2007 //Emerging infectious diseases. - 2008. - T. 14. - №. 12. - C. 1870.
Читайте также:
- Миокардит как осложнение сепсиса
- Дополните информацию дифтерию и грипп причисляют к
- Китайская медицина лечение рожи
- Основные клинические синдромы у больных менингококковой инфекции
- Что делать если при коклюше поднимается температура


