Опыты гриффитса с пневмококками
Гриффит работал с пневмококками - бактериями, вызывающими пневмонию. Он брал два штамма пневмококков: капсульный и бескапсульный. Капсульный - патогенный (вирулентный), при инфицировании таким штаммом мыши погибают, бескапсульный - непатогенный. При введении мышам смеси убитых нагреванием (и, следовательно, потерявших вирулентность) капсульных пневмококков и живых бескапсульных невирулентных бактерий, животные погибали в результате размножения капсульных вирулентных форм. Обнаруженное явление Гриффит интерпретировал как трансформацию.

После заражения пневмококками капсульного патогенного (вирулентного) штамма мыши погибают. Капсульные пневмококки размножаются.

При инфицировании пневмококками бескапсульного непатогенного штамма животные не погибают. Бескапсульные пневмококки не размножаются.

После заражения пневмококками капсульного патогенного (вирулентного) штамма, предварительно убитыми нагреванием, мыши не погибают. Пневмококки не размножаются.

При введении мышам одновременно бескапсульных невирулентных пневмококков и капсульных, убитых нагреванием, животные погибают. Капсульные пневмококки размножаются.
Бескапсульные невирулентные пневмококки приобрели некоторые свойства убитых капсульных бактерий.
Определение: Трансформация - это приобретение одним организмом некоторых признаков другого организма за счет захвата части его генетической информации.
В 1944г. этот эксперимент был повторен Освальдом Эйвери, Колином Мак-Леодом и Маклином Мак-Карти в варианте смешивания бескапсульных пневмококков с взятыми от капсульных белками, полисахаридами или ДНК. В результате этого эксперимента была выявлена природа трансформирующего фактора.
Трансформирующим фактором оказалась ДНК.
2. 1952Г. Эксперимент Альфреда Херши и Марты Чейз.
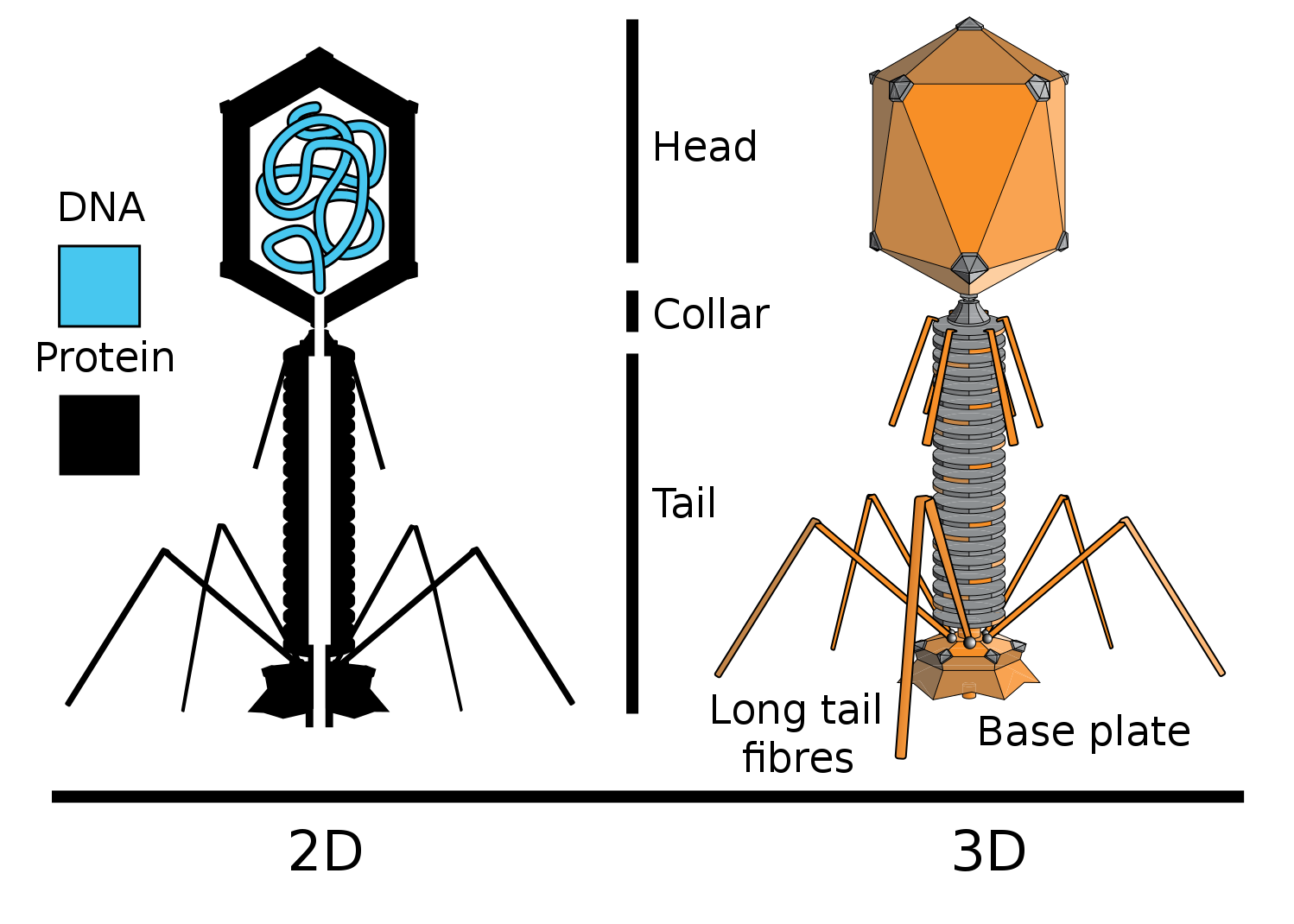
Фаги (бактериофаги) - это вирусы, размножающиеся в бактериях.
E. сoli - кишечная палочка (эубактерия).
Суть опыта: фаги, у которых белковая оболочка была мечена радиоактивной серой (S 35 ), а ДНК - радиоактивным фосфором (Р 32 ), инкубировали с бактериями. Затем бактерии отмывали. В смывных водах не обнаруживали Р 32 , а в бактериях - S 35 Следовательно, внутрь попала только ДНК. Через несколько минут из бактерии выходили десятки полноценных фагов, содержащих и белковую оболочку, и ДНК.
Эксперимент А.Херши и М.Чейз

Фаги, у которых белковая оболочка была мечена радиоактивной серой (S 35 ), а ДНК - радиоактивным фосфором (Р 32 ), инкубировали с бактериями.

Затем бактерии отмывали. В смывных водах не обнаруживали Р 32 , а в бактериях - S 35 . В то же время большая часть Р 32 оказалась внутри бактериальных клеток, а вся S 35 - в окружающей среде.

Следовательно, внутрь попала только ДНК. Через несколько минут из бактерии выходили десятки полноценных фагов, содержащих немеченую белковую оболочку, и ДНК, меченую Р 32 .
Именно ДНК выполняет генетическую функцию - несет информацию как о создании новых копий ДНК, так и о синтезе фаговых белков
Отсюда следовал однозначный вывод о том, что именно ДНК выполняет генетическую функцию - несет информацию как о создании новых копий ДНК, так и о синтезе фаговых белков.

Привет Хабр! Сегодня мы продолжим прошлый рассказ о ДНК. В нем мы поговорили о том, сколько ее бывает, как ДНК хранится и почему так важно то, как она хранится. Сегодня мы начнем с исторической справки и закончим основами кодирования информации в ДНК.
Теперь, встал вопрос, как отдельные звенья соединены между собой. Для этого цепи ДНК нужно было разрушить и посмотреть на то, что получится после разрушения. Для этого полимер ДНК подвергался гидролизу. Однако Левен изменил метод гидролиз. Теперь вместо многочасового кипячения в закисленной среде он использовал ферменты. На этот раз из гидролизатов удалось выделить не только отдельные аденин, гуанин, тимин, цитозин, дезоксирибозу и фосфорную кислоту, но и более крупные фрагменты, например соединения азотистых оснований с углеводом или углевода с фосфорной кислотой. Вместе с тем в гидролизатах нуклеиновых кислот не были обнаружены соединения, состоящие из двух азотистых оснований, или соединения типа основание – фосфорная кислота. То есть стало понятно, что фосфорная кислота соединяется с сахаром, а он в свою очередь, с азотистым основанием. Соединения азотистых оснований с углеводом было предложено называть нуклеозидами, а фосфорные эфиры нуклеозидов назвали нуклеотидами.
В результате этих работ Левен пришел к выводу, что нуклеиновые кислоты являются полимерами. В качестве мономеров служат нуклеотиды. Содержание каждого из четырех нуклеотидов в ДНК, или РНК, по данным химического анализа того времени, представлялось Левену равным. Поэтому Левен предложил следующую теорию строения нуклеиновых кислот: они являются полимерами, мономерами которых служат блоки из четырех нуклеотидов, соединенных последовательно.
Теория тетрануклеотидного строения в то время выглядела вполне обоснованно, войдя во все учебники довоенного времени. Однако вопрос функции ДНК оставался неясным. Чтобы прояснить этот вопрос понадобилось почти полвека.
Наступил период, во время которого биологи накапливали сведения об распространении нуклеиновых кислот в различных типах животных и растительных тканей, в бактериях и вирусах, в некоторых одноклеточных организмах.
В то время научное сообщество всерьез полагало, что за хранение генетической информации ответственны именно белки. Традиционное представление о первичной роли белков в жизненном процессе не позволяло и думать о том, что столь важное вещество, как вещество наследственности, могло быть чем-либо, кроме белка. Белки были крайне разнообразны по своей структуре, чего тогда не могли сказать о нуклеиновых кислотах. Известный советский генетик-цитолог Н. К. Кольцов подсчитал, что, варьируя последовательность 20 аминокислот, входящих в состав белковой молекулы, можно создать триллионы непохожих друг на друга белков.
Если бы мы захотели напечатать в самой упрощенной форме, как печатаются логарифмические таблицы, этот триллион молекул и предоставили для выполнения этого плана все ныне существующие типографии мира, выпуская в год 50000 томов по 100 печатных листов, то до конца предпринятой работы протекло б столько времени, сколько его прошло с архейского периода д наших дней.
Действительно много… 20 в 20й… А ведь последовательности бывают куда длиннее чем 20 аминокислот.
А вот как пишет по этому поводу А. Р. Кизель – один из наиболее эрудированных биохимиков того времени.
Из только что приведенных воззрений на роли нуклеиновой кислоты… вытекает ее непричастность к строению генов и следует, что гены составлены из какого-то другого материала. Этого материала мы еще достоверно не знаем, несмотря на то, что он в большинстве случаев прямо называется белком.
Первый успех пришел из микробиологии. В 1944 г. были опубликованы результаты опытов Эвери и сотрудников (США) по трансформации бактерий. Пару слов о трансформации.
Сама трансформация была открыта в 1928 году микробиологом Гриффитсом.
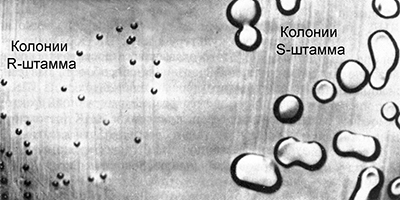
Гриффит работал с культурами пневмококка (Streptococcus pneumoniae) возбудителя одной из форм пневмонии. Некоторые штаммы этой бактерии являются вирулентными, вызывая воспаление легких. Их клетки покрыты полисахаридной капсулой, защищающей бактерию от действия иммунной системы. В культуре такие бактерии образуют крупные гладкие колонии правильной сферической формы. Благодаря этому, они получили название S–штаммы (от английского smooth – гладкий).
Существуют различные вирулентные штаммы пневмококка, они отличаются по антителам, которые вырабатываются в организме при попадании в него бактерий. Их называют IS, IIS, IIIS и т. д. Время от времени некоторые клетки вирулентных штаммов S мутируют, утрачивая способность синтезировать полисахаридную оболочку, и становятся авирулентными. В культуре они образуют мелкие шероховатые колонии неправильной формы, из-за этого получили название R–штаммов (от английского rough – шероховатый). Иногда происходят обратные мутации, восстанавливающие способность к синтезу полисахаридной оболочки, но только в группах соответствующих штаммов:
Это говорит о том, что авирулентные R–штаммы всегда соответствуют родительскому вирулентному S–штамму.
Гриффит вводил разным группам лабораторных мышей вирулентный и авирулентный штамм пневмококка. В первой контрольной группе инъекция вирулентного штамма IIIS приводила к гибели животных. Животные второй контрольной группы после инъекции авирулентного штамма IIR оставались живы. После этого Гриффит нагревал раствор с культурой вирулентого штамма IIIS при температуре 60 °С, что привело к гибели бактерий. Убитые нагреванием бактерии он ввел третьей группе подопытных мышей. Животные остались живы, что в принципе и ожидалось. Однако это не все. Он ввел части выживших мышей бактерии авирулентного штамма IIR.
Казалось, ни к каким страшным последствиям для мышей это не могло привести. Однако вопреки ожиданиям, животные погибли. Когда из их тел были выделены бактерии и высеяны в культуру, оказалось, что они относятся к вирулентному штамму IIIS.

Тот факт, что вызывающие гибель мышей клетки синтезировали полисахаридную оболочку типа III, а не II, свидетельствовал о том, что они не могли возникнуть в результате обратной мутации IIR — IIS. Из этого Гриффит сделал очень важный вывод. Авирулентные бактерии штамма IIR могут трансформироваться в вирулентные как-то взаимодействуя с убитыми нагреванием бактериями штамма IIIS, которые еще оставались в теле мышей. Другими словами, авирулентные бактерии штамма IIR получают от мертвых бактерий штамма IIIS некий фактор, превращающий их в вирулентные. Однако, что это за фактор, Гриффит не знал.
Собственно этот феномен и был назван бактериальной трансформацией. Он представляет собой однонаправленный перенос наследственных признаков от одной бактериальной клетки к другой.
Теперь вернемся к опытам Эвери. Схема их экспериментов несколько схожа с экспериментами Гриффитса. Эвери и сотрудники поставили перед собой задачу выяснить химическую природу трансформирующего агента. Они разрушали суспензию пневмококков и удаляли из экстракта белки, капсульный полисахарид и РНК, однако трансформирующая активность экстракта сохранялась. Трансформирующая активность препарата не терялась при его обработке кристаллическим трипсином или химотрипсином (разрушающими белки), рибонуклеазой (разрушает РНК). Было ясно, что препарат не являлся ни белком, ни РНК. Однако трансформирующая активность препарата полностью утрачивалась при обработке его дезоксирибонуклеазой (разрушающей ДНК), причем ничтожные количества фермента вызывали полную инактивацию препарата. Таким образом, было установлено, что трансформирующий фактор у бактерий является чистой ДНК. Этот вывод явился значительным открытием, и Эвери отлично сознавал это. Он писал, что это как раз то, о чем давно мечтали генетики, а именно вещество гена. Кажется вот оно доказательство. Но уж слишком сильна была вера в белок, как вещество наследственности. Некоторые считали, что трансформацию могут вызывать и те ничтожные примеси белка, которые оставались в препарате.
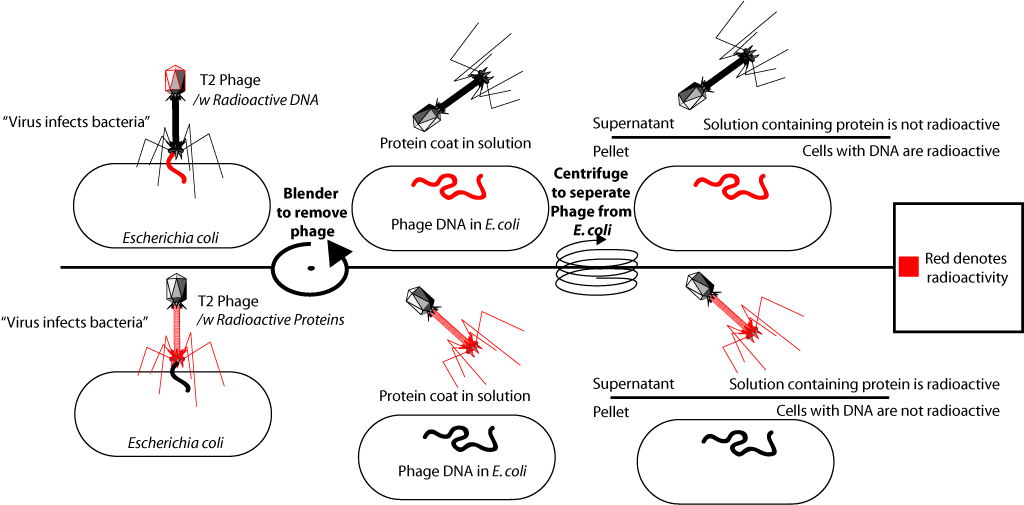
Новым доказательством прямой генетической роли ДНК явились опыты вирусологов Херши и Чейз. Они работали с бактериофагом Т2 (Бактериофаги — вирусы бактерий), который заражает бактерию Escherichia coli (кишечную палочку).
Собственно что они сделали. В состав ДНК одних бактериофагов они включили радиоактивный фосфор (P32), а в состав белков других — изотоп серы (S35). Для этого одни бактерии выращивались на среде с добавлением радиоактивного фосфора в составе фосфат иона, другие — на среде с добавлением радиоактивной серы в составе сульфат иона. Затем к этим бактериям добавлялся бактериофаг Т2, который, размножаясь в клетках бактерий, включал радиоактивную метку в свою ДНК (P есть в ДНК, но нет в белках), или белки (S есть в белках, но нет в ДНК).
Эти открытия сильно повлияли на многих биологов того времени. В особенности на знаменитого своими правилами Чаргаффа. Он считал, что Эвери по сути открыл 'новый язык', или как минимум показал, где его искать.
Чаргафф принялся искать разницу в нуклеотидном составе и расположении нуклеотидов в препаратах ДНК, полученных из различных источников. И, поскольку методов позволяющих точно дать химическую характеристику ДНК, в то время не существовало… ему пришлось их придумать. Им было показано, что старая тетрануклеотидная теория строения нуклеиновых кислот неверна. ДНК у разных организмов по составу и строению сильно отличаются. При этом обнаружились новые факты, не установленные ранее для других природных полимеров, а именно регулярности в соотношении отдельных оснований в составе всех исследованных ДНК. Сейчас даже школьники знают их, как правила Чаргаффа.
- Количество аденина равно количеству тимина, а гуанина — цитозину: А=Т, Г=Ц.
- Количество пуринов равно количеству пиримидинов: А+Г=Т+Ц.
- Вытекает из первого и второго. Количество оснований с аминогруппами в положении 6 равно количеству оснований с кетогруппами в положении 6: А+Ц=Т+Г.
Механизм мы затрагивали в прошлой статье, поэтому тут я останавливаться на нем не буду.
Потихоньку мы подошли к двум легендарным людям, открывшим структуру ДНК. Фрэнсис Крик и Джеймс Уотсон встретились впервые в 1951 году. Уотсон тогда решил заняться структурой ДНК. Как биолог, он понимал, что при выборе определенной структуры ДНК нужно учитывать существование какого-то простого принципа удвоения молекулы ДНК, заложенного в ее структуре. Ведь одним из важнейших свойств генов является передача наследственной информации.
Криком же была создана теория дифракции рентгеновских лучей на спиралях, позволяющая определить, находится исследуемая структура в спиральной конформации или нет. В то время рентгенограммы ДНК уже существовали. Их получили в Лондоне Морис Уилкинс и Розалинд Фрэнклин.
По характеру рентгенограммы ДНК Уотсон и Крик поняли, что исследуемая структура находится в спиральной конформации. Они знали также, что молекула ДНК представляет собой длинную линейную полимерную цепь, состоящую из мономеров-нуклеотидов. Фосфодезоксирибозный костяк этого полимера непрерывен, а сбоку к дезоксирибозным остаткам присоединены азотистые основания. Для построения моделей оставалось решить вопрос, сколько цепей линейного полимера уложено в компактную структуру.
На основании рентгенограммы В-формы ДНК Уотсон и Крик предположили, что молекула ДНК состоит из двух линейных полинуклеотидных цепей с фосфодезоксирибозным остовом снаружи молекулы и азотистыми основаниями внутри ее. Что в последствии подтвердилось. Оставалось только решить вопрос о порядке расположения азотистых оснований двух цепей внутри биспирали.
Рассматривая возможные комбинации пар азотистых оснований, Уотсон обнаружил, что пары аденин–тимин и гуанин–цитозин имеют одинаковый размер и стабилизируются водородными связями. Сразу же объяснялись и правила Чаргаффа: если в биспирали ДНК аденин одной цепи всегда соединяется с тимином другой цепи, а гуанин всегда входит в паре с цитозином, то аденина в составе ДНК должно быть всегда столько же, сколько тимина, а гуанина – столько же, сколько цитозина. Ясно было также, как должно происходить удвоение молекулы ДНК. Каждая цепь комплементарна другой, и в процессе репликации ДНК цепи биспирали должны разойтись и на каждой полинуклеотидной цепи должна достроиться комплементарная к ней цепь. Тут тоже было несколько теорий, но о них через неделю, в следующей статье.
Итак, мы знаем, что ДНК — носитель информации, знаем из чего она состоит. Но как кодирует информацию — все еще не понятно.
Пойдем от задачи. ДНК кодирует 20 аминокислот (можно сказать, что 21, но селеноцистенин пока не трогаем). Нуклеотидов имеется 4 варианта. То есть один нуклеотид может кодировать 4 варианта, 2 — 16, 3 -64. Логично предположить, что код — триплетен (то есть три основания кодируют одну аминокислоту). Про экспериментальное подтверждение можете почитать здесь. Боюсь, что тут и без того много истории…
Собственно у нас есть 64 варианта и 20 аминокислот. Аминокислоты могут кодироваться разными кодонами. Так же существуют старт и стоп кодоны, с которых начинается считывание.
Не забываем, что сначала ДНК считывается в РНК, с которой уже происходит считывание в белок.
Таблица внизу — соответствие кодонов РНК аминокислотам. Помним, что в РНК нет тимина, вместо него идет урацил.
Если вы не нашли в таблице старт кодон — поищите AUG. Он кодирует метионин и одновременно является стартовым. При трансляции генов прокариот, пластидных и митохондриальных генов стартовой аминокислотой является N-формилметионин (это просто для справки)).
Если расписать весь путь от ДНК до белка, получим что-то такое.
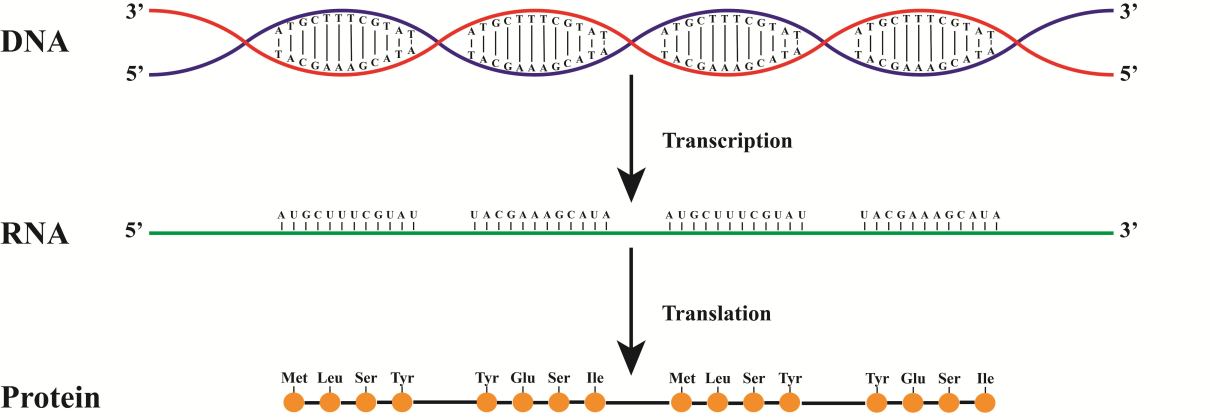
На данном рисунке синтез идет с красной цепи. Как следствие РНК будет совпадать с синей цепью (не забываем про замену Т на У)
Как я уже говорил, каждую аминокислоту может кодировать несколько кодонов. На первый взгляд это кажется не особо нужным побочным эффектом избыточности числа кодонов. Но у него, на самом деле, довольно важная роль.
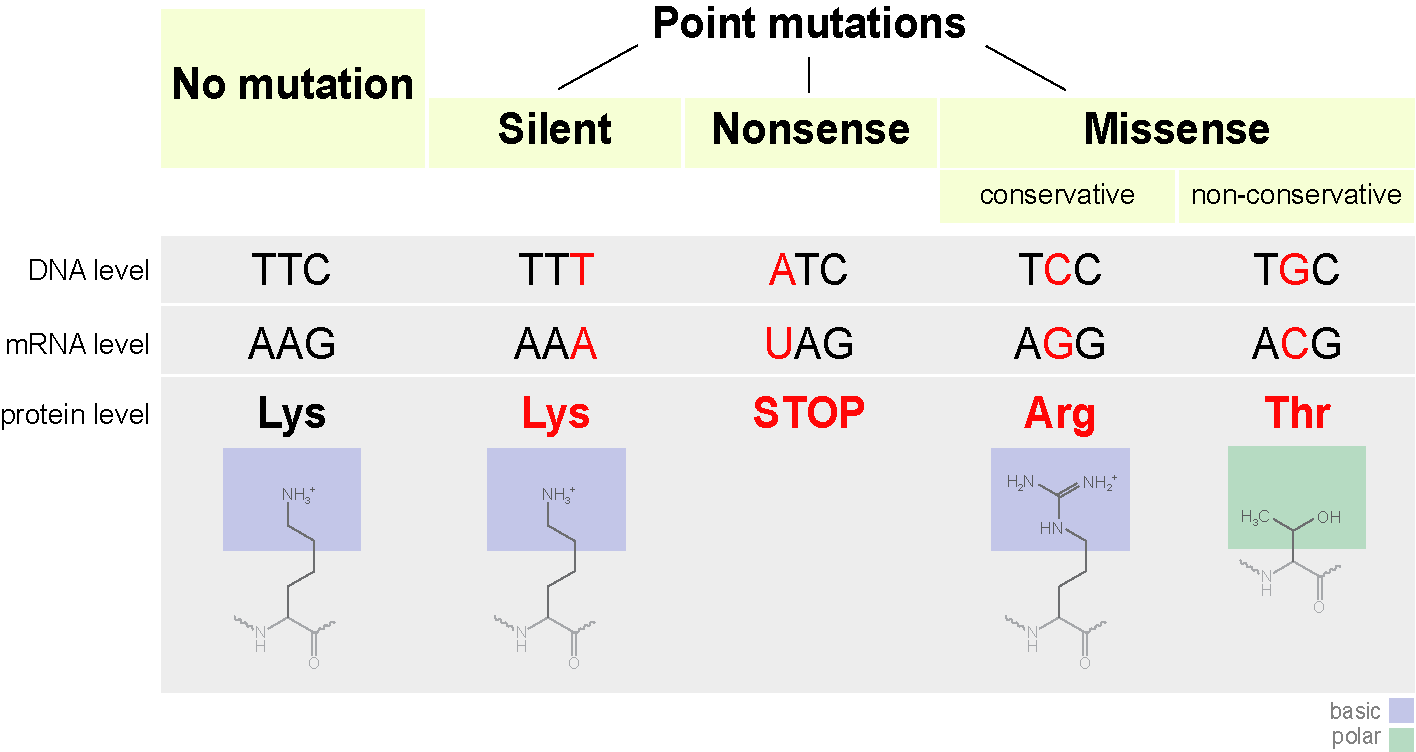
Тут мы немного затронем мутации. Они бывают разных типов. От хромосомных, когда целые куски хромосом удаляются из генома, меняются местами, дублируются, до точечных, когда происходит замена одного азотистого основания на другое. Сфокусируемся на точечных мутациях.
Кодон может начать кодировать другую аминокислоту, что не всегда страшно. Такие мутации называются миссенс-мутацими (то есть со сменой смысла). Это может повлиять на структуру белка. Например если положительно заряженная аминокислота заменится на отрицательно заряженную — это может сделать белок нестабильным, или приведет к тому, что он свернется в другую конформацию (да, линейная последовательность аминокислот обычно сворачивается в определенную форму) и не сможет выполнять свои функции (или начнет делать это лучше, это уже попахивает эволюцией).
Если конкретно, то гемоглобин S имеет единичную замену нуклеотида (А на Т) в кодирующем гене. В результате триплет ГАГ, кодирующий глутамат, заменяется на ГТГ, кодирующий валин. Гемоглобин S тоже может транспортировать кислород, но делает это хуже чем обычный гемоглобин.
В молекуле гемоглобина Хикари аспарагин замещен на лизин, однако он все также хорошо перенести кислород.
Как пример с потерей функции рассмотрим гемоглобин M. Другая точечная мутация в гене гемоглобина приводит к полной утрате функции (гистидин меняется на тирозин в активном центре).
Кстати, сворачивание белка выглядит примерно так, если опустить все нюансы.
Что еще может произойти?
Замена одного азотистого основания может так же привести к появлению стоп кодона в центре последовательности, или наоборот стоп кодон в конце исчезнет. На выходе получится либо неполная цепь, либо экстремально длинная цепь, которые в любом случае не смогут нормально функционировать. Такие мутации называются нонсенс.
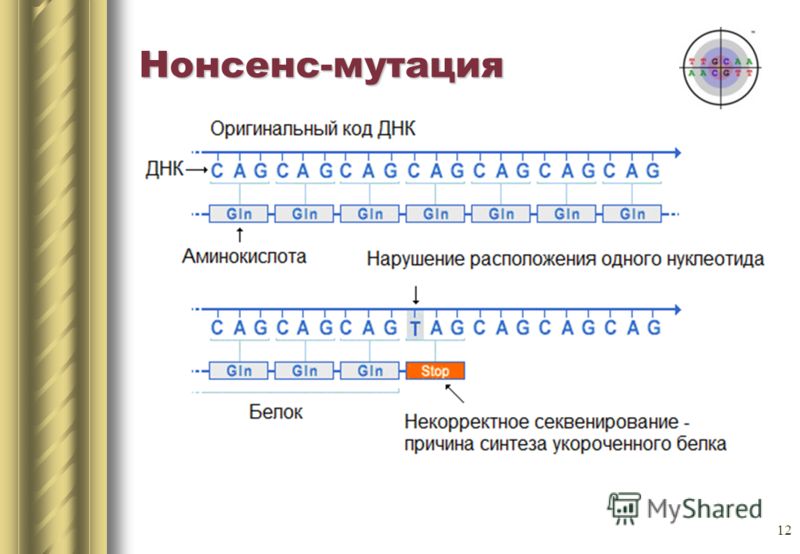
Есть еще третий тип мутации — сайленс-мутация. По сути происходит смена кодона на другой, кодирующий ту же аминокислоту. Свойства белка не меняются.
Подитожим общей схемой.
В завершение хотел бы еще рассказать об одной интересной особенности. Одну аминокислоту может кодировать несколько кодонов. Это мы знаем. Но что это значит? Организм использует сразу все кодоны для кодирования. Но какие-то чаще, какие-то реже.
Сравним человека и… кишечную палочку (Escherichia coli) по частоте использования кодонов кодирующих цистеин.
Он кодируется двумя кодонами UGU и UGC.
Человек
UGU 10.6
UGC 12.6
Кишечная палочка (штамм O127:H6)
UGU 19.1
UGC 0.0
Цифры это встречаемость триплета на тысячу. Видно, что мы используем оба кодона примерно с одинаковой частотой, в то время как E. coli почти не использует UGC кодон.
Об этой особенности нужно помнить, особенно когда ты занимаешься геноинженерией и хочешь нарабатывать продукт гена одного организма в другом. Если ген человека, с частой встречаемость UGC кодона попытаться вставить в кишечную палочку данного штамма — вас ждет разочарование. В клетке аминокислоты связаны с транспортными РНК, каждая из которых соответствует своему кодону. Так вот тРНК соответствующих UGC кодону будет крайне мало, что сильно замедлит синтез.
Если интересно, тут можно посмотреть отличия в кодонном составе у разных организмов.
Кодонный состав может сильно отличаться как у организмов разных видов, так и разных штаммов. Так у Escherichia coli O157:H7 EDL933 все более менее поровну в плане UGC и UGU. Или вот еще пример. У штаммов туберкулезной палочки выделенных в разных странах также отличается кодовый состав.
В этот раз было очень много истории и относительно мало биологии. Больше такого не будет. Мы поговорили о том, как стало понятно, что ДНК — носитель информации, как она хранится в самой ДНК. Поговорили об избыточности ген кода и о том, к чему это приводит. Немного затронули мутации и разницу в частоте использования определенных кодонов.
В следующий раз поговорим о репликации ДНК.
Результаты, которых никто не ожидал
По установившейся в науке о микробах терминологии кокки - это бактерии, имеющие круглую форму. Пневмококки - бактерии, вызывающие крупозную пневмонию, воспаление легких. Микробиологи давно выяснили, что у пневмококков существуют разновидности, или типы, которые и были обозначены римскими цифрами I, II, III, IV и т. д. Различия, стоящие за этими цифрами, довольно четкие, а для высших организмов и весьма ощутимые, так как связаны они с вирулентностью микробов, то есть их способностью распространяться в организме и вызывать болезнь. Но есть и различия, которые можно просто увидеть и по ним отличить один тип от другого.
У III типа есть массивная полисахаридная капсула, окружающая клетки, которая у пневмококков II типа под микроскопом имеет вид узкой полоски. Вирулентность пневмококков, их способность вызвать болезнь как раз зависит от наличия или отсутствия полисахаридной капсулы.
Английский микробиолог Гриффит работал с пневмококками, изучая их способность поражать мышей. И привлекали Гриффита именно пневмококки II и III типа. Результаты своих опытов он опубликовал в 1928 году. Они были столь разительны, что объяснить их автор не мог. И не удивительно.
Понадобилось еще 16 лет усилий целых коллективов ученых и сложнейшие исследования, чтобы понять, что же все-таки произошло в опытах Гриффита. А опыты были не ахти какие сложные. Повторить их не составляло большого труда. Но вот объяснить?!
. Итак, в распоряжении Гриффита пневмококки II и III типов.
Вначале проводится проверка штаммов на их вредоносность.
Вот мышам вводится взвесь пневмококков И, бескапсульного типа (авирулентного). Как и следовало ожидать, все животные остаются живы. Применение штамма III (вирулентного) типа, имеющего массивные полисахаридные капсулы, приводит к поголовной гибели мышей.
Теперь Гриффит берет пробирку со взвесью пневмококков этого штамма и нагревает ее на газовой горелке. Температура должна убить культуру микробов, и они станут безвредными. И действительно, введя животным убитых нагреванием пневмококков, Гриффит убеждается, что ни одна из мышей не гибнет. Собственно говоря, пока ничего поразительного не происходит, все естественно и закономерно. Но Гриффит продолжает эксперимент дальше.
В пробирку с убитыми температурой пневмококками III типа добавляется взвесь живой культуры II типа пневмококков. Они живые, но, как показывает контроль, для мышей безвредны (авирулентны). Теперь мышам вводится смесь пневмококков двух штаммов: вирулентного, но мертвого III и живого, но авирулентного II типа. И неожиданный результат - все животные гибнут. Почему? Казалось бы, такая смесь не должна причинять животным никакого вреда, ведь порознь ни убитые огнем пневмококки III типа, ни живые, но вообще безвредные пневмококки II типа не дали ни одного случая гибели.
Может быть, в опыте допущена какая-нибудь ошибка? Ну, например, нагревание убило не всех пневмококков III типа? Гриффит тщательно проверяет каждый этап эксперимента, ставит его несколько раз подряд, но эффект все тот же: смесь штаммов вызывает безусловную гибель подопытных мышей. В группах контрольных, где используется каждый штамм отдельно, все животные живы. Необъяснимо, но факт! И совсем уже поразительно другое: когда из погибших животных Гриффит выделяет пневмококков, то все они оказываются. III типа.
Под микроскопом видны массивные полисахаридные капсулы, а гибель мышей, которым Гриффит вводит этих микробов, подтверждает их высокую вирулентность. Что же произошло? Почему ранее убитые нагреванием пневмококки III типа "воскресли"? Объяснить этого Гриффит не в состоянии. Не могут найти объяснения и другие исследователи, повторившие опыты Гриффита. Но странное явление установлено, и его надо изучить и понять. Конечно, мертвые пневмококки III типа не "воскресали". Но что же тогда? Может быть, в смеси штаммов, используемых Гриффитом, живые авирулентные пневмококки II типа в присутствии убитых нагреванием превращались в III тип, приобретая его капсулу и вирулентность? Но ведь это же невероятно. Такого никогда не бывало. И все-таки английский микробиолог Эвери с сотрудниками решает вести работу, исходя именно из такого невероятного предположения.
Причем Эвери хочет изучить возможность такого превращения не в опытах на животных, что у биологов называется in vivo, а исследовать это явление вне организма, то есть in vitro, в пробирке. Задача заключалась в том, чтобы выделить и определить химическую природу веществ, под влиянием которых может произойти превращение (трансформация) одного типа пневмококков в другой. И вот, проработав несколько лет и преодолев огромные технические трудности, Эвери и его сотрудники на нескольких парах штаммов пневмококков доказали, что трансформация одного типа в другой существует.
Насколько это была кропотливая и трудоемкая работа, можно судить хотя бы по тому, что в первых опытах Эвери частота трансформации составляла лишь одну на миллион обрабатываемых клеток.
Вещество, под влиянием которого происходит превращение пневмококков, Эвери назвал трансформирующим фактором. Дальнейшее изучение химической природы выделенного вещества, проведенное Эвери, Мак-Леодом и Мак-Карти, анализы, проделанные другими исследователями, позволили установить, что это дезоксирибонуклеиновая кислота (ДНК). Произошло это в 1944 году.
Итак, если из пневмококков III типа выделить дезоксирибонуклеиновую кислоту и добавить ее в питательную среду, где растут пневмококки II типа, то эти последние приобретают некоторые ранее им не свойственные признаки, в точности соответствующие признакам III типа пневмококков, из которых была выделена ДНК. В частности, пневмококки II типа "одеваются" в массивные полисахаридные капсулы, которых у них до этого никогда не было.
После выделения и дальнейшего выращивания трансформированные клетки не только сохраняли капсулу, но и приготовленные из них экстракты обладали той же трансформирующей способностью, как и полученные из исходного штамма. Тем самым было показано, что трансформация in vitro приводит к точно такому же наследственному изменению, какое происходило in vivo шестнадцать лет назад в опытах Гриффита.
Наследственный для одного типа пневмококков признак наличия капсул стал наследственным уже для другого типа. Это был первый в истории случай наследственной передачи признаков с одной разновидности микробов на другую через искусственно выделенное химическое вещество. Дезоксирибонуклеиновая кислота - вещество, через которое передаются наследственные признаки, - материальный субстрат наследственности, Только такой вывод можно было сделать из опытов Эвери. Вывод этот был столь разительным, что не все генетики с ним сразу согласились. Действительно, почему следует отдать предпочтение какой-то нуклеиновой кислоте, когда в экстрактах, которыми пользовался Эвери, имелась, хотя и очень незначительная, примесь белков? Белок и нужно считать тем веществом, которое передало наследственные признаки от одного типа пневмококков другому. Ведь белок - основа жизни.
Жизнь - форма существования белковых тел. Вся живая природа - от гигантского дуба до маленькой былинки, от слона и кита до микроскопической бактерии- построена из белков. Да и строение самих белковых молекул известно. Немногим более 20 "строительных кирпичиков" - аминокислот, из которых складываются молекулы белков, встречается в природе. Как будто очень немного. Однако если допустить, что в образовании существующих в живой природе белков принимают участие всего лишь 16 аминокислот, и то число возможных сочетаний, в которые способны вступить эти соединения в различных количественных отношениях, будет поистине астрономическим. Оно выражается цифрой 24 с 17 нулями! Поскольку каждая такая комбинация дает определенный белок, не удивительно, что белки различных видов животных и растений, а также индивидуумов данного вида и различных тканей каждого индивида представляют собой нечто более или менее своеобразное, специфическое. Так обстоит дело с белками.
А что можно сказать про нуклеиновые кислоты? Строение их молекул неизвестно, их место в общей цепи обмена веществ в клетке непонятно. И приписывать ДНК участие в передаче наследственных признаков просто абсурдно.
Так рассуждали некоторые биологи, и в тот период в какой-то мере их можно было понять. Для доказательства наследственной роли ДНК опытов Эвери было мало.
Читайте также:


