Резистентность стрептококков к антибиотикам
Стрептококки представляют собой бактерии, разделенные на несколько групп. Для лечения каждой из них имеется ряд определенных препаратов. Поэтому антибиотики от стрептококка могут быть разными. Наиболее часто эти бактерии поражают слизистые поверхности, а также кожу рук, лица и шеи. Кроме того, эта инфекция нередко проявляет себя в виде заболеваний верхних дыхательных путей.
Почему они возникают
Человек может инфицироваться стрептококками половым путем, через слюну или слизь. Нередко заболевания передаются в результате контакта с носителем инфекции. Как правило, бактерии группы Альфа вызывают такие болезни как ангина, рожа, воспаление легких (пневмония), пародонтит, ревматизм и скарлатина. Стрептококки, относящиеся к группе B, провоцируют развитие воспалений половой системы.
Признаки заболевания
Определить наличие инфекции можно по следующим симптомам.
- У больного резко поднимается температура.
- Миндалины покрываются довольно толстым слоем гноя.
- Увеличиваются лимфатические узлы.
- Боль в горле становится острой и постоянной.
При инфицировании мочеполовой системы появляются неприятные выделения из влагалища, сопровождающиеся резким запахом. Как женщин, так и мужчин тревожит зуд и покраснение половых органов. Если в результате инфицирования пострадал кожный покров, то у человека может наблюдаться озноб, сонливость и покраснение, сопровождающееся зудом. Кроме того, у пациента обязательно поднимается температура тела. Причем она будет колебаться от тридцати семи до тридцати девяти градусов. В конечном итоге кожа покрывается пузырьками и шелушащимися наростами.
Как определить заболевание? Для этого существуют свои методы диагностики. Понадобятся мазки, рентген легких, УЗИ мочевого пузыря и почек. А также больной сдает анализ крови.
Как лечить

Для того, чтобы избавится от стрептококковой инфекции пациенты принимают антибиотики. Лечение стрептококковой инфекции обычно длится от пяти до семи дней. Кроме того, им также понадобятся препараты, восстанавливающие здоровую микрофлору желудка и кишечника. В качестве укрепляющего иммунитет средства врач назначает курс приема витаминов. А также способствуют быстрому выздоровлению процедуры в физкабинете. Они не только улучшат процесс кровообращения, но и уничтожат остатки бактерий.
Он относится к антибиотикам первого поколения. Его назначают, как правило, при лечении верхних дыхательных путей, в том числе и лор заболеваний. А также при инфекции мочеполовой системы, включая почки и инфицирования кожного покрова. Лечение стрептококка антибиотиками сложно представить без этого средства. Препарат не выписывают детям до шести лет. Если у ребенка масса тела ниже сорока килограмм, то ему можно принимать не более тридцати миллиграмм препарата в сутки. Обычная доза составляет 1000 миллиграмм в день. Ее обычно разделяют на два раза. В редких случаях врач может увеличить ежедневный прием средства до 3000 миллиграмм.
Противопоказан этот антибиотик в случае острых заболеваний почек. Иногда у больного могут наблюдаться неблагоприятные симптомы. Например, чаще всего возникает понос, головокружение и тошнота. Кроме того, может появиться высыпание на коже, сопровождающееся зудом. Хранится средство в течении трех лет при температуре, не превышающей тридцати градусов.
В его составе содержится 500 миллиграмм эритромицина, а в качестве дополнительных компонентов добавлен крахмал, повидон, стеарат магния, макрогол и тальк. Он продается в виде таблеток с яркой оболочкой. Этот антибиотик от гемолитического стрептококка. С его помощью отлично избавляются от многих заболеваний верхних дыхательных путей, а также инфекций, передающихся половым путем. Пациентам, у которых присутствуют нарушения в работе печени или почек, следует быть осторожными и строго придерживаться рекомендаций лечащего врача.
Как правило, употребляют препарат один раз в день примерно за полчаса до еды или спустя два часа после нее. При сложных заболеваниях иногда требуется двойная доза препарата. Ее обязательно разделяют на два раза и выпивают утром и вечером. Следует учитывать, что стрептококк без антибиотиков вылечить крайне сложно. Курс лечения обычно составляет пять дней. В случае передозировки возникает сыпь на коже, боль в желудке и тошнота. У некоторых пациентов может появиться головная боль и слабость.

Он отлично проникает во все ткани внутренних органов и препятствует развитию вредоносной микрофлоры. Большая часть средства выходит с мочей. Он предназначен для лечения гайморита, тонзиллита, воспаления легких и тому подобных заболеваний. Иногда врачи назначают этот антибиотик при роже, дизентерии, холецистите и воспалении почек.
Он представляет собой капсулы или таблетки антибиотики, лечащие стрептококк. Они содержат от полграмма до четверти активного компонента кларитромицина. В качестве дополнительных веществ присутствует стеарат магния, коллоидный диоксид и кросскармелоза. Средство содержится в упаковке в количестве от семи до четырнадцати штук. Его назначают при различных заболеваниях верхних дыхательных путей, а также он входит в состав комплексного лечения язвы желудка. Не рекомендуется его использовать для лечения детей, не достигших двенадцатилетнего возраста.
Он относится к группе пенициллинов. Это еще один антибиотик, убивающий стрептококк. С его помощью можно избавиться от ларингита, стоматита, синусита, рожи, скарлатины и острого отита. Продается препарат в виде таблеток или порошка для приготовления раствора. Кроме того, в аптеке можно встретить также сироп для лечения детей. Среди побочных эффектов, которые часто возникают во время курса, чаще всего наблюдают диарею, конъюнктивит, насморк, а также потерю аппетита.
Употребляют его следующим образом. Маленьким детям, не достигшим двенадцати месяцев, обычно дают не более тридцати миллиграмм в сутки. Взрослые пациенты, как правило, используют по 0,5 грамм препарата через каждые шесть часов.

Принимают препарат обычно по одной капсуле через два или три часа после приема пищи. Капсулу крайне не рекомендуется раскрывать. Она находится в удобной желатиновой оболочке и поэтому отлично проглатывается даже маленькими детьми. В зависимости от характера заболевания, врач может назначить прием препарата через каждые восемь часов. Курс лечения составляет от одной недели до двух. Если у пациента присутствуют болезни почек и печени, то следует увеличить временной промежуток между приемом препарата.
Как и при использовании других антибиотиков, это средство может вызвать дисбактериоз, который очень часто выражается расстройством стула и бурлением в желудке. Кроме того, иногда возникает головокружение и сонливость. Некоторые пациенты также отмечают снижение работоспособности. В редких случаях появляется сыпь и зуд на коже. Хранится препарат в течение трех лет при температуре не выше двадцати пяти градусов.
В аптеке эти антибиотики от стрептококка можно встретить только в виде таблеток. Препарат используется для лечения острых отитов, воспаления легких и почек, заболеваний мочеполовой системы, острых артритов, дерматозов и так далее. Как правило, его не назначают детям, вес которых менее двадцати килограмм.
Обычная дозировка препарата для ежедневного использования составляет три таблетки в сутки. Курс лечения длится от пяти до четырнадцати дней. В том случае, если произошла передозировка, рекомендуется сделать промывание желудка. В противном случае может возникнуть тошнота, сопровождающаяся рвотой, а также повреждение слизистой желудка.
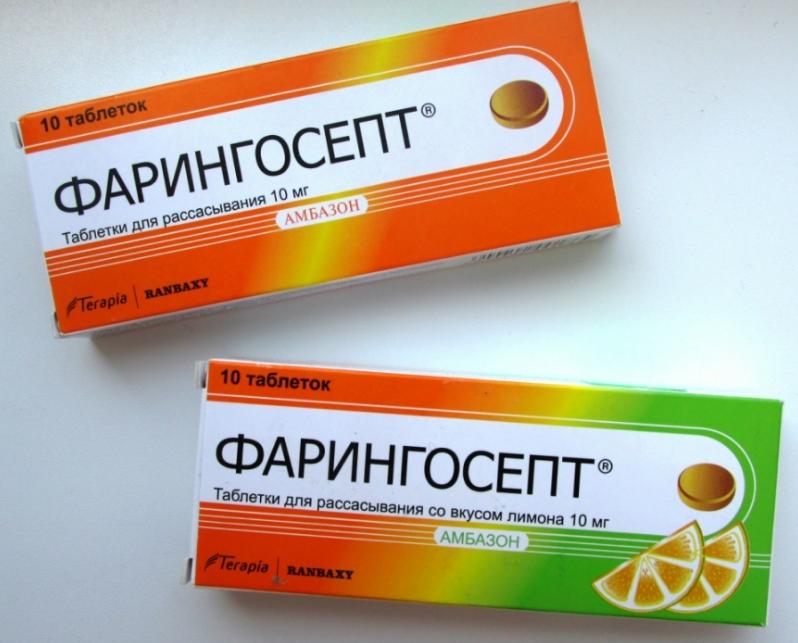
Это средство представлено в виде леденцов для рассасывания во рту. Как несложно догадаться, его назначают при заболеваниях горла и верхних дыхательных путей. Он хорошо зарекомендовал себя среди антибиотиков, действующих на стрептококк. Кроме того, он неплохо показал себя при комплексном лечении воспаления среднего уха. Количество леденцов, используемых в сутки, не должно превышать пяти штук. А также детям до семилетнего возраста дают не более трех леденцов в день. В случае передозировки иногда возникает сыпь и зуд на поверхности кожи. Срок хранения этого популярного средства составляет всего два года при температуре не выше двадцати пяти градусов.
Дополнительное лечение


Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Применение антибактериальных препаратов будет максимально эффективным, когда медикаментозная терапия является целенаправленной, то есть этиотропной: если возбудителем заболевания являются стрептококки, то следует применять антибиотики от стрептококков.
Для этого необходимо бактериологическое исследование – чтобы выделить и идентифицировать конкретную бактерию, подтвердив ее принадлежность к роду грамположительных бактерий Streptococcus spp.
Какие антибиотики убивают стрептококк?
Эффективными в отношении стрептококков могут быть препараты бактерицидного действия, способные не только преодолеть факторы их вирулентности – ферменты-антигены, цитотоксины (приводящие к β-гемолизу), поверхностные адгезивные белки, позволяющие стрептококку противостоять фагоцитозу – но и обеспечить эрадикацию патогена in vivo. И для того чтобы антибиотик мог искоренить бактерии, он должен проникать через их внешние мембраны и поражать уязвимые структуры клеток микроорганизма.
Основные названия антибактериальных фармакологических средств, которые считаются лучшими антибиотиками от стрептококка:
Антибиотики от гемолитического стрептококка или антибиотики против стрептококка группы А – β-гемолитического стрептококка группы А штамма Streptococcus pyogenes – включают и антибиотики от стрептококка в горле (поскольку указанный штамм вызывает стрептококковый фарингит и тонзиллит): β-лактамные карбапенемы – Имипенем (другие торговые названия – Имипенем с циластатином, Тиенам, Циласпен), Меропенем (Мепенам, Меробоцид, Инемплюс, Дорипрекс, Синерпен); антибиотики группы линкозамидов Клиндамицин (Клиндацин, Климицин, Клинимицин, Далацин); Амоксиклав (Амоксил, А-Клав-Фармекс, Аугментин, Флемоклав Солютаб).
Антибиотики от стрептококка пневмония – колонизирующей носоглотку комменсальной бактерии Streptococcus pneumoniae, часто называемой пневмококком включают все вышеперечисленные препараты, а также цефалоспориновые антибиотики IV поколения Цефпиром (Кейтен) или Цефепим.
Воспаление внутренней оболочки сердца чаще всего является следствием патогенного воздействия зеленящего стрептококка – альфа-гемолитического типа Streptococcus viridans. Если он с кровью попадает в сердце, то способен вызывать подострый бактериальный эндокардит (особенно у людей с поврежденными сердечными клапанами). Лечение зеленящего стрептококка антибиотиками проводят с помощью Ванкомицина (торговые названия – Ванкоцин, Ванмиксан, Ванкорус) – гликопептидного антибиотика.
Чувствительность стрептококков к антибиотикам – фактор успешного лечения
Прежде чем перейти к характеристике отдельных антибактериальных средств, используемых при стрептококковых инфекциях, следует подчеркнуть, что важнейшим фактором эффективности лечения является чувствительность стрептококков к антибиотикам, которой определяется способность лекарственных средств уничтожать бактерии.
Нередко эффективность антибиотикотерапии настолько мала, что возникает вопрос – почему антибиотик не убил стрептококк? Данные бактерии – в частности, Streptococcus pneumoniae – за последние два десятка лет продемонстрировали значительное повышение резистентности, то есть сопротивления антибактериальным препаратам: на них не действует тетрациклин и его производные; почти треть их штаммов не поддаются воздействию эритромицина и пенициллина; выработалась устойчивость к некоторым препаратам группы макролидов. А фторхинолоны изначально менее эффективны при стрептококковой инфекции.
Снижение чувствительности стрептококков к антибиотикам исследователи связывают с трансформацией отдельных штаммов в результате генетического обмена между ними, а также с мутациями и усилением естественного отбора, так или иначе спровоцированного теми же антибиотиками.
И речь идет не только о порицаемом медиками самолечении. Лекарство, назначенное врачом, тоже может оказаться бессильным перед стрептококковой инфекцией, поскольку в большинстве случаев антибактериальный препарат назначают без выявления конкретного возбудителя, так сказать, эмпирически.
Кроме того, антибиотик не успевает убить стрептококк, если пациент раньше времени прекращает принимать препарат, сокращая длительность курса лечения.
Полезная информация также в материале – Антибиотикорезистентность
Код по АТХ
Фармакологическая группа
Фармакологическое действие
Показания к применению антибиотиков от стрептококков
Штаммы, серотипы и группы стрептококков весьма многочисленны, как и вызываемые ими воспалительные заболевания, которые распространяются от слизистой глотки до оболочек головного мозга и сердца.
Список показаний к применению антибактериальных средств включает: перитонит, сепсис, септицемию и бактериемию (в том числе неонатальную); менингит; скарлатину; импетиго и рожу; стрептодермию; лимфаденит; синусит и острый средний отит; пневмококковые фарингит, тонзиллит, бронхит, трахеит, плеврит, бронхопневмонию и пневмонию (в том числе нозокомиальную); эндокардит. Эффективны при инфекционных воспалениях мягких и костной тканей (абсцессах, флегмонах, фасцитах, остеомиелите) и поражениях суставов стрептококкового происхождения с ревматической лихорадкой в острой форме.
Данные антибиотики используются в лечении пиелонефрита и острого гломерулонефрита; воспаления мочеполовых органов; внутрибрюшной инфекции; послеродовых инфекционных воспалений и т.д.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Форма выпуска
Форма выпуска антибиотиков Имипенем, Меропенем, Цефпиром и Ванкомицин – стерильный порошок во флаконах, предназначенный для приготовления раствора, который вводится парентерально.
Амоксиклав выпускается в трех формах: таблетки для перорального применения (по 125, 250, 500 мг), порошок для приготовления принимаемой внутрь суспензии и порошок для приготовления раствора для инъекций.
А Клиндамицин имеет форму капсул, гранул (для приготовления сиропа), раствора в ампулах и 2% крема.

[11], [12], [13], [14], [15], [16]
Фармакодинамика
Бета-лактамные антибиотики Имипенем и Меропенем, относящиеся к карбапенемам (классу органических соединений, известных как тиенамицины), проникают в бактериальные клетки и мешают синтезу жизненно важных компонентов их клеточных стенок, что приводит к разрушению и гибели бактерий. От пенициллинов эти вещества несколько отличаются строением; кроме того, в состав Имипенема входит натрия циластатин, который тормозит его гидролиз почечной дегидропептидазой, что продлевает воздействие препарата и повышает его эффективность.
Сходный принцип действия имеет Амоксиклав – комбинированный препарат с аминопенициллином амоксициллином и клавулановой кислотой, которая является специфическим ингибитором β-лактамаз.
Фармакодинамика Клиндамицина базируется на связывании с субъединицей 50 S рибосом клеток бактерий и угнетении белкового синтеза и роста РНК-комплекса.
Цефалоспориновый антибиотик четвертого поколения Цефпиром также нарушает выработку гетерополимерных пептидогликанов (муреинов) каркаса стенок бактерий, приводя к разрушению пептидогликановых цепочек и лизису бактерий. А механизм действия Ванкомицина кроется как в ингибировании синтеза муреинов, так и в нарушении синтеза РНК бактерий Streptococcus spp. Преимущество данного антибиотика в том, что он, не имея в своей структуре β-лактамного кольца, не подвергается воздействию защитных ферментов бактерий – β-лактамаз.

[17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27]
Фармакокинетика
Меропенем проникает в ткани и биологические жидкости, но связывание с белками плазмы не превышает 2%. Расщепляется с образованием одного неактивного метаболита. Две трети препарата элиминируется в первоначальном виде; при в/в введении период полувыведения составляет 60 минут, при в/м инъекции – около полутора часов. Выводится из организма почками в среднем через 12 часов.
В фармакокинетической характеристике Клиндамицина отмечается его 90%-ая биодоступность и высокая степень связывания с альбуминами крови (до 93%). После приема внутрь максимальная концентрация препарата в крови достигается примерно через 60 минут, после введения в вену – через 180 минут. Биотрансформация происходит в печени, часть метаболитов терапевтически активны. Выведение из организма длится около четырех суток (через почки и кишечник).
Цефпиром вводится путем инфузии, и хотя с белками плазмы крови препарат связывается менее чем на 10%, в течение 12 часов терапевтическая концентрация в тканях удерживается, а биодоступность составляет 90%. Данный препарат в организме не расщепляется и выводится почками.
После перорального приема Амоксиклава в кровь амоксициллин и клавулановая кислота попадают примерно через час, а выводятся вдвое дольше; связывание с белками крови 20-30%. При этом накопление препарата отмечается в синусах верхней челюсти, легких, плевральной и спинномозговой жидкостях, в среднем ухе, брюшной полости и органах малого таза. Амоксициллин почти не расщепляется и выводится почками; метаболиты клавулановой кислоты экскретируются через легкие, почки и кишечником.
Для фармакокинетики Ванкомицина характерно связывание с белками плазмы крови на уровне 55% и проникновение во все биологические жидкости организма и через плаценту. Биотрансформация препарата незначительна, а период полувыведения составляет в среднем пять часов. Две трети вещества выводится почками.

[28], [29], [30], [31], [32], [33], [34], [35], [36], [37]
Использование антибиотиков от стрептококков во время беременности
Безопасность применения антибиотиков-карбапенемов (Имипенема и Меропенема) беременными производителями не установлена, поэтому их использование во время беременности допускается только значительном перевесе пользы для будущей матери над потенциальным негативным воздействием на плод.
Таков же принцип использования беременным и кормящим Клиндамицина и Амоксиклава.
При беременности применять Цефпиром запрещается. Запрет на использование Ванкомицина касается первого триместра беременности, а на более поздних сроках применение допускается только в крайних случаях – при наличии угрозы жизни.
Противопоказания
Основные противопоказания к применению:
Имипенем и Меропенем – наличие аллергии и повышенная чувствительность к препаратам, детский возраст до трех месяцев;
Клиндамицин – воспаление кишечника, недостаточность печени или почек, детский возраст до года;
Цефпиром – непереносимость пенициллина, беременность и лактация, возраст пациентов младше 12-ти лет;
Амоксиклав – повышенная чувствительность к пенициллину и его производным, застой желчи, гепатит;
Ванкомицин – нарушения слуха и кохлеарный неврит, недостаточность почек, первый триместр гестации, лактационный период.

[38], [39], [40], [41], [42], [43]
Побочные действия антибиотиков от стрептококков
Наиболее вероятные побочные действия Имипенема, Меропенем и Цефпирома включают:
болезненность в месте укола, тошноту, рвоту, диарею, кожные высыпания с зудом и гиперемией, снижение уровня лейкоцитов и повышение содержания мочевины в крови. Также может быть гипертермия, головная боль, нарушение дыхания и сердечного ритма, судороги, нарушение микрофлоры кишечника.
Кроме уже перечисленных, побочные эффекты Клиндамицина могут проявляться в виде привкуса металла во рту, гепатита и холестатической желтухи, повышения уровня билирубина в крови, боли в эпигастральной области.
Применение Амоксиклава может сопровождаться тошнотой, рвотой и диареей, острым воспалением кишечника (псевдомембранозным колитом) из-за активизации оппортунистической инфекции – клостридий, а также экссудативной эритемой кожи и развитием токсической некротизации эпидермиса.
Аналогичные побочные действия могут проявлять при лечении зеленящего стрептококка антибиотиками-гликопептидами (Ванкомицином). Кроме того, данный антибиотик может негативно повлиять на слух.

[44], [45], [46]
Способ применения и дозы
Способ применения препаратов зависит от их формы выпуска: таблетки принимают внутрь, растворы для инъекции вводятся парентерально.
Имипенем может вводиться в вену (медленно, в течение 30-40 минут) и в мышцу, но внутривенное введение практикуется чаще. Разовая доза взрослым составляет 0,25-0,5 г (в зависимости от заболевания), количество инъекции – три-четыре в течение суток. Дозы для детей определяют по массе тела – по 15 мг на каждый килограмм. Максимальная суточная доза для взрослых – 4 г, для детей – 2 г.
Меропенем вводят в вену – струйно или капельно: через каждые 8 часов по 0,5-1 г (при менингите – по 2 г). Для детей до 12 лет дозировка из расчета 10-12 мг на каждый килограмм массы тела.
Капсулированный Клиндамицин принимается внутрь – по 150-450 мг четыре раза в сутки в течение десяти дней. Для детей больше подходит сироп: до года – по половине чайной ложки трижды в день, после года - по чайной ложке. Инъекции Клиндамицина – внутривенные капельные и внутримышечные – назначаются в суточной дозе от 120 до 480 мг, (делится на три введения); продолжительность парентерального применения – 4-5 дней с переходом на прием капсул до окончания курса лечения, общая продолжительность которого составляет 10-14 дней. Клиндамицин в форме вагинального крема используют раз в сутки в течение недели.
Антибиотик от стрептококков Цефпиром вводят только внутривенно, а доза зависит от патологии, которую вызвал стрептококк – по 1-2 г дважды в течение суток (через 12 часов); максимально допустимая доза – 4 г в сутки.
Амоксиклав взрослым и детям старше 12-ти лет вводится внутривенно четыре раза в сутки по 1,2 г; детям до 12-ти лет – по 30 мг на килограмм массы тела. Курс лечения – 14 дней с возможным переходом (по состоянию) на прием таблеток. Таблетки Амоксиклав принимают во время еды по 125-250 мг или по 500 мг два-три раза в сутки в течение 5-14 дней.
Разовая доза Ванкомицина, который требует очень медленного в/в введения, для взрослых составляет 500 мг (через каждые шесть часов). Для детей дозу рассчитывают: на каждый килограмм веса ребенка – по 10 мг.

[47], [48], [49], [50]

Streptococcus pneumoniae — основной возбудитель внебольничной пневмонии, менингита, сепсиса, бактериемии и среднего отита. Пенициллин, вошедший в клиническую практику в начале 1940-х годов, при пневмококковых инфекциях показал крайне высокую клиническую эффективность, однако уже в 1967 году появились первые подтвержденные сообщения о выделении устойчивых к нему изолятов. Еще через 10 лет вспышка пневмококковой инфекции в Южной Африке подтвердила существование множественной резистентности этого возбудителя к пенициллину, тетрациклину, эритромицину, левомицетину, клиндамицину и рифампицину. Исследования показали, что устойчивые к антибиотикам изоляты S. pneumoniae выделяются и у пациентов, ранее не получавших антибактериальную терапию. Распространение антибиотикорезистентности, связанное с чрезмерным и порой неоправданным использованием антибиотиков, стало серьезной проблемой медицины.
Бета-лактамы
Устойчивость S. pneumoniae к пенициллину и другим бета-лактамам развивается вследствие мутации, приводящей к структурным изменениям пенициллин-связывающего белка (ПСБ). К семейству ПСБ относятся ферменты, отвечающие за синтез пептидогликанов бактериальной клетки. При их блокировании пенициллином нарушается целостность клеточной стенки, что ведет к лизису клетки и ее гибели. У S. pneumoniae описаны 6 видов ПСБ; три из них имеют наибольшее значение для развития резистентности: ПСБ1а, ПСБ2х и ПСБ2b, при этом мутация гена ПСБ1а приводит лишь к снижению чувствительности к пенициллину.
Чувствительность бактерий к антибиотикам in vitro оценивается по значению минимальной подавляющей концентрации (МПК) — это та концентрация препарата, которая приводит к видимому подавлению роста возбудителя в тестовой среде. Так как у пневмококка присутствует несколько видов ПСБ, единичной мутации еще недостаточно для формирования высокого уровня резистентности к пенициллину. Накопление мутаций приводит к постепенному и ступенчатому нарастанию МПК, и для развития клинически значимой резистентности к пенициллинам необходимо сочетание нескольких мутаций. Такой механизм в значительной степени может преодолеваться увеличением дозы препарата или изменением режима его применения. Сниженная чувствительность или резистентность S. pneumoniae к пенициллину распространяется и на другие бета-лактамные антибиотики. В меньшей степени нарушается связывание парентеральных цефалоспоринов 4 и 5-го поколений и карбапенемов.
Макролиды
Группу макролидов объединяет наличие в структуре молекулы лактонового кольца, которое может состоять из 12–16 атомов. Механизм действия этих антибиотиков связан с блокированием рибосомальной РНК бактерий и подавлением РНК-зависимого синтеза белка. Уровень устойчивости S. pneumoniae к макролидам в США в настоящее время варьирует от 20 до 40 %. Формирование нечувствительности к этой группе антибиотиков может быть связано с двумя независимыми механизмами:
Первый механизм связан с эффлюксом — способностью микроорганизма активно выводить антибиотик из клетки. Этот механизм кодируется геном mef(A) бактерий и реализуется за счет работы внутриклеточного насоса — эффлюксной помпы. Он характерен для 14- и 15-членных макролидов; 16-членные макролиды эффлюксу не подвержены. В прежние годы эффлюкс приводил к небольшому увеличению МПК и низкому уровню резистентности пневмококка к макролидам. Создание высоких концентраций препарата в очаге инфекции иногда помогало преодолеть работу эффлюксной помпы. Однако в последние годы МПК для изолятов S. pneumoniae, обладающих механизмом эффлюкса, увеличились еще в 2–4 раза, и это практически лишило макролиды способности действовать в очаге инфекции, вызванной устойчивыми к ним возбудителями.
Второй механизм, связанный с наличием гена erm(B), состоит в модификации области связывания антибиотика с его мишенью — 23S РНК, компонентом 50S субъединицы бактериальных рибосом. Приобретение бактерией этого гена сразу приводит к развитию высокого уровня устойчивости к 14-, 15- и 16-членным макролидам, линкозамидам и стрептограмину В (MSLB-фенотип). MSLB-фенотип резистентности пневмококка превалирует во всем мире, хотя в отдельных регионах, в частности, в США, преобладает вариант, связанный с геном mef(A). Также описаны изоляты, имеющие сразу оба механизма резистентности. Их доля в последние годы нарастает, и при этом они обычно устойчивы к целому ряду антибиотиков.
Линкозамиды
Единственный препарат из этой группы, который в настоящее время используется в клинической практике — это клиндамицин. Механизм его действия обусловлен связыванием с 50S субъединицей рибосом микробной клетки и, таким образом, ингибированием синтеза белка. В результате невозможности формирования пептидных связей нарушается строение клеточной стенки, что приводит к уменьшению адгезии S. pneumoniae к клеткам хозяина и увеличению фагоцитарной активности в отношении самой бактерии. Клиндамицин относится к бактериостатическим препаратам, но в отношении некоторых штаммов S. pneumoniae действует бактерицидно. Из-за высокой активности против стрептококков и стафилококков клиндамицин используется для лечения вторичных внебольничных инфекций, развивающихся на фоне инфекции S. pneumoniae, и в качестве альтернативного препарата при наличии устойчивости к бета-лактамным антибиотикам.
Хотя линкозамиды и макролиды имеют разную химическую структуру, для них характерен один и тот же механизм резистентности пневмококка, связанный с геном erm B. Данные исследования SENTRY, проведенного в 2008 году, показывают, что лишь 80 % штаммов S. pneumoniae в США чувствительны к клиндамицину. В 2011 году этот показатель оказался еще ниже — 78 %. Для клиндамицина характерен феномен индуцибельной резистентности, развивающейся в ходе терапии, поэтому его не следует использовать для эмпирической терапии тяжелых пневмококковых инфекций при отсутствии данных диско-диффузионного теста на подавление чувствительности бактерий к клиндамицину в присутствии макролида.
Фторхинолоны
На момент открытия фторхинолонов повсеместно наблюдалась высокая чувствительность S. pneumoniae к этим антибиотикам. Тем не менее, ципрофлоксацин сегодня не рассматривается в качестве противопневмококкового препарата, так как его фармакокинетические параметры в терапевтических дозах не препятствуют селекции резистентных изолятов. В 2007 году Американское общество инфекционных болезней (IDSA) и Американское торакальное общество (ATS) исключили ципрофлоксацин и другие ранние фторхинолоны из перечня препаратов для лечения инфекций, вызванных S. pneumoniae. Фторхинолоны последнего поколения обладают высокой противопневмококковой активностью, доступны как в парентеральной, так и в пероральной форме и играют важную роль в лечении пневмококковых инфекций, устойчивых к другим антибиотикам.
Фторхинолоны непосредственно подавляют синтез ДНК бактерий. Для репликации ДНК микроорганизма необходимо наличие двух ферментов — ДНК-гиразы и топоизомеразы, которые блокируются хинолоновым кольцом этой группы антибиотиков. У отдельных фторхинолонов отмечается разное сродство к ферментам, участвующим в репликации, при этом большинство препаратов имеют большее или меньшее сродство к обоим из них. Первое и второе поколения фторхинолонов действуют преимущественно на топоизомеразу II, а последующие поколения — на топоизомеразу IV, что увеличивает их активность в отношении грамположительных бактерий, включая S. pneumoniae.
Описаны 3 механизма формирования резистентности пневмококков к действию фторхинолонов.
Первый из них связан с накоплением мутаций генов топоизомеразы (parC и parE) и ДНК-гиразы (gyrA и gyrB), приводящих к структурным изменениям активных сайтов ферментов. Для развития высокого уровня устойчивости к фторхинолонам 3–4-го поколений необходимо сочетание двух мутаций: gyrA и parC. Мутации генов gyrB и parЕ встречаются редко, и их клиническое значение неясно.
Второй механизм связан с действием эффлюксной помпы, которая удаляет антибиотик из бактериальной клетки. Способность бактерий к активному выведению антибиотика для разных фторхинолонов неодинакова — так, левофлоксацин подвержен эффлюксу в значительно меньшей степени, чем ципрофлоксацин.
Третий механизм — плазмидная резистентность, связанная с продукцией плазмидами белков, защищающих мишени действия фторхинолонов. Такой механизм распространен в США, Европе и Восточной Азии. Обычно он приводит к низкому уровню резистентности, но может вносить вклад и в развитие резистентности высокого уровня за счет кумулятивного действия при сочетании с другими механизмами.
Тетрациклины
Доксициклин, препарат из группы тетрациклинов, был введен в практику как недорогой препарат для эмпирической терапии внебольничной пневмонии в 1940-х годах. К 2002 году 16,6 % пенициллин-резистентных S. pneumoniae были устойчивы к тетрациклину. В последние десятилетия количество устойчивых к тетрациклину штаммов пневмококка повсеместно нарастает.
Самый важный механизм формирования устойчивости S. pneumoniae к действию тетрациклинов — защита рибосом, позволяющая бактерии синтезировать белок даже при связывании антибиотика с рибосомальной мишенью. Механизм такой защиты точно не известен, но в нем участвуют белки, кодируемые генами tet(O) и tet(M). Имеются сообщения о том, что доксициклин более активен, чем тетрациклин, в отношении штаммов пневмококка, несущих ген tet(M). Этот антибиотик может применяться для лечения пневмококковых инфекций, но для этого должна быть подтверждена высокая чувствительность к нему S. pneumoniae в данном регионе. Необходимо учитывать, что доксициклин относится к антибиотикам широкого спектра действия, поэтому применение его при пневмококковых инфекциях должно быть ограничено во избежание роста резистентности других бактерий.
Ко-тримоксазол (триметоприм/сульфаметоксазол)
Комбинация триметоприма и сульфаметоксазола известна с 1968 года. Целесообразность создания такой комбинации была связана с синергичным воздействием этих двух препаратов на метаболизм фолиевой кислоты бактерии. Сульфаметоксазол блокирует фермент дигидроптероат-синтетазу, а триметоприм — дигидрофолат-редуктазу, которые участвуют в образовании нуклеиновых кислот. Таким образом, ко-тримоксазол препятствует размножению бактерий, т. е. обладает бактериостатическим действием.
Первоначально комбинация использовалась для лечения инфекций мочевыводящих путей, однако в дальнейшем показания для ее применения расширились и стали включать острый синусит, острый средний отит и обострение хронического бронхита. В силу низкой цены ко-тримоксазол был включен ВОЗ в перечень жизненно важных препаратов. Уже в 1980-х годах были описаны первые случаи устойчивости S. pneumoniae к триметоприму/сульфаметоксазолу. В дальнейшем ее быстрый рост был связан с очень частым назначением этих препаратов для лечения острого среднего отита у детей и профилактики СПИДа у взрослых — показание, в то время считавшееся оправданным. Триметоприм и сульфаметоксазол — препараты разных фармакологических групп, к ним существуют разные механизмы бактериальной резистентности, однако, поскольку они применяются в комбинации, то соответствующие генетические маркеры у одного и того же штамма обычно сочетаются. По данным эпидемиологических исследований, 1/3 штаммов S. pneumoniae в США устойчивы к ко-тримоксазолу, и этот показатель в разных регионах варьирует от 25 до 45 %. На данный момент подобная картина характерна как для развитых, так и для развивающихся стран. В силу этого ко-тримоксазол не должен рассматриваться как препарат выбора для лечения инфекций, вызванных S. pneumoniae.
Распространение устойчивости S. pneumoniae к большинству антибиотиков для современной медицины приобрело характер эпидемии. Выбор препарата для эмпирической терапии пневмококковых инфекций должен диктоваться как текущим уровнем антибиотикорезистентности, так и риском ее дальнейшего распространения в популяции. Наряду со строгим контролем использования антибиотиков должны прорабатываться альтернативные стратегии для уменьшения формирования резистентности микроорганизмов, включающие и возможности вакцинации.
Читайте также:


