Рпга с менингококковым диагностикумом
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
Групп А,В,С эритроцитарный
Полисахаридные группоспецифические антигены менингококка, адсорбированные на эритроцитах. Используется для серодиагностики менингококковой инфекции в РПГА.
Диагностикум бруцеллезный эритроцитарный
Антигенный сухой
Бруцеллезный антиген, адсорбированный на эритроцитах. Применяется для выявления специфических антител в сыворотке крови людей и животных в РПГА, а также для выявления бруцеллезных антигенов в объектах внешней среды и органах животных в РНат
Диагностикум туляремийный эритроцитарный
Антигенный жидкий и сухой
Туляремийный антиген, адсорбированный на эритроцитах. Используется для выявления специфических антител в РПГА, а также для обнаружения туляремийного антигена в объектах внешней среды, трупах и органах животных в РНат.
Диагностикум сыпнотифозный эритроцитарный жидкий
Антигены риккетсий Провацека, адсорбированные на эритроцитах. Используется для серодиагностики сыпного тифа в РПГА.
Диагностикум эритроцитарный Коксаки–В
Группоспецифический для РПГА.
Групповой адсорбированный на эритроцитах барана антиген вирусов Коксаки – В, выращенных в культуре клеток Нер – 2. Используется для выявления специфических антител в сыворотках крови человека в РПГА.
Диагностикум эритроцитарный коревой
Антигенный сухой для РПГА
Антигены вирусы кори, адсорбированные на эритроцитах барана. Препарат используется для выявления сывороточных антител к вирусу кори в РПГА.
Иммунные сыворотки и иммуноглобулины
Диагностические иммунные сыворотки – сывороточные препараты, содержащие антитела против одного (моновалентные) или нескольких (поливалентные) антигенов и используемые при идентификации возбудителей.
Их получают путем иммунизации животных (чаще кроликов, реже – ослов и лошадей) известными полноценными антигенами.
В зависимости от типа реакции, в которых предполагается использовать сыворотки, различают: агглютинирующие, преципитирующие, иммунофлюоресцентные и другие диагностические сыворотки.
Агглютинирующие сыворотки выпускают неадсорбированные (нативные) и адсорбированные (очищение от родственных антител в пределах группы, рода, семейства методом адсорбиции по Кастелляни ).
Сыворотка диагностическая к стрептококку группы А
Диагностическая сыворотка содержит антитела против полисахаридного антигена стрептококка группы А . Получена путем иммунизации кроликов или ослов убитой вакциной. Применяется для идентификации стрептококка группы А в реакции диффузной преципитации в агаровом геле (РДПА).
Сыворотка агглютинирующая эшерихиозная ОК – поливалентная
Препарат содержит антитела – агглютинины к поверхностным ( К ) и соматическим ( О ) антигенами эшерихий. Применяется для идентификации эшерихий по К и О антигенами в РА на стекле. Поливалентные сыворотки применяются для ориентировочной РА на стекле.
Сыворотка агглютинирующая адсорбированния поливалентная ОВ
К эшерихиям коли для реакции агглютинации
Сыворотка содержит специфические антитела – агглютинины к поверхностным (В) и соматическим (О) антигенам эшерихий. Применяется для реакции ориентировочной РА на стекле для идентификации эшерихий по В и О антигенам.
Сыворотка эшерихиозная агглютинирующая
адсорбированная О – 151
Сыворотка содержит антитела к антигену О – 151, получена путем иммунизации кроликов убитой культурой эшерихий О – 151, очищена от К – антигенов методом Кастелляни. Применяется для сероидентификации кишечных палочек в РА на стекле.
Сыворотка агглютинирующая адсорбированная к шигеллам
Флекснера поливалентная
Препарат содержит антитела к шигеллам Флекснера нескольких серотипов. Применяется для идентификации шигелл Флекснера в РА на стекле. При положительной реакции агглютинации культуру проверяют с каждой из сывороток, входящих в поливалентную.
Менингококки.
Менингококки относятся к роду Neisseria, род N. meningitidis.
Это диплококки бобовидной формы, в мазках имеют вид кофейных зерен. Спор не образуют, жгутиков не имеют, в организме образуют капсулу. Грамотрицательные. Строгие аэробы.
Менингококки требовательны к питательным средам — растут только на средах, содержащих человеческий белок (сывороточный агар, асцитагар), при температуре 37 °С. На сывороточном агаре образуют нежные прозрачные колонии средней величины. В сывороточном бульоне дают рост в виде помутнения и осадка на дне.
Биохимически малоактивны, ферментируют только глюкозу и мальтозу, образуя кислоту, но не образуя газ. Крайне неустойчивы во внешней среде, чувствительны к перемене температуры, погибают при температуре ниже 37 °С.
По капсульному полисахаридному антигену менингококки подразделяют на четыре основные серогруппы (группы А, В, С, D) и три дополнительные (X, Y, Z).
Клинические формы могут быть различными: менингококковый назофарингит, цереброспинальный менингит, менингококкцемия (менингококковый сепсис), менингококковый эндокардит и др.
После перенесенного заболевания формируется стойкий видоспецифический антимикробный иммунитет. У детей младшего возраста имеется пассивный иммунитет, обусловленный полученными от матери IgG.
1) бактериологическое исследование; материал для исследования определяется клинической формой заболевания; среда —
сывороточный агар;
2) иммуноиндикация: иммунофлюоресценция, ИФА, реакции
преципитации, латексагглютинации;
3) серодиагностика: РПГА с парными сыворотками (для диагностики генерализованных форм инфекции). Лечение: этиотропная терапия: сульфаниламиды, пенициллины, хлорамфеникол.
химическая менингококковая вакцина, содержащая поли
сахаридные антигены серогрупп А и С (активный антимикробный иммунитет);
человеческий иммуноглобулин (пассивный антимикробный иммунитет).
Менингококковую инфекцию вызывают менингококки — Neisseria meningitidis (бактерии 3й группы патогенности). Материалом для исследования служит отделяемое носоглотки, спинномозговая жидкость, кровь, соскоб из элементов геморрагической сыпи на коже, секционный материал.
Менингококки очень чувствительны к колебаниям температуры, поэтому материал сразу же сеют на питательные среды или немедленно, не допуская охлаждения, отправляют в лабораторию, где до посева сохраняют в термостате.
Отделяемое слизистой оболочки носовой части глотки снимают специальным клювовидным (изогнутым под углом) тампоном. Наиболее результативным является немедленный посев носоглоточной слизи на плотные питательные среды с тщательным разобщением бактериальных клеток. Если время доставки в лабораторию превышает 3 ч., то тампон помещают в пробирку с 3 мл среды обогащения (содержит 0,1 % агарагара, 20% сыворотки и 20 ЕД/мл ристомицина) и ставят в термостат при 37 °С (после подращивания материал высевают на сывороточный агар).
Микроскопия. Микроскопическое исследование спинномозговой жидкости и крови дает возможность определить наличие возбудителя. Если спинномозговая жидкость имеет вид гноя, то мазки готовят без ее предварительной обработки; при незначительной мутности спинномозговую жидкость центрифугируют и из осадка делают мазки. Окрашивают их по Граму, водным раствором основного фуксина и/или метиленовым синим. При окраске по Граму форменные элементы спинномозговой жидкости могут изменяться, что осложняет обнаружение возбудителя. Менингококки имеют вид диплококков бобовидной формы, соприкасающихся вогнутыми краями и расположенных внутри цитоплазмы лейкоцитов. Часто обнаруживается нежная капсула. При менингококцемии менингококки иногда можно обнаружить в мазках крови. Для этого готовят препарат толстой капли и без фиксации окрашивают его 2 — 3 мин водным раствором метиленовой сини, лишнюю окраску смывают водопроводной водой и высушивают пре, парат на воздухе. На голубом фоне препарата видны окрашенные в темносиний цвет лейкоциты, а между ними множество мелких, темносиних кокков, расположенных в виде кучек, парно или по одному.
Экспресс-диагностика основана на обнаружении в спинномозговой жидкости или крови больного специфического антигена, Осуществляется с помощью латексагглютинации, ИФА, встречного иммуноэлектрофореза с групповыми преципитирующими сыворотками. Эти методы приобретают особое значение при неэффективности микроскопической диагностики и посевов.
Бактериологическое исследование. Менингококк растет на питательных средах с нативным белком (бульон или агар сывороткой, асцитической жидкостью или кровью). Для исследования материала, обильно контаминированного нормофлорой мазки из носоглотки), применяют посев на плотные селективыс среды с антибиотиками (ристомицином, ванкомицином и нистатином). Спинномозговую жидкость лучше сеять после центрифугирования (3000 об/мин в течение 5 мин). Засевают 2 — 3 капли полученного осадка на поверхность подогретой питательной среды в чашке и инкубируют при 37 "С в атмосфере с повышенным содержанием СО2 (используют СО2инкубатор, газогенераторные пакеты или эксикатор с зажженной свечой). Остаток спинномозговой жидкости используют для РВИЭФ и других методов индикации возбудителя. Как правило, одновременно с прямым посевом материал засевают на среду обогащения (например, полужидкую сывороточную среду) с последующим пересевом на плотные среды для выделения чистой культуры.
На 3й день исследования для идентификации чистой культуры у нее выявляют оксидазную активность и делают посев на среды с углеводами. Менингококки обладают оксидазой, ферментируют глюкозу и мальтозу с образованием кислоты, лактозу, сахарозу и фруктозу не ферментируют, полисахарид из сахарозы не образуют, не растут в присутствии 0,2% желчи. Для выявления оксидазной активности на кусочек фильтровальной бумаги, смоченной каплей свежеприготовленного 1%го раствора солянокислого парадиэтилфенилендиамина, петлей наносят культуру менингококков. Культуры, обладающие оксидазной активностью, в течение 30 — 60 с вызывают вначале порозовение, а затем почернение бумаги с реактивом. Для определения способности образовывать полисахарид культуры нейссерий засевают на бескрахмальную среду с 1 % сахарозы и инкубируют при 37 °С в течение 24 — 48 ч, после чего на рост наносят каплю йодного раствора Люголя. В случае образования полисахарида сразу развивается буро-лиловое окрашивание.
Для дифференциации менингококка и непатогенных нейссерий (Neisseria mucosa, Neisseria sicca и др.) используют свойство последних расти на простых питательных средах, а также способность образовывать колонии при комнатной температуре (22 °С).
Для обнаружения менингококка в крови во флаконы с 50 мл бульона, содержащего 0,1 % агарагара, засевают 5 —10 мл крови, асептически взятой из вены. Через сутки делают пересев культуры на сывороточный агар. Выделение и идентификация культур осуществляются таким же образом, как и при исследовании спинномозговой жидкости.
Серологическое исследование.Серодиагностику применяют в качестве вспомогательного метода (в основном для эпидемиологического анализа). Ставят РНГА с эритроцитами, нагруженными группоспецифическими полисахаридными АГ или ИФА с теми же антигенами.
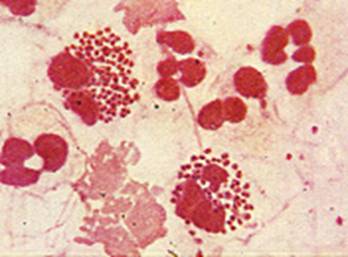
Рис. Колонии менингококков.
Гонококки
Относятся к роду Neisseria, вид N. gonorrhoeas.
Это диплококки бобовидной формы, в мазках располагаются внутриклеточно в протоплазме лейкоцитов, имеют вид кофейных зерен.
Спор не образуют, неподвижны, образуют микрокапсулу, грамотрицательные. Являются облигатными аэробами.
Гонококки исключительно требовательны к питательным средам, растут только на средах, содержащих человеческие белки (сывороточном агаре, асцитагаре и др.). На сывороточном агаре образуют мелкие блестящие колонии в виде капель.
1)Биохимически малоактивны, расщепляют только глюкозу (до кислоты).
Гонококковая инфекция— антропонозная инфекция, источник заражения — больной человек, носительства не бывает. Путь передачи половой, возможно заражение новорожденного при прохождении через родовые пути больной матери.
Клинические формы гонококковой инфекции:
1) гонорея (урогенитальная, экстрагенитальная);
2) гонококковая септикопиемия;
3) специфический конъюнктивит новорожденных (возникает
только при прохождении через родовые пути больной гонореей матери).
По длительности течения гонореи и выраженности клинических признаков различают:
1) свежую гонорею (длительность течения не более 2 месяцев):
2) хроническую гонорею (вялотекущее заболевание продолжительностью более 2 месяцев или с неустановленным сроком).
По клиническому течению различают:
1) неосложненную гонорею (гнойное воспаление нижних отделов урогенитального тракта);
2) осложненную гонорею (процесс распространяется на верхние отделы мочеполовой системы).
Перенесенное заболевание не оставляет стойкого иммунитета. Диагностика:
1) при острой форме:
а) бактериоскопия мазка отделяемого уретры, шейки матки;
б) бактериологическое исследование;
2) при хронической форме:
б) бактериологическое исследование;
в) серодиагностика — РСК;
Особенность серодиагностики: диагноз ставится качественно по обнаружению в сыворотке обследуемого антител) по результатам однократной реакции (без парных сывороток). Это объясняется тем, что постинфекционный иммунитет при гонорее не формируется (нет постинфекционных антител).
Лечение: этиотропная терапия антибиотиками.
Специфическая профилактика не разработана.
Микроскопия.Готовят не менее двух мазков на предметном стекле. Мазки фиксируют в фиксирующей жидкости и окрашивают щелочным раствором метиленового синего и по Граму. При микроскопии гонококки имеют вид бобовидных грамотрицательных диплококков, расположенных, подобно менингококкам, внутри клеток (нейтрофильных гранулоцитов), а также внеклеточно. Окраска по Граму позволяет дифференцировать гонококки со стафилококками и другими бактериями.
При хронической гонорее в мазках обнаруживается большое количество сопутствующих микроорганизмов, а морфология возбудителя может меняться: наблюдаются диплококки с неодинаковыми по величине и форме клетками. При неадекватном лечении сульфаниламидами и антибиотиками происходят значительные изменения формы и величины гонококков: крупные шаровидные, величиной до размеров эритроцита, либо мелкие пылевидные — Lформы.
В связи с тем, что в исследуемом материале могут находиться и другие грамотрицательные бактерии, сходные с гонококками, применяют методы индикации. Так, мазки обрабатывают флюоресцирующими антителами против гонококков и при люминесцентной микроскопии наблюдают свечение клеток гонококков (прямая РИФ). Бактериоскопическое исследование, особенно при хронической, леченой гонорее, а также гонорее у женщин не всегда дает положительный результат, поэтому используют другие методы диагностики.
Бактериологическое исследование.Его проводят в тех случаях, когда гонококки в мазках не обнаруживают или находят нетипичные, измененные формы. Культуральное исследование необходимо для контроля излеченности, при диагностике заболевания у детей, для судебномедицинской экспертизы. Ввиду особой чувствительности гонококка к охлаждению материал для исследования по возможности не транспортируют. Кроме того, гонококк очень чувствителен ко многим антимикробным веществам, поэтому за 1 —2 дня до посева необходимо исключить применение больным антисептиков и прекратить антибактериальную терапию.
При хронической гонорее перед исследованием для повышения вероятности выявления возбудителя проводят провокацию биологическим методом: однократное внутримышечное введение гоновакцины взрослым в количестве 500 млн микробных тел, детям старше 3х лет — 100 — 200 млн микробных тел, детям старше 3х лет — 100 — 200 млн микробных тел. Детям до 3х лет гоновакцину не вводят. Провокация может быть также термической, механической и алиментарной.
Посев производят непосредственно после взятия материала.
Для культивирования гонококка используют МПА (рН 7,4) с добавлением асцитической жидкости — асцитагар.
Применяются также среды следующего состава, мл:
| Стоимость услуги: | 990 руб.* Заказать |
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
Метод исследования: РПГА
Возбудителем менингококковой инфекции является Neisseria meningitidis (менингококк). Менингококк колонизирует заднюю стенку носоглотки человека и может вызывать инфекционный процесс с широким спектром клинических проявлений: бессимптомное носительство, назофарингит и генерализованную форму – менингококцемию и/или менингит. Менингококковая инфекция поражает лиц всех возрастов, но чаще (70%) болеют дети. Более чем 90% случаев генерализованных форм менингококковой инфекции обусловлены штаммами серогрупп А, В и С. Применение РПГА (реакция гемагглютинации) позволяет определить принадлежность возбудителя к наиболее распространенным серогруппам менингококков (А и С).
Исследование сыворотки больного в реакции непрямой (пассивной) гемагглютинации является вспомогательным методом диагностики менингококковой инфекции и позволяет существенно увеличить процент лабораторного подтверждения генерализованных форм менингококковой инфекции. Исследовать сыворотку крови больного рекомендовано в динамике, т.е. взятых в разные сроки заболевания (на 1-й и 10 - 12-й дни болезни).
ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ:
- Обследование лиц с подозрением на менингококковую инфекцию;
- Эпидемиологические обследования;
- Оценка эффективности вакцинацинопрофилактики
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ:
Референсные значения (вариант нормы):
| Параметр | Референсные значения | Единицы измерения |
|---|---|---|
| Anti-Neisseria meningitidis A, C, | Для лиц старше 5 лет: ≥ 1:80 - условно-диагностический титр для менингококковой инфекции серогруппы A; ≥ 1:20 - условно-диагностический титр для менингококковой инфекции серогруппы C; Для детей до 5 лет: ≥ 1:40 - условно-диагностический титр для менингококковой инфекции серогруппы A; ≥ 1:10 - условно-диагностический титр для менингококковой инфекции серогруппы C; | титр |
При интерпретации результата необходимо учитывать прививочный анамнез. Результаты считаются положительными при исследовании парных сывороток крови, взятых с интервалом 10-12 дней, при нарастании титра антител не менее чем в 4 раза.
" ["serv_cost"]=> string(3) "990" ["cito_price"]=> NULL ["parent"]=> string(2) "25" [10]=> string(1) "1" ["limit"]=> NULL ["bmats"]=> array(1) < [0]=>array(3) < ["cito"]=>string(1) "N" ["own_bmat"]=> string(2) "12" ["name"]=> string(31) "Кровь (сыворотка)" > > >
| Тип | В офисе |
|---|---|
| Кровь (сыворотка) |
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
Метод исследования: РПГА
Возбудителем менингококковой инфекции является Neisseria meningitidis (менингококк). Менингококк колонизирует заднюю стенку носоглотки человека и может вызывать инфекционный процесс с широким спектром клинических проявлений: бессимптомное носительство, назофарингит и генерализованную форму – менингококцемию и/или менингит. Менингококковая инфекция поражает лиц всех возрастов, но чаще (70%) болеют дети. Более чем 90% случаев генерализованных форм менингококковой инфекции обусловлены штаммами серогрупп А, В и С. Применение РПГА (реакция гемагглютинации) позволяет определить принадлежность возбудителя к наиболее распространенным серогруппам менингококков (А и С).
Исследование сыворотки больного в реакции непрямой (пассивной) гемагглютинации является вспомогательным методом диагностики менингококковой инфекции и позволяет существенно увеличить процент лабораторного подтверждения генерализованных форм менингококковой инфекции. Исследовать сыворотку крови больного рекомендовано в динамике, т.е. взятых в разные сроки заболевания (на 1-й и 10 - 12-й дни болезни).
ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ:
- Обследование лиц с подозрением на менингококковую инфекцию;
- Эпидемиологические обследования;
- Оценка эффективности вакцинацинопрофилактики
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ:
Референсные значения (вариант нормы):
| Параметр | Референсные значения | Единицы измерения |
|---|---|---|
| Anti-Neisseria meningitidis A, C, | Для лиц старше 5 лет: ≥ 1:80 - условно-диагностический титр для менингококковой инфекции серогруппы A; ≥ 1:20 - условно-диагностический титр для менингококковой инфекции серогруппы C; Для детей до 5 лет: ≥ 1:40 - условно-диагностический титр для менингококковой инфекции серогруппы A; ≥ 1:10 - условно-диагностический титр для менингококковой инфекции серогруппы C; | титр |
При интерпретации результата необходимо учитывать прививочный анамнез. Результаты считаются положительными при исследовании парных сывороток крови, взятых с интервалом 10-12 дней, при нарастании титра антител не менее чем в 4 раза.
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
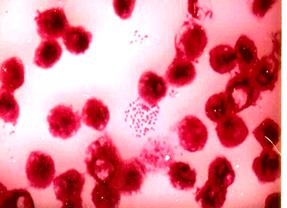
стороной друг к другу, позволяет сделать положительное заключение о наличии у пациента менингококковой инфекции (рис. 22).
А б
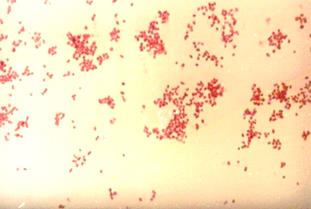
Рис. 22. Менингококк(Neisseria meningitides) в спинно-мозговой жидкости больного эпидемическим цереброспинальным менингитом (а) и в чистой культуре (б). Окраска по Граму. х630
Микроскопическое исследование мазков из носоглотки бактерионосителей дает возможность выявить наряду с менингококком стафилококки, стрептококки и непатогенные нейссерии (Moraxella spp. и др.), дифференцировать которые по морфологическим и тинкториальным свойствам практически невозможно.
Бактериологический метод.Исследуемый материал засевают петлей на чашки с сывороточным МПА, содержащим антибиотики (ристомицин, ванкомицин, колистин и ниста-
тин) для подавления роста сопутствующей микрофлоры (преимущественно кокков). Асцитическая жидкость в качестве добавки к питательным средам в настоящее время не
применяется, так как в результате лечения больных в ней накапливаются вещества, ингибирующие рост микроорганизмов (в том числе менингококка). Менингококк на сывороточном МПА вырастает при температуре 37 0 С в атмосфере с повышенным содержанием СО2 (используют СО2 инкубатор, газогенераторные пакеты или эксикатор с зажженной свечой) через 48 часов, колонии величиной с булавочную головку, прозрачные, с голубоватым оттенком и ровными краями. В мазках из чистой культуры менингококка (рис.21) микрокартина иная (полиморфные дипло- и тетракокки), чем в мазках из спинно-мозговой жидкости.
Типичные для менингококка колонии пересевают в пробирку со скошенным сывороточным МПА для выделения чистой культуры. Идентификацию чистой культуры менингококка, ее дифференциацию от сапрофитных нейссерий, обитающих в носоглотке, проводят на основании изучения комплекса биологических свойств (табл. 18).
Таблица 18.Основные биологические свойства нейссерий
| Свойства | Виды нейссерий | ||||
| N.meningitidis | N.subflava | N.flava | N.mucosa | N.sicca | |
| Рост на МПА | - | + | + | + | + |
| Потребность в СО2 | + | - | - | - | |
| Желтый пигмент | - | + | + | ± | ± |
| Ферментация: глюкозы мальтозы сахарозы фруктозы лактозы | К+ К+ - - - | К+ К+ К± К± - | - - - - - | К+ К+ К+ К+ - | К+ К+ К+ К+ - |
| Образование полисахарида из сахарозы | - | ± | + | + | + |
| Нитратредуктаза | - | - | - | + | - |
| РА с менингококковыми сыворотками сероваров А., В, С | + | - | - | - | - |
Обозначения: (+) – наличие признака, (-) – отсутствие признака, (±) – непостоянный признак, К – образование кислоты
Специфический полисахаридный менингококковый антиген можно выявить в спинномозговой жидкости с помощью метода встречного иммуноэлектрофореза в геле. С этой целью в агаровом геле на стеклянных пластинках, размером 9x12 см, вырезают два параллельных ряда лунок диаметром 3 мм. В лунки одного ряда вносят исследуемый ликвор, в лунки другого - преципитирующие сыворотки против менингококков разных серогрупп. Пластинки помещают в аппарат для иммуноэлектрофореза на 40-45 мин при комнатной температуре. Положительный результат характеризуется появлением 1-2 полосок преципитации между лунками со спинномозговой жидкостью и соответствующей антисывороткой.
Генодиагностика. Исследуемый материал используют для обнаружения ДНК возбудителя с помощью ПЦР, что дает основание в случае получения положительного результата поставить предварительный диагноз.
Серодиагностика.Для ретроспективного подтверждения диагноза используют РНГА с парными сыворотками.
Экспресс-методы диагностики.Для выявления антигенов менингококков в мазках из исследуемого материала используют ИФМ, а также непрямую латекс-агглютинацию и РНГА с антительными диагностикумами.
Самостоятельная работа студентов
1. Микроскопический метод. Изучение морфологии менингококка в мазках из ликвора больного с подозрением на менингококковую инфекцию (демонстрация). Типично наличие грамотрицательных диплококков, располагающихся внутри лейкоцитов.
2. Бактериологический метод. Учет культуральных свойств менингококка на сывороточном МПА с ристомицином. Колонии менингококков прозрачные с голубым оттенком, ровные, мелкие (с булавочную головку). Изучить биохимические свойства менингококка в соответствии с таблицей .
3. Учесть демонстрационную РНГАс парными сыворотками больного (7 и 14 дни болезни) с подозрением на менингококковую инфекцию.
4. Биопрепараты для диагностики и профилактики менингококковой инфекции:
· отечественная химическая вакцина полисахаридная менингококковая вакцина групп А и С. Применяется по эпидемиологическим показаниям. В России зарегистрирована также кубинская В+С менингококковая вакцина, состоящая из белков менингококков группы В и полисахаридов менингококка группы С, а также полисахаридная вакцина МенингоА+С фирмы Пастер Мерье Коннот;
· агглютинирующие и преципитирующие сыворотки против менингококка, применяются с диагностической целью для постановки РА с целью серологического типирования менингококка и встречного иммуноэлектрофореза для обнаружения менингококкового антигена в спинно-мозговой жидкости.
· эритроцитарные антительные менингококковые диагностикумы для обнаружения антигенов менингококка в спинномозговой жидкости с помощью РНГА.
к приказу Минздрава РФ
от 23 декабря 1998 г. N 375
Методические указания
по использованию реакции непрямой гемагглютинации
для выявления антител при менингококковой инфекции
1. Показания к проведению серологических исследований
Реакцию непрямой гемагглютинации (РНГА) с менингококковыми эритроцитарными диагностикумами*(15) серогрупп А, В и С проводят в следующих случаях:
а) как дополнительный метод диагностики менингококковой инфекции. Обязательным требованием является исследование сывороток крови от больных, взятых в разные сроки от начала заболевания, т.е. в динамике (в начале заболевания, на 7 и 15 день болезни).
б) для ретроспективного выявления локализованных форм менингококковой инфекции в очагах заболевания;
в) при проведении иммуно-эпидемиологических исследований среди населения с целью определения соотношения серонегативных и серопозитивных контингентов;
г) при оценке иммунологической эффективности противоменингококковой вакцинации.
2. Методика постановки реакции непрямой гемагглютинации (РНГА)
с эритроцитарными менингококковыми диагностикумами
Реакцию непрямой гемагглютинации можно ставить как макро-, так и микрометодом, причем, в последнем случае используют только микротитраторы системы "Такачи".
Различия между этими методами заключаются лишь в объемах используемых ингредиентов и сроках учета результатов реакции. При макрометоде реагирующая смесь в каждой лунке состоит из 0,5 мл соответствующего разведения сыворотки крови и 0,25 мл диагностикума. В микрометоде объемы соответственно уменьшаются: 0,05 мл сыворотки и 0,025 мл диагностикума.
Учет результатов исследования в микротитраторе проводят спустя 2 часа инкубации в термостате; при макрометоде иногда требуется дополнительная экспозиция в течение 1-2 часов при комнатной температуре.
При постановке РНГА можно использовать многоканальные пипетманы с указанными объемами ингредиентов.
2.1. Необходимые реагенты и приборы:
- эритроцитарные менингококковые серогруппы А, В и С диагностикумы;
- сыворотки диагностические менингококковые группоспецифические А, В и С *(16);
- нормальная кроличья сыворотка*(17), сухая кроличья плазма или бычий сывороточный альбумин*(18);
- исследуемый материал (сыворотка крови человека);
- полистироловые пластины с лунками, серологические пробирки или микротитраторы с V-образными лунками (системы "Такачи");
- термостат для поддержания температуры 37°С;
- водяная баня для поддержания температуры 56°С;
- потенциометр для измерения рН растворов;
- пипетки стеклянные мерные (ГОСТ 20-292-74);
- дозаторы пипеточные П1 на 0,5; 0,05 (2Т2.933.053 ТО);
- хлорид натрия (NaCl),
- натрий фосфорно-кислый двузамещенный (Nа2НРО4-12H2O);
- калий фосфорно-кислый однозамещенный (КН2Р04);
2.2. Подготовка ингредиентов.
2.2.1. Приготовление исходного забуференного физиологического раствора рН 7,2 (ЗФР).
После растворения солей проверяют рН раствора, который должен быть равен 7.2. Раствор фильтруют через бумажный фильтр, разливают во флаконы и стерилизуют при 0,5 атм. 30 минут.
ЗФР необходим для приготовления стабилизирующего буфера, в котором проводят титрование исследуемых сывороток крови.
2.2.2. Стабилизирующий буфер.
В качестве стабилизатора можно применять нормальную кроличью сыворотку (НКС), сухую кроличью плазму или бычий сывороточный альбумин (БСА).
Используемая НКС не должна давать неспецифической (спонтанной) реакции гемагглютинации с эритроцитарными диагностикумами. Инактивированную при +56°С в течение 30 минут НКС или плазму добавляют к ЗФР из расчета 1,0 мл на 100,0 мл (получают 1% раствор), БСА не инактивируют. Концентрация БСА в ЗФР - 0,5%.
2.2.3. Взятие крови.
Для проведения серологических исследований кровь от больных ГФМИ или с подозрением на эту инфекцию забирают из локтевой вены с соблюдением обычных правил асептики: при массовых серологических исследованиях кровь берут из пальца.
После образования сгустка, полученную сыворотку отсасывают стерильной пипеткой в стерильную посуду (пробирки, ампулы). Хранят сыворотку крови в холодильнике при +4°С. В реакции исследуют сыворотки крови без признаков пророста.
Перед постановкой РНГА сыворотки разводят 1:5 исходным буфером (ЗФР). Титрование сывороток проводят в стабилизирующем буфере.
Реакцию оценивают по общепринятой 4-х плюсовой системе (см. Наставление по применению эритроцитарных менингококковых диагностикумов).
За титр противоменингококковых антител принимают максимальное разведение сыворотки крови, в котором наблюдают четко выраженную агглютинацию эритроцитов с интенсивностью не менее чем на 2+, при условии, что в предыдущих лунках реакция шла на 4+ или 3+. Сыворотки крови с разведения 1:5 и выше с четко выраженной агглютинацией эритроцитов, оценивают как положительные.
4. Рекомендуемые сроки, кратность обследования
и трактовка серологических результатов
При выборе оптимальных сроков и кратности обследования больных ГФМИ и для правильной трактовки серологических результатов необходимо принимать во внимание ряд факторов, влияющих на уровень антител: возраст больного, преморбидный фон, клиническую форму, тяжесть и период болезни; сопутствующие заболевания, серологические особенности возбудителя. При менингококковой инфекции, также как и при других инфекционных заболеваниях, правильная оценка результатов серологических исследований может быть дана только при их сопоставлении с эпидемиологическими и клиническими данными.
Оптимальные сроки взятия крови у больного ГФМИ - первые дни болезни (1-3 день), вторая третья и последующие недели болезни. Первую сыворотку крови необходимо брать сразу же при поступлении больного в стационар, последующие через 7-10 дней.
4.1. РНГА при генерализованных формах менингококковой инфекции.
4.1.1. РНГА с диагностикумами А и С.
Антитела к группоспецифическим полисахаридам менингококков серогрупп А и С при ГФМИ можно выявить уже в первые дни болезни. Число серопозитивных лиц среди взрослых больных составляет в эти сроки около 40%. Максимальный уровень антител отмечается на 2-3-ей неделях болезни, с 4-5 недели уровень антител постепенно снижается.
За условно-диагностический титр антител к полисахаридам менингококков серогрупп А и С у детей старше 3-х лет и взрослых принимают положительную реакцию в разведении сыворотки крови 1:40-1:80, т.к. у лиц, не инфицированных менингококками в момент обследования, антитела в таких титрах встречаются сравнительно редко (9-11%).
У детей в возрасте до 1 года продукция антител выражена слабо, в связи с чем положительные реакции наблюдают обычно в более поздние сроки (со 2 недели болезни).
У детей моложе 3-х лет за условно-диагностический титр антител к полисахаридам А и С принимают положительную реакцию в разведении 1:20 и выше, т.к. при отсутствии менингококковой инфекции у детей этого возраста антитела или не обнаруживаются, или встречаются в единичных случаях в титрах не выше чем 1:5-1:10.
Интенсивность антителообразования не одинакова при различных клинических формах менингококковой инфекции. При менингококцемии и сочетанных формах (менингококцемия + менингит) уровень антител обычно выше, чем при других формах болезни.
При тяжелом течении ГФМИ и особенно при инфекционно-токсическом шоке противоменингококковые антитела обнаруживаются в низких титрах, а в отдельных случаях не выявляются вообще. При очень тяжелом течении болезни особенно при наличии тяжелых осложнений (отек и набухание мозга) антителообразование выражено слабо: в остром периоде болезни обнаруживают около 10% серопозитивных проб с низкими титрами (1:5-1:10). В дальнейшем, при улучшении состояния больных титры антител и число серопозитизных проб может возрастать.
Обнаружение уже на 1 неделе болезни антител к полисахаридам менингококков серогрупп А и С в титре 1:160 и выше подтверждает менингококковую этиологию заболевания. В некоторых случаях такие титры антител, обнаруженные на 1 неделе болезни, могут сохраняться и в более поздние сроки заболевания. Хотя у данных больных не наблюдается сероконверсии, высокие показатели РНГА могут служить достаточным основанием для серологического подтверждения диагноза ГФМИ.
Диагноз ГФМИ определяется как этиологически подтвержденный при наличии динамики (четырехкратного и более) нарастания уровня антител. При двукратном нарастании титра антител - диагноз оценивается как подтвержденный лишь при выраженной клинической картине.
Число этиологически подтвержденных случаев ГФМИ методом РНГА может достигать: у взрослых 80%, у детей, в среднем 70% (в возрастной группе детей до 3-х лет - 60%, в старших возрастных группах - 80%).
4.1.2. РНГА с диагностикумом серогруппы В.
При интерпретации серологических данных, полученных при работе с эритроцитарным диагностикумом на основе полисахарида менингококков серогруппы В, необходимо учитывать следующие моменты.
Изучение иммуноструктуры населения с помощью РНГА с диагностикумом серогруппы В представляет определенные сложности из-за сходства химической структуры В-полисахарида менингококка и капсульного полисахарида E.coli К1. Существует возможность наличия перекрестных реакций, что усложняет интерпретацию результатов относительно менингококка серогруппы В. Диагностикум может быть использован для подтверждения диагноза ГФМИ при исследовании сывороток крови в динамике - взятой в начале заболевания и через 2, 3 недели.
Генерализованные формы менингококковой инфекции, обусловленные менингококками серогруппы В, наиболее часто (до 60%) диагностируются у детей первых трех лет жизни, у которых антителообразование выражено слабо. При ГФМИ у взрослых, в большинстве случаев, в первые дни болезни уровень антител к менингококкам серогруппы В составляет 1:20-1:40, с последующей сероконверсией на 2-3 неделях. В отдельных случаях (14%) содержание антител на 2-3 неделях болезни может достигать титров 1:640 - 1:1280 и выше.
4.1.3. Групповая специфичность РНГА.
При постановке РНГА с набором эритроцитарных диагностикумов может выявляться одновременное присутствие антител к нескольким полисахаридам. В таких случаях серогруппу менингококков, вызвавших заболевание у данного больного, определяют по динамике нарастания уровня антител к одному из полисахаридов. При этом разница показателей парных сывороток должна быть не меньше чем на два разведения. При получении одинаковых титров антител к двум полисахаридам в условно-диагностических титрах, диагностируется ГФМИ без установления серогруппы возбудителя.
При локализованных формах менингококковой инфекции серологические исследования не следует рассматривать как метод диагностики, поскольку вопрос о носительстве или менингококковом назофарингите решается на основании бактериологического обследования. Но в ряде случаев при проведении исследований в очагах ГФМИ серологические данные могут послужить дополнительным тестом, ретроспективно подтверждающим клинико-эпидемиологический диагноз менингококковой инфекции. При этом следует проводить обязательное исследование парных образцов сывороток крови, полученных с 10-14 дневным интервалом.
При назофарингите антителообразование более выражено, чем при бактерионосительстве. У больных назофарингитом менингококковой этиологии в 90% случаев выявляются противоменингококковые антитела, причем в 50% случаев с титрами от 1:40 и выше. Среди бактерионосителей независимо от серогруппы выделенного возбудителя специфические антитела определяют в 65% случаев, а с титрами от 1:40 и выше у 30% носителей.
В сыворотках крови, полученных от носителей, так же как и от больных (см. п.4.1.3.), могут выявляться антитела к нескольким полисахаридам менингококков. Нарастание антител к гомологичной серогруппе чаще отмечают при носительстве менингококков серогруппы А. В отдельных случаях динамика антител (сероконверсия) не позволяет серологически установить доминирующую серогруппу менингококков. В этом случае определяют носительство без установления серогруппы.
4.3. РНГА при иммуно-эпидемиологических исследованиях.
Целью иммуно-эпидемиологических исследований является определение числа лиц вероятно восприимчивых к менингококковой инфекции и групп риска. Анализ проводят по числу серопозитивных и серонегативных лиц с учетом существующей эпидемической ситуации.
Например, в период эпидемического неблагополучия увеличивается число серопозитивных лиц и соответственно уменьшается число серонегативных к эпидемической серогруппе менингококков. В период спорадической заболеваемости, наоборот, растет число серонегативных лиц.
При проведении иммуно-эпидемиологических исследований среди населения объем репрезентативных выборок устанавливается эпидемиологом в соответствии с численностью и возрастным составом коллектива, района, населенного пункта.
Определяемый фоновый уровень противоменингококковых антител связан с заболеваемостью менингококковой инфекцией на данной территории и уровнем носительства. Наиболее высокий уровень антител в разные эпидемические периоды определяют к менингококкам серогруппы В, что, возможно, отражает их серологическое родство с E.coli К1, моракселлой, непатогенными нейссериями. При этом число серопозитивных проб с титрами антител 1:20 и выше может достигать 90%.
К менингококкам серогруппы С уровень антител наименьший, число серопозитивных сывороток с титром антител 1:20 и выше составляет 8%.
Уровень антител к менингококкам серогруппы А дает достаточно четкую характеристику эпидемиологической ситуации и отражает широту циркуляции возбудителя.
Анализ серологических результатов эпидемиологических исследований проводят на основании расчета следующих показателей:
а) процента серонегативных проб, полученных с каждым из эритроцитарных диагностикумов (А, В и С), который может отражать число вероятно восприимчивых лиц к менингококковой инфекции;
б) процента серопозитивных проб (все серопозитивные сыворотки крови, начиная с разведения 1:5 и выше), из числа которых выделяют пробы с титрами антител:
- в возрастной группе до 3-х лет с 1:10 и выше к полисахаридам А и С, с 1:20 и выше к полисахариду В;
- в старших возрастных группах детей и у взрослых с 1:20 и выше к полисахаридам А и С, с 1:80 и выше к полисахариду В. Процент сывороток крови с указанными выше уровнями антител отражает доминирующие на данной территории серогруппы менингококков.
Формирование поствакцинального иммунитета носит группоспецифический характер. В связи с этим, в зависимости от используемой для профилактики менингококковой вакцины, серологические исследования для оценки эффективности вакцинации проводят с применением РНГА с гомологичным эритроцитарным диагностикумом.
При вакцинации взрослых специфические противоменингококковые антитела к полисахариду А выявляют в высоких титрах (1:40-1:640 и выше) не менее чем у 80% привитых уже на 3-4 неделе после вакцинации. На протяжении последующих 6-8 месяцев у привитых титры антител несколько снижаются, но сохраняются на повышенном уровне не более двух лет.
*(1) Группоспецифические сыворотки производит Санкт-Петербургский научно-исследовательский институт вакцин и сывороток.
*(2) Описание морфологии колоний и морфологии культуры других бактерий см. в соответствующих методических рекомендациях.
* (3) Подробная идентификация микробов рода H.influenzae изложена в Методических рекомендациях "Современные методические подходы к микробиологической диагностике гемофильной инфекции". Утверждена МЗ России, Санкт-Петербург, 1992 г.
*(4) "Методические указания по определению чувствительности микроорганизмов к антибиотикам методом диффузии в aгаре с использованием дисков. Утверждена МЗ СССР в 1983 г. N 2675-83.
Взамен "Методических указаний по определению чувствительности микроорганизмов к антибиотикам методом диффузии в агар с использованием дисков" N 2675-83 действуют Методические указания МУК 4.2.1890-04 "Определение чувствительности микроорганизмов к антибактериальным препаратам", утвержденные Главным государственным санитарным врачом РФ 4 марта 2004 г.
*(5) Методические указания по микробиологической диагностике заболеваний, вызванных энтеробактериями, утвержденными МЗ СССР, 1984 г.
*(6) Методические рекомендации "Обнаружение и идентификация синегнойной палочки в объектах окружающей среды", утвержденных МЗ СССР, 1982 г.
*(7) Инструкция по бактериологическому обследованию на выявление носителей патогенного стафилококка и проведение санации. Приложение к приказу МЗ СССР N 720, утвержденных в 1978 г.
*(8) Приказ МЗ СССР N 535 от 22 апреля 1985 г.
*(9) Методические рекомендации "Микробиологические методы обследования пульмонологических больных" утвержденных МЗ СССР, 1981 г.
*(10) Материал можно исследовать в соответствии с методическими рекомендациями: Выделение менингококка от больных и бактерионосителей (Оренбург, 1984 г.) N 3083, утвержденных МЗ СССР 15.08.84. Для этого тампон погружают в среду Игла или среду 199, без антибиотиков.
*(11) Желчь сухая, выпускается Московским мясокомбинатом.
*(12) Методические рекомендации "Современные методические подходы к микробиологической диагностике гемофильной инфекции. "Утверждены Минздравом России, 1992 г.
*(13) Используют только те коммерческие сыворотки в "Наставлении" к которым сказано, что они пригодны для постановки реакции преципитации.
*(14) В нашей стране кроме отечественной вакцины зарегистрирована и разрешена к применению полисахаридная менингококковая вакцина А+С (менинго А + С) производства "Пастер Мерье Коннот" Франция.
*(15) Характеристика эритроцитарных менингококковых диагностикумов, выпускаемых производственным предприятием МНИИ-ЭМ им. Г.Н.Габричевского Минздрава РФ, условия их хранения и техника постановки реакции непрямой (пассивной) гемагглютинации подробно изложены в Наставлении по применению диагностикумов, которое вложено в упаковку препаратов.
*(16) Входят в набор эритроцитарных менингококковых диагностикумов.
*(17) Нормальную кроличью сыворотку получают от здоровых кроликов.
*(18) Кроличья плазма и бычий сывороточный альбумин - коммерческие препараты.
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
Читайте также:
- Мазок из зева на бета-гемолитический стрептококк группы а бгса
- Африканская чума свиней по южному федеральному округу
- Антитела к иерсиниоз igm что это такое
- Иммунитет после вакцинации от коклюша
- Как вылечить чуму свиней народными средствами


