Сепсис и септический шок в реанимации

Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
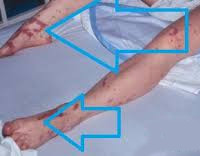
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Определение
Определение сепсиса показывает эволюцию взглядов на этиологию и патогенез данного состояния. Само определение неоднократно менялось, ранее считалось, что главенствующую роль в патогенезе играет системный воспалительный ответ, однако на данный момент центральную роль отводят нарушению действий воспалительной и противовоспалительной систем. Решение о необходимости изменения дефиниции было принято в 2017 году European Society of Intensive Care Medicine и Society of Critical Care Medicine.
Сепсис ― угрожающая жизни органная дисфункция, вызванная дезрегулирующим ответом организма хозяина на инфекцию.
Септический шок ― подвид сепсиса, в основе которого лежит нарушение циркуляции, а патологические изменения в клетках и метаболизме достаточно глубоки, чтобы в значительной степени увеличить летальность.
Диагностика
Исходя из определения и патогенеза, для скрининга сепсиса было предложено использовать шкалу qSOFA (quick Sepsis-related Organ Failure Assessment).
- Системное артериальное давление ≤ 100 мм рт. ст.;
- Частота дыхания ≥ 22 в минуту;
- Любое нарушение сознания ( Таблица 1 | Критерии SOFA
После выставления диагноза проводится начальная интенсивная терапия, важной частью которой является проведение массивной инфузии, далее определяется среднее артериальное давление (СрАД), а также уровень лактата. Среднее артериальное давление определяется по формуле: СрАД = САД – ДАД + ⅓ ДАД, где САД ― систолическое артериальное давление, а ДАД ― диастолическое артериальное давление. При необходимости применения вазопрессоров для поддержания адекватного среднего артериального давления ( ≥ 65 мм рт. ст.), а также при высоком уровне лактата ( > 2 ммоль/л) выставляется диагноз септический шок.
Начальная терапия
Интенсивная терапия сепсиса должна начинаться сразу же после постановки диагноза. Рекомендации по ведению сепсиса 2012 года предлагали использовать цели, которые необходимо было достигнуть за определенное время. К сожалению, после проведения крупных испытаний данная стратегия не показала преимуществ по сравнению со стандартной терапией, а также оказалась более затратной.
После выявления сепсиса для коррекции сепсис-индуцированной гипоперфузии в начальном периоде используются кристаллоиды в объеме 30 мл/кг внутривенно в первые 3 часа. Последующая инфузия должна проводиться на основании имеющихся в наличии данных о физиологии пациента (частота сердечных сокращений, артериальное давление, артериальная сатурация кислорода, частота дыхания, температура и другие данные), полученных с помощью неинвазивных и инвазивных методов. Предпочтение желательно отдавать динамическим методам измерения.
У пациентов с септическим шоком, требующим применения вазопрессоров, необходимо поддерживать среднее артериальное давление на уровне не менее 65 мм рт. ст. Пациентам с повышенными уровнями лактата (маркер тканевой гипоперфузии) необходимо проводить интенсивную инфузионную терапию с целью его снижения до нормальных уровней.
Всем организациям здравоохранения рекомендуется разрабатывать собственные или усовершенствовать имеющиеся программы по ведению сепсиса и септического шока, методам скрининга у тяжелобольных пациентов, а также оценке риска развития сепсиса. Допустимо применение других шкал для скрининга состояния тяжелобольных пациентов: привычная шкала ССВО, LODS (Logistic Organ Disfunction System), NODS (National Organ Disfunction System).
Интенсивная терапия сепсиса
Антибактериальная терапия
До начала антибактериальной терапии необходимо взять посевы (кровь, спинномозговую жидкость, мочу, секрет из дыхательных путей, раневое отделяемое или другие жидкости организма) для определения чувствительности микроорганизмов к антибиотикам с использованием как минимум двух наборов культур: анаэробной и аэробной. Однако взятие посевов не должно существенно затягивать начало антибактериальной терапии сепсиса. Антибиотикотерапия должна начинаться в максимально ранние сроки, до 1 часа после постановки диагноза сепсиса или септического шока. Любое промедление в назначении антибактериальных средств значительно повышает смертность пациентов. Эмпирическую антимикробную терапию рекомендуется начинать с одного или нескольких антибиотиков (АБ) из двух разных классов, с широким спектром активности, действующих на предполагаемую флору (бактериальную и/или грибковую).
При выборе АБ необходимо учитывать: анатомический источник и типичную его флору, преобладающую флору в госпитале или вне его, резистентность преобладающего патогена, иммунные нарушения у пациента (нейтропения, спленэктомия, плохо контролируемая ВИЧ-инфекция, приобретенные или врожденные дефекты иммуноглобулина, системы комплемента или функции лейкоцитов), а также возраст пациента и наличие сопутствующей патологии, хронических заболеваний. Дозу и время введения необходимо оптимизировать на основании фармакодинамики/фармакокинетики и специфических свойств препаратов. Необходимо помнить о том, что у пациентов зачастую есть нарушение функции почек и/или печени, а также о возможной резистентности микроорганизмов. При применении бета-лактамных АБ важно достигнуть концентраций выше минимальной ингибирующей в течение как можно более длительного времени, в то время как для аминогликозидов и фторхинолонов главную роль играет достижение пиковой концентрации.
Деэскалацию (замена АБ широкого спектра действия на АБ более узкого спектра действия) антибактериальной терапии проводят в течение нескольких последующих дней после того, как определены микроорганизмы, вызвавшие сепсис и септический шок, и их спектр чувствительности к антибиотикам, либо наступает значительное клиническое улучшение/ухудшение. По возможности каждый день оцениваются клинические данные, и на их основании проводится решение об деэскалации. Рекомендуемая длительность антибактериальной терапии составляет 7–10 дней, что зачастую достаточно для большинства серьезных инфекций, ассоциированных с развитием сепсиса и септического шока.
При проведении антибиотикотерапии необходимо руководствоваться уровнем прокальцитонина (ПКТ), это позволяет сократить продолжительность курса, а также отменить АБ у пациентов, у которых имелись подозрение на сепсис и слабые доказательства наличия инфекции. При снижении уровня прокальцитонина более, чем на 80 % от пикового значения или снижении ПКТ менее 0,5 мкг/л необходимо прекратить введение АБ.
Контроль очага
Необходимо как можно быстрее (не позже 6‒12 часов после постановки диагноза) выявить или исключить наличие очага инфекции в организме и провести вмешательство по его удалению. Следует обратить особое внимание на внутрисосудистые девайсы (центральные венозные катетеры), так как они могут быть источниками инфекции.
Инфузионная терапия
Препаратами выбора для инфузионной терапии при развитии сепсиса и септического шока являются кристаллоиды. Предпочтительней применять сбалансированные растворы, так как они не вызывают развитие гиперхлоремического метаболического ацидоза (раствор Хартмана или Рингер-лактат), при их отсутствии допустимо применение несбалансированных растворов (Рингер или физиологический раствор NaCl 0,9 %). Недостаточно данных об использовании препаратов желатина для восстановления объема внутрисосудистого русла при сепсисе.
При необходимости инфузии значительных объемов кристаллоидов допускается добавление инфузии коллоидов (альбумина 20 %) с целью достижения плазменного уровня альбумина > 30 г/л. На основании данных проведенных исследований не рекомендуется использование при сепсисе и септическом шоке растворов гидроксиэтилкрахмала.
Вазоактивные препараты
Добутамин может назначаться пациентам, имеющим признаки тканевой гипоперфузии, на фоне адекватной инфузии и использовании других вазопрессоров. Дозу данного препарата необходимо тщательно титровать для достижения желаемого эффекта (восстановление тканевой перфузии), а при развитии аритмий или усугублении гипотензии незамедлительно прекратить его введение. Всем пациентам с септическим шоком желательно установить артериальный катетер для контроля показателей гемодинамики.
Кортикостероиды
Нет необходимости использовать глюкокортикоиды, когда на фоне инфузионной терапии и применения вазопрессоров достигнута гемодинамическая стабильность. Если же невозможно поддерживать гемодинамику на должном уровне на фоне приведенной выше терапии (инфузия + прессоры), допускается применение гидрокортизона внутривенно в дозе 200 мг/сутки.
Препараты крови
Трансфузия эритроцитов проводится при снижении уровня гемоглобина менее 70 г/л у взрослых без признаков тяжелой гипоксемии, ишемии миокарда или острого кровотечения. Эритропоэтин у пациентов с сепсисом не применяется. Свежезамороженная плазма может использоваться при нарушениях свертываемости крови перед планированием инвазивных процедур или при наличии активного кровотечения.
Трансфузия тромбоцитов проводится в зависимости от клинической необходимости при уровне:
- 9 , если отсутствует риск кровотечения;
- 9 при наличии значительного риска развития кровотечения;
- ≤ 50 х 10 9 при наличии активного кровотечения, проведении хирургического вмешательства или инвазивной процедуры.
Иммуноглобулины
Эксперты не рекомендуют использовать иммуноглобулины у пациентов с сепсисом и септическим шоком.
Очистка крови
Эффект применения различных технологий очистки крови не доказан. Необходимо провести дополнительные исследования.
Искусственная вентиляция легких (ИВЛ)
На фоне сепсиса у пациентов часто развивается сепсис-индуцированный острый респираторный дистресс синдром (ОРДС). При развитии ОРДС проводится ИВЛ со следующими параметрами:
- Целевой дыхательный объем 6 мл/кг на прогнозируемую массу тела (ПМТ). ПМТ у мужчин = 50 + 0,91 * (рост в см – 152,4), ПМТ у женщин = 45,5 + 0,91 * (рост в см –152,4);
- Верхний предел давления плато (Рplat) = 30 см вод. ст.;
- Высокий PEEP — около 10‒12 см вод. ст., для подбора оптимального PEEP можно использовать таблицы, основанные на значениях FiO2;
- Использование рекрутмент маневра и прон-позиции при отношении PaO2/FiO2 Седация и анальгезия
Необходимо избегать продолжительной или интермиттирующей седации пациентов, которым проводится ИВЛ. Если же все-таки необходима седация, то предпочтительнее использовать короткодействующие препараты (пропофол или дексмедетомидин).
Контроль гликемии
Рекомендуется поддержание уровня глюкозы ≤ 10 ммоль/л. При наличии двух последовательных проб крови с превышением данного уровня глюкозы необходимо незамедлительно начать введение инсулина. Мониторинг гликемии проводится каждые 1–2 часа до момента, когда уровни глюкозы и инфузия инсулина не стабилизируются; после стабилизации контроль проводится каждые 4 часа. Для измерения уровней глюкозы предпочтительнее использовать артериальную кровь. Допустимо использование портативных глюкометров, однако нужно критически относиться к результатам данных исследований.
Почечно-заместительная терапия (ПЗТ)
При развитии у пациентов с сепсисом острого повреждения почек и наличии показаний к диализу может применятся длительная или перемежающаяся почечно-заместительная терапия. Во время ПЗТ возможен контроль и изменение баланса жидкости у гемодинамически нестабильных пациентов.
Применение бикарбоната натрия
Не рекомендуется раннее применение бикарбоната натрия при индуцированном гипоперфузией лактат-ацидозе с pH ≥ 7,15.
Профилактика венозной тромбоэмболии (ВТЭ)
Рекомендуется проводить профилактику ВТЭ у пациентов с сепсисом и септическим шоком, предпочтительнее низкомолекулярными гепаринами (НМГ) либо с помощью нефракционированного гепарина (НФГ). Возможно использование механических методов профилактики (компрессионные чулки или устройства для перемежающейся пневматической компрессии) как дополнение к основной терапии или как самостоятельный метод при наличии противопоказаний к применению НМГ и НФГ .
Не рекомендуется применение антитромбина III.
Профилактика язв
У пациентов с сепсисом и септическим шоком, имеющих факторы риска желудочно-кишечного кровотечения (проведение ИВЛ > 48 часов, заболевания печени, коагулопатии, проведение ПЗТ), необходимо проводить профилактику стрессовых язв с помощью блокаторов протонной помпы или антагонистов Н2-гистаминовых рецепторов.
Питание
Рекомендуется раннее начало энтерального питания у пациентов с сепсисом. В зависимости от переносимости могут использоваться трофические/гипокалорические смеси или полное раннее энтеральное питание. Начинать парентеральное питание следует не ранее 8 суток при невозможности обеспечить раннее энтеральное питание. При непереносимости энтерального питания или наличии высокого риска аспирации может проводиться измерение остаточного объема желудка, а также использоваться пост-пилорические зонды для кормления. Пациентам с гастропарезом, диабетом или получающим седативные и вазоактивные препараты может потребоваться применение прокинетиков (метоклопрамид, домперидон). При применении прокинетиков необходим ЭКГ мониторинг для ранней детекции синдрома удлиненного QT и снижения риска внезапной смерти.
Отсутствуют данные о положительном эффекте применения омега-3-жирных кислот, внутривенного введения селена, аргинина, глютамина и карнитина.
Источники:
- Singer M. et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3) //Jama. – 2016. – Т. 315. – №. 8. – С. 801-810.
- Rhodes A. et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016 //Intensive care medicine. – 2017. – Т. 43. – №. 3. – С. 304-377.
- при тяжелой септицемии с лейкоцитозом эффективно сочетание карбенициллина с цефалоспоринами и гентамицином;
- при септическом очаге в брюшной полости или в малом тазу: гентамицин с линкомицином и ампициллином;
- в случае генерализованной инфекции, вызванной бактероидами, эффективны линкомицин или клиндамицин;
- уремические формы инфекции лечатся гентамицином с пенициллином или цефалоспоринами с канамицином и левомицетаном.
Pneumococcus или стрептококки групп А,В,С,G
Цефалоспорины*, ванко мицин, эритромицин
— инфекция мочевых путей
— эндокардит и другие серьезные инфекции
Ампициллин или амоксициллин
Норфлоксацин, ципро флоксацин
Ванкомицин + гентами цин
— метициллин-
чувствительные
— метициллин-
резистентные
Полусинтетические
пенициллины
Ванкомицин
Триметоприм-сульфа-метоксазол
Клиндамицин, ванко мицин
Аэробные грамотрицательные бактерии:
Klebsiella, Enterobacter, Serratia, Proteus (индолполо жительные)
Ампициллин или триметоприм -сульфаметоксазол
Цефотаксим или цефтриаксон
Цефотаксим или цефтриаксон
Азтреонам, аминогли козиды
или
амоксициллин
сульфа-метоксазол,
цефотаксин,
цефтриаксон
Тикарциллин или цефтазидим + аминогликозид
Азтреонам или имипе нем + аминогликозид
- метилпреднизолон вводится в дозе 30 мг/кг болюсно, затем 4—5мг/кг — поддерживающая доза.
- дексаметазон — 5 мг/кг в/в;
- ретаболил или феноболил 1 мл в/ м 1 раз в неделю;
Несмотря на все успехи теоретической и практической медицины, сепсис остается одной из нерешенных проблем XX века. Об этом красноречиво свидетельствуют следующие цифры: летальность при септическом шоке в 1909 г. была 41%, в 1985 г. она составила 40% (Sanford J., 1985).
Синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) представляет собой приобретенное расстройство гемостаза, при котором одновременно или последовательно наблюдается массивное микротромбообразование, избыточное потребление факторов свертывания, активация фибринолиза и кровоточивос.
Артериальная гипертония относится к числу основных причин сердечно-сосудистой смертности и распространенность ее среди населения, согласно современным критериям, составляет около 50%. Опасность вынашивания беременности на фоне гипертонической болезни определяется риском развития сочетанного гестоза.
Лечение ДВС-синдрома зависит от стадии процесса. В первую очередь необходимо устранить причину, вызвавшую активацию тромбокиназы (тромбопластина). Если видимая причина отсутствует, то необходимо начать посиндромную терапию, направленную на восстановление адекватной гемодинамики, микроциркуляции, дых.
Прежде всего, для дальнейшего изложения материала надо определиться терминологически, поскольку это в значительной степени упорядочивает представление материала и придает ясность его восприятию. К примеру, преэклампсию называли родильными судорогами, родильным нефритом, эклампсией и преэкламптическо.
Для диагностики ДВС-синдрома не существует одного простого теста, необходимо использование комплекса лабораторных методов для выявления данной патологии. Диагностика синдрома диссеминированного внутрисосудистого свертывания должна быть срочной, информативной, основанной на системе простых и легко вы.
Важным моментом, определяющим лечебную тактику и прогноз при массивных кровотечениях, является правильное измерение кровопотери в родах и при кесаревом сечении. Существует несколько способов измерения кровопотери в родах и при кесаревом сечении.
, MD, MBA, Stanford University Medical Center
Last full review/revision February 2018 by Paul M. Maggio, MD, MBA

Сепсис представляет собой спектр заболеваний с риском смерти, колеблющимся от умеренного (например, 10%) до значительного (например, > 40%) в зависимости от различных возбудителей и факторов со стороны хозяина, наряду со своевременностью выявления и предоставления соответствующего лечения.
Септический шок является разновидностью сепсиса со значительно повышенным уровнем смертности в связи с серьезными нарушениями кровообращения и/или клеточного метаболизма. Септический шок предполагает наличие персистирующей гипотонии (определяется как потребность в вазопрессорах для поддержания среднего артериального давления ≥ 65 мм рт. ст., и уровень сывороточного лактата > 18 мг/дл [2 ммоль/л], несмотря на реанимационные мероприятия, проведенные в достаточном объеме [1]).
Понятие синдрома системного воспалительного ответа (ССВО), которое определяется специфическими нарушениями жизненно важных функций и результами лабораторных исследований, уже давно используется для выявления сепсиса на ранних стадиях. Однако было обнаружено, что критерии ССВО имеют недостаточную чувствительность и специфичность при повышенном риске смерти, что является основным аспектом использования такой концептуальной модели. Отсутствие специфичности может быть обусловлено тем, что ССВО чаще является адаптивным, а не патологическим ответом.
Справочные материалы
1. Singer M, Deutschman CS, Seymour CW, et al: The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA 315:801–810, 2016.
Этиология
Большинство случаев септического шока вызвано внутрибольничными грамотрицательными бактериями или грамположительными кокками и часто возникает у пациентов с ослабленным иммунитетом и у пациентов с хроническими заболеваниями. Реже возбудителями являются грибы рода Candida. Следует заподозрить послеоперационную инфекцию (глубокую или поверхностную) в качестве причины септического шока у пациентов, которые недавно перенесли операцию. Неспецифическая, редкая форма шока, вызванная токсинами стафилококков и стрептококков называется синдромом токсического шока.
Септический шок встречается чаще у новорожденных ( Неонатальный сепсис), у пожилых людей и беременных женщин. Предрасполагающие факторы включают:
Лейкопению (особенно, связанную с раком или лечением цитотоксическими лекарственными средствами)
Наличие инвазивных устройств (в том числе эндотрахеальных трубок, сосудистых или мочевых катетеров, дренажей и других инородных материалов)
Первоочередным лечением являются антибиотики или кортикостероиды
К наиболее распространенным локализациям инфекции относятся легкие, мочевые и желчные пути и ЖКТ.
Патофизиология
Патогенез септического шока полностью не изучен. Воспалительные агенты (например, бактериальный токсин) провоцируют выработку провоспалительных медиаторов, включая ФНО и ИЛ-1. Эти цитокины вызывают нейтрофильно-эндотелиальную клеточную адгезию, активируют механизмы свертывания крови и обуславливают образование микротромбов. Они также способствуют высвобождению других медиаторов, включая лейкотриены, липоксигеназу, гистамин, брадикинин, серотонин и IL-2. Им противостоят противовоспалительные медиаторы, такие как IL-4 и IL-10, в результате механизма обратной отрицательной связи.
Сначала артерии и артериолы расширяются, уменьшается периферическое артериальное сопротивление; сердечный выброс, как правило, увеличивается. Этот этап называется тепловым шоком. Позже, сердечный выброс может уменьшиться, падает АД (с или без увеличения периферического сопротивления), и появляются типичные признаки шока.
Даже на стадии увеличенного сердечного выброса, вазоактивные медиаторы приводят к тому, что кровоток минует капилляры (распределительный дефект). Ослабленный капиллярный ток из этого шунтирования наряду с капиллярной обструкцией микротромбами уменьшают доставку кислорода и снижают выведение углекислого газа и других продуктов распада. Гипоперфузия приводит к дисфункции, а иногда и к недостаточности одного или более органов, включая почки, легкие, печень, мозг и сердце.
Коагулопатия может развиться из-за внутрисосудистой коагуляции с участием основных факторов свертывания крови, усиленного фибринолиза, и чаще комбинации обоих.
Клинические проявления
Симптомы и признаки сепсиса могут быть малозаметными и часто легко принимаются за проявления других заболеваний (например, белая горячка, первичная дисфункция сердца, эмболия легочной артерии), особенно у послеоперационных больных. У пациентов с сепсисом, как правило, отмечаются: лихорадка, тахикардия, обильное потоотделение и тахипноэ; АД остается в норме. Также могут присутствовать другие признаки инфекции, являющейся ричиной сепсиса. По мере ухудшения состояния больного с сепсисом или при развитии септического шока ранним симптомом, особенно у пожилых людей и маленьких детей, может быть спутанность сознания или снижение активности. АД снижается, однако кожа остается парадоксально теплой. Позже, конечности становятся прохладными и бледными с периферическим цианозом. Дисфункция органов приводит к появлению дополнительных симптомов и признаков в зависимости от пораженного органа (например, олигурия, одышка).
Диагностика
АД, частота сердечных сокращений и мониторинг кислородного статуса
Общий анализ крови с лейкоцитарной формулой, уровень электролитов, креатинина и лактата
Показания инвазивного центрального венозного давления (ЦВД), Pa O 2 и сатурации кислорода в центральной вене (ScvO2)
Бактериологический посев крови, мочи и других потенциальных очагов инфекции, в том числе из ран у пациентов после операции
Сепсис подозревают, когда у пациента с известной инфекцией развиваются системные симптомы воспаления или органной дисфункции. Аналогичным образом, у пациентов с необъяснимыми признаками системного воспаления необходимо изучить наличие инфекционных заболеваний в анамнезе, провести медицинский осмотр и лабораторные исследования, которые включают общий анализ мочи и бактериологический посев мочи (особенно у пациентов с постоянными катетерами), бактериологический посев крови и посевы других подозрительных жидкостей организма. Пациентам с подозрением на хирургическую или скрытую причину сепсиса может потребоваться УЗИ, КТ или МРТ в зависимости от предполагаемого источника. При тяжелом сепсисе уровни C- реактивного белка и прокальцитонина в крови часто повышены и могут облегчить постановку диагноза, но эти показатели не являются специфичными. Диагноз основывается прежде всего на клинических проявлениях.
Другие причины шока (например, гиповолемия, инфаркт миокарда) должны быть исключены с помощью анамнеза, медицинского осмотра, электрокардиограммы и анализа кардиомаркеров в сыворотке крови. Даже в отсутствие ИМ гипоперфузия, обусловленная сепсисом, может привести к появлению признаков ишемии на электрокардиограмме, включая неспецифические отклонения ST-T, инверсии зубца T, наджелудочковые и желудочковые экстрасистолии.
Важно выявить дисфункцию органа как можно раньше. Был разработан ряд систем оценки, но шкала динамической оценки органной недостаточности (шкала SOFA) и шкала quick SOFA (qSOFA) были одобрены в отношении риска смерти и являются относительно простыми в использовании.
С помощью критериев шкалы qSOFA выявляют пациентов, которым необходимо провести дальнейшие клинические и лабораторные исследования (должны присутствовать все 3 критерия):
Частота дыхания ≥ 22/мин
Систолическое АД ≤ 100 мм рт. ст.
Оценка по шкале SOFA является более надежной, но требует проведения лабораторных исследований ( Шкала динамической оценки органной недостаточности (SOFA)).
≥ 400 мм рт. ст. (53,3 кПа)
12,0 мг/дл (204 мкмоль/л)
САД ≥ 70 мм рт. ст.
САД 15 мкг/кг/мин в течение ≥ 1 ч
Эпинефрин > 0,1 мкг/кг/мин в течение ≥ 1 ч
Норэпинефрин > 0,1 мкг/кг/мин в течение ≥ 1 ч
5,0 мг/дл (440 мкмоль/л)
* Более высокий балл указывает на лучшее состояние неврологических функций.
F IO 2 = фракция вдыхаемого O2; кПа = килопаскали; САД = среднее артериальное давление; Pao2 = парциальное давление кислорода артериальной крови.
По материалам Singer M, Deutschman CS, Seymour CW, et al: The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA 315:801-810, 2016.
Проводят ОАК, ГСАК, рентгенологическое исследование органов грудной клетки, анализ уровней электролитов в сыворотке, азота, мочевины крови и креатинина, P co 2 и проб печени. Измерение уровня лактата в сыворотке или сатурации кислорода в центральной вене (ScvO2) (или сразу оба анализа) могут помочь в определении лечения. Количество лейкоцитов может быть уменьшено ( 4 000/мкл) или увеличено (> 15 000/ мкл ), а количество ПМЯ-клеток может снизиться до 20%. В ходе развития сепсиса количество лейкоцитов может увеличиваться или уменьшаться в зависимости от тяжести сепсиса или шока, иммунологического статуса пациента и этиологии инфекции. Одновременное использование кортикостероидов может увеличить количество лейкоцитов и, таким образом, маскировать изменения в анализах, связанные с проявлениями болезни.
Гипервентиляция с дыхательным алкалозом (низкий Pa co 2 и повышенный pH крови) появляется рано, как реакция компенсации метаболического ацидоза. Уровень сывороточного бикарбоната обычно низкий, а уровни лактата в сыворотке и крови повышаются. Шок прогрессирует, метаболический ацидоз ухудшается, и снижается pH крови. Раннее развитие гипоксемической дыхательной недостаточности приводит к снижению соотношения PaO2:F IO 2, а иногда и к выраженной гипоксемии с Pa o 2 70 мм рт. ст. Диффузные инфильтраты на рентгенограмме грудной клетки могут появляться вследствие развития острого респираторного дистресс-синдрома (ОРДС). Уровень мочевины и креатинина обычно прогрессивно возрастают в результате почечной недостаточности. Значения билирубина и трансаминазы могут повыситься, хотя клинически выраженная печеночная недостаточность редко встречается у пациентов с нормальными исходными функциональными пробами печени.
У большинства пациентов с тяжелым сепсисом развивается относительная недостаточность коры надпочечников (т. е. нормальный или немного повышенный исходный уровень кортизола, который не увеличивается в значительной степени в ответ на дальнейший стресс или экзогенный АКТГ). Функция надпочечников может быть проверена путем измерения сывороточного кортизола в 8 часов утра , уровень 5 мг/дл считается неадекватным. При другом подходе уровень кортизола можно измерять до и после введения 250 мкг синтетического AКТГ; повышение уровня 9 мкг/дл считают недостаточным. Тем не менее, при резистентном септическом шоке проведение анализов на кортизол не требуется перед началом кортикостероидной терапии.
Измерения гемодинамики с помощью центрально-венозного или легочно-артериального катетера ( Мониторинг и обследование тяжелобольных пациентов : Методика) могут использоваться, когда неясен тип шока или необходимы большие объемы жидкости (например, > 4–5 литров 0,9% физиологического раствора в течение более, чем 6–8 ч). Эхокардиография, проведенная у постели больного в ОИТ, является практичным и неинвазивным альтернативным методом контроля гемодинамики. При септическом шоке сердечный выброс увеличивается, а периферическое сосудистое сопротивление уменьшается, в то время как при других формах шока сердечный выброс, как правило, снижается, а периферическое сосудистое сопротивление увеличивается. Показатели ЦВД и давления заклинивания в лёгочной артерии (ДЗЛА) вероятнее всего будут в норме при септическом шоке, в отличие от гиповолемического, обструктивного или кардиогенного шока.
Читайте также:
- Чума на северо западе
- Бактистатин помогает ли при хеликобактерии
- Как избавиться от стрептококка в мочевом пузыре
- Можно фенистил при скарлатине
- Комплексный план мероприятий по предупреждению заноса и распространения африканской чумы свиней






