Амфотерицин В - эффективность, токсичность
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Для просмотра информации о патентах вам необходимо зарегистрироваться и оплатить 30-ти дневный доступ. Разовый платеж составит 149 рублей (НДС не облагается).
Средство, стимулирующее продукцию гранулоцитарно-макрофагального колониестимулирующего фактора в клетках системы мононуклеарных фагоцитов
Изобретение относится к медицине, в частности к иммунологии, а именно к средствам иммунокоррекции, и может быть использовано в качестве индуктора гранулоцитарно-макрофагального колониестимулирующего фактора в клетках системы мононуклеарных фагоцитов in vitro и для эфферентной терапии при.
Способ диагностики метаболического синдрома
Изобретение относится к области медицины. Для диагностики метаболического синдрома выявляют наличие абдоминального ожирения, артериальной гипертензии, гипергликемии натощак, гипертриглицеридемии, гипоальфахолестеринемии, гиперурикемии, неалкогольной жировой болезни печени. Дополнительно.
Фармацевтическая композиция для лечения цитостатической миелосупрессии
Изобретение относится к фармацевтической композиции для лечения цитостатической миелосупрессии. Заявленная композиция включает 0,4-4 мас.% окисленного декстрана с молекулярной массой 35-70 кДа в качестве стимулятора лейкопоэза, липосомообразующий агент - фосфатидилхолин в количестве 1,0-4,0.
Фармацевтическая композиция для лечения клещевого энцефалита
Изобретение относится к области медицины. Композиция содержит мас.%: 1-фенил-2,3-диметил-4-йодпиразолон-5 - 5,0-10,0; окисленный декстран - 40,0-45,0; полиэтиленгликоль - 20,0-45,0; фосфатидилхолин - 10,0-30,0. Использование заявленной композиции позволяет повысить эффективность лечения.
Фармацевтическая композиция для лечения ожогов
Изобретение относится к фармацевтической композиции для лечения ожогов и содержит в качестве активного компонента окисленный декстран с м.М. 35-65 кДа, в качестве вспомогательных компонентов для симптоматической терапии ожогов она содержит анестезин, полиэтиленоксид с м.М. 1,5-6,0 кДа.
Биологически активная добавка для изготовления косметических средств
Изобретение относится к области косметологии и представляет собой биологически активную добавку для изготовления косметических средств, содержащую окисленный декстран с молекулярной массой 35-70 кДа и косметически приемлемый наполнитель, причем компоненты в добавке находятся в определенном.
Фармацевтическая композиция, содержащая алкалоиды, резистентная к рекреационным злоупотреблениям (варианты), и способ ее получения, способ приема фармацевтической субстанции, содержащей алкалоиды, теплокровным существом, добавка для предотвращения рекреационных злоупотреблений фармацевтической субстанцией, содержащей алкалоиды, и способ ее получения
Предложены варианты фармацевтических композиций, способных противостоять извлечению из них фармацевтической субстанций-алкалоидов для использования по немедицинскому назначению и рекреационным злоупотреблениям. Они включают, по крайней мере, одну фармацевтическую субстанцию (ФС) - алкалоид со.
Биологически активная добавка к пище, обладающая гепатопротекторными и иммуностимулирующими свойствами
Изобретение относится к фармацевтической промышленности, в частности к композиции, обладающей гепатопротекторными и иммуностимулирующими свойствами. Композиция, обладающая гепатопротекторными и иммуностимулирующими свойствами, содержит окисленный декстран с молекулярной массой 40-70 кДа.
Способ получения биотинилированного производного окисленного декстрана
Изобретение относится к медицине, экспериментальной и клинической фармакологии. Суть способа: окисленный декстран растворяют в трис-ацетатном буферном растворе с рН 5,0-5,5, добавляют к полученному раствору гидразид биотина в соотношении к окисленному декстрану, равном 1:(20-25), после чего.
Композиция для лечения ожогов
Изобретение относится к фармацевтической промышленности и представляет собой композицию для лечения ожогов, содержащую окисленный декстран с молекулярной массой 35-65 кДа, антисептик, анестетик, наноалмазы с размером частиц 4-10 нм и фармацевтически приемлемый наполнитель, причем компоненты в.
Штамм вируса болезни ньюкасла для изучения онколитических свойств и механизмов онколизиса для создания прототипного противоопухолевого препарата
Изобретение относится к области вирусологии и касается онколитического штамма вируса болезни Ньюкасла. Охарактеризованный штамм выделен из клоакального смыва клинически здорового сизого голубя. Выделенный штамм прошел 3 пассажа на развивающихся куриных эмбрионах и депонирован в Государственную.
Амфотерицин В - эффективность, токсичность
Амфотерицин В - эффективность, токсичность
Амфотерицин В относится к группе полиеновых антимикотиков, продуцируется актиномицетом Streptomyces nodosus. Механизм действия препарата заключается в соединении его с эргостеролом — основным стеролом мембраны клеток грибов. Это изменяет проницаемость мембраны, нарушает ее целостность, приводит к потере содержимого цитоплазмы и гибели клетки. Мембраны клеток человека также содержат стеролы, поэтому взаимодействие амфотерицина В возможно с клетками не только грибов, но и макроорганизма.
Спектр активности амфотерицина В. Амфотерицин В проявляет широкий спектр антигрибковой активности, включая Aspergillus spp., Candida spp., Cryptococcus neoformans, Sporothrix schenckii, эндемичных возбудителей микозов (Blastomyces dermatitidis, Coccidioides immitis, Histoplasma capsulatum, Paracoccidioides brasiliensis). К амфотерицину В слабочувствительны зигомицеты (Mucor spp., Rhizopus spp. и др.), Fusarium spp.; резистентны — Aspergillus terreus, Scedosporium spp., Trichosporon spp., Candida lusitaniae.
Фармакокинетика амфотерицина В. Максимальная пиковая концентрация в крови, составляющая 1—2 мг/л, отмечается при введении амфотерицина В в дозе 1 мг/кг. Концентрация амфотерицина В в плазме крови в конце инфузии выше в 2 раза при быстром введении препарата, в течение 45 мин, чем при 5-часовой инфузии (2,02 мг/л против 1,18 мг/л). По прошествии 12 ч после введения в свободном состоянии в крови определяется менее 10 % амфотерицина В, более 90 % связывается с белками плазмы, распределяясь в органах и тканях: в печени (до 40 % дозы), легких (до 6 %), почках (до 2 %). В цереброспинальной жидкости определяется менее 5 %.
Концентрация препарата в биологических жидкостях: плевральной, синовиальной, перитонеальной — составляет 2/3 плазменной концентрации. Амфотерицин В концентрируется в тканях длительное время, освобождение происходит крайне медленно. Первоначальный период полувыведения составляет 24 ч, далее, по мере применения препарата, может удлиняться до 15 сут.
Основной путь экскреции амфотерицина В до сих пор неясен. Полагают, что метаболизм происходит в печени, менее 5 % выводится в неизмененном виде с мочой. Концентрация амфотерицина В не изменяется при почечной или печеночной недостаточности, при гемодиализе.
Токсичность амфотерицина В. Лечение амфотерицином В сопряжено с высокой частотой возникновения побочных эффектов, наиболее частые из них — лихорадка до 38— 40 °С, озноб. Проявления их могут быть меньшими при удлинении периода введения препарата. В случае возникновения озноба вводят глюкокортикоиды, наркотические препараты.
Введение амфотерицина В через вену приводит к возникновению флебитов. Каждый раз препарат следует вводить в разные вены, удлинять время инфузии, вводить гепарин (500—1000 ЕД/л) в раствор.
Наиболее тяжелое побочное действие амфотерицина В — это токсическое воздействие на почки (повреждение канальцев). В большинстве случаев функция почек восстанавливается через несколько месяцев после окончания терапии амфотерицином В, однако могут возникать и необратимые случаи почечной недостаточности. При лечении амфотерицином В контроль за уровнем креатинина следует проводить дважды в неделю. Если уровень креатинина повышается, то дозу препарата снижают или урежают введения. Применение раствора натрия гидрокарбоната или изотонического раствора натрия хлорида перед инфузией амфотерицина В может уменьшить проявления нефротоксичности.
Другое частое побочное действие амфотерицина В — развитие гипокалиемиии, гипомагниемии. Мониторирование уровня электролитов осуществляют 2—3 раза в неделю.
Терапия амфотерицином В в течение 2 нед и более может осложниться умеренной нормохром-ной анемией. К редким осложнениям относятся бронхоспазм, гипотензия, дыхательная недостаточность.
Взаимодействие амфотерицина В. Совместное назначение амфотерицина В с препаратами, оказывающими токсическое действие на почки, такими, как аминогликозиды, циклоспорин А, ванкомицин, цисплатин и др., способствует повышению их нефротоксичности.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Амфотерицин B (Amphotericin B)
Порошок лиофилизированный для приготовления раствора для инфузий — пористая масса желтого цвета, без запаха или почти без запаха. Гигроскопичен.
Мазь — мазь желтого цвета.
Характеристика
Стерильный комплекс полиенового противогрибкового антибиотика амфотерицина В, продуцируемого актиномицетом Streptomyces nodosus, с дезоксихолатом натрия и буфером, в состав которого входят амфотерицин В, натрий фосфорнокислый дву- и однозамещенный. Инактивируется под действием света, кислорода воздуха. Растворим в воде и 5% растворе глюкозы с образованием коллоидной системы, диметилсульфоксиде, практически нерастворим в эфире, хлороформе, 96% спирте.
Фармакологическое действие
Связывается со стеролами (эргостеролами) клеточной мембраны чувствительных грибов. В результате нарушается проницаемость мембраны и внутриклеточные компоненты попадают во внеклеточное пространство.
Фармакодинамика
Оказывает фунгицидное или фунгистатическое действие в зависимости от концентрации в биологических жидкостях и чувствительности возбудителя. Активен в отношении многих патогенных грибов, в т.ч. Candida spp., Histoplasma capsulatum, Cryptococcus neoformans, Aspergillus spp. или лейшманий.
Фармакокинетика
При в/в введении распределяется в большинстве органов и тканей организма, в спинномозговой жидкости не определяется. Проникает через плаценту. Связывание с белками плазмы составляет 90%. Выводится почками, очень медленно, 2–5% в активной форме. Может обнаруживаться в моче в течение 7 нед после отмены.
При местном применении — практически не всасывается.
Показания
Кандидоз ЖКТ , кишечное кандидоносительство, кандидоз внутренних органов, хронические и гранулематозные диссеминированные формы кандидоза, кокцидиоз, криптококкоз, гистоплазмоз, североамериканский бластомикоз, хромомикоз, плесневой микоз, споротрихоз.
Противопоказания
Гиперчувствительность к амфотерицину В и др. компонентам препарата, выраженные нарушения функции печени и почек, заболевания кроветворной системы, сахарный диабет.
Для мази — гиперчувствительность к амфотерицину B.
Применение при беременности и кормлении грудью
С осторожностью при беременности (адекватных и строго контролируемых исследований безопасности применения у беременных женщин не проведено). На время лечения следует прекратить грудное вскармливание (неизвестно, проникает ли амфотерицин В в грудное молоко).
Побочные действия
При в/в введении:
Со стороны нервной системы и органов чувств: головная боль, полинейропатия, нечеткость зрения, диплопия.
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): артериальная гипо- или гипертензия, аритмия, изменения ЭКГ , анемия, лейкопения, тромбоцитопения.
Со стороны органов ЖКТ: тошнота, рвота, диарея, боль в эпигастрии, повышение активности печеночных ферментов.
Со стороны мочеполовой системы: нарушение функции почек, в т.ч. повышение концентрации креатинина в сыворотке крови, протеинурия, азотемия, ацидоз.
Аллергические реакции: кожная сыпь, зуд, отек Квинке, бронхоспазм (при ингаляции).
Прочие: повышение температуры тела, озноб, понижение аппетита, нарушение электролитного состава крови, в т.ч. гипокалиемия, гипомагниемия; тромбофлебит в месте инъекции; при ингаляции возможно першение в горле, кашель, насморк.
При местном применении отсутствуют побочные эффекты, характерные для системного действия, но возможно возникновение аллергических реакций.
Взаимодействие
При одновременном применении с потенциально нефротоксичными антибиотиками, циклоспорином, диуретиками повышается риск развития нефротоксического действия. При одновременном применении со средствами, угнетающими костный мозг, лучевой терапией повышается риск развития анемии и др. гематологических нарушений. Может усиливать эффекты сердечных гликозидов (особенно на фоне дефицита калия в организме) и недеполяризующих периферических миорелаксантов. При одновременном применении с флуцитозином понижает клиренс последнего, вследствие чего возможно усиление токсичности флуцитозина.
Способ применения и дозы
В/в капельно (20–30 капель/мин) в течение 3–6 ч. Раствор готовят в стерильных условиях непосредственно перед применением: во флакон добавляют 5–10 мл воды для инъекций (стерильным шприцом через прокол резиновой пробки, предварительно обработав ее спиртом). Для в/в введения используют концентрацию 100–125 ЕД в 1 мл растворителя. Далее смесь взбалтывают до полного растворения порошка, раствор из флакона при помощи иглы набирают в стерильный шприц и вливают во флакон с 400 мл стерильного 5% раствора глюкозы (в указанном количестве растворителя должно быть растворено не более 50000 ЕД антибиотика). Раствор готовят в защищенном от яркого света помещении. В случае появления осадка препарат не используют.
Дозу устанавливают индивидуально из расчета 250 ЕД/кг. До начала введения предварительно вводят 100 ЕД/кг (для определения индивидуальной переносимости), при хорошей переносимости, отсутствии побочных эффектов и при необходимости дозу увеличивают до 1000 ЕД/кг.
Перед каждым введением устанавливают точную массу больного и производят расчет дозы препарата (250 ЕД препарата на 1 кг массы тела больного массой 75 кг).
Средняя общая доза на курс лечения — 1500000–2000000 ЕД (18–20 вливаний). Препарат вводят через день или 1–2 раза в нед (опасность кумуляции). Длительность лечения — не менее 4–8 нед (во избежание рецидивов).
Детям назначают в следующих суточных дозах (ЕД/кг):
В возрасте 1–3 года: с 1 по 5 вливания — 75–150 ЕД/кг; с 6 по 10 вливания — 100–250 ЕД/кг; с 11 по 15 вливания — 150–350 ЕД/кг; с 16 по 20 вливания 175–400 ЕД/кг.
В возрасте 4–7 лет: с 1 по 5 вливания — 100–200 ЕД/кг; с 6 по 10 вливания — 150–300 ЕД/кг; с 11 по 15 вливания — 175–400 ЕД/кг; с 16 по 20 вливания — 200–500 ЕД/кг.
В возрасте 8–12 лет: с 1 по 5 вливания — 125–250 ЕД/кг; с 6 по 10 вливания — 175–300 ЕД/кг; с 11 по 15 вливания — 200–450 ЕД/кг; с 16 по 20 вливания — 225–600 ЕД/кг.
В возрасте 13–18 лет: с 1 по 5 вливания — 150–300 ЕД/кг; с 6 по 10 вливания — 200–400 ЕД/кг; с 11 по 15 вливания — 225–500 ЕД/кг; с 16 по 20 вливания — 250–700 ЕД/кг.
Первый курс лечения — 20 капельных в/в инфузий 2 раза в нед, после перерыва 1 мес курс повторяют. Степень и количество побочных явлений уменьшается при прерывистом курсовом лечении (30–40 вливаний в течение 5–6 мес).
При непереносимости суточные и курсовые дозы понижают и увеличивают интервалы между введением препарата. Повторные курсы лечения начинают с меньших доз.
Ингаляционно. Раствор готовят непосредственно перед употреблением из расчета 50000 ЕД на 10 мл стерильной воды для инъекций. Ингаляции проводят 1–2 раза в сутки продолжительностью — 15–20 мин из расчета 1000–2000 ЕД/кг. При использовании ингаляторов, работающих только на вдохе, разовую дозу уменьшают до 5 мл (25000 ЕД). Курс лечения — 10–14 дней, повторный курс — через 7–10 дней. Оставшийся во флаконе раствор используют для ингаляций в течение 24 ч при условии его хранения в холодильнике.
Мазь. Местно, наносят тонким слоем 1–2 раза в сутки (до 4 раз). Курс лечения — не менее 10 дней.
Меры предосторожности
При в/в введении препарата для уменьшения выраженности побочных явлений назначают жаропонижающие и антигистаминные препараты, витамины группы В, аскорбиновую кислоту, НПВС , препараты железа, калия и др. В процессе лечения необходим систематический контроль функции почек, печени, состава крови и уровня калия в крови. При появлении симптомов анемии лечение Амфотерицином В следует прекратить. Для лучшей переносимости антибиотика в раствор для ингаляций рекомендуется добавить 10–15 капель медицинского глицерина.
Производитель
Акционерное Курганское общество медицинских препаратов и изделий «Синтез», Россия.
Амфотерицин В (Amphotericin B) инструкция по применению
Форма выпуска, упаковка и состав препарата Амфотерицин В
Лиофилизат для приготовления раствора для инфузий в виде пористой массы желтого цвета, без запаха, или почти без запаха, гигроскопичен.
| 1 фл. | |
| амфотерицин В | 50 000 ЕД |
Вспомогательные вещества: натрия фосфат однозамещенный, дезоксихолевая кислота.
50 000 ЕД - Флаконы объемом 10 мл (1) - пачки картонные.
50 000 ЕД - Флаконы объемом 10 мл (5) - пачки картонные.
50 000 ЕД - Флаконы объемом 10 мл (10) - пачки картонные.
Фармакологическое действие
Полиеновый макроциклический антибиотик с противогрибковой активностью. Продуцируется Streptomyces nodosus. Оказывает фунгицидное или фунгистатическое действие в зависимости от концентрации в биологических жидкостях и от чувствительности возбудителя. Связывается со стеролами (эргостеролами), находящимися в клеточной мембране чувствительного к препарату гриба. В результате нарушается проницаемость мембраны и происходит выход внутриклеточных компонентов во внеклеточное пространство и лизис гриба.
Активен в отношении большинства штаммов Histoplasma capsulatum, Coccidioides immitis, Paracoccidioides braziliensis, Candida spp., Blastomyces dermatidis, Rhodotorula spp., Cryptococcus neoformans, Sporothrix schenekii, Mucor mucedo, Rhizopus spp., Absidia spp., Basodiobolus ranarum, Aspergillus fumigatus.
Умеренно активен в отношении некоторых простейших: Leishmania braziliensis, Leishmania mexicana, Naegleria fowleri.
К амфотерицину В, как правило устойчивы: Pseudallescheria boydii, Fusarium spp.
Неэффективен в отношении бактерий, риккетсий, вирусов.
Фармакокинетика
После однократного внутривенного введения в крови создается эффективная концентрация (дозозависимая), сохраняющаяся в течение 24 ч. После внутривенного введения 1-5 мг/сут максимальная концентрация (C max ) в плазме - 0.5-2 мкг/мл. Связь с белками плазмы - более 90%.
Распределяется в легких, печени, селезенке, почках, надпочечниках, мышцах и других тканях. Концентрации в плевральном выпоте, перитонеалькой, синовиальной жидкостях, водянистой влаге достигают примерно 2/3 от концентрации в плазме; в спинномозговой жидкости обычно не определяется. Кажущийся объем распределения у взрослых - 4 л/кг, у детей - 0.4-8.3 л/кг, у новорожденных - 1.5-9.4 л/кг.
Показания препарата Амфотерицин В
Прогрессирующие, жизнеугрожающие грибковые инфекции, вызванные чувствительными к амфотерицину В микроорганизмами:
- диссеминированный криптококкоз, криптококковый менингит;
- менингит, вызываемый другими грибами;
- инвазивный и диссеминированный аспергиллез;
- североамериканский бластомикоз;
- диссеминированные формы кандидоза;
- кокцидиоидоз;
- паракокцидиоидоз;
- гистоплазмоз;
- фикомикоз (зигомикоз);
- хромомикоз;
- плесневый микоз;
- диссеминированный споротрихоз;
- гиалогифомикоз;
- хроническая мицетома;
- инфекции брюшной полости (в т.ч. перитонит);
- эндокардит;
- эндофтальмит;
- грибковый сепсис;
- грибковые инфекции мочевыводящих путей;
- висцеральный лейшманиоз (в том числе у пациентов с иммунодефицитом), американский кожно-висцеральный лейшманиоз (не является препаратом выбора).
| Код МКБ-10 | Показание |
| B37.5 | Кандидозный менингит |
| B37.6 | Кандидозный эндокардит |
| B37.7 | Кандидозный сепсис |
| B38 | Кокцидиоидомикоз |
| B39 | Гистоплазмоз |
| B40 | Бластомикоз |
| B41 | Паракокцидиоидомикоз |
| B42 | Споротрихоз |
| B43 | Хромомикоз и феомикотический абсцесс |
| B44 | Аспергиллез |
| B45 | Криптококкоз |
| B46 | Зигомикоз |
| B47 | Мицетома |
| B55.0 | Висцеральный лейшманиоз |
| H45.1 | Эндофтальмит при болезнях, классифицированных в других рубриках |
| I33 | Острый и подострый эндокардит |
| K65.8 | Другие виды перитонита |
| N10 | Острый тубулоинстерстициальный нефрит (острый пиелонефрит) |
| N11 | Хронический тубулоинтерстициальный нефрит (хронический пиелонефрит) |
| N30 | Цистит |
| N34 | Уретрит и уретральный синдром |
Режим дозирования
Внутривенно капельно в течение 2-4 ч, рекомендуемая концентрация - 0.1 мг/мл. Пробная доза - 1 мг (основание) разводят в 20 мл 5% раствора декстрозы и вводят внутривенно в течение не менее 20-30 мин под контролем артериального давления, пульса, температуры тела через каждые 30 мин в течение 2-4 ч.
При хорошей переносимости рекомендуемая суточная доза - 0.25-0.3 мг/кг в зависимости от степени тяжести заболевания.
При повышенной чувствительности к препарату, заболеваниях сердечно-сосудистой системы, недостаточности функции почек лечение начинают с низких доз - 5-10 мг и, постепенно увеличивая на 5-10 мг/сут, доводят до рекомендуемой суточной дозы - 0.5-0.7 мг/кг.
Подбор терапевтических доз осуществляется индивидуально в зависимости от вида и тяжести инфекции. При использовании препарата через день доза не должна превышать 1.5 мг/кг (во избежание развития сердечно-легочной недостаточности). Максимальная суточная доза - 1.5 мг/кг.
Споротрихоз : курсовая доза 2.5 г, продолжительность терапии - 9 мес.
Аспергиллез: курсовая доза - 3.6 г, продолжительность лечения - 11 мес.
Риноцеребральный фикомикоз: курсовая доза - 3-4 г.
В случае прерывания терапии более чем на 7 дней возобновлять ее следует с самой низкой дозы (0,25 мг/кг), постепенно увеличивая до желаемого уровня.
Детям: внутривенно, вначале 0.25 мг/кг (основание) в сутки в 5% растворе декстрозы в течение 6 ч; с учетом переносимости дозу постепенно увеличивают (обычно на 0.125 - 0.25 мг/кг каждый день или через день) до максимальной дозы 1 мг/кг или 30 мг на 1 м 2 . Детям вводится в минимальных эффективных дозах.
Для приготовления раствора для внутривенного введения используют раствор с исходной концентрацией 5 мг/мл. Для этого стерильным шприцем (игла не менее № 20) вносят 10 мл стерильной воды для инъекций без бактериостатических добавок непосредственно во флакон с препаратом. Содержимое флакона встряхивают до образования прозрачного коллоидного раствора. Для получения раствора с концентрацией 0.1 мг/мл его разводят 5% раствором декстрозы с рН не ниже 4.2 в соотношении 1:50. Перед разведением необходимо проверить кислотность имеющегося раствора декстрозы. рН раствора декстрозы, как правило, превышает 4.2, в противном случае перед разведением в него следует добавить 1 -2 мл буферного раствора.
Рекомендуется следующий буферный раствор: натрия гидрофосфат (безводный) -1.59 г, натрия дигидрофосфат (безводный) - 0.96 г, воды для инъекций - до 100 мл.
Перед добавлением к раствору декстрозы буферный раствор стерилизуют фильтрованием через бактериальный керамический или мембранный фильтр или путем автоклавирования в течение 30 мин при давлении 1 атм и 121 °С.
Побочное действие
Со стороны пищеварительной системы: часто - снижение аппетита, диспепсия, тошнота, рвота, диарея, гастралгия, гепатотоксичность (повышение активности "печеночных" ферментов, гипербилирубинемия); нечасто - острая печеночная недостаточность, гепатит, желтуха, геморрагический гастроэнтерит, мелена.
Со стороны нервной системы: часто - головная боль, нечасто - судороги, преходящее вертиго, периферическая нейропатия, энцефалопатия.
Со стороны органов чувств: нечасто - нарушение зрения, диплопия; потеря слуха, шум в ушах.
Со стороны органов кроветворения: часто - нормохромная нормоцитарная анемия; нечасто - агранулоцитоз, нарушение свертывания крови, лейкопения, гемолитическая анемия, тромбоцитопения, эозинофилия, лейкоцитоз.
Со стороны сердечно-сосудистой системы: часто - снижение артериального давления; нечасто - аритмии, включая фибрилляцию желудочков, изменения на ЭКГ, повышение артериального давления, шок, остановка сердца, сердечная недостаточность.
Со стороны дыхательной системы: часто - тахипноэ; нечасто - одышка, аллергический пневмонит, отек легких.
Со стороны мочевыделительной системы: часто - нарушение функции почек, в том числе азотемия, гипокалиемия, гипостенурия, почечный тубулярный ацидоз, нефрокаль-циноз; нечасто - острая почечная недостаточность, олигурия, анурия, нефрогенный несахарный диабет. Предварительное введение 0.9% раствора нятрия хлорида снижает риск нефротоксичкости, введение натрия гидрокарбоната - риск почечного тубулярного некроза.
Аллергические реакции: часто - анафилактоидные реакции, бронхоспазм, чихание; нечасто - сыпь, особенно макулопапулезная, зуд, эксфолиативиый дерматит, токсический эпидермальный некролиз, синдром Стивенса-Джонсона.
Местные реакции: тромбофлебит в месте инъекции, химический ожог.
Прочие: часто - лихорадка, снижение массы тела, миалгия, артралгия, общая слабость.
Лабораторные показатели: гипокалиемия, гиперкалиемия, гипомагниемия, гипокаль-циемия, гиперкреатининемия.
Противопоказания к применению
- гиперчувствительность;
- хроническая почечная недостаточность;
- период лактации.
С осторожностью: заболевания почек (в т.ч. гломерулонефрит), амилоидоз, гепатит, цирроз печени, анемия, агранулоцитоз, сахарный диабет, беременность.
Амфотерицин В - эффективность, токсичность
1‑е направление – Изучение влияния липидного микроокружения на ионные каналы, формируемые антимикробными агентами
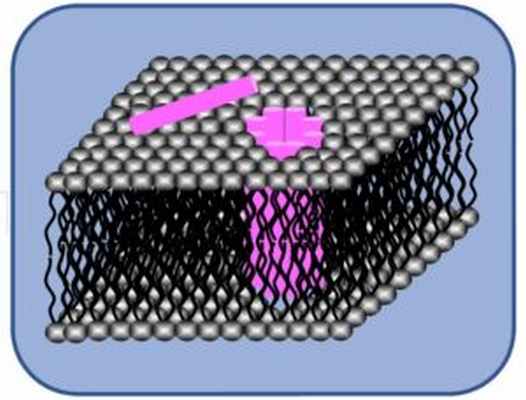
Как известно, основной функцией клеточной мембраны является барьерная. Нарушение работы этого барьера, например, вследствие перфорации мембраны, т.е. формирования в ней сквозных отверстий, называемых порами или каналами, приводит к неконтролируемому обмену клеточного содержимого с внешней средой и гибели клетки. По этому принципу действуют многие известные токсины. Если в результате воздействия гибнет бактериальная или грибковая клетка, то соединение проявляет антимикробные свойства и представляет несомненный интерес для нужд фармакологии, например, в качестве антибиотика. Это может быть важно в свете борьбы с возрастающей антибиотикорезистентностью патогенных микроорганизмов. Для успешного применения такого соединения в медицинской практике, прежде всего, необходимо ответить на вопрос о том, какие молекулярные механизмы обеспечивают прицельность его действия? Ответы на эти вопросы кроются в понимании того, как структурные компоненты мембраны, липиды, влияют на процессы формирования пор антибиотиком. Именно это направление исследований является для лаборатории приоритетным. В качестве объектов пристального изучения выступают антибактериальные пептиды и противогрибковые липопептиды. Для выполнения исследований используются модельные липидные мембраны. Среди основных методов – регистрация токов, протекающих через плоские липидные бислои при фиксации трансмембранного напряжения, а также оценка проницаемости мембран, основанная на измерении утечки флуоресцентного маркера из липосом.
2‑е направление – Поиск малых молекул – модификаторов физико-химических свойств липидного матрикса мембран
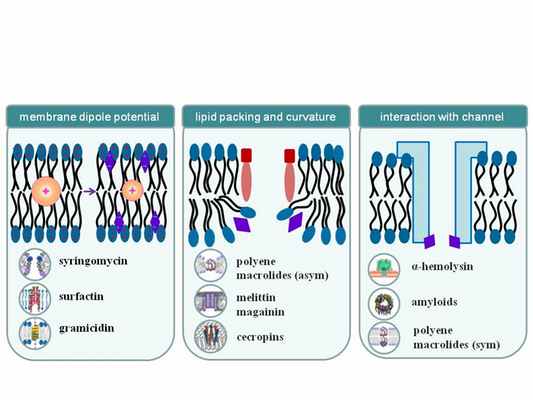
Другим важным направлением деятельности является поиск малых молекул – модификаторов физических свойств липидного матрикса мембран. В качестве объектов исследования выбраны растительные полифенолы, алкалоиды, сапонины, местные анестетики, тиреоидные гормоны, ксантеновые и стирилпиридиновые красителям. Для решения поставленных задач проекта применяется комплексный методологический подход, включающий электрофизиологические и спектрофлуориметрические методы измерения граничного и дипольного потенциала мембран, конфокальную флуоресцентную микроскопию гигантских одноламеллярных липосом, дифференциальную сканирующую микрокалориметрию суспензии липидных везикул. Основной задачей является выявление связи между структурой малых молекул и количественным изменением физико-химических параметров липидных мембран, а также обоснование возможностей применения малых молекул в качестве самостоятельных лекарственных средств или в комплексе с другими фармакологически активными соединениями. Возможность управления физико-химическими характеристиками мембран с помощью малых молекул открывает широкие перспективы в модуляции свойств ионных каналов, получения фундаментальных знаний об их структуре, повышения эффективности и избирательности действия антибиотиков.
3‑е направление – Разработка инновационных липид-ассоциированных форм полиеновых макролидных антибиотиков для терапии системных микозов

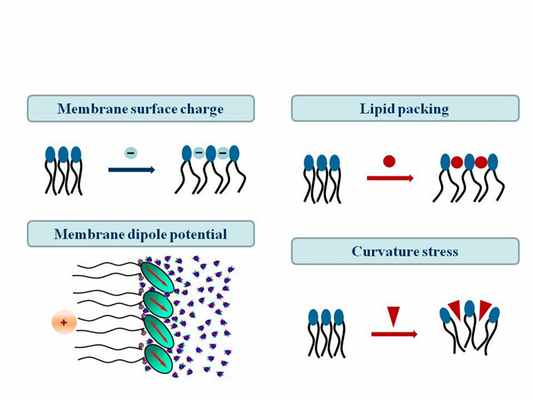
В последние годы отмечается рост инвазивных микозов, вызываемых Candida spp. (кандидоз) и Aspergillus spp. (аспергиллез). Эта группа инфекций ассоциирована с высоким уровнем смертности у онкобольных и других иммунокомпрометированных пациентов. Основными причинами летальности являются резистентность возбудителей и высокая токсичность наиболее эффективных препаратов, что требует поиска новых антифунгальных средств и применения инновационных лекарственных форм. До сих пор наиболее эффективными препаратами для борьбы с инвазивными микозами остаются амфотерицин В и другие полиеновые макролиды. Большинство исследователей сходятся во мнении, что механизм фунгицидного действия полиенов обусловлен связыванием эргостерина в мембране грибковой клетки и нарушением проницаемости мембраны вследствие формирования ион-проводящих пор. Вероятность взаимодействия с холестерином определяет высокую токсичность антибиотиков, наиболее часто выражающуюся в нефропатии. До недавнего времени это являлось серьезным ограничением применения полиенов в клинической практике, однако использование альтернативных стратегий их введения, в частности, липосомальной формы амфотерицина В, позволило значительно снизить токсичность терапии. С целью дальнейшего снижения токсичности и увеличения эффективности действия полиеновых макролидов в лаборатории разрабатываются их новые липид-ассоциированные формы. Стратегия разработки включает введение в состав липосом флавоноидов, увеличивающих порообразующую способность антибиотиков, а, следовательно, и эффективность их действия, а также стеринов, сродство полиенов к которым выше, чем к холестерину, что позволит снизить токсичность препарата. Создан прототип препарата, представляющий собой полиен-содержащие флавоносомы, изучены молекулярные механизмы его взаимодействия с модельными липидными мембранами, проведено тестирование прототипа на клеточных тест-системах.
Читайте также:
