Белки регулирующие полимеризацию актиновых мономеров
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Основной белок цитоскелета – актин. Актин присутствует в клетках всех ныне живущих организмов, и найден даже в клетках прокариот.
В мышечных клетках актин составляет около 20% от массы всего белка. Его содержание высоко и в других типах клеток эукариот – 5-10% всего клеточного белка.
Клетки дрожжей содержат один тип актинового белка. В клетках высших эукариот их несколько. У млекопитающих – по крайней мере, 6 типов, обозначаемых в соответствии с кодом генов семейства актина. 4 типа актина содержатся в разных типах мышечных клеток, а 2 – в остальных.
С актином связаны многочисленные белки (около 150), которые влияют на его структуру и функции.
Пространственная структура мономеров актина и актинового филамента была определена в 1990 г. Актин присутствует в клетке как в форме мономерного белка глобулярно-грушевидной формы с молекулярным весом 42 кД, так и в виде полимеров - длинных нитей и их пучков, связанных с другими элементами цитоскелета и мембранами.
Каждый мономер (G-актин) состоит из 375 аминокислот и имеет два сайта плотного связывания, которые обеспечивают соединение типа головка-хвост. В итоге актиновые мономеры полимеризуются, формируя F–актин – филаментозный актин. Каждый мономер повернут на 166 о , что задает формирование двойной спиральной структуры. Т.о., волокно актина представляет собой длинную двойную спираль. Диаметр волокна - 6 - 7 нм.
При полимеризации мономеры актина выстраиваются в ряд, поэтому образованная цепь имеет полярность - + и – концы.
Процесс полимеризации актина подробно изучен in vitro. Полимеризация актина происходит в две стадии. Первая стадия носит название "нуклеация", то есть создание ядра (nucleus) или затравки из первых трех мономеров актина. Димер (комплекс двух мономеров) является нестабильной структурой и легко разрушается. Именно нуклеация определяет общую скорость полимеризации. Вторая стадия, удлинение нити, протекает легче, с большей скоростью.
Полимеризация актина обратима, и одна и та же нить может расти с одного конца и разрушаться с другого. Однако присоединение происходит в 5-10 раз быстрее к плюс-концу.
Мономеры актина связывают АТФ, хотя полимеризация идет без него. Тем не менее, при наличии АТФ полимеризация идет быстрее, и в ее процессе АТФ переходит в АДФ. Этот процесс до конца не понят, хотя очевидно, что связывание АТФ играет важную роль в регуляции сборки и «разборки» актинового волокна.
Существует ряд соединений, влияющих на полимеризацию актина. Эти соединения используются при изучении биологии клетки.
Цитохалазин – связывается с +концом актиновой цепи и блокирует ее удлинение. Это ведет к изменению формы клеток и нарушению митотического деления – иллюстрация необходимости актина для этих процессов.
Фаллоидин – плотно связывается с актиновыми филаментами и блокирует их диссоциацию на отдельные молекулы. Фаллоидин, связанный с флуоресцентными красителями, часто используют для визуализации актиновых филаментов во флуоресцентном микроскопе.
Латрункулин (Latrunculin) - связывает G-актин и блокирует его присоединение к филаменту.
Полимеризация и деполимеризация молекул актина в клетке регулируются большим количеством разных актин-связывающих белков.
Некоторые из таких белков присоединяются к одному концу нити, блокируя на этом конце полимеризацию и деполимеризацию, тогда рост и укорочение микрофиламента идут лишь на другом конце, не закрытом блокирующим белком. Некоторые специальные белки соединяют несколько мономеров в "зачаток" нити и вызывают нуклеацию нового микрофиламента. В дальнейшем такие нити растут в одну сторону, обычно в сторону плюс-конца. Специальные белки могут присоединяться к бокам нескольких микрофиламентов. При этом одни белки связывают микрофиламенты в сети, другие - в пучки. Наличие таких белков, регулирующих связывание актина в нити, позволяет клетке иметь пул свободных молекул актина, которые могут использоваться в случае необходимости.
Белок тимозин – наиболее важная молекула, отвечающая за секвестрацию филаментов актина и препятствующая их включению в филаменты.
Профилин – тоже препятствует сборке актина в филаменты. Однако, профилин может усиливать полимеризацию, связывая АТФ.
Кэпирующие белки – еще один вариант регуляции полимеризации актина.
Отдельные актиновые филаменты могут быть организованы в пучки и сети, которые играют различную роль в клетках.
Актиновые пучки образованы параллельно лежащими филаментами, которые скреплены между собой.
В актиновых сетях филаменты свободно скреплены примерно под прямым углом, образуя сетчатую структур со свойствами полужидкого геля.
Сшивка фимбрином дает жесткие пучки, а альфа-актинином -–более свободные, способные к сокращению. Вариант: актиновая сеть, скрепленная филамином. Само строение сети свидетельствует о ее подвижности.
Филаменты актина в клетке сконцентрированы у ее поверхности, формируя кортекс – сетчатую структуру, связанную с плазмалеммой. Кортекс (кора) имеется во всех клетках. Это – зона активных процессов, зона локализации цитоплазматических доменов трансмембранных белков, соответственно, кортекс играет важную роль в жизнедеятельности клеток. Связь трансмембранных белков с актином.
Кортекс хорошо изучен у эритроцитов, для которых показаны связи актина с различными белками. В отличие от эритроцитов, у большинства клеток плазмалемма неравномерна по строению и функциям. Это отражается и на связи с актином. Так, фибробласты в культуре прикрепляются к внеклеточному веществу с помощью интегринов. Интегрины, в свою очередь, связаны с пучками актина, которые формируют нити натяжения (stress fibers). Нити натяжения формируют остов, определяющий форму клетки.
Актин таким же образом заякорен в клетках эпителия, участвуя в образовании межклеточных контактов (зона слипания, замыкающий комплекс).
Выросты. Поверхность большинства клеток несет различные выросты, образование которых связано с актиновыми микрофиламентами.
Микроворсинки – наиболее хорошо изученные структуры. МВ – пальцевидные выросты на поверхности клеток, которые наиболее характерны для клеток, специализирующихся на всасывании, например, - клетки кишечного эпителия. МВ так много на этих клетках, что они формируют слой – т.н. щеточную кайму. На поверхности каждой клетки находится около 1000 МВ, что увеличивает поверхность в 10-20 раз.
Основа МВ – параллельно расположенные пучки актиновых филаментов, 20-30 штук. Сшивка – виллином и фимбрином. МВ – постоянные образования на клеточной поверхности. Микроворсинки имеют одинаковые размеры, в отличие от других выростов клеточной поверхности.
Псевдоподии, филлоподии и ламеллоподии – выросты клеточной поверхности, формирующиеся в ответ на внешние стимулы. Термин "псевдоподия" означает в переводе - ложная ножка. Это действительно ножка, которая двигает клетку вперед по подложке. Перемещение макрофагов и нейтрофилов в тканях организма также происходит посредством выпускания псевдоподий и подтягиваний тела клетки. Вместе с тем это - ножка особая: псевдоподия может вырасти заново из тела клетки, образовать свои «мышцы», сократиться и исчезнуть за считанные минуты.
Филоподии – палочковидные выросты на поверхности клетки, ламеллоподии – плоские выросты, еще выделяют сладки (ruffles) клеточной поверхности. Исследования последних лет показали, что все эти разновидности выпячиваний клеточной поверхности различаются по молекулярным механизмам формирования и, очевидно, по функциям.
С морфологической точки зрения все эти выросты можно назвать «отросток», и часто именно этот термин используется применительно к срезам клеток.
Белки регулирующие полимеризацию актиновых мономеров
Белки регулирующие полимеризацию актиновых мономеров
• Во вногих эукариотических клетках присутствуют два белка, которые связываются с мономерным актином. Это тимозин b4 и профилин
• В клетках Metazoa тимозин b4 изолирует актиновые мономеры и поддерживает цитозольный пул АТФ-актина, который может быть использован для быстрой элонгации филаментов
• Комплексы профилина с актиновыми мономерами способствуют элонгации только оперенных концов филаментов
В клетках поддерживается пул мономерного актина, который может быть использован для быстрой элонгации, когда внешний сигнал определяет время и место запуска процесса роста филаментов. Скорость элонгации актинового филамента зависит от концентрации актиновых мономеров, доступных для полимеризации. Для того чтобы осуществить быструю элонгацию в соответствующей клетке шкале времени, концентрация актиновых мономеров, доступных для полимеризации, должна быть гораздо выше критической. Белки, которые связываются с актиновыми мономерами, способствуют регуляции скорости роста филаментов.
В клетках Metazoa присутствуют два наиболее распространенных белка, которые связываются с мономерами актина. Это тимозин b4 и профилин. Тимозин b4 обнаружен только у высших эукариот и, главным образом, находится в высокоподвижных и способных к фагоцитозу клетках. Профилин найден в большинстве эукариот, включая клетки растений, животных и дрожжей.
Концентрация этих белков сопоставима с клеточной концентрацией актина. Хотя оба белка связывают актиновые мономеры, тимозин b4 и профилин по-разному регулируют полимеризацию актина, и оба играют критическую роль в физиологических процессах.
Хотя белок представляет собой небольшой пептид, считается, что он связывается с протяженным участком поверхности мономера актина, стерически блокируя много областей, необходимых для образования важных контактов, стабилизирующих филаменты. В клетках, обладающих повышенной подвижностью, таких как нейтрофилы, концентрация тимозина b4 может достигать нескольких сотен микромоль. Это позволяет таким клеткам поддерживать большой цитоплазматический пул мономера актина. Тимозин b4 связывается с более высоким сродством с АТФ-актиновыми (Кd ~2 мкМ), чем с АДФ-актиновыми мономерами (Kd ~50 мкМ). Поэтому пул неполимерного актина в клетках состоит, главным образом, из АТФ-актина.
Профилин также является небольшим (Мr ~ 15 кДа) белком, способным связываться с мономерным актином, образуя комплексы в соотношении 1:1. Однако, в отличие от тимозина b4, эти комплексы могут связываться с оперенными концами актиновых филаментов. При связывании комплекса с оперенным концом профилин диссоциирует и в дальнейшем может связать другой мономер актина. Рисунок ниже показывает, что поскольку профилин связывает мономеры актина по субдоменам 1 и 3, в его присутствии блокируется связывание мономера с заостренным концом филамента. Таким образом, комплекс профилин-актин способствует элонгации исключительно на оперенном конце филамента.
Еще одно ключевое свойство профилина — это его способность обменивать нуклеотид, связанный с мономерным актином. Поскольку, внутриклеточная концентрация АТФ гораздо выше, чем АДФ, присутствие профилина позволяет мономеру актина быстро вступать в равновесие с цитоплазматическим АТФ и превращать АДФ-актиновые мономеры в АТФ-актиновые. Это способствует поддержанию большого пула АТФ-актиновых мономеров, необходимых для быстрого роста филаментов.
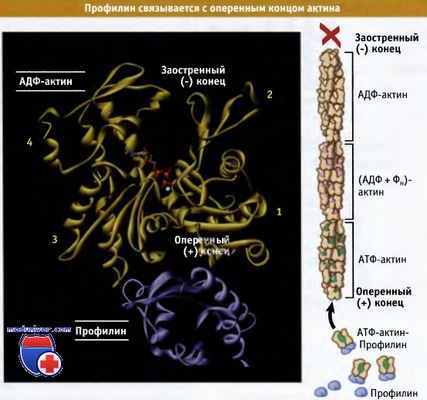
Профилин связывается с оперенным концом актиновых мономеров
и обеспечивает регуляцию полимеризации актина за счет включения мономера только со стороны оперенного конца.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Белки регулирующие полимеризацию актиновых мономеров
Организация клетки. Цитоскелет
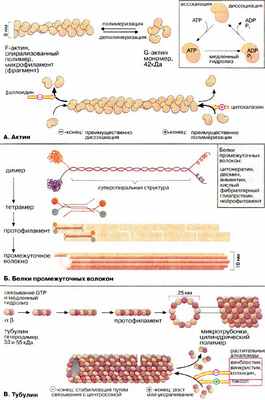
Цитоплазма эукариотических клеток пронизана трехмерной сеткой из белковых нитей (филаментов), называемой цитоскелетом. В зависимости от диаметра филаменты разделяются на три группы: микрофиламенты (6-8 нм), промежуточные волокна (около 10 нм) и микротрубочки (около 25 нм). Все эти волокна представляют собой полимеры, состоящие из субъединиц особых глобулярных белков.
Микрофиламенты (актиновые нити) состоят из актина — белка, наиболее распространенного в эукариотических клетках. Актин может существовать в виде мономера ( G-актин , «глобулярный актин») или полимера ( F-актин , «фибриллярный актин»). G-актин — асимметричный глобулярный белок (42 кДа), состоящий из двух доменов. По мере повышения ионной силы G-актин обратимо агрегирует, образуя линейный скрученный в спираль полимер, F-актин. Молекула G-актина несет прочно связанную молекулу АТФ (АТР), которая при переходе в F-актин, медленно гидролизуется до АДФ (ADP), т.е. F-актин проявляет свойства АТФ-азы.
При полимеризации G-актина в F-актин ориентация всех мономеров одинакова, поэтому F-актин обладает полярностью . Волокна F-актина имеют два разноименно заряженных конца — (+) и (-), которые полимеризуются с различной скоростью. Эти концы не стабилизированы специальными белками (как, например, в мышечных клетках), и при критической концентрации G-актина (+)-конец будет удлиняться, а (-)-конец укорачиваться. В условиях эксперимента этот процесс может быть ингибирован токсинами грибов. Например, фаллоидин (яд бледной поганки) связывается с (-)-концом и ингибирует деполимеризацию, в то время как цитохалазин (токсин из плесневых грибов, обладающий свойством цитостатика) присоединяется к (+)-концу, блокируя полимеризацию.
Актинассоциированные белки. В цитоплазме клеток имеются более 50 различных типов белков, которые специфически взаимодействуют с G-актином и F-актином. Эти белки выполняют различные функции: регулируют объем G-актинового пула (профилин), оказывают влияние на скорость полимеризации G-актина (виллин), стабилизируют концы нитей F-актина (фрагин, β-актинин) , сшивают филаменты друг с другом или с другими компонентами (как, например, виллин, α-актинин, спектрин, MARCKS) или разрушают двойную спираль F-актина (гельзолин) . Активность этих белков регулируется ионами Са 2+ и протеинкиназами.
Б. Белки промежуточных волокон
Структурными элементами промежуточных волокон являются белки, принадлежащие к пяти родственным семействам и проявляющие высокую степень клеточной специфичности. Типичными представителями этих белков являются цитокератины, десмин, виментин, кислый фибриллярный глиапротеин [КФГП (GFAP)] и нейрофиламент . Все эти белки имеют в центральной части базовую стержневую структуру, которая носит название суперспирализованной α-спирали (см. кератин, с. 76). Такие димеры ассоциируют антипараллельно, образуя тетрамер. Агрегация тетрамеров по принципу "голова к голове" дает протофиламент . Восемь протофиламентов образуют промежуточное волокно.
В отличие от микрофиламентов и микротрубочек свободные мономеры промежуточных волокон едва ли встречаются в цитоплазме. Их полимеризация ведет к образованию устойчивых неполярных полимерных молекул.
Микротрубочки построены из глобулярного белка тубулина , представляющего собой димер α- и β-субъединиц (53 и 55 кДа). α, β- Гетеродимеры образуют линейные цепочки, называемые протофиламентами. 13 протофиламентов образуют циклический комплекс. Затем кольца полимеризуются в длинную трубку. Как и микрофиламенты, микротрубочки представляют собой динамические полярные структуры с (+)- и (-)-концами. (-)-Конец стабилизирован за счет связывания с центросомой (центр организации микротрубочек), в то время как для (+)-конца характерна динамическая нестабильность. Он может либо медленно расти, либо быстро укорачиваться. Тубулиновые мономеры связывают ГТФ (GTP), который медленно гидролизуется и ГДФ (GTP). С микротрубочками ассоциируют два вида белков: структурные белки (MAP от англ. microtubuls-associated proteins) и белки-транслокаторы.
Белки регулирующие полимеризацию актиновых мономеров
Биологическая подвижность и полимеризация актина (Клячко Н.Л. , 2000), БИОЛОГИЯ
Дана новая информация о механизме полимеризации актина, лежащей в основе многих проявлений биологической подвижности. Рассмотрен путь передачи внеклеточного сигнала на полимеризующийся актин, включающий G-белки, WASP и Arp2/3-комплекс. Приведены примеры эксплуатации подвижными патогенными бактериями механизма полимеризации актина в клетках хозяина.
И ПОЛИМЕРИЗАЦИЯ АКТИНА
Институт физиологии растений им. К.А. Тимирязева Российской академии наук, Москва
Полимеризация актина важна для многих процессов в клетке, она подвержена строгой пространственной и временной регуляции. Актиновые микрофиламенты вместе с микротрубочками и промежуточными филаментами образуют динамичную сеть в цитоплазме клеток, так называемый цитоскелет, который не только определяет форму клетки и пространственную организацию ее компонентов, но и лежит в основе разнообразных типов внутриклеточной и клеточной подвижности.
Из статей, опубликованных ранее в "Соросовском Образовательном Журнале", можно узнать об общей организации цитоскелета, его составе, основных формах движения клеток животных и работе молекулярных моторов, то есть молекул, умеющих превращать химическую энергию гидролиза АТФ в механическую работу при сокращении мышц, перемещении органелл и т.п. 2. Одним из примеров такого моторного белка, участвующего в движении по нитям полимерного актина, является миозин. Взаимодействие актина и миозина приводит к сокращению мышц. Оно также лежит в основе перемещения органелл и молекул вдоль нитей актина, который в данном случае играет роль рельсов для перемещения, в то время как моторный белок служит паровозом.
Однако некоторые формы движения осуществляются без участия специализированных моторов: они основаны на процессе полимеризации актина. Само по себе быстрое удлинение нитей актина приводит к возникновению движущей силы в направлении роста этих нитей. Быстрая полимеризация актина происходит, например, при перемещении клеток фибробластов и некоторых низших грибов с помощью специализированных выростов - псевдоподий в сторону привлекательного для них сигнала или в направлении от отталкивающего сигнала (положительный и отрицательный таксис).
До недавнего времени механизм быстрой локальной полимеризации актина в клетках оставался неясным. Еще не так давно Ю.М. Васильев писал о полимеризации актина в местах выбрасывания псевдоподий подвижными клетками животных: "Вероятно, под мембраной в этих местах концентрируются какие-то белки, вызывающие полимеризацию новых микрофиламентов, но пока природу этих белков мы еще точно не знаем" [1, с. 39]. В последние годы сделано несколько открытий, позволивших узнать больше о таких белках и заполнить брешь в цепи событий, происходящих на пути от внеклеточного сигнала до конечного результата, а именно движения. Описанию этих новых фактов и посвящена данная статья.
НОВОЕ О ПОЛИМЕРИЗАЦИИ АКТИНА
Актин: мономеры и полимеры
Актин присутствует в клетке как в форме мономерного белка с молекулярным весом 42 кД, так и в виде длинных нитей и их пучков, связанных с другими элементами цитоскелета и мембранами. Мономеры актина имеют грушевидную форму, и при их полимеризации возникает спирально закрученная полярная нить с различающимися концами: заостренным (минус) и оперенным (плюс) концом (рис. 1). Такие названия появились в связи с тем, что при взаимодействии актиновых нитей с фрагментами молекулы моторного белка миозина образуется комплекс, имеющий под электронным микроскопом стреловидную форму. При этом острие стрелы указывает на заостренный конец, а ее оперение обращено в сторону противоположного конца филамента.
Полимеризация актина происходит в две стадии. Первая стадия носит название "нуклеация", то есть создание ядра (nucleus) или затравки из первых трех мономеров актина. Димер (комплекс двух мономеров) является нестабильной структурой и легко разрушается. Именно нуклеация определяет общую скорость полимеризации. Вторая стадия, удлинение нити, протекает легче, с большей скоростью.
В пробирке мономерный актин может присоединяться и диссоциировать с обоих концов нити, но присоединение происходит быстрее к плюс-концу. Процесс непрерывного присоединения мономеров к оперенному (плюс) концу и их диссоциации с заостренного (минус) конца, то есть непрерывный круговорот мономеров (от англ. treadmilling - бесконечная, монотонная механическая работа) (см. рис. 1).
В живой клетке процесс полимеризации актина может быть не похож на treadmilling, то есть на круговорот мономеров в пробирке, поскольку полярные концы актинового филамента могут быть несвободными. В клетке присутствуют десятки так называемых актинсвязывающихся белков, которые сильно влияют на процесс полимеризации актина. Некоторые из них могут блокировать активно растущий оперенный плюс-конец, так называемые кэп-белки (от англ. cap - шапочка), прекращая таким образом полимеризацию уже существующих нитей и освобождая мономерный актин для построения новых нитей. Другие белки могут разрезать нити актина, формируя тем самым новые фрагменты с заостренными и оперенными концами. Существуют белки, связывающие мономеры актина и таким образом делающие их недоступными для полимеризации (например, профилин), белки, деполимеризующие актин, и т.п.
Актин - крайне консервативный белок, состоящий практически из одинаковых аминокислот у всех исследованных организмов. Однако помимо такого консервативного классического актина в клетках имеется много так называемых актиноподобных белков (actin-related proteins, Аrp), гомология которых с актином составляет всего от 30 до 60%. Различают несколько подсемейств таких белков: Аrp1, Аrp2, Аrp3 и др. Области гомологии этих белков с актином расположены главным образом в центральной части белковой глобулы. Поэтому долгое время считали, что эти белки неспособны к полимеризации, а также и совместной полимеризации с актином. Однако в последнее время становится ясно, что такое утверждение не вполне верно. Так, было обнаружено, что Аrp1 (центрактин) может полимеризоваться вместе с актином в составе так называемого динактинового комплекса, участвующего в перемещении органелл по микротрубочкам. Аrp2 и Аrp3 поодиночке действительно не взаимодействуют с актином. Однако недавно было показано, что эти два белка входят в состав так называемого Arp2/3-комплекса, содержащего помимо Аrp2 и Аrp3 белков еще пять или шесть (в зависимости от организма) субъединиц, не имеющих гомологии ни с одним из белков в компьютерных базах данных (рис. 2, а). Этот сложно устроенный комплекс был впервые выделен из амебы Acanthamoeba castellanii. Впоследствии было показано, что Arp2/3-комплекс очень консервативен и присутствует у всех исследованных эукариотных организмов от дрожжей до человека (для растений таких данных пока нет). В живых клетках этот комплекс накапливается в местах, где происходит быстрая полимеризация актина, например в разного рода псевдоподиях, в кортикальном слое цитоплазмы у дрожжей, в хвосте подвижных патогенных бактерий.
Оказалось, что Arp2/3-комплекс имеет повышенное сродство к минус-концам актиновых филаментов, а именно гетеродимер Arp2-Arp3 может служить матрицей, на которой происходит образование новых актиновых нитей (нуклеация) (рис. 2, а). Кроме того, комплекс может присоединяться к боковым сторонам нитей и таким образом обеспечивать их ветвление (рис. 2, б ). Интересно, что боковые нити актина отходят от основной нити строго под углом 70?, образуя жесткую сеть. Быстро растущие плюс-концы нитей актина обращены в сторону периферии клеток, например к мембране псевдоподия (рис. 2, б ). При этом создается движущая сила, толкающая мембрану вперед, в направлении перемещения клетки.
Концентрация Arp2/3-комплекса в клетках в 40-100 раз меньше, чем концентрация мономеров актина, но она достаточно велика, чтобы заблокировать все заостренные концы нитей, например у Acanthamoeba. Это, конечно, не означает, что treadmilling (круговорот мономеров) актина никогда не происходит в живых клетках. Напомним, во-первых, что комплекс характерен не для всех субпопуляций актина, и, во-вторых, возможно, что при определенных физиологических условиях он может диссоциировать от актиновых полимеров.
Сродство Arp2/3-комплекса к актину не слишком велико, и он ускоряет полимеризацию актина всего в 2-3 раза. Оказывается, для более эффективного функционирования сам комплекс должен быть активирован. Роль активаторов комплекса играют другие белки.
Движение патогенной бактерии Listeria
Первый белок, играющий роль активатора Arp2/3-комплекса, был обнаружен у патогенной бактерии Listeria monocytogenes, которая может вызывать опасные для жизни человека заболевания, такие, как энцефалит. Эта бактерия способна с большой скоростью перемещаться в цитоплазме клеток хозяина. Однако она не имеет жгутиков, и в ее клетке, как и у других прокариот, нет собственного актинового цитоскелета. Эта бактерия-паразит приспособилась использовать для перемещения актин эукариотной клетки, в которой она живет. L. monocytogenes научилась быстро полимеризовать актин хозяина вблизи одного из своих полюсов. В результате в ее кильватере образуется "хвост кометы" из непрерывно полимеризующегося актина, что и создает движущуюся силу для перемещения бактерии (рис. 3, вставка).
Оказалось, что на поверхности этой бактерии вблизи одного из ее полюсов имеется белок ActA, который умеет присоединять и активировать Arp2/3-комплекс и как следствие - во много раз ускорять полимеризацию актина. Пространственно процесс ограничен областью вблизи поверхности бактерии. Это достигается совместным действием многих актинсвязывающих белков, которые блокируют концы растущих филаментов актина, обеспечивают их ветвление, деполимеризацию и т.д. Растущие нити актина, по-видимому, направлены быстро растущими оперенными плюс-концами в сторону движения бактерии (точно так же, как это происходит при образовании псевдоподий в клетках эукариот) и толкают бактерию вперед.
Недавно M.-F. Carlier и ее сотрудники воссоздали процесс движения бактерии в системе in vitro, состоящей только из очищенных цитоскелетных белков. Ученые также определили степень необходимости каждого из белков - участников этого процесса. Помимо актина для моделирования процесса движения оказались необходимы всего три компонента: Arp2/3-комплекс, актиндеполимеризующий фактор и кэп-белки. Еще три белка были полезны, но необязательны для поддержания движения. Скорость движения бактерий составила 2-4 мкм/мин, то есть была не намного меньше, чем в клеточных экстрактах.
Таким образом, на предметном стекле был воспроизведен процесс движения патогенной бактерии Listeria и изучен его молекулярный механизм. Показано, что бактерия использует для передвижения полимеризацию актина цитоплазмы клетки-хозяина, активируя его с помощью собственного мембранного белка ActA.
РЕГУЛЯЦИЯ ПОЛИМЕРИЗАЦИИ АКТИНА
В КЛЕТКАХ ЭУКАРИОТ
Если полимеризация актина вблизи поверхности патогенной бактерии происходит конститутивно (без внешнего сигнала), то в подвижных клетках эукариот (например, в псевдоподиях фибробластов) или в зонах внутриклеточной подвижности, основанной на полимеризации актина, перестройка актинового цитоскелета обычно происходит в ответ на внеклеточный сигнал (свет, химический стимул). Уже давно известны начальные и конечные звенья в передаче этого сигнала. Внеклеточный сигнал воспринимается мембранным рецепторным белком и затем передается на так называемые G-белки, небольшие белки, способные связывать ГТФ, изменять свою конформацию и благодаря этому передавать сигналы на другую белковую молекулу. Гидролиз ГТФ до ГДФ G-белком возвращает его в неактивную конформацию. Некоторые такие G-белки (Rho, Rac и Cdc42) в итоге передают сигнал на актиновый цитоскелет, что приводит к быстрой полимеризации актина в зонах образования ламеллоподий и филоподий (разные типы псевдоподий) или волокон натяжения, пересекающих клетку пучков актиновых нитей. Промежуточные звенья в этой системе передачи сигнала до недавнего времени не были выяснены. Теперь стало очевидным, что полимеризации актина предшествует взаимодействие его мономеров с Arp2/3-комплексом, который затем должен быть активирован какими-то белками по аналогии с ActA-белком Listeria. Начались поиски таких белков в клетках животных и дрожжей, которые вскоре увенчались успехом. Было найдено несколько гомологичных белков. Первый из открытых белков получил название WASP, поскольку был найден у больных Wiscott-Aldrich-синдромом - наследуемой болезнью человека. Для этих белков характерно сложное доменное строение: они содержат домены связывания с белками и другими регуляторными молекулами (рис. 4, а). Показано, что эти белки, в частности, могут связывать Arp2/3-комплекс, мономерный актин, профилин, G-белки, сигнальную молекулу - фосфатидилинозитол-4,5-бисфосфат. Функциональное назначение разных доменов различно. Так, на С-конце WASP-белка рядом расположены домены связывания мономерного актина и Arp2/3-комплекса. Это обеспечивает их пространственное сближение и может облегчать процесс полимеризации актина. На N-конце WASP-белка расположены домены связывания G-белков и других сигнальных молекул. Благодаря этому WASP и его аналоги могут служить посредниками при действии многих факторов и участвовать в передаче сигнала (на участке между G-белками и Arp2/3-комплексом), активирующего полимеризацию актина.
Сами белки семейства WASP, по-видимому, в свою очередь, нуждаются в активации. Так, было показано, что С-концевые фрагменты этих белков более активны в стимуляции полимеризации актина, чем целые белки. Это может означать, что белки из семейства WASP могут существовать в клетке в неактивной конформации (рис. 4, б ) и только взаимодействие сигнальных молекул (G-белки, фосфоинозитолфосфатиды) с N-концевой частью этих белков переводит их в активную конформацию.
Итак, WASP-белки и Arp2/3-комплекс составляют те центральные звенья в цепи передачи внеклеточного сигнала, вызывающего полимеризацию актина, которые до недавнего времени были белыми пятнами в наших знаниях (рис. 5). Любопытно, что, если патогенная бактерия Listeria, о которой шла речь выше, сама синтезирует мембранный белок ActA (гомолог WASP), активирующий Arp2/3-комплекс эукариотной клетки, другая патогенная бактерия, возбудитель дизентерии Shigella flexneri, продвинулась еще дальше в степени эксплуатации механизма полимеризации актина клетки хозяина: ее мембрана содержит белок, который умеет присоединять WASP-белок хозяина (а не имитировать его активность), вклиниваясь в сигнальную цепь хозяина и активируя Arp2/3-комплекс с помощью Cdc42 (G-белок). Более того, если покрыть WASP-белком микроскопические стеклянные бусинки, то они тоже сумеют собирать актин вблизи своей поверхности и перемещаться в клеточных экстрактах без участия каких-либо моторных белков, только благодаря полимеризации актина.
Для выполнения актиновым цитоскелетом множества функций в клетке необходимо, чтобы сборка и организация актиновых нитей происходили в нужное время и в нужном месте. В последние десять лет шли интенсивные исследования с использованием генетических, биохимических и цитологических подходов для выяснения путей передачи внеклеточного сигнала к местам активной полимеризации актина. За это время был открыт Arp2/3-комплекс, служащий матрицей для нуклеации нитей актина и обнаружено несколько белков, регулирующих его активность. В последние годы было предпринято много усилий, чтобы понять механизм, с помощью которого G-белки семейства Rho регулируют состояние актинового цитоскелета, и практически заполнена брешь в цепи передачи внеклеточного сигнала на цитоскелет с участием G-белков. Важные для расшифровки этого пути передачи сигнала уроки были извлечены из изучения подвижности патогенных бактерий внутри эукариотической клетки и воспроизведения этого движения в модельных системах. Очевидно, что новые детали пространственной и временной регуляции сборки и организации актинового цитоскелета будут выяснены в последующие годы.
1. Васильев Ю.М. Клетка как архитектурное чудо. 1. Живые нити // Соросовский Образовательный Журнал. 1996. ╧ 2. С. 36-43.
2. Васильев Ю.М. Клетка как архитектурное чудо. 2. Цитоскелет способный чувствовать и помнить // Там же. ╧ 4. С. 4-10.
3. Тихонов А.Н. Молекулярные моторы. 2. Молекулярные основы биологической подвижности // Там же. 1999. ╧ 6. С. 17-24.
4. Welch M.D. The World According to Arp: Regulation of Actin Nucleation by the Arp2/3 Complex // Trends Cell Biol. 1999. Vol. 9. P. 423-427.
5. Machesky L.M., Cooper J.A. Bare Bones of the Cytoskeleton // Nature. 1999. Vol. 401. P. 542-543.
Рецензент статьи О.Н. Кулаева
Нелла Леопольдовна Клячко, доктор биологических наук, ведущий научный сотрудник Института физиологии растений им. К.А. Тимирязева РАН. Область научных интересов - пространственная организация белоксинтезирующего аппарата и его взаимодействие с цитоскелетом растительной клетки. Автор более 80 научных публикаций.
Актиновая нить
Нити актина или микрофиламенты , является гомополимером из актина , белок 42 кДа ( Единицы атомной массы ). Это важный компонент цитоскелета эукариотических клеток, а также мышечных волокон . Таким образом, актин составляет около 10% от общего белка типичной животной клетки, половина которого собрана в актиновые филаменты, а другая половина находится в цитозоле в форме мономеров актина. Актин в форме нитей иногда называют F-актином (фибриллярный), а мономерная форма называется G-актином (шаровидный).
Резюме
Структура нити
Актиновый филамент возникает в результате полимеризации нескольких глобулярных актиновых единиц с вращением на 167 ° и взаимодействующих через их большую субъединицу (маленькие субъединицы, направленные наружу от филамента, создают впечатление двух филаментов, окруженных друг другом). Нить имеет диаметр около 7 нм и постоянную длину около 17 мкм , что составляет порядок величины диаметра ячеек.
Каждая нить поляризована, потому что все глобулярные молекулы актина «указывают» в одном направлении, к одному концу, называемому (-), а другому - (+). К этой структурной полярности добавляется полярность полимеризации. (См. ниже).
Динамика полимеризации
Глобулярный G-актин полимеризуется в F-актин (актиновая нить).
Полимеризация начинается с фазы зародышеобразования, в которой в основном образуются тримеры. Затем мономеры собираются в двойную спираль, которая, следовательно, не имеет центра симметрии. На одном конце, обозначенном (+), с зазубриной или щеткой, кинетические константы по порядку величины в 10 раз больше, чем на другом конце, обозначенном (-) или заостренным концом. Кроме того, мономеры, связанные с АТФ (АТФ-актин), присутствующие в большинстве в живых клетках, имеют большую тенденцию к полимеризации, чем мономеры, связанные с АДФ (АДФ-актин).
Актин, связанный с филаментом, имеет тенденцию гидролизовать свой АТФ. Это свойство, наряду с полярностью нити, лежит в основе так называемого феномена « беговой дорожки » . Действительно, (+) конец будет иметь тенденцию захватывать подавляющее большинство АТФ-актина, следовательно, способствуя полимеризации на этом конце. С другой стороны, (-) конец менее активен, актин филамента, который находится рядом с ним, провел больше времени в филаментарной форме и в основном находится в форме АДФ-актина. Следовательно, на (-) конце равновесие смещается в сторону деполимеризации.
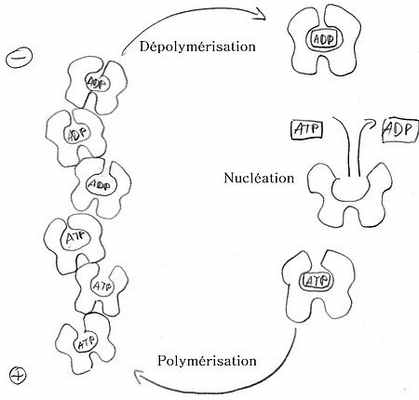
Эти два сопутствующих сдвига равновесия заставляют цепь непрерывно увеличиваться на стороне (+) и уменьшаться на стороне (-). Если мы сохраним фиксированный центральный мономер, кажется, что вся цепочка будет двигаться. Подача энергии, необходимая для поддержания этого состояния вне равновесия, происходит в окружающей жидкой среде, где АДФ-актин регенерируется в АТФ-актин. Термин «конвейерная лента» предполагает, что мономеры, покидающие (-) конец, возвращаются, чтобы присоединиться к (+) концу после прохождения через раствор. Однако макроскопически никакая масса не переносится. Этот процесс позволяет реализовать молекулярный мотор, который позволяет некоторым клеткам перемещаться с помощью ламеллопод . Он также является источником движения бактерий Listeria . Однако необходимы несколько других белков, и сам по себе актин не может преобразовать химическую энергию гидролиза АТФ в работу.
Связанные белки
Связанные с актином белки (или ААР) являются ключом к контролю клетки над запасом актина. Они позволяют регулировать полимеризацию и пространственно организовать волокна. Они, в свою очередь, контролируются регуляторными белками, которые входят в сложную сеть, взаимодействующую со всей клеткой.
Сшивающие белки
- Фимбрин : поддерживает плотные волокна фасцикулированного актина.
- альфа- актинин : димерный белок, связывающий 2 микрофиламента вместе, удерживая их параллельно друг другу (фокус закрепления . ). Он связывается с положительным полюсом, обеспечивая взаимодействие актин- миозина , особенно при амебоидном движении.
- Филамин : блокирует сшитый актин, чтобы предотвратить его переход в фасцикулированный актин.
- Ворсинки : удерживают плотные волокна фасцикулированного актина, характерные для микроворсинок.
- Спектрин : позволяет прикреплять микрофиламенты актина к плазматической мембране.
Стабилизирующие белки
- Тропомиозиновый комплекс
- Набор головных уборов протеин
Полимеризационные белки
Белки зародышеобразования
Именно эти белки позволяют инициировать полимеризацию. Есть несколько типов, с разными режимами действия.
- Arp2 / 3 , структурно близкий к белку актина, служит в качестве отправной точки для полимеризации: G актина мономеров приходят связываться с ней, что приводит к образованию нити. При размещении минус (-) конец микрофиламента прилипает к комплексу Arp2 / 3 . Таким образом, полимеризация развивается с (+) концом, который также вызывает рост микрофиламента. Комплекс Arp2 / 3 находится на переходе между нитями актина, он активируется GTPase Cdc42 .
- Формин имеет две богатые пролином домены FH1 и FH2. Из профилина каждый связанно с G актином приходит связывается с первым доменом FH1. Эти актины затем переносятся во второй домен FH2, где они связываются один за другим, образуя филамент. Формин активируется GTPase Rho.
Регуляторные белки
Эти белки используются для регулирования количества G-актина, присутствующего в цитоплазме.
- Тимозин крепится к заостренным концом G-актина и предотвращает обмен АДФ соединен с последним с помощью молекулы АТФ.
- В профилин связывается с G-актина и способствует обмену АДФ для АТФ, и пусть - сторону свободного актина; таким образом, он может быть вставлен в полимер на конце с зазубринами.
Белки для укладки
Они связываются с зазубренным концом актиновой нити, чтобы предотвратить полимеризацию (добавление G-актина) и, следовательно, остановить рост нити. Они также могут связываться с заостренным концом, чтобы остановить деполимеризацию или позволить образование ядра (инициирование полимеризации).
- Тропомодулин связывается с минус-концом актиновой нити и предотвращает полимеризацию и деполимеризацию.
- CAP ( покрывающий белок ) прикрепляется к плюсовому концу филамента и предотвращает полимеризацию и деполимеризацию.
Белки фрагментации
Эти белки позволяют расщеплять актиновые филаменты:
- gelsolin , как предполагает его название, чтобы перейти из геля актина (в ячеистой сети) раствора актина (G-актин);
- кофилин накладывает дополнительный поворот к актина, в результате чего его деполимеризации.
Моторные белки
- Миозинтипа 1 : удерживает широкий актин с помощью альфа-актинина.
- Миозин типа 2 : сокращение мышц.
- Миозин 5-го типа : моторный белок, способный двигаться к положительному концу.
Надстройки
Актиновые филаменты устроены по-разному в зависимости от их биологических функций. Вот несколько примеров наблюдаемых структур и их основных свойств: балки, кабели напряжения, сети, кометы.
Читайте также:
