Дифференциация клеток. Регенерация клеток
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Что мы знаем о регенеративной медицине? Наверняка многие думают, что это скорее что-то из косметологии. Но нет. На сегодняшний день методы регенеративной медицины активно применяются при заболеваниях и травмах, особенно когда шансы не только на выздоровление, но и на выживание низки, когда иные методы лечения уже исчерпали себя. Это специальные терапевтические подходы, позволяющие восстановить поврежденные или пораженные болезнями ткани, например, при помощи стволовых клеток человека и животных. Направление хоть и современное, но уже почти 25 лет существует в медицине и продолжает активно развиваться во многих странах.
«Научная Россия» в интервью с Анастасией Юрьевной Ефименко, кандидатом медицинских наук, заведующей лабораторией репарации и регенерации тканей Института регенеративной медицины Медицинского научно-образовательного центра МГУ им. М.В. Ломоносова, узнала, какие новшества разработаны в области регенеративной медицины, и в чем её уникальность в медицине в целом.
- Можно ли сейчас утверждать, что регенеративная медицина – новая отрасль медицины в целом? И насколько она позволит улучшить здоровье пациентов?
- Регенеративная медицина сегодня – это не сколько отрасль, а вообще новая медицина. Регенерация – это способность живых организмов восстанавливать утраченные и поврежденные ткани и органы. До недавних пор медицина с помощью лекарств оказывала влияние на функцию клеток, в основном подавляя неблагоприятные процессы и способствуя лечению заболеваний.
Возможности медицины в плане восстановления утраченных и поврежденных тканей, выращивания новых структур – это была только мечта. На сегодняшний день мы дошли до неё.
Регенеративная медицина базируется на совершенно беспрецедентных успехах учёных-биологов, учёных-химиков и врачей, а также специалистов по биологии развития. Сегодня правильнее говорить не регенеративная медицина, а регенеративная биомедицина. В ней очень тесно связаны междисциплинарные области, которые помогают друг другу в том, чтобы понять, как ткани и органы могут обновляться и восстанавливаться при повреждениях и заболеваниях, а также каким образом эти знания можно реализовать в виде терапевтических подходов.
Потребность в этом огромная. Практически все тяжелейшие заболевания связаны с необратимым повреждением уникальных функций различных тканей и органов. Задача регенеративной медицины – научиться их замещать, а в идеале – понять, как сам организм справляется, и помочь ему. В этом смысле она принципиально отличается от всех других направлений: и клинической медицины, и медицинской науки.
Регенеративная медицина исследует универсальные механизмы, которые реализуются во всех тканях и системах организма. Понимание этих универсальных механизмов с помощью одного успешного открытия позволит придумать новые подходы к лечению заболеваний самых разных органов и систем.
- Как происходит процесс регенерации тканей с помощью стволовых клеток?
- Основные клеточные работники, отвечающие за замещение погибших или утраченных клеток тканей, – это стволовые клетки. Они обнаружены во всех тканях, но различаются по своей потенции. В настоящее время описывают много разных типов стволовых клеток. Некоторые из них могут быть выделены из организма человека из самых разных тканей в культуру.
Одна из ключевых задач регенеративной медицины – изучение свойств стволовых клеток и условий их успешного функционирования. Практический результат таких исследований – попытка использовать эти уникальные по своим свойствам клетки в качестве клеточного препарата для введения их в ткань, где нужно замещение, и запуска в процесс дифференцировки - специализации в нужные типы ткани. Это непростая задача.
Первоначально огромные ожидания по поводу успешности таких подходов регенеративной медицины во многом себя не оправдали. Сейчас мы наблюдаем такой своеобразный «откат» назад, так как стало очевидно, что нужно лучше понять, как функционируют стволовые клетки и каким образом их уникальные свойства можно использовать. В этом смысле важно переосмыслить концепцию регенерации с точки зрения действия не стволовой клетки отдельно, поскольку в самом организме (это уже показано в ряде очень серьёзных исследований) любые стволовые клетки существуют в специальном окружении – микроокружении, которое называется нишей стволовой клетки. Это очень специализированный набор разных клеточных, матриксных, сигнальных компонентов, малых молекул, которые управляют функцией стволовых клеток. С одной стороны, позволяют ей сохранять свойства стволовости, с другой стороны – при активации, при повреждении нужно правильно интерпретировать сигнал и запустить дифференцировку стволовой клетки в нужном направлении.
- Можно ли восстановить часть работы головного мозга после тяжелых повреждений?
- В головном мозге есть свои стволовые клетки – нейральные стволовые клетки. Они активируются при повреждении, но этого зачастую оказывается недостаточно. Настолько сложна эта ткань и сложны взаимодействия между клетками, что само по себе восстановление клеточного состава еще не означает восстановление функции органа.
На сегодняшний день активно разрабатываются подходы получения нейральных клеток, например, для лечения болезни Паркинсона – специфических дофаминергических нейронов. Их научились получать из стволовых клеток особого типа. Но способность к дифференцировке у них значительно ниже, чем у клеток эмбрионов. Это проблема, которая существенно ограничивает возможности разработки препаратов.
Однако, в 2006 году было сделано открытие – специализированные клетки путем внесения нескольких генетических конструкций с траскрипционными факторами, регулирующими генетическую программу, можно «откатить» обратно в эмбриональное стволовое состояние. Это индуцированные плюрипотентные клетки. Из таких клеток сейчас хорошо научились получать нейроны различного типа и другие клетки нервной ткани в лабораторных условиях. Проводится множество исследований в попытке использовать эти подходы для лечения нейродегенеративных заболеваний. Разрабатываются интересные направления, связанные с лечением постинсультных состояний в попытке ограничить повреждения, способствуя улучшению и восстановлению тканей мозга.
В Институте регенеративной медицины МНОЦ и на факультете фундаментальной медицины Московского университета тоже ведутся такие разработки. С одной стороны, они направлены на поиск факторов, критически влияющих на функцию нейронов, которые могут быть введены как генетическая конструкция – генная терапия (направление регенеративной медицины, которое предполагает введение определенных генов, управляющих функцией клеток и позволяющих создать локально хорошую экспрессию нужного фактора, способствующего выживанию нейронов). С другой стороны – производится попытка найти комплекс факторов, влияющих на разные типы клеток в головном мозге. А при их введении способствовать восстановлению микроокружения нейронов для выживания или стимулирования нейральных стволовых клеток при повреждении, чтобы они заместили утраченные нейроны и способствовали установлению новых связей между нейронами в головном мозге.
- Как себя показывает клеточная терапия? В чем её уникальность?
Сейчас многие коллективы, в том числе в нашей стране, активно работают с клетками с химерным антигенным, Т-клеточным рецептором (CAR-T) для того, чтобы научить их распознавать и солидные опухоли. Эта задача оказалась более сложной. Тем не менее в этой области есть успехи. Можно ожидать, что клеточная терапия свою нишу займет не только в онкогематологии, но и в других направлениях онкологии.
Если говорить про регенеративную медицину, то есть одно направление, которое давно реализуется в клеточной терапии, – это трансплантация костного мозга. Сейчас мы имеем эту технологию клеточной терапии, спасающую многие жизни каждый год в реальной практике.
Для восстановления других тканей клеточная терапия - тоже прекрасный подход, только значительно сложнее в реализации. Нужно, чтобы введённые извне клетки дошли до ткани-мишени и органа-мишени, встроились туда и попали в микроокружение, которое позволит им работать. Так, к сожалению, происходит не всегда. В этом смысле важным вопросом является источник клеток для клеточной терапии.
Сейчас, основываясь на понимании того, как клетки взаимодействуют друг с другом, развивается еще интересное ответвление клеточной терапии – клеточная терапия без клеток. Это использование комплекса сигналов, секретируемых специализированным типом клеток (стволовых клеток или их потомками). Комплекс этих сигналов, или секретом клеток, может быть использован как терапевтический агент. В этом случае мы избавляемся от различных рисков, связанных с введением живых клеток в организм. Можно наработать комплекс этих сигналов сразу в большом количестве, стандартизовать его, проверить на безопасность и затем использовать его в качестве лекарственного препарата.
Клеточная терапия без клеток сейчас тоже активно развивается. Пока её перспективы в разных направлениях только исследуются. Но это станет одним из разделов, позволяющим имитировать регенераторные сигналы и за счет этого стимулировать собственный эндогенный потенциал тканей к восстановлению и воссозданию структурного, функционального комплекса нужных процессов для здоровья человека.
- Какие новейшие разработки уже готовы войти в практику?
- Здесь нужно быть достаточно осторожными, так как регенеративная медицина – это не просто ещё один подход, который позволит нам предложить новую таблетку от чего-либо. Нет! Это работа с совершенно новыми объектами, влияющими на саму сущность устройства организма человека: на клеточный состав тканей, на генетическую программу клеток и на взаимодействие систем органов между собой.
Не зря Институты регенеративной медицины локализуются в медицинских центрах, потому что трансляция таких разработок - безусловно, важнейшая задача для нас.
Одним из интересных направлений нашей лаборатории являются исследования и создание подходов к направленной регуляции ниш стволовых клеток, поскольку это позволяет регулировать регенерацию тканей изнутри за счет комплексного влияния на различные компоненты ниши, управляющей функцией стволовых клеток. Для одного из таких препаратов у нас заканчиваются в этом году доклинические исследования, и мы готовим документы на клинические испытания.
Важно также понимать, почему при многих повреждениях регенерация тканей не происходит или является недостаточной. А надо сказать, что в большинстве наших тканей и органов заживление реализуется не столько путем полноценной регенерации и восстановления тканей, сколько за счёт быстрого «залатывания» дефекта и развития на этом месте соединительнотканного рубца.
Борьба с этим дисбалансом, когда вместо регенерации происходит фиброз (особенно в жизненно важных органах – сердце, легких, почках) - это одна из очень интересных задач, которую мы сейчас пытаемся решать. Сфокусировались на фиброзе легких, поскольку есть связанные с ним тяжёлые заболевания, которые практически не лечатся. Мы пытались изучать, как дифференцировка клеток вовлечена в это прогрессирование неостановимого фиброза при хроническом повреждении легких, и обнаружили подкласс клеток стромы, которые способны регулировать этот процесс за счет переноса особых сигналов в клетки, участвующие в наработке фиброзного матрикса, которые называются миофибробласты. Они заточены на производство множества компонентов соединительнотканного матрикса.
Есть в строме определенный подтип клеток, выделяющий сигнальные неуодирующие микроРНК, которые в маленьких пузырьках (везикулах) переносятся к миофибробластам и способны влиять на генетическую программу, останавливая их превращение в клетки, секретирующие много-много матрикса.
Использование таких пузырьков с нужными микроРНК или сами микроРНК в комплексе, который по результатам исследований будет показан как эффективный регулятор, и может стать терапевтическим подходом для лечения фиброза. Результаты этих данных получены на животных моделях. Если окажется, что и у людей эти подходы могут не просто останавливать прогрессирование фиброза легких, развившееся в результате инфекционных и других поражений, но и приводить к лечению и восстановлению хотя бы части функциональной ткани, то это позволит создать уникальные препараты и вывести их в клиническую практику.
ДИФФЕРЕНЦИАЦИЯ КЛЕТОК
ДИФФЕРЕНЦИАЦИЯ КЛЕТОК, процесс приобретения клетками зародыша особых черт для выполнения специализированных функций. Первоначально все клетки зародыша одинаковы, однако вскоре начинается их дифференциация на различные типы, например, костные клетки, мозговые клетки, сердечные клетки, мышечные клетки и т.д. Тот же процесс протекает и у взрослых растений и животных, когда происходит регенерация потерянных или поврежденных тканей.
Научно-технический энциклопедический словарь .
Смотреть что такое "ДИФФЕРЕНЦИАЦИЯ КЛЕТОК" в других словарях:
дифференциация клеток — ląstelių diferenciacija statusas T sritis augalininkystė apibrėžtis Vyksmas, kurio metu vienos ląstelės palikuonys pasiekia tam tikrą vėliau išlaikomą sandaros ir funkcijų specializaciją. atitikmenys: angl. cytodifferentiation rus. дифференциация … Žemės ūkio augalų selekcijos ir sėklininkystės terminų žodynas
дифференциация — и, ж. différenciation f., нем. Differentiation <лат. differentia различие. Разделение целого на различные части, формы, ступени. Политическая дифференциация общества. Дифференциация языков. Дифференциация клеток. БАС 2. Дифференциация… … Исторический словарь галлицизмов русского языка
Клеток дифференциация — * клетак дыферэнцыяцыя * cell differentiation процесс, в результате которого потомки одной клетки достигают определенной специализации структуры и функций и сохраняют их () … Генетика. Энциклопедический словарь
дифференциация пола — Генетически детерминированный процесс превращения половых клеток в оогонии и сперматогонии в процессе закладки и развития половых органов; в основе Д.п. лежит хромосомная детерминация пола (половые хромосомы, или пол детерминирующие аутосомные… … Справочник технического переводчика
Дифференциация пола — * дыферэнцыяцыя полу * sex differentiation генетически детерминированный процесс превращения половых клеток в оогонии и сперматогонии в процессе закладки и развития половых органов. В основе Д. п. лежит хромосомная детерминация пола (половые… … Генетика. Энциклопедический словарь
Дифференциация — (лат. differenciatia различие) 1. развитие специализированных клеток из стволовых клеток или бластомеров (греч. blastos росток, meros доля); 2. способность различать сходные стимулы и реагировать на них избирательным образом (например,… … Энциклопедический словарь по психологии и педагогике
дифференциация пола — sex differentiation дифференциация пола. Генетически детерминированный процесс превращения половых клеток в оогонии и сперматогонии в процессе закладки и развития половых органов; в основе Д.п. лежит хромосомная детерминация пола (половые… … Молекулярная биология и генетика. Толковый словарь.
ДИФФЕРЕНЦИАЦИЯ — 1. В эмбриологии – процесс, посредством которого группа изначально подобных клеток продуцирует ряд клеток различных видов. 2. В социологии – процесс, в ходе которого внутри общества формируются группы, роли, статусы и т.д. В психологии имеется… … Толковый словарь по психологии
Дифференциация (Differentiation) — 1. В эмбриологии этап эмбрионального развития, во время которого неспециализированные клетки или ткани становятся специализированными и начинают приспосабливаться к выполнению определенных функций. 2. В онкологии степень сходства опухолевых… … Медицинские термины
дифференциация — процесс приобретения различий в строении между однородными структурными элементами организма для выполнения разных функций, напр. Д. клеток меристем при образовании постоянных тканей … Анатомия и морфология растений
- Дифференциация клеток
Этот вопрос относится к числу наиболее сложных и в тоже время интересных как для цитологии, так и для биологии. Дифференцировка - это процесс возникновения и развития структурных и функциональных различий между первоначально однородными эмбриональными клетками, в результате которого образуются специализированные клетки, ткани и органы многоклеточного организма. Дифференцировка клеток является важнейшей составной частью процесса формирования многоклеточного организма. В общем случае дифференцировка необратима, т.е. высокодифференцированные клетки не могут превращаться в клетки другого типа. Это явление называется терминальной дифференцировкой и присуще преимущественно клеткам животных. В отличие от клеток животных, большинство клеток растений даже после дифференцировки способны переходить к делению и даже вступать на новый путь развития. Такой процесс называется дедифференцировкой. Например, при надрезе стебля некоторые клетки в зоне разреза начинают делиться и закрывают рану, другие вообще могут подвергаться дедифференцировке. Так клетки коры могут превратиться в клетки ксилемы и восстановить непрерывность сосудов в области повреждения. В экспериментальных условиях при культивировании растительной ткани в соответствующей питательной среде клетки образуют каллус. Каллус – это масса относительно недифференцированных клеток, полученная из дифференцированных клеток растений. При соответствующих условиях из одиночных клеток каллуса можно вырастить новые растения. При дифференцировки не происходит потерь или перестройки ДНК. Об этом убедительно свидетельствуют результаты экспериментов по пересадке ядер из дифференцированных клеток в недифференцированные. Так ядро из дифференцированной клетки вводили в энуклеированную яйцеклетку лягушки. В результате из такой клетки развивался нормальный головастик. Дифференцировка в основном происходит в эмбриональный период, а также на первых стадиях постэмбрионального развития. Кроме того, дифференцировка имеет место в некоторых органах взрослого организма. Например, в кроветворных органах стволовые клетки дифференцируются в различные клетки крови, а в гонадах – первичные половые клетки – в гаметы.
Рекомендуемые материалы
2. Факторы и регуляция дифференциации
На первых этапах онтогенеза развитие организма происходит под контролем РНК и других компонентов, находящихся в цитоплазме яйцеклетки. Затем на развитие начинают оказывать влияние факторы дифференцировки.
Выделяют два основных фактора дифференцировки:
1. Различия цитоплазмы ранних эмбриональных клеток, обусловленные неоднородностью цитоплазмы яйца.
2. Специфические влияния соседних клеток (индукция).
Роль факторов дифференцировки заключается в избирательной активации или инактивации тех или иных генов в различных клетках. Активность определенных генов приводит к синтезу соответствующих белков, направляющих дифференциацию. Синтезируемые белки могут блокировать или, напротив, активировать транскрипцию. Первоначально активация или инактивация разных генов зависит от взаимодействия тотипотентных ядер клеток со своей специфической цитоплазмой. Возникновение локальных различий в свойствах цитоплазмы клеток называется ооплазматической сегрегацией. Причина этого явления заключается в том, что в процессе дробления яйцеклетки участки цитоплазмы, различающиеся по своим свойствам, попадают в разные бластомеры. Наряду с внутриклеточной регуляцией дифференцировки с определенного момента включается надклеточный уровень регуляции. К надклеточному уровню регуляции относится эмбриональная индукция.
Эмбриональная индукция – это взаимодействие между частями развивающегося организма, в процессе которого одна часть (индуктор) входит в контакт с другой частью (реагирующей системой) и определяет развитие последней. Причем установлено не только воздействие индуктора на реагирующую систему, но и влияние последней на дальнейшую дифференцировку индуктора.
Под действием какого-либо фактора сначала происходит детерминация.
Детерминацией, или латентной дифференцировкой, называют явление, когда внешние признаки дифференцировки еще не проявились, но дальнейшее развитие ткани уже происходит независимо от фактора, вызвавшего их. Клеточный материал считают детерминированным со стадии, на которой он впервые при пересадке в новое место развивается в орган, который из него образуется в норме.
3. Стволовая клетка и дифферон
К числу перспективных направлений биологии XXI века относится изучение стволовых клеток. Сегодня исследования стволовых клеток по значимости сопоставимо с исследованиями по клонированию организмов. По мнению ученых применение стволовых клеток в медицине позволит лечить многие "проблемные" заболевания человечества (бесплодие, многие формы рака, диабет, рассеянный склероз, болезнь Паркинсона и др.).
Стволовая клетка – это незрелая клетка, способная к самообновлению и развитию в специализированные клетки организма.
Стволовые клетки подразделяют на эмбриональные стволовые клетки (их выделяют из эмбрионов на стадии бластоцисты) и региональные стволовые клетки (их выделяют из органов взрослых особей или из органов эмбрионов более поздних стадий). Во взрослом организме стволовые клетки находятся, в основном, в костном мозге и, в очень небольших количествах, во всех органах и тканях.
Свойства стволовых клеток. Стволовые клетки самоподдерживаются, т.е. после деления стволовой клетки одна клетка остается в стволовой линии, а вторая дифференцируются в специализированную. Такое деление называется несимметричным.
Функции стволовых клеток. Функция эмбриональных стволовых клеток заключается в передаче наследственной информации и образовании новых клеток. Основная задача региональных стволовых клеток - восстановление потерь специализированных клеток после естественной возрастной или физиологической гибели, а также в аварийных ситуациях.
Дифферон – это последовательный ряд клеток, образовавшийся из общего предшественника. Включает стволовые, полустволовые и зрелые клетки.
Например, стволовая клетка, нейробласт, нейрон или стволовая клетка, хондробласт, хондроцит и т. д.
Нейробласт - малодифференцированная клетка нервной трубки, превращающаяся в дальнейшем в зрелый нейрон .
В лекции "13. Методы статистической идентификации" также много полезной информации.
Нейрон - клетка, являющаяся структурной и функциональной единицей нервной системы.
Хондробласт - малодифференцированная клетка хрящевой ткани, превращающаяся в хондроцит (зрелая клетка хрящевой ткани).
Дифференциация клеток. Регенерация клеток
Дифференциация клеток. Регенерация клеток
Клетки отличаются друг от друга не только характером дифференциации, но и ее степенью. Одни клетки становятся высокодифференцированными (нервные клетки, клетки поперечнополосатых мышц), другие — остаются сравнительно малодифференцированными (эпителиоциты базального слоя многослойного эпителия, некоторые виды соединительнотканных клеток).
Малодифференцированные клетки энергично размножаются, тогда как высокая дифференциация, как правило, приводит к утрате клеткой способности делиться (клетки периферической крови, верхних слоев эпидермиса, костные, нервные). Однако существуют высокодифференцированные клетки, способные делиться (клетки печени, почек, поджелудочной железы).
В течение жизни взрослого организма происходит непрерывная смена клеток: одни отмирают, другие размножаются, пополняя эту убыль. У человека ежедневно гибнет около 2% клеток (500 млрд.) и столько же образуется вновь. Этот процесс называют физиологической регенерацией. В ряде тканей и органов он не выражен (клетки центральной нервной системы, органы чувств, мышцы). Поэтому клетки этих тканей и органов рассматривают как обновляющиеся на субклеточном или молекулярном уровне.
В тех тканях, где имеет место физиологическая регенерация, скорость смены дифференцированных клеток и, следовательно, продолжительность их жизни различны. Одни клетки быстро погибают и заменяются новыми (энтероциты тонкого кишечника — 1—2 сут, эпидермоциты — 4—10 сут, гранулоциты — 3—7 сут, эритроциты — 3—4 мес), другие — значительно медленнее (клетки многих паренхиматозных органов).
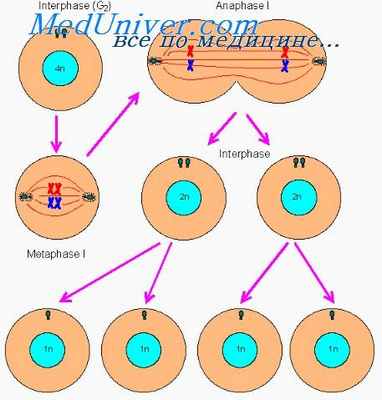
Регенерация сопровождается делением клеток путем митоза, эндомитоза, амитоза и разнообразными клеточными изменениями. Клетки могут перемещаться пассивно или активно: например, перемещение клеток из нижнего в верхние слои эпидермиса и передвижение клеток крови. Изменения могут носить или прогрессивный (созревание клеток молока), или регрессивный (ороговение эппдермоцитов) характер.
К изменениям клеток можно отнести и их обособление от окружающих клеток, которое либо приводит клетку к гибели (слущивание клеток ворсинок кишечника), либо не сопровождается немедленной гибелью (клетки крови).
Процесс физиологической регенерации может быть непрерывным или периодическим. При непрерывной регенерации в одной группе органов происходит смена клеток или структур, погибающих в результате дифференцирования. Погибая, эти клетки выполняют определенную функцию. Так, ороговевшие клетки эпидермиса играют защитную и теплорегулирующую роль, клетки сальных желез служат в качестве жировой смазки и т. п.
В другой группе органов происходит смена отторгающихся клеток, которая может рассматриваться тоже как дифференцирование, поскольку клетки при этом начинают выполнять другую функцию (зрелые клетки периферической крови, половые клетки). В третьей группе органов выявляется смена изнашивающихся клеток или структур. Имеется в виду обновление клеточного состава мсрокриновых желез (поджелудочная, слезные, слюнные и др.) и паренхиматозных органов (печень, почки, легкие и др.).
Периодическая или циклическая регенерация свойственна некоторым органам и структурам, существующим лишь определенный период, после чего наступает их дегенерация (структуры в репродуктивных органах и связанные с ними половые признаки, волосы и др.); циклическая регенерация касается, как правило, обновления целых органных структур.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Российские ученые выяснили, что стволовые клетки способны сами определять свою судьбу
Группа ученых из Московского государственного университета имени М.В. Ломоносова, Института физиологии имени И.П. Павлова и Института биологии гена РАН выяснили, что пласт из стволовых клеток обладает очень неоднородной структурой. Для него характерны произвольно сформировавшиеся плотные образования, в которых клетки дифференцируются в кости и хрящи более эффективно, чем остальные. Подобное явление происходит в процессе формирования соединительных тканей плода в утробе матери. Исследование российских ученых опубликовано в научном издании Biomedicines.
Как известно, регенерация выполняет одну из главных защитных функций любого живого организма. В многоклеточных системах обновлением тканей занимаются разнообразные стволовые клетки, обладающие уникальной способностью дифференциации ― превращения в особые клетки одной или нескольких тканей.
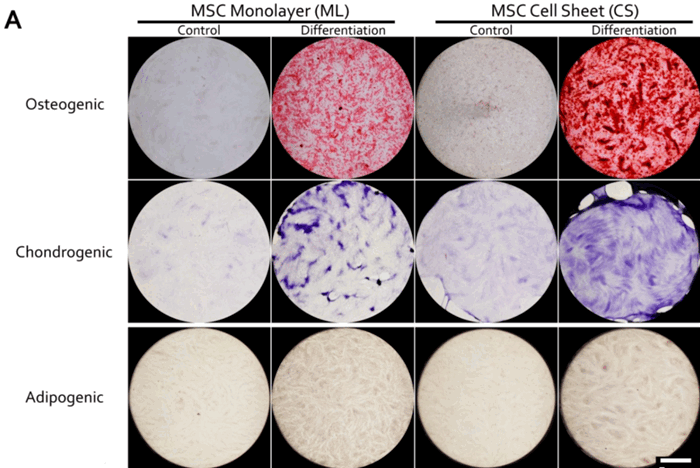
Мультипотентные мезенхимные стромальные клетки (ММСК) занимают главное место в процессе регенерации: они служат источником формирования костей, хрящей и жировых тканей. Эти клетки содержатся практически во всех органах. Благодаря сигнальным молекулам костный мозг отправляет ММСК по кровеносным сосудам в участки организма, которые требуют срочного восстановления тканей. Ученые задались вопросом, как именно клетки самостоятельно формируются в упорядоченную структуру, даже если те находятся в самых неподходящих условиях для жизни.
Павел Макаревич, участник исследования, заведующий лабораторией генно-клеточной терапии, кандидат медицинских наук, доцент факультета фундаментальной медицины МГУ имени М.В. Ломоносова, рассказал, что механизм самоорганизации ММСК определяет построение стромы, соединительнотканного компонента любого органа. Взаимодействие ММСК и стромы способствуют выживанию, делению, дифференцировке и миграции стволовых и специализированных клеток. Таким образом, строма определяет дальнейшую судьбу клеток в поврежденной ткани.
«Как правило, при заживлении формируется соединительнотканный рубец, лишенный функции этого органа. Однако если мы поймем, как ММСК определяют, в какой тип клеток превращаться, то мы сможем приблизиться к расшифровке механизма полной регенерации», — объяснил ученый.
В основу исследования легла клеточная модель первичной соединительной ткани на основе пласта, которую также используют при хирургическом устранении повреждений организма. Эти пласты синтезируют в той же среде, в которой формируются костные, жировые и хрящевые ткани. Ученые следили, как изменяется процесс формирования структур ММСК, чтобы оценить различные варианты дифференциации клеток.
В ходе эксперимента клетки формировали уплотнения, в которых создавались соединительные ткани, которые по строению напоминали костные и хрящевые. Впоследствии оказалось, что в этих уплотнениях резко повышалась активность генов, которые отвечают за формирование преимущественно плотных тканей. Также ученые выяснили, что эти гены подавляют образование белковых структур, которые помогают стромальным клеткам преобразовываться в жировые ткани: похожее явление отмечают во время беременности, когда формируются соединительные ткани плода.
«В какой-то степени это новый взгляд на хорошо изученную конструкцию в виде клеточного пласта из ММСК — все его воспринимают как "пластырь" из клеток, однако даже в этой примитивной конструкции мы обнаружили разделение культуры на группы с разными свойствами. Мы пытаемся взглянуть на задачи регенеративной медицины с позиции биологии развития и ищем параллели между процессами, определяющими формирование ткани в эмбриогенезе, и тем, как ведут себя стволовые клетки взрослого организма. Такой подход очень перспективен для восстановления утраченных тканей; в будущем, возможно, мы сможем залечивать раны без рубцов», — прокомментировал Павел Макаревич.
Читайте также:
- Поликистозная болезнь почек
- Слезотечение
- Цитология (гистология) биопсии наружного уха при воспалении и опухоли
- Портопульмональная гипертензия
- Эпидермальный стафилококк. Staphylococcus epidermidis. Факторы патогенности эпидермального стафилококка. Микробиологическая диагностика эпидермального стафилококкаd.
