Дифференциальная диагностика пурпуры Шенлейн-Геноха
Добавил пользователь Morpheus Обновлено: 27.01.2026
зарегистрируйте свою электронную почту на сайте и получайте дополнительные информационные материалы по аутоиммунной диагностике
где сдать анализ крови на тест анализы спб СПб инвитро Петербург Питер на целиакию аутоиммунные заболевания аутоантитела онкогенетика онкогены онкоген аутоиммунная диагностика Лапин autoimmun антиядерные лабораторная антинуклеарный фактор антинуклеарные антитела HEp-2 тип волчанка свечения амилоидоз склеродермия иммуноблот ревматоидный цитруллиновый расшифровка экстрагируемые скрининг заболевания смешанное системная СКВ артрит дсДНК CCP ССР АЦЦП саркоидоз антинейтрофильные криоглобулины гранулематозные АНФ АНЦА ANCA ENA иммунофиксация васкулиты Крона целиакия аутоиммунный печени язвенный колит глиадину трансглутаминазе стероидпродуцируюшим Вегенера яичника эндокринопатии пузырные пузырчатка пемфигоид рассеянный склероз миастения миелина белок олигоклональный изоэлектрофокусирования IgG IgA IgM легкие цепи полиневрит ганглиозидам полимиозит парапротеин миелома неоптерин островковые GAD антимитохондриальные гладкие скелетные мышцы ASCA колит антигену фосфолипидный синдром кардиолипину фосфолипидам гликопротеину нуклеосомам SSA SSB RNP Sm CENT Scl Jo-1 АМА антикератиновые антиперинуклеарный MCV LKM-1 рецептору иммунофлюоресценция ИФА иммунологическая лаборатория университет санкт-петербург павлова Чардж-Стросса полиангиит микрокристаллические первичный билиарный цирроз трансглутаминаза трансглютаминаза критерии ревматоидного артрита 2010 года СПб Питер Петербург нейрогенетика BRCA NRAS KRAS BRAF HER2 MSI PCA3 тест мутации
Что ищут на нашем сайте:
Кальпротектин фекальный адрес, скрининг ВКЗ, синдром жильбера, ГОМОГЕННЫЙ ТИП ФЛУАРЕСЦЕНЦИИ ЯДРА, целиакия, Иммунные групповые антитела, DFS 70, гудпасчера, Гликированный гемоглобин HbA 1c, миелома и колит, антистрептолизин, Скрининг на аутоиммунные заболева, скрининг крови для исключения миел, единицы измерения аццп, антитела к ацетилхолиновым рецепт, Определение антигена Giardia lamblia в ст, скрининг аутоимунного поражения п, скрининг болезней соед ткани, 01 02 15 651, антител к экстрагируемым ядерным а, иммунология.
Диагностика васкулитов и поражения почек, Антитела к цитоплазме нейтрофилов
Диагностика васкулитов (аортоартериит Такаясу, височный артериит, с-м Кавасаки, узелковый полиартериит, с-м Вегенера, с-м Чарг-Штраусса, микроскопический полиангиит, быстропрогрессирующий гломерулонефрит, пурпура Шонлейн-Геноха, криоглобулинемия)
Васкулиты представляют собой широкий спектр заболеваний имеющих разнообразную природу. Среди них первичные васкулиты имеют аутоиммунную этиологию, а другие процессы являются вторичными по отношению к опухолям, инфекциям и коагулопатиям.
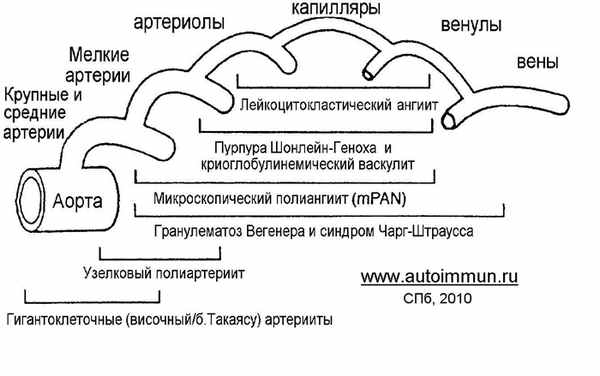
На основании классификации Чаппелл Хилл 1994 г. прервичные васкулиты делят по калибру пораженных сосудов и механизму иммунологического поражения. Васкулиты крупных сосудов (аортоартериит, височный артериит, узелковый периартериит) связаны с поражением эндотелия. Этот процесс сопровождается появлением антител к эндотелию и выбросом цитокинов, приводящих к выраженному острофазовому ответу, в том числе увеличению СОЭ и СРБ. По выраженности острофазовый ответ при системных васкулитах похож на сепсис.
Поражения мельчайших сосудов или капилляриты (с-м Шонлейн-Геноха, криоглобулинемия) возникают под воздействием циркулирующих иммунных комплексов (ЦИК),которые представлены полимерными иммуноглобулинами и недостаточно растворимы. Так, резкое снижение растворимости ЦИК при криоглобулинемии на фоне охлаждения является причиной кожной пурпуры, артралгий, полиневрита и гломерулонефрита. При капилляритах целесообразно исследовать белки комплемента и антитела к ним. Биопсия кожи, при капилляритах позволяет обнаружить специфические отложения иммуноглобулинов в стенках мелких сосудах.
Тест 01.02.15.395 Антитела к эндотелиальным клеткам (HUVEC)
Антигенные мишени антиэндотелиальных антител невозможно очистить или синтезировать, поэтому основным методом выявления данных аутоантител является нРИФ на клетках эндотелия пуповины человека (HUVEC). Исследуется титр антител и у 70% больных с васкулитами крупных и средних сосудов отмечается положительный результат обнаружения антител. Антитела к эндотелию могут иметь перекрестную реакцию с антикардиолипиновыми антителами.
Тест 01.02.15.010 Антинейтрофильные цитоплазматические антитела (АНЦА или ANCA)
Основной тест для выявления антинейтрофильных антител является нРИФ с исследованием титра и типа свечения цитоплазмы клетки. Выделяют два основных типа свечения антител к цитоплазме нейтрофилов (АНЦА или ANCA) – цитоплазматический (характерный для с-ма Вегенера) и перинуклеарный (характерный для других васкулитов и воспалительных заболеваний кишечника). Для описания типов свечения антител к нейтрофилов обычно используются сокращения – цАНЦА и пАНЦА. Кроме того, при выявлении антител к цитоплазме нейтрофилов (АНЦА) могут быть обнаружены антитела против ядер нейтрофилов или редкий тип свечения хАНЦА. При обнаружении положительного результата обнаружения АНЦА необходимо определить антигенную специфичность антител. Целесообразно выявлять АНЦА совместно с АНФ ( тест 01.02.15.035 ), так как последние могут маскировать АНЦА, а также АНФ, АНЦА и РФ в качестве скрининга васкулитов и ревматической патологии ( тест 01.02.15.020 ).
Тест 01.02.15.140 Антитела к протеиназе 3 (ПР3 или PR-3),
Тест 01.02.15.135 Антитела к миелопероксидазе (МПО или MPO),
Тест 01.02.15.415 Антитела к антигенам антинейтрофильных антител (6 антигенов)
В азурофильных гранулах цитоплазмы нейтрофилов находится ряд белков, которые осуществляют микробицидные и бактерицидные функции этих клеток. Антитела к ним играют большое значение в диагностике васкулитов, поражений печени и заболеваний кишечника.
Пурпура Шенлейна—Геноха
О.Г. КРИВОШЕЕВ, доцент кафедры терапии и профессиональных заболеваний ММА им. И.М. Сеченова, кандидат медицинских наук; С.В. ГУЛЯЕВ, ассистент кафедры терапии и профессиональных заболеваний ММА им. И.М. Сеченова, кандидат медицинских наук
Пурпура Шенлейна—Геноха (геморрагический васкулит) — системный васкулит, поражающий микроциркуляторное русло (артериолы, капилляры и посткапиллярные венулы), с типичным отложением в стенке сосудов иммунных комплексов, состоящих из иммуноглобулинов А (IgA). Клинически болезнь проявляется кожной геморрагической сыпью, суставным синдромом, поражением желудочно-кишечного тракта (ЖКТ) и почек.
Пурпура Шенлейна—Геноха развивается в любом возрасте, однако максимальная заболеваемость наблюдается у детей в возрасте 4—6?лет, составляя примерно 13—18 случаев на 100 тыс. С возрастом заболеваемость снижается и развитие болезни после 60 лет считается редкостью.
Этиология заболевания не установлена, однако увеличение частоты развития пурпуры Шенлейна—Геноха в холодное время года, а также нередкая связь дебюта болезни с эпизодами острой респираторной или кишечной инфекции могут косвенно свидетельствовать об инфекционной природе заболевания. В список этиологических агентов, ассоциирующихся с развитием пурпуры Шенлейна—Геноха, входят ?-гемолитический стрептококк группы А, гемофильная палочка, хламидии, микоплазмы, легионеллы, иерсинии, вирусы Эпштейна—Барр, Коксаки, гепатита В и С, аденовирус, цитомегаловирус, парвовирус В19, сальмонеллы, Helicobacter pylori, Clostridium difficile. Имеются единичные наблюдения пурпуры Шенлейна—Геноха, развившейся после проведения вакцинации против брюшного тифа, кори, гриппа. В качестве триггеров заболевания могут выступать алкоголь, лекарства, пищевые продукты, переохлаждение, укусы насекомых.
Патогенез
В настоящее время пурпура Шенлейна—Геноха рассматривается как иммунокомплексное заболевание, связанное с отложением в сосудистой стенке гранулярных IgA-депозитов и активацией комплемента. Эта концепция основывается на результатах многочисленных исследований, показавших нарушение синтеза и/или метаболизма IgA у большинства больных пурпурой Шенлейна—Геноха: повышение уровня сывороточного IgA, IgA-содержащих иммунных, а также IgA-фибронектиновых комплексов. Тем не менее патогенетическое значение этих нарушений требует дальнейшей оценки. В последние годы накапливаются факты, свидетельствующие о противовоспалительных свойствах IgA, что дает основание расценивать увеличение его синтеза как компенсаторный процесс, возникающий вторично в ответ на воспалительную реакцию в слизистых оболочках. Так, было показано, что IgA обладает способностью уменьшать продукцию провоспалительных цитокинов и не способен активировать комплемент; IgA обнаруживается в эндотелии непораженных сосудов и в мезангии неизмененных почечных клубочков; описано наблюдение пурпуры Шенлейна—Геноха при полном селективном дефиците IgA. Учитывая нередкую связь развития пурпуры Шенлейна—Геноха с эпизодами инфекций респираторного тракта и ЖКТ, это предположение представляется вполне вероятным.
Другой причиной изменений в метаболизме IgA при пурпуре Шенлейна—Геноха может быть нарушение О-гликозилирования шарнирной области тяжелых цепей молекулы IgA1, что, как было показано, может приводить к нарушению клиренса IgA1 рецепторами печени и удлинению периода циркуляции IgA-полимеров и IgA-содержащих иммунных комплексов в системном кровотоке. Показано, что молекулы IgA1 с аберрантным гликозилированием приобретают способность активировать комплемент по альтернативному пути и имеют повышенную тропность к мезангиальному матриксу почечных клубочков.
В последние годы получены дополнительные данные, косвенно подтверждающие предположение об инфекционно зависимом характере пурпуры Шенлейна—Геноха. Так, было показано, что у большинства больных в период обострения кожного васкулита наблюдается транзиторная эндотоксемия — циркуляция в системном кровотоке липополисахарида грамотрицательных бактерий. Патогенетическое значение этого феномена при пурпуре Шенлейна—Геноха требует дальнейшего изучения, однако предполагается возможность участия эндотоксина в развитии сосудистого воспаления, опосредованного реакцией Шварцмана. Важную роль в патогенезе эндотоксемии может играть хроническое воспаление кишечной стенки, возможно, обусловленное дисфункцией ее локальной иммунной системы или инфекционным процессом. В пользу этого предположения свидетельствует обнаружение повышенной кишечной проницаемости для макромолекул (овальбумин) у большинства больных пурпурой Шенлейна—Геноха в период обострений кожного васкулита. Кроме этого продемонстрировано наличие у больных пурпурой Шенлейна—Геноха хронического воспалительного процесса в слизистой оболочке тонкой кишки, что, по-видимому, является морфологической основой для нарушения функции кишечного барьера и развития транзиторной эндотоксемии.
Клиническая картина
Клиническая картина пурпуры Шенлейна—Геноха складывается из четырех типичных проявлений: кожной геморрагической сыпи, поражения суставов, ЖКТ и почек. В большинстве случаев болезнь развивается исподволь, постепенно и существенно не нарушает общее состояние больных. Как правило, такой вариант начала болезни наблюдается при изолированном поражении кожи. Количество органных проявлений пурпуры Шенлейна—Геноха варьирует от 1—2 до комбинации всех 4 классических признаков, которые могут развиваться в любой последовательности в течение нескольких дней или недель болезни. В некоторых случаях, кроме упомянутых проявлений, может развиваться поражение других органов, в частности, легких, сердца, центральной нервной системы.
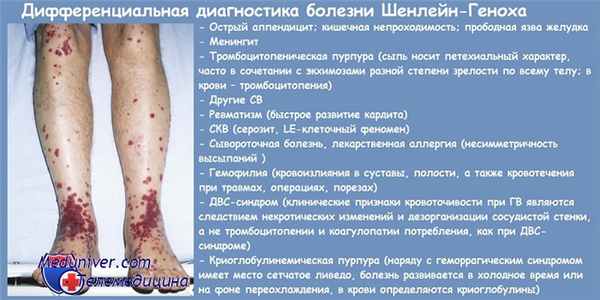
Поражение кожи наблюдается у всех больных пурпурой Шенлейна—Геноха и является обязательным критерием диагностики. В большинстве случаев геморрагическая сыпь является первым клиническим проявлением болезни, к которому в дальнейшем присоединяется поражение других органов и систем. Наиболее типичная локализация кожных высыпаний: нижние конечности — голени и стопы. Нередко кожная сыпь распространяется на бедра, ягодицы, туловище, верхние конечности и исключительно редко на лицо. В процессе эволюции геморрагии постепенно бледнеют, трансформируются в коричневые пигментные пятна и затем исчезают. При длительном рецидивирующем течении кожа в области поражения может пигментироваться вследствие развития гемосидероза. В большинстве случаев геморрагическая сыпь представлена петехиями и пурпурой, однако в ряде случаев могут также наблюдаться эритематозно-макулярные и уртикарные элементы.
Поражение суставов, как правило, развивается параллельно с поражением кожи и протекает по типу мигрирующих полиартралгий, реже — артритов. Излюбленная локализация — коленные и голеностопные суставы, реже поражаются локтевые, лучезапястные и другие суставы. Эти проявления болезни всегда преходящи и доброкачественны, никогда не приводят к развитию стойких изменений в суставах.
Поражение ЖКТ отмечается у 60—80% больных детского возраста и у 40—65% взрослых больных. Наиболее постоянный симптом: боли в животе, усиливающиеся после еды, что нередко создает типичную картину «брюшной жабы». Частым осложнением абдоминального поражения при пурпуре Шенлейна—Геноха является кишечное кровотечение.
Поражение почек при пурпуре Шенлейна—Геноха может приобретать хроническое течение и является главным фактором, определяющим прогноз болезни в целом. Частота вовлечения почек варьирует от 30 до 70% в зависимости от возраста больных. У взрослых поражение почек выявляется почти в 2 раза чаще, чем у детей. Как правило, клинические признаки поражения почек выявляют в первые 3 месяца заболевания, тем не менее при хроническом рецидивирующем течении кожного васкулита возможно отсроченное возникновение признаков гломерулонефрита — спустя несколько месяцев или даже лет после дебюта болезни. Возможными предвестниками вовлечения в процесс почек у детей являются мужской пол, возраст старше 5 лет, абдоминальный синдром, персистирующая кожная пурпура и снижение уровня фактора XIII в плазме крови. У взрослых больных к факторам риска поражения почек относят наличие лихорадки и эпизоды инфекций в дебюте болезни, распространение кожной сыпи на туловище, тяжелый абдоминальный синдром и наличие лабораторных признаков воспалительной активности болезни. Тяжесть почечной патологии, как правило, не коррелирует с выраженностью кожных проявлений болезни, однако как у детей, так и у взрослых отмечена достоверная положительная корреляция между частотой поражения почек и развитием абдоминального синдрома, что требует более тщательного динамического наблюдения за соответствующим контингентом больных. У детей в половине случаев поражение почек имеет благоприятное течение с полным клинико-лабораторным выздоровлением, в то время как у большинства взрослых больных наблюдается тенденция к хроническому персистирующему течению нефрита.
У половины больных пурпурой Шенлейна—Геноха гломерулонефрит проявляется микрогематурией, которая, как правило, сочетается с минимальной или умеренно выраженной протеинурией. У трети больных наблюдается макрогематурия, которая чаще всего развивается в дебюте нефрита, но может возникать и на более поздних этапах почечного поражения во время обострений кожного васкулита или респираторных инфекций. Возможны и более тяжелые варианты почечного поражения, в том числе нефротический синдром, быстропрогрессирующий нефрит и острая почечная недостаточность. У 14—20% больных обнаруживается синдром артериальной гипертензии. Развитие хронической почечной недостаточности (ХПН) в исходе гломерулонефрита отмечается у 12—30% больных.
Диагностика
Диагностика пурпуры Шенлейна—Геноха основывается на выявлении типичных клинических признаков заболевания, в первую очередь двусторонних кожных геморрагических высыпаний в момент осмотра или в анамнезе. Специфических лабораторных тестов при пурпуре Шенлейна—Геноха не существует. Изменения в клиническом анализе крови — повышение скорости оседания эритроцитов (СОЭ) — могут отражать воспалительную активность болезни, а также выраженность осложнений (анемия при кишечном кровотечении). Наличие тромбоцитопении — критерий исключения пурпуры Шенлейна—Геноха. Выраженное повышение СОЭ и значительная диспротеинемия не характерны для пурпуры Шенлейна—Геноха. Активность болезни отражают уровень фактора Виллебранда и тромбомодулина в плазме крови. Обнаружение высокого уровня продуктов деградации фибрина/фибриногена в плазме при активных формах болезни не является признаком развития ДВС-синдрома, а лишь отражает высокую воспалительную активность заболевания. В план обследования всех больных необходимо включать вирусологическое и иммунологическое исследование крови для исключения других заболеваний, протекающих с кожной пурпурой.
Ключевую роль в подтверждении клинического диагноза играет биопсия кожи и/или почек, реже других органов, с обязательным проведением иммуногистохимического исследования, выявляющего фиксацию в сосудистой стенке IgA-содержащих иммунных комплексов. Следует учитывать, что кроме пурпуры Шенлейна—Геноха, IgA-депозиты обнаруживают при поражении кожи в рамках хронических воспалительных заболеваний кишечника (болезнь Крона, язвенный колит), хронических диффузных заболеваний печени алкогольной этиологии, целиакии, герпетиформного дерматита Дюринга.
Морфологическая картина поражения почек при пурпуре Шенлейна—Геноха идентична таковой при болезни Берже (первичной IgA нефропатии). Наиболее частый морфологический вариант поражения почек — мезангиопролиферативный гломерулонефрит, характеризующийся фокальной или диффузной пролиферацией мезангиоцитов. Иммуногистохимическое исследование выявляет гранулярные депозиты IgA, реже IgG, а также С3-компонента комплемента, фибрина. В более тяжелых случаях отмечается формирование эпителиальных «полулуний».
Широко используемые классификационные диагностические критерии пурпуры Шенлейна—Геноха, предложенные в 1990?г. Американской коллегией ревматологов и включающие возраст больного менее 20 лет, пальпируемую пурпуру, абдоминальный синдром и морфологическую картину кожного лейкоцитокластического васкулита (необходимо наличие 2 и более из 4 критериев), имеют малую практическую значимость вследствие их низкой чувствительности и специфичности (87,1 и 87,7%, соответственно).
Дифференциальная диагностика
Дифференциальная диагностика проводится с широким кругом заболеваний, протекающих с поражением сосудов мелкого калибра:
- первичные васкулиты сосудов мелкого калибра (гранулематоз Вегенера, микроскопический полиангиит, синдром Черджа–Стросс, криоглобулинемический васкулит). Дифференциально-диагностическое значение имеют результаты исследования крови на антинейтрофильные цитоплазматические антитела (гранулематоз Вегенера, микроскопический полиангиит, синдром Черджа–Стросс) и криоглобулины (криоглобулинемический васкулит); данные морфологического исследования (гранулематозное воспаление при гранулематозе Вегенера, эозинофильный васкулит при синдроме Черджа—Стросс). Особое значение имеет иммуногистохимическое исследование биоптатов пораженных тканей. Обнаружение IgA-депозитов является характерным признаком пурпуры Шенлейна—Геноха.
- Васкулиты при аутоиммунных заболеваниях (системной красной волчанке, ревматоидном артрите, болезни Шегрена, болезни Крона, язвенном колите). Дифференциация основывается на клинических особенностях, свойственных каждой нозологии, результатах лабораторно-инструментальных методов исследования.
- Васкулиты при инфекциях (подострый инфекционный эндокардит, туберкулез, инфекция вирусами гепатита В и С), злокачественных новообразованиях, лекарственной аллергии.
При поражении кожи могут быть эффективны такие лекарственные средства группы сульфаниламидов: сульфасалазин (внутрь по 500—1000 мг 2 раза в сутки), колхицин (внутрь, 1—2 мг 1 раз в сутки). Глюкокортикоиды эффективны у подавляющего числа больных, особенно в высоких дозах, однако их длительное применение у больных пурпурой Шенлейна—Геноха без вовлечения внутренних органов нежелательно, поскольку выраженность побочных эффектов в такой ситуации может превосходить тяжесть самой болезни. Назначение нестероидных противовоспалительных препаратов (НПВП) оправдано лишь при выраженном суставном синдроме и неэффективности других лекарственных средств. В остальных случаях от назначения НПВП следует воздерживаться вследствие неблагоприятного действия на слизистую оболочку кишечника и усиления кишечной проницаемости.
Поражение желудочно-кишечного тракта с интенсивными абдоминалгиями — абсолютное показание к назначению глюкокортикоидов:
преднизолон внутривенно капельно 300—500 мг/сут в течение 3 дней подряд с последующим переходом на прием внутрь 0,5 мг/кг 1 раз в сутки в течение 2—3 недель, затем быстрое снижение дозы по 5?мг каждые 3 суток до полной отмены.
Желудочно-кишечное кровотечение (в том случае, если оно обусловлено васкулитом, а не иными причинами) не является противопоказанием к назначению глюкокортикоидов внутрь, а, напротив, служит одним из основных показаний к такому лечению. Противопоказанием к назначению глюкокортикоидов внутрь при абдоминальном синдроме может быть только перфорация стенки кишки, которая в настоящее время крайне редко осложняет течение пурпуры Шенлейна—Геноха.
Наибольшие проблемы медикаментозного лечения пурпуры Шенлейна—Геноха связаны с выбором средств лечения хронического гломерулонефрита. Большинство авторов считают оправданным применение сверхвысоких доз глюкокортикоидов, цитостатиков и/или сеансов плазмафереза в случае тяжелого гломерулонефрита (нефротический синдром с нормальной или нарушенной функцией почек; более 50% клубочков с эпителиальными «полулуниями»).
В этом случае используется следующая схема:
- преднизолон внутрь 1 мг/кг 1 раз в сутки в течение 4—6 недель, затем снижение дозы по 2,5 мг/недель до полной отмены или преднизолон внутривенно капельно 15?мг/кг 1 раз в сутки в течение 3 дней подряд (всего 6—20 трехдневных «пульсов» с интервалом в 3—4 недели);
+ - циклофосфамид внутривенно капельно 15 мг/кг 1 раз в 3—4 недели, под контролем уровня лейкоцитов периферической крови и трансаминаз (всего 6—20 «пульсов»);
+ - плазмаферез с объемом эксфузии 30—60?мл/кг, 10—14 сеансов.
В единичных неконтролируемых исследованиях показана эффективность при тяжелых вариантах поражения почек комбинации глюкокортикоидов и азатиоприна, а также комбинации глюкокортикоидов и циклофосфамида с антиагрегантами или антикоагулянтами.
Кроме того, для лечения больных с нефротическим и быстропрогрессирующим гломерулонефритом предлагается использовать внутривенные иммуноглобулины:
иммуноглобулин человеческий нормальный внутривенно по 400—1000 мг/кг в течение 1—5 сут, повторные курсы 1 раз в месяц в течение 6 месяцев.
В отношении менее тяжелых форм гломерулонефрита единства мнений нет. При изолированной микрогематурии, минимальной протеинурии (до 0,5 г/сут) и сохранной функции почек, как правило, активного иммуносупрессивного лечения не требуется. При умеренной протеинурии (0,5—1 г/сут) показано назначение лекарственных средств, влияющих на неиммунные механизмы прогрессирования поражения почек: ингибиторы ангиотензинпревращающего фермента и/или антагонисты рецепторов ангиотензина II (в связи с их способностью уменьшать внутриклубочковую гипертензию и выраженность протеинурии), статины (при нарушении липидного обмена). В некоторых ретроспективных исследованиях показан благоприятный эффект тонзиллэктомии на течение нетяжелых форм гломерулонефрита при пурпуре Шенлейна—Геноха.
урокиназа внутривенно медленно 5000 МЕ/кг 3 раза в неделю в течение 3—12?недель.
По мнению авторов, действие урокиназы может быть основано на уменьшении выраженности внутриклубочковой гиперкоагуляции и растворении депозитов фибриногена/фибрина.
Прогноз
Важным клиническим прогностическим фактором, определяющим частоту развития ХПН, является выраженность протеинурии. Так, если при минимальной протеинурии ХПН развивается у 5% больных, то при нефротическом синдроме этот показатель повышается до 40—50%. Наиболее неблагоприятным в отношении развития ХПН является сочетание нефротического синдрома с артериальной гипертензией и нарушением функции почек в дебюте гломерулонефрита.
Наиболее важным морфологическим критерием для определения прогноза поражения почек считают долю почечных клубочков с «полулуниями» от общего числа клубочков. Так, по данным французских авторов, наблюдавших 151 больного от 1 года до 18 лет, при наличии «полулуний» больше, чем в 50% клубочков терминальная почечная недостаточность развилась у 37% больных, а еще у 18% гломерулонефрит имел хроническое прогрессирующее течение. С другой стороны, у 85% пациентов, достигших терминальной почечной недостаточности, «полулуния» имелись более чем в половине почечных клубочков. У 70% больных с полным выздоровлением или минимальными изменениями в анализах мочи «полулуний» в клубочках не было найдено.
Важно, что у большинства больных с поздним прогрессированием гломерулонефрита отсутствуют клинические признаки активности почечных и внепочечных поражений, что объясняют преимущественным влиянием на течение почечного поражения неиммунных механизмов прогрессирования. В связи с этим у всех больных пурпурой Шенлейна—Геноха с поражением почек крайне важным является тщательный контроль артериального давления и коррекция метаболических нарушений, в частности гиперурикемии и дислипидемии.
ПУРПУРА ШЕНЛЕЙНА-ГЕНОХА

1.1 Что это такое?
Пурпура Шенляйна-Геноха (ПШГ) является заболеванием, при котором воспаление затрагивает очень мелкие кровеносные сосуды (капилляры). Это воспаление в сосудах называется васкулит и обычно поражает мелкие кровеносные сосуды в коже, кишечнике и почках. Воспаление в сосудах приводит к повышенной кровоточивости. В местах кровоизлияний на коже появляется сыпь красного или фиолетового оттенка, под названием пурпура. Возможна также повышенная кровоточивость кишечника или почек, вызывая появление крови в стуле или в моче (гематурия).

1.2 Как часто встречается это заболевание?
ПШГ, хотя и не является распространенным заболеванием у детей, относится к числу наиболее распространенных системных васкулитов у пациентов в возрасте от 5 до 15 лет. Заболевание чаще встречается у мальчиков, чем у девочек (2:1).
На частоту встречаемости заболевания не влияет этническое происхождение или географический регион проживания. Большинство случаев в Европе и Северном полушарии происходят зимой, но некоторые случаи наблюдаются также осенью или весной. ПШГ поражает приблизительно 20 из 100 000 детей в год.

1.3 Каковы причины заболевания?
Никто не знает, что вызывает ПШГ. Считается, что возбудители инфекции (такие как вирусы и бактерии) потенциально могут служить толчком к развитию болезни, потому что она часто появляется после инфекции верхних дыхательных путей. Тем не менее, ПШГ также отмечалась на фоне приема лекарств, укусов насекомых, переохлаждения, химических токсинов и употребления в пищу специфических пищевых аллергенов. ПШГ может быть реакцией на инфекцию (чрезмерно агрессивная реакция иммунной системы вашего ребенка).
Считается, что в основе заболевания лежит патологическая реакция иммунной системы - в тканях, пораженных ПШГ выявляются специфические продукты иммунной системы, такие как иммуноглобулин А (IgA). Это приводит к поражению мелких кровеносных сосудов в коже, суставах, желудочно-кишечном тракте, почках и иногда в центральной нервной системе или яичках.

1.4 Является ли это заболевание наследственным? Является ли это заболевание заразным? Можно ли предотвратить данное заболевание?
ПШГ не является наследственным заболеванием. Оно не является инфекционным заболеванием и не может быть предотвращено.

1.5 Каковы основные симптомы?
Ведущим симптомом является характерная кожная сыпь, которая присутствует у всех пациентов с ПШГ. Сыпь обычно начинается с мелкой крапивницы; красные возвышающиеся пятна, на месте которых со временем появляются фиолетовые кровоизлияния. Это называется «пальпируемая пурпура», поскольку возвышающуюся на пораженных участках кожи сыпь можно прощупать. Пурпура, как правило, появляется на нижних конечностях и ягодицах, хотя в некоторых случаях поражения могут также появиться в других частях тела (верхние конечности, туловище и т.д.).
Боль в суставах (артралгия) или боль и опухание суставов с ограничением движения (артрит), как правило, затрагивает коленные и голеностопные суставы, реже – лучезапястные суставы, локтевые суставы и суставы пальцев рук. Такие явления встречаются у большинства пациентов (> 65%). Боль в суставах и/или артрит сопровождается легкой отечностью тканей и болезненностью мягких тканей, расположенных рядом с суставом и вокруг него. На ранних стадиях заболевания, особенно у маленьких детей, может возникнуть отек мягких тканей рук и ног, лба и мошонки.
Симптомы, связанные с суставами, носят временный характер и исчезают в течение от нескольких дней до нескольких недель.
Воспаление сосудов в более чем 60% случаев сопровождается болями в животе. Эти боли, как правило, носят прерывистый характер, локализуются вокруг пупка и могут сопровождаться легкими или тяжелыми желудочно-кишечными кровотечениями (геморрагией). В очень редких случаях может произойти заворот петель кишечника. Это явление носит название кишечной непроходимости и вызывает закупорку кишечника, для устранения которой может потребоваться хирургическое вмешательство.
В случае воспаления сосудов почек они могут кровоточить (приблизительно у 20-35% больных). Кроме того, могут развиться гематурия (кровь в моче) и протеинурия (белок в моче) от легкой до тяжелой степени. Проблемы с почками, как правило, не носят серьезного характера. В редких случаях заболевание почек может длиться в течение нескольких месяцев или лет и прогрессировать, приводя к почечной недостаточности (1-5%). В таких случаях требуется консультация специалиста по заболеваниям почек (нефролога) в сотрудничестве с лечащим врачом пациента.
Симптомы, описанные выше, могут иногда на несколько дней предшествовать появлению кожной сыпи. Они могут появляться одновременно или постепенно, в различном порядке.
Другие симптомы, такие как судороги, кровоизлияния в мозг или легкие и отек яичек, обусловленные воспалением сосудов в этих органах, встречаются редко.

1.6 Одинаково ли проявляется заболевание у всех детей?
Болезнь более или менее одинакова у всех детей, но степень поражения кожи и органов может значительно отличаться от пациента к пациенту.

1.7 Отличается ли болезнь у детей от болезни у взрослых?
Болезнь у детей не отличается от заболевания у взрослых, но она редко поражает молодых пациентов.
2. ДИАГНОСТИКА И ЛЕЧЕНИЕ
2.1 Как диагностируется данное заболевание?
Диагностика ПШГ основывается, главным образом, на клинической картине: наличие классической пурпурной сыпи, которая, как правило, ограничивается нижними конечностями и ягодицами, и преимущественно сопровождается, по меньшей мере, одним из следующих проявлений: боль в животе, поражение суставов (артрит или артралгия) и почек (наиболее часто – гематурия). При диагностике необходимо исключить другие заболевания, которые могут вызвать сходную клиническую картину. Биопсия кожи, которая позволяет определить наличие иммуноглобулина А путем гистологических исследований, для диагностики требуется редко.

2.2 Какие лабораторные и другие исследования полезны?
Специфических анализов, которые способствовали бы диагностике ПШГ, не существует. Скорость оседания эритроцитов (СОЭ) или уровень С-реактивного белка (СРБ, показатель системного воспаления) могут быть в норме или повышенными. Скрытая кровь в кале может быть признаком небольшого кишечного кровотечения. Анализ мочи следует проводить в течение заболевания с целью проверки на предмет поражения почек. Гематурия низкой степени является распространенным признаком заболевания. Со временем она проходит. Биопсия почек может потребоваться, если поражение почек является серьезным (почечная недостаточность или значительная протеинурия). Визуализационные методы исследований, такие как УЗИ, обычно рекомендуют, чтобы исключить другие причины боли в животе и для проверки возможных осложнений, таких как непроходимость кишечника.

2.3 Можно ли лечить данное заболевание?
Большинство больных ПШГ хорошо переносят заболевание и не нуждаются вообще ни в каких лекарствах. При наличии симптомов ребенку необходим постельный режим. В случае необходимости лечения, оно носит, в основном, поддерживающий характер. Боль обычно купируют либо с помощью простых анальгетиков (болеутоляющих), таких как парацетамол, либо (в случае более выраженных жалоб на боли в суставах) при помощи нестероидных противовоспалительных препаратов, таких как ибупрофен и напроксен.
Применение кортикостероидов (через рот или, иногда, внутривенно) показано пациентам с тяжелыми желудочно-кишечными симптомами или кровотечениями и только в редких случаях, когда симптомы носят тяжелый характер и связаны с поражением других органов (например, яичек). Если заболевание почек является серьезным, необходима биопсия почки, а в случае наличия показаний назначается комбинированное лечение кортикостероидами и иммунодепрессантами.

2.4 Каковы побочные эффекты лекарственной терапии?
В большинстве случаев при ПШГ медикаментозное лечение не является необходимым или применяется лишь в течение короткого времени; таким образом, никаких серьезных побочных эффектов не ожидается. В редких случаях, когда ввиду тяжелого поражения почек требуется применение преднизона и иммуносупрессивных препаратов в течение длительного времени, возможны побочные эффекты, которые могут вызывать проблемы.

2.5 Как долго будет продолжаться болезнь?
Острая фаза болезни длиться около 4-6 недель. У половины больных ПШГ детей случается, по крайней мере, один рецидив в течение 6-недельного периода, который обычно бывает короче и проходит в более легкой форме, чем первый эпизод. Рецидивы редко длятся дольше. Наличие рецидива не свидетельствует о тяжести заболевания. Большинство пациентов выздоравливает полностью.
3. ПОВСЕДНЕВНАЯ ЖИЗНЬ
3.1 Как болезнь может повлиять на ребенка и повседневную жизнь семьи и какие периодические медицинские осмотры необходимы?
У большинства детей болезнь проходит сама собой и не вызывает долгосрочных проблем. У небольшого процента пациентов, у которых наблюдается стойкое или тяжелое поражение почек, возможно прогрессирующее течение с развитием почечной недостаточности. В целом, ребенок и семья могут вести нормальную жизнь.
Анализ мочи следует выполнять несколько раз в течение заболевания и через 6 месяцев после того, разрешения ПШГ: это необходимо для выявления потенциальных проблем с почками, поскольку в некоторых случаях поражение почек может проявиться через несколько недель или даже месяцев после начала заболевания.

3.2 Как насчет школы?
Во время острой фазы болезни всяческая физическая активность обычно ограничивается и может потребоваться постельный режим. После выздоровления дети могут снова посещать школу и вести нормальную жизнь, участвуя во всех тех же мероприятиях, что и их здоровые сверстники. Школа для детей не менее важна, чем работа для взрослых: это место, где они учатся, как стать самостоятельными и продуктивными членами общества.

3.3 Как насчет спорта?
Ребенок может заниматься всеми видами деятельности, которые ему под силу. Таким образом, общая рекомендация состоит в том, чтобы позволять пациентам участвовать в занятиях спортом, которые следует временно прекращать при появлении болей в суставах, а учителя физкультуры обязаны предотвращать спортивные травмы, в частности среди подростков. Хотя механическое напряжение плохо сказывается на воспаленных суставах, необходимо понимать, что небольшое повреждение, которое может получить ребенок, – это гораздо меньшее зло, чем психологический ущерб, связанный с невозможностью заниматься спортом с друзьями из-за болезни.

3.4 Как насчет диеты?
Никаких доказательств того, что диета может влиять на болезнь, не существует. В целом, ребенок должен соблюдать сбалансированную, нормальную для своего возраста диету. Растущему ребенку рекомендуется здоровая, хорошо сбалансированная диета с достаточным содержанием белков, кальция и витаминов. Пациентам, принимающим кортикостероиды, необходимо избегать переедания, поскольку эти препараты могут повышать аппетит.

3.5 Может ли климат влиять на течение болезни?
Доказательств того, что климат может повлиять на проявления болезни, отсутствуют.

3.6 Можно ли ребенку делать прививки?
Прививки следует перенести на более поздний срок. Решение о том, когда делать пропущенные прививки, должен принять педиатр. В целом, прививки не повышают активность заболевания и не вызывают серьезных неблагоприятных реакций у больных детей. Однако вакцинаций с использованием живых ослабленных вакцин, как правило, следует избегать. Это связано с гипотетическим риском индукции инфекции у больных, получающих высокие дозы иммуносупрессивных или биологических препаратов.

3.7 Как насчет половой жизни, беременности, контрацепции?
Болезнь не налагает никаких ограничений в отношении нормальной половой активности или беременности. Однако пациенты, принимающие лекарства, всегда должны быть очень осторожны в отношении возможных последствий этих препаратов для плода. По вопросам контрацепции и беременности пациентам рекомендуется проконсультироваться с врачом.
Дифференциальная диагностика пурпуры Шенлейн-Геноха
Дифференциальная диагностика пурпуры Шенлейн-Геноха
Дифференциальная диагностика сосудистых пурпур подразумевает в первую очередь отделение типичной иммунологической формы болезни Шенлейна-Геноха от других первичных или вторичных иммунных васкулитов, а также и от различных форм неиммунных капилляропатий; все они составляют разные клинические формы сосудистых пурпур. Для клинициста важно однако, на первом этапе, отделить сосудистые пурпуры от тромботической пурпуры с специфическими гематологическими характеристиками, как мы указывали в предыдущих главах.
Среди классических иммуноаллергических сосудистых пурпур отмечается purpura fulminans, как острая форма или даже сверхострая форма аллерго-анафилаксической пурпуры. В настоящее время она выступает как синдром, в котором различается несколько патогенетических типов. Некоторые могут быть суровыми острыми формами пурпуры Шенлейна-Геноха, в особенности у ребенка, при которых, наряду с кожными геморрагиями некротического характера, ассоциируется и абдоминальный, церебральный и почечный синдром по поводу диссеминированных микротромбозов вследствие массивной преципитации иммунных комплексов.
При других проявляется механизм Санарелли — Шварцманна, принимающий характер синдрома Ватергаузена-Фридериксона (Waterhousen-Friederickson), который встречается при менингококковых инфекциях, а также и при септицемических состояниях, вызванных пневмококком или стрептококком. Известно, что этот синдром является формой ДВС, со специальной микробной этиологией, при которой кровотечения происходят во время коагулопатии потребления, провоцированной тромбопластиновым разгружением благодаря септическому эндотелииту.
Важно, чтобы при всех суровых формах, имеющих характер purpura fulminans, уточнялась септическая микробная этиология, а путем лабораторных анализов, определялся синдром ДВС, требующий срочного правильно организованного лечения антикоагулирующими медикаментами.
Более обширную группу иммунологических пурпур составляют пурпуры, появляющиеся при известных автоиммунынх заболеваниях, предшествуя другим системным проявлениям этих заболеваний или фигурируя в их клинико-биологической картине. Таковыми являются сосудистые пурпуры при красной волчанке, узелковом периартериите, синдроме Сжегрена, синдроме Бехчета. Во время острого приступа полиартикулярного ревматизма могут появляться симптомы пурпуры, подобные тем, которые встречаются при болезни Шенлейна-Геноха.
Сосудистые пурпуры по поводу сенсибилизации к медикаментам отличаются от тромбоцитопенических и во всем походят на постмикробную пурпуру Шенлейн-Геноха, при которой анамнез и иногда кожные тесты выявляют сенсибилизирующий медикамент (Popescu). Тест бластической трансформации лимфоцитов больного, инкубированных in vitro с соответствующими дилюциями медикамента, по-видимсму не оправдал себя как специфический тест. Однако могут оказаться полезными другие иммунные тесты, которые выявляют клеточную сенсибилизацию и наличие антител антимедикамент в сыворотке, такие как реакции фиксирования комплемента, реакции пассивной гемагглютинации Бойдена, используемые и в нашей стране, особенно в дерматологии (Iosif).
Кроме этого, тест дегрануляции базофилов по способу окна в коже Ребука (Rebuck), который при условии тщательного выполнения может выявлять медикамент или другие сенсибилизирующие химические вещества (Popescu).
Узловидные высыпания, как узелковая эритема или полиморфная эритема могут ассоциироваться и с сосудистыми пурпурами, обычно локализированными, детерминированными множеством этиологических сенсибилизирующих факторов, медикаментами, микробными инфекциями, вирусными инфекциями. Во время инфекционных состояний, вызванных стрептококком, стафилококком, пневмококком, различными типами энтерококка, тифознопаратифозными бациллами, а также и при вялотекущем эндокардите или при злокачественном язвенно-вегетирующем остром эндокардите также появляются сосудистые пурпуры благодаря прямому действию токсинов или благодаря микробным эмболиям.
Они происходят в период бактериемии, отвечают на специфическое антиинфекционное лечение, отличаясь от постинфекционной аллергической пурпуры.
При вторичном синдроме во время вялотекущих гипергаммаглобулинемических эндокардитов появляются однако хронические или рецидивирующие иммуноаллергические сосудистые пурпуры.
Более редкими формами аллергических сосудистых пурпур являются пурпуры по поводу автосенсибилизации к собственным эритроцитам или к ДНК. Первую описали впервые Gartner и Diamond как высыпание появляющегося на психоневротической почве у женщин (Ratnoff и Agle, 1968). Она появляется при повторных эпизодах, с петехиями в определенных зонах, обычно после психических напряжений или небольших травм. Может сопровождаться дигестивными кровотечениями, гематуриями, метроррагиями и иногда общими тревожными симптомами с абдоминальными коликами или грудными болями, сильной головной болью, рвотами, поносом и даже припадками коллапса.
Лабораторные исследования не обнаруживают ничего особенного но интрадермореакции с собственными эритроцитами дают явно положительные местные реакции и с общими явлениями. У некоторых пациенток получаются положительные на гемоглобин или на фосфолипидные дериваты, экстрагированные из эритроцитарных оболочек (Groch и сотр.).
Большинство авторов считает эти пурпуры психогенными, появляющимися на депрессивном, истериоидном, мазохическом фоне (Gottlieb), и которые нуждаются в лечении, причем некоторые формы излечиваются гипнозом (Agle и сотр.). Являясь обычно доброкачественными и мимолетными, они не нуждаются в васкулотропном или дессенсибилизирующем лечении, но в лечении психического состояния.
Пурпуры по поводу сенсибилизации к ДНК приближаются или сочетаются с пурпурами по поводу сенсибилизации к эритроцитам (Spiera и Schwartz), но встречаются очень редко: известно лишь несколько случаев. Вообще они появляются на месте травмы и начинаются с узелковых, болезненных инфильтраций, которые становятся за сутки буллезными и подтечными, распространяясь на ограниченную зону. Интрадермореакции с лизатами лейкоцитов или с 0,5 мг ДНК из тимуса теленка дают положительные реакции, однако обычно только по-близости затронутой зоны. Гистологически констатитуется васкулит по поводу воспалительной инфильтрации и отложения PAS-позитивного материала, а также и круглые образования с характером гематоксиновых Feulgen-позитивных тел (Schwartz и сотр.).
Говоря о лечении, следует подчеркнуть, что антигистаминовые препараты и кортизон не оказывают никакого влияния, но зато хлорохин дает быстро хорошие результаты. Этот тип пурпур не эволюирует к красной волчанке. и тесты в этом направлении отрицательные, хотя считается, что эти пурпуры появляются по поводу сенсибилизации к ДНК, возникая по поводу клеточных поражений после солнечного облучения (Schwartz и сотр.).
Другие формы пурпуровых ангиопатий — более сложной, обычно неаллергической природы и смешиваются с рассмотренными выше. Некоторые составляют точно определенные сущности, но в основном встречаются редко.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Дифференциальная диагностика пурпуры Шенлейн-Геноха
AКР — Американская коллегия ревматологов
АГ — артериальная гипертония
АД — артериальное давление
АНЦА — антинейтрофильные цитоплазматические антитела
ИКАВ — индекс клинической активности васкулита
МКБ-10 — Международная классификация болезней десятого пересмотра
РА — ревматоидный артрит
СВ — системные васкулиты
СКВ — системная красная волчанка
СОЭ — скорость оседания эритроцитов
СРБ — С-реактивный белок
ФВ — фактор Виллебранда
ЦНС — центральная нервная система
Васкулит — поражение стенки сосуда любого калибра по типу очагового или сегментарного воспаления и некроза сосудистой стенки с последующим развитием окклюзивных изменений и ишемических расстройств в органах и тканях, которые кровоснабжаются соответствующими сосудами.
Системные васкулиты (СВ) характеризуются воспалительными и некротическими изменениями сосудистой стенки с вовлечением в патологический процесс сосудов разных регионов и любого калибра — от аорты до капилляров. СВ относятся к иммуновоспалительным ревматическим заболеваниям, которые характеризуются высокой распространенностью, трудностью ранней диагностики, быстрым развитием инвалидности и неблагоприятным прогнозом для жизни [1].
Дифференциальная диагностика также является довольно сложной, так как клиническая симптоматика СВ нередко характеризуется наличием «перекрещивающихся синдромов» [2—6].
По Международной классификации болезней десятого пересмотра — МКБ-10 (Женева, 1995) СВ включены в XIII класс «Системные поражения соединительной ткани» (М30—М31). Некоторые формы классифицируются в других рубриках: пурпура Шенлейна—Геноха (D69.0), болезнь Бехчета (М35.2), эссенциальная криоглобулинемия (D89.1), облитерирующий тромбангиит (болезнь Бюргера. I73.1).
Предполагается существование нескольких патогенетических эффекторных механизмов повреждения сосудистого русла, лежащих в основе СВ: поражение сосудов, связанное с иммунными комплексами с органоспецифическими антителами (АТ), АТ против лизосомальных ферментов гранулоцитов, нарушением клеточного иммунитета и образованием гранулем.
Не касаясь вопросов классификации васкулитов, можно отметить, что основное деление происходит по калибру пораженных сосудов и наличию гранулематозного воспаления.
В последние годы выявлено более раннее развитие атеросклероза у больных с аутоиммунными процессами [7—10], что подтвердили и полученные нами данные [11]. К тому же современная медикаментозная терапия васкулитов предполагает использование генно-инженерных биологических препаратов, особенно при васкулитах, ассоциированных с антинейтрофильными цитоплазматическими антителами (АНЦА), что также обусловливает необходимость четкой диагностики [12—16].
Материалы и методы
В настоящей работе представлены результаты разработки этапов диагностического поиска при СВ.
Под наблюдением находилось 360 больных, при обследовании которых использованы классификационные критерии Американской коллегии ревматологов (AКР) [17] и собственные критерии [18], определены показатели иммунного статуса с исследованием гуморального и клеточного иммунитета, системы гемостаза, проведено сканирование сосудов, применены гистологические и иммуноморфологические методы.
Результаты
Алгоритм постановки диагноза включает ряд этапов.
I этап — выявление клинических признаков васкулита. Поражение сосудов проявляется кожным синдромом, вовлечением слизистых оболочек, синдромом трофических расстройств, ишемическим синдромом, артериальной гипертонией (АГ), вовлечением вен и органными изменениями. Кожный синдром включает наличие «сосудистой бабочки», капилляритов, дигитальных язв и некрозов, периферической гангрены, узелков по ходу сосудов, панникулита, телеангиоэктазий, геморрагических высыпаний, ливедо, пальпируемой пурпуры. Поражение слизистых оболочек характеризуется энантемой, геморрагическими высыпаниями и язвенно-некротическими проявлениями. Синдром трофических расстройств определяется локальными трофическими изменениями кожи и трофическими язвами. При ишемическом синдроме отмечаются синдром перемежающейся хромоты верхних и нижних конечностей, а также висцеральные эквиваленты синдрома Рейно, ишемическая полинейропатия, ишемические поражения центральной нервной системы (ЦНС), регионарные ишемические расстройства, асимметрия пульсации артерий. Вовлечение вен характеризуется наличием флебитов и тромбозов.
Органные поражения при СВ касаются практически всех органов и систем ввиду широкой распространенности процесса. Изменения сердца проявляются коронарным синдромом, миокардитом, миокардиодистрофией, вовлечением эндокарда и перикарда. Патология легких включает «сосудистую пневмонию», «летучие» инфильтраты в легких, инфарктную пневмонию, бронхоспастический синдром и плеврит. Вовлечение почек характеризуется наличием изолированного мочевого синдрома, гломерулонефрита, нефропатии, АГ и инфарктов почки. Патология пищеварительного тракта обусловлена язвами желудочно-кишечного тракта, тромбозом брыжеечных артерий, ишемическим абдоминальным синдромом. Поражения нервной системы проявляются асимметричной полинейропатией (полиневритом), несимметричными множественными мононевритами и патологией ЦНС в виде психозов, нарушений мозгового кровообращения, зрительных расстройств. При некоторых нозологических формах возможны вовлечение глаз, поражения верхних дыхательных путей и придаточных пазух полости носа.
II этап включает выявление клинических и лабораторных признаков системности процесса. Следует обращать внимание на наличие таких общепатологических симптомов, как лихорадка, потеря массы тела, артралгии, миалгии, увеличение скорости оседания эритроцитов (СОЭ), анемия, вовлечение ряда органов и систем.
III этап предполагает разграничение первичного и вторичного характера васкулитных синдромов. Вторичные васкулиты сопровождают онкологические, инфекционные, гематологические заболевания, туберкулез, сепсис, аллергические, паразитарные и профессиональные болезни. Вторичные васкулиты типичны и для заболеваний ревматического профиля: системной красной волчанки (СКВ), ревматоидного артрита (РА), болезни Шегрена и системной склеродермии.
IV этап — клинико-инструментальное исследование сосудов. Следует получить клинические и инструментальные доказательства поражения сосудов, учитывая данные анамнеза, клинического обследования, ангиографии, ангиосканирования, допплерографии, биомикроскопии и капилляроскопии. Поражения крупных артерий характеризуются ослаблением пульсации, наличием сосудистых шумов, аневризм, формированием коллатералей, асимметрией пульса и артериального давления (АД), данными ультразвуковых методов исследования. Вовлечение средних артерий включает ослабление или исчезновение пульсации, наличие тромбозов, аневризм, результаты ангиосканирования. Патология мелких артерий определяется синдромом капилляротрофической недостаточности и изменениями микроциркуляторного русла при биомикроскопии. Наличие флебитов и тромбозов служит доказательством вовлечения в патологический процесс вен.
Так, преимущественное поражение крупных и средних артерий характерно для артериита Такаясу (сохранена терминология МКБ-10) и гигантоклеточного артериита; средних и мелких артерий — для облитерирующего тромбангиита, болезни Кавасаки и некротизирующих васкулитов типа узелкового полиартериита, мелких артерий — для геморрагического васкулита, эссенциального криоглобулинемического васкулита, эозинофильного ангиита, гранулематоза Вегенера, синдрома Черджа—Строс, микроскопического полиангиита, кожного лейкоцитокластического васкулита.
V этап — определение специфических маркеров поражения сосудистой стенки и проведение лабораторной диагностики васкулита. Лабораторное обследование больных СВ включает выявление иммунных комплексов, аутоАТ, клеточных иммунных реакций, показателей повреждения эндотелия и предполагает определение антиэндотелиальных АТ (АТ класса IgG к эндотелиальной клетке), АТ к сосудистому эндотелиальному клеточно-специфическому антигену, АТ к эластину, АТ к фосфолипидам, АНЦА, маркеров повреждения эндотелия типа фактора Виллебранда (ФВ), тромбомодулина и ангиотензинпревращающего фермента. Безусловно, выявление всех перечисленных факторов практически недоступно, но определение АТ к фосфолипидам, АНЦА и ФВ следует считать обязательным. По уровню СОЭ и С-реактивного белка (СРБ) уточняют активность иммуновоспалительного процесса.
VI этап — морфологическое исследование биопсийного материала как диагностический критерий с применением гистохимических и иммуноморфологических методов. Определяют тип васкулита и состав воспалительного клеточного инфильтрата. Описано несколько основных гистологических типов васкулита: некротизирующий или гранулематозный с различным количеством гигантских клеток, со смешанным клеточным составом, преобладанием нейтрофилов, наличием эозинофилов, лейкоцитокластический, лимфоцитарный, лимфоплазмоцитарный васкулит, склерозирующий фиброз со скудным инфильтратом. Уточняют наличие особых признаков в виде одновременного наличия острых и затухающих сосудистых поражений, нормальных и пораженных сосудов, аневризм, микроаневризм, внесосудистых некротизирующих гранулем.
VII этап — выделение основных патогенетических звеньев сосудистого повреждения: васкулиты, ассоциирующиеся с иммунными комплексами (геморрагический васкулит, васкулит при РА и СКВ, болезнь Бехчета, криоглобулинемический васкулит); органоспецифическими АТ (синдром Гудпасчера — АТ к базальной мембране клубочков почек, болезнь Кавасаки — АТ к эндотелию); васкулиты, ассоциирующиеся с АНЦА (гранулематоз Вегенера, микроскопический полиартериит, узелковый полиартериит, гранулематоз Вегенера); клеточно-опосредованные васкулиты с образованием гранулем (височный артериит, болезнь Такаясу).
VIII этап — определение возможной этиологии васкулита. Хотя этиология большинства первичных васкулитов неизвестна, не исключается роль вирусов (цитомегаловируса, вируса гепатитов В и С, ВИЧ, парвовируса, вируса Эпштейна—Барр) и ряда бактерий, чаще грамположительных. По возможности предпринимаются попытки определения АТ к перечисленным вирусам и характеристики микробного спектра содержимого носоглотки, мокроты. Предполагается выявление иммуногенетических маркеров васкулита.
IX этап — использование классификационных критериев АКР для уточнения формы васкулита [17].
Узелковый полиартериит — снижение массы тела более чем на 4 кг, livedo reticularis, боль и чувствительность в яичках, миалгии, слабость или гиперчувствительность ног, моно- или полинейропатия, диастолическое АД более 90 мм рт.ст., повышение уровня мочевины или креатинина в крови, наличие вируса гепатита В, артериографические изменения и данные биопсии, свидетельствующие о наличии некротизирующего васкулита.
Синдром Черджа—Строс — бронхиальная астма, эозинофилия, аллергия в анамнезе, моно- или полинейропатия, непостоянные инфильтраты в легких, изменения в околоносовых пазухах.
Гранулематоз Вегенера — воспаление пазух полости носа или рта, изменения при рентгенологическом исследовании грудной клетки, осадок мочи, гранулематозное изменение при биопсии.
Пурпура Шенлейна—Геноха — пальпируемая пурпура, возраст пациента в начале болезни моложе 20 лет, приступы болей в животе, гранулоциты в стенке сосуда при биопсии.
Васкулит гиперчувствительности — возраст пациента старше 16 лет, употребление лекарств в начале болезни, пальпируемая пурпура, макулопапулезная сыпь, данные биопсии. В нашей стране эти две формы практически не различаются и объединяются термином «геморрагический васкулит».
Артериит Такаясу (в нашей стране чаще используется термин «неспецифический аортоартериит») — возраст пациента в начале болезни моложе 40 лет, перемежающаяся хромота, снижение пульса на плечевой артерии, разница АД на плечевых артериях более 10 мм рт.ст., шум на подключичных артериях и аорте, изменения на артериограмме.
Гигантоклеточный (височный) артериит — поражение височной артерии, возраст пациента в начале болезни старше 50 лет, повышение СОЭ, изменения при биопсии.
Для подтверждения облитерирующего тромбангиита предлагают использовать следующие критерии: мужской пол, возраст дебюта моложе 45 лет, курение, снижение пульсации на тыльной артерии стопы, перемежающаяся хромота нижних конечностей, трофические язвы, тромбофлебиты, при биопсии — деструктивно-продуктивный или продуктивный тромбоваскулит, при ангиосканировании — сужение или окклюзия дистальных артерий конечностей.
X этап — постановка нозологического диагноза с указанием активности процесса, а также течения, распространенности поражения, органной патологии и функциональной недостаточности пораженного органа. Предложен индекс клинической активности васкулита (ИКАВ), причем учитываются признаки, обусловленные только им. В соответствии с клиническим значением каждому признаку присвоен определенный балл [19]. Шкала активности васкулита и детальная ее расшифровка представлены в монографии Е.Л. Насонова и соавт. «Васкулиты и васкулопатии» [20]. Среди значительного количества тестов наиболее целесообразными являются определение СОЭ, СРБ, ФВ, АНЦА, криоглобулинов и неоптерина. По шкалам, разработанным английскими исследователями из группы по изучению васкулитов [21], проводится оценка степени повреждения органов или систем при васкулитах с вычислением индекса повреждения. P. Bacon и соавт. [22] предложили проводить общую оценку состояния больных, так называемый логарифм общей интегральной оценки васкулита (Vasculitis Integrated Total Assessment Log), который включает ИКАВ, индекс повреждения, а также индекс функциональной активности пациента. Последний представляет собой опросник из 36 пунктов, позволяющий оценить качество жизни больного васкулитом.
Представленные этапы диагностики СВ помогут в установлении нозологической формы, определении активности процесса и назначении патогенетической терапии.
Диагностика СВ до настоящего времени вызывает трудности, тем более, что при постановке диагноза используются классификационные критерии СВ, которые были разработаны AКР в основном для эпидемиологических исследований.
Определение таких лабораторных маркеров как СРБ, АНЦА, криоглобулины [23—26], следует использовать, как было указано выше, для уточнения активности иммунного воспаления. Для исключения других системных ревматических заболеваний в плане дифференциального диагноза рекомендуется определять антинуклеарный фактор, ревматоидный фактор, антифосфолипидные АТ, АТ к нативной ДНК.
Раннее развитие атеросклероза у больных этой категории приводит к изменению клинической симптоматики, увеличению риска развития прежде всего сердечно-сосудистых заболеваний [7, 27, 28]. Использование новых лекарственных схем с применением генно-инженерных биологических препаратов [29—31] и антигенных наносистем [32] увеличивает продолжительность жизни больных СВ и обусловливает необходимость длительного диспансерного наблюдения этого контингента больных.
Безусловно, для выработки отечественных диагностических критериев и апробации логарифма общей интегральной оценки васкулита необходимо проведение многоцентровых клинических исследований.
Читайте также:
