Дооперационная диагностика рака желудка. Мультицентрический рак желудка
Добавил пользователь Владимир З. Обновлено: 24.01.2026
ГБУЗ Ярославской области «Клиническая онкологическая больница», отделение диагностической и терапевтической эндоскопии
ФГБУ "Поликлиника №1" Управления делами Президента РФ
ГБУЗ Ярославской области «Клиническая онкологическая больница»
кафедра эндоскопии Медицинского университета г. Канадзава, Япония
Особенности эндоскопической диагностики и тактики лечения при раннем раке желудка недифференцированного морфологического строения
Журнал: Доказательная гастроэнтерология. 2015;4(1): 25‑30
Рак желудка является актуальной проблемой как в мире, так и в Российской Федерации. Прогноз заболевания зависит от стадии процесса и наиболее благоприятен при выявлении заболевания на ранних стадиях. Эндоскопическому удалению подлежит ранний рак, при котором риск лимфатического метастазирования незначителен. Однако вопрос о возможности эффективного лечения раннего недифференцированного рака желудка долгое время оставался предметом клинических исследований и дискуссий, поскольку данная форма рака имеет более высокий риск метастазирования и худший прогноз. Нами представлен случай пациентки 58 лет с диагнозом раннего рака тела желудка (низкодифференцированный рак), Т1N0M0, стадия Iа, клиническая группа II. Отличительными особенностями этого случая является плоское распространение опухоли и отсутствие четких границ, что требует тщательного эндоскопического осмотра и выполнения биопсии не только самого образования, но и окружающей слизистой оболочки кнаружи от видимого края патологического участка. Это необходимо для точного определения размеров опухоли и выбора дальнейшей лечебной тактики.
Прогноз зависит от стадии заболевания: общая 5-летняя выживаемость больных раком желудка составляет 25—30%, однако этот показатель больных ранним раком желудка после оперативного лечения достигает 95%. Эндоскопическому удалению подлежит ранний рак, при котором риск лимфатического метастазирования незначителен. Согласно японским рекомендациям, расширенными показаниями для эндоскопической подслизистой диссекции являются [3]:
— внутрислизистый дифференцированный рак любого размера без изъязвления;
— внутрислизистый дифференцированный рак менее 30 мм в диаметре при наличии изъязвления;
— дифференцированный рак с минимальной подслизистой инвазией (
Вопрос о возможности эффективного лечения недифференцированного рака долгое время оставался предметом клинических исследований и дискуссий, поскольку данная форма рака имеет более высокий риск метастазирования и худший прогноз [4]. К настоящему времени накоплены клинические данные об эффективности и безопасности лечения раннего недифференцированного рака менее 20 мм в диаметре, ограниченного слизистой оболочкой [5, 6]. Однако в ряде случаев точно определить границы и размер участка недифференцированного рака очень сложно, поскольку зачастую опухолевый рост (из-за морфологических особенностей) не распространяется на поверхность слизистой оболочки, доступной эндоскопическому осмотру. В результате снижается успешность эндоскопического лечения таких форм рака желудка [7]. Именно поэтому тщательная предоперационная диагностика и правильный выбор тактики лечения недифференцированного раннего рака желудка являются сложной задачей современной эндоскопии и онкологии.
Клинический случай
Пациентка М., 58 лет, направлена на скрининговое эндоскопическое исследование верхних отделов желудочно-кишечного тракта (рис. 1). На момент обследования больная жалоб не предъявляла; по данным анамнеза, профессиональных вредностей не было, наследственность по онкопатологии не отягощена. При выполнении ЭГДС выявлен плоский патологический участок слизистой оболочки в нижней трети тела желудка по передней стенке размером около 2,0 см в диаметре. Поверхность патологического участка неровная, в зоне образования определяются множественные плоскоуглубленные участки с неровными (а местами нечеткими) границами. При осмотре в узком спектре света с увеличением в области образования определяются разрозненные участки с полностью разрушенной структурой и наличием патологически измененных «штопорообразных» сосудов, характерных для недифференцированного рака. Учитывая нечеткость границ и подозрение на низкую дифференцировку опухоли, выполнена биопсия как самого образования, так и окружающей слизистой оболочки по окружности кнаружи от видимого края патологического участка. Гистологическое исследование выявило наличие низкодифференцированной (G3) микротубулярной карциномы с перстневидно-клеточным компонентом в области опухоли, а также в дистальной части макроскопически неизмененной слизистой оболочки в непосредственной близости к видимой границе опухоли. При иммуногистохимическом исследовании выявлена экспрессия муцина MUC3. Для предоперационного Т-стадирования рака была проведена эндосонография, по результатам которой опухоль лоцировалась только в собственной пластинке слизистой оболочки, признаков инвазии в подслизистый слой выявлено не было. По данным ультразвукового исследования и компьютерной томографии органов брюшной полости признаков метастазирования в региональных лимфатических узлах (N-стадирование) и отдаленных метастазов (М-стадирование) не определялось. Был установлен диагноз: «Ранний низкодифференцированный рак тела желудка, Т1N0M0, стадия Iа, клиническая группа II». Учитывая относительно большое распространение зоны опухоли, низкую дифференциацию рака, нечеткость границ, принято решение о проведении хирургического лечения. Пациентке выполнена лапароскопическая гастрэктомия с D2 лимфодиссекцией. При исследовании постоперационного препарата выявлены участки низкодифференцированной (G3) карциномы. Признаков метастазирования в региональные лимфатические узлы не выявлено.
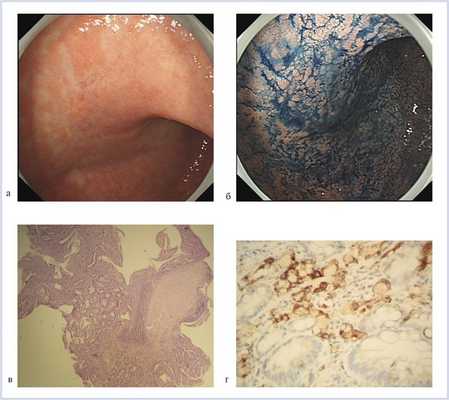
Рис. 1. Клинический случай раннего недифференцированного рака. а — плоский патологический участок слизистой оболочки нижней трети тела желудка по передней стенке размером около 2,0 см (эндоскопия в белом свете); б — границы образования четко не визуализируются (хромоскопия с индигокармином); в — разрозненные участки с полностью разрушенной структурой и наличием патологически измененных «штопорообразных» сосудов, характерных для недифференцированного рака, границы образования четко не визуализируются (увеличительная и узкоспектральная эндоскопия); г — биопсия выполнена из зоны патологического участка и на 5 мм кнаружи от видимого каря образования.
Согласно гистологической классификации Lauren [8], рак желудка подразделяется на два различных типа: диффузный и кишечный. Развитие рака желудка кишечного типа рассматривается как многоступенчатый процесс, включающий в себя последовательное изменение слизистой оболочки: хроническое воспаление, атрофия, кишечная метаплазия, дисплазия и аденокарцинома. При этом инфекция Helicobacter pylori является важным участником формирования этих патологических процессов. Кишечный тип рака является дифференцированным, к которому относится высоко-, умереннодифференцированная тубулярная аденокарцинома и папиллярная аденокарцинома. Напротив, при раке диффузного типа такая последовательность отсутствует: он обычно развивается на фоне неатрофического гастрита, имеет низкую дифференциацию и включает в себя низкодифференцированную аденокарциному и перстневидноклеточный рак. Рак желудка диффузного типа чаще встречается в молодом возрасте и отличается худшим прогнозом, что может быть связано с более злокачественным потенциалом опухолевых клеток, быстрым течением, ранним метастазированием и плохой выявляемостью на ранних стадиях [9].
Эндоскопическое исследование с биопсией служит основным методом диагностики рака желудка. Однако для поиска раннего недифференцированного рака требуется очень тщательный осмотр слизистой оболочки, поскольку изменения ее поверхности носят минимальный характер. При стандартном эндоскопическом осмотре в белом свете ранний внутрислизистый недифференцированный рак без изъязвления выглядит как локальный участок побледнения слизистой оболочки (как правило, без четких границ) [10]. При эндоскопическом исследовании в узком спектре света с увеличением определяется характерный микрососудистый рисунок в виде патологических разрозненных «штопорообразных» микрососудов. Тем не менее в случае недифференцированного типа раннего рака желудка возможности современной эндоскопии, даже при применении современных диагностических методик, ограничены. Это связано с морфологическими особенностями недифференцированного типа рака, поскольку распространение опухоли зачастую идет в средней части собственно слизистой оболочки под слоем относительно неизмененного эпителия. По этой причине осмотр поверхности эпителия, в том числе с применением увеличительной и узкоспектральной эндоскопии, не позволяет определить точные границы опухоли. По данным исследований, внутрислизистое латеральное распространение опухоли под слоем нормального эпителия может достигать 3 мм [11]. В этой связи для адекватной диагностики патологического процесса и его границ требуется выполнение биопсии не только из области измененного участка, но и из окружающей слизистой оболочки по окружности кнаружи (как минимум на 5 мм) от видимого края образования. Определение границ опухоли в соответствии с отрицательными результатами биопсии обязательно не только в случае недифференцированного (диффузного) рака, но и при отсутствии визуализации четких границ дифференцированного (кишечного) типа рака после применения хромоскопии с индигокармином и увеличительной и узкоспектральной эндоскопии (рис. 2) [12].
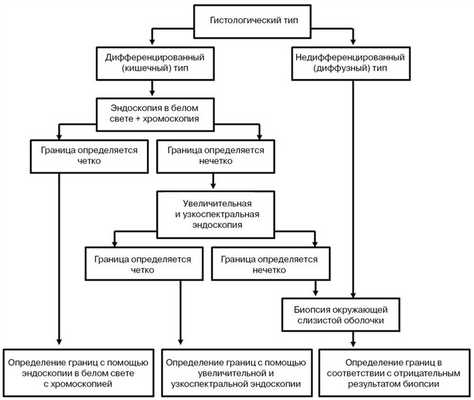
Рис. 2. Алгоритм определения границ опухоли в зависимости от гистологического строения (по K. Yao, адаптировано) [12].
Выбор тактики лечения раннего недифференцированного рака зависит от размеров и глубины инвазии диагностированной опухоли и, соответственно, от риска лимфогенного метастазирования. Известно, что низкодифференцированный рак отличается более высоким потенциалом лимфогенного метастазирования по сравнению с дифференцированным типом аденокарциномы виду особенностей морфологии опухоли и анатомии лимфатических сосудов слизистой оболочки желудка. Наибольшая плотность лимфатических сосудов в слизистой оболочке представлена в ее глубоких слоях, а локализация низкодифференцированного рака в средней и нижней частях собственной пластинки слизистой оболочки, а также полное разрушение архитектоники желез желудка делают процесс метастазирования более быстрым. Однако, как показывают результаты исследований, внутрислизистый рак размером менее 2 см в диаметре без изъязвления поверхности имеет крайне низкий риск лимфогенного метастазирования, что позволило включить эти критерии в расширенные показания для эндоскопической подслизистой диссекции. При таких размерах, отсутствии изъязвления, инвазии и вовлеченности лимфатических сосудов риск наличия метастазов составляет 0—2,5% (95% ДИ) [13]. Поэтому эндоскопическое лечение также может успешно проводиться при условии соответствия характеристик опухоли так называемым расширенным критериям для эндоскопической подслизистой диссекции. Однако истинные границы и размер опухоли в таком случае могут не соответствовать этим показателям, определяемым при эндоскопическом исследовании, в связи с чем необходимо взвешенное коллегиальное принятие решения о дальнейшей терапии, поскольку стандартом лечения рака желудка до сих пор остается хирургическая резекция с лимфодиссекцией.
Заключение
Недифференцированный рак желудка является особой формой рака, отличающейся высоким злокачественным потенциалом, ранним метастазированием и плохой выявляемостью на ранних стадиях. Поэтому только тщательная эндоскопическая диагностика с выполнением биопсии, исключающая игнорирование минимальных изменений слизистой оболочки желудка, поможет выявить ранние формы недифференцированного рака, имеющие низкий риск лимфогенного метастазирования и, как следствие, хороший прогноз после лечения. В ряде случаев опухоль может быть подвергнута малоинвазивному эндоскопическому лечению (как альтернатива полостной операции), однако возможность и целесообразность хирургического лечения в этом случае следует рассматривать в первую очередь.
Дооперационная диагностика рака желудка. Мультицентрический рак желудка
Лечение множественного рака желудка. Прогноз при множественном раке желудка
Лечение первично множественных раков, так же как и солитарных опухолей, заключается в радикальном оперативном удалении пораженных отделов желудка с максимальным захватом здоровых тканей. Именно при первичной множественности ракового поражения в желудке нужно шире устанавливать показания для полной гастрэктомии, даже в тех случаях, когда множественные раковые узлы расположены на ограниченном участке стенки желудка и тем более при разбросанной локализации раковых поражений в различных его отделах.
Следует предусмотреть необходимость распространения радикального вмешательства и на соседние органы (пищевод, двенадцатиперстную кишку) для тех случаев, когда множественный опухолевый процесс охватывает и эти отделы пищеварительного тракта.
Принципиальная необходимость подобного радикализма диктуется основными положениями мультицентрического канцерогенеза у подобных больных, предполагающими такое состояние слизистой оболочки желудка, которое характеризуется потенциальной возможностью развития нового узла множественного рака даже на макроскопически нормальных ее участках (так называемая готовность к переходу в рак, по Н. П. Еланскому).
При метахронном возникновении новой раковой опухоли после оперативного удаления солитарного рака желудка также показано подобное радикальное оперативное вмешательство (гастрэктомия оставшегося после первой операции отдела желудка) за исключением случаев противопоказаний, которые установлены и для радикального удаления солитарной опухоли.
Прогноз при первично множественных раках желудка различными авторами оценивается неодинаково. По мнению С. И. Бабичева и Г. Н. Акжигитова (1964), течение первично множественных опухолей желудка имеет более злокачественный характер. По данным этих авторов, из 20 больных радикально оперированных по поводу первично множественного рака желудка 9 живы в течение одного года, 3 — 2 лет и 1—5 лет.
А. М. Суслов (1959), исследуя лимфатические узлы у больных раком желудка, установил поражение регионарных лимфатических узлов при множественных опухолях в 2 раза чаще, чем у больных с солитарными опухолями. В то же время В. М. Вольская (1964) утверждает, что при своевременной диагностике и радикальном лечении больных первично множественным раком желудка непосредственные результаты лечения мало отличаются от результатов лечения солитарного рака.
Имеющиеся в литературе материалы о прогнозе первично множественных раков желудка немногочисленны и не позволяют сделать окончательных выводов. Однако уже опубликованные к настоящему времени данные свидетельствуют о том, что у подобных больных предсказание не должно рассматриваться как безусловно неблагоприятное, так как радикальное лечение нередко приводит к значительному продлению жизни больных, а иногда и стойкому излечению в течение более 5 лет.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика множественного рака желудка. Пример множественного рака желудка
Наряду с основными методами рентгенологического исследования (просвечивание и снимки) следует в необходимых случаях использовать и дополнительные методы (париетографию, томографию и др.). Кроме этого, всегда необходимо учитывать возможность существования сочетанпых первично множественных раков или других опухолей смежных с желудком органов пищеварительного тракта.
Поэтому именно в интересах полноценной диагностики первично множественных злокачественных опухолей следует строго придерживаться уже достаточно укоренившейся в практике методики одновременного рентгенологического исследования глотки, пищевода, желудка, двенадцатиперстной и начальной части тонкой кишки.
Однако даже при соблюдении всех этих условий рентгенодиагностика первично множественных раков желудка не всегда оказывается успешной, особенно в точном определении числа опухолевых узлов. Это может быть обусловлено различными причинами: тесным расположением, различием размеров узлов, когда рентгенологическое изображение крупной опухоли проекционно прикрывает собой мелкие узлы; расположением их в труднодоступных для рентгенодиагностики отделах желудка, в частности кардиальном.
При возникновении первично множественных раков желудка из множественных полипов, а также при множественном раке с большим числом первичных узлов дооперационпая расшифровка истинной природы обнаруживаемых изменений нередко связана с большими трудностями, так как в этих случаях наблюдаются такие изменения внутренней поверхности желудка, которые фактически не отличимы от картины злокачественного рельефа при солитарном раковом поражении.
Это связано с тем, что задерживающаяся между узлами множественных опухолей контрастная взвесь симулирует картину истинного злокачественного рельефа, а невозможность пальпаторного разъединения существующих множественных опухолевых узлов (особенно при их тесном расположении на небольшом участке) не позволяет получить объективные данные о множественности патологического процесса.
В этом отношении характерно одно наше наблюдение. У больного, 52 лет, с диспепсическими клиническими признаками в течение нескольких лет было произведено рентгенологическое исследование желудка в связи с подозрением на раковое его поражение. При рентгенологическом исследовании в области синуса желудка с переходом на антральный отдел и нижнюю треть тела его была отмечена картина, характерная для злокачественного рельефа, на котором при тщательном прощупывании не удавалось рентгенологически дифференцировать какие-либо отдельные узлы опухоли.
Кроме того, определялось нарушение перистальтики на пораженном участке при нормальной эвакуаторной функции желудка. На основании этих данных был сделан вывод о наличии у больного солитарного обширного ракового поражения.
Во время операции наличие ракового процесса было подтверждено; произведена резекция желудка. И только при макроскопическом осмотре резецированного препарата было установлено, что у больного имеется 7 опухолей от I до 3,5 см в диаметре, расположенных на широком основании вплотную друг к другу. Последующее гистологическое исследование двух полипов выявило наличие злокачественного поражения (аденокарциномы); остальные опухолевые узлы имели гистологическое строение доброкачественных полипов.
Таким образом, рентгенологическая картина первично множественных раков желудка неодинакова у различных больных, и она зависит от ряда особенностей, характеризующих каждый конкретный случай первично множественной опухоли. При этом имеют значение размеры опухолей, макроскопический их вид, расстояние между узлами опухоли (компактное расположение или разбросанность), их локализация, степень вовлечения в патологический процесс различных слоев стенки желудка и соседних органов, а также одновременное наличие или отсутствие предраковых заболеваний желудка.
Наблюдение Г. А. Кочетовой иллюстрирует трудность дооперационного распознавания двойного первично множественного рака желудка. При клиническом и рентгенологическом исследовании больного, 53 лет, предположен солитарный рак желудка, а при операции было установлено наличие двух первичных опухолей. Подробные данные гистологического исследования показали наличие в обоих узлах одного гистологического типа рака (адспокарциномы). Однако детальное исследование клеточных элементов опухолей доказало, что степень дифференциации клеток аденокарципомы в каждой из них была различной.
В наблюдении В. М. Вольской заслуживают внимания хорошие результаты радикального оперативного лечения двойного первично множественного рака желудка, даже при наличии метастазов обеих опухолей в лимфатические узлы. Предоперационная рентгенологическая диагностика у данного больного, 41 года, была успешной и полностью подтверждена при изучении препарата. Следует отметить, что гистологическое строение обоих раковых узлов было неодинаковым с различной степенью дифференцированное™ клеточных элементов опухоли.
С. И. Бабичев и Г. Н. Акжигитов наблюдали больного, 45 лет, с неполной дооперациониой рентгенологической диагностикой, когда вторая и третья опухоли желудка, несмотря на значительные их размеры, были определены только во время операции и при осмотре макропрепарата. При гистологическом исследовании в двух узлах установлена одинаковая гистологическая структура (плоскоклеточный рак), а в третьей — адеиокарцинома. В отличие от предыдущего случая, несмотря на успешно произведенную радикальную операцию, больной умер через 3 месяца после выписки из стационара от метастазов в печень. Такой неблагоприятный результат в данном случае едва ли можно отнести за счет первичной множественности ракового поражения желудка, так как подобное метастазирование приводит к неблагоприятным исходам и при солидарных опухолях желудка.
В наблюдении Н. Н. Еланского мультицентрический рост рака происходил на нескольких (7) участках слизистой оболочки желудка, очевидно, на почве предшествовавших раку и скрыто протекавших полипов. При рентгенологическом исследовании были отмечены признаки солитарной опухоли и только при операции и на макропрепарате был расшифрован первично множественный характер патологического процесса; гистологическая структура опухолей была одинаковой.
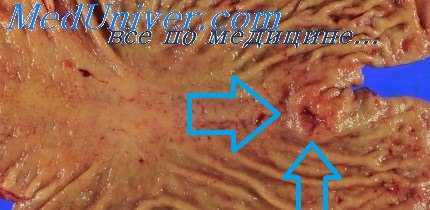
Больной, 51 года, поступивший в клинику в общем тяжелом состоянии, предъявлял жалобы на слабость, кашель, одышку, боли в животе. Болен один год, когда появились отеки на нижних конечностях и увеличение живота. За 20 дней до госпитализации состояние больного ухудшилось, появились боли в животе, заметно ухудшился аппетит. Клинический диагноз: атрофический цирроз печени; асцит, общий атеросклероз; очаговая пневмония.
При вскрытии в брюшной полости обнаружено около 3 л желтоватой прозрачной жидкости. На передней поверхности желудка имеется блюдцеобразная опухоль размерами 5х8 см, с приподнятыми краями и изъязвлениями в центре. Такая же опухоль размерами 5х6 см обнаружена на задней стенке желудка. В центре этой прорастающей всю стенку желудка опухоли имеется перфоративное отверстие, прикрытое поджелудочной железой.
Гистологически в обеих опухолях картина железистого рака. На расстоянии 1,5 см от привратника, на передней стенке исторического отдела желудка имеется полип (гистологически аденоматозный) высотой 4 см с ворсинчатой поверхностью. На большой кривизне тела желудка имеется еще один ворсинчатый полип высотой 1,5 см, который гистологически представлял пролиферирующий аденоматозный полип с явлениями малигнизации. В пнлорическом отделе по большой кривизне желудка опухоль 1,5X3 см с отчетливыми границами. Гистологически: аденокарцинома. Еще одна небольшая опухоль расположена на малой кривизне желудка вблизи большой раковой опухоли; гистологически — невринома. Слизистая желудка во всех его отделах сглажена и заметно истончена, гистологически: картина хронического гастрита (из наблюдения Ю. Ф. Ломакина, 1961).
Несмотря на резкую выраженность анатомических изменений, прижизненный диагноз первично множественного опухолевого процесса в желудке не был установлен. По-видимому, это можно объяснить тем, что клиническая картина заболевания у этого больного была не характерной, представляя одну из клинических «масок» рака желудка, описанных С. А. Рейнбергом (1952). Интересны результаты вскрытия, при котором обнаружены две раковые опухоли (аденокарциномы), два полипа, из которых один был с признаками малигнизацни, и картина хронического атрофического гастрита во всех отделах желудка. Эти патологические процессы могут рассматриваться как морфологические проявления стадий мультицентрического развития первично множественного рака, начиная от гастрита, доброкачественного полипа, малигнизацни последнего и кончая возникновением на этой почве двух первичных раковых поражений одинаковой гистологической структуры.
Рак желудка

Клиническая классификация (наиболее распространенные подходы, например: по этиологии, по стадии и т.д.).
Международная классификация TNM. Последний пересмотр этой классификации состоялся в 2009 г. и она была одобрена всеми национальными комитетами по классификациям заболеваний (1, 21).
4. Антральный (С16.3) и пилорический (С16.4) отделы.
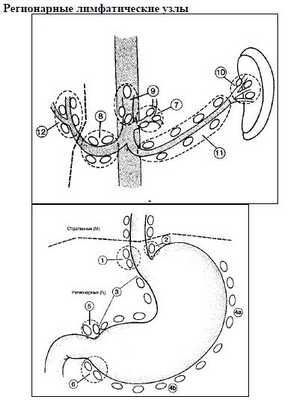
Регионарными лимфатическими узлами для желудка являются лимфатические узлы, расположенные вдоль малой (1, 3, 5) и большой (2, 4а, 4б, 6) кривизны, вдоль левой желудочной (7), общей печеночной (8), селезеночной (10, 11) и чревной (9) артерий, а также гепатодуоденальные узлы (12). Поражение других внутрибрюшинных лимфатических узлов, таких как гепатодуоденальные (12), ретропанкреатические, мезентериальные и парааортальные, классифицируются как отдаленные метастазы.
Клиническая классификация TNM (ICD-C16.1, 2, 3, 4)
Т - Первичная опухоль.
ТХ - Первичная опухоль не может быть оценена.
ТО - Отсутствие данных о первичной опухоли.
Tis - Карцинома insitu, интраэпителиальная опухоль без инвазии в собственную пластинку слизистой оболочки, тяжелая дисплазия.
Т1 - Опухоль прорастает в собственную пластинку слизистой оболочки, мышечную пластинку слизистой оболочки или подслизисгую основу.
Т1а - Опухоль прорастает в собственную пластинку слизистой оболочки или мышечную пластинку слизистой оболочки.
Т1b - Опухоль прорастает в подслизистую основу.
Т2 - Опухоль прорастает в мышечную оболочку.
ТЗ - Опухоль прорастает в подсерозную основу.
Т4 - Опухоль прорастает в серозную оболочку и распространяется на соседние структуры 1,2,3 .
Т4а - Опухоль прорастает в серозную оболочку.
Т4b - Опухоль врастает в соседние структуры 1,2,3 ).
Примечания
1 Соседними структурами для желудка являются - селезенка, поперечная ободочная кишка, печень, диафрагма, поджелудочная железа, брюшная стенка, надпочечники, почки, тонкая кишка, забрюшинное пространство.
2 Интрамуральное (внутрипросветное) распространение на двенадцатиперстную кишку или пищевод классифицируют по глубине наибольшей инвазии в любой из этих органов, включая желудок.
3 Опухоль, которая распространяется на желудочно-ободочную или желудочно-печеночную связку, большой или малый сальник, но не прорастает в висцеральную брюшину, классифицируют как ТЗ.
N - Региональные лимфатические узлы.
NX - Региональные лимфатические узлы не могут быть оценены.
N0 - Нет метастазов в региональных лимфатических узлах.
N1 - Метастазы в 1-2 региональных лимфатических узлах.
N2 - Метастазы в 3-6 региональных лимфатических узлах.
N3 - Метастазы в 7 и более региональных лимфатических узлах.
N3a - Метастазы в 7-15 региональных лимфатических узлах.
N3b - Метастазы в 16 и более региональных лимфатических узлах.
М - Отдаленные метастазы.
МО - Нет отдаленных метастазов.
М1 - Есть отдаленные метастазы.
Примечание: отдаленные метастазы включают диссеминацию по брюшине, положительную цитологию перитонеальной жидкости и элементы опухоли в сальнике, не являющиеся частью непрерывного распространения.
Гастроинтестинальная стромальная опухоль (ICD-OC15-18; С20; С48.1)
Клническая классификация TNM
Т1 - Опухоль не более 2 см.
Т2 - Опухоль более 2 см, но не более 5 см в наибольшем измерении.
ТЗ - Опухоль более 5 см, но не более 10 см в наибольшем измерении.
Т4 - Опухоль более 10 см в наибольшем измерении.
NX - Региональные лимфатические узлы не могут быть оценены*.
N1 - Есть метастазы в региональных лимфатических узлах.
* При ГИСО региональные лимфатические узлы вовлекаются редко, поэтому те случаи, когда статус лимфатических узлов не может быть оценен клинически или морфологически, рассматривают как N0 вместо NXили pNX.
pTNM патогистологическая классификация
Требования к определению категорий pT, pN, pM соответствуют требованиям к определению категорий T, N, M.
Примечание. PN0 гистологическое исследование включает обычно 15 и более регионарных лимфатических узлов.
G - гистопатологическая дифференцировка.
GX - степень дифференцировки не может быть установлена.
G1 - высокая степень дифференцировки.
G2 - средняя степень дифференцировки.
G3 - низкая степень дифференцировки.
G4 - недифференцируемый рак.
Группировка по стадиям:
| Стадия 0 | Тis | N0 | М0 |
| Стадия ІА | Т1 | N0 | М0 |
| Стадия ІБ | Т1 | N1 | М0 |
| Т2 а/b | N0 | М0 | |
| Стадия ІІ | Т1 | N2 | М0 |
| Т2a/b | N1 | М0 | |
| Т3 | N0 | М0 | |
| Стадия ІІІА | Т2a/b | N2 | М0 |
| Т3 | N1 | М0 | |
| Т4 | N0 | М0 | |
| Стадия ІІІБ | Т3 | N2 | М0 |
| Стадия ІV | Т4 | N1-2 | М0 |
| Т1-4 | N3 | М0 | |
| Любая Т | Любая N | М1 |
| Т1 | Собственная пластика слизистой оболочки, подслизистая основа |
| Т2 | Мышечная оболочка, субсероза |
| Т2а | Мышечная оболочка |
| Т2b | Субсероза |
| Т3 | Прорастает серозную оболочку |
| Т4 | Распространяется на соседние структуры |
| N1 | ЛУ 1-6 групп |
| N2 | ЛУ 7-11 групп |
| N3 | ЛУ 12-16 групп |
Диагностика
Диагностические критерии*** (описание достоверных признаков заболевания в зависимости от степени тяжести процесса).
Жалобы и анамнез (характер возникновения и проявления болевого синдрома).
Патогномоничных симптомов рака желудка не установлено. Жалобы больного могут соответствовать проявлениям различных заболеваний желудка (хронический гастрит, язвенная болезнь желудка и т.д.).
Физикальное обследование (напр.: резкая боль в эпигастральной области).
Болевой симптомокомплекс можно условно разделить на язвенно-подобный и характерный для хронического гастрита и полипоза желудка. Похудание и слабость являются преходящими и соответствуют времени обострению патологического очага. При ранних стадиях заболевания консервативная инфузионная, спазмолитическая и общеукрепляющая терапия способствуют купированию этих симптомов.
Симптоматика рака желудка связана с его локализацией в органе и возникшими осложнениями. Для проксимального рака желудка характерным являются симптомы дисфагии - похудание, нарушение проходимости сначала твердой, а позже и жидкой пищи вплоть до полной дисфагии.
Локализующаяся опухоль в теле желудка, как правило, на ранних стадиях ничем не проявляется. Могут отмечаться астеновегетативные симптомы (общая слабость, недомогание, потеря аппетита и т.д.), т.н. «синдром малых признаков» Савицкого. При распаде опухоли на первый план выступают симптомы желудочного кровотечения: рвота «кофейной гущей», слабость, головокружение с коллаптоидным состоянием, темный стул - мелена. Такие пациенты, как правило, являются клиентами экстренных хирургических клиник и своевременное выявление источника кровотечения является очень важной задачей для установления метода лечения.
При раке дистальной локализации рака желудка основными клиническими проявлениями будут симптомы стеноза выходного отдела желудка. Это может быть компенсированный, субкомпенсированный и декомпенсированный стеноз с катастрофической потерей веса, нарушением водно-электролитного баланса до развития судорожного синдрома.
Таким образом, при возникновении малейшего подозрения на рак желудка, пациенты должны быть без промедления подвергнуты обследованию, поскольку успех лечения зависит от своевременной диагностики заболевания. Поэтому, далее нам хотелось бы представить для Вас алгоритм действия врача первичного звена (поликлиники, врачебной амбулатории и т.д.).
Прежде всего при опросе больного следует обращать внимание на наличие болей в эпигастрии, снижение или извращение аппетита, тошноту, отрыжку, рвоту, утомляемость, слабость, беспричинное прогрессирующее похудание.
При осмотре необходимо обратить внимание на бледность кожных покровов, состояние тургора кожи, слизистых оболочек, необходимо провести тщательную пальпацию живота.
Особое внимание должно быть уделено контингенту лиц, состоящих на диспансерном учете по поводу язвенной болезни желудка, хронического атрофического гастрита, полипоза желудка, пернициозной анемии, а также к пациентам, ранее перенесшим резекцию желудка.
Лабораторные исследования
- общий анализ крови - для опухоли пищевода характерны гипохромная анемия, повышение СОЭ, лейкоцитоз;
- коагулограмма - наблюдаются признаки гиперкоагуляции.
Инструментальные исследования
Показания для консультации специалистов (напр.: онколога с указанием цели конультации).
Перечень основных и дополнительных диагностических мероприятий (отдельно перечислить обследования, которые необходимо провести до плановой госпитализации):
Основные диагностические мероприятия:
1. Фиброгастроскопия с биопсией опухоли и морфологическим исследованием биопсийного материала.
2. Рентгенконтрастное исследование желудка.
3. УЗИ органов брюшной полости, внутриполостная ультрасонография.
4. Рентгенологическое исследование легких.
5. УЗИ периферических лимфатических узлов, пальцевое исследование прямой кишки, осмотр гинеколога (у женщин).
6. Общий анализ крови.
7. Биохимический анализ крови: общий белок, мочевина, креатинин, билирубин, амилаза, трансаминазы, электролиты, глюкоза.
8. Группа крови, резус-фактор.
Дополнительные диагностические мероприятия
Фиброколоноскопия, лапароскопия, ирригоскопия, ангиография, МРТ, сцинтиграфия костей скелета, компьютерная томография, ПЦР-исследование, ПЭТ- исследование, С-kit.
Дифференциальный диагноз
Размер полипов варьирует от небольшого выбухания до крупных полипоидных масс, имитирующих рак желудка
Характеризуется медленным ростом, изъязвлением и кровоточивостью; поражение лимфатических узлов не характерно
Необходимо помнить о возможности заживления язвенной формы рака желудка на фоне противоязвенной терапии
Лечение
Показанием к хирургическому лечению рака желудка является установление диагноза операбельного рака желудка при отсутствии противопоказаний к операции.
Основными радикальными операциями при раке желудка являются субтотальная, дистальная, проксимальная резекция желудка и гастрэктомия.
Главное условие радикальности операции заключается в удалении единым блоком пораженного опухолью желудка или соответствующей его части и регионарных лимфоузлов с окружающей их клетчаткой (лимфодиссекция).
В настоящее время на основании работ JRSGC (1998) детально описаны 16 групп регионарных лимфатических узлов, формирующих четыре последовательных (не в истинном понимании последовательности) этапа метастазирования от различных отделов желудка - N1 до N4.
Второй этап: лимфатические узлы по ходу артериальных стволов - общей печеночной артерии, чревного ствола, левой желудочной, в воротах селезенки, по ходу селезеночной артерии (№7-11).
Третий этап: лимфатические узлы гепатодуоденальной связки, ретропанкреатодуоденальные; корня брыжейки поперечно-ободочной кишки (№№12-14).
Следует отметить, что различным локализациям первичной опухоли в желудке соответствуют различные этапы метастазирования, что подтверждено проспективными исследованиями по выживаемости групп пациентов при поражении различных групп лимфатических узлов.
На основании классификации и с учетом исследований по результатам выживаемости (M. Sasako et al., 1995; T. Aiko et al., 1998) вовлечение лимфатических коллекторов N1-2 рассматривается как регионарное метастазирование, тогда как вовлечение N3-4 - как отдаленное метастазирование (M1 Lym).
Различные варианты лимфодиссекции нашли свое отражение в классификации объема операций: вариант лимфодиссекции определяется на основании последнего удаляемого этапа метастазирования.
Тип хирургического вмешательства на основании объема лимфодиссекции
| Тип вмешательства | Объем лимфодиссекции | |||
| N1 | N2 | N3 | N4 | |
| Стандартная гастрэктомия D1 | + | - | - | - |
| Стандартная радикальная гастрэктомия (СРГ) D2 | + | + | + | + |
Для определения радикальности и адекватности операции служит контроль на отсутствие опухолевых клеток по линии пересечения органов (пищевода, желудка, двенадцатиперстной кишки), определяемое микроскопически.
Субтотальная проксимальная резекция желудка выполняется при раке кардиального отдела желудка I и II стадий. При раке проксимального отдела желудка III стадии или инфильтративных формах производится гастрэктомия.
Показанием к выполнению дистальной субтотальной резекции желудка является наличие экзофитной опухоли или небольшой инфильтративной опухоли в нижней трети желудка, не выходящей за пределы серозного слоя стенки желудка, при условии высокой или умеренной степени дифференцировки (cтадия T1-2 N0-1M0).
Во всех остальных случаях рака желудка показана гастрэктомия, что связано с биологическими особенностями распространения раковых клеток. При распространении опухоли проксимально по пищеводу, операция должна выполняться из комбинированного торако-лапаротомного доступа по Osawa-Garlok с пищеводно-тонкокишечным анастомозом по Ру.
Спленэктомия выполняется при проксимальной локализации и\или в теле желудка, прорастании опухолью всех слоев стенки желудка.
Диагностированный на предоперационном этапе местнораспространенный рак желудка (стадии опухолевого процесса II, IIIa, IIIb, IV хирургическая), особенно низкодифференцированные формы - показание для проведения курсов (2-3) предоперационной полихимиотерапии. Базовыми препаратами лекарственной терапии являются таксотер, иринотекан, оксалиплатин, кселода. Оценка эффективности предоперационной терапии проводится контрольными эндоскопическими, ультрасонографическими, компьютерно-томографическими методами исследованиями, а также методами ИГХ.
Результаты лечения больных с ІV стадией остаются крайне неудовлетворительными. Четких схем лечения нет.
Для ликвидации осложнений, обусловленных распространенным опухолевым процессом, выполняют оперативные вмешательства с паллиативной целью. В зависимости от конкретной ситуации выполняют паллиативную резекцию желудка, гастрэктомию, обходной гастроэнтероанастомоз на длинной петле с межкишечным соустьем, накладывают гастро- или еюностому. Возможно выполнение эндоскопической реканализации путем диатермокоагуляции опухоли.
Стандартных схем химиотерапевтического лечения больных раком желудка ІV стадии нет. Существует множество различных схем использования цитостатиков у больных диссеминированным раком желудка, которые отличаются друг от друга не только набором химиопрепаратов, но и временем проведения, количеством курсов, использованием модификаторов, а также способом введения их в организм. Частичных эффектов у больных диссеминированным раком желудка можно добиться в 15-35% случаев от применения в режиме монотерапии таких препаратов, как 5-фторурацил, фторафур, цисплатин, этопозид, CCNU, доксорубицин, эпирубицин. Продолжительность частичных ремиссий при этом короткая, на выживаемости эффект не сказывается.
В девяностых годах начато исследование эффективности и продолжается до настоящего времени при генерализованном раке желудка новых препаратов - доцетаксела, паклитаксела, кампто, S-1, УФТ.
В настоящее время наиболее часто используются комбинации на основе 5-фторурацила и лейковорина. Целесообразно использовать для терапии рака желудка 5-фторурацил, цисплатин, этопозид, доксорубицин и эпирубицин.
Несмотря на это, эффективность химиотерапевтического лечения больных распространенным раком желудка остается на низком уровне, в большинстве случаев отмечается частичная и непродолжительная ремиссия опухолевого процесса.
5. Эндоскопическая мукозэктомия (при наличии раннего рака желудка (T1) при условии овладения техники проведения операций).
Обязательным компонентом стандартных операций является лимфодиссекция в объеме D2. Стадии заболевания Т3, N1-2 предполагают курсы адъювантной полихимиотерапии.
2. Обязательным компонентом стандартных операций является лимфодиссекция в объеме D2. Установление до операции местнораспространенной формы (Т3-Т4), наличие метастазов в регионарных (N1-N2), а также низкодифференцированные гистологические формы опухолевого процесса предполагают проведение курсов (2-3) неоадъювантной лекарственной терапии при условии согласия пациентов на проведение лекарственной терапии.
3. Адъювантные курсы полихимиотерапии с учетом ответа опухоли на проводимую предоперационную лекарственную терапию.
1. Неоадъювантная полихимиотерапия (2-3) курса при условии согласия пациентов на лекарственную терапию.
Читайте также:
- Синдром общей слабости при гипотонии. Ортостатический синдром или постуральная гипотония
- Лечение туберкулеза. Методы лечения туберкулеза. Профилактика туберкулеза. Методы профилактики туберкулеза.
- Сифилис глазницы. Диагностика и рентгенография при сифилисе глаза
- Причины и профилактика тромбоэмболии легочной артерии. Бронхо-пульмональный артериальный шунт
- Ионизирующее излучение. Процесс радиоактивного распада
