ДВС-синдром. Плазмаферез при ДВС-синдроме
Добавил пользователь Валентин П. Обновлено: 17.01.2026
Плазмаферез при неотложных состояниях. Плазмаферез в экстренной хирургии
Одним из первых методов экстракорпоральной детоксикации (ЭКД) является плазмаферез. Так же, как и метод гемодиализа, плазмаферез впервые был внедрен в клиническую практику в середине 40-х годов XX века. Пик применения ПФ в России пришелся на конец 70-х — 80-е годы XX столетия.
Плазмаферез относится к гравитационным методам ЭКД, основанным на центрифугирповании. Принцип метода состоит в том, что при центрифугировании, когда на кровь воздействуют центробежные силы, форменные элементы располагаются слоями вокруг оси вращения. Наиболее плотные клетки оказываются на периферии (эритроциты), ближе к центру будут клетки, имеющие меньшую плотность (лейкоциты, затем тромбоциты). В центре делительной камеры остается чистая плазма, которая в случае проведения терапевтического ПФ удаляется целиком, со всеми содержащимися в ней физиологическими и токсическими компонентами и замещается свежезамороженной донорской или кровезаменителями. Таким образом, ПФ расценивается как универсальный эфферентный метод, позволяющий воздействовать на токсические субстраты любой природы, молекулярной массы, электрохимического заряда. Хотя плазмаферез традиционно относят к гравитационным эфферентным методам, за последние годы широкое распространение получили плазменные мембранные фильтры, позволяющие отделять жидкую часть крови от ее форменных элементов.
Плазмаферез позволяет воздействовать на структуру клеточных мембран эритроцитов, тромбоцитов и лейкоцитов. Отмечается, что суммарное детоксикационное действие ПФ, его воздействие на реологию и иммунитет по сравнению с другими эфферентными методами существенно выше.
Плазмаферез может выступать как самостоятельный метод ЭКД, так и являться частью детоксикационных мероприятий, если плазма, полученная путем плазмафереза, будет подвергнута сорбции, фильтрации, преципитации или другим воздействиям.
Свои особенности имеет такой вариант ПФ, как плазмообмен, когда удаляется не менее одного расчетного объема циркулирующей плазмы, которая не менее чем на 70 % от удаленного объема замещается свежезамороженной донорской или 5 %-ным раствором альбумина. Этот вариант ПФ обычно используется для борьбы с синдромом эндогенной интоксикации.
Плазмаферез и плазмообмен относят к группе неселективных методов экстракорпоральной детоксикации. Между тем только эти ЭК методы эффективны при эндотоксикозах, вызванных патологическими субстратами высокомолекулярной природы, или политоксикозах, когда причиной патологического состояния является избыток токсических субстратов различной молекулярной массы.
В настоящее время все большее распространение получают методы селективного ПФ, основанные на криогепариновой преципитации. Методики селективного ПФ позволяют не только повысить эффективность процедуры, но и сократить количество необходимых плазмозамещающих сред.
Метод криоафереза или криогепариновой преципитации основан на свойстве белка плазмы фибронектина полимеризоваться в присутствии гепарина на холоде и образовывать преципитат, в состав которого помимо фибронектина входят циркулируюшие иммунные комплексы, иммуноглобулины М, А и G, криоглобулины, фибриноген, СЗ-компонент комплемента, пе-рекисно-модифицированные липопротеиды, фактор Вилле-бранда. Метод позволяет удалять из плазмы от 30 до 50 % перечисленных веществ, более 80 % криоглобулинов, около 90 % фибронектина при сохранении до 85-90 % альбумина. Таким образом, селективный ПФ повышает иммунокорригирующее и реокорригирующее действия метода и уменьшает вероятность осложнений, связанных с плазмозамещением.
По вполне понятным причинам плазмаферез имеет вполне широкое клиническое применение и занял прочное место в лечении целого ряда заболеваний самой различной природы. Правда, следует отметить, что бум увлечения этим методом постепенно проходит, и круг показаний к ПФ сужается. В клинике определяются вполне конкретные ситуации, когда необходим тот или иной метод ЭКД с учетом эфферентных возможностей и особенностей.
В условиях многопрофильного хирургического стационара приходится сталкиваться с целым рядом ситуаций, когда ПФ как метод ЭКД по праву становится методом выбора или используется в комплексе с другими эфферентными методиками. В настоящем разделе представлен опыт наблюдения 250 пациентов, находившихся на лечении в 1990—2002 годах. Было вьшолнено более 500 сеансов обменного плазмафереза.
Диссеминированное внутрисосудистое свёртывание крови (ДВС-синдром)

Диссеминированное внутрисосудистое свёртывание крови (ДВС-синдром) – это один из наиболее распространённых в интенсивной терапии и представляющих большую опасность для больных вид патологии гемостаза. ДВС-синдром в настоящее время является важной проблемой медицины, так как осложняет течение практически любого заболевания, может являться причиной их развития и нередко предопределяет прогноз заболевания. Данный синдром универсален и может протекать как молниеносно с развитием смертельного исхода, так и латентно. При ДВС-синдроме возможно свёртывание крови в сосудистом русле, так и регионарные и органные тромбозы.
ДВС-синдром является полиэтиологическим заболеванием и может развиваться при различных заболеваниях и патологических процессах, которые приведены в таблице 1.
Заболевания системы крови
Острый промиелоцитарный лейкоз
Хронический мегакориоцитарный лейкоз
Серповидноклеточная анемия (гемолитический криз)
Эмболия околоплодными водами
Внутриутробная смерть плода
Конфликт матери и плода по АВО и резус-фактору
Заболевания сосудистой стенки и сосудов
Тромбоэмболия лёгочной артерии
Тромботическая тромбоцитопеническая пурпура
Шок (травматический, ожоговый, септический)
Массивные поражения тканей (краш-синдром, большие операции)
Синдром массивных трансфузий
Переливание несовместимой крови
Отравления и интоксикации (лекарственные, змеиные яды)
В основе патогенеза ДВС-синдрома лежит преобладание активирующих свёртывающую систему механизмов над антикоагулянтной системой.
Развитие тяжёлого ДВС-синдрома начинается в результате массивной и длительной активации свёртывающей системы в под воздействием внешнего фактора. В результате этого развивается состояние гиперкоагуляции, что приводит к повсеместному образованию мелких сгустков, которые оседают в микроциркуляторном русле.
Обязательным элементом ДВС-синдрома является агрегация тромбоцитов. В результате гиперкоагуляции тромбоциты склеиваются между собой. Постепенно количество тромбоцитов уменьшается, в связи с чем развивается тромбоцитопения потребления.
В патогенезе ДВС-синдрома центральное место занимают образование в сосудистом русле тромбина и истощение механизмов, препятствующих свёртыванию крови и агрегации тромбоцитов. В процессе развития ДВС-синдрома может происходить снижение уровня основного физиологического антикоагулянта – антитромбина III в плазме. В результате запущенного патологического процесса в крови накапливается огромное количество активированных факторов свёртывания, что приводит к истощению системы фибринолиза и образовавшиеся сгустки практически перестают лизиироваться. Развивается блокада микроциркуляции, приводящая к нарушению кровоснабжения почек, печени, лёгких, слизистых оболочек кишечника, что создаёт предпосылки к развитию полиорганной недостаточности (ПОН).
Основными типичными клиническими проявлениями ДВС-синдрома являются геморрагии и/или тромбозы и ПОН. ПОН развивается в результате тромбогеморрагических поражений органов, имеющих богатую микроциркуляторную сеть. К данным органам относятся лёгкие, почки, головной мозг, кожа, надпочечники и печень.
Первыми признаками поражения лёгких является одышка и падение артериальной оксигенации. Нарушение микроциркуляции под воздействием вазоактивных субстанций приводит к развитию острой дыхательной недостаточности с нарастающей одышкой, цианозом, ателектазами в лёгких и прогрессирующим отёком лёгких.
Отложение фибрина в сосудах почечных клубочков может привести к почечной недостаточности. В клинической картине наблюдается олигоурия, рефрактерная к диуретикам, микро-и макрогематурия, высокие показатели мочевины и креатинина сыворотки крови.
Нарушения микроциркуляции головного мозга приводит к энцефалопатии, нарушению психики, потери сознания. В случае тяжёлого течения ДВС-синдрома возможно кровоизлияние в головной мозг.
Для ДВС-синдрома характерно образование стрессовых, гипоксических эрозий и язв слизистой желудочно-кишечного тракта, осложняющихся диффузным кровотечением.
При ДВС-синдроме отмечается геморрагический синдром, который носит смешанный гемотомно-петехиальный характер. На коже спонтанно или при незначительных воздействиях появляются синяки. Течение геморрагического синдрома сопровождается носовыми, десневыми кровотечениями и кровотечениями из места инъекций.
Кровотечения, геморрагический синдром и внутрисосудистый гемолиз приводят к развитию анемического синдрома. Анемический синдром сопровождается снижением уровня гемоглобина, эритроцитов.
В результате нарушения микроциркуляции, наличия гематом и повышения проницаемости слизистой оболочки желудочно-кишечного тракта создаются благоприятные условия для развития генерализованной инфекции – сепсиса.
По клиническому течению ДВС-синдрома выделяют:
Острый ДВС-синдром характерен для акушерской патологии, сепсиса, массивного краш-синдрома, обширных ожогов, массивного распада опухолей, переливания несовместимой крови. Для острого ДВС-синдрома характерна диффузная кровоточивость из операционной раны, носовые, десневые, постинъекционные кровотечения.
Подострое течение ДВС-синдрома наблюдается при аутоиммунных заболеваниях, хронических инфекциях и при всех перечисленных выше патологических состояниях. Длительность подострого течения занимает от нескольких недель до месяцев.
Хронический ДВС-синдром может длительное время не проявляться клинически. Возникновение ДВС-синдрома связано с прогрессированием основного заболевания. Хронический ДВС-синдром встречается при терапевтической патологии, например при сердечной недостаточности, хроническом гломерулонефрите, септическом эндокардите.
Рецедивирующий ДВС-синдром проявляется необильными носовыми кровотечениями, синяками на коже в период обострения основного заболевания.
В настоящее время в течение ДВС-синдрома выделяют три стадии:
I стадия – гиперкоагуляции. Для стадии гиперкоагуляции характерно повышение агрегации тромбоцитов и тромбообразование. При остром течении ДВС-синдрома данная стадия кратковременна и быстро переходит в стадию гипокоагуляции.
II стадия – нормокоагуляция. В этой стадии наблюдается субкомпенсация гемостаза.
III стадия – гипокоагуляция, при которой развивается выраженная кровоточивость, являющаяся следствием истощения фибринолиза.
ДВС-синдром является вторичным проявлением патологического процесса. Поэтому главной задачей является устранение провоцирующего фактора или своевременное лечение основного заболевания.
Лечение ДВС-синдрома включает в себя:
- Антикоагулянтную терапию.
- Заместительную терапию.
- Антифибринолизные препараты.
- Дезагреганты и препараты реологического действия.
- Экстракорпоральная детоксикация.
Использование гепарина оправдано на любой стадии ДВС-синдрома. В стадии гиперкоагуляции ДВС-синдрома гепарин применяется в суточной дозе 500-800 ЕД/кг. Доза гепарина подбирается в соответствии с лабораторными показателями гемостаза. Считается, что исходное время свертывания по Ли-Уайту должно увеличиться в 2 раза. Определёнными преимуществами обладают препараты фракционированного гепарина (фраксипарин, клексан, фрагмин), которые можно вводить 1-2 раза в сутки без значительных колебаний времени свертывания. В стадии гипокоагуляции гепарин вводят вместе со свежезамороженной плазмой (СЗП). В данном случае доза гепарина составляет 2500-5000 ЕД. Введение гепарина перед СЗП повышает активность антитромбина-III (AT-III) по отношению к факторам Ха и IХа, обрывает процесс внутрисосудистого свёртывания и тем самым не даёт развиться коагулопатии потребления.
Заместительная терапия предназначена для восстановления гемостаза больного. К заместительной терапии относится переливание СЗП, которая содержит достаточную концентрацию необходимых компонентов гемостаза. На начальных этапах лечения ДВС-синдрома доза СЗП составляет 800-1600 мл/сут. В стадии гипокоагуляции доза СЗП увеличивается до 15-20 мл/кг/сут.
Эффективно применение криопреципитата, содержащего более высокие концентрации фибриногена, фактора Виллебранда, фибронектина и фактора ХIII. Криопреципитат показан при остром или молниеносном течении ДВС-синдрома.
Для восстановления объёма циркулирующей крови используются растворы кристаллоидов, альбумина и коллоидов. В I стадии применяется растворы гидроксиэтилкрахмала, что способствует улучшению микроциркуляции.
При снижении уровня гемоглобина ниже 70-80 г/л, гематокрита менее 25% показано переливание отмытых эритроцитов, а при их отсутствии — эритроцитной массы. Тромбоцитарный концентрат переливают при снижении уровня тромбоцитов до 50•109/л.
В стадии гипокоагуляции показано введение ингибиторов протеаз: контрикала или апротинина (трисалол). Контрикал в водят внутривенно в начальной дозе 350000 АтрЕ и затем в поддерживающей дозе 140000 АтрЕ каждые 4 ч до нормализации показателей гемостаза. Начальная доза трасилола составляет 500000 КИЕ и поддерживающая – 50000 КИЕ/ч.
Одним из компонентов терапии ДВС-синдрома является использование препаратов улучшающих микроциркуляцию и дезагрегантов.
Важным компонентом комплексной терапии ДВС-синдрома являются методы экстракорпоральной детоксикации. Методы экстракорпоральной детоксикации повышают эффективность лечения ДВС-синдрома и его осложнений, что позволяет снизить летальность.
Плазмаферез (ПФ) позволяет удалять продукты паракоагуляции, активаторы свёртывания, циркулирующие иммунные комплексы, крупномолекулярные соединения. ПФ необходимо проводить в максимально ранние сроки ДВС-синдрома. Для достижения клинического эффекта необходимо, чтобы объём удаляемой плазмы за один сеанс ПФ был не менее 50% объёма циркулирующей плазмы. Замещение должно производиться СЗП в объёме, равном объёму удаляемой плазмы.
Развитие ПОН и в частности острого повреждения почек является показанием для проведения заместительной почечной терапии (ЗПТ): гемодиализ, гемофильтрация, гемодиафильтрация. ЗПТ удаляет низко- и среднемолекулярные токсины, медиаторы воспаления, снижает объём жидкости, улучшает кислородтранспортную функцию крови.
Прогноз при ДВС-синдроме определяется степенью его выраженности, распространенностью и характером течения. Опыт современной медицины даёт основание говорить о возможности эффективного лечения больных с острыми вариантами ДВС-синдрома, однако летальность может составлять 50 %.
ДВС-синдром. Плазмаферез при ДВС-синдроме
Показания к плазмаферезу при ДВС-синдроме. Эффективность плазмафереза при ДВС
Выраженная клиническая картина гипокоагуляционного кровотечения и неэффективность проводимых трансфузионных, медикаментозных и других лечебных мероприятий должны стать показанием к началу обменного плазмафереза, даже если получить биохимические данные экстренно не представляется возможным.
Некоторые специалисты рекомендуют включать плазмаферез в комплексную интенсивную терапию после операций, осложнившихся большой кровопотерей, не дожидаясь клинической манифестации синдрома полиорганных нарушений.
Например, в отделении неотложной гематологической помощи на основании имеющихся сведений о стадийности течения реанимационного периода и патогенетических механизмов формирования синдрома ПОН и ДВС-синдрома у рожениц с массивной кровопотерей был предложен высокоэффективный эфферентный метод их профилактики. Способ основан на элиминации эндотоксинов и недоокисленных продуктов обмена из кровеносного русла на ранних стадиях реанимационного периода, а именно, не более чем через 12 ч после проведения радикального хирургического гемостаза. Детоксикация осуществляется проведением дискретного плазмафереза в объеме не менее 50 % ОЦП. Оптимальный объем плазмозамещения — 70 % ОЦП. Замещение проводится естественными коллоидами и гипертоническими растворами углеводов. Предпочтение авторы метода отдают донорской свежезамороженной плазме как источнику факторов свертывающей и противосвертывающей систем в их естественном соотношении, а также гуморальных факторов иммунитета.
Уменьшение количества СЗП в трансфузионной программе опасно усугублением ДВС-синдрома и развитием ятрогенного иммунодефицита. Проведение плазмафереза приводит к нормализации системной гемодинамики, нормализации хронометрических показателей гемостаза, восстановлению уровня фибриногена, снижению уровня маркеров ДВС-синдрома, купируется клиника отека мозга, восстанавливается темп диуреза. Проведение раннего ПФ способствует раннему переводу рожениц на самостоятельное дыхание, так как к концу процедуры восстанавливается микроциркуляция и ликвидируется гипоксия, что подтверждается улучшением показателей КОС и нормализацией сатурации. В дальнейшем во всех случаях использования раннего плазмафереза отмечено благоприятное послеродовое течение.
ДВС-синдром является обязательным компонентом раннего послеоперационного периода у пациентов, оперированных по поводу обширных аневризм аорты и других оперативных вмешательств, сопровождающихся кровопотерей до одного объема циркулирующей крови и более. При обширных реконструктивных вмешательствах на аорте и ее ветвях существует целый ряд предпосылок к развитию ДВС-синдрома непосредственно в послеоперационный период. Это такие факторы, как:
— массивная кровопотеря;
— массивное кровозамещение, синдром гомологичной крови;
— охлаждение организма во время операции;
— использование синтетических пластических материалов;
— хронический ДВС-синдром, сопутствующий исходному заболеванию;
— большой объем операции, высокая степень травматиза-ции тканей;
— интраоперационные гемодинамические сдвиги, нарушения микроциркуляции;
— использование методов вспомогательного и искусственного кровообращения и связанные с этим осложнения и др.
Все эти факторы указывают на высокий риск развития ДВС-синдрома и полиорганной дисфункции в раннем послеоперационном периоде. Одним из способов профилактики подчас фатальных осложнений может быть ЭК детоксикация в виде плазмафереза, выполненного в первые часы после хирургического вмешательства. Как показывает наш опыт, при своевременно начатом ПФ клинического результата можно достичь, если объем плазмозамещения составит 50—70 % ОЦП. При развернутой картине ДВС-синдрома необходимый объем удаляемой плазмы составляет один рассветный ОЦП. Замещение выполняется свежезамороженной донорской плазмой в соотношении не менее 1:1. Адекватная своевременная эфферентная терапия позволяет добиться дальнейшего благоприятного послеоперационного течения или снизить число дальнейших послеоперационных осложнений.
- Вернуться в оглавление раздела "Неотложная хирургия."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ДВС-синдрому на нашем сайте МедУнивер посвящен целый раздел. Однако и этот раздел будет неполным без упоминания об этом серьезном, подчас критическом состоянии, часто встречающемся в хирургической практике.
В предыдущей статье четко показано, что синдром диссеминированного внутрисосудистого свертывания, так же как синдром ПОН, всегда вторичен и может быть следствием самых различных состояний. В их числе опухоли, многие сосудистые заболевания, инфаркт миокарда, различная гинекологическая патология, хирургические кровотечения, инфекционные заболевания, врожденные пороки сердца, нарушения липидного обмена, гемолитические осложнения, массивные повреждения тканей (травмы, обширные операции, синдром длительного раздавливания и позиционное сдавление), острые воспалительные заболевания органов брюшной полости, сепсис, трансплантация органов, тканей, костного мозга, шок различной этиологии и многие другие.
В целом можно сказать, что развитие тяжелого ДВС-синдрома начинается тогда, когда имеется массивная длительная активация свертывания. В хирургии одной из главных причин развития этого состояния является массивная кровопотеря и, следовательно, массивная гемотрансфузия.
Кровопотеря сама по себе всегда сопровождается нарушениями гемокоагуляции по типу коагулопатии потребления. Инфузия крови на этом фоне сопровождается ускорением и генерализацией ДВС-синдрома, возникновением спонтанной кровоточивости. Больного, как правило, удается застать во второй фазе ДВС-синдрома — гипокоагуляции. Следствием нарушений в системе гемостаза является полиорганная недостаточность. По некоторым литературным данным, после кардиохирургических вмешательств признаки ДВС-синдрома выявляются у 40,9 % больных. В 72,2 % случаев кардиохирургический ДВС-синдром протекает с выраженными полиорганными нарушениями.
При острых формах ДВС-синдрома возможен внутрисосудистый гемолиз. Эритроциты, особенно донорские, потерявшие способность к деформации, разрезаются, фрагментируются нитями фибрина. Развивающаяся анемия имеет сложную природу и является следствием исходной кровопотери, внутрисосудистого гемолиза и продолжающегося кровотечения.
В наиболее общих чертах клинические проявления хирургического ДВС-синдрома складываются из ряда синдромов, в числе которых:
— тромботические явления;
— геморрагический синдром;
— нарушения микроциркуляции, приводящие к расстройству функции внутренних органов;
— анемический синдром;
— нарушения гемодинамики.
Эффективность лечения острого ДВС-синдрома и связанных с ним полиорганных расстройств в значительной степени зависит от быстроты его распознавания и адекватности проводимых лечебных мероприятий. Терапию ДВС-синдрома следует начинать, ориентируясь на клинические параметры, не дожидаясь результатов лабораторных анализов.
Известны работы, свидетельствующие об успешной терапии ДВС-синдрома, вызванного массивной гемотрасфузией (до 10—15 единиц эритроцитарной массы в течение суток), на фоне применения гепарина, антитромбина III, свежезамороженной плазмы, тромбо- и эритроконцетратов. В то же время весьма часто терапия, включающая массивное переливание СЗП (до 10 единиц в день), тромбоконцентрата, препаратов низкомолекулярного гепарина и антитромбина III оказывается неэффективной, и клиника коагулопатического кровотечения нарастает. В биохимических анализах при этом отмечается резкое снижение уровня фибриногена или афибриногенемия, тромбоцитопения, нарастает содержание продуктов деградации фибриногена и фибрина.
В этом отношении наиболее показательны случаи ДВС-синдрома у пациентов, оперированных по поводу обширных аневризм аорты. Кровопотеря в подобных случаях может достигать 7—12 л, а замещение составляет 15—20 единиц эритроцитарной массы в течение 7—12 ч. Выраженность коагулопатии в этих случаях особенно высока. Истечение крови наблюдается не только по дренажам, но и из краев раны, из проколов кожи, образуются обширные внугрикожные гематомы. Геморрагический синдром может иметь фатальный характер.
ДВС-синдром
ДВС-синдром – расстройство гемостаза, связанное с гиперстимуляцией и дефицитом резервов свертывающей системы крови, приводящее к развитию тромботических, микроциркуляторных и геморрагических нарушений. При ДВС-синдроме наблюдается петехиально-гематомная сыпь, повышенная кровоточивость, дисфункция органов, а в острых случаях – развитие шока, гипотонии, сильных кровотечений, ОДН и ОПН. Диагноз устанавливают по характерным признакам и лабораторным тестам системы гемостаза. Лечение ДВС-синдрома направлено на коррекцию гемодинамики и нарушений свертывающей системы (антиагреганты, антикоагулянты, ангиопротекторы, гемотрансфузии, плазмаферез и др.).
Общие сведения
ДВС-синдром (диссеминированное внутрисосудистое свертывание, тромбогеморрагический синдром) – геморрагический диатез, характеризующийся чрезмерным ускорением внутрисосудистой коагуляции, образованием рыхлых сгустков крови в микроциркуляторной сети с развитием гипоксических и дистрофически-некротических измерений в органах. ДВС-синдром представляет опасность для жизни пациента из-за риска возникновения обширных, плохо купируемых кровотечений и острой дисфункции органов (главным образом, легких, почек, надпочечников, печени, селезенки), имеющих обширную микроциркуляторную сеть.
ДВС-синдром можно рассматривать, как неадекватную защитную реакцию, направленную на ликвидацию кровотечения при повреждении кровеносных сосудов и изоляцию организма от пораженных тканей. Встречаемость ДВС-синдрома в различных отраслях практической медицины (гематологии, реаниматологии, хирургии, акушерстве и гинекологии, травматологии и др.) достаточно велика.
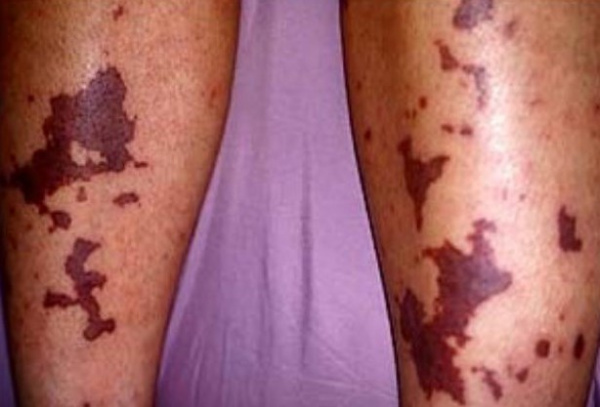
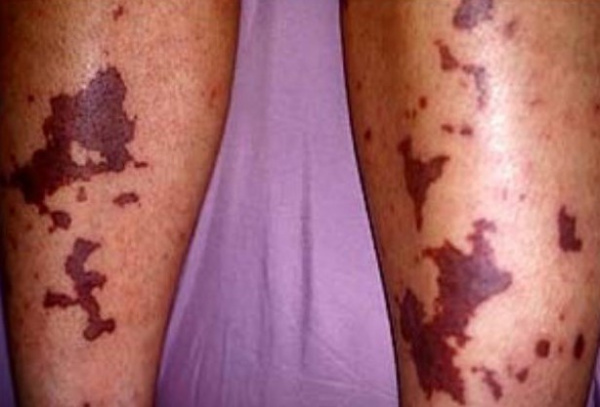
Причины ДВС-синдрома
ДВС-синдром развивается на фоне заболеваний, протекающих с повреждением тканей, эндотелия сосудов и клеток крови, сопровождаемых микрогемодинамическими нарушениями и сдвигом гемостаза в сторону гиперкоагуляции. Основной причиной ДВС-синдрома выступают септические осложнения бактериальных и вирусных инфекций, шок любой природы. ДВС-синдром часто сопутствует акушерской патологии - тяжелому гестозу, предлежанию и преждевременной отслойке плаценты, внутриутробной гибели плода, эмболии амниотической жидкостью, ручному отделению последа, атоническим маточным кровотечениям, а также операции кесарево сечение.
Развитие тромбогеморрагического синдрома могут инициировать метастазирующие злокачественные опухоли (рак легкого, рак желудка), обширные травмы, ожоги, серьезные хирургические вмешательства. Нередко ДВС-синдром сопровождает трансфузию крови и ее компонентов, трансплантацию тканей и органов, протезирование сосудов и клапанов сердца, применение искусственного кровообращения.
Способствовать возникновению ДВС-синдрома могут сердечно-сосудистые заболевания, протекающие с гиперфибриногенемией, увеличением вязкости и снижением текучести крови, механическим препятствием кровотоку атеросклеротической бляшкой. К ДВС-синдрому могут приводить прием медикаментов (ОК, ристомицина, диуретиков), острые отравления (например, ядом змеи) и острые аллергические реакции.
Патогенез
Несостоятельность гемостаза при ДВС-синдроме возникает за счет гиперстимуляции свертывающей и быстрого истощения антикоагулянтной и фибринолитической систем гемостаза.
Развитие ДВС-синдрома обуславливается различными факторами, которые появляются в кровяном русле и напрямую активируют процесс свертывания, либо осуществляют это через медиаторы, воздействующие на эндотелий. В качестве активаторов ДВС-синдрома могут выступать токсины, ферменты бактерий, околоплодные воды, иммунные комплексы, стрессовые катехоламины, фосфолипиды, снижение сердечного выброса и кровотока, ацидоз, гиповолемия и др.
Развитие ДВС-синдрома происходит с последовательной сменой 4-х стадий.
I - начальная стадия гиперкоагуляции и внутрисосудистой агрегации клеток. Обусловлена выбросом в кровь тканевого тромбопластина или веществ, обладающих тромбопластиноподобным действием и запускающих внутренний и внешний пути свертывания. Может продолжаться от нескольких минут и часов (при острой форме) до нескольких дней и месяцев (при хронической).
II - стадия прогрессирующей коагулопатии потребления. Характеризуется дефицитом фибриногена, кровяных пластинок и плазменных факторов вследствие их избыточного расхода на тромбообразование и недостаточного возмещения.
III - критическая стадия вторичного фибринолиза и выраженной гипокоагуляции. Отмечается разбалансировка гемостатического процесса (афибриногенемия, накопление патологических продуктов, разрушение эритроцитов) с замедлением свертывания крови (вплоть до полной неспособности к свертыванию).
IV - стадия восстановления. Наблюдаются либо остаточные очаговые дистрофические и некротические изменения в тканях тех или иных органов и выздоровление, либо осложнения в виде острой органной недостаточности.

Классификация ДВС-синдрома
По выраженности и скорости развития ДВС-синдром может быть острым (в т.ч., молниеносным), подострым, хроническим и рецидивирующим. Острая форма тромбогеморрагического синдрома возникает при массивном выбросе в кровь тромбопластина и ему подобных факторов (при акушерской патологии, обширных операциях, травмах, ожогах, синдроме длительного сдавления тканей). Характеризуется ускоренной сменой стадий ДВС-синдрома, отсутствием нормального защитного антикоагуляционного механизма. Подострая и хроническая формы ДВС-синдрома связаны с обширным изменением поверхности эндотелия сосудов (например, вследствие атеросклеротических отложений), выступающим в роли активирующей субстанции.
ДВС-синдром может проявляться локально (ограниченно, в одном органе) и генерализованно (с поражением нескольких органов или всего организма). По компенсаторному потенциалу организма можно выделить компенсированный, субкомпенсированный и декомпенсированный ДВС-синдром. Компенсированная форма протекает бессимптомно, микросгустки лизируются за счет усиления фибринолиза, факторы свертывания восполняются из резервов и путем биосинтеза. Субкомпенсированная форма проявляется в виде гемосиндрома средней степени тяжести; декомпенсированная - характеризуется каскадными реакциями реактивного фибринолиза, несостоятельностью коагуляционных процессов, несворачиваемостью крови.
ДВС-синдром может протекать с одинаковой активностью прокоагулянтного и сосудисто-тромбоцитарного звеньев гемостаза (смешанный патогенез) или с преобладанием активности одного из них.
Симптомы ДВС-синдрома
Клинические проявления ДВС-синдрома определяются темпом развития и распространенностью поражения, стадией процесса, состоянием компенсаторных механизмов, наслоением симптомов заболевания-индуктора. В основе ДВС-синдрома лежит комплекс тромбогеморрагических реакций и дисфункции органов.
При острой манифестной форме быстро (за несколько часов) развивается генерализованный ДВС-синдром, для которого характерно шоковое состояние с гипотонией, потерей сознания, признаками отека легких и острой дыхательной недостаточности. Гемосиндром выражается нарастающей кровоточивостью, массивными и профузными кровотечениями (легочными, маточными, носовыми, желудочно-кишечными). Характерно развитие очагов ишемической дистрофии миокарда, панкреонекроза, эрозивно-язвенного гастроэнтерита. Молниеносная форма ДВС-синдрома свойственна эмболии околоплодными водами, когда коагулопатия стремительно (в течение нескольких минут) переходит в критическую стадию, сопровождаясь кардиопульмонарным и геморрагическим шоком. Летальность матери и ребенка при этой форме ДВС-синдрома приближается к 80%.
Подострая форма ДВС-синдрома носит локальный характер с более благоприятным течением. Незначительный или умеренный гемосиндром проявляется петехиальной или сливной геморрагической сыпью, синяками и гематомами, усиленной кровоточивостью из мест инъекций и ран, кровотечениями из слизистых оболочек (иногда - «кровавый пот», «кровавые слезы»). Кожа приобретает бледный вид, мраморность, становится холодной на ощупь. В ткани почек, легких, печени, надпочечников, ЖКТ развиваются отек, резкое полнокровие, внутрисосудистая коагуляция, сочетание очагов некроза и множественных кровоизлияний. Самая распространенная - хроническая форма ДВС-синдрома часто имеет бессимптомное течение. Но по мере прогрессирования фонового заболевания нарастают проявления геморрагического диатеза и нарушения функции органов.
ДВС-синдром сопровождается астеническим синдромом, плохим заживлением ран, присоединением гнойной инфекции, развитием келоидных рубцов. К осложнениям ДВС-синдрома относятся гемокоагуляционный шок, острая дыхательная недостаточность, ОПН, некроз печени, язвенная болезнь желудка, инфаркт кишечника, панкреонекроз, ишемический инсульт, острая постгеморрагическая анемия.

Диагностика ДВС-синдрома
Для установления ДВС-синдрома необходимы тщательный сбор анамнеза с поиском этиологического фактора, анализ клинической картины и данных лабораторных исследований (общего анализа крови и мочи, мазка крови, коагулограммы, паракоагуляционных проб, ИФА). Важно оценить характер кровоточивости, уточнить стадию коагулопатии, отражающую глубину нарушений.
Для ДВС-синдрома характерна петехиально-гематомная кровоточивость, геморрагии сразу из нескольких мест. При малосимптомном течении гиперкоагуляция выявляется только лабораторными методами. К обязательным скрининговым тестам относятся определение количества тромбоцитов, фибриногена, АПТВ, протромбинового и тромбинового времени, времени свертывания по Ли-Уайту. Исследование маркеров внутрисосудистого свертывания - РФМК и ПДФ, D-димера методом ИФА и паракоагуляционных проб помогает подтвердить ДВС-синдром.
Критериями ДВС-синдрома являются наличие фрагментированных эритроцитов в мазке крови, дефицит тромбоцитов и фибриногена, повышение концентрации ПДФ, падение активности антитромбина III в сыворотке крови, удлинение АПТВ и тромбинового времени, отсутствие образования или нестабильность сгустка или in vitro. Выполняется оценка функционального состояния «шоковых органов»: легких, почек, печени, сердечно-сосудистой системы, головного мозга. ДВС-синдром необходимо дифференцировать от первичного фибринолиза, других коагулопатических синдромов.
Лечение ДВС-синдрома
Успех лечения ДВС-синдрома возможен при его ранней диагностике. Активные лечебные мероприятия требуются при выраженной симптоматике в виде кровотечений и органной недостаточности. Больных с ДВС-синдромом следует госпитализировать в ОРИТ и при необходимости проводить ИВЛ, активную противошоковую терапию. При малосимптомном ДВС-синдроме основным представляется лечение фоновой патологии, коррекция параметров гемодинамики и функциональных нарушений органов.
Острый ДВС-синдром требует срочного устранения его первопричины, например, экстренного родоразрешения, гистерэктомии - при акушерской патологии или антибиотикотерапии – при септических осложнениях. Для ликвидации гиперкоагуляции показано введение антикоагулянтов (гепарина), дезагрегантов (дипиридамола, пентоксифиллина), фибринолитиков. Больные должны находиться под постоянным динамическим контролем показателей гемостаза.
В качестве заместительной терапии при ДВС-синдроме применяются трансинфузии свежезамороженной плазмы, тромбоцитарной или эритроцитарной массы (при падении уровня тромбоцитов или Hb); криопреципитата (при сердечной недостаточности), физраствора. При кровотечениях, угрожающих жизни, возможно назначение антифибринолитических средств (аминокапроновой к-ты, ингибиторов протеаз). При кожных геморрагиях и ранах накладываются повязки с этамзилатом, гемостатическая губка.
По показаниям применяют кортикостероиды, оксигенотерапию, плазмаферез. Для восстановления микроциркуляции и нарушенных функций органов назначают ангиопротекторы, ноотропные препараты, посиндромную терапию. В случае ОПН проводят гемодиализ, гемодиафильтрацию. При хроническом ДВС-синдроме целесообразно использование дезагрегантов, вазодилататоров, в послеоперационном периоде - гепаринотерапии.
Прогноз и профилактика ДВС-синдрома
Прогноз ДВС-синдрома - вариативный, зависит от основного, этиологически значимого заболевания, тяжести нарушений гемостаза и своевременности начатого лечения. При остром ДВС-синдроме не исключен летальный исход в результате некупируемой большой кровопотери, развития шока, ОПН, острой дыхательной недостаточности, внутренних кровоизлияний. Предупреждение ДВС-синдрома заключается в выявлении пациентов группы риска (особенно, среди беременных и лиц пожилого возраста), лечении фонового заболевания.
Читайте также:
