ЭхоКГ при васкулопатии трансплантата сердца
Добавил пользователь Morpheus Обновлено: 27.01.2026
Трансплантация сердца – это шанс для пациентов, имеющих любое из следующих состояний и имеющих высокий риск смерти, и серьезные симптомы, несмотря на оптимальное использование препаратов и медицинской аппаратуры:
Сердечная недостаточность Сердечная недостаточность (СН) Сердечная недостаточность (СН) – синдром дисфункции желудочков сердца. Левожелудочковая недостаточность приводит к развитию одышки и быстрой утомляемости, правожелудочковая недостаточность –. Прочитайте дополнительные сведенияТрансплантация также может быть показана пациентам, которые
Не могут быть отлученными от временных сердечно-вспомогательных аппаратов после инфаркта миокарда или нетрансплантационных кардиохирургических операций
Имеют сердечные осложнения заболеваний легких, требующие трансплантации легких
Единственным абсолютным противопоказанием для трансплантации сердца является
Легочная гипертензия, которая не реагирует на предоперационное лечение
Относительные противопоказания включают органную недостаточность (например, легочную, почечную, печеночную) и локальные или системные инфильтративные нарушения (например, саркому сердца, амилоидоз).
Желудочковый аппарат вспомогательного кровообращения: переходной этап к трансплантации и целевое лечение
В последние годы имплантируемые желудочковые аппараты вспомогательного кровообращения значительно улучшились, и эти устройства используются для лечения некоторых пациентов, которым ранее требовалась бы трансплантация сердца, и пациентов, для которых трансплантация противопоказана. Эти устройства обычно используются для оказания помощи в работе левого желудочка в качестве промежуточной меры (переходный этап к трансплантации) или долгосрочного (целевого) лечения у пациентов, не являющихся кандидатами на трансплантацию. Устройства становятся все более компактными, имеющими целью имплантации батарейного отсека под кожу и использования индукционной зарядки. Проблему представляет инфекция, которая может возникать в месте введения под кожу канюлей. Тем не менее, в настоящее время имеются данные о пациентах, которые пережили операцию и хорошо себя чувствуют в течение нескольких лет после того, как эти устройства были имплантированы.
Методика
Донорское сердце хранится в условиях гипотермии. Оно должно быть трансплантировано в течение 4–6 часов. Реципиент находится на аппарате искусственного кровообращения; сердце реципиента удаляют, сохраняя in situ заднюю стенку правого предсердия. Затем сердце донора трансплантируют ортотопически (в нормальном положении) с формированием аортальных анастомозов, анастомозов легочных артерий и вен; простой анастомоз соединяет оставшуюся заднюю стенку предсердия с донорским органом. Использование in vitro насосной системы, изменяющей метаболизм клеток донорского сердца и, следовательно, продлевающей его жизнеспособность до пересадки на более, чем на 4-6 часа, находится в стадии изучения.
Схемы иммуносупрессивной терапии разнообразны, но подобны тем схемам, которые применяются при трансплантации почек Методика и трансплантация печени Методика (например, моноклональные антитела к рецепторам IL-2, ингибиторы кальциневрина, кортикостероиды—см. таблицу Иммуносупрессанты, используемые для лечения реакции отторжения трансплантата [Immunosuppressants Used to Treat Transplant Rejection] Иммуносупрессанты, применяемые при лечении реакции отторжения трансплантата ).
Осложнения при трансплантации сердца
Отторжение
У 50–80% пациентов наблюдается по крайней мере 1 эпизод отторжения Отторжение Трансплантатами могут быть собственные ткани пациента (аутотрансплантанты; например, кости, костный мозг и трансплантаты кожи) Генетически идентичная (сингенная [от монозиготных близнецов]). Прочитайте дополнительные сведения (в среднем 2–3); у большинства пациентов он протекает бессимптомно, но у примерно 5% развиваются дисфункция легочной вентиляции или предсердные аритмии. Максимальное число случаев острого отторжения приходится на 1-й месяц, их число снижается в следующие 5 месяцев и стабилизируется к году.
Факторы риска отторжения включают:
Женщина или чернокожий донор
Несовпадение по главному комплексу гистосовместимости человека
Возможно, цитомегаловирусная инфекция
Поскольку повреждение трансплантата может быть необратимым и катастрофическим, один раз в год проводят биопсию эндомиокарда; при этом в образцах определяют степень и распространенность инфильтратов клеток мононуклеаров и наличие поврежденных миоцитов. При дифференциальной диагностике исключают ишемию вокруг операционной области, цитомегаловирусную инфекцию, идиопатическую В-клеточную инфильтрацию (эффект Quilty).
Слабая степень отторжения (стадия 1) без существенных клинических проявлений не требует никакого лечения; средняя и тяжелая степени отторжения (стадия от 2 до 4) или слабая степень с клиническими проявлениями лечатся с помощью импульсной терапии кортикостероидами (500 мг или 1 г ежедневно в течение нескольких дней) и антитимоцитарным глобулином при необходимости (см. таблицу Признаки отторжения трансплантата сердца по категориям [Manifestations of Heart Transplant Rejection by Category] Проявления отторжения трансплантата сердца по категориям* ). Шкала оценок отклонения отображает прогрессирующие уровни изменений при гистологическом исследовании образцов биопсии.
Васкулопатия аллотрансплантата сердца
Основное осложнение при трансплантации сердца – поражение кровеносных сосудов сердечного аллотрансплантата, форма атеросклероза, при которой происходит диффузное сужение или облитерация просвета сосудов (у 25% пациентов). Это полиэтиологическое заболевание, и его развитие зависит от возраста донора, холодовой или реперфузионной ишемии, дислипидемии, применения иммуносупрессантов, хронического отторжения и вирусной инфекции (аденовирус у детей, цитомегаловирус у взрослых).
С целью ранней диагностики во время эндомиокардиальной биопсии часто проводят стресс-тест или коронарную ангиографию с внутрисосудистым ультразвуковым исследованием или без него.
Лечение заключается в агрессивном снижении уровня липидов Лечение Дислипидемией называют либо повышение уровней холестерина, триглицеридов (ТГ) или того и другого, либо низкий уровень холестерина липопротеинов высокой плотности в плазме, что способствует. Прочитайте дополнительные сведенияПрогноз при трансплантации сердца
Однолетняя выживаемость после трансплантации сердца составляет 85–90%, а ежегодная смертность в дальнейшем – около 4%.
Предтрансплантационные предикторы 1-летней смертности включают в себя
Потребность в предоперационной вентиляции или аппарате для поддержки функции левого желудочка
Реципиент или донор женского пола
Другие диагнозы, кроме сердечной недостаточности или ишемической болезни сердца
Посттрансплантационные прогностические факторы включают:
Повышение уровней С-реактивного белка и тропонина
Причиной смерти в течение первого года наиболее часто является острое отторжение или инфицирование; после первого года –васкулопатия аллотрансплантата сердца или лимфопролиферативные заболевания.
У реципиентов, которым было пересажено сердце и которые прожили > 1 года, отмечаются отличные показатели функционального статуса; возможность физических упражнений ниже нормы, но достаточна для ежедневной активности и может повыситься с течением времени в связи с симпатической реиннервацией. Более 95% пациентов достигает I функционального класса по классификации Нью-Йоркской ассоциации кардиологов (NYHA) Классификация выраженности хронической сердечной недостаточности Нью-Йоркской кардиологической ассоциации (NYHA) , и > 70% возвращаются к работе на полный рабочий день.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
2.4 Инструментальная диагностика
3. Комплексное исследование функции внешнего дыхания (исследование кривой "поток-объем", определение объема закрытия, остаточного объема легких, легочной диффузии, внутригрудного объема и фракций общей емкости легких, сопротивления дыхательных путей);
Степень доказанности: C.
4. МРТ головного мозга;
Степень доказанности: C.
5. Рентгеновская спиральная компьютерная томография органов грудной клетки с внутривенным контрастированием;
Степень доказанности: C.
6. Рентгеновская спиральная компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным контрастирование;
Степень доказанности: C.
7. Рентгенография грудной клетки непосредственно перед переводом больного в операционную;
Степень доказанности: C.
Степень доказанности: C.
9. Пробы с физической нагрузкой: максимальное потребление кислорода VO2max, тест 6-ти минутной ходьбы;
Степень доказанности: C.
10. Эндомиокардиальная биопсия у реципиентов трансплантированного сердца выполняется в рамках обязательного планового обследования и у больных с клиническими признаками дисфункции сердечного трансплантата;
Степень доказанности: C.
11. Коронароангиографическое исследование у больных с клиническими признаками ишемической кардиопатии с целью выявления возможностей реваскуляризации миокарда как способа лечения сердечной недостаточности, а также у реципиентов трансплантированного сердца в рамках обязательного планового обследования и у больных с клиническими признаками дисфункции сердечного трансплантата;
Степень доказанности: C.
12. Катетеризация правых отделов сердца и исследование показателей центральной гемодинамики с определением показателей сердечного выброса, сердечного индекса, давления в полостях сердца, давления в легочной артерии, центрального венозного давления, сопротивления легочных сосудов, транспульмонарного градиента давления);
Степень доказанности: C.
Класс IIa (относительные показания)
1 Медикаментозные пробы при ЭКГ (дополнительно к основной ЭКГ);
Степень доказанности: C.
2 Ортостатическая проба при ЭКГ (дополнительно к основной ЭКГ);
Степень доказанности: C.
Степень доказанности: C.
4 Ультразвуковое исследование брюшной полости и почек;
Степень доказанности: C.
5 Перфузионная сцинтиграфия миокарда с Tc-99м-тетрофосмином синхронизированная с ЭКГ;
Степень доказанности: C.
Степень доказанности: C.
7 Холтеровское мониторирование при длительности мониторирования до 24 часов;
8 Исследование поздних потенциалов сердца;
Степень доказанности: C.
9 УЗ-допплерография в импульсном режиме парных сосудов (артерий или вен);
Степень доказанности: C.
10 УЗ-допплерография в дуплексном режиме парных сосудов (артерий или вен);
Степень доказанности: C.
11 УЗИ брюшной аорты или нижней полой вены;
Степень доказанности: C.
12 Транскраниальная УЗ-допплерография;
Степень доказанности: C.
13 УЗ-допплерография магистральных сосудов внутренних органов;
Степень доказанности: C.
14 Рентгеновская спиральная компьютерная томография головного мозга;
Степень доказанности: C.
Катетеризация правых отделов сердца у потенциальных реципиентов сердечного трансплантата.
Катетеризация правых отделов сердца выполняется с целью верификации снижения насосной функции миокарда, проведения дифференциального диагноза и определения показателей гемодинамики и сосудистого сопротивления в малом круге кровообращения. Исследование проводится всем больным перед включением в лист ожидания трансплантации сердца.
Рекомендации для диагностической катетеризации правых отделов сердца
Всем потенциальным реципиентам сердечного трансплантата следует выполнять зондирование правых отделов сердца. Периодичность выполнения зондирования определяется индивидуально с учетом клинических показателей. У больных с механической поддержкой кровообращения и легочной гипертензией зондирование правых отделов сердца выполняется каждые 3 - 6 месяцев. Высокое значение показателя легочного сосудистого сопротивления, рефрактерного к медикаментозной терапии, является противопоказанием для трансплантации сердца. У таких больных используются устройства механической поддержки кровообращения. Исследования [8, 9] показали, что имплантация устройств механической поддержки кровообращения может сопровождаться снижением показателя сосудистого легочного сопротивления через 3 - 6 месяцев, однако в некоторых случаях эффективное снижение значений этого показателя может наблюдаться уже в течение первого месяца.
1. Катетеризация правых отделов сердца должна быть проведена всем кандидатам при включении в лист ожидания трансплантации сердца;
Степень доказанности: C.
2. Катетеризация правых отделов сердца должна проводиться с интервалом от 3 до 6 месяцев для больных, поставленных в лист ожидания, с обратимой легочной гипертензией или прогрессирующей сердечной недостаточностью;
Степень доказанности: C.
3. При выявлении показателей систолического давления в легочной артерии > 50 мм рт.ст., транспульмонарного градиента (ТПГ) > 15 мм рт.ст., показателя легочного сосудистого сопротивления (ЛСС) > 5 единиц Вуда, необходимо повторить измерения на фоне действия легочных вазодилятаторов (оксид азота, силденафил и др.);
Степень доказанности: C.
4. Катетеризация правых отделов сердца выполняется у больных с необходимостью мониторирования эффективности и безопасности медикаментозной терапии вазодилятаторами, диуретиками и средствами с инотропным действием.
Степень доказанности: C.
Диагностические критерии периоперационной дисфункции сердечного трансплантата
1. Критерии удовлетворительной сократительной функции сердечного трансплантата: ДПП 8 - 12 мм рт.ст., ДЗЛА 12 - 15 мм рт.ст., СИ >= 2,5 л/мин/м2 на фоне применения допамина и/или добутамина в дозировке 5 мкг/кг/мин ФИПЖ >= 30%, индексированный конечно-диастолический объем (ИКДОПЖ) = 55%; отсутствие гипокинезии свободной стенки правого желудочка (ПЖ), амплитуда движения фиброзного кольца трикуспидального клапана в направлении верхушки ПЖ >= 2,0 см (по данным транспищеводного или трансторакального ЭХОКГ исследования);
Степень доказанности: C.
2. Критерии нарушения сократительной функции сердечного трансплантата: ДПП > 12 мм рт.ст. и/или ДЗЛА > 15 мм рт.ст., необходимость применения допамина и/или добутамина в дозировке более 5 мкг/кг/мин и/или адреналина (независимо от величины дозировки) с целью поддержания СИ > 2,5 л/мин/м2. Умеренно выраженные нарушения насосной функции (дисфункции) сердечного трансплантата: потребность в допамине и/или добутамине в дозировках от 5 до 10 мкг/кг/мин без или в комбинации с адреналином ( < 75 нг/кг/мин); Значимое нарушение - необходимость применения допамина и/или добутамина в дозировках 10 - 20 мкг/кг/мин и адреналина в дозировках 75 - 200 нг/кг/мин; Выраженное нарушение - дозировка вводимого допамина и/или добутамина >20 мкг/кг/мин и адреналина > 200 нг/кг/мин и необходимость применения различных методов вспомогательного кровообращения;
Степень доказанности: C.
3. Критерии бивентрикулярного нарушения сократительной функции сердечного трансплантата: ДПП > 12 мм рт.ст., ДЗЛА > 15 мм рт.ст., необходимость применения допамина и/или добутамина в дозировке более 5 мкг/кг/мин и/или адреналина (независимо от величины дозировки) с целью поддержания СИ > 2,5 л/мин/м2, ДПП/ДЗЛА 0,8 - 1,0; ФИЛЖ < 55% (транспищеводное или трансторакальное ЭХОКГ исследование); ФИПЖ < 30%, ИКДОПЖ >130 мл/м2 (термодилюционная волюметрия); гипокинезия свободной стенки ПЖ, уменьшение амплитуды движения фиброзного кольца трикуспидального клапана (менее 2,0 см) в направлении верхушки ПЖ (транспищеводное или трансторакальное ЭХОКГ исследование);
Степень доказанности: C.
4. Критерии нарушения сократительной функции сердечного трансплантата по правожелудочковому типу: ДПП > 12 мм рт.ст., ДЗЛА < 15 мм рт.ст., ДПП/ДЗЛА >1,0, необходимость применения допамина и/или добутамина в дозировке более 5 мкг/кг/мин и/или адреналина (независимо от величины дозировки) с целью поддержания СИ > 2,5 л/мин/м2; ФИЛЖ >= 55% (транспищеводное или трансторакальное ЭХОКГ исследование); ФИПЖ < 30%, ИКДОПЖ >130 мл/м2; гипокинезия свободной стенки ПЖ, уменьшение амплитуды движения фиброзного кольца трикуспидального клапана (менее 2,0 см) в направлении верхушки ПЖ (транспищеводное или трансторакальное ЭХОКГ исследование);
Степень доказанности: C.
Степень доказанности: C.
6. При диагностике гемодинамических вариантов дисфункции сердечного трансплантата необходимо исключать возможные механические причины, приводящие к нарушению функционирования правого и/или левого желудочков сердца и вызывающие стенозирование (сужение) в области анастомозов верхней и нижней полых вен (при бикавальной методике выполнения ТС), легочной артерии, левого предсердия или аорты. В связи с этим при проведении дифференциальной диагностики патогенеза нарушений функционирования сердечного трансплантата необходимо полноценное интраоперационное чреспищеводное эхокардиографическое исследование для выявления возможных анатомических дефектов;
Степень доказанности: C.
Рекомендации по послеоперационному мониторингу реципиентов пересаженного сердца
1. Периоперационный мониторинг реципиентов сердца должен включать в себя непрерывный мониторинг ЭКГ, послеоперационные ЭКГ в 12 отведениях, инвазивный мониторинг антериального давления, давления в правом предсердии или центрального венозного давления; давления заклинивания легочной артерии, периодическое измерение сердечного выброса, измерение сатурации O2; интраоперационная чреспищеводная эхокардиография, постоянная оценка диуреза.
Степень доказанности: C.
Регулярные клинические обследования и консультации больных после трансплантации сердца
1. Пожизненное наблюдение центром трансплантации всех больных после трансплантации сердца необходимо в связи; 1) с наличием риска острого или хронического отторжения трансплантанта; 2) необходимостью в подборе дозировок, мониторировании эффективности и безопасности иммуносупрессивной терапии; 3) высоким риском развития инфекционных осложнений и новообразований 4) развитием сопутствующих заболеваний и осложнений, требующих вмешательства или коррекции терапии;
Степень доказанности: C.
2. При длительном наблюдении больных после трансплантации сердца требуется мультидисциплинарный подход с участием врачей-хирургов, кардиологов, физиологов, диетологов, психотерапевтов и др. Сами больные и лечащие врачи должны сознавать, что после трансплантации сердца требуется пожизненное наблюдение специалистов;
Степень доказанности: C.
3. Частота повторных визитов зависит от особенностей послеоперационного периода и количества времени, прошедшего после вмешательства;
Степень доказанности: C.
4. При неосложненном течении послеоперационного периода повторные посещения врача следует выполнять через каждые 10 дней (раз в неделю) в течение первого месяца, каждые 2 недели в течение 2-го месяца, ежемесячно в течение 1-го года и каждые 3 - 6 месяцев в последующее время после трансплантации;
Степень доказанности: C.
5. Повторные консультации и обследования могут проводиться чаще в случае развития осложнений или при наличии особенностей клинического или психосоциального статуса больного;
Степень доказанности: C.
6. Наблюдение больных в отдаленном периоде после трансплантации сердца осуществляется специалистами центра трансплантации в сотрудничестве с местными органами здравоохранения и социальной поддержки;
Степень доказанности: C.
7. Местные органы здравоохранения должны проинформировать центр трансплантации в случаях:
- любой госпитализации больного в лечебное учреждение;
- изменений медикаментозной терапии, включая назначение любых антибактериальных, противогрибковых или противовирусных лекарственных средств;
- развития артериальной гипотонии или снижения уровней систолического АД более чем на 20 мм рт.ст. по сравнению с прежними уровнями
- увеличения ЧСС более чем на 10 мин-1;
- подъема температуры до 38 °C в течение 2 суток;
- снижения веса более чем на 0.9 - 1.0 кг в неделю или на 2 - 2.5 кг в течение неопределенного периода времени;
- выполнения любых хирургических вмешательств;
- появления жалоб на одышку;
- пневмонии или любых инфекционных заболеваний органов дыхания;
- появления болей в грудной клетке;
- снижения показателя объема форсированного выдоха за 1 сек более чем на 10%
- появления тошноты, рвоты или диареи;
- клинических признаков нарушения мозгового кровообращения, обморока или изменений когнитивного (ментального) статуса.
Степень доказанности: C.
1. Помимо плановых амбулаторных визитов реципиенты донорского сердца должны быть в плановом порядке госпитализированы для проведения детального клинического обследования каждые 1 - 2 года (Таблица 3);
Степень доказанности: B.
2. Основными задачами регулярной плановой госпитализации больных после трансплантации сердца являются выявление признаков отторжения трансплантата и возможных нежелательных событий. План обследования должен включать:
- полное физикальное обследование;
- анализ изменений в клинических назначениях и выявление возможной связи изменений в назначениях с изменением клинического статуса больного;
- общий и биохимический анализы крови;
- коронароангиографическое исследование с внутрикоронарным ультразвуковым исследованием (каждые 1 - 2 года);
- проведение эндомиокардиальной биопсии согласно графику, представленному в таблице;
- проведение обучения в рамках образовательных программ для больных, их родственников и медицинских работников разных специальностей, работающих с пациентом;
Степень доказанности: B.
3. Помимо плановых обследований, больным настоятельно рекомендуется обращаться в центр трансплантации по всем вопросам, связанным с состоянием здоровья;
ЭхоКГ при васкулопатии трансплантата сердца


- НИО хирургии аорты, коронарных и периферических артерий
- НИО новых хирургических технологий
- НИО хирургической аритмологии
- НИО эндоваскулярной хирургии
- НИО сосудистой и гибридной хирургии
- НИО онкологии и радиотерапии
- НИО ангионеврологии и нейрохирургии
- НИО анестезиологии и реаниматологии
- НИО лучевой и инструментальной диагностики
- Состав совета по защите докторских и кандидатских диссертаций
- Требования к соискателям
- Соискатели
- Апелляции
- ГОСТ по оформлению диссертации и автореферата
- Контакты совета
- Генеральный директор Центра
- Руководство Центра
- Миссия
- История
- Мероприятия
- Фотопроекты
- Истории пациентов
- Нормативные документы
- Структура отдела
- Организационно-методическая работа с регионами
- Развитие телемедицинских технологий
- Кадровая политика и повышение квалификации
- Публичный отчет
- Устав и регистрационные документы
- Лицензии
- Публичный отчет
- Сведения о медицинских работниках
- План развития Центра
- Политика обработки персональных данных
- Охрана труда
- Политика в области охраны труда
- Противодействие коррупции
- Учетная политика
Сложнейшая операция, требующая высочайшегоо мастерства хирургов и полной совместимости реципиента и донора
На базе НМИЦ им. акад. Е.Н. Мешалкина проводятся сложнейшие и уникальные операции по пересадке сердца. Трансплантация сердца - дорогостоящее лечение, требующее от медицинского персонала высочайшей квалификации и многолетнего опыта. Для проведения хирургического вмешательства необходима полная совместимость тканей пациента и донорского органа. Недостаток донорских органов обуславливает ограниченное количество этого вида оперативного лечения. Но несмотря на это, надежда и желание жить никогда не угасает в людях, и мы готовы помогать таким пациентам. В нашей клинике создана целая команда врачей, которая занимается лечением пациентов с трансплантированным сердцем.
ПОКАЗАНИЯ ДЛЯ ТРАНСПЛАНТАЦИИ
К необходимости операции по пересадке сердца чаще всего приводит дилатационная кардиомиопатия, когда размеры сердца начинают увеличиваться, сердечная мышца "растягивается", а сокращения ее становятся все слабее. Второе место среди заболеваний, приводящих к необходимости пересадки сердца, занимает ишемическая болезнь сердца, часто приводящая к образованию инфарктов миокарда с последующими рубцовыми полями, что приводит к потере сердцем способности выполнять эффективные сокращения. Небольшой процент больных, которым показана пересадка сердца, составляют пациенты с клапанными пороками.
Для того чтобы продлить жизнь пациента до того времени, пока будет найдено донорское сердце, у него приходится применить, по выражению трансплантологов, «мост», т.е. ту или иную методику, улучшающую кровообращение. Первая из них - «фармакологический мост» - интенсивное использование мощных кардиотонических средств. Часто эти лекарственные средства через некоторое время уже не в состоянии обеспечить нужный уровень кровообращения в организме, тогда приходится переходить к «механическому мосту» - применению различных механических насосных устройств - искусственное сердце, которое частично, а иногда и полностью обеспечивает кровообращение.
ЧТО НЕОБХОДИМО ДЛЯ ТРАНСПЛАНТАЦИИ
Для того чтобы не произошло отторжения донорского органа необходимо соблюдение ряда правил. Прежде всего необходимо чтобы донор и реципиент были схожи по антигенам гистосовместимости, которые у человека объединены в систему HLA (Human leucocyte antigens). По результатам теста на совместимость производится подбор наиболее подходящих донора и реципиента.
При помощи второго теста (cross-match) определяются потенциально опасные антитела у реципиента, которые могут повредить трансплантат. Если в крови реципиента их много, высока вероятность отторжения донорского органа.
ТЕРАПИЯ ПОСЛЕ ТРАНСПЛАНТАЦИИ
Из-за реакции иммунной системы организма на чужеродный орган, после трансплантации сердца необходим прием препаратов, не позволяющих организму отторгнуть донорское сердце. Человеку с трансплантированным сердцем необходимо регулярно поддерживать связь с лечащими врачами, прежде всего кардиологами. Специалисты НМИЦ в клинике и после выписки будут следить за вашим состоянием здоровья, делать тесты, чтобы убедиться в том, что ваше новое сердце работает правильно. В первый год после операции, необходимо относиться к своему здоровью с особой осторожностью, чтобы избежать инфекционных осложнений.
В большинстве случаев, люди хорошо себя чувствуют после операции. Могут ходить на работу и вести активный образ жизни. В Клинике им. акад. Е.Н. Мешалкина ежегодно проводятся несколько трансплантаций. Опытные специалисты проводят эту сложнейшую процедуру на высшем уровне. Заботливый медицинский персонал помогает сделать период ожидание донорского органа и послеоперационный период максимально комфортным для пациента.
Легочная гипертензия при саркоидозе органов дыхания

1Кафедра пульмонологии ФПО, 2НИИ пульмонологии, 3кафедра рентгенологии и медицинской радиологии. Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова Минздрава РФ
Понятие «легочная гипертензия» включает группу заболеваний, характеризующихся прогрессирующим повышением легочного сосудистого сопротивления, что приводит к развитию правожелудочковой недостаточности с последующим формированием «легочного сердца». Проблема легочной гипертензии (ЛГ) представляет особый интерес в связи с улучшением ее диагностики при различных заболеваниях.
Легочная гипертензия, ассоциированная с саркоидозом (ЛГАС), хорошо известное осложнение саркоидоза, которое обычно возникает при неблагоприятном прогрессирующем течении саркоидоза органов дыхания (СОД) 3. Распространенность ЛГАС среди больных СОД, по мнению ряда исследователей, колеблется от 5 до 74% [15], что можно объяснить отсутствием однородной группы обследуемых и применением различных методов исследования. ЛГАС выявляется у 74% больных СОД, которым необходима трансплантация [5]. Пятилетняя выживаемость пациентов с ЛГАС составляет 59% [6], а смертность в 10 раз выше по сравнению с больными СОД без ЛГ [7]. ЛГ была выявлена у 47% больных СОД с одышкой и нарушениями вентиляционной способности легких [8]. Вместе с тем имеются публикации о выявлении ЛГ у больных СОД при отсутствии фиброза легких [9, 10]. Возможно, это объясняется особенностями патофизиологии ЛГАС. Кроме общих патогенетических механизмов (гипоксия, вазореактивность, ремоделирование сосудистого русла, миокардиальная дисфункция, портопульмональная гипертензия, легочная веноокклюзионная болезнь, сосудистая рестрикция), участвующих в формировании ЛГ при различных заболеваниях легких, выделяют специфические механизмы, которые имеют место только при СОД. К их числу относят внешнюю компрессию легочных сосудов увеличенными лимфатическими узлами средостения или фиброзными изменениями и сосудистую васкулопатию вследствие поражения стенок сосудов саркоидными гранулемами. Саркоидозные гранулемы выявляют в стенках сосудов у 69-100% больных с ЛГАС. В так называемый «васкулит» могут вовлекаться все слои сосудистой стенки, преимущественно поражаются лимфатические сосуды (рис. 1). Изолированная саркоидная васкулопатия может наблюдаться у пациентов с относительно небольшим вовлечением паренхимы легких. Падение коэффициента диффузии оксида углерода при сохраненных дыхательных объемах может быть первым признаком васкулопатии при прогрессирующей одышке. Поражение саркоидозом сердца или печени может усиливать развитие миокардиальной дисфункции или портопульмональной гипертензии. Возможно, клинические проявления ЛГАС зависят от преобладания того или иного патогенетического механизма. ЛГ в покое диагностируется при среднем давлении в легочной артерии (СрДЛА) свыше 25 мм рт. ст. и свыше 30 мм рт. ст. при физической нагрузке. Клинические проявления ЛГАС неспецифичны (одышка, кашель, снижение толерантности к физической нагрузке) и длительное время могут объясняться наличием саркоидоза. Физикальное обследование выявляет акцент второго тона над легочной артерией. Признаки правожелудочковой недостаточности встречаются у 21% пациентов с ЛГАС и выявляются поздно [11].
Из лабораторных методов исследования выделяют определение уровня натрийдиуретического пептида (ВNP), концентрация которого повышается при ЛГ. Повышенный уровень BNP является маркером плохого прогноза [13]. Пациенты с ЛГАС имеют более низкие показатели диффузионной способности легких, а у больных с тяжелой ЛГАС выявляется обратная связь между ЖЕЛ и СрДЛА [14, 15]. Кардиопульмональные тесты и тесты с физической нагрузкой (6MWT, проба Вальсальвы) представляются полезными для выявления ранних нарушений гемодинамики и ЛГ.
Роль рентгенологических методов исследования в диагностике ЛГАС зачастую недооценивается. На рентгенограммах органов грудной клетки можно увидеть расширение тени легочной артерии и заподозрить ЛГ. Использование компьютерной томографии (КТ) позволяет измерить размер основных и проксимальных легочных артерий, а высокое разрешение (ВР) диагностировать вентиляционно-перфузионные нарушения на фоне хорошо изученной КТ-картины СОД. При тяжелой ЛГ выявляется больший калибр легочной артерии на уровне ее бифуркации по сравнению с восходящей аортой. КТ может дать дополнительную информацию о возможных патогенетических вариантах ЛГАС: наличии обструкции легочных сосудов лимфаденопатией средостения или зонами фиброза, или выявить признаки, указывающие на наличие легочно-окклюзионной болезни. Сдавление просвета легочных артерий у больных СОД наблюдается в 2% случаях [12]. Магнито-резонансная томография обеспечивает наиболее точные измерения правого желудочка и фракции выброса.
Эталонным методом исследования легочной гемодинамики является катетеризация правых камер сердца и сосудов легких с прямым определением гемодинамических показателей. Однако этот способ является хирургической манипуляцией с присущими ей техническими трудностями и осложнениями и довольно редко используется в клинической практике, особенно, при обследовании больных терапевтичес¬кого профиля. Гораздо чаще применяются неинвазивные методы – эхокардиография (ЭхоКГ) и допплеркардиография (ДКГ), позволяющие с высокой точностью определить размеры полостей сердца, толщину и сократительную способность миокарда, характеристики внутрисердечного кровотока и своевременно диагностировать ЛГ.
В связи с недостаточно изученными механизмами патогенеза ЛГАС лечение этой группы больных затруднено. Большое внимание отводится лечению сопутствующей патологии (сердечной недостаточности, легочной эмболии, обструктивного апноэ сна) и проведению длительной кислородотерапии с использованием концентратора при наличии гипоксемии. Имеются противоречивые данные о применении кортикостероидов при ЛГАС [1621]. Возможно, оправдано назначение кортикостероидных препаратов у больных с прогрессирующим саркоидозом или в случае уменьшения просвета проксимальных легочных сосудов увеличенными лимфатическими узлами средостения. Некоторые авторы полагают, что при наличии саркоидной васкулопатии можно надеяться на положительный эффект кортикостероидной терапии. Рефрактерность к кортикостероидной терапии может быть обусловлена развитием ЛГ, требующей назначения специфической терапии [16].
Специфическая терапия, разработанная для лечения больных с ЛГ, включает простаноиды, антагонисты рецепторов эндотелина-1 (ЭТ-1) и ингибиторы фосфодиэстеразы-5 (ИФДЭ-5). Сегодня в России доступны три препарата для терапии ЛГ, каждый из которых действует на определенный механизм развития ЛГ, – силденафил цитрат, бозентан и иллопрост. О применении специфической терапии при ЛГАС имеются единичные зарубежные публикации. Шесть пациентов с ЛГАС на протяжении 29 мес получали внутривенно эпопростенол и ингаляции оксида азота [22]. У пяти пациентов было отмечено улучшение функционального класса, один пациент умер. В другом исследовании восемь пациентов в течение длительного времени получали ингаляции оксида азота, у пяти из них отмечался положительный нагрузочный тест (6МWT), у троих – улучшение функционального класса [23]. В последние годы появился ряд публикаций о случаях успешного применения антагонистов эндотелиновых рецепторов в лечении ЛГАС 24. Через 4 мес лечения бозентаном у троих из пяти пациентов с исходным СрДЛА 50 мм рт. ст. выявили его снижение (до 35 мм рт. ст.) при повторной катетеризации правых отделов сердца [27].
Высокая смертность больных с ЛГАС свидетельствует о необходимости разработки критериев ее ранней диагностики необходимой для своевременной корректировки терапии. В клинике пульмонологии ПСПбГМУ им. И.П. Павлова накоплен опыт по диагностике ЛГАС с помощью ЭхоКГ и ДКГ [28, 29]. Согласно рекомендациям по диагностике и лечению ЛГ ESC/ERS (2009), диагноз ЛГ считается возможным исходя из эхокардиографических данных, если максимальная скорость трикуспидальной регургитации меньше или равняется 2,8 м/с и СДЛА меньше или равняется 36 мм рт. ст. при наличии дополнительных ЭхоКГ признаков ЛГ: дилатация правых отделов и ствола ЛА, гипертрофия ПЖ, нарушение характера движения межжелудочковой перегородки. В том случае, если скорость трикуспидальной регургитации выше 2.9 м/с и систолическое давление в ЛА выше 37 мм рт. ст., диагноз ЛГ считается возможным и без наличия дополнительных ЭхоКГ признаков ЛГ [30].
Целью настоящей работы было выявить особенности нарушений легочно-сердечной гемодинамики в зависимости от стадии СОД, определить значимость неивазивных методов исследования для ранней диагностики ЛГАС.
Материалы и методы
Основу исследования составили 320 больных СОД, находившихся на обследовании и лечении в клинике пульмонологии ПСПбГМУ им. акад. И. П. Павлова с 2004 по 2013 год. У 229 пациентов (69 %) саркоидоз был подтвержден морфологически. Средний возраст больных составил 38,9 1,9 лет (соотношение женщин и мужчин – 191/129). Острое течение СОД наблюдалось у 48 пациентов (15 %) и хроническое – у 272 (85%). В соответствии с Консенсусом ATS, ERS и WASOG (1999) саркоидоз 1 стадии был диагностирован у 98 больных (30,6 %), 2-й – у 136 (42,5 %), 3-й – у 52 (16,3%) и 4-й стадии – у 34 (10,6%) пациентов. Все больные на момент обследования находились в фазе обострения. В динамике обследовано 32 % пациентов. Контрольную группу составили 37 практически здоровых лиц (средний возраст – 49,3 1,7 лет), которым проводилась эходопплеркардиография.
Помимо рутинного клинико-рентгенологического исследования, больным выполнялись мультиспиральная КТ (МСКТ) с высоким разрешением (ВР) и при подозрении на тромбоэмболию легочной артерии (ТЭЛА) – КТ-ангиография, перфузионная сцинтиграфии с Тс99m-микросферами (Макротех), КТ-ангиография и однофотонная эмиссионная КТ (ОФЭКТ) с Тс99m-микросферами с последующим совмещением КТ-ОФЭКТ изображения. Исследования проводились на мультиспиральном рентгеновском компьютерном томографе «Asteion» (Toshiba) и мультидетекторных гамма-камерах (Phillips Forte, «Phillips» и Е.саm, «Siemens»). Семи больным была проведена ОФЭКТ миокарда и позитивная томосцинтиграфия грудной клетки с использованием двухдетекторного однофотонного томографа с вариабельным положением детекторов E.cam (ФРГ). Шестнадцати больным была выполнена перфузионная сцинтиграфия миокарда на гамма-камере Sigma 410 S (ФРГ) с использованием Тс99m-технетрила. Радионуклидное исследование легких осуществлялось по специальным методикам, разработанным на кафедре рентгенологии и радиационной медицины ПСПбГМУ им. акад. И. П. Павлова. Всем больным выполнялась допплерэхокардиография (ДопплерЭхоКГ) с использованием эходопплеркардиографа VIVID-7 Dimension (GE, США) [31].
Результаты и обсуждение
Повышение СДЛА было выявлено у 92 (28,7%) из 320 больных СОД. У больных с развитием ТЭЛА повышение СДЛА отмечалось от пограничных показателей до 75-100 мм рт. ст. Повышение СДЛА (максимально до 50 мм рт. ст.) отмечалось у больных СОД с сопутствующей патологией (пороки сердца – 3, склеродермия – 3, системная красная волчанка – 3, ревматоидный артрит – 2, постлучевой фиброз легких после мастэктомии – 2, токсикомания – 2, ХОБЛ – 2, ожирение – 7), на фоне которой также может возникать ЛГ. Для однородности исследуемой группы из нее были исключены пациенты с ИБС, ГБ, нарушениями липидного спектра, повышенным уровнем холестерина, заболеваниями эндокринной системы, имеющие профессиональную вредность. Это позволило выявить изменения, обусловленные СОД, а не сопутствующей патологией. Основу исследования составили 111 больных СОД. Анализ средних значений основных эхокардиографических параметров свидетельствует о том, что изменения гемодинамики МКК и нарушения функционального состояния миокарда встречались на всех стадиях СОД (табл. 1, 2).
Для выявления скрытых нарушений легочно-сердечной гемодинамики у больных с 4 стадией СОД и нормальным СДЛА была выполнена нагрузочная проба Вальсальвы. После проведения пробы у четырех человек отмечалось умеренное, а у троих значительное повышение СДЛА, что позволило диагностировать наличие латентной ЛГ. Достоверное повышение СДЛА было отмечено и в контрольной группе, но оно не превышало нормальных значений (рис. 3). Также было отмечено достоверное снижение ФВ ЛЖ и УО ЛЖ, что свидетельствует о наличии у этих пациентов гипокинетического типа кровоснабжения. При этом среднее значение ФВ ЛЖ было ниже допустимой нормы (рис. 4).
Поражение сердца саркоидозом было выявлено у 9 из 111 больных СОД, у 12 пациентов диагноз саркоидоза сердца обсуждался как вероятный. Пациенты с саркоидозом сердца были преимущественно молодого возраста с 1 и 2 стадиями, они не предъявляли жалоб со стороны сердечно-сосудистой системы. У всех пациентов, которым был установлен саркоидоз сердца, отмечалось значительное снижение ФВ левого желудочка. У части больных было отмечено нарушение как систолической, так диастолической функции ЛЖ. Диагноз саркоидоз сердца был установлен с учетом показателей эхокардиографии (снижение ФВЛЖ, гипертрофия ЗСЛЖ, сегментарный фиброз ЗСЛЖ, МЖП, папиллярных мышц), сцинтиграфии миокарда (умеренное и выраженное снижение перфузии мокарда, накопление галия в миокарде) и ЭКГ (атриовентрикулярная блокада 1 степени, изменения сегмента ST и зубца Т). Во всех случаях поражения сердца саркоидозом отмечалась ЛГ.
Заключение. Проведенное исследование показало, что генез легочной гипертензии, ассоциированной с саркоидозом, обусловлен многими патогенетическими факторами и не может быть объяснен только прогрессирующим фиброзом легких. Комплекс методов, включающий ЭКГ, ЭхоДКГ и современные лучевые методы исследования, позволяет своевременно выявить ранние признаки развития ЛГ при СОД, а также в случаях поражения саркоидозом сердца и развития ТЭЛА.
Список литературы
1. Shigemitsu H, Nagai S, Sharma OP. Pulmonary hypertension and granulomatous vasculitis in sarcoidosis. Curr. Opin. Pulm. Med. 2007; 13: 434–8.
2. Battesti JP, Georges R, Basset F et al. Chronic cor pulmonale in pulmonary sarcoidosis. Thorax 1978; 33: 76–84.
3. Rizzato G, Pezzano A, Sala G et al. Right heart impairment in sarcoidosis: haemodynamic and echocardiographic study. Eur. J.Respir. Dis. 1983; 64: 121–8.
4. Mayock RL, Bertrand P,Morrison CE et al. Manifestations of sarcoidosis. Analysis of 145 patients with a review of nine seriesselected from the literature. Am. J. Med. 1963; 35: 67–89.
5. Shorr AF, Helman DL, Davies DB et al. Pulmonary hypertension in advanced sarcoidosis: epidemiology and clinical characteristics. Eur. Respir. J. 2005; 25: 783–788.
6. Orens JB, Estenne M, Arcasoy S et al. International guidelines for the selection of lung transplant candidates: 2006 update a consensus report from the Pulmonary Scientific Council of the International Society for Heart and Lung Transplantation. J. Heart Lung Transplant. 2006; 25: 745–755.
7. Baughman RP, Engel PJ, Taylor L et al. Survival in sarcoidosis associated pulmonary hypertension: the importance of hemodynamic evaluation. Chest 2010. DOI: 10.1378/09-2002.
8. Baughman RP, Engel PJ, Meyer CA et al. Pulmonary hypertension in sarcoidosis. Sarcoidosis Vasc. Diffuse Lung Dis. 2006; 23:108–116.
9. Rosen Y, Moon S, Huang CT et al. Granulomatous pulmonary angiitis in sarcoidosis. Arch. Pathol. Lab. Med. 1977; 101: 170–174.
10. Takemura T, Matsui Y, Saiki S et al. Pulmonary vascular involvement in sarcoidosis: a report of 40 autopsy cases. Hum. Pathol.1992; 23: 1216–1223.
11. Sulica R, Teirstein AS, Kakarla S et al. Distinctive clinical, radiographic, and functional characteristics of patients with sarcoidosis-related pulmonary hypertension. Chest 2005; 128:1483–1489.
12. Сперанская А.А. Комплексное компьютерно-томографическое и радионуклидное исследование в дифференциальной диагностике интерстициальных заболеваний легких. Дисс. канд. наук, СПб., 2013.
13. Leuchte HH, Baumgartner RA, Nounou ME et al. Brain natriuretic peptide is a prognostic parameter in chronic lung disease. Am. J. Respir. Crit. Care Med. 2006; 173: 744–750.
14. Corte TJ, Wort SJ, Gatzoulis MA et al. Elevated Brain natriuretic peptide predicts mortality in interstitial lung disease. Eur. Respir.J. 2010; 36: 819–25. DOI: 10.1183/09031936.00173509.
15. Handa T, Nagai S, Shigematsu M et al. Patient characteristics and clinical features of Japanese sarcoidosis patients with low bronchoalveolar lavage CD4/CD8 ratios. Sarcoidosis Vasc. Diffuse Lung Dis. 2005; 22: 154–160.
16. Baughman RP. Pulmonary hypertension associated with sarcoidosis. Arthritis Res. Ther. 2007; 9 (Suppl. 2): S8.
17. Rodman DM, Lindenfeld J. Successful treatment of sarcoidosis associated pulmonary hypertension with corticosteroids. Chest 1990; 97: 500–502.
18. Mangla A, Fisher J, Libby DM et al. Sarcoidosis, pulmonary hypertension, and acquired peripheral pulmonary artery stenosis. Cathet. Cardiovasc. Diagn. 1985; 11: 69–74.
19. Gluskowski J, Hawrylkiewicz I, Zych D et al. Effects of corticosteroid treatment on pulmonary haemodynamics in patients with sarcoidosis. Eur. Respir. J. 1990; 3: 403–407.
20. Damuth TE, Bower JS, Cho K et al. Major pulmonary artery stenosis causing pulmonary hypertension in sarcoidosis. Chest 1980; 78: 888–91.
21. Barst RJ, Ratner SJ. Sarcoidosis and reactive pulmonary hypertension. Arch. Intern. Med. 1985; 145: 2112–2114.
22. Fisher KA, Serlin DM, Wilson KC et al. Sarcoidosis-associated pulmonary hypertension: outcome with long-termepoprostenol treatment. Chest 2006; 130: 1481–1488.
23. Preston IR, Klinger JR, LandzbergMJ et al. Vasoresponsiveness of sarcoidosis-associated pulmonary hypertension. Chest 2001; 120: 866–72.
24. Foley RJ, Metersky ML. Successful treatment of sarcoidosis-associated
pulmonary hypertension with bosentan. Respiration 2008; 75: 211–14.
25. Sharma S, Kashour T, Philipp R. Secondary pulmonary arterial hypertension: treated with endothelin receptor blockade. Tex. Heart Inst. J. 2005; 32: 405–10.
26. Pitsiou GG, Spyratos D, Kioumis I et al. Sarcoidosis-associated pulmonary hypertension: a role for endothelin receptor antagonists? Ther. Adv. Respir. Dis. 2009; 3: 99–101.
27. Robert P. Baughman MD, Daniel A. et al. Concise Review of Pulmonary Sarcoidosis. 3AJRCCM Articles in Press. Published on October 29, 2010 as doi:10.1164/rccm.201006-0865CI
28. Лебедева Е.В. Функциональное состояние миокарда и особенности гемодинамики малого круга кровообращения у больных саркоидозом легких по данным ЭХОКГ. Дисс. канд. наук, СПб., 2004.
29. Перлей В.Е. Влияние повышенного внутригрудного давления на гемодинамику малого круга кровообращения. Дисс. канд. наук, Л., 1985.
30. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur. Heart J. 2009; 30: 2493–2537.
31. Амосов В.И., Сперанская А.А., Лукина О.В., Бобров Е.И. Мультиспиральная компьютерная томография в клиниках медицинского унивеситета. – СПб.: ЭЛБИ-СПб., 2009. 234 c.
КТ и МРТ диагностика сердца при трансплантации
Какой метод диагностики выбрать: МРТ, КТ, ЭХО-КГ, ангиографию
Какое исследование предпочтительнее
- До операции: ЭХО-КГ
- После операции по трансплантации (пересадке) сердца: ЭХО-КГ, при необходимости биопсия миокарда.
Что покажет рентген грудной клетки и КТ сердца
После операции по трансплантации (пересадке) сердца:
- увеличение контуров сердца в связи с диспропорцией между сердцем донора и перикардом реципиента
- Застой в легких или инфекция
- Пневмомедиастинум
- Пневмоторакс
- Пневмоперикард и расширение средостения
- В некоторых случаях пневмомедиастинум и расширение средостения могут также наблюдаться при медиастините (показание к проведению КТ).
Для чего проводят УЗИ сердца
- признаки, как при хронической СН
- кардиомегалия
- выпот в полость перикарда
- нарушение функции желудочков.
После операции по трансплантации (пересадке) сердца:
- острое отторжение: утолщение стенок сердца
- увеличение эхогенности
- выпот в полость перикарда
- диастолическая и систолическая дисфункция.
Что покажут снимки КТ сердца при трансплантации
- Полезна при длительном наблюдении
- Использование МСКТ-ангиографии для исключения васкулопатии трансплантата не оценено, но оправданно
- У пациентов с иммуносупрессией необходимо исключить вторичные злокачественные поражения, такие как лимфома, посттрансплантационные лимфопролиферативные процессы, опухоли кожи, висцеральные опухоли и саркома Капоши.
В каких случаях проводят МРТ сердца при пересадке
После операции по трансплантации (пересадке) сердца:
- Функциональные признаки, как приЭХО-КГ
- Отторжение определяется по очаговому или диффузному увеличению интенсивности сигнала на Т2-взвешенном изображении
- Контрастное усиление миокарда после введения Gd-DTРА.
Какие инвазивные диагностические процедуры необходимы
До операции (донор или реципиент):
- ангиография для исключения ИБС и аномалий отхождения коронарных артерий
После операции по трансплантации (пересадке) сердца:
- Биопсия правых отделов сердца - «золотой стандарт» для исключения острого отторжения трансплантата
- При длительном наблюдении ангиография коронарных сосудов - «золотой стандарт» для определения васкулопатии трансплантата
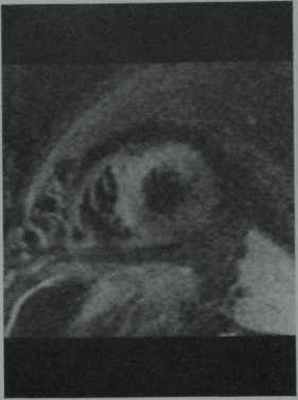
Хроническое отторжение у мужчины 63 лет через 4 года после пересадки сердца. Т2-взвешенная МРТ в режиме TSE с подавлениемсигнала от жировой ткани в проекции по короткойоси сердца демонстрирует выраженную гипертрофию миокарда и увеличение интенсивностисигнала от перегородки в связи с хроническимотторжением.
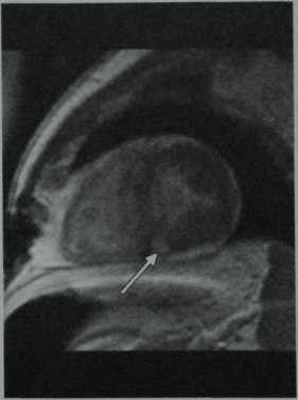
Тот же пациент. МРТ в режиме IRGE после введения Gd-DTPA демонстрирует диффузное усиление с очагами относительной гиперинтенсивности в нижней частиперегородки (стрелка).
Клинические проявления
После операции по трансплантации (пересадке) сердца:
- такая же, как у пациентов с другими хирургическими вмешательствами на сердце
- Увеличение риска инфекционных осложнений в связи с иммуносупрессией.
Методы лечения
- Лечение СН
- Иммуносупрессия
- Лечение инфекционных осложнений
- Вторичная профилактика ИБС
- Повторная пересадка сердца.
Течение и прогноз
- Острое отторжение возникает с частотой до 55%
- Обычно возникает между 2-й неделей и 3-м месяцем после трансплантации сердца
- Наиболее высокая смертность - на протяжении первых 6 месяцев после пересадки
- Частота 10-летней выживаемости достигает 54%
- Основная причина смерти в течение первого года после операции - васкулопатия трансплантата (скоротечная форма ИБС, частота - 50% в первые 5 лет после операции)
- Вторая основная причина смерти - злокачественные процессы, особенно лимфопролиферативные заболевания
Что хотел бы знать лечащий врач?
- Инфекции
- Признаки отторжения (МРТ)
- Функциональная оценка сердца
- Послеоперационные осложнения
- Злокачественные процессы.
Какие патологии имеют симптомы, схожие с проблемами трансплантата
Послеоперационное расширение средостения
- Нормальный признак после перенесенной операции
- Медиастинит
- Кровотечение в средостении
- Расслоение аорты или псевдоаневризма
- Послеоперационные
Бактериальная пневмония(например,Staphylococcusaureus, Pseudomonasspp., Klebsiellaspp.)
Читайте также:
