Эпидемиология множественных опухолей тонкой кишки. Множественные карциноиды тонкой кишки
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Среди 305 больных карциноидом желудочно-кишечного тракта Ес-клеточные новообразования тонкой кишки выявлены у 29 (9,5 %) пациентов. Даже в условиях многопрофильных специализированных стационаров при обследовании больных карциноидами тонкой кишки отмечаются затруднения в диагностике. До хирургического вмешательства карциноид тонкой кишки заподозрен лишь в одном случае. По неотложным показаниям прооперированы 23 пациента. Лечение больных карциноидом тонкой кишки осуществляется по самым общим принципам оказания медицинской помощи пациентам с онкологической патологией. Выбор методик послеоперационной терапии у больных карциноидом тонкой кишки нередко осуществляется без учета специфики клинического течения, данных специальных морфологических исследований и прогноза Ес-клеточных новообразований. В результате исследования выявлены особенности клинического течения у больных карциноидом тонкой кишки, оценено их лечение и предложены пути улучшения результатов оказания медицинской помощи.
В структуре нейроэндокринных опухолей (НЭО) желудочно-кишечного тракта (ЖКТ) наиболее часто встречаются серотонинпродуцирующие новообразования, или так называемые Ес-клеточные опухоли ‒ карциноиды (Крц) [1]. Среди Ес-клеточных новообразований ЖКТ Крц тонкой кишки (Тнк) констатируются в 29 % наблюдений [5]. Верификация Крц Тнк представляет определенные трудности [8]. Нередко это связано с недостаточным опытом врачей по причине редкости данной патологии и в связи с отсутствием возможностей использования специальных методов обследования пациентов на этапах оказания больным неспециализированных видов медицинской помощи [9]. Трудности диагностики Крц Тнк обусловлены и тем, что очевидные проявления карциноидного синдрома выявляются лишь в 5 % случаев. Заболевание в основном манифестируется уже при развитии метастатического поражения или осложнений, обусловленных местным прогрессированием онкологического процесса [4]. Несмотря на расширившиеся возможности верификации Крц Тнк с помощью современных специальных технологий обследования пациентов, дооперационная диагностика продолжает оставаться недостаточно эффективной [1, 10]. Хирургические вмешательства являются одним их этапов комплексного лечения больных Крц Тнк [2, 3, 7]. Метастазы в брюшной полости при операциях, проводимых по поводу карциноидов тонкой кишки, выявляются в 31-39 % случаев [6]. При наличии региональных метастазов в случаях Крц Тнк 5-летняя выживаемость составляет 65 %, отдаленных ‒ 36 % [5]. Поэтому заинтересованный анализ данных о Крц Тнк позволяет оценить возможности современного обследования и лечения пациентов и акцентировать внимание специалистов как многопрофильных лечебно-профилактических учреждений, так и врачей первичного звена здравоохранения на необходимости улучшения качества оказания медицинской помощи больным данной патологией.
Материалы и методы исследования
Проанализированы результаты обследования и хирургического лечения 305 больных с Крц ЖКТ. Пациенты проходили обследование и лечение в ряде лечебно-профилактических учреждений Санкт-Петербурга: ГУЗ «Городская Александровская больница», ГУЗ «Ленинградская областная клиническая больница», ГУЗ «Ленинградский областной онкологический диспансер», ФГУЗ «Военно-медицинская академия им. С.М. Кирова», ГУЗ «Госпиталь для ветеранов войн» в период с 1954 по 2010 гг. Среди них Крц Тнк выявлены в 29 (9,5 %) клинических наблюдениях. Соотношение контингентов мужчин и женщин составилио 1:1 (15:14). Большинство пациентов (25 чел.) ‒ люди старшей возрастной группы (60 лет и старше). Сопутствующие заболевания, в основном со стороны сердечно-сосудистой системы, выявлены у 23 из 29 пациентов.
По локализации Крц Тнк распределились следующим образом: в четырех наблюдениях опухоль располагалась в двенадцатиперстной кишке (в одном из этих случаев ‒ в области большого дуоденального сосочка (БДС)); еще у 4 пациентов ‒ в тощей и у 21 больного ‒ в подвздошной кишках. В трех из 29 случаев выявлены синхронные и метахромные опухоли.
Результаты исследованияи их обсуждение
По неотложным показаниям госпитализированы 23 из 29 больных Крц Тнк. На догоспитальном этапе у них подозревались заболевания, относящиеся к группе «острый живот» (острая кишечная непроходимость ‒ 16 наблюдений, ущемленная послеоперационная вентральная грыжа ‒ один больной, острый холецистит, механическая желтуха ‒ 1 человек, острый живот ‒ 5 случаев). Как случайная находка в плановом порядке карциноидная опухоль Тнк выявлена у 6 больных при обследовании пациентов по поводу других заболеваний, не связанных с эндокринной системой организма. В частности, у трех больных в луковице двенадцатиперстной кишки (ДПК) при фибрагастродуоденоскопии (ФГДС) диагностированы полипы, при морфологическом исследовании которых установлена карциноидная природа заболевания. Еще у трех пациентов Крц Тнк выявлены при операции по поводу новообразования толстой кишки.
В 28 наблюдениях клинические проявления карциноидного синдрома отсутствовали. Для пациентов с Крц тонкой кишки характерными оказывались жалобы на невыраженные (без четкой локализации) боли в животе, немотивированную слабость, длительные (до 5-6 дней) запоры, потерю массы тела. В 10 случаях до появления клинической картины острой кишечной непроходимости (ОКН) отмечалось немотивированное повышение температуры тела до субфибрильных цифр.
О проявлениях карциноидного синдрома можно было судить лишь у одной пациентки, оперированной по неотложным показаниям по поводу ОКН. У больной клиническая картина заболевания возникла на фоне послеоперационной вентральной грыжи, и для проведения хирургического вмешательства она была взята с предварительным диагнозом «ущемленная послеоперационная вентральная грыжа». Однако в ходе операции было установлено, что причиной ОКН явилось не ущемление содержимого грыжевого мешка, а опухоль, карциноидный генез которой был установлен при морфологическом исследовании во время операции. В течение года до операции у этой пациентки отмечались эпизоды расстройства стула (поносы до 5-6 раз в сутки), в связи с чем она неоднократно госпитализировалась в инфекционные отделения с подозрением на острую кишечную инфекцию. Ретроспективно оценивая этот случай, можно предположить, что отмечаемые нарушения со стороны ЖКТ в виде диареи могли быть связаны с гиперпродукцией серотонина, и это можно было рассматривать как один из симптомов «карциноидного синдрома».
Трудности диагностики Крц Тнк оказывались причиной постановки неправильного дооперационного диагноза у 28 больных. Только у одного пациента с полипом ДПК диагноз карциноида был установлен до операции после проведения биопсии и выполнения микроморфологического исследования.
При обследовании больных Крц Тнк до операции применялись методики, позволяющие верифицировать карциноиды сугубо как опухолевые процессы без подозрения на нейроэндокринную природу заболевания. В частности, при применении биохимических, рентгенологических методов диагностики, ФГДС, фиброколоноскопии (ФКС), ультразвукового исследования (УЗИ), компьютерной томография (КТ) истинный диагноз заболевания установлен не был. Вместе с тем выполнение радиоиммунных и радиоизотопных исследований, направленных на определение уровня серотонина в крови и его метаболитов в моче, а также проведение сцинтиграфии на дооперационном этапе позволяет констатировать нейроэндокринную природу новообразования и в связи с последним спланировать адекватный объем хирургического вмешательства и мероприятий консервативного лечения.
Все больные с Крц Тнк оперированы. Планово хирургические вмешательства выполнены 6 пациентам. У трех больных карциноидные полипы ДПК удалены при ФГДС. Эндоскопическое исследование для этих пациентов явилось и завершающим этапом лечения. Еще у трех пациентов Крц Тнк верифицированы в ходе хирургического вмешательства по поводу новообразования толстой кишки. Один из этих больных ранее оперирован по поводу ОКН, вызванной аденокарциномой прямой кишки. В ходе операции, осуществляемой по неотложным показаниям, опухоль тонкой кишки диаметром до 1 см выявлена не была. Через 3 месяца после операции Гартмана и курса химиотерапии этот пациент повторно прооперирован. В ходе второго хирургического вмешательства, кроме новообразования толстой кишки, в подвздошной кишке диагностирована симультанная опухоль 0,6×0,5см. При морфологическом исследовании удаленного новообразования тонкой кишки верифицирован карциноид. Такой же (метахромный) характер новообразования выявлен и еще у одного больного с аденокарциномой восходящего отдела толстой кишки. В этом случае выявлен карциноид в подвздошной кишке. Еще у одного больного с множественными полипами прямой кишки при выполнении передней резекции прямой кишки в ходе ревизии органов брюшной полости в подвздошной кишке выявлена опухоль 0,5×0,5 см. При микроморфологическом исследовании диагностировано синхронное поражение карциноидом тонкой и толстой кишок.
Больным Крц Тнк, оперированным по неотложным показаниям, выполнялась резекция тонкой кишки. У 19 пациентов Крц локализовался в подвздошной кишке в 15‒80 см от илеоцекального угла, у четырех ‒ в тощей кишке (на расстоянии 1‒1,5 м от связки Трейтца). В 5 случаях ее резекция на протяжении не менее чем 1 м выполнена в связи с явными расстройствами кровообращения в тонкой кишке.
У двух больных при верификации острой хирургической патологии со стороны органов брюшной полости допущены ошибки дооперационной диагностики. У одного пациента опухоль тонкой кишки, обусловившая ОКН, локализовалась в грыжевом мешке. Этот больной оперирован с предварительным диагнозом «ущемленная послеоперационная вентральная грыжа». Второй пациент с Крц БДС оперирован при механической желтухе на фоне клинической картины острого калькулезного холецистита. Однако во время операции подозрения о желчнокаменной болезни не подтвердились, несмотря на то, что по данным УЗИ они были. Крц БДС у этого пациента диагностирован только в послеоперационном периоде, после повторной ФГДС и выполнения биопсии ткани из фатерова соска.
Дооперационные осложнения Крц Тнк в виде абсцесса брюшной полости со значительным объемом содержимого (до 1000 мл), без повышения температуры тела верифицированы у двух больных. Нагноение послеоперационной раны и абсцесс брюшной полости диагностированы у 2 пациентов. Летальных исходов в раннем послеоперационном периоде не было. Все прооперированные больные выписаны из стационаров.
После операции всем пациентам выполнены морфологические исследования, по данным которых онкологический процесс IV стадии выявлен у 23 (79,3 %) больных. Морфологически верификация диагноза карциноида Тнк осуществлялась при окраске микропрепаратов лишь с помощью обычных гистологических методов на основании характерного для большинства
Ес-клеточных новообразований варианта гистологического строения опухоли. Иммуногистохимические исследования в наблюдаемой группе больных проводились лишь в одном случае.
Ряд зарубежных авторов полагает целесообразным при хирургическом лечении больным Крц Тнк выполнять холецистэктомию. Подобная рекомедация основывается на мнении исследователей о том, что в послеоперационном периоде при длительной специфической терапии октреотидом повышается риск формирования камней в желчном пузыре. В наших наблюдениях так называемая профилактическая холецистэктомия больным Крц Тнк не выполнялась, так как ни в одном случае лечения пациентов терапия октреотидом не проводилась.
Анализ представленных данных позволяет считать, что даже в условиях многопрофильных специализированных стационаров, где имеются практически все возможности для обследования и лечения пациентов в любое время суток, отмечаются очевидные затруднения в диагностике случаев карциноидных опухолей тонкой кишки. Как и другие авторы [4, 6], мы полагаем, что трудности диагностики карциноидов тонкой кишки обусловлены отсутствием специфических (за исключением карциноидного синдрома) клинических проявлений данного заболевания. Очевидно также, что эффективность обычных лабораторно-инструментальных методов исследования без применения ряда специальных методов диагностики при верификации случаев карциноидов невелика. Объективные трудности до-, итра- и послеоперационной диагностики Крц Тнк обусловливают несвоевременную и неполноценную диагностику данного заболевания. Отсутствие представлений у многих специалистов хирургического профиля об обследовании больных с данной нейроэндокринной патологией ЖКТ способствует назначению неадекватной терапии в послеоперационном периоде. Выполнение иммуногистохимических исследований микропрепаратов, направленных на определение принадлежности опухоли к нейроэндокринному происхождению, степени его злокачественности и характеру продуцируемых гормонов, несомненно, позволяет улучшить качество оказания медицинской помощи больным Крц Тнк, осуществлять выбор специфической консервативной терапии и прогнозировать течение заболевания. Однако иммуногистохимические методики дорогостоящие и не всегда могут применяться вне специализированных лечебных учреждений, куда по неотложным показаниям, как правило, поступают больные Крц Тнк. Поверхностный подход в изучении особенностей карциноидных новообразований, как и в отношении других нейроэндокринных опухолей, неприемлем. Практикующим врачам необходимо помнить о возможностях применения для диагностики Крц Тнк гистохимических методик окраски микропрепаратов по Гримелиусу, Массону-Гамперлю, Сивье-Мунгеру. Эти методики морфологических исследований недвусмысленно позволяют установить нейроэндокринную природу опухоли, а с учетом проведения морфометрии ‒ степень ее злокачественности. Использование доступных методик импрегнации препаратов серебром возможно во всех гистологических лабораториях, а следовательно, данное обстоятельство позволят осуществлять верификацию нейроэндокринных новообразований.
Выводы
Верификация Крц Тнк затруднительна. Однако она возможна при четком соблюдении алгоритма диагностики и лечения больных данной патологией. Типовые подходы при выполнении хирургических вмешательств в неотложном порядке и верификация заболевания в послеоперационном периоде не способствуют надлежащему качеству оказания медицинской помощи больным Крц Тнк. Эту проблему не замечать нельзя. Однако можно констатировать, что даже в многопрофильных специализированных стационарах при оказании медицинской помощи больным Крц Тнк в алгоритме обследования и лечения должны быть заложены критерии исключения (подтверждения) опухолевых образований Ес-клеточной природы. Кроме рутинных, в алгоритме диагностики карциноидов Тнк должны применяться радиоиммунные, радиоизотопные, иммуногистохимические и другие специфические методы исследования. Выработка окончательной тактики мониторинга состояния и лечения больных Крц Тнк не должна переноситься на постстационарный этап оказания медицинской помощи.
Список литературы
- Нейроэндокринные опухоли желудочно-кишечного тракта: принципы диагностики и лечения: рук. для врачей / под ред. В.А. Горбуновой, А.В. Егоровой, А.В. Кочатковой. ‒М.: Б.и., 2009. ‒ 195 с.
- Hellman P. Effect of surgery on the outcome of midgut carcinoid disease with lymph node and liver metastases// World J. Surg. ‒ 2002. ‒ Vol. 26, №8. ‒ Р.991-997.
- Lal A., Chen H. Treatment of advanced carcinoid tumors// Curr. Opin. Oncol. ‒ 2006. ‒ Vol. 18. ‒ Р. 9-15.
- Maggard M.A., O´Connel J.B., Ko C.Y. Updated population-based review of carcinoid tumors // Ann. Surg. ‒ 2004. ‒ Vol. 240, №1. ‒ P. 117-122.
- Modlin I.M. A 5 ‒ Decade Analysis of 13,715 Carcinoid Tumors/ Modlin I.M., Lye K.D., Kidd M. // Cancer. ‒ 2003. ‒ Vol. 97, № 4. ‒ P. 934-959.
- Modlin I.M. Gastroenteropancreatic neuroendocrine tumours// Lanc. Oncol. ‒ 2008. ‒Vol. 9, №1. ‒ P. 61-72.
- Ohrvall U. Method for dissection of mesenteric metastases in mid-gut carcinoid tumors // World J. Surg. ‒ 2000. ‒ Vol. 24, №11. ‒ Р. 1402-1418.
- Shebani K.O. Prognosis and survival in patients with gastrointestinal tract carcinoid tumors // Ann. Surg. ‒ 1999. ‒ Vol. 229. ‒ Р. 815-821.
- Sippel R.S., Chen H. Carcinoid tumors //Surg. Oncol. Clin. N. Am. ‒ 2006. ‒ Vol.15, №3. ‒ P. 463-478.
- Warner R. Carcinoid tumor: A guide to diagnosis and treatment/ Warner R., Rauben C. // CA, Glendale: S.E.A., 2005. ‒ P. 26-27.
Рецензенты:
Белов Д.Ю., к.м.н., зав. отделом стандартизации в здравоохранении Санкт-Петербургского государственного учреждения здравоохранения «Медицинский информационно-аналитический Центр»;
Сулиманов Р.А., д.м.н., профессор, зав. кафедрой госпитальной хирургии Института медицинского образования ГОУ ВПО «Новгородский государственный университет имени Ярослава Мудрого».
Эпидемиология множественных опухолей тонкой кишки. Множественные карциноиды тонкой кишки
Эпидемиология множественных опухолей тонкой кишки. Множественные карциноиды тонкой кишки
Судя по литературным данным, первично множественные злокачественные опухоли тонкой кишки встречаются редко. Однако низкая частота этих опухолей в значительной степени обусловлена недостаточной диагностикой их не только при клинико-рентегнологическом обследовании, по и во время операции.
По-видимому, в практической работе подобные случаи встречаются чаще, чем они описываются в литературе. Поэтому проблема первично множественных злокачественных опухолей тонкой кишки имеет определенное практическое значение. Тщательное и целеустремленное клиническое и в особенности рентгенологическое исследование с дальнейшим усовершенствованием методики и техники должно способствовать как своевременной диагностике этого заболевания, так и установлению истинной частоты его.
Кроме того, большое значение имеет тщательная ревизия всех петель тонкой кишки во время операции, изучение удаленного макропрепарата и последующее гистологическое исследование.
При лечении первично множественных злокачественных опухолей этой локализации наиболее эффективным методом является радикальное удаление пораженных отделов кишечника. Большая длина тонкой кишки несомненно благоприятствует максимальному радикализму предпринимаемой операции и позволяет произвести резекцию значительных участков пораженного ее отрезка. Так же как и при некоторых соли-тарных опухолях (саркомы), лучевая терапия является важным звеном в комплексном послеоперационном лечении больных с первично множественными злокачественными опухолями этой локализации; должны быть изучены и перспективы химиотерапии.
Среди солитарных и первично множественных опухолей тонкой кишки наибольшее значение имеют саркомы, затем раки. Из других более редких злокачественных опухолей должны быть упомянуты так называемые карциноиды. Тонкая кишка занимает второе место после червеобразного отростка по частоте локализации этой редкой опухоли. Чаще поражается подвздошный отдел кишки, а в 28% случаев кар-циноидная опухоль тонкой кишки бывает множественной (Т. П. Макаренко и М. И. Брусиловский, 1964).
Метастазы этой опухоли с обширным распространением наблюдаются более чем в 1/3 случаев. O'Shea, O'Reilly (1966) сообщили об одном случае множественной злокачественной карциноидной опухоли тонкого кишечника. Ostermiller Joergenson (1966) среди 46 больных с карциноидными опухолями локализацию в подвздошной кишке отмстили у 32, в тощей — у 7, в двенадцатиперстной— у 1, на протяжении всего тонкого кишечника — у 2, а у 4 больных точная локализация опухоли не установлена. Они же наблюдали у 1/3 больных множественные карциноидные опухоли.
Клинически они обычно протекают бессимптомно или при наличии таких кишечных расстройств, которые не являются характерными (поносы, боли в животе, крайне редки кровотечения), лишь в отдельных случаях диагностика облегчается установлением карциноидного синдрома. Поэтому диагностика данного заболевания устанавливается чаще всего при операции, предпринимаемой в большинстве случаев по поводу кишечной непроходимости, возникающей вследствие перегиба петель кишечника спайками, развивающимися в результате фиброза серозной поверхности кишки. При операции карциноидов тонкой кишки необходимо производить тщательную ревизию всех отделов ее, имея в виду, что эта опухоль часто бывает множественна и число отдельных опухолевых узлов может достигать до 100.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Опухоли тонкой кишки
Опухоли тонкой кишки составляют 1–5% от всех опухолей желудочно-кишечного тракта. В США ежегодно регистрируется примерно 11 110 новых случаев рака тонкого кишечника и 1 700 смертельных исходов ( 1 Общие справочные материалы Опухоли тонкой кишки составляют 1–5% от всех опухолей желудочно-кишечного тракта. В США ежегодно регистрируется примерно 11 110 новых случаев рака тонкого кишечника и 1 700 смертельных исходов. Прочитайте дополнительные сведения ). Диагностика при помощи энтероклизиса. Лечение подразумевает проведение резекции.
Доброкачественные опухоли включают лейомиомы, липомы, нейрофибромы, фибромы. Все эти опухоли могут протекать с такими симптомами, как вздутие живота, боль, кровотечение, диарея, а при развитии непроходимости – рвота. Полипы наблюдаются реже, чем в толстой кишке.
Аденокарцинома, злокачественная опухоль, наблюдается редко. Как правило, она развивается в двенадцатиперстной или начальном отделе тонкой кишки и протекает с минимальной симптоматикой. У пациентов с болезнью Крона, которая затрагивает тонкий кишечник, опухоли имеют тенденцию располагаться дистально и в обходных или воспаленных петлях кишечника.
Первичная злокачественная лимфома Обзор лимфомы (Overview of Lymphoma) Лимфомы представляют собой гетерогенную группу заболеваний, происходящих из клеток ретикулоэндотелиальной и лимфатической системы. Основные варианты лимфом – лимфома Ходжкина и неходжкинские. Прочитайте дополнительные сведения развивается в подвздошной кишке; пораженный длинный сегмент становится ригидным. Лимфомы тонкой кишки могут развиваться на фоне продолжительной нелеченной целиакии Целиакия Целиакия - иммунологически опосредованное заболевание, развивающееся у генетически предрасположенных лиц и обусловленное непереносимостью глютена, что приводит к воспалению слизистой оболочки. Прочитайте дополнительные сведенияКарциноидные опухоли Обзор карциноидных опухолей (Overview of Carcinoid Tumors) Карциноидные опухоли развиваются из нейроэндокринных клеток из желудочно-кишечного тракта (90%), поджелудочной железы, бронхов и реже из мочеполовых путей. Более 95% всех карциноидных опухолей. Прочитайте дополнительные сведения (которые также называют нейроэндокринные опухоли желудочно-кишечного тракта) чаще всего выявляются в тонкой кишке, особенно в подвздошной кишке и аппендиксе; при таких локализациях более крупные поражения могут стать злокачественными. Множественные опухоли отмечаются в 50% случаев. При опухоли диаметром > 2 см к моменту операции в 80% случаев имеются местные метастазы или метастазы в печень. Примерно в 30% случаях карциноид тонкой кишки протекает с непроходимостью, болью, кровотечениями, или карциноидным синдромом. Лечение в связи с карциноидными опухолями заключается в проведении хирургической резекции; могут потребоваться повторные хирургические вмешательства. Для эффективного контроля заболевания при метастатических карциноидных опухолях можно использовать терапию аналогом соматостатина длительного действия с повышением дозы, пептидную рецепторную радиолигандную терапию (PRRT) с использованием радиомеченного аналога соматостатина или эверолимуса.
Саркома Капоши Саркома Капоши Саркома Капоши – это многоочаговая сосудистая опухоль, вызванная вирусом герпеса 8 типа. Она может возникнуть в классической, ассоциированной со СПИДом, эндемической (в Африке) и ятрогенной. Прочитайте дополнительные сведения впервые описанная у пожилых еврейских и итальянских мужчин, развивается в агрессивной форме у африканцев, пациентов с трансплантированными органами, а также страдающих СПИДом, у 40–60% которых наблюдается поражение желудочно-кишечного тракта. Новообразования могут возникать по ходу всего ЖКТ, но обычно – в желудке, тонкой кишке, дистальных отделах толстой кишки. Новообразования ЖКТ, как правило, протекают бессимптомно, однако воможно развитие кровотечения, диареи, белок-теряющей энтеропатии, инвагинации. Тактика лечения саркомы Капоши Лечение Саркома Капоши – это многоочаговая сосудистая опухоль, вызванная вирусом герпеса 8 типа. Она может возникнуть в классической, ассоциированной со СПИДом, эндемической (в Африке) и ятрогенной. Прочитайте дополнительные сведения зависит от клеточного типа, локализации и протяженности поражения.
Общие справочные материалы
1. Siegel RL, Miller KD, Jemal A: Cancer statistics, 2020. CA Cancer J Clin 70(1):7–30, 2020. doi: 10.3322/caac.21590
Морфологические факторы прогноза нейроэндокринных опухолей желудочно-кишечного тракта и поджелудочной железы
Нейроэндокринные опухоли (НЭО) могут развиваться в любых органах, где в норме имеются эндокринные клетки: в желудочно-кишечном тракте (ЖКТ), легких, тимусе, почках, яичниках, простате, молочной и щитовидной железах, коже (1). По своему происхождению нейроэндокринные (эндокринные) опухоли пищеварительного тракта можно разделить на опухоли желудочно-кишечного тракта
(НЭО ЖКТ) и опухоли поджелудочной железы (НЭО ПЖ)
- КЛЮЧЕВЫЕ СЛОВА: опухоль, аппендикс, синдром, кишки, тимус, желудок, операция
Нейроэндокринные опухоли (НЭО) могут развиваться в любых органах, где в норме имеются эндокринные клетки: в желудочно-кишечном тракте (ЖКТ), легких, тимусе, почках, яичниках, простате, молочной и щитовидной железах, коже (1). По своему происхождению нейроэндокринные (эндокринные) опухоли пищеварительного тракта можно разделить на опухоли желудочно-кишечного тракта
(НЭО ЖКТ) и опухоли поджелудочной железы (НЭО ПЖ)
Рис. 1. А. Низкая пролиферативная активность (Ki67 = 8%) в высокодифференцированной нейроэндокринной карциноме желудка. Б. Высокая пролиферативная активность (Ki67 > 50%) в низкодифференцированной нейроэндокринной карциноме желудка
Рис. 2. А. Злокачественная инсулинома поджелудочной железы. Инвазия сосуда капсулы. Б. Злокачественная гастринома. Инвазия нерва комплексами опухолевых клеток.
Рис. 3. Ко-экспрессия цитокератина 19 (А) и синаптофизина в смешанной экзо-эндокринной карциноме поджелудочной железы. Появление метастазов в печени через 4 года после операции
Рис. 4. А. Метастаз в лимфатический узел злокачественного карциноида подвздошной кишки: многочисленные комплексы опухолевых клеток. Реакция с серотонином. Б. То же наблюдение. Низкая пролиферативная активность клеток злокачественного карциноида (Ki67 мене
НЭО соответственно своему эмбриональному происхождению делятся на опухоли верхней (карциноиды легких, тимуса, желудка и двенадцатиперстной кишки), средней (аппендикса, подвздошной, тощей и проксимальной кишки) и нижней (дистальной части толстой и прямой кишки) кишки. Эффект применения химиотерапии (ХТ) в случае нерезектабельных и метастазирующих НЭО зависит как от их функциональной активности (клинического синдрома), так и от степени злокачественности опухоли или ее биологического потенциала. Важнейшими критериями злокачественного потенциала НЭО, определяющими степень их злокачественности (Grade 1 ), считают степень дифференцировки опухоли (высокодифференцированные, низкодифференцированные), наличие инвазии сосудов и нервов, некрозов, высокую митотическую и пролиферативную активность клеток опухоли.
Степень дифференцировки и степень злокачественности (Grade) опухоли
В 2000 году Всемирной организацией здравоохранения (ВОЗ) [2] была принята классификация НЭО ЖКТ и ПЖ, где эти опухоли разделены на 3 основные группы: 1) высокодифференцированные опухоли, доброкачественные и неопределенной степени злокачественности (функционирующие и нефункционирующие); 2) высокодифференцированные эндокринные карциномы низкой степени злокачественности (функционирующие и нефункционирующие); 3) низкодифференцированные эндокринные карциномы высокой степени злокачественности (мелко- и крупноклеточные эндокринные карциномы); 4) смешанные экзо-эндокринные карциномы. В настоящее время Европейской ассоциацией по нейроэндокринным опухолям (ENETS) предложено делить НЭО ЖКТ и ПЖ по степени их злокачественности (Grade) на 3 основные группы – G1, G2, G3 (табл. 1). В соответствии с этим в группы G1-G2 входят высокодифференцированные НЭО ЖКТ и ПЖ, а в группу G3 – низкодифференцированные нейроэндокринные карциномы (НЭК) [3]. Это деление базируется на параметрах, которые непосредственно отражают степень злокачественности НЭО – индексах митотической и пролиферативной активности опухолевых клеток. Индекс митотической активности может быть подсчитан при рутинном исследовании в препаратах, окрашенных гематоксилином и эозином, он определяется как количество митозов в 10 репрезентативных полях зрения (РПЗ) с равномерным распределением в них опухолевых клеток, без артефициальных изменений и при большом увеличении микроскопа (х400). Индекс пролиферации определяется при иммуногистохимическом (ИГХ) исследовании с использованием антител Ki67 (клон MIB-1) как доля клеток, ядра которых экспрессируют. Этот маркер из расчета на 100 опухолевых клеток (%) при большом увеличении микроскопа (х400). Индекс Ki67 вычисляется как среднее значение при просчете не менее 1000 клеток (оптимально- 2000 клеток). Считается, что митотический индекс более точно отражает пропорцию делящихся клеток и, следовательно, является более надежным критерием степени злокачественности НЭО, чем индекс Ki67 (4). Поэтому в морфологическом заключении при исследовании НЭО обязательно следует указывать значения и митотического индекса и индекса пролиферации. Чтобы выделить опухоли, для лечения которых рекомендовано применение более агрессивных методов терапии, следует проводить учет пролиферирующих клеток не в одном произвольно выбранном участке опухоли, а обязательно исследовать наиболее активно пролиферирующие участки опухоли – так называемые «горячие точки».
Высокодифференцированные НЭО ЖКТ и ПЖ – это опухоли низкой или промежуточной степени злокачественности, а низкодифференцированные – высокой. Низкодифференцированные НЭО имеют тенденцию к стремительной диссеминации, они устойчивы к терапии, быстро приводят к летальному исходу. Поэтому самым важным аспектом морфологического заключения является принципиальное разграничение высокодифференцированных и низкодифференцированных НЭО (рис. 1, А и Б). Высокодифференцированные НЭО – доброкачественные и неопределенной степени злокачественности (пограничные) – характеризуются слабо выраженной клеточной атипией; в высокодифференцированных эндокринных карциномах низкой степени злокачественности клеточная атипия слабо или умеренно выражена, ядра гиперхромные с отчетливыми ядрышками, характерно увеличение ядерно-цитоплазматического соотношения, митотической активности и индекса пролиферации Ki67. Большинство высокодифференцированных НЭО ЖКТ и ПЖ прогрессируют медленно, иногда в течение многих лет и даже десятилетий, но, тем не менее, являются потенциально злокачественными новообразованиями. В последние годы накоплены данные о том, что метастазы, в том числе и в печень, могут выявляться через много лет (10-30 и более) после удаления так называемых «доброкачественных» НЭО 7. Поэтому сейчас рекомендовано вообще отказаться от термина «доброкачественные НЭО» и использовать термин «НЭО неопределенной степени злокачественности» [4].
Функционирующие и нефункционирующие НЭО
Для определения функционального статуса НЭО при гистологическом исследовании используют эндокринные маркеры – пептиды и/или амины, обладающие гормональной активностью (инсулин, глюкагон, соматостатин, вазоактивный интестинальный полипептид, панкреатический полипептид, гастрин, серотонин, АКТГ, кальцитонин, и другие) [10]. НЭО часто продуцируют сразу несколько гормонов, поэтому диагноз базируется как на наличии характерного гиперфункционального синдрома, так и на выявлении доминирующей популяции эндокринных клеток, составляющей более 50% клеток опухоли. В соответствии с этим НЭО верифицируют как инсулиномы, глюкагономы, гастриномы, соматостатиномы, ПИПомы, ВИПомы, кальцитониномы, карциноиды (серотонин-продуцирующие) и др. Важная информация о функциональном статусе опухоли может быть получена при исследовании ультраструктуры опухолевых клеток. Тип эндокринных гранул в их цитоплазме и их количество позволяют уточнить диагноз НЭО, особенно при нефункционирующих опухолях.
Для НЭО различной локализации имеются и свои специфические факторы прогноза, которые следует учитывать при постановке диагноза и выборе терапии.
Нейроэндокринные опухоли ПЖ (НЭО ПЖ)
Большинство высокодифференцированных функционирующих НЭО пищеварительного тракта составляют опухоли ПЖ (табл. 2). Опухоли, которые преимущественно локализуются в теле и хвосте ПЖ (глюкагономы, инсулиномы, ВИПомы), имеют склонность к гематогенной диссеминации; гастриномы ПЖ чаще метастазируют в регионарные лимфатические узлы. НЭО ПЖ, продуцирующие островковые гормоны (инсулин, глюкагон, соматостатин и панкреатический полипептид), как правило, имеют менее злокачественный потенциал, чем те, которые продуцируют эктопические гормоны, в норме не характерные для этого органа (гастрин, нейротензин, АКТГ, кальцитонин, гормон роста и другие).
Гастриномы ПЖ обладают более злокачественным потенциалом, чем соответствующие опухоли 12-перстной кишки. Хотя обычно они прогрессируют медленно, но в большинстве случаев дают метастазы в лимфатические узлы или печень. Иммунофенотип клеток гастрином ПЖ характеризуется ко-экспрессией маркеров нейроэндокринной и экзокринной дифференцировки (хромогранина А, синаптофизина, цитокератинов 19 и 20 и/или ЭМА), следовательно, они обладают смешанным экзо-эндокринным иммунофенотипом, который и определяет их злокачественный потенциал [11, 12]. В последние десятилетия применение эффективных противоязвенных препаратов в лечении пациентов с гастриномами позволяет смягчить симптомы эндокринной гиперфункции, однако это не устраняет саму причину опухоли [13]. Это привело к тому, что во всех индустриально развитых странах в последние годы возросла летальность от гастрином, обусловленная их латентным ростом и прогрессированием. Риск смерти у пациентов с гастриномами ПЖ увеличивается при высоком уровне гастрина в сыворотке, наличии метастазов в лимфатические узлы, печень, кости, при крупных размерах опухоли, а также при ее поздней диагностике.
Глюкагономы ПЖ долго могут расти как нефункционирующие опухоли, а симптомы синдрома Маллисона (некротическая мигрирующая эритема, глоссит, хейлит, анемия, снижение веса, депрессия и венозный тромбоз) возникают, как правило, в тех случаях, когда опухоль достигает достаточно больших размеров. В этой стадии уже имеются метастазы и плохой прогноз заболевания. Соматостатиномы ПЖ также могут долго не давать симптомов. Характерный для этой опухоли синдром (сахарный диабет, снижение веса, холелитиаз, стеаторея и гипохлоргидрия) возникает не во всех случаях. Иногда соматостатиномы могут проявляться симптомами карциноидного синдрома, синдрома Кушинга или другими. В таких случаях диагноз ставится исключительно после ИГХ и электронно-микроскопического исследования – на основании экспрессии соматостатина в большинстве опухолевых клеток и наличия в них характерных эндокринных гранул. На момент постановки диагноза соматостиномы ПЖ обычно достигают больших размеров, дают метастазы в печень и имеют крайне плохой прогноз.
Нефункционирующие НЭО ПЖ (вернее опухоли без выраженного клинического синдрома) – самые сложные для постановки диагноза опухоли. Определить степень нейроэндокринной дифференцировки этих опухолей позволяет только экспрессия в них общих маркеров нейроэндокринной дифференцировки – синаптофизина, хромогранина А [1, 11, 14, 15]. НЭО ПЖ чаще всего метастазируют в печень и лимфатические узлы (парапанкреатические, ворот печени, парааортальные, мезентериальные), в редких случаях – в лимфатические узлы средостения и подмышечные, еще реже в кости, брюшину, легкие, почки, щитовидную железу. Примерно 90% пациентов с НЭО ПЖ, у которых не выявлены метастазы, и около 50% пациентов с выявленными метастазами живут 5 и более лет.
Факторами более благоприятного прогноза и длительного выживания пациентов с высокодифференцированными злокачественными НЭО ПЖ, по мнению Chu Q.D. et al. [16], являются: радикальное удаление опухоли; отсутствие метастазов в печень или появление их на поздних стадиях прогрессирования опухоли; применение «агрессивной» ХТ (в случае наличия метастазов в печени).
Факторы неблагоприятного прогноза всех высокодифференцированных НЭО ПЖ: нерадикальность выполненной операции; наличие метастазов в печень; низкая степень дифференцировки клеток опухоли; инвазия кровеносных (рис. 2 А), лимфатических сосудов и нервов (рис. 2 Б) (что наблюдается в 90% опухолей с метастазами или массивной инвазией окружающих органов и тканей и лишь в 30% опухолей без метастазов). Самыми важными факторами плохого прогноза высокодифференцированных НЭО ПЖ являются метастазы в печень, высокий митотический индекс и индекс Ki67. Определение индекса мечения Ki67 НЭО ЖКТ и ПЖ в соответствии с рекомендациями ENETS является золотым стандартом при определении риска прогрессирования НЭО ПЖ, выборе лечения и оценке эффективности ХТ (17). По нашим данным, более злокачественный потенциал и высокий риск появления метастазов в печень определяет и иммунофенотип клеток НЭО ПЖ. Так, факторами плохого прогноза является ко-экспрессия маркеров нейроэндокринной (хромогранина А, синаптофизина) и экзокринной дифференцировки (маркера клеток протокового эпителия – цитокератина 19, эпителиально-мембранного антигена, муцинов) (рис. 3 А и Б), а также ко-экспрессия нескольких гормонов в одной и той же клетке опухоли (например, инсулина и гастрина, инсулина и соматостатина, соматостатина и кальцитонина, АКТГ, гастрина и т. д.) [7]. Показано также, что экспрессия ассоциированного с метастазами гена 1 (MTA1) является еще одним потенциальным маркером злокачественного потенциала НЭО ПЖ [18].
НЭО пищевода. Высокодифференцированные НЭО пищевода встречаются очень редко (примерно 0,05% всех НЭО ЖКТ). Обычно они имеют крупные размеры (более 4 см), локализуются в дистальном отделе пищевода и не дают специфических гормональных синдромов.
НЭО желудка. Опухоли 1 типа – самые многочисленные из высокодифференцированных НЭО желудка (табл. 3). Они локализованы в пределах слизистого и подслизистого слоев тела желудка, образованы чаще всего ECL-клетками, продуцирующими гистамин, и обычно ассоциируются с развитием эндокринных синдромов. НЭО желудка 2 типа встречаюся реже, чем 1 типа, но могут развиваться при синдроме МЭН-1 и сопровождаться симптомами синдрома Золлинера-Эллисона (ЗЭС). Опухоли небольших размеров могут быть удалены эндоскопически и имеют хороший прогноз. НЭО желудка 3 типа – это обычно опухоли из ECL-, серотонин- или гастрин-продуцирующих клеток, без преимущественной локализации в желудке. Опухоли 2 и 3 типа размером более 2 см, с инвазией сосудов, глубокой инвазией мышечной пластинки обычно дают метастазы в лимфатические узлы [19, 20].
НЭО двенадцатиперстной и тощей кишки. Высокодифференцированные НЭО и локализованные в двенадцатиперстной и тощей кишке обычно растут бессимптомно [15]. Выделяют 4 типа НЭО: гастриномы, соматостатиномы, нефункционирующие серотонин-, гастрин- или кальцитонин-продуцирующие нейроэндокринные карциномы и ганглиоцитарные параганглиомы. До 2/3 опухолей этой локализации составляют гастриномы, которые обычно локализуются в верхних отделах двенадцатиперстной кишки, ассоциированы с СЗЭ, имеют небольшие размеры (не более 1 см), могут быть спорадическими, а при синдроме МЭН-1 – множественными. Дуоденальные гастриномы даже небольших размеров (менее 0,5-1 см) могут давать метастазы в регионарные лимфатические узлы, которые иногда значительно больше первичной опухоли, поэтому в некоторых случаях их ошибочно трактуют как первичные гастриномы ПЖ или «первичные гастриномы лимфатических узлов». Дуоденальные соматостатиномы обычно локализуются в области Фатерова соска и не вызывают специфического синдрома. При инвазии мышечного слоя вероятность появления метастазов в регионарных лимфатических узлах очень велика. Дуоденальные ганглиоцитарные параганглиомы обычно локализуются вблизи Фатерова соска и даже при размерах более 2 см и инвазии мышечной пластинки имеют благоприятный прогноз.
Эпидемиология множественных опухолей тонкой кишки. Множественные карциноиды тонкой кишки
ФГБУ «Лечебно-реабилитационный центр» Минздрава России, Москва, Россия
Стадирование опухолей желудочно-кишечного тракта по седьмой редакции классификации TNM (2010 г.): особенности и отличия от предыдущей редакции
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2011;(8): 92‑97
Лядов В.К. Стадирование опухолей желудочно-кишечного тракта по седьмой редакции классификации TNM (2010 г.): особенности и отличия от предыдущей редакции. Хирургия. Журнал им. Н.И. Пирогова. 2011;(8):92‑97.
Lyadov VK. The gastrointestinal tumors' staging according to the 7th edition of Union of International Cancer Control (UICC 2010) classification. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2011;(8):92‑97. (In Russ.).
ФГБУ «Лечебно-реабилитационный центр» Минздрава России, Москва, Россия
ФГБУ «Лечебно-реабилитационный центр» Минздрава России, Москва, Россия
Классификация опухолей TNM («Tumor-Node-Metastasis») Международного союза по борьбе с раком является наиболее распространенным в мире способом стадирования злокачественных заболеваний. Данная классификационная система учитывает распространенность первичной опухоли (категория T), наличие метастазов в регионарные лимфатические узлы (категория N) и отдаленных метастазов (M). Комбинация трех категорий позволяет выделить стадии опухолевого процесса.
Наиболее современная, седьмая редакция данной классификации рекомендована к использованию с января 2010 г. и довольно существенно отличается от прежних редакций [14]. Обращает на себя внимание большое количество новых классификаций, а также использование в ряде случаев дополнительных прогностических факторов. Существенно изменены и дополнены системы стадирования таких распространенных опухолей, как рак пищевода, желудка, ободочной и прямой кишок.
С учетом того, что правильное стадирование опухоли является залогом проведения современной эффективной комбинированной терапии нам представляется необходимым суммировать и детально рассмотреть отличия новой редакции классификации TNM от предыдущих. Статья посвящена особенностям данной классификации относительно опухолей желудочно-кишечного тракта.
Новые классификации
Опухоли кардиоэзофагеального перехода
Опухоли, исходящие из стенки желудка или пищевода на расстоянии не более 5 см от кардиоэзофагеального перехода и распространяющиеся на пищевод, стадируются в соответствии со схемой, предложенной для рака пищевода. При отсутствии распространения на пищевод либо при расположении первичного очага в желудке на расстоянии более 5 см от кардиоэзофагеального перехода применяется классификация рака желудка.
Отсутствие данного уточнения в ранних редакциях классификации TNM приводило к тому, что опухоли кардиоэзофагеального перехода стадировались как по классификации рака пищевода, так и по схеме для рака желудка. В свою очередь это создавало серьезную путаницу при анализе результатов лечения в исходно неоднородной группе пациентов.
Гастроинтестинальные стромальные опухоли (ГИСО)
Прогностически значимыми факторами считаются локализация и размер опухоли, а также митотический индекс. Последний оценивается по числу митозов в 50 репрезентативных полях зрения высокого разрешения при исследовании участка опухоли с наиболее активной пролиферацией клеток [8].
Категория T для ГИСО всех локализаций: T1≤2 см, T2>2-5 см, Т3>5-10 см, Т4≥10 см.
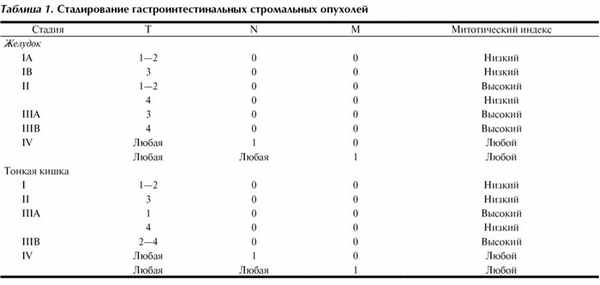
Доказанная эффективность таргетной (иматиниб, сунитиниб) терапии в отношении ГИСО обусловила стремительное развитие данной области клинической онкологии за последние годы. Появление унифицированной и признанной международным сообществом классификации (табл. 1), основанной на доказанных факторах прогноза заболевания, позволит выделить группы риска по рецидиву и более четко определять показания к применению адъювантной и паллиативной терапии.
Карциноиды и нейроэндокринные опухоли (НЭО)
Появление эффективных методов диагностики (гормональные маркеры, сцинтиграфия с аналогами соматостатина, позитронно-эмиссионная томография) и лечения (аналоги соматостатина длительного действия, интерферонотерапия, стрептозотоцин) НЭО различных локализаций диктует необходимость создания их унифицированной классификации.
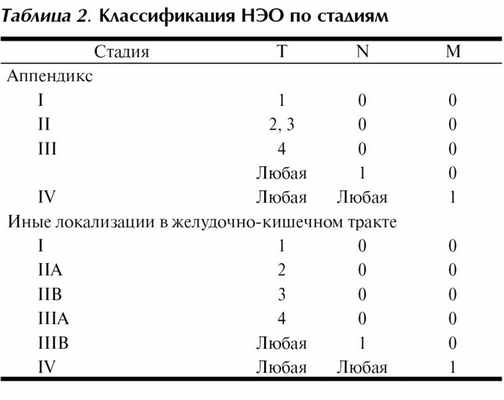
В седьмой редакции классификации TNM разработаны отдельные классификации для НЭО аппендикса, желудка, тонкой и толстой кишок (табл. 2). Мелко-/крупноклеточные (низкодифференцированные) опухоли, а также НЭО поджелудочной железы стадируются как карциномы соответствующей локализации.
Категория Т для НЭО аппендикса: Т1≤2 см; Т2>2-4 см, распространение на слепую кишку; Т3>4 см, распространение на подвздошную кишку; Т4 - выход на серозную оболочку, распространение на окружающие органы и структуры помимо описанных выше.
Категория Т для НЭО желудка: Tis 1 см или распространение на мышечный слой; T3 - распространение на субсерозный слой; Т4 - выход на серозную оболочку; врастание в окружающие структуры.
Категория Т для НЭО тонкой кишки: Т1≤1 см, распространение на собственную пластинку слизистой оболочки или подслизистый слой; Т2>1 см или распространение на мышечный слой; T3 - распространение на субсерозный слой для опухолей тощей и подвздошной кишок, врастание в поджелудочную железу или забрюшинное пространство для опухолей двенадцатиперстной кишки или фатерова соска; Т4 - выход на серозную оболочку; врастание в окружающие структуры.
Категория Т для НЭО толстой кишки: Т1≤2 см, распространение на собственную пластинку слизистой оболочки или подслизистый слой (Т1а≤1 см, Т1b>1-2 см); Т2>2 см или распространение на мышечный слой; T3 - распространение на субсерозный слой или врастание в периколярную жировую клетчатку; Т4 - выход на серозную оболочку; врастание в окружающие структуры.
Категория N - Nx - данные о поражении регионарных лимфатических узлов отсутствуют; N0 - метастазов в регионарные лимфатические узлы нет; N1 - метастазы в регионарные лимфатические узлы есть.
Карцинома аппендикса (включая бокаловидноклеточный карциноид)
Категория T: T1 - прорастание до подслизистого слоя; Т2 - распространение на мышечную оболочку; Т3 - распространение на субсерозный слой либо не покрытые брюшиной периаппендикулярные ткани; Т4а - выход на серозную оболочку/муцинозная опухоль в правом нижнем квадранте живота; Т4b - распространение на окружающие органы и структуры.
Категория N: N1 - поражено ≤ 3 регионарных лимфатических узлов; N2 - поражено > 3 регионарных лимфатических узлов.
Категория M: М1а - интраперитонеальные метастазы за пределами правого нижнего квадранта живота; M1b - отдаленные метастазы, за исключением поражения брюшины.
Распределение по стадиям - как при раке ободочной кишки. Возможно, появление данной классификации позволит сделать группу опухолей ободочной кишки более однородной, поскольку муцинозные опухоли аппендикса значительно отличаются от аденокарциномы ободочной кишки по своей биологии и требуют особого учета и описания.
Карцинома внутрипеченочных желчных протоков
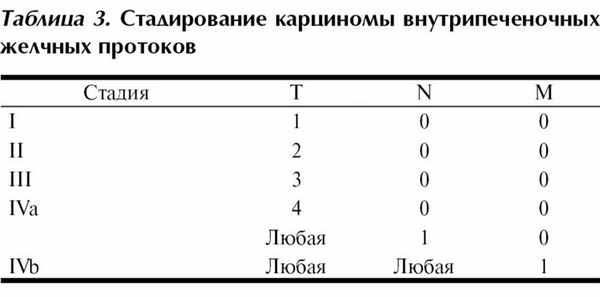
Ранее данные опухоли стадировались в соответствии со схемой, предложенной для гепатоцеллюлярного рака. Между тем существенные биологические различия этих образований едва ли позволяют оценивать результаты их лечения по единой схеме. Разработана отдельная классификация для внутрипеченочной холангиокарциномы, учитывающая количество опухолей, наличие сосудистой инвазии и поражение регионарных лимфатических узлов (табл. 3).
Категория Т: Т1 - солитарный очаг без сосудистой инвазии (включая как инвазию крупных ветвей воротной и печеночных вен, так и микрососудистую инвазию); Т2а - солитарный очаг, имеется сосудистая инвазия; Т2b - множественные опухоли (включая первично-множественные опухоли, сателлиты и внутрипеченочные метастазы) с сосудистой инвазией или без нее; Т3 - выход на висцеральную брюшину либо прямая инвазия в окружающие органы; Т4 - наличие распространения по ходу протоков (перидуктально).
Категория N: N0 - нет метастазов в регионарные лимфатические узлы; N1 - поражены регионарные лимфатические узлы. Метастазы в лимфатических узлах вокруг чревного ствола либо в аортокавальных узлах считаются отдаленными.
Применение данной классификации позволит накопить больший объем информации об особенностях развития и прогноза внутрипеченочной холангиокарциномы и соответственно должно способствовать улучшению результатов ее лечения.
Опухоли внепеченочных желчных протоков
Ранее существовавшая классификация TNM опухолей внепеченочных желчных протоков [15] разделена на классификации образований проксимального отдела внепеченочных желчных протоков (правый и левый долевые протоки и общий печеночный проток до места впадения пузырного протока) и опухолей дистальных отделов.

Категория T для проксимально расположенных опухолей: Т1 - распространение в пределах стенки протока; Т2а - выход за пределы стенки протока; Т2b - распространение на паренхиму печени; Т3 - поражение ветвей воротной вены или печеночной артерии с одной стороны; Т4 - поражение ствола воротной вены или двустороннее поражение ее ветвей (табл. 4).
Категория T для рака дистальных отделов печеночных протоков: Т1 - опухоль не прорастает стенку протока; Т2 - выход за пределы стенки протока; T3 - распространение на окружающие органы и сосуды; T4 - распространение на чревный ствол или верхнюю брыжеечную артерию. Распределение по стадиям не изменилось. Категория N: N1 - метастазы в регионарные лимфатические узлы.
Деление образований желчных протоков на опухоли внутрипеченочных протоков, проксимального и дистального отделов внепеченочных протоков обусловлено анатомическими особенностями различных отделов желчного дерева и давно признается хирургами и онкологами. Появление уточненной классификации лишь отражает этот подход и должно позволить более объективно оценивать результаты лечения.
Классификационные системы, претерпевшие существенные изменения
Рак пищевода
Категория T: в группу Tis отнесена дисплазия высокой степени. Выделены группы T1a: инвазия собственной либо мышечной пластинки слизистой оболочки и T1b: инвазия подслизистого слоя. Сохранены группы T2: поражение мышечной оболочки пищевода и T3: выход опухоли за пределы пищевода (поражение адвентиции). Группа T4 разделена на T4a: врастание в плевру, перикард, диафрагму или брюшину и T4b: поражение прочих рядом расположенных структур.
Категория N: внедрена стратификация по числу пораженных регионарных лимфатических узлов: N1 - 1-2 измененных узла, N2 - 3-6 узлов, N3 >6 метастатически измененных узлов.
Категория M: отсутствует выделение M1a и M1b, любые отдаленные метастазы относятся к категории M1.
Наконец, внедрены уточняющие схемы стадирования с учетом степени дифференцировки, расположения и гистологического строения (аденокарцинома/плоскоклеточный рак) для ранних стадий рака пищевода (табл. 5, 6, 7).
Рак желудка
Категория T: без изменений осталась стадия T1: T1a - распространение в пределах собственной пластинки слизистой оболочки; T1b - инвазия в подслизистый слой; T2 - поражение мышечной оболочки желудка; Т3 - врастание в субсерозный слой (ранее T2b); T4a - выход на серознуюоболочку (ранее Т3); T4b - врастание в окружающие структуры.
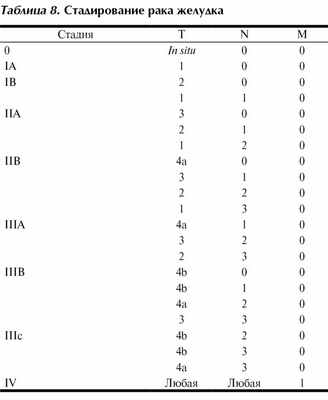
Категория N: N1 - 1-2 метастатических лимфатических узла; N2 - 3-6 пораженных узлов (ранее N1); N3а - 7-15 пораженных узлов (ранее N2); N3b - 16 и более пораженных узлов (ранее N3) (табл. 8).
Эти изменения уточняют и закрепляют ранее выработанный в отношении рака желудка принцип оценки количества метастатических лимфатических узлов, а не их локализации, а также отражают данные о значительном отрицательном влиянии на выживаемость пациентов выхода опухоли на серозную оболочку желудка.
Рак ободочной и прямой кишок
Изменения коснулись всех анатомических категорий, в рамках которых выделены подгруппы. Так, стадия T4 разделена на T4a - опухоль выходит на поверхность висцеральной брюшины и Т4b - прямая инвазия в окружающие структуры.
Категория N: N1a - 1 пораженный лимфатический узел; N1b - 2-3 пораженных узла; N1c - опухолевые сателлиты [1] в брыжейке кишки без поражения регионарных лимфатических узлов; N2a - от 4 до 6 пораженных узлов; N2b - 7 и более пораженных узлов.

Категория M: M1a - метастазы в один орган; M1b - метастазы более чем в один орган либо карциноматоз брюшины (табл. 9).
Последние десятилетия ознаменовались фундаментальными открытиями и достижениями в области биологии опухолевых заболеваний. Достаточно подробно изучены такие образования, как гастроинтестинальные стромальные и нейроэндокринные опухоли, карцинома внутрипеченочных желчных протоков и ряд других. В клиническую практику вошли таргетная терапия, иммунотерапия, а комбинированное лечение является сегодня стандартом помощи при раке различной локализации. Не случайно, что существенные изменения коснулись и системы стадирования опухолей по TNM [14].
Появился ряд новых классификаций. Например, отдельная система стадирования разработана для рака внутрипеченочных желчных протоков. Публикация в 2009 г. результатов крупного эпидемиологического исследования (598 пациентов) Н. Nathan и соавт. [7] позволила разработать данную классификацию, исключив из нее размер опухоли, поскольку данный критерий при статистическом анализе не оказывал существенного влияния на выживаемость пациентов. Кроме того, выяснилось, что наличие множественных очагов опухоли и сосудистой инвазии прогностически неблагоприятно, однако эти факторы не обладают аддитивным негативным влиянием на выживаемость. Наконец, выделение в отдельную группу с неблагоприятным прогнозом образований с перидуктальным распространением (Т4) будет способствовать их учету и анализу.
Всеобъемлющей переработке подверглась классификация рака пищевода. Основанием для изменений послужили выводы Всемирной комиссии по борьбе с раком пищевода (Worldwide Esophageal Cancer Collaboration). Глубокий статистический анализ выживаемости 4627 больных раком пищевода и пищеводно-желудочного перехода, не получавших предоперационной или послеоперационной адъювантной терапии, позволил стратифицировать больных на 10 достаточно гомогенных групп в зависимости от глубины инвазии в стенку пищевода и числа пораженных лимфатических узлов [12].
К важнейшим результатам исследования относятся данные о том, что при отсутствии лимфогенного метастазирования прогностической значимостью обладают степень дифференцировки и локализация опухоли. В то же время при наличии метастазов в регионарные лимфатические узлы эти факторы утрачивают значение, и на первый план выходит количество пораженных лимфатических узлов, что ранее было показано в отношении карциномы желудка и колоректального рака [1, 6]. Отсюда возникли уточняющие прогностические системы стадирования для начальных стадий аденокарциномы и плоскоклеточного рака пищевода.
Большое значение имеет уточнение принципа стадирования опухолей пищеводно-желудочного перехода, поскольку ранее существовали затруднения при стадировании этих образований. В соответствии с новой редакцией все опухоли, вовлекающие пищевод и исходящие из области на 5 см проксимальнее и на 5 см дистальнее кардиоэзофагеального перехода, классифицируются по предложенной для рака пищевода схеме. Высокая прогностическая точность данной классификации, а также уточненной классификации рака желудка уже была подтверждена независимыми исследователями [5, 11, 16].
Существенным изменением является удаление из классификации категории Mx. Ранее широкое использование данной категории нередко приводило к неадекватному учету подобных случаев в онкологических регистрах. На сегодняшний день любая опухоль без клинических или патологоанатомических признаков отдаленных метастазов регистрируется как клинически М0 (сM0). Для установления данной стадии принципиально достаточно сбора анамнеза и осмотра пациента [2].
Существенно расширены категории T и N при колоректальном раке, что позволило более равномерно стратифицировать пациентов по 10 стадиям. Основанием для данных изменений послужили результаты эпидемиологического исследования L. Gunderson и соавт. [3, 4], посвященного анализу исходов лечения 36 тыс. пациентов с раком прямой кишки и 110 тыс. больных аденокарциномой ободочной кишки. Широкое обсуждение вызывает выделение опухолевых сателлитов колоректального рака в жировой клетчатке в отдельную группу метастазов (категория N1c). Отсутствие четких критериев для дифференцировки между очагами прерывистого роста первичной опухоли, участками венозной инвазии или полностью замещенными опухолью лимфатическими узлами привело к появлению данной отдельной категории с неопределенным влиянием на прогноз [9, 10, 13].
Таким образом, основными отличиями новой редакции классификации TNM от предыдущих следует признать создание новых классификаций для редких образований, выделение большего числа классификационных групп для наиболее распространенных локализаций рака, закрепление принципа регистрации количества пораженных лимфатических узлов, а не их локализации. Можно предположить, что развитие классификации потребует уточнения адекватности впервые созданных классификаций в независимых исследованиях, а также, в перспективе, позволит максимально индивидуализировать лечебные подходы у онкологических больных.
[1] Если опухолевый узел расценивается патологоанатомом как полностью замещенный опухолевой тканью лимфатический узел (обычно с гладким контуром), его следует трактовать как пораженный регионарный лимфатический узел (т.е. N1a, N1b, N2a или N2b).
Читайте также:
