Если вам поставили диагноз дисбактериоз. Лечение дисбактериоза
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Диcбактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Дисбактериоз, или дисбиоз – это качественное и количественное изменение микрофлоры в организме. Для него характерно увеличение или резкое уменьшение бактерий, снижение их разнообразия. Дисбактериоз может возникнуть на любом участке, где присутствуют бактерии, включая кожу, влагалище, ротовую полость и т.д.
Микрофлора играет важную роль в поддержании работы иммунной системы, но существует и обратная связь – при серьезном снижении иммунитета возникает дисбактериоз.
Причины появления дисбактериоза
В кишечнике человека присутствует от 70 до 80% клеток иммунной системы. Поэтому любая нестабильность кишечной микрофлоры может нарушить естественные защитные механизмы организма, настроенные против болезней и недомоганий.
Дисбактериоз кишечника связан не только с кишечными расстройствами, но и с множеством других состояний, на первый взгляд не относящихся к пищеварению, – кожными проблемами (акне, экзема), неврологическими расстройствами и т.д.
Среди причин развития дисбактериоза отмечают:
- Увеличение числа болезнетворных бактерий и дрожжевых грибов (например, кандида) и недостаток полезных микроорганизмов.
- Проникновение микроорганизмов, в норме находящихся в толстом отделе кишечника, в тонкий кишечник. Это происходит при хронических заболеваниях, характеризующихся поражением слизистой оболочки желудочно-кишечного тракта (болезнь Крона или неспецифический язвенный колит).
- К другим факторам врачи относят генетическую предрасположенность, несбалансированное питание с низким содержанием клетчатки, но с высоким содержанием сахара и обработанных продуктов, физический и психологический стресс, чрезмерное потребление алкоголя, частое применение антибактериальных препаратов и средств от изжоги, плохую гигиену полости рта.
- Дисбактериоз у практически здоровых лиц:
- возрастной дисбактериоз – изменения микрофлоры у людей пожилого возраста;
- сезонный дисбактериоз – изменения микрофлоры в холодное время года;
- нутритивный дисбактериоз – связанный с несбалансированным питанием;
- профессиональный дисбактериоз – при различных профессиональных вредностях.
- Дисбактериоз, сопровождающий различные заболевания органов пищеварения (желудка, поджелудочной железы, печени и желчевыводящих путей, кишечника, при синдроме мальабсорбции (нарушенном всасывании питательных веществ)).
- Дисбактериоз при других заболеваниях:
- инфекционных,
- иммунодефицитных,
- при гипо- и авитаминозах (уменьшенном поступлении в организм или плохой усвояемости необходимых витаминов),
- при интоксикациях и воздействии на организм человека радионуклидов (радиоактивных изотопов, которые можно встретить в местах с повышенным радиационным фоном, в ограниченном количестве и под строгим контролем они используются для диагностики и лечения некоторых заболеваний).
- Лекарственный дисбактериоз. Возникает вследствие приема антибиотиков, иммунодепрессантов, антацидов, антисекреторных, слабительных средств, химиотерапии и других лекарственных препаратов.
- Стрессорный дисбактериоз. Возникает как результат длительного эмоционального или физического стресса.
- Бессимптомная форма дисбактериоза.
- Локальная, или местная форма дисбактериоза. Наблюдается при развитии локального воспалительного процесса в кишечнике (у больного появляются симптомы колита или энтерита – воспалительных заболеваний толстого или тонкого кишечника).
- Распространенная форма дисбактериоза. Проявляется выраженными нарушениями пищеварения.
- 1-я степень тяжести;
- 2-я степень тяжести;
- 3-я степень тяжести;
- 4-я степень тяжести.
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
- изучение клинических признаков;
- исследование верхних отделов желудочно-кишечного тракта, в том числе эндоскопическое с аспирацией содержимого или биопсией тощей кишки, включающее бактериологическое исследование аспирата или биоптата (это наиболее точный метод, однако в силу технических сложностей он не может быть использован повседневно);
- посев кала на дисбактериоз;
- исследование копрограммы после предварительной пищевой нагрузки.
Симптомы дисбактериоза зависят от формы и степени тяжести течения заболевания. Пациенты могут предъявлять жалобы на расстройство желудка, тошноту, диарею или запор, повышенное газообразование и вздутие живота, снижение аппетита, необъяснимую усталость и проблемы с концентрацией внимания, неприятный запах изо рта, высыпания на коже.
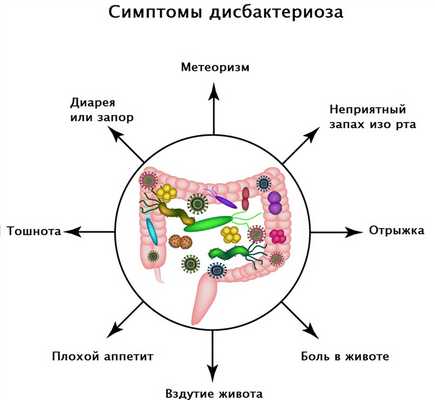
Диагностика заболевания
При постановке диагноза врач обращает внимание на жалобы, симптомы заболевания и результаты осмотра. Но для оценки степени тяжести дисбактериоза обычно требуются лабораторные и инструментальные обследования.
- Клинический анализ крови с развернутой лейкоцитарной формулой.
Лечение дисбактериоза
Терапия дисбактериоза направлена не только на излечение заболевания, но и на повышение иммунитета организма.
Первостепенное значение имеет диета, исключающая острую, жареную, копченую пищу, продукты с высоким содержанием сахара, быстрые углеводы, некоторые фрукты (яблоки, бананы, виноград), молочные продукты, но допускающая кисломолочные, поскольку они содержат пробиотики и стимулируют рост полезных микроорганизмов.
Предпочтение следует отдавать продуктам, богатым пищевыми волокнами (хлеб из муки грубого помола, крупы, кроме белого риса, овощи и зелень, сухофрукты).
Медикаментозное лечение дисбактериоза обычно включает антибактериальные синтетические средства (кишечные антисептики), бактериофаги, пробиотики, пребиотики. Антибиотики назначают в случае распространенной формы дисбактериоза, выраженной интоксикации, длительной диареи, лабораторно доказанного микробного заражения кишечника, при тяжелом иммунодефиците. Препарат, дозу, кратность и путь введения рекомендует врач.
Для купирования диареи, боли в животе, уменьшения вздутия принимают препараты симптоматической терапии.
Осложнения
Дисбактериоз негативно влияет на иммунную систему и ослабляет защитные силы организма. В результате повышается восприимчивость к инфекционным и простудным заболеваниям.
Нарушение кишечной микрофлоры ведет к проблемам с обменом веществ, обострениям эндокринологических заболеваний.
Доказана связь между психическим здоровьем и дисбактериозом. Депрессии и повышенная тревожность могут возникнуть на фоне дисбактериоза или же их течение может усугубляться.
У женщин дисбактериоз кишечника способен привести к нарушению нормальной микрофлоры влагалища, что чревато развитием бактериального вагиноза, кандидоза и других заболеваний мочеполовой системы.
Профилактика дисбактериоза
Для профилактики дисбактериоза необходимо следить за рационом питания, обязательно включать в него пищу, богатую клетчаткой и пищевыми волокнами, кисломолочные продукты.
Если по медицинским показаниям врачи назначают антибиотики, то их прием следует сопровождать пробиотиками и пребиотиками, а в ряде случаев противогрибковыми препаратами.
КИШЕЧНЫЙ ДИСБАКТЕРИОЗ
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Что понимают под дисбактериозом?
Какие методы диагностики являются современными и достоверными?
Какие лекарственные препараты применяются при дисбактериозе?
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
Нормальная микробная флора кишечника
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
Дисбактериоз
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
Дисбактериоз тонкой кишки
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Дисбактериоз толстой кишки
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические особенности дисбактериоза
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Основным симптомом псевдомембранозного колита является обильная водянистая диарея, началу которой предшествовало назначение антибиотиков. Затем появляются схваткообразные боли в животе, повышается температура тела, в крови нарастает лейкоцитоз. Эндоскопическая картина псевдомембранозного колита характеризуется наличием бляшковидных, лентовидных и сплошных «мембран», мягких, но плотно спаянных со слизистой оболочкой. Изменения наиболее выражены в дистальных отделах ободочной и прямой кишок. Слизистая оболочка отечная, но не изъязвлена. При гистологическом исследовании обнаруживают субэпителиальный отек с круглоклеточной инфильтрацией собственной пластинки, капиллярные стазы с выходом эритроцитов за пределы сосудов. На стадии образования псевдомембран под поверхностным эпителием слизистой оболочки возникают экссудативные инфильтраты. Эпителиальный слой приподнимается и местами отсутствует; оголенные места слизистой оболочки прикрыты лишь слущенным эпителием. На поздних стадиях болезни эти участки могут занимать большие сегменты кишки.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Методы диагностики
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
Лечение
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Бактериальные препараты
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Регуляторы пищеварения и моторики кишечника
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
К вопросу о дисбиозе кишечника и его коррекции у детей
Важнейшую роль в жизнедеятельности организма человека играет микробиоценоз кишечника. Всю микрофлору кишечника можно разделить на три группы: основная — бифидобактерии ( Bifidobacterium (В.) bifidum, B. brevis, B. longum, B. adolescentis и др.) и лактоба
Важнейшую роль в жизнедеятельности организма человека играет микробиоценоз кишечника. Всю микрофлору кишечника можно разделить на три группы: основная — бифидобактерии (Bifidobacterium (В.) bifidum, B. brevis, B. longum, B. adolescentis и др.) и лактобациллы (Lactobacillus (L.) acidophilus, L. fermentum, L. brevis, L. lactis и др.); сопутствующая — кишечные палочки с типичными биологическими свойствами и энтерококки (Enterococcus (Е.) fecalis, E. faecium) и остаточная — условно-патогенные бактерии семейства энтеробактерий: клебсиеллы, цитробактеры, протеи и др., а также дрожжеподобные грибы.
Нормальная микрофлора выполняет важные функции — защитную, обменную и иммуноиндуцирующую, участвуя в поддержании гомеостаза. Нарушение любой из них сопровождается изменением метаболизма, возникновением дефицита микронутриентов, снижением иммунного статуса.
Нарушения микробиоценоза кишечника связаны с характером питания, возрастом, проведением антибактериальной, гормональной, лучевой терапии, хроническими заболеваниями желудочно-кишечного тракта, изменением иммунного статуса, состоянием окружающей среды; они наступают задолго до клинических проявлений. Изменения нормальной микрофлоры получили название дисбактериоза, или дисбиоза. Дисбактериоз является микробиологическим понятием и ни в коем случае не может быть самостоятельным диагнозом.
Микроэкологическая классификация степеней тяжести дисбиоза кишечника была предложена в 1998 г. С. Д. Митрохиным.
I степень тяжести — увеличено или уменьшено общее количество кишечных палочек. Кишечные палочки с атипичными биологическими свойствами отсутствуют. Количество бифидобактерий и лактобацилл не изменено. Изменения в общих показателях микробного метаболитного паспорта фекалий характерны лишь в отношении пула летучих жирных кислот (ЛЖК), содержания фенилпропионовой кислоты, скатола и метиламина. Общее содержание ЛЖК у больных с I степенью тяжести дисбактериоза может быть несколько меньшим или большим, чем у здоровых лиц. Содержание скатола снижено. Содержание фенилуксусной кислоты и метиламина повышено. Отмечаются изменения удельного веса щавелевоуксусной кислоты в профиле дикарбоновых кислот (ДКК). Дисбактериоз — латентный, компенсированный, кишечные дисфункции не регистрируются.
II степень тяжести — незначительно снижено количество бифидобактерий и лактобацилл. Наблюдаются количественные и качественные (появление форм с атипичными биологическими свойствами) изменения кишечных палочек. Высеваются в умеренном количестве условно-патогенные кишечные микроорганизмы. Отмечаются изменения как в общих, так и в специфических показателях микробного метаболитного паспорта фекалий (снижение экскреции с фекалиями фенольных соединений: п-крезола, индола, а также скатола). Количество фенилпропионовой кислоты на порядок превышает таковое у здоровых лиц. Профиль фенольных соединений (ФС) также меняется: удельный вес индола возрастает более чем в 2 раза, несколько снижается удельный вес п-крезола и более чем в 10 раз снижен удельный вес скатола. В целом экскреция с фекалиями карбоновых и ароматических аминокислот, фенольных и индольных соединений (за исключением фенилаланина), а также гистамина и серотонина при II степени тяжести дисбиоза снижена. Изменен профиль сложных и простых аминов (АмП): удельный вес гистамина и серотонина ниже, а представителя простых аминов — метиламина — выше. Дисбактериоз — локальный (местный), субкомпенсированный; кишечные дисфункции, как правило, не наблюдаются.
III степень тяжести — существенное снижение количества бифидобактерий (105–106) в сочетании со снижением количества лактобацилл и резким изменением типичных свойств кишечных палочек (значительное преобладание гемолитических, лактозонегативных форм). Значительное увеличение количества условно-патогенных бактерий с патогенными свойствами (гемолитических форм) и патогенных дрожжеподобных грибов (родов Candida albicans, Geotrichum и др.). Характерны еще более выраженные изменения как в общих, так и в специфических показателях микробного метаболитного паспорта фекалий. Снижена величина экскреции с фекалиями ФС: п-крезола и индола. В фекалиях практически отсутствует скатол. Напротив, содержание фенилпропионовой кислоты в каловых массах резко увеличивается. Профиль ФС меняется таким образом, что существенно увеличивается удельный вес индола и значительно снижается удельный вес п-крезола. Cодержание в фекалиях гистамина и серотонина может быть выше или ниже по сравнению с нормой (зависит от нозологической формы основного заболевания). Содержание карбоновых кислот меняется следующим образом: резко уменьшается пул ЛЖК, практически не обнаруживается щавелевоуксусная кислота и значительно возрастает экскреция с каловыми массами альфа-кетоглутаровой кислоты. Изменен профиль ЛЖК. При нарушениях стула по типу диареи удельный вес уксусной кислоты ниже, а пропионовой и масляной кислот, наоборот, повышен, при констипации наблюдается противоположная картина. Отмечаются снижение или увеличение удельного веса молочной кислоты и аналогичные изменения удельного веса альфа-кетоглутаровой кислоты в профиле ДКК.
IV степень тяжести — резкое снижение или отсутствие бифидобактерий, значительное уменьшение количества лактобацилл, резкое уменьшение количества или отсутствие кишечных палочек с типичными свойствами, значительное возрастание количества как облигатных, так и факультативных видов (в норме не встречающихся) кишечных бактерий и дрожжеподобных грибов с патогенными свойствами. Выявляются патогенные кишечные бактериии (сальмонеллы, шигеллы, ерсинии). Качественные изменения в микробном метаболитном паспорте остаются такими же, как и при III степени, но их количественные характеристики еще более изменены; характерна глубокая разбалансировка биохимических регуляторных механизмов микробной экосистемы, сочетающаяся с аналогичной разбалансировкой микробной инфраструктуры кишечника. Дисбактериоз — распространенный (с бактериемией), декомпенсированный (с угрозой генерализации инфекции, сепсиса или септикопиемии); наблюдаются выраженные кишечные дисфункции.
В клинической практике условно выделяются три основные группы кишечной микрофлоры: облигатная — постоянно встречающаяся (резидентная, аутохтонная, индигенная); добавочная (сопутствующая) и транзиторная (случайная, аллохтонная) (табл.).
В зависимости от клинических проявлений выделяют различные степени проявления дисбактериоза. В частности, одна из таких классификаций принадлежит В. А. Таболину (1998).
I степень — латентная фаза дисбиоза, проявляется только в снижении на один-два порядка количества защитной микрофлоры — бифидобактерий, лактобацилл, а также полноценных кишечных палочек (до 80% от общего количества). Остальные показатели соответствуют физиологической норме (эубиозу). Как правило, начальная фаза не вызывает дисфункций кишечника и возникает при воздействии неблагоприятных факторов (нарушение режима питания и др.). В этой фазе возможно вегетирование в кишечнике незначительного количества отдельных представителей условно-патогенной флоры. Клинических проявлений дисбактериоза в этой фазе нет.
II степень — пусковая фаза более серьезных нарушений, характеризуется выраженным дефицитом бифидобактерий на фоне нормального или сниженного количества лактобацилл или снижения их кислотообразующей активности, дисбалансом в количестве и качестве кишечных палочек, среди которых нарастает доля лактозонегативных или цитратассимилирующих вариантов. При этом на фоне дефицита защитных компонентов кишечного микробиоценоза происходит размножение либо плазмокоагулирующих стафилококков, либо протеев, либо грибов рода Candida albicans. Вегетирование в кишечнике протеев или плазмокоагулирующих стафилококков в этой фазе развития дисбактериоза чаще транзиторное, чем постоянное. Функциональные расстройства пищеварения выражены неотчетливо — спорадически жидкий стул зеленоватого цвета с неприятным запахом, со сдвигом рН в щелочную сторону, иногда — задержка стула; может отмечаться тошнота.
III степень — фаза агрессии аэробной флоры, характеризующаяся отчетливым нарастанием содержания агрессивных микроорганизмов; при этом размножаются до десятков миллионов в ассоциации золотистые стафилококки и протеи, гемолитические энтерококки; наблюдается замещение полноценных эшерихий бактериями родов Klebsiella, Enterobacter, Citrobacter и др. Эта фаза дисбактериоза проявляется дисфункциями кишечника с расстройствами моторики, секреции ферментов и всасывания. У больных отмечается учащенный разжиженный стул, часто зеленого цвета, ухудшение самочувствия, дети становятся вялыми, капризными.
IV степень — фаза ассоциативного дисбиоза, характеризующаяся глубоким разбалансированием кишечного микробиоценоза с изменением количественных соотношений основных групп микроорганизмов, изменением их биологических свойств, накоплением токсических метаболитов. Характерно вегетирование энтеропатогенных серотипов E. coli, сальмонелл, шигелл и других возбудителей острых кишечных инфекций. Возможно размножение клостридий. Эта фаза дисбиоза характеризуется функциональными расстройствами пищеварительной системы и нарушениями общего нутритивного статуса, дефицитом массы тела, бледностью кожных покровов, частым стулом с примесью слизи, зелени, иногда крови, с резким гнилостным или кислым запахом.
Для подтверждения диагноза необходимо провести следующее исследование:
Определение состава фекальной микрофлоры — наиболее доступный метод, однако он недостаточно информативен, поскольку отражает микробный состав лишь дистальных отделов кишечника. Важным диагностическим тестом синдрома избыточного бактериального роста является экскреторный дыхательный тест с идентификацией различных метаболитов, которые продуцируются с участием интракишечных бактерий (лактулозный тест с определением в выдыхаемом воздухе Н2). Последний для повседневной педиатрической практики представляется наиболее приемлемым. Газожидкостная хроматография позволяет оценить химические соединения, связанные с жизнедеятельностью нормальной микрофлоры. В ряде случаев целесообразно исследование липополисахаридов (ЛПС)-О-антигена и уровня энтеротоксинов. Для определения степени дисбактериоза можно пользоваться стандартным методом Р. Б. Эпштейн–Литвак и Ф. Л. Вильшанской (1969).
Коррекция нормального состава кишечной флоры должна быть комплексной и направленной в первую очередь на лечение основного заболевания, вызвавшего дисбаланс микрофлоры; необходим комплекс лечебно-охранительных мероприятий по общему оздоровлению организма ребенка в целом и на коррекцию его микрофлоры в частности.
Организация охранительного режима включает благоприятную психологическую атмосферу, длительное пребывание на свежем воздухе, более продолжительный сон, соответствующий режим питания.
Адекватное, сбалансированное питание в соответствии с возрастом ребенка при нормальном функционировании органов и систем предотвращает развитие дисбиозов. Наиболее важным мероприятием является естественное вскармливание детей грудного возраста. Идеальной пищей для новорожденного ребенка и детей первых месяцев жизни является молоко матери, которое больше всего подходит ее ребенку, так как имеет родственную связь с его тканями. Углеводы грудного молока (90% из них составляет β-лактоза) ферментируются посредством бифидобактерий в молочную кислоту, которая обеспечивает низкий уровень рН стула у детей. В литературе неоднократно отмечалось влияние естественного вскармливания на состояние микробиоценоза кишечника у детей раннего возраста. Так, состав микрофлоры мекония новорожденных, получавших грудное молоко, отличался низким содержанием аэробной микрофлоры, превалированием бифидофлоры над аэробной флорой и низким содержанием гнилостных бактерий (клостридии, бактероиды, род Proteus). При искусственном вскармливании рост бифидобактерий либо отсутствовал полностью, либо их содержание было резко снижено.
В настоящее время широкое распространение получает так называемое функциональное питание. Употребляются готовые пищевые продукты, в которые добавлены биопрепараты, антиоксиданты, каротиноиды, ферменты и другие субстраты. Для детей раннего возраста, находящихся на искусственном вскармливании, рекомендуются адаптированные смеси, обогащенные представителями микрофлоры: «Малютка», «Биолакт адаптированный», «Бифидок», «Бифилин», «Бифидолакт», «Бифилайф», «Виталакт» и др. Во многих случаях оправдывает себя применение сухой смеси «Лактофидус», содержащей бифидобактерии и стрептококки, и смеси «НАН» с бифидобактериями. Для выхаживания детей неонатального периода разработано функциональное питание в виде лиофилизированного грудного молока, обогащенного B. bifidum. Принимая во внимание, что одним из важнейших этапов выхаживания новорожденных в отделениях реанимации и интенсивной терапии является организация рационального вскармливания, недавно на кафедре неонатологии РГМУ был разработан новый вид функционального питания специально для вышеназванного контингента детей. Данный тип функционального питания представляет собой лиофилизированное грудное молоко, содержащее B. bifidum 791 в концентрации 10 8 КОЕ/мл (Ю. Г. Мухина, 2000). Функциональное питание не относится к категории лекарственных препаратов, используется для улучшения здоровья человека в целом.
Диета у детей с проявлениями дисбактериоза должна быть полноценной по калорийности и содержанию основных физиологических ингредиентов. Прием пищи необходимо осуществлять в одни и те же часы, желательно восстановить эндогенный биоритм пищеварения. Питание должно быть как можно более разнообразным. При этом желательно исключить или ограничить употребление продуктов, агрессивных в отношении аутофлоры, таких как макароны и вермишель из муки высшего сорта, консервы и полуфабрикаты из мяса, рыбы, бобовых, все виды свинины, баранины, печень, почки, мозги, тугоплавкие животные жиры, цельное и сгущенное молоко, сладкие йогурты, консервированные овощи и фрукты, сладости, лимонад, мороженое, шоколад. К группе рекомендуемых продуктов, стимулирующих рост индигенной микрофлоры кишечника, относятся чечевица, изделия из пшеницы, ржи, кукурузы, гречихи, проса, некоторые овощи — капуста, морковь, кабачки, тыква, артишок, топинамбур, свежие фрукты, неконсервированные фруктовые и овощные соки, орехи, мясо и рыба нежирных сортов, кисломолочные продукты, растительные жиры.
В комплексной диетотерапии больных дисбактериозами можно использовать и кобылий кумыс. Под его влиянием у больных уменьшаются гнилостные процессы в кишечнике, снижается количество гнилостных бактерий и улучшаются биологические свойства E. coli и других представителей индигенной микрофлоры. Е. А. Толмачевой разработана технология изготовления кумыса из коровьего молока, изучено его действие на кишечную микрофлору. Применение коровьего кумыса приводило к резкому уменьшению роста в кишечнике спороносных анаэробных бактерий, главным образом B. putrificus, B. perfringens и B. sporogenes.
Важное значение имеет также наличие в питании овощей, фруктов и растений, обладающих антимикробной активностью. Многие антибактериальные вещества, выделенные из растений, стимулируют иммунобиологические реакции организма, инактивируют бактериальные экзотоксины и гиалуронидазу.
Представляется уместным подчеркнуть, что только комплексная коррекция дисбиоза дает более выраженный стойкий клинический и микробиологический эффект. Одной из главных составляющих этого комплексного подхода является заместительная терапия.
Важнейшим методом терапии дисбиоценоза (дисбактериоза) кишечника является применение лекарственных средств биологического происхождения, способных регулировать равновесие микрофлоры кишечника. С целью ликвидации дефицита индигенной флоры используют пробиотики — препараты живых микроорганизмов (представителей индигенной микрофлоры кишечника), которые обладают способностью целенаправленно регулировать кишечную микроэкологию и восстанавливать эубиоз. Это кисломолочные бактерии, бифидобактерии, кисломолочные стрептококки.
Препараты-пробиотики на основе этих микроорганизмов широко используются в западноевропейских странах, Канаде и США в качестве пищевых добавок, а также в йогуртах и других молочных продуктах. Микроорганизмы, входящие в состав пробиотиков, непатогенны, нетоксигенны, сохраняют жизнеспособность при хранении. Пробиотики не считаются лекарственными препаратами, а рассматриваются как средства, благоприятно влияющие на состояние здоровья людей. В педиатрической практике получили широкое распространение такие пробиотики, как Бифидумбактерин, Лактобактерин, Колибактерин, Бификол, Бифидумбактерин-форте, Ацилакт, Примадофилюс, Линекс, Бифиформ и др.
Для усиления действия пробиотиков рекомендуется дополнительно назначать средства, обладающие противовоспалительными и иммуномодулирующими свойствами: Ф (Иммунал, Echinacea with Golden Seal), комплексные иммуномодулирующие препараты и витаминно-минеральные комплексы.
Оптимизация диагностики, индивидуализация лечения и проведение профилактики дисбактериоза кишечника позволят повысить эффективность терапии и обеспечат устойчивый бактериологический фон кишечника человека, что будет способствовать поддержанию хорошего качества жизни.
П. Л. Щербаков, доктор медицинских наук, профессор
НЦЗД РАМН, Москва
Диcбактериоз
- Клинический анализ крови с развернутой лейкоцитарной формулой.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий.
Читайте также:
