Факторы, влияющие на экспрессию гена
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Долгое время биологи думали, что мы наследуем что-либо от наших биологических родителей исключительно за счет генов. Но в последние десятилетия ученые стали добавлять: важно не только то, какие гены есть в ДНК, но и то, как и где они работают. Так в генетике появился новый раздел — эпигенетика. «Чердак» рассказывает об этом подробнее: о том, как работают по-настоящему эффективные менеджеры генов, о том, как стресс переживших войну и геноцид родителей влияет на их детей, и о возможном будущем без рака, но с запасным сердцем и сверхвыносливой печенью.
Эпигенетика занимается тем, как наследуются приобретенные изменения. Нет, речь не о том, что если жираф будет систематически тренироваться объедать возможно более высокие ветки, то его дети вырастут еще выше. И не о том, что живые существа можно приучить к чему-то так, чтоб их потомство поменяло свой внешний вид или свои физиологические особенности. Эпигенетика — это наука о наследуемых изменениях в паттернах экспрессии генов, или, как писал еще в 1942 году сам автор термина Конрад Уоддингтон, «раздел биологии, изучающий те причинно-следственные связи между генами и их производными, которые приводят к формированию фенотипа».
Ни определение почтенного британского биолога, одной из ключевых фигур в теоретической биологии, ни слова о паттернах экспрессии сами по себе нельзя назвать особенно простыми, поэтому мы начнем с другой стороны.
Клетка как молекулярный наноробот
XX век открыл человечеству совершенно новый мир, где клетки оказались не безликими строительными кирпичиками живой ткани, а сложнейшими объектами, по сути организмами в организме. Или, что будет вполне корректно, самовоспроизводящимися нанороботами, существование которых поддерживается за счет трех типов молекул: липидов, белков и нуклеиновых кислот.
Нуклеиновые кислоты и белки собираются из стандартных блоков — нуклеотидов и аминокислот соответственно. При том, что земные организмы используют всего пять нуклеотидов, а аминокислот известно несколько сотен разновидностей, вариантов нуклеиновых кислот и белков может быть гораздо большее количество. Сама возможность жизни основывается на том, что комплект белков и ДНК может синтезировать копию самого себя, создавая второй комплект ДНК и второй набор белков.
В ДНК записана информация, позволяющая синтезировать все остальные сложно организованные молекулы. При помощи специальных белков с ДНК можно снять слепок в виде молекулы РНК (это рибонуклеиновая кислота, в ней одна нить вместо двух и чуть иной набор нуклеотидов), а уже на основе РНК создать рибосомы — специальные сложноорганизованные молекулярные машины, которые затем собирают белок из отдельных аминокислот. Цепочка «ДНК — РНК — белок» вошла во все книги по биологии как центральная догма молекулярно-клеточной теории. Некоторое время считалось, что вся жизнь крутится вокруг генов, участков ДНК, связанных с синтезом отдельной молекулы белка или РНК.
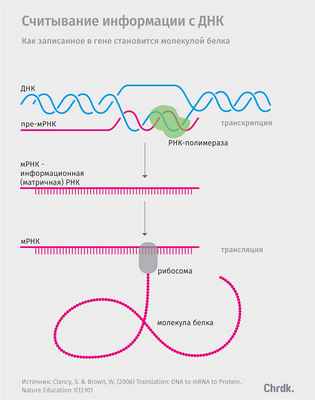
Но в этой схеме есть ряд изъянов, причем довольно очевидных. Например, у нейрона, клетки печени, сперматозоида или лимфоцита набор генов совершенно одинаковый, однако это совершенно разные клетки. Более того, нейрон мыши невозможно отличить от человеческого без довольно тонкого молекулярного анализа, а вот отличить клетку кожи от нейрона в пределах одного организма сможет даже неспециалист. Геном человека содержит множество генов, которые почти не отличаются от генов дрожжей, но разница между нами и дрожжами очевидна. Для наших клеток важно не только то, какие гены находятся в ДНК, но и то, сколько именно молекул собирается на их основе и какие именно гены сейчас активны.
«И тысячу за знание»
Есть анекдот про автослесаря, который устранил поломку одним ударом молотка, но при этом выставил счет на тысячу рублей: 10 за удар и 990 за знание, куда ударить. Организация жизни клетки напоминает этот анекдот: ряд исследований указывает, что ключевую роль в эволюции сложных организмов сыграли не те гены, которые кодируют какие-то конкретные белки (то есть «ударяют»), а те, которые связаны с тонкой регуляцией работы остального генома (знают, куда «ударить»).
Под работой генов, или, как говорят биологи, экспрессией, подразумевается синтез белка или РНК, которые этот ген кодирует. В классической догме «ДНК — РНК — белок» гены нужны для того, чтобы удовлетворить потребность клетки в чем-то конкретном: новых частях внутриклеточного скелета, ферментах для расщепления захваченных питательных веществ или каких-то веществах для секреции вовне. Все перечисленное либо состоит из белков (кодируемых генами), либо требует специальных белков (снова кодируемых генами) для своей сборки.
Клеточный «скелет» из микротрубочек, покрашенный флуоресцентным красителем. Клетка, кстати, злокачественная. Howard Vindin / CC BY-SA 4.0
Однако детальное изучение молекулярно-биологических машин внутри клетки показало, что некоторые гены нужны еще и для того, чтобы регулировать работу своих соседей. А не просто для того, чтобы собрать белковую деталь для строительства клетки или даже белковую машину для производства чего-либо.
Существуют белки, называемые факторами транскрипции. Они «садятся» на ДНК в строго заданном месте — начале конкретного гена — и позволяют начать синтезировать молекулы РНК с этого фрагмента. А там, где РНК, потом появляется и соответствующий белок. Это означает, что ген, кодирующий фактор транскрипции, позволяет клетке синтезировать белки, кодируемые иными генами. Всего в человеческом геноме около двадцати тысяч белков, из них две тысячи — это транскрипционные факторы. Получается, что каждый десятый ген, по сути, сам ничего в клетке не производит, а лишь следит за тем, чтобы в нужное время и в нужных обстоятельствах что-то производилось.
Именно эти «менеджеры», точнее сеть взаимодействий между ними, на рубеже XX—XXI веков стали предметом пристального внимания биологов. Они пришли к выводу, что в эволюции, похоже, главную роль играет совершенствование управления генами, а не просто появление каких-то удачных белков. Примером — одним из многих — может быть ген FOXP2. После того как его человеческий вариант включили в геном мышей, грызуны стали лучше обучаться и даже пищать начали иначе. Этот ген кодирует белок, который представляет собой именно транскрипционный фактор: он отвечает не за то, что голосовые связки должны быть как-то по особому эластичны, и не за то, что нервные клетки приобретают какие-то особые рецепторы. FOXP2 — это лишь эффективный внутриклеточный управляющий, который знает, как использовать гены мыши.
Факторами транскрипции внутриклеточный менеджмент не ограничивается. Куски ДНК, которые сейчас не нужны, могут быть деактивированы. При этом нуклеотиды в ее составе химически меняются, а сама ДНК буквально «запирается на замок». Для этого специальные вещества, деацетилазы гистонов, действуют на входящие в состав хромосом белковые молекулы (гистоны). Они меняют свою форму и сближаются с ДНК так, что к ней уже не могут подобраться другие белки, считывающие информацию, и те же транскрипционные факторы. Поэтому для разблокировки сначала нужно вернуть гистоны в «открытое» состояние. Кроме того, есть система белков, которые в ответ на изменение рецепторов на мембране клетки запускают целый каскад химических реакций, в результате которых активность одних генов (синтез РНК и белка, кодируемого этим геном, глохнет) подавляется, а экспрессия других увеличивается.
Зачем это изучать
Теоретически если бы медики научились управлять экспрессией генов, люди получили бы фантастические возможности. Супермышцы, удвоенная кратковременная память, запасное сердце, сверхвыносливая печень — это можно было бы сделать даже без изменения набора генов, просто выключая и включая уже имеющиеся гены в нужное время и в нужном месте. Органы уже не нужно будет пересаживать: можно будет взять хоть лоскут кожи, выделить из него живые клетки и затем запрограммировать их на превращение во что угодно — в глаз, в печень, в ногу. Можно пофантазировать и о репродуктивных технологиях: в мире, где сперматозоиды и яйцеклетки можно вырастить из кого угодно, выражения «не могу стать отцом» или «не могу стать матерью» утратят смысл. Вполне возможно, что в энциклопедиях будущего статья о раке будет в одном разделе со статьями о чуме, оспе и прочих страшных болезнях, которые уже канули в Лету.
Однако сейчас управление экспрессией генов — это прежде всего изменение способа мыслить о живой материи. Экспрессия меняется в наших клетках постоянно, это часть естественной реакции на те или иные события. Нейроны в головном мозге меняют паттерны экспрессии в каждый момент, когда мозг сталкивается с новой информацией. Еще более пятидесяти лет назад ученые показали, что нарушение синтеза белков фактически стирает память о недавно произошедшем событии. Позже удалось выяснить, что важны не всякие белки, а лишь те, которые кодируются так называемыми немедленными ранними генами. А раковые клетки становятся таковыми не сразу, а в результате серии процессов, которые связаны опять-таки с тем, что одни гены выключаются, в то время как другие начинают работу.
Ученые за последние полвека узнали много такого, что может радикально изменить медицину. Если говорить, к примеру, о том же раке, то сейчас исследователи знают, что за способностью игнорировать сигналы клеточного роста (это то, чем отличаются в худшую сторону клетки опухоли, они не слышат «стоп, хватит расти!» от соседей) стоят конкретные гены и что экспрессия генов связана с действием молекул, кодируемых иными генами. Это открывает если не суперспособности и лечение рака одним курсом таблеток из ближайшей аптеки, то возможность существенно продвинуться к этому. Кроме того, нельзя не задать вопрос о судьбе половых клеток: если их паттерн экспрессии как-то задается во время созревания, то не может ли окружение матери/отца повлиять на потомство без изменения ДНК, но с изменением порядка работы генов?
Сегодня мы можем уверенно сказать — да, может. Пережитый родителями стресс влияет на паттерны экспрессии в клетках детей. И это не только в опытах на животных, но и в случае с людьми, пережившими войны, геноцид или массовые репрессии. На потомков могут влиять даже особенности питания — не за счет воспитания и родительского опыта, а за счет химической активации или дезактивации генов.

Краткий экскурс в историю позволяет понять, что эпигенетическое наследование может играть важную роль в нашей жизни. «Наша» здесь означает не «земные организмы», а вполне конкретные группы людей. У кого-то дед прошел всю Вторую мировую, у кого-то прадед отсидел в тюрьме за анекдот, чьи-то родители бежали из зоны боевых действий, а чьи-то предки злоупотребляли алкоголем. Все это может влиять на ДНК, не вызывая при этом классических мутаций. Стресс может не менять последовательность нуклеотидов в генах, но может заставлять гены «замолчать» или «заговорить», а это, как уже известно, может радикально повлиять на здоровье.
Больше чем гены
Применительно к человеку эпигенетика — очень соблазнительный способ думать о человеческом же благополучии и здоровье. Так, обзорная статья «Эпигенетика и образ жизни», опубликованная в 2013 году в журнале Epigenomics (да, под эпигенетическую тематику выделен отдельный научный журнал), собрала свыше двух сотен цитирований, при том что в среднем статьи из этого издания цитируют пять раз. Авторы обзора выделили несколько причин, из-за которых паттерны экспрессии генов изменяются. Наряду с воздействием химических веществ из окружающей среды там были работа в ночные смены, употребление алкоголя, курение, диета и физическая активность. Уже этого было бы достаточно для морально-этического вопроса о том, насколько люди свободны в определении своего жизненного пути. Но четыре года спустя в Molecular Psychiatry появилась работа, авторы которой довольно убедительно связывали бедность с образом жизни (что очевидно) и с эпигенетическими изменениями, которые могут способствовать развитию психических заболеваний.
Последнее означает уже больше, чем старое расхожее утверждение о неблагополучии трущоб и беспросветности бедности. Дело может быть не просто в душевных терзаниях, а в молекулах внутри нервных клеток. В конце концов, «душевная тоска» XIX столетия и «нервное переутомление» XX века сейчас часто определяются как один из вариантов депрессивного расстройства и успешно лечатся с помощью препаратов, молекулы которых избирательно подавляют перенос нейромедиатора серотонина через мембраны нервных клеток. Мы знаем, на какие конкретно процессы внутри нейронов надо повлиять, чтобы беспричинная тоска ушла. И это работает, пусть и с рядом ограничений.
Флуоксетин: вещество, молекулы которого блокируют перенос серотонина через клеточную мембрану. Используется в качестве антидепрессанта. Simone Hogan / Shutterstock
Связь сознания и эмоций с генами и молекулами бросает вызов не только свободе воли как философской концепции. Нейробиологическое знание дает повод для практических моральных задач. Может ли, скажем, система социальных лифтов в виде образования и доступа к карьерному росту поднять обитателей городских трущоб? Или же можно вывезти подростков из бедного района, но нельзя поменять работу мозга на клеточном уровне, которая была обусловлена тем самым бедным районом, где жили его бабушки с дедушками? Разительные социальные перемены XIX—XX веков указывают, что от не умеющих читать бедных крестьян до ученых, врачей и писателей может быть всего одно-два поколения. Но, возможно, медикам с социальными работниками пора подумать о таблетках от потомственной нищеты, депрессии и алкоголизма?
Эти вопросы до сих пор открыты, и их нельзя рассматривать в отрыве от нейропластичности — свойства нервной системы перестраиваться в ответ на практически любое событие. Мозг людей меняется (буквально отращивая новую ткань и сжимая иные участки), когда они в юном возрасте учатся чтению, запоминают городские улицы во время работы таксистами или ломают ведущую руку. Даже практика медитации, похоже, меняет наш мозг (но это не точно). Все это опять-таки связано с регуляцией роста клеток, а это снова экспрессия генов и тонкие механизмы регуляции совместной работы разных молекул. Мы явно очень далеки от того, чтобы произвольно конструировать человеческое тело, победить рак и шизофрению, отрастить новую ногу. Но, кажется, ученые теперь знают, в каком направлении им двигаться.
Факторы, влияющие на экспрессию генов
От наследования, сцепленного с полом, надо отличать наследование, ограниченное полом. Все гены, которыми попадает данный организм, определяют только его генетический потенциал, т.е. только то, каким он может быть. Иное дело каким он окажется в действительности. Зародышевое развитие зависит от взаимодействия всех генов во время их экспрессии, иными словами в то время, когда они обеспечивают или не обеспечивают образование тех или иных полипептидов и белков. Важнейшую роль в развитии играют также факторы среды. В последние два десятилетия мы несколько раз были свидетелями поистине страшных случаев, когда под влиянием лекарственных препаратов, принимаемых беременными женщинами, нарушалось нормальное развитие плода и рождались уроды, или когда дети этих женщин в раннем возрасте заболевали раком (вследствие утраты их организмом контроля над клеточным делением).
Роль половых гормонов заключается главным образом в воздействии на репродуктивную систему и связанные с нею органы, однако эти гормоны могут также влиять на ряд других признаков организма. Гены, степень экспрессии которых определяется уровнем половых гормонов, называются генами, зависимыми от пола. (Обычно, хотя и не всегда, такие гены локализуются в аутосомах.) Бык может, например, нести гены, определяющие высокую молочность, но молока он давать не будет, потому что у него слишком низок уровень женских гормонов. Эти гены делают его, однако, ценным производителем для молочного стада. Точно так же, и самцы и самки обладают генетическим потенциалом, необходимым для образования органов, свойственных противоположному полу, но у них в процессе развития образуются органы, характерные для их собственного пола, потому что уровень соответствующих гормонов у них выше. У самок и у самцов имеются также гормоны, свойственные противоположному полу, но содержание их гораздо ниже.
Ген, определяющий облысение, типичное для мужчин, локализован в аутосоме, но его экспрессия зависит от мужских половых гормонов. У мужчин этот ген ведет себя как доминантный ген из-за присутствия мужских половых гормонов; у женщин же он ведет себя как рецессивный ген, так что женщина лысеет в том случае, если у нее имеется две дозы этого гена.
Пол влияет у человека и на такой признак, как подагра. При подагре в тканях, главным образом в суставах (чаще всего в области большого пальца стопы), отлагаются соли мочевой кислоты, причиняющие человеку мучительную боль. Ген, ответственный за это заболевание, экспрессируется в присутствии мужских половых гормонов гораздо сильнее, нежели в присутствии женских. В литературе викторианской эпохи подагра фигурирует главным образом как одна из причин частых приступов гнева у капризных старых джентльменов. Считалось, что для облегчения страданий больным надо воздерживаться от жирной и острой пищи и не пить красного вина. Эти ограничения, однако, лишь еще больше портили характер жертв подагры. К счастью, в наше время подагру умеют лечить.
Половые гормоны далеко не единственные факторы, влияющие на фенотипическую экспрессию генов. Многие признаки, контролируемые в основном только одной парой генов, в какой-то мере зависят от влияния продуктов других генов, называемых генами-модификаторами. Долгое время считалось, что цвет глаз у человека определяется одной парой генов, причем карий цвет доминирует над голубым. Теперь мы знаем, что в определении цвета глаз участвуют по меньшей мере также и две пары генов-модификаторов и что у голубоглазых родителей может родиться кареглазый ребенок, хотя это и случается крайне редко.
В разном возрасте организм вырабатывает разные гормоны, так что и возраст тоже играет роль в экспрессии генов. Достаточно вспомнить, например, многие изменения, сопровождающие половое созревание: у мальчиков - «ломку» голоса и рост семенников; у девочек - увеличение молочных желез и появление характерных жировых отложений, придающих женской фигуре свойственную ей округлость; и, наконец, у обоих полов - рост волос в подмышечных впадинах и на лобке.
На экспрессию генов влияют также факторы внешней Среды, а именно пища, свет и температура. Так, плохо питающиеся люди бывают обычно ниже ростом, чем допускают их I ены. Сейчас во многих странах молодые люди обогнали в ройте своих отцов именно потому, что они с детства питались лучше, чем их родители.
Свет - один из факторов, влияющих на экспрессию генов. Человек, подвергающийся в течение некоторого времени действию солнечных лучей, становится от этого более смуглым (некоторые, впрочем, только краснеют).
Что такое эпигенетика и как она поможет нам жить дольше

Эпигенетика — раздел генетики, который изучает то, как наше поведение и окружающая среда влияют на работу наших генов. В отличие от генетических, эпигенетические изменения обратимы.
На практике это означает, что наша социальная среда, режим дня и питания, физические нагрузки меняют то, как организм воспроизводит клетки, влияющие на работу всех органов. И даже более того: эта информация может передаваться генетически.
Сам термин впервые ввел в 1942 году английский биолог Конрад Уоддингтон. Он впервые связал генетику и то, что Аристотель называл «эпигенезом» — учением о последовательном эмбриональном развитии. Философ разбивал куриные яйца, чтобы изучить процесс развития зародыша и порядок формирования его органов.
Уоддингтон сравнил развитие организма с течением реки, где исток — зачатие, а устье — зрелость. При этом важен и рельеф, по которому протекает река: он определяет ее протяженность, скорость и направление. По аналогии с этим внешние факторы влияют на наше развитие.
В 1960–1970-х годах ученые начали активно изучать гены, и столкнулись с тем, что не все они работают одинаково: некоторые включаются и выключаются под влиянием внешней среды.
В 1998 году группа швейцарских ученых во главе с Ренато Паро из Университета Базеля исследовала мух-дрозофил, у которых в результате мутации пожелтели глаза. Они выяснили, что, если содержать этих мух при более высокой температуре, то у потомства будут красные глаза, ч. Ученые пришли к выводу, что температура активировала хромосомный элемент в ДНК и запустила механизм, который наследуется генетически.
Позже новозеландские ученые Питер Глюкман и Марк Хансон смогли объяснить этот феномен. Они предположили, что в развивающемся организме происходит особая адаптация к предполагаемым условиям, которые ожидаются после рождения. Если прогноз оказался верным, и организм успешно адаптировался, информация об этом сохраняется на генетическом уровне как особо важная для выживания. Но если прогноз не сработал, вместо адаптации организм получает дисфункцию. Например, если во время внутриутробного развития эмбриону не хватало питательных веществ, он начинает активнее запасать их впрок. Если после рождения с едой по-прежнему туго, это оказывается полезным механизмом. Но если нет — у человека начинаются проблемы с метаболизмом, которые затем приводят к ожирению и диабету 2-го типа.
В 2003 году Рэнди Джиртл и Роберт Уотерленд из Дюкского университета (США) встроили мышам ген ожирения, а затем добавили в их корм фолиевую кислоту, витамин В12, холин и метионин. В результате мыши родили нормальное потомство, и даже несколько последующих поколений были абсолютно здоровыми.
В 2006-м их коллеги Эндрю Файер и Крейг Мелло получили первую Нобелевскую премию за исследования механизма формирования эпигенетической памяти клеток. С этого момента эпигенетика стала широко известна научному сообществу.
В 2020 году ученые доказали, что эпигенетика может участвовать в эволюции наравне с генетическими изменениями.
Как работает эпигенетика
Генетическая информация о нашем организме содержится в ДНК. Совокупность генов ДНК — это генотип, который наследуется при рождении и передается в неизменном виде потомству. Но у нас есть также фенотип — внешний вид клетки, который определяется генотипом и внешней средой.
Эпигенетические модификации — то есть те, которые происходят под влиянием внешних факторов, — не меняют генотип, но могут изменить фенотип. В результате изменится то, как ваш организм считывает последовательность генов в ДНК. Процесс считывания является одним из этапов экспрессии генов: в ходе нее наследственная информация из ДНК преобразуется в РНК, а затем в белок.
От экспрессии зависит, как часто и какие в нашем организме образуются белки, отвечающие за все жизненно важные процессы. Эпигенетические изменения могут включать и выключать те или иные гены в ходе экспрессии.
Этот приобретенный механизм (фенотип) наследуется вместе с генотипом, но может быть выключен под влиянием новых воздействий. К примеру, у однояйцевых близнецов один генотип, но фенотипы могут быть разные. В результате их масса тела, рост и вес будут отличаться, потому что у клеток разная программа экспрессии генов.
Александр Панчин, кандидат биологических наук, научный журналист и популяризатор науки:
«У человека около 200 разных типов клеток. Во всех этих клетках — одинаковая ДНК, но внутри нее работают разные участки — гены. За это в значительной степени и отвечают эпигенетические модификации. К молекулам ДНК — в зависимости от условий, типа клетки и даже времени суток — могут приклеиваться различные молекулы. Некоторые из этих модификаций могут активировать или усиливать работу тех или иных генов, а иные — подавлять. Поэтому даже при одинаковой ДНК две клетки могут выглядеть и функционировать совершенно по-разному: например, нейрон и клетка скелетной мускулатуры».

Важные факты об эпигенетике
- Эпигенетика — это то, что делает нас уникальными. Например, у детей из одной семьи могут быть разные оттенки кожи и волос, разное строение тела и пищевые аллергии. Именно благодаря эпигенетическим процессам мы так отличаемся от шимпанзе, хотя наши ДНК совпадают на 99%. эпигенетических изменений — это природные и климатические условия, а также социальная среда и воспитание. Но есть множество других: физические нагрузки, образ жизни, питание, уровень стресса, особенности старения. Такие заболевания, как болезнь Альцгеймера, способны переключать гены из нормального в нездоровое состояние даже в глубокой старости, и это может стать наследуемым признаком.
- Эпигенетические процессы начинаются еще до рождения и продолжаются на протяжении всей жизни человека. При этом в старости на нас гораздо больше влияют эпигенетические механизмы, заложенные при внутриутробном развитии, чем наш собственный образ жизни.
- К эпигенетическим изменениям относятся только те, которые выходят за рамки нормальных процессов в организме. Например, приобретение загара таковым не является.
- Перенесенные инфекции тоже влияют на эпигенетику. Бактерии и вирусы способны подорвать иммунную систему, и это унаследуют ваши дети. — результат и генетических, и эпигенетических процессов. Точнее, накопления генетических и эпигенетических мутаций, которые запускают неконтролируемое деление клеток и отвечают за то, какие органы они поражают.
- Паттерны экспрессии меняются в нашем мозгу каждый раз, когда мы сталкиваемся с новой информацией, а нарушение синтеза белков стирает память о недавнем событии.
- Эпигенетические изменения обратимы. Вы можете изменить режим питания и нагрузок, и это повлияет на ваш врожденный метаболизм.
Самый хорошо изученный эпигенетический механизм — это процесс метилирования. К цитозиновым основаниям (один из элементов ДНК) добавляется метильная группа: один атом углерода и три атома водорода. Результат может быть разным. Это вызывает различные изменения в активности генов. Например, инактивация Х-хромосом у эмбриона, которые отвечают за пол будущего ребенка.
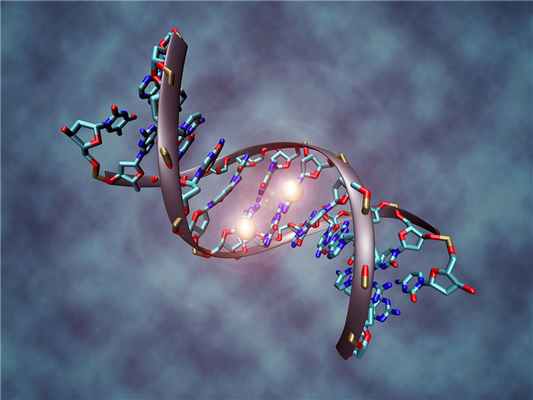
Так выглядит процесс метилирования в ДНК (Фото: Christoph Bock, Max Planck Institute for Informatics )
Метилирование отвечает за то, как будут развиваться ткани и органы, а еще влияет на подавление онкогенов и некоторых вирусов.
Одни из поставщиков метильных групп, которые запускают метилирование — фолиевая кислота и витамин В12, которые часто принимают женщины во время беременности. Если этих веществ окажется недостаточно, у ребенка могут возникнуть лишние хромосомы, что приведет к развитию синдрома Дауна.
В последние годы эпигенетические изменения происходят под влиянием токсичных веществ, которые производят промышленным способом. Например, бисфенол-А, который используют при изготовлении пластиковых бутылок и контейнеров. Он уничтожает метильные группы и подавляет ферменты, которые прикрепляют их к ДНК.
Александр Панчин:
«Эпигенетические метки, в своем большинстве, стираются на ранних этапах развития эмбрионов. Хотя существуют отдельные работы о влиянии факторов среды на эпигенетические особенности потомства и даже их наследственную передачу (пусть и весьма ограниченную). Подобные работы, на мой взгляд, иногда некорректно используют для обоснования проблем со здоровьем или психикой у людей, чьи предки были подвержены неблагоприятным условиям: войнам или голоду. У меня есть ощущение, что это политизировало тему эпигенетики и мешает ее беспристрастному изучению».
Можно ли продлить жизнь с помощью эпигенетики?
Управление эпигенетическими процессами открывает перед нами огромные перспективы. С помощью направленной экспрессии генов мы могли бы получить физические и ментальные суперспособности, бесконечно регенерировать органы и существенно продлить себе жизнь. К сожалению, пока это только теория.
Но уже сегодня ученые исследуют возможности остановить развитие раковых клеток, модифицируя экспрессию генов. А мы сами можем изменить свой организм к лучшему, поменяв режим на более здоровый и передать эти изменения по наследству.
К примеру, отказ от курения может запустить повышенное метилирование ДНК. Прием фолиевой кислоты во время беременности может снизить риски множества врожденных заболеваний и отклонений у ребенка. Регулярное употребление сои, куркумы и зеленого чая, а также разнообразное питание тоже стимулируют позитивные эпигенетические изменения. Таким же эффектом обладают мягкий климат, регулярные нагрузки и свежий воздух.
Совсем недавно было опубликовано исследование о новой системе изменения активности генов, которая называется CRISPRoff. У ученых уже есть инструмент для редактирования ДНК CRISPR/Cas9 — это «молекулярные ножницы», которые могут искать конкретные гены в геноме. Достаточно указать им, какие 20 «букв» (нуклеотидов) в ДНК нужно распознать и где их разрезать, и они это сделают. Теперь систему модифицировали, чтобы она не разрезала ДНК, а приклеивала в нужном месте метильные группы, выключая тот или иной ген. Это может помочь в борьбе со старением, онкологическими заболеваниями и многими другими.
Факторы, влияющие на экспрессию гена
На экспрессию генов могут повлиять многие факторы. Некоторые из них заставляют экспрессию признаков отклоняться от моделей, предсказанных менделевским наследованием.
Пенетрантность и экспрессивность
Экспрессивность является пределом, до которого ген экспрессируется в одного человека. Она может быть классифицирована как процент; например, когда ген имеет 50%-ную экспрессивность, присутствует только половина функции или тяжесть составляет только половину того, что может произойти при полной экспрессии. На экспрессивность могут оказывать влияние окружающая среда и другие гены, поэтому люди, обладающие одинаковым геном, могут изменяться в фенотипе. Экспрессивность может меняться даже среди членов одной семьи.
Пенетрантность и экспрессивность
То, как генотип переводится на фенотип зависит от пенетрантности и экспрессивности.
Пенетрантность относится к тому экспрессируется ли ген или нет. То есть, это означает, у скольких людей с геном есть признак, связанный с геном. Пенетрантность может быть полной (100%) или неполной (например, 50% если признак имеется только у половины людей).
Экспрессивность определяет, насколько влияет признак или насколько особенности признака проявляются в человеке. Экспрессия, которая может быть выражена в процентах, колеблется от полной до минимальной, или она может отсутствовать. Различные факторы, в том числе набор генов, воздействие вредных веществ, другие воздействия окружающей среды, а также возраст, могут повлиять на экспрессивность.
И пенетрантность и экспрессивность могут варьировать: У носителей гена признак может развиться или не развиться, а у людей с развившимся признаком может варьироваться степень экспрессии этого признака.
Сцепленное с полом наследование
Признак, который появляется только у одного пола, называют сцепленным с полом. Сцепленное с полом наследование отличается от сцепленного с Х-хромосомой наследования, которое относится к признакам, переносимым на Х-хромосоме. Ограниченное полом наследование, которое, возможно, более правильно называть обусловленным полом наследованием, относится к особым случаям, в которых половые гормоны и другие физиологические различия между мужчинами и женщинами изменяют экспрессивность и пенетрантность гена. Например, преждевременное облысение (известное как облысение по мужскому типу) является аутосомно-доминантным признаком, но такое облысение редко экспрессирует у женщин, а потом обычно только после менопаузы.
Геномный импринтинг
Геномный импринтинг является дифференциальной экспрессией генетического материала в зависимости от того, был ли он унаследован от отца или матери. У большинства аутосом экспрессируется как родительская, так и материнская аллели. Однако у менее 1 % аллелей экспрессия возможна только с отцовской или материнской аллели. Например, у человека ген инсулино подобного фактора 2 нормально экспрессируется только из аллеля, унаследованного от отца.
Геномный импринтинг обычно определяется эффектами, которые могут происходить в развитии гамет. Такие изменения, как метилирование ДНК, может вызвать экспрессирование в разной степени определенных материнских или отцовских аллелей. Заболевание может, по-видимому, пропустить поколение, если геномный импринтинг препятствует экспрессированию аллели, вызвающей болезнь. Дефектный импринтинг, например, атипичная активация или молчание аллелей, может привести к клинически значимым нарушениям (например, синдром Прадера–Вилли Вторичный гипогонадизм , синдром Ангельмана).
Кодоминантность
Наблюдаются обе кодоминантные аллели. Таким образом, фенотип гетерозигот отличается от такового любой гомозиготы. Например, если человек имеет 1 аллель, кодирующую кровь группы А и 1 аллель, кодирующую группу крови В, у человека будет кровь обеих групп (группа крови АВ).
Хромосомная инактивация
У женщин, у которых 2 (или, при наследственных нарушениях, связанных с половыми хромосомами, более 2) Х-хромосомы (кроме яйцеклеток) инактивированы все, кроме одной из Х-хромосом; т.е., большинство аллелей на хромосоме не экспрессируются. Инактивация происходит случайным образом индивидуально в каждой клетке в начале внутриутробной жизни, иногда инактивируется X-хромосома от матери, а иногда X-хромосома от отца. Иногда большая часть инактивации Х-хромосомы происходит от одного из родителей, называется перекосом инактивации X-хромосомы. В любом случае, как только в клетке произошла инактивация, все потомки этой клетки имеют одинаковую инактивацию Х-хромосомы.
Однако, некоторые аллели экспрессируются из неактивной Х-хромосомы. Многие из этих аллелей находятся на хромосомных участках, соответствующих участкам Y-хромосомы (и, таким образом, называются псевдо-аутосомальными участками - поскольку и мужчины, и женщины получают 2 копии этих участков).
Ключевые моменты
Если в родословной выявляется пропуск поколения, рассматривают диагноз неполной пенетрантности, неполной экспрессивности, и (менее вероятно) геномного импринтинга.
Экспрессия генов также может быть модифицирована сцепленным с полом наследованием, геномным импринтингом, кодоминантностью аллелей, инактивацией Х-хромосомы.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Стенфордское исследование экспрессии генов кожи
под воздействием BBL
Исследования, проведенные в Стэндфордском Университете доказали, что:
— под влиянием процедур Forever Young BBL «омолаживается» более 1000 РНК стареющей кожи,
— экспрессия т.е. активность генов клеток становится такой же как и в молодых клетках.
Омоложенные гены участвуют в регуляции таких функций клеток как:
— долголетие
— иммунитет кожи
— длительность жизни фибробластов
— угнетение опухолевых процессов
Это клинически проявляется в:
— увеличении эластичности
— более однородном и упорядоченном распределении коллагена
— коррекции мелких морщин, пигментных пятен и сосудистых
Анализ экспрессии генов
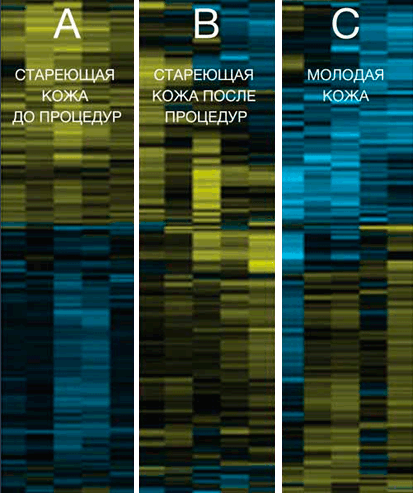
Группа A — стареющая кожа до проведения процедур (старше 50 лет).
Группа B — Forever Young BBL стареющая кожа после 3-х процедур (старше 50 лет)
Группа C — молодая кожа, не подвергавшаяся воздействию BBL (моложе 30 лет)
Стареющая кожа после процедур Forever Young BBL показала изменения в экспрессии генов, подобно экспрессии генов в молодой коже.
1 Chang A, Bitter P, et al. (2012) Journal of Investigative Dermatology advance online publication 30 August 2012; doi: 10.1038.jid.2012.187.
Исследования, проводимые на моделях организмов, предполагают, что стареющие клетки могут быть функционально омоложены. Возможно ли применить эту концепцию к коже человека?
До сих пор это оставалось недоказанным.
В нашем организме порядка 30 000 генов, не так много, как можно было бы предположить. Из них за качество кожи отвечают чуть более 2000 генов. Предлагаем вам ознакомиться с результатами уникального исследования, в ходе которого изучались генные изменения, происходящие вследствие фотостарения и естественного старения (хроностарения) кожи человека, а также влияние процедур широкополосного света (BBL) на эти процессы. Оказалось, что старение кожи ассоциировано со значительными изменениями в РНК и, что процедуры BBL способны их «омолаживать», то есть делать более сходными по экспрессии с генами клеток молодой кожи. Таким образом, процедура BBL может восстанавливать экспрессию генов в клетках с фото- и хронологическим старением кожи человека, подобно клеткам молодой кожи.
До сих пор это оставалось недоказанным.
В нашем организме порядка 30 000 генов, не так много, как можно было бы предположить. Из них за качество кожи отвечают чуть более 2000 генов. Предлагаем вам ознакомиться с результатами уникального исследования, в ходе которого изучались генные изменения, происходящие вследствие фотостарения и естественного старения (хроностарения) кожи человека, а также влияние процедур широкополосного света (BBL) на эти процессы. Оказалось, что старение кожи ассоциировано со значительными изменениями в РНК и, что процедуры BBL способны их «омолаживать», то есть делать более сходными по экспрессии с генами клеток молодой кожи. Таким образом, процедура BBL может восстанавливать экспрессию генов в клетках с фото- и хронологическим старением кожи человека, подобно клеткам молодой кожи.
Введение
Старение является комплексным процессом сложных генетических изменений и влияния окружающей среды и связано с множественными изменениями экспрессии генов в процессе жизни. На наш организм влияют множественные факторы, запуская экспрессию тех или иных генов. Но каким именно образом изменения на генном уровне сказываются на здоровье человека, до сих пор неизвестно. Многочисленные мутации единичных генов показывают продление жизни в моделях организмов (Partridge, 2010; de Magalhaes и соавт., 2012). Ограничения в диете также могут замедлять скорость старения, даже если начинают использоваться в конце жизни (Partridge, 2010). Так например, недавно Питер Нобл (Peter Noble) и Алекс Пожитков (Alex Pozhitkov) из университета Вашингтона в Сиэтле изучили генную экспрессию после смерти у мышей и рыбок и обнаружили, что многие гены продолжают работать после смерти. Более того, через 24-36 часов после того, как организм умирает, начинается экспрессия ранее неактивных генов.
Посмертно продолжается транскрипция более тысячи генов, отвечающих за воспалительные процессы, иммунитет, апоптоз (запрограммированную гибель клеток), клеточный транспорт, эмбриональное развитие, эпигенетическое регулирование и рак. Полностью их экспрессия прекращаются только через 96 часов после смерти.
Так же Совсем недавно в нескольких выступлениях было показано омоложение стареющих клеток или тканей, демонстрирующих удивительную обратимость процессов старения. Например, при гетерохронном парабиозе молодых и старых мышей высвобождаются циркуляторные факторы, которые восстанавливают функции стареющих стволовых клеток мышц (Liu and Rando, 2011). Кроме того, блокирование фактора транскрипции NF-kB в старых клетках эпидермиса мышей может прерывать клеточное старение и восстанавливать общую экспрессию генов клеток старой кожи, делая их подобными молодым клеткам (Adler et al., 2007).
Возникает вопрос: обладают ли такой же обратимостью процессы старения в коже человека, которые развиваются в течение десятилетий, а не месяцев или лет, как было показано на моделях мышей? Выявление прикладных методов блокирования процессов старения является серьезным вызовом.
Широкополосный свет (BBL), известный также как широкополосный импульсный свет, — общедоступная и популярная процедура «омоложения» кожи, является идеальной технологией для тестирования этой концепции. Согласно данным Американского общества эстетической и пластической хирургии (ASAPS), в 2009 году только в США на эти процедуры было потрачено более 215 млн долларов. В отличие от абляционных процедур, улучшающих состояние кожи за счет термической деструкции и запуска процесса регенерации эпидермиса и поверхностного слоя дермы, BBL использует широкополосный некогерентный свет в диапазоне от 400
до 1200 нм, который поглощается многими хромофорами в кожи.
В настоящее время процедуры BBL используются для уменьшения выраженности морщин, при нарушении пигментации, при эритеме и эластозе (Bitter Jr, 2000; Negishi et al., 2001). Однако ранее исследование результатов воздействия этого света не выходило за пределы гистологического анализа.
Термин «омоложение» используется как исследователями, так и обывателями, однако давайте попробуем разобратся с определением. В данном исследовании мы трактуем понятие «омоложение» как восстановление показателей молодости в стареющих клетках и тканях. Действительно ли после процедуры BBL кожа омолаживается на генном уровне и становится подобной молодой коже или же происходящие изменения связаны с раневыми процессами и запуском процессов регенерации, что фундаментально отличается от молодой неповрежденной кожи?
Гистологические исследования подтверждают, что BBL достоверно снижает содержание меланина в дерме и устраняет телеангиэктазии (Bitter Jr, 2000; Prieto и соавт., 2002). Также в нескольких исследованиях сообщалось об увеличении содержания коллагена в верхних слоях сосочковой дермы к третьей неделе после процедуры (Negishi et al., 2001). Однако синтез нового коллагена может носить изменчивый или краткосрочный эффект: данные ультразвукового анализа кожи через 3 месяца после процедуры не показали признаков влияния на коллаген и эластин (Prieto et al., 2002).
Мы изучили молекулярные основы ответа на процедуры BBL, определяя общую экспрессию генов кожи человека с фотостарением и хронологическим старением после процедур BBL. Целью являлось проанализировать широкий спектр изменений в РНК стареющих клеток при воздействии BBL, включая изменения экспрессии генов (кодируемых и некодируемых) и регуляцию генов.
Участники исследования и материалы
Рисунок 1.
Клинические и гистологические эффекты процедуры BBL
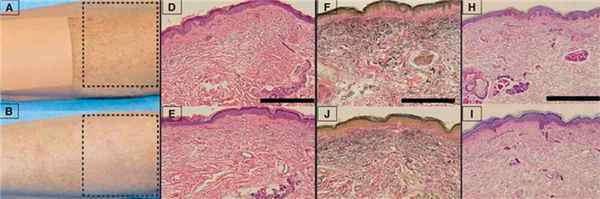
a) Рука женщины 73 лет до процедуры BBL (штрих-линия указывает зону процедуры, повязка указывает контрольную зону, не подвергающуюся лечению)
b) Та же рука после трех процедур BBL: отмечается сокращение мелких морщин, уменьшение гиперпигментации и эритемы на обработанном участке кожи (зона, обозначенная штрих-линией) в сравнении с необработанным участком
c) Таблица ниже — Показатели старения кожи: значительное уменьшение вымраженности мелких морщин, уменьшение выраженности пигментации и снижение общего показателя старения кожи после процедуры BBL.
Значение Р. Согласно двухстороннему t-тесту.
d) Гистология кожи до процедуры BBL показывает наличие эластоза (увеличение х 200, окрашивание гемотоксилин-эозином, ГЭ)
e) Редукция эластоза (х 200, ГЭ) после процедуры BBL
f) До процедуры — явный эластоз (увеличение х 200, окрашивание по von Giesen)
g) После процедур эластоз менее выражен (увеличение х 200, окрашивание по von Giesen)
h) До процедуры волокна коллагена дезорганизованны и неупорядоченны (увеличение х 200, окрашивание PAS)
i) После процедур волокна более однородны (увеличение х 200, окрашивание PAS). Цена деления — 1 мм.
Читайте также:
