Геномный импринтинг и эпигенетика. Характеристика
Добавил пользователь Alex Обновлено: 15.01.2026
Синдромы Прадера-Вилли и Ангельмана. Характеристика
Возможно, наиболее полно изученные примеры роли геномного импринтинга при болезнях человека — синдромы Прадера-Вилли и Ангельмана.
Синдром Прадера-Вилли — сравнительно частый дисморфический синдром, характеризующийся ожирением, чрезмерным и беспорядочным аппетитом, небольшими кистями и стопами, низким ростом, гипогонадизмом и умственной отсталостью. Приблизительно в 70% случаев синдрома наблюдают цитогенетическую делецию, затрагивающую проксимальный отдел длинного плеча хромосомы 15 (15q11-q13), причем только в хромосоме, унаследованной от отца больного.
Таким образом, геном таких пациентов имеет генетическую информацию в области 15q11-q13, происходящую только от матерей. И наоборот, примерно у 70% пациентов с редким синдромом Ангельмана, характеризующегося необычным лицом, низким ростом, выраженным интеллектуальным отставанием, спастикой и судорогами, отмечают делецию приблизительно той же хромосомной области, но теперь в хромосоме, унаследованной от матери; т.е. пациенты с синдромом Ангельмана имеют генетическую информацию в регионе 15q11-q13, происходящую только от отцов.
Эта необычная ситуация удивительным образом доказывает, что родительское происхождение генетического материала в описанных случаях (в хромосоме 15) имеет выраженное влияние на клиническое проявление дефекта.
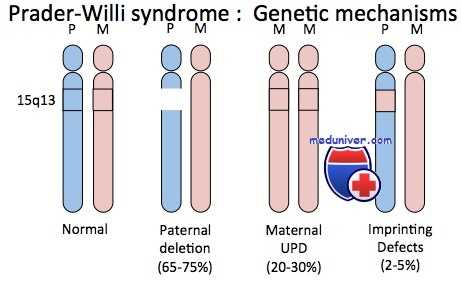
Приблизительно 30% пациентов с синдромом Прадера-Вилли не имеют цитогенетически обнаруживаемых делеций; но у них выявлены две цитогенетически нормальные хромосомы 15, обе унаследованные от матери. Ситуация иллюстрирует однородительскую дисомию — наличие дисомной линии клеток, содержащих две хромосомы или их части, унаследованные от одного родителя. Если оба экземпляра представлены идентичной хромосомой, состояние называют изодисомией; если присутствуют разные гомологи от одного родителя — гетеродисомией.
Приблизительно 3-5% пациентов с синдромом Ангельмана также имеют однородительскую дисомию, только с двумя неповрежденными хромосомами 15 отцовского происхождения. Эти пациенты служат дополнительным подтверждением того, что синдромы Прадера-Вилли и Ангельмана — результат потери соответственно отцовского или материнского вклада генов участка 15q11-q13.
Кроме хромосомной делеции и однородительской дисомии, несколько пациентов с синдромами Прадера-Вилли и Ангельмана, вероятно, имеют дефект в самом центре импринтинга. В результате не происходит переключения от женского к мужскому импринтингу в сперматогенезе или от мужского к женскому в овогенезе.

Оплодотворение сперматозоидом, несущим аномально персистирующий женский импринтинг, приведет к рождению ребенка с синдромом Прадера-Вилли; оплодотворение яйцеклетки, имеющей несвойственный ей мужской импринтинг, закончится рождением ребенка с синдромом Ангельмана.
Наконец, мутации в материнской копии одного гена — убиквитин-протеин лигазы Е6-АР, как оказалось, вызывают синдром Ангельмана. Ген убиквитин-протеин лигазы Е6-АР расположен в области 15q11-q13 и в норме импринтирован, экспрессируется только материнский аллель в центральной нервной системе (ЦНС).
Полагают, что крупные материнские делеции области 15q11-q13 и отцовские однородительские дисомии хромосомы 15, наблюдаемые при синдроме Ангельмана, служат причиной заболевания, так как приводят к утрате материнской копии критически важного импринтированого гена. Мутации для одного импринтированного гена при синдроме Прадера-Вилли пока еще не обнаружены.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Геномный импринтинг и эпигенетика. Характеристика
При некоторых болезнях экспрессия фенотипа связана с тем, от кого из родителей унаследован мутантный аллель или аномальная хромосома. Различия экспрессии генов между отцовской и материнской аллелью — результат геномного импринтинга.
Импринтинг — нормальный процесс, вызванный изменениями в хроматине в характерных позициях генома, произошедшими в половых клетках только одного из родителей. Изменения включают ковалентные модификации ДНК, например метилирование цитозина с формированием 5-метилцитозина, или изменения и замены в гистоновых белках хроматина, которые могут влиять на экспрессию генов в конкретной хромосомной области.
Примечательно, что импринтинг влияет на экспрессию генов, а не на первичную последовательность ДНК. Это обратимая форма инактивации гена, а не мутация, таким образом, пример эпигенетигеского эффекта. Эпигенетика — раздел генетики человека и медицинской генетики всевозрастающей важности, изучающий влияние на экспрессию генов и фенотип как у здоровых, так и больных при многих патологиях, включая цитогенетические аномалии, моногенные заболевания и онкологию.
Импринтинг происходит при гаметогенезе, до оплодотворения, и отмечает отдельные гены как исходящие от матери или отца. После зачатия импринтинг регулирует экспрессию генов в пределах импринтируемой области в некоторых или всех соматических тканях эмбриона.
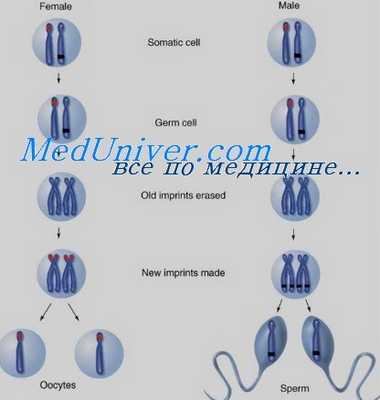
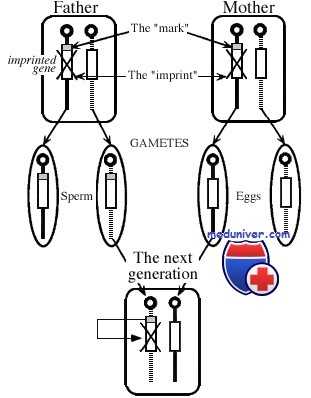
Состояние импринтинга сохраняется и после рождения через сотни клеточных делений, приводя к тому, что в клетке экспрессируется только материнская или отцовская копия гена. В то же время импринтинг обратим: если аллель отцовского происхождения наследуется женщиной, он преобразуется в ее половых клетках, так что она может передать его потомству уже с материнским импринтингом.
Аналогично импринтированный материнский аллель, унаследованный мальчиком, должен преобразоваться в его половых клетках, с тем чтобы стать импринтированным отцовским аллелем у его потомства. Управление данным процессом осуществляют центры импринтинга — специальные элементы ДНК, находящиеся в пределах импринтируемых областей генома. Хотя точный механизм их действия неизвестен, они должны вызывать эпигенетические изменения в хроматине, которые затем распространяются по хромосоме в области импринтинга.
Здесь мы сфокусируемся на влиянии импринтинга в клинической цитогенетике, так как множество его эффектов обнаруживают вследствие хромосомных аномалий.
Подтверждение геномного импринтинга получено для множества хромосом или хромосомных областей всего генома при сравнении фенотипов лиц, несущих ту же цитогенетическую аномалию, затрагивающую материнский или отцовский гомолог. Хотя оценки варьируют, вероятно, что, по крайней мере, несколько десятков, если не сотен генов у человека проявляют эффекты импринтинга.
Некоторые области содержат единственный импринтируемый ген; другие содержат целые группы, в некоторых случаях занимающие более 1 мегабазы вдоль хромосомы, или же множественные гены импринтинга.
Признак импринтированных генов, отличающий их от других аутосомных локусов, — экспресия в тканях только одного аллеля, или материнского, или отцовского. В отличие от этого, в неимпринтируемых локусах всех клеток (т.е. в подавляющем большинстве локусов генома) экспрессируются как материнские, так и отцовские аллели.
Эпигенетическая регуляция ооцита. Геномный импринтинг
Кроме регуляции на уровне транскрипции и трансляции, на экспрессию специфических генов влияют эпигенетические регуляторные механизмы ооцита, сперматозоида и раннего эмбриона. Эта регуляция осуществляется через процесс геномного импринтинга, а также всю молекулярную программу через глобальные изменения степени метилирования и структурного ре-моделирования хроматина. Последнее связано с существенными изменениями архитектоники ядра в процессе роста и созревания ооцита.
Хромосомы живых ооцитов мышей можно наблюдать при использовании культуральной среды, содержащей краситель Hoechst — химическое вещество, образующее хелатные соединения с малой бороздкой ДНК и испускающее синее флюоресцентное излучение при поглощении ультрафиолетовых лучей. Изначально в примордиальных и первичных фолликулах центромеры и околоцентромерный гетерохроматин располагаются на периферии ядра ооцитов. Затем, по мере роста ооцита, они распределяются по всему ядру, впоследствии скапливаясь по периферии ядрышка. Этот перинуклеолярный гетерохроматиновый ободок, или кариосфера, выглядит как яркий ореол вокруг ядрышка.
Несмотря на то что этот ареол связывают с тотальным угнетением транскрипционной активности и высокой готовностью к мейозу и развитию эмбриона, сегодня хорошо известно, что ремоделирование хроматина и угнетение транскрипции — отдельные процессы, регулируемые разными механизмами. Как и в соматических клетках, важную роль в масштабном ремоделировании хроматина больших ооцитов играют гистондеацетилазы, так как их ингибирование приводит к разрушению архитектоники кариосферы и нарушениям конфигурации мейотических хромосом и веретена деления.
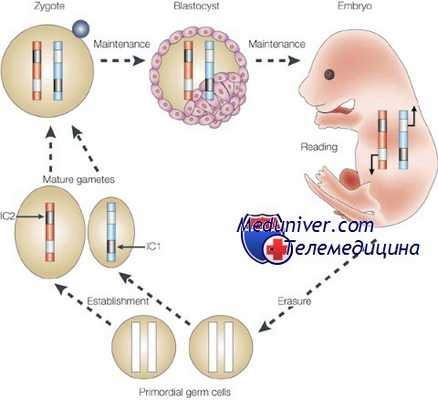
Другой важный установленный механизм эпигенетической регуляции — контроль активации и угнетения транскрипционной активности через процессы деметилирования и метилирования соответственно. В то время как геном предшественников соматических клеток подвергается реметилированию уже перед гаструляцией к 6,5 дпк, геном предшественников ППК остается деметилированным еще к 12,5 дпк. К 15,5 дпк происходит частичное метилирование, завершающееся к 18,5 дпк. Геном эмбриона инактивен вплоть до двухклеточной стадии развития у мышей (восьмиклеточной у человека), после чего он активируется при помощи тотального деметилирования.
Такие глобальные изменения метилирования следует отличать от Х-инактивации и геномного импринтинга. Если коротко, Х-инактивация — сложный и во многом случайный процесс, при котором одна из Х-хромосом у самок млекопитающих (с генотипом XX) инактивируется, чтобы обеспечить эквивалентное количество Х-сцепленных генов у эмбрионов с женским XX- и мужским XY-генотипом. Инициация этого процесса контролируется локусом, именуемым центром Х-инактивации (Xic), расположенным на Xql3. Этот локус содержит специфический транскрипт Х-инактивации (Xist), на котором записана некодирующая мРНК, покрывающая Х-хромосому в цис-положении, и запускает инактивацию.
Геномный импринтинг
И наконец, более геноспецифичный механизм эпигенетической регуляции — геномный импринтинг, с помощью которого осуществляется предопределенный дифференциальный сайленсинг материнских и отцовских аллелей. В процессе гаметогенеза определенные гены аутосом гиперметилируются (сайленсинг) в зависимости от их родительской принадлежности. Будучи однажды установленными, эти метки (импринты), как предполагают, становятся защищенными от тотального деметилирования генома.
Импринтинг для разных генов может происходить в разное время в процессе оогенеза, сперматогенеза и эмбриогенеза. Зачастую врожденные синдромы и раковые опухоли возникают в результате неэффективного сайленсинга или инактивации аллеля соответствующего родителя.
Если предположить, что ВРТ достоверно связаны с дефектами импринтинга, следует изучить все возможные причины их появления, включая контролируемую гиперстимуляцию яичников, культивирование эмбрионов и сами клинические состояния, послужившие причиной бесплодия, так как дефекты импринтинга могут сами являться причиной бесплодия. Понятно, что необходимы дальнейшие интенсивные исследования в этой области, которые позволят понять, могут ли таким образом механизмы импринтинга влиять на развитие ВРТ.
Научная электронная библиотека

В исследованиях генетических процессов, связанных с патогенезом заболеваний, особое внимание уделяется не только изменениям последовательностей ДНК, но также и транскрипционной активности ДНК в клетке. Вариация активности генома (экспрессия генов) как в отдельно взятой клетке, так и во всем организме достигается за счет различных эпигенетических процессов. Эпигенетические процессы представляют собой наследуемые изменения в экспрессии генов, нарушающие законы Менделя, без количественного или качественного (мутационного) изменения последовательности ДНК. В настоящее время описан целый ряд эпигенетических феноменов и процессов, таких как инактивация хромосомы Х, геномный импринтинг, унипарентальная дисомия, изменение порядка репликации ДНК, метилирование ДНК, биохимическая модификация гистонов и другие. Изучает подобные процессы особое направление в генетике – эпигенетика. Наиболее изученными эпигенетическими процессами являются модификация химической структуры ДНК за счет метилирования цитозина ЦГ динуклеотидов в 5′-положении, приводящее к транскрипционной инактивации генов, а также различные биохимические модификации гистоновых белков, образующих хроматин, которые могут, как приводить к инактивации, так и к активации генов. Следует отметить, что эпигенетические механизмы лежат в основе нормальной активности клетки, тогда как нарушение этих процессов приводит к целому ряду функциональных аномалий различных тканей организма, среди которых наиболее часто встречаются пороки развития центральной нервной системы. Наиболее подробно изученным эпигенетическим феноменом является процесс инактивации хромосомы Х.
Женский кариотип характеризуется наличием двух половых хромосом Х (гоносомы), а мужской – половыми хромосомами Х и Y. Этот факт свидетельствует о несоответствии содержания генетической информации у лиц мужского и женского пола. У человека, как и у других млекопитающих, этот дисбаланс экспрессии генов разрешается благодаря инактивации одной из хромосом Х во всех клетках организма. Предположение о возможной инактивации генов хромосомы Х было впервые предложено после исследования конденсированных хроматиновых структур в клетках млекопитающих. На внутриклеточном уровне данный процесс сопровождается образованием исключительно стабильной гетерохроматиновой структуры – одной или нескольких инактивированных хромосом Х. В зависимости от их количества в клетке определяется анеуплоидия хромосомы Х. Селективность процесса инактивации хромосомы Х является произвольной. В результате у большинства женских особей наблюдается мозаичная экспрессия материнских и отцовских аллелей локусов хромосомы Х. В среднем вклад каждой хромосомы должен составлять примерно 50 %, но поскольку процесс Х-инактивации случайный, то он теоретически может значительно варьировать. Инактивированная хромосома Х характеризуется следующими свойствами: полной транскрипционной инактивацией большинства Х-сцепленных генов; конденсацией гетерохроматина в интерфазе; поздней репликацией инактивированной хромосомы Х в S фазе деления клетки; метилированием цитозина ЦГ динуклеотидов в 5′-положении в генах, подверженных транскрипционной инактивации; химической модификацией гистоновых белков (гипоацетилирование), приводящей к транскрипционной инактивации генов, а также некоторыми другими особенностями,
которые приводят к образованию и сохранению стабильности на протяжении клеточного цикла факультативного гетерохроматина (неактивной хромосомы Х). Особое место занимает экспрессия гена XIST (X-inactive specific transcript) на инактивированной хромосоме, продуктом которой является ядерная или хромосомная РНК, покрывающая инактивированную хромосому Х и участвующая в структурной организации факультативного гетерохроматина или неактивной хромосомы Х.
Несмотря на то, что вклад каждой хромосомы Х (отцовской и материнской) должен составлять примерно 50 %, у значительного числа женщин наблюдается инактивация преимущественно одной из родительских хромосом Х – неравная Х-инактивация или сдвиг Х-инактивации. Известны следующие механизмы инактивации хромосомы Х, приводящие к случайной (равной) [1] и неравной Х-инактивации [2, 3]:
1) процесс, приводящий к случайной Х-инактивации, следующий: отцовская или материнская хромосома Х независимо инактивируется в каждой клетке на ранних стадиях развития плода. Инактивация генов сохраняется за счет метилирования цитозина на неактивной хромосоме Х. Таким образом, достигается практически эквивалентная (50:50) экспрессия генов отцовской и материнской хромосом Х в организме.
2) процесс, приводящий к неслучайной Х-инактивации, следующий: одна из хромосом Х (отцовская или материнская) имеет летальную мутацию, что препятствует дальнейшему развитию клеток, в которых хромосома Х с мутацией активна. В результате чего, в организме присутствуют преимущественно клетки, в которых мутированная хромосома Х неактивна, и, таким образом, в организме наблюдается неравная Х-инактивация.
3) процесс, приводящий к неслучайной Х-инактивации, может быть следующий: мутации в гене XIST приводит к тому, что выбор активной хромосомы Х неслучайный.
Неравная инактивация хромосомы Х представляется одной из особенностей ряда наследственных заболеваний. Болезни, связанные с ней, могут быть вызваны генными или хромосомными (геномными) мутациями, а также внешними факторами, при которых наблюдается неравная инактивация хромосомы Х без мутаций. Эта группа заболеваний включает в себя болезни, связанные с Х-сцепленными рецессивными мутациями, большую часть которых составляет Х-сцепленная умственная отсталость, а также ряд мультифакторных заболеваний (например, аутизм).
Известным эпигенетическим феноменом, имеющим особое значение для медицинской генетики – генетики нервных и психических болезней, является полиморфизм генов или SNP (single nucleotide polymorphisms), приводящий к изменению последовательности ДНК, связанному
с нарушением функциональной активности закодированного им белка. В настоящее время описано несколько подобных генов, полиморфные варианты которых имеют повышенную частоту среди больных нервными и психическими болезнями, например, гены, кодирующие серотониновые и допаминовые рецепторы при шизофрении. Несмотря на то, что этот феномен все же связан с изменением последовательности ДНК, тот факт, что они являются синонимическими мутациями, позволяет рассматривать подобные вариации экспрессии генов в рамках эпигенетики.
Определенные участки гомологичных хромосом не являются функционально одинаковыми. Локусы в таких участках могут показывать различия их активности в зависимости от материнского и отцовского происхождения. Так, определенные гены в зависимости от того, на какой хромосоме (материнской или отцовской) они расположены, вносят различный вклад в развитие эмбриона. Такие специфические различия в регуляции генов в зависимости от родительского происхождения определяются как геномный импринтинг.
Геномный импринтинг может вовлекать генные локусы либо отцовского, либо материнского происхождения. Так, в соматических клетках человека, как у мужчин, так и у женщин отцовская последовательность ДНК гомологичных хромосом может быть активна, в то время как материнская последовательность ДНК инактивирована. Геномный импринтинг и унипарентальная дисомия (см ниже) являются причиной ряда таких заболеваний, как синдром Прадера-Вилли и Ангельмана, связанных с локусами длинного плеча (q) хромосомы 15. Геномный импринтинг также зависит от особенностей метилирования в зависимости от родительского происхождения хромосом (различное метилирование локусов родительских хромосом). Например, если ген материнского происхождения метилирован (инактивирован), а этот же ген отцовского происхождения не является метилированным, то только отцовский ген будет экспрессироваться. Так как импритинг стирается в половых клетках, то гомологичные гены становятся метилированными в женских половых клетках, а в мужских половых клетках – неметилированными, в результате чего в зиготе наблюдается различие в метилировании аллелей импринтированных генов. Особенно хорошо демонстрирует феномен геномного импринтинга один из участков хромосомы 7 у мыши. Если одна третья часть обеих хромосом 7 в эмбрионе мыши отцовского происхождения, то мышь будет иметь большие размеры тела. Напротив, если материнского, то эмбрионы будут иметь маленькие размеры по сравнению с нормой и погибнут в ходе эмбрионального развития. Это объясняется различиями инактивации гена инсулин-подобного фактора роста-2 (IGF2), который расположен в этом участке и является особенно значимым для роста в эмбриональном развитии. Этот участок хромосомы 7 у мыши является гомологичным определенному участку короткого плеча хромосомы 11 у человека. Однородительская дисомия этого участка предрасполагает к наследственным синдромам, которые характеризуются клиникой синдрома Беквита-Видеманна (большой размер тела и опухоль Вилмса). Другим примером однородительской дисомии являются синдромы Прадера-Вилли и Ангельмана, при которых наблюдается потеря функций одного из хромосомных участков в зависимости от родительского происхождения. Синдромы Прадера-Вилли и Ангельмана являются клинически различными заболеваниями с нарушениями развития и поведения. Они вызваны потерей функции двух хромосомных участков, локализованных вблизи друг от друга на хромосоме 15. Эти два заболевания различаются клинической картиной вследствие потери функции участка хромосомы либо отцовского, либо материнского происхождения. Это синдромы одного и того же участка одной хромосомы. Делеция этой части хромосомы 15 обнаруживается до 70 % пациентов с синдромами Прадера-Вилли или Ангельмана. Если делеция затрагивает отцовскую хромосому, то это приводит к синдрому Прадера-Вилли и, наоборот, если материнскую – к синдрому Ангельмана. Для синдрома Прадера-Вилли характерны неонатальная гипотония, задержка развития, гиперфагия и ожирение, короткий рост, маленькие верхние и нижние конечности, гипогонадизм и гипопигментация. При cиндроме Ангельмана делеция хромосомы 15 имеет материнское происхождение. Для этой болезни характерны следующие признаки: умственная отсталость с нарушением развития речи, дружеское расположение (ласковый смех без видимых причин), гиперактивное поведение, судороги, специфические изменения в ЭЭГ и гипопигментация. Имеются ДНК маркеры, позволяющие установить родительское происхождение делеции молекулярно-генетическими методами. При синдроме Прадера-Вилли отсутствует отцовский аллель, а при cиндроме Ангельмана – материнский. Примерно 30–35 % пациентов с синдромом Прадера-Вилли и 20–30 % с синдромом Ангельмана не имеют делеции. В этих случаях часто обнаруживают однородительскую дисомию у 30 % детей с синдромом Прадера-Вилли и у 2 % –
с синдромом Ангельмана. У 1–2 % пациентов с синдромом Прадера-Вилли и у 20 % с синдромом Ангельмана не обнаруживают ни делеции, ни однородительской дисомии. В этих случаях болезнь может иметь семейное происхождение. Эти два синдрома являются примером геномного импринтинга у человека. Генные локусы этих синдромов, следовательно, являются объектами геномного импринтинга. Импринтинговые локусы в этом участке затрагивают большое число генов и, по-видимому, контролируются общим центром импринтинга, расположенном в этом районе. Мутации в центре импринтинга могут передаваться половыми клетками одного из родителей.
Унипарентальная или однородительская дисомия является феноменом, определяемым присутствием двух гомологичных хромосом (или хромосомных сегментов), унаследованных только от одного родителя и отсутствием соответствующей хромосомы (или сегмента), унаследованных от другого родителя. Различают два типа унипарентальной дисомии: изодисомия и гетеродисомия. Термин изодисомии относится к наличию двух копий одной и той же родительской хромосомы; гетеродисомия означает, что каждая из двух гомологичных хромосом передалась от одного родителя. Однородительская дисомия может являться причиной различных заболеваний у человека, включая мультифакторные болезни, связанные с нарушениями психики.
Повторяющиеся последовательности ДНК являются относительно нестабильными элементам генома человека. Для медицинской генетики, изучающей различные генетические феномены, связанные с нарушениями психики, особый интерес представляют тринуклеотидные повторы – тандемно повторяющиеся элементы, дискретной единицей которых является последовательность, состоящая из 3-х нуклеотидов. Несмотря на то, что заболевания, причиной которых является экспансия (увеличение) тринуклеотидных повторов, вызваны мутационными изменениями последовательности ДНК, многие из них принято рассматривать в рамках эпигенетики. Это связано с тем, что некоторые тринуклеотидные повторы имеют в своей структуре цитозин и гуанин, образующие ЦГ последовательности, цитозин которых в условиях экспансии метилируется. Наиболее ярким примером такого заболевания, имеющим исключительное значение для медицинской генетики, педиатрии и психиатрии, является синдром умственной отсталости, сцепленный с ломкой хромосомой Х или FRAXA. FRAXA представляет собой самую частую генетическую форму, связанную с умственной отсталостью и экспансией тринуклеотидных повторов. Это заболевание связано с увеличением нестабильных ЦГГ-повторов в гене FMR1 (Fragile X mental retardation 1). Считается, что больные FRAXA характеризуются наличием более 200 тринуклеотидных ЦГ-повторов. В результате экспансии ЦГГ-повторы также как и ЦГ динуклеотиды, расположенные далее по длине последовательности, метилируются, что приводит к отсутствию экспрессии гена FMR1. Отсутствие продукта транскрипции гена FMR1 – белка FMRP приводит к умственной отсталости в сочетании с различными когнитивными отклонениями. Из фенотипических проявлений синдрома FRAXA необходимо отметить умеренную или тяжелую умственную отсталость (IQ = 30–55), гиперактивность, гиперкинез, эмоциональную нестабильность, признаки аутизма, большие оттопыренные ушные раковины, макроорхидизм, а также неадекватные движения рук (в 60 % случаев); уменьшенный ответный глазной контакт (в 90 % случаев); характерные изменения речи (быстрое повторение целых фраз, окончаний, звуков, бормотание); у 50 % больных девочек наблюдается умственная отсталость средней тяжести, приводящая к когнитивным отклонениям; макроцефалия (в раннем детстве). В ряде случаев наблюдается внезапная смерть. Психопатологические отклонения, в основном присутствующие у мальчиков, характеризуются выраженным полиморфизмом: от разной степени умственной отсталости до ранней злокачественной детской шизофрении со спонтанно возникающими тревожно-депрессивными состояниями и бредоподобным фантазированием. У нормальных индивидуумов число повторов варьирует от 6 до 52, известно также, так называемое, «премутационное состояние», которое характеризуется увеличением ЦГГ-повторов от 54 до 200. Частота носителей премутации в общей популяции оценивается как 1:250 женщин и 1:800 мужчин. У 30 % мужчин с премутацией в гене FMR1 наблюдаются характерные фенотипические отклонения – синдром FXTAS (fragile X tremor and ataxia syndrome – синдром тремора и атаксии, сцепленный с ломкой хромосомой Х). Кроме тремора и атаксии у этих больных наблюдаются также социопатия, уменьшенный ответный глазной контакт, депрессия, когнитивные расстройства; отмечается также гиперактивность с дефицитом внимания, легкая умственная отсталость и аутистические проявления. Среди женщин с премутацией в гене FMR1 частота фенотипических отклонений пока не выяснена. Это может быть связано с компенсирующим эффектом присутствия второй хромосомы Х в женском кариотипе. Однако, известно, что у женщин с премутацией в 16–24 % случаев наблюдается повышенная частота рекуррентных спонтанных абортов, причина которых в настоящее время неизвестна.
Эпигенетика: гены и кое-что сверху
Пожалуй, самое емкое и в то же время точное определение эпигенетики принадлежит выдающемуся английскому биологу, нобелевскому лауреату Питеру Медавару: «Генетика предполагает, а эпигенетика располагает».

Знаете ли вы, что наши клетки обладают памятью? Они помнят не только то, что вы обычно едите на завтрак, но и чем питались во время беременности ваша мама и бабушка. Ваши клетки хорошо помнят, занимаетесь ли вы спортом и как часто употребляете алкоголь. Память клеток хранит в себе ваши встречи с вирусами и то, насколько сильно вас любили в детстве. Клеточная память решает, будете ли вы склонны к ожирению и депрессиям. Во многом благодаря клеточной памяти мы не похожи на шимпанзе, хотя имеем с ним примерно одинаковый состав генома. И эту удивительную особенность наших клеток помогла понять наука эпигенетика.
Эпигенетика — довольно молодое направление современной науки, и пока она не так широко известна, как ее «родная сестра» генетика. В переводе с греческого предлог «эпи-» означает «над», «выше», «поверх». Если генетика изучает процессы, которые ведут к изменениям в наших генах, в ДНК, то эпигенетика исследует изменения активности генов, при которых структура ДНК остается прежней. Можно представить, будто некий «командир» в ответ на внешние стимулы, такие как питание, эмоциональные стрессы, физические нагрузки, отдает приказы нашим генам усилить или, наоборот, ослабить их активность.
Управление мутацией
Развитие эпигенетики как отдельного направления молекулярной биологии началось в 1940-х. Тогда английский генетик Конрад Уоддингтон сформулировал концепцию «эпигенетического ландшафта», объясняющую процесс формирования организма. Долгое время считалось, что эпигенетические превращения характерны лишь для начального этапа развития организма и не наблюдаются во взрослом возрасте. Однако в последние годы была получена целая серия экспериментальных доказательств, которые произвели в биологии и генетике эффект разорвавшейся бомбы.
Переворот в генетическом мировоззрении произошел в самом конце прошлого века. Сразу в нескольких лабораториях был получен ряд экспериментальных данных, заставивших генетиков сильно призадуматься. Так, в 1998 году швейцарские исследователи под руководством Ренато Паро из Университета Базеля проводили эксперименты с мухами дрозофилами, у которых вследствие мутаций был желтый цвет глаз. Обнаружилось, что под воздействием повышения температуры у мутантных дрозофил рождалось потомство не с желтыми, а с красными (как в норме) глазами. У них активировался один хромосомный элемент, который и менял цвет глаз.
К удивлению исследователей, красный цвет глаз сохранялся у потомков этих мух еще в течение четырех поколений, хотя они уже не подвергались тепловому воздействию. То есть произошло наследование приобретенных признаков. Ученые были вынуждены сделать сенсационный вывод: вызванные стрессом эпигенетические изменения, не затронувшие сам геном, могут закрепляться и передаваться следующим поколениям.
Но, может, такое бывает только у дрозофил? Не только. Позже выяснилось, что у людей влияние эпигенетических механизмов тоже играет очень большую роль. Например, была выявлена закономерность, что предрасположенность взрослых людей к диабету 2-го типа может во многом зависеть от месяца их рождения. И это при том, что между влиянием определенных факторов, связанных со временем года, и возникновением самого заболевания проходит 50−60 лет. Это наглядный пример так называемого эпигенетического программирования.
Что же может связывать предрасположенность к диабету и дату рождения? Новозеландским ученым Питеру Глюкману и Марку Хансону удалось сформулировать логическое объяснение этого парадокса. Они предложили «гипотезу несоответствия» (mismatch hypothesis), согласно которой в развивающемся организме может происходить «прогностическая» адаптация к условиям обитания, ожидающимся после рождения. Если прогноз подтверждается, это увеличивает шансы организма на выживание в мире, где ему предстоит жить. Если нет — адаптация становится дезадаптацией, то есть болезнью.
К примеру, если во время внутриутробного развития плод получает недостаточное количество пищи, в нем происходят метаболические перестройки, направленные на запасание пищевых ресурсов впрок, «на черный день». Если после рождения пищи действительно мало, это помогает организму выжить. Если же мир, в который попадает человек после рождения, оказывается более благополучным, чем прогнозировалось, такой «запасливый» характер метаболизма может привести к ожирению и диабету 2-го типа на поздних этапах жизни.
Опыты, проведенные в 2003 году американскими учеными из Дюкского университета Рэнди Джиртлом и Робертом Уотерлендом, уже стали хрестоматийными. Несколькими годами ранее Джиртлу удалось встроить искусственный ген обычным мышам, из-за чего те рождались желтыми, толстыми и болезненными. Создав таких мышей, Джиртл с коллегами решили проверить: нельзя ли, не удаляя дефектный ген, сделать их нормальными? Оказалось, что можно: они добавили в корм беременным мышам агути (так стали называть желтых мышиных «монстров») фолиевую кислоту, витамин В12, холин и метионин, и в результате этого появилось нормальное потомство. Пищевые факторы оказались способными нейтрализовать мутации в генах. Причем воздействие диеты сохранялось и в нескольких последующих поколениях: детеныши мышей агути, родившиеся нормальными благодаря пищевым добавкам, сами рождали нормальных мышей, хотя питание у них было уже обычное.
В ответе за случайность
Почти все женщины знают, что во время беременности очень важно потреблять фолиевую кислоту. Фолиевая кислота вместе с витамином В12 и аминокислотой метионином служит донором, поставщиком метильных групп, необходимых для нормального протекания процесса метилирования. Витамин В12 и метионин почти невозможно получить из вегетарианского рациона, так как они содержатся преимущественно в животных продуктах, поэтому разгрузочные диеты будущей мамы могут иметь для ребенка самые неприятные последствия. Не так давно было обнаружено, что дефицит в рационе этих двух веществ, а также фолиевой кислоты может стать причиной нарушения расхождения хромосом у плода. А это сильно повышает риск рождения ребенка с синдромом Дауна, что обычно считается просто трагической случайностью.
Также известно, что недоедание и стресс в период беременности меняет в худшую сторону концентрацию целого ряда гормонов в организме матери и плода — глюкокортикоидов, катехоламинов, инсулина, гомона роста и др. Из-за этого у зародыша начинают происходить негативные эпигенетические изменения в клетках гипоталамуса и гипофиза. Это чревато тем, что малыш появится на свет с искаженной функцией гипоталамо-гипофизарной регуляторной системы. Из-за этого он будет хуже справляться со стрессом самой различной природы: с инфекциями, физическими и психическими нагрузками и т. д. Вполне очевидно, что, плохо питаясь и переживая во время вынашивания, мама делает из своего будущего ребенка уязвимого со всех сторон неудачника.
Можно уверенно сказать, что период беременности и первых месяцев жизни наиболее важен в жизни всех млекопитающих, в том числе и человека. Как метко выразился немецкий нейробиолог Петер Шпорк, «в преклонных годах на наше здоровье порой гораздо сильнее влияет рацион нашей матери в период беременности, чем пища в текущий момент жизни».
Судьба по наследству
Наиболее изученный механизм эпигенетической регуляции активности генов — процесс метилирования, который заключается в добавлении метильной группы (одного атома углерода и трех атомов водорода) к цитозиновым основаниям ДНК. Метилирование может влиять на активность генов несколькими способами. В частности, метильные группы могут физически препятствовать контакту фактора транскрипции (белка, контролирующего процесс синтеза информационной РНК на матрице ДНК) со специфичными участками ДНК. С другой стороны, они работают в связке с метилцитозин-связывающими белками, участвуя в процессе ремоделирования хроматина — вещества, из которого состоят хромосомы, хранилища наследственной информации.
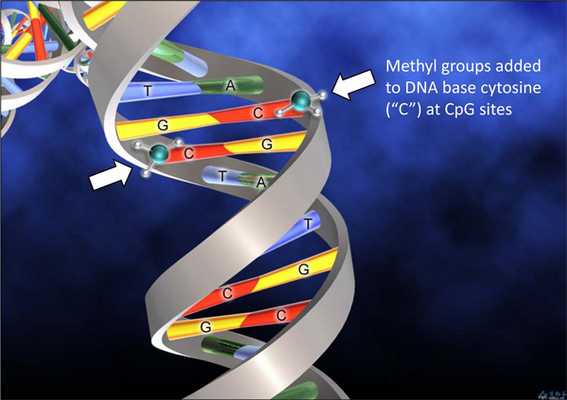
Метилирование ДНК
Метильные группы присоединяются к цитозиновым основаниям, не разрушая и не изменяя ДНК, но влияя на активность соответствующих генов. Существует и обратный процесс — деметилирование, при котором метильные группы удаляются и первоначальная активность генов восстанавливается
Метилирование участвует во многих процессах, связанных с развитием и формированием всех органов и систем у человека. Один из них — инактивация X-хромосом у эмбриона. Как известно, самки млекопитающих обладают двумя копиями половых хромосом, обозначаемых как X-хромосома, а самцы довольствуются одной X и одной Y-хромосомой, которая значительно меньше по размеру и по количеству генетической информации. Чтобы уравнять самцов и самок в количестве генных производимых продуктов (РНК и белков), большинство генов на одной из X-хромосом у самок выключается.
Кульминация этого процесса происходит на стадии бластоцисты, когда зародыш состоит из 50−100 клеток. В каждой клетке хромосома для инактивации (отцовская или материнская) выбирается случайным образом и остается неактивной во всех последующих генерациях этой клетки. С этим процессом «перемешивания» отцовских и материнских хромосом связан тот факт, что женщины намного реже страдают заболеваниями, связанными с X-хромосомой.
Метилирование играет важную роль в клеточной дифференцировке — процессе, благодаря которому «универсальные» эмбриональные клетки развиваются в специализированные клетки тканей и органов. Мышечные волокна, костная ткань, нервные клетки — все они появляются благодаря активности строго определенной части генома. Также известно, что метилирование играет ведущую роль в подавлении большинства разновидностей онкогенов, а также некоторых вирусов.
Метилирование ДНК имеет наибольшее прикладное значение из всех эпигенетических механизмов, так как оно напрямую связано с пищевым рационом, эмоциональным статусом, мозговой деятельностью и другими внешними факторами.
Данные, хорошо подтверждающие этот вывод, были получены в начале этого века американскими и европейскими исследователями. Ученые обследовали пожилых голландцев, родившихся сразу после войны. Период беременности их матерей совпал с очень тяжелым временем, когда в Голландии зимой 1944−1945 годов был настоящий голод. Ученым удалось установить: сильный эмоциональный стресс и полуголодный рацион матерей самым негативным образом повлиял на здоровье будущих детей. Родившись с малым весом, они во взрослой жизни в несколько раз чаще были подвержены болезням сердца, ожирению и диабету, чем их соотечественники, родившиеся на год или два позднее (или ранее).
Анализ их генома показал отсутствие метилирования ДНК именно в тех участках, где оно обеспечивает сохранность хорошего здоровья. Так, у пожилых голландцев, чьи матери пережили голод, было заметно понижено метилирование гена инсулиноподобного фактора роста (ИФР), из-за чего количество ИФР в крови повышалось. А этот фактор, как хорошо известно ученым, имеет обратную связь с продолжительностью жизни: чем выше в организме уровень ИФР, тем жизнь короче.
Позднее американский ученый Ламбер Люмэ обнаружил, что и в следующем поколении дети, родившиеся в семьях этих голландцев, также появлялись на свет с ненормально малым весом и чаще других болели всеми возрастными болезнями, хотя их родители жили вполне благополучно и хорошо питались. Гены запомнили информацию о голодном периоде беременности бабушек и передали ее даже через поколение, внукам.
Многоликая эпигенетика
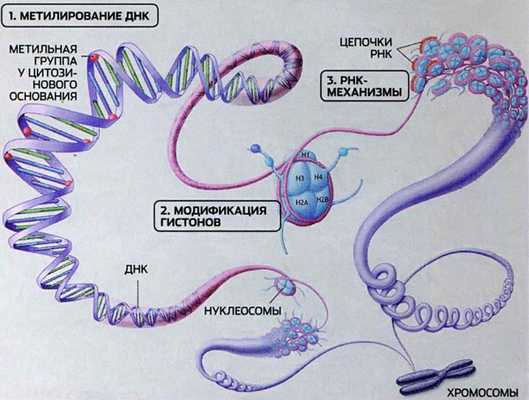
Эпигенетические процессы реализуются на нескольких уровнях. Метилирование действует на уровне отдельных нуклеотидов. Следующий уровень — это модификация гистонов, белков, участвующих в упаковке нитей ДНК. От этой упаковки также зависят процессы транскрипции и репликации ДНК. Отдельная научная ветвь — РНК-эпигенетика — изучает эпигенетические процессы, связанные с РНК, в том числе метилирование информационной РНК.
Гены не приговор
Наряду со стрессом и недоеданием на здоровье плода могут влиять многочисленные вещества, искажающие нормальные процессы гормональной регуляции. Они получили название «эндокринные дизрапторы» (разрушители). Эти вещества, как правило, имеют искусственную природу: человечество получает их промышленным способом для своих нужд.
Самый яркий и негативный пример — это, пожалуй, бисфенол-А, уже много лет применяющийся в качестве отвердителя при изготовлении изделий из пластмасс. Он содержится в некоторых видах пластиковой тары — бутылок для воды и напитков, пищевых контейнеров.
Отрицательное воздействие бисфенола-А на организм заключается в способности «уничтожать» свободные метильные группы, необходимые для метилирования, и подавлять ферменты, прикрепляющие эти группы к ДНК. Биологи из Гарвардской медицинской школы обнаружили способность бисфенола-А тормозить созревание яйцеклетки и тем самым приводить к бесплодию. Их коллеги из Колумбийского университета обнаружили способность бисфенола-А стирать различия между полами и стимулировать рождение потомства с гомосексуальными наклонностями. Под воздействием бисфенола нарушалось нормальное метилирование генов, кодирующих рецепторы к эстрогенам, женским половым гормонам. Из-за этого мыши-самцы рождались с «женским» характером, покладистыми и спокойными.
К счастью, существуют продукты, оказывающие положительное влияние на эпигеном. Например, регулярное употребление зеленого чая может снижать риск онкозаболеваний, поскольку в нем содержится определенное вещество (эпигаллокатехин-3-галлат), которое может активизировать гены-супрессоры (подавители) опухолевого роста, деметилируя их ДНК. В последние годы популярен модулятор эпигенетических процессов генистеин, содержащийся в продуктах из сои. Многие исследователи связывают содержание сои в рационе жителей азиатских стран с их меньшей подверженностью некоторым возрастным болезням.
Изучение эпигенетических механизмов помогло понять важную истину: очень многое в жизни зависит от нас самих. В отличие от относительно стабильной генетической информации, эпигенетические «метки» при определенных условиях могут быть обратимыми. Этот факт позволяет рассчитывать на принципиально новые методы борьбы с распространенными болезнями, основанные на устранении тех эпигенетических модификаций, которые возникли у человека под воздействием неблагоприятных факторов. Применение подходов, направленных на корректировку эпигенома, открывает перед нами большие перспективы.
Читайте также:
