Гипопаратиреоз и гипокальциемия. Гиперпаратиреоз и гиперкальциемия
Добавил пользователь Skiper Обновлено: 29.01.2026
Гипопаратиреоз и гипокальциемия. Гиперпаратиреоз и гиперкальциемия
Гипопаратиреоз характеризуется нарушением баланса кальция и фосфора, его причиной служат наследственные факторы или недостаточность паратгормона, вызванная оперативным вмешательством на щитовидной железе. Аналогичная ситуация создается в тех случаях, когда паратгормон не может воздействовать на клеточные рецепторы, например, при псевдо- или псевдопеевдогипопаратиреозе. Характерны следующие изменения:
• гипокальциемия,
• гипомагнисмия,
• гиперфосфатсмия.
Общие симптомы представлены болью в животе, тошнотой и рвотой.
Неврологические симптомы определяются выраженностью гипокальциемии и включают:
• тетанию, проявляющуюся парестезиями в конечностях, карпопедальным спазмом, «рукой акушера», ларингеальным стридором. При объективном исследовании выявляют оживление сухожильных рефлексов, положительные симптомы Хвостека и Труссо;
• припадки: в большинстве случаев генерализованные и плохо поддающиеся лечению;
• головную боль и застойные диски зрительных первое: механизм их возникновения тот же, что и при псевдоопухоли головного мозга;
• признаки поражения базальных ганглиев: может наблюдаться целый рил гино- и гииеркинстических экстра пирамидных расстройств, например, хореоатетоз;
• психические симптомы: повышенная утомляемость, апатия, спутанность, галлюцинации и другие психотические нарушения.
Другие симптомы. Возможны катаракта и миопатия с повышением уровня КФК. Часто выявляется внутричерепная кальцификация. преимущественно в области базальных ганглиев.
При гипопаратиреозе наблюдается низкий уровень паратгормона. Изменения ЭЭГ неспецифичны. Гипокальииемия при нормальном уровне паратгормона может быть признаком хронической почечной недостаточности, недостаточности витамина D. Преходящая шпокальци-емия возможна при многих тяжелых соматических заболеваниях.
Гиперпаратиреоз и гиперкальциемия
Гиперпаратиреоз развивается в большинстве случаев вследствие аденомы паращитовидных желез с гиперсекрецией паратгормона. Классические проявления включают мочекаменную болезнь (камни в почках ее стоят из оксалатов или фосфатов кальция) кистозный остеофиброз, язвенное пораже нис двенадцатиперстной кишки.
Неврологические проявления связаны с повышенным уровнем кальция в крови и включают:
• эмоциональную лабильность, утомляемость, апатию, беспокойство, нарушения сна, депрессию, тошноту, рвоту, анорексию, спутанность сознания, психотические расстройства, угнетение сознания вплоть до комы;
• нарушения памяти идеменцию;
• поражение Неврпо-мышечных структур в виде слабости и атрофии мьшщ, преимущественно в области плечевою и тазового пояса. ЭМГ выявляет миопатические изменения. Возможны также фасиикуляции, гипестезии, парестезия и гипорефлексия;
• атаксию, глазодвигательные нарушс ния, спастические парезы, дизартрию, дисфагию;
• эпилептические припадки.
Диагноз подтверждает выявление повышенного уровня кальция и паратгормона в крови. При обнаружении параггормонпродуцирующей аденомы следует заподозрить синдром множественной эндокринной неоплазии A или В типа. Если повышен только уровень кальция, а содержание паратгормона остается в норме или оказывается низким, необходим дифференциальный диагноз с опухолями (грудной клетки, легких, почек, системы кроветворения), почечной недостатоностью, передозировкой витамина D, саркоидозом и заболеваниями с повышенным метаболизмом костной ткани.
Основным методом лечения является хирургическое удаление аденомы. Лечение других причин гиперкальциемии зависит от их этиологии и клинической ситуации. Из лечебных мероприятий слелует упомянуть гидратацию и форсированный диурез, применение бифосфонатов и кальцитонина.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лечение тяжелого идиопатического гипопаратиреоза на примере клинического случая
Гипопаратиреоз представляет собой редкое эндокринное заболевание, характеризующееся недостаточностью паратгормона (ПТГ), развитием гипокальциемии и нарушением ремоделирования костной ткани.
Целью лечения является нормализация показателей фосфорно-кальциевого обмена и нивелирование клинических проявлений. Традиционная схема терапии заболевания включает применение препаратов кальция и витамина D, в дозах необходимых для поддержания уровня кальция на нижней границе референсного интервала.
Однако лечение гипопаратиреоза в случае трудно корригируемой гипокальциемии представляет определенные сложности для врача-клинициста. Вместе с тем, компенсация заболевания необходима для предотвращения внекостной кальцификации. Ежедневные подкожные инъекции ПТГ (1–84) и ПТГ (1–34) патогенетически обоснованы для заместительной терапии гипопаратиреоза. Однако использование препаратов ПТГ должно быть ограничено группой пациентов, у которых не удается достичь компенсации заболевания на фоне терапии препаратами витамина D и кальция.
В данной статье описывается клинический случай идиопатического гипопаратиреоза с выраженной клинической картиной на фоне трудно корригируемой гипокальциемии, осложненный синдромом Фара. Идиопатический гипопаратиреоз является следствием аутоиммуной деструкции паратощитовидных желез и выставляется путем исключения всех известных причин гипопаратиреоза.
Лечение терипаратидом позволило снизить дозы препаратов кальция и витамина D и достичь компенсации заболевания.
Ключевые слова
Для цитирования:
For citation:
АКТУАЛЬНОСТЬ
Гипопаратиреоз характеризуется сниженной функцией околощитовидных желез, что приводит к недостаточной секреции паратгормона (ПТГ), или резистентностью клеток и тканей к его действию [1]. Дефицит ПТГ обуславливает нарушение обмена кальция и фосфора, что клинически проявляется повышением нервно-мышечной возбудимости и общей вегетативной активности с развитием судорожного синдрома [2]. Гипопаратиреоз относится к редким эндокринным заболеванием с распространенностью среди общей популяции 0,2–0,3%, поэтому в ряде случаев в клинической практике возникают трудности при установлении генеза болезни и подборе адекватной терапии [1].
В статье представлено клиническое наблюдение пациента с идиопатическим гипопаратиреозом, осложненным тяжело корригируемой гипокальциемией и внескелетной кальцификацией.
ОПИСАНИЕ СЛУЧАЯ
Пациент В., 70 лет, обратился в отделение нейроэндокринологии и остеопатий ФГБУ «НМИЦ эндокринологии» Минздрава России с жалобами на судороги в мышцах верхних и нижних конечностей, возникающих до 7 раз в сутки, преимущественно в ночное время, а также на шум в голове, снижение слуха, трудности в письме и общую слабость.
Из анамнеза известно, что генерализованные судороги появились в возрасте 35 лет, тогда же впервые выявлен низкий уровень кальция в крови (со слов, 0,9 ммоль/л). В дебюте болезни несколько лет проводилось лечение бычьим ПТГ. Практически весь период заболевания пациент получал терапию препаратами кальция в больших дозах (4–7 г/сут). Несмотря на проводимую терапию, у больного сохранялись жалобы на судороги, а улучшение общего состояния происходило только при проведении внутривенных инфузий глюконата кальция.
Только последние 2 года пациент принимал карбонат кальция до 4 г/сут в сочетании с активными метаболитами витамина D до 2 мкг/сут.
РЕЗУЛЬТАТЫ ФИЗИКАЛЬНОГО, ЛАБОРАТОРНОГО И ИНСТРУМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ
На момент осмотра: рост 163 см, масса тела 73 кг, индекс массы тела 27.5 кг/м2. На фоне приема 1 мкг альфакальцидола и 2 г кальция отмечались положительные симптомы Хвостека и Труссо. При проведении теста рисования «спирали Архимеда» выявлен эссенциальный тремор. При общении с пациентом отмечены мнестические нарушения.
При лабораторном обследовании выявлена выраженная гипокальциемия, гиперфосфатемия в сочетании с низким уровнем ПТГ (Табл. 1). При анализе суточной мочи на кальций диагностирована гипокальциурия (Табл. 1), что в совокупности с вышеперечисленными нарушениями фосфорно-кальциевого обмена свидетельствуют о наличии гипопаратиреоза.
Таблица 1. Лабораторное обследование пациента П. при первом обращении
Кальций общий, ммоль/л
Кальций ионизированный, ммоль/л
Щелочная фосфатаза, Ед/л
С-концевой телопептид коллагена 1 типа, нг/мл
Кальций в суточной моче, ммоль/сут
Дефицит ПТГ приводит к снижению скорости костного ремоделирования, что лабораторно подтверждается низким уровнем маркеров костного обмена – остеокальцина и С-концевого телопептида коллагена 1 типа (Табл. 1). Недостаточное обновление костной ткани приводит к повышению ее минеральной и трабекулярной плотности (Табл. 2). Минеральная плотность кости (МПК) возрастает в большей степени, как видно из таблицы 2, по сравнению с косвенными данными о плотности трабекулярных структур.
Таблица 2. Рентгеновская денситометрия пациента П.
Примечание: TBS (trabecular bone score) – трабекулярный костный индекс, показывающий микроархитектонику костной ткани. Определяется при проведении стандартной денситометрии поясничных позвонков.
У пациента не было оперативных вмешательств и лучевого воздействия на области шеи, как наиболее частых причин развития гипопаратиреоза, другая патология околощитовидных желез (ОЩЖ) исключена по результатам УЗИ. Наследственные формы заболевания в данном случае маловероятны ввиду начала заболевания в 35 лет, тогда как генетически обусловленные формы манифестируют в раннем детском возрасте. Учитывая отсутствие поражения других эндокринных желез, аутоиммунный генез также исключен. Синдром мальабсорбции и патология желудочно-кишечного тракта были опровергнуты посредством гастроскопии и колоноскопии. Таким образом, методом исключения наиболее вероятных причин заболевания установлен диагноз «идиопатического гипопаратиреоза».
Из анамнеза выяснено, что в возрасте 64 лет пациент перенес острый инфаркт миокарда. В январе 2018 года ввиду кальцификации стенок сосудов проведено стентирование передней нисходящей артерии. Для исключения других очагов эктопической кальцификации вследствие гипопаратиреоза проведена МСКТ головного мозга, по результатам которой диагностирован синдром Фара – кальцификация базальных ганглиев (Рис. 1). Данное осложнение длительно текущего декомпенсированного гипопаратиреоза является следствием приема высоких доз препаратов кальция на фоне гиперфосфатемии. У данного пациента синдром Фара клинически проявляется эссенциальным тремором и мнестическими нарушениями.
Рис. 1. МСКТ головного мозга. Примечание: Синдром Фара – кальцификация базальных ганглиев (справа) и нервных волокон (слева).
В стационаре в связи с тяжелой гипокальциемией и выраженными клиническими проявлениями проводились внутривенные инфузии 10% раствора глюконата кальция 40 мл в 200 мл 0,9% раствора хлорида натрия с выраженным положительным эффектом в виде нормализации уровня кальция (Рис. 2) и регрессом судорожного синдрома. Поскольку постоянное внутривенное введение препаратов кальция привело бы к снижению качества жизни больного, пациент был переведен на пероральный прием препаратов кальция и активных метаболитов витамина D, на фоне максимальных доз которых (7–9 г кальция и 3–4 мкг альфакальцидола в сутки) удалось добиться компенсации состояния (Рис. 2).
Рис. 2. Динамика уровня кальция на фоне проводимого лечения
Принимая во внимание наличие серьезных осложнений гипопаратиреоза в виде внескелетной кальцификации, прием препаратов кальция в больших дозах нежелателен, в связи с чем принято решение о назначении альтернативной терапии терипаратидом. Лечение терипаратидом в дозе 20 мкг дважды в день является более физиологичным в данном случае и способствует нормализации биохимических показателей фосфорно-кальциевого обмена на фоне меньших доз альфакальцидола и препаратов кальция. Однако, ввиду отсутствия официальных показаний в инструкции к препарату, его назначение возможно только по проведению врачебной комиссии.
ОБСУЖДЕНИЕ
В 75% случаев гипопаратиреоз развивается после хирургического вмешательства на области шеи [3], из-за повреждения или удаления ОЩЖ в ходе операции, а также кровоизлияния в них или развития фиброзных процессов. Вторая по встречаемости форма заболевания – аутоиммуный гипопаратиреоз – обусловлена иммуноопосредованным разрушением клеток ОЩЖ. Он встречается как в качестве изолированного заболевания, так и в рамках наследственного аутоиммуного полигландулярного синдрома 1 типа, для которого характерны слизисто-кожный кандидоз, гипопаратиреоз и первичная надпочечниковая недостаточность [4]. Среди детей и подростков основной причиной гипопаратиреоза являются наследственные заболевания, приводящие к нарушению эмбриогенеза или аутоиммунному поражению ОЩЖ, а также дефектам рецепторов к ПТГ. К более редким причинам относят разрушение ОЩЖ после лучевого воздействия или инфильтративных заболеваний (гемохроматоз, болезнь Вильсона, гранулемы). Гипомагниемия (вследствие алкоголизма или мальабсорбции) также может привести к развитию гипопаратиреоза, т.к. в условиях дефицита магния нарушается синтез ПТГ. В некоторых случаях, как в представленном клиническом примере, генез гипопаратиреоза остается неясным.
Для лечения хронической гипокальциемии при гипопаратиреозе используют традиционную схему лечения: карбонат/цитрат кальция 1–9 г в пересчете на элементарный кальций в сочетании с альфакальцидолом в средней дозе 0,5–2 мкг/сут (до 4 мкг/сут) и колекальциферолом в дозе, необходимой для достижения уровня витамина D более 30 нг/мл. Препараты витамина D способствуют увеличению реабсорбции кальция в почечных канальцах и стимулируют его мобилизацию из костей. Лечение проводят под контролем уровеней кальция в крови и суточной моче во избежание передозировки и развития гиперкальциемии и гиперкальциурии. Одни из основных целей лечения – поддержание уровня общего кальция сыворотки на нижней границе референсного интервала и уровня фосфора сыворотки на верхней границе референса, что в большинстве случаев способствует нивелированию симптомов гипокальциемии и препятствует развитию внекостной кальцификации.
Впервые патогенетическая терапия гипопаратиреоза с использованием терипаратида вне показаний при хронической гипокальциемии была изучена в перекрестном исследовании, в котором принимали участие 10 взрослых пациентов. Время наблюдения составило 10 недель, по окончанию которых удалось достичь стойкой нормокальциемии и нормокальциурии у всех пациентов при введении препарата 1 раз в сутки [7]. В другом исследовании было доказано преимущество двукратных инъекций ПТГ 1–34, что приводило к более эффективной нормализации уровня кальция в крови [8]. В некоторых ситуациях возможно непрерывное подкожное введение ПТГ 1–34 с помощью помпы, которое обеспечивает меньшую вариабельность уровня кальция в крови и моче и стабилизацию уровня магния в пределах референсного интервала. В настоящее время, доставка ПТГ 1–34 с помощью помпы является более физиологичной альтернативой подкожным инъекциям [9].
Другим ограничением к применению терипаратида является максимально установленный срок лечения 2 года, что связано с развитием остеосаркомы при превышении данного периода в исследованиях на крысах [10]. Следует отметить, это осложнение было связано с наличием открытых зон роста у крыс в течение всего жизненного цикла, тогда как у людей зоны роста полностью закрываются к 20–25 годам. Тем не менее, рекомендуется информировать пациента о данных ограничениях при назначении терипаратида.
Компенсация фосфорно-кальциевого обмена при гипопаратиреозе необходима для предотвращения эктопической кальцификации. При идиопатическом гипопаратиреозе синдром Фара наблюдается в 70% случаев, и его прогрессирование коррелирует с гиперфосфатемией [11]. Тем не менее, имеются и другие факторы, располагающие к развитию кальцификации базальных ганглиев, т.к. для гиперфосфатемии вследствие хронической болезни почек синдром Фара не характерен [12]. Вероятнее всего, именно низкий уровень ПТГ запускает процесс отложения кальция в базальных ганглиях [13], поэтому заместительная терапия препаратами ПТГ представляется патогенетически обоснованной в комплексном лечении идиопатического гипопаратиреоза.
ЗАКЛЮЧЕНИЕ
В настоящее время первой линией терапии гипопаратиреоза являются препараты кальция и активные метаболиты витамина D [14]. Однако, наиболее физиологичным способом лечения гипопаратиреоза должна стать заместительная терапия рекомбинантным человеческим ПТГ (1–84) или его фрагментом ПТГ (1–34) – терипаратидом. Эти методы лечения используются для компенсации гипокальциемии, когда традиционная терапия неэффективна или развиваются значимые осложнения, течение которых может усугубляться при применении традиционной терапии с высокими дозами кальция [14].
Определенные сложности связаны с ограничением применения терипаратида до 24 месяцев согласно инструкции. Однако, применение терипаратида для лечения гипопаратиреоза является заместительной терапией в отличие от лечения остеопороза и по всей видимости может быть пролонгировано. Вместе с тем, необходимы дальнейшие исследования в этой области.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Согласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Гипопаратиреоз и гипокальциемия. Гиперпаратиреоз и гиперкальциемия
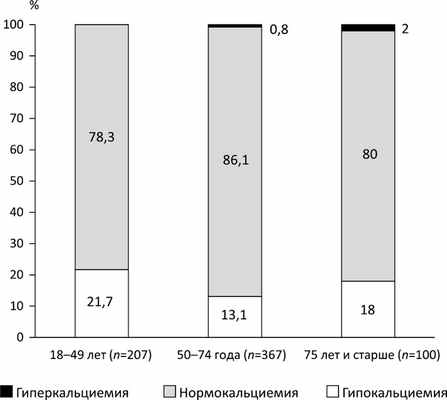
Частота уровня кальция в крови у пациентов трех возрастных групп (%).
Frequency of blood calcium levels in patients of three age groups (%).
Возрастная группа от 18 до 49 лет (207 пациентов). Нормокальциемия у пациентов этой группы определялась в 78,3% случаев (2,26 [2,20; 2,32] ммоль/л). Случаев гиперкальциемии зафиксировано не было. Гипокальциемия была отмечена у 21,7% (2,11 [2,03; 2,13] ммоль/л) пациентов. Частота гипокальциемии среди женщин была выше, чем у мужчин. Гипокальциемия встречалась чаще, чем у пациентов старших возрастных групп (от 50 лет) (21,7% против 14,1%; p=0,014, χ 2 ).
Возрастная группа 75 лет и старше (100 пациентов). Нормокальциемия наблюдалась в 80% случаев (2,25 [2,2; 2,3] ммоль/л), гиперкальциемия — в 2% (с максимальным повышением до 2,88 ммоль/л), гипокальциемия — у 18% пациентов (2,09 [2,01; 2,12] ммоль/л). Статистически значимых различий между женщинами и мужчинами по частоте гипокальциемии также выявлено не было.
В настоящем исследовании обращает на себя внимание достаточно высокая частота гипокальциемии, особенно среди пациентов молодого возраста (18—49 лет) по сравнению со старшими возрастными группами (21,7% против 14,1%). Ранее полученные нами результаты скрининга уровня кальция в крови в независимых выборках взрослых жителей трех городов России (Сургут — 191 пациент, Иркутск — 243 пациента, Москва — 499 пациентов), различных по своим экологическим, возрастным и социальным условиям, также продемонстрировали высокую встречаемость гипокальциемии в 6, 31 и 5% соответственно [16]. Данные по распространенности снижения уровня кальция в литературе немногочисленны, в основном они представлены на смещенной выборке госпитализированных пациентов и не позволяют экстраполировать показатели на общую популяцию. Тем не менее в недавнем исследовании A. Catalano и соавт. (12 334 пациентов, анализ данных за период 2011—2014 гг.) гипокальциемия среди стационарных больных определялась в 3420 (27,72%) случаях, статистически значимо чаще у пациентов старше 65 лет — 2097 (61,3%; χ 2 =2407, p<0,0001) случаев, а также у мужчин — 1952 (57,07%; χ 2 =136, p<0,0001) случая [8].
Учитывая относительно невысокую распространенность гипопаратиреоза (25—37 случаев на 100 тыс.) [17], полученные в настоящем исследовании результаты по частоте гипокальциемии могут свидетельствовать о преобладании других причин ее развития, прежде всего вследствие дефицита витамина D и алиментарной недостаточности кальция. Среди других вероятных этиологических факторов гипокальциемии в исследованной когорте можно выделить хроническую болезнь почек, особенно в старших возрастных группах.
Гипокальциемия, ассоциированная с дефицитом 25 (OH)D, может быть обусловлена географическим расположением включенных в исследование городов в северной широте выше 35 параллели, при котором из-за острого угла падения солнечных лучей и их рассеивания в атмосфере с ноября по конец марта в коже витамин D практически не синтезируется. Недостаточная инсоляция по причине небольшого количества солнечных дней и средняя годовая температура, низкое содержание витамина D в продуктах питания, избыточная масса тела и ожирение, темный цвет кожи являются дополнительными факторами риска дефицита 25(OH)D, в том числе у лиц молодого возраста, и в ряде случаев могут способствовать развитию вторичного гиперпаратиреоза и, как следствие, заболеваний костной и соединительной ткани [18].
По данным зарубежных исследований, гиперкальциемия в общей популяции определяется в среднем в 0,7—1% случаев [6, 10, 11], чаще у лиц старших возрастных групп, что согласуется с полученными в настоящем исследовании результатами. В группе 50—74 лет у 8 (2,2%) пациентов показатели общего кальция находились в верхненормальном диапазоне 2,5—2,55 ммоль/л. Всем пациентам с высоконормальными и превышающими референсный диапазон показателями требовались повторное определение кальция с обязательной коррекцией на альбумин, а при подтверждении гиперкальциемии — анализ на ПТГ. Двукратное определение уровня кальция, в том числе с поправкой на уровень альбумина, представляется наиболее экономически целесообразным, так как позволяет избежать лабораторных ошибок и, как следствие, необоснованного дорогостоящего обследования на предмет ПГПТ, онкологических заболеваний или других причин гиперкальциемии. По данным скрининга кальция в Сургуте, Иркутске и Москве, повышение уровня общего кальция относительно референсного диапазона в различных возрастных группах фиксировалось в 9, 5 и 3% соответственно. Средний возраст пациентов с гиперкальциемией составил 61±10 лет (соотношение мужчин и женщин — 1:3), средний уровень кальция — 2,7±0,2 ммоль/л. Группой риска развития гиперкальциемии были пациенты в возрасте 50 лет и старше (8% против 2,7%; p<0,05).
Опыт зарубежных исследований свидетельствует о высокой эффективности введения определения уровня кальциемии в рутинный биохимический анализ крови, что позволяет в несколько раз увеличить выявляемость пациентов не только с гипокальциемией, но и с ПГПТ и онкопатологией. ПГПТ относится к социально значимым заболеваниям в связи с вовлечением в патологический процесс большинства органов и систем, что обусловливает высокий риск инвалидизации и преждевременной смерти пациентов. У больных с ПГПТ значимо возрастают риски низкотравматичных переломов, в том числе шейки бедра, а также нефролитиаза/нефрокальциноза, снижения фильтрационной функции почек вплоть до развития претерминальных и терминальных стадий. При этом наиболее частыми причинами смерти у пациентов с ПГПТ являются почечная недостаточность (около 8%) и сердечно-сосудистые заболевания (более 68%), включая инфаркт миокарда, инсульт, сердечную недостаточность [21, 22]. Гиперкальциемия вследствие онкологических заболеваний считается одним из наиболее грозных метаболических нарушений, часто имеет острое начало и выраженную клиническую симптоматику, требующую госпитализации и экстренной помощи в специализированных отделениях [12].
В России у значительной части пациентов гиперкальциемия и ПГПТ диагностируются на этапе тяжелых костных и висцеральных проявлений, что связано с отсутствием рутинного определения кальция и свидетельствует о низкой информированности врачей и пациентов [16]. Поздняя выявляемость этих нарушений серьезно ухудшает прогноз и создает предпосылки для высоких экономических затрат на лечение и реабилитацию пациентов.
Заключение
В настоящем исследовании была зафиксирована высокая частота гипокальциемии (16,5%; 95% ДИ 13,8—19,5%), при этом она достоверно чаще выявлялась у пациентов в возрасте до 50 лет, чем в более старших возрастных группах (21,7% против 14,1%). В возрастном диапазоне 18—49 лет гипокальциемия у женщин встречалась чаще, чем у мужчин (29,8% против 10,5% соответственно). Гиперкальциемия была зафиксирована в 0,7% (0,2%; 1,7%) случаев, причем только у лиц старше 50 лет. Проведенное исследование подтверждает важность определения кальция в сыворотке крови, так как отклонения в его уровнях являются маркерами различных заболеваний и патологических состояний даже у молодых людей. Выявленная высокая частота гипокальциемии, скорее всего, является следствием таких распространенных нарушений, как дефицит 25(ОН)D и алиментарная недостаточность кальция. Повышение уровня кальция определялось у 0,7% пациентов старших возрастных групп, что согласуется с результатами других исследований, посвященных этой проблеме. Тяжесть заболеваний, приводящих к развитию гиперкальциемии и ассоциированных осложнений, заставляет врачей более внимательно относиться к диагностике этого состояния и стремиться к более раннему выявлению его причин. В международных исследованиях оценка гиперкальциемии в первую очередь направлена на своевременную диагностику и анализ распространенности ПГПТ и онкологических заболеваний.
Участие авторов: концепция и дизайн — Н.Г. Мокрышева, С.С. Мирная, Е.А. Добрева, А.К. Еремкина, И.С. Маганева, О.М. Драпкина; сбор и обработка материала — С.С. Мирная, И.С. Маганева, В.Л. Володичева, И.В. Крюкова, И.А. Барсуков, А.К. Еремкина; статистическая обработка данных — О.Ю. Реброва, А.Р. Айнетдинова; написание текста — Н.Г. Мокрышева, И.С. Маганева, В.Л. Володичева, С.С. Мирная, А.К. Еремкина; редактирование — Н.Г. Мокрышева, С.С. Мирная, А.К. Еремкина, И.С. Маганева, О.Ю. Реброва.
Хронический гипопаратиреоз у взрослых: клиническая картина, диагностика, лечение, динамический контроль
Гипопаратиреоз является редкой патологией кальций-фосфорного обмена и чаще всего развивается после хирургического вмешательства на органах шеи. В связи с увеличением распространенности заболеваний щитовидной и околощитовидных желез, лечение которых может привести к развитию гипопаратиреоза, данная проблема становится все более актуальной. Ведение пациента с хроническим гипопаратиреозом основано на подборе персонализированной схемы лечения, динамическом контроле осложнений заболевания и профилактике побочных эффектов терапии.
Ключевые слова
Для цитирования:
For citation:
Введение
Гипопаратиреоз – заболевание, характеризующееся недостатком паратиреоидного гормона (ПТГ), приводящим к гипокальциемии, гиперфосфатемии и повышению фракционной экскреции кальция с мочой.
Эпидемиология
Распространенность гипопаратиреоза, по результатам эпидемиологических исследований, проведенных в Дании, США и Норвегии, варьирует в пределах 10,2–37 случаев на 100 тыс. населения [1–4]. В России подобных данных нет в связи с отсутствием крупномасштабных исследований частоты встречаемости данного состояния.
Этиология
Самой распространенной причиной гипопаратиреоза (63–91%) является повреждение, удаление либо нарушение кровоснабжения околощитовидных желез (ОЩЖ) в ходе хирургического вмешательства на органах шеи. Риск возникновения послеоперационного гипопаратиреоза зависит в первую очередь от объема операции и опыта хирурга. Наиболее часто послеоперационный гипопаратиреоз развивается после хирургического лечения рака щитовидной железы и диффузного токсического зоба [5, 6]. Тотальная паратиреоидэктомия, показанная при множественном поражении ОЩЖ (синдромы множественных эндокринных неоплазий (МЭН) 1 и 2 типов, вторичный гиперпаратиреоз на фоне хронической болезни почек), также может приводить к развитию послеоперационного гипопаратиреоза. Описаны случаи отсроченного развития послеоперационного гипопаратиреоза спустя годы после операции на органах шеи, возникшего вследствие изменений сосудов, кровоснабжающих оставшиеся ОЩЖ.
К более редким причинам развития гипопаратиреоза относится аутоиммунное поражение ОЩЖ, которое может быть как изолированным, так и в составе аутоиммунного полигландулярного синдрома 1 типа (АПС 1 типа) [7]. Гипопаратиреоз встречается в рамках поликомпонентных генетических синдромов, например, при синдроме Ди-Джорджи, синдроме Бараката (HDR-синдром), синдроме Саньяд-Сакати (HRD-синдром) и др. Среди других причин гипопаратиреоза также выделяют пострадиационный (возникший после терапии радиоактивным йодом диффузного токсического зоба) и метастатический (инфильтрация ОЩЖ метастазами из других органов) [8–10].
Клиническая картина и симптомы гипопаратиреоза
Клинические проявления гипопаратиреоза различны и затрагивают почти все системы организма (рис. 1) [11]. Основным симптомом гипопаратиреоза является повышение нервно-мышечной возбудимости как следствие низких показателей кальциемии. Предполагается, что в основе кальцификации мягких тканей, наблюдаемой при длительно текущем заболевании, лежит хроническая гиперфосфатемия.
Рис. 1. Клинические проявления гипопаратиреоза (по материалам Mannstadt M. и др. [11]).
* – осложнения главным образом стандартной терапии препаратами кальция и витамина D
Периферическая нервная система
Недостаток кальция в организме приводит к частичной деполяризации потенциала покоя на мембране нейронов, тем самым увеличивая вероятность запуска потенциала действия. Как следствие, повышаются нервно-мышечная возбудимость и общая вегетативная реактивность. Усиление чувствительности сенсорного (чувствительного) нейрона проявляется в виде парестезий в конечностях и в околоротовой области; моторного (двигательного) нейрона – мышечными спазмами, вплоть до тетании: от классического карпопедального спазма до жизнеугрожающего ларингоспазма. Повышение нервно-мышечной возбудимости может быть диагностировано с помощью пробы Хвостека (подергивание мышц лица при постукивании по области выхода тройничного нерва) и пробы Труссо (появление судорог в кисти («рука акушера») через 1–3 минуты после сдавления плеча манжетой для измерения артериального давления) (рис. 2) [12–15].
Рис. 2. Проба Труссо, «рука акушера». Симптом Хвостека.
Тяжелая гипокальциемия ассоциирована как с локальными, так и генерализованными судорогами тонико-клонического типа. Именно генерализованные судороги ранее считались признаками низкого уровня кальция крови, хотя они сопровождают только 4–8% случаев тяжелой гипокальциемии [16].
Центральная нервная система
По данным исследований, проведенных в США и Индии, частота кальцификации различных отделов головного мозга у пациентов с гипопаратиреозом составляет в среднем 52–74% [16, 17]. Чаще всего кальцификации визуализируются в базальных ганглиях, среди других локализаций – белое вещество головного мозга, таламус, зубчатое ядро. Хотя точной причины, приводящей к формированию внескелетной кальцификации, не установлено, прогрессирование кальцификации тесно связано с изменениями обмена фосфора.
Установлено, что два гена: натрий-зависимый фосфорный транспортер 2 типа (PIT2, также известный как SLC20A2) и ксенотропный и политропный рецептор ретровируса 1 (XPR), ассоциированные с семейной изолированной кальцификацией базальных ганглиев (синдром Фара), кодируют белки-переносчики фосфора, таким образом подтверждая гипотезу о роли фосфора в развитии эктопической кальцификации при хроническом гипопаратиреозе [18, 19].
Клинические проявления кальцификации различных отделов центральной нервной системы у пациентов с длительным анамнезом гипопаратиреоза неспецифичны. Прямой связи с симптомами паркинсонизма (неврологические нарушения движения, характеризующиеся тремором, брадикинезией, ригидностью и постуральной нестабильностью) и дистонии (неврологические расстройства движения, связанные со «скручиванием» или аномальными фиксированными позами) не выявлено, и эти нарушения отмечаются гораздо реже, чем, например, кальцификация базальных ганглиев [15, 16, 20]. Вопрос о наличии взаимосвязи между объемом, локализацией обызвествлений и неврологическими симптомами остается противоречивым [16, 17, 20].
Сердечно-сосудистая система
В ряде случаев гипопаратиреоз сопровождается нарушением сердечного ритма. В исследовании Vered I. и соавт. у пациентов с гипопаратиреозом и длительной некомпенсированной гипокальциемией на электрокардиограммах наблюдалось удлинение интервала QT, наряду с изменениями U и Т зубцов [21]. Необходимо отметить, что большинство из этих симптомов разрешаются после компенсации заболевания и достижения стойкой нормокальциемии.
Хронический гипопаратиреоз тяжелого течения может сопровождаться развитием гипокальциемической дилатационной кардиомиопатии, которая, как правило, обратима на фоне компенсации заболевания. Частота развития кардиомиопатии у пациентов с гипопаратиреозом невелика [22].
По данным P. Agarwal и соавт., у пациентов с хроническим идиопатическим гипопаратиреозом отмечалось увеличение толщины комплекса интима-медиа в сонных, почечных артериях и аорте, а также повышение уровня коронарного кальция той или иной степени выраженности в 10% случаев [23–25]. Индекс коронарного кальция коррелировал с уровнем альбумин-скорректированного кальция крови. Несмотря на существующие доказательства повышения маркеров сердечно-сосудистых заболеваний у пациентов с хроническим гипопаратиреозом, риски развития патологии сердечно-сосудистой системы (ишемической болезни сердца, нарушений сердечного ритма и др.) по результатам крупного датского исследования не отличались от общепопуляционных значений. Однако это было ретроспективное исследование базы данных пациентов с послеоперационным гипопаратиреозом (n=688) [26]. Необходимы дальнейшие исследования, посвященные изучению факторов риска и патогенетических аспектов сердечно-сосудистой патологии при хроническом гипопаратиреозе.
Почки
Традиционное лечение препаратами кальция и активными метаболитами витамина D способствует повышению экскреции кальция с мочой, что обусловлено отсутствием ПТГ-опосредованной реабсорбции в дистальном канальце нефрона. Хроническая гиперкальциурия – фактор риска нефрокальциноза и нефролитиаза, а также развития почечной недостаточности. В многочисленных исследованиях распространенность нефрокальциноза среди больных, получающих стандартную терапию препаратами кальция и активными метаболитами витамина D, варьирует в пределах 12–57% [27]. В ранее упомянутом датском исследовании отмечено повышение рисков развития нефролитиаза у пациентов с послеоперационным гипопаратиреозом в 4,82 раза по сравнению с общей популяцией [26].
Пациенты с гипопаратиреозом, принимающие препараты кальция и витамина D, имеют повышенный риск развития хронической болезни почек. В американской когорте 41% пациентов имели скорость клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2 (СКФ ≥90 мл/мин/1,73 м2 считается нормой), что в 2–17 раз превышает скорректированные на возраст значения [16]. В двух датских исследованиях отмечено повышение частоты диагностированной почечной недостаточности в 3,10 раза (95% CI 1,73–5,55) и в 6,01 раза (95% CI 2,45–14,75) у пациентов с послеоперационным гипопаратиреозом и гипопаратиреозом другой этиологии, по сравнению с группой здорового контроля [2, 26].
Скелетно-мышечная система и зубная ткань
Гипопаратиреоз ассоциирован со снижением активности костного метаболизма (замедление процессов костеобразования и костной резорбции) и может быть связан как с нормальной, так и с повышенной минеральной плотностью кости (МПК), а также изменениями микроархитектоники костной ткани [28, 29]. Сниженная скорость костеобразования была продемонстрирована снижением количества тетрациклиновых меток в биопсийном материале костной ткани по сравнению с группой контроля [30–32]. Снижение костной резорбции характеризуется уменьшением количества и глубины резорбционных ямок, недостаточным костеобразованием в результате каждого цикла ремоделирования и снижением прочности кости [29]. По результатам гистоморфометрии и микрокомпьютерной 3D-томографии костной ткани у пациентов с гипопаратиреозом отмечается увеличение МПК, толщины кортикального слоя, повышение плотности трабекулярной кости с нетипичным преобладанием пластинчатых трабекул [33, 34].
В связи с отсутствием полномасштабных исследований риска переломов у пациентов с хроническим гипопаратиреозом клиническое значение аномальной микроархитектоники костной ткани остается предметом дискуссий. По результатам датского исследования случай-контроль, риск переломов костей у пациентов с гипопаратиреозом не отличался от общепопуляционного [2, 26]. Получены интересные данные по структуре переломов. Пациенты с гипопаратиреозом, не связанным с хирургическим вмешательством, по сравнению с общей популяцией имеют большие риски переломов костей верхних конечностей (1,94; 95% CI 1,31–2,85); при этом у пациентов с послеоперационным гипопаратиреозом, напротив, эти риски ниже общепопуляционных показателей (0,69; CI 0,49–0,97) [35]. В исследовании Maira L. Mendonça и соавт. было продемонстрировано увеличение частоты морфометрических переломов позвоночника у пациентов с послеоперационным гипопаратиреозом независимо от показателей МПК, полученных при проведении двухэнергетической рентгеновской денситометрии (DEXA) [36].
Состояние суставов при гипопаратиреозе характеризуется повышением рисков развития спондилоартропатии, характеризующейся оссификацией связок и образованием синдезмофитов [37]. В небольшой серии клинических наблюдений сообщалось о наличии клинически выраженной спондилоартропатии у 3 из 40 пациентов с гипопаратиреозом, с выявлением радиологических изменений в 14 из 40 случаев [38].
При гипопаратиреозе может наблюдаться миопатия скелетных мышц, для которой характерно специфическое повышение уровня креатинфосфокиназы в сыворотке крови. Миопатия подтверждается наличием гистологических изменений в биопсийном материале и, по-видимому, относится к проявлениям тяжелой гипокальциемии [39, 40]. По сравнению с лицами соответствующего пола и возраста пациенты с гипопаратиреозом имеют значимо сниженную мышечную силу и требуют более длительного времени для прохождения тестов физического функционирования [41].
Патология зубов, описанная у пациентов с гипопаратиреозом, не связанным с хирургическим вмешательством, включает гипоплазию зубной эмали, укорочение корней, гипоплазию или отсутствие зубов [42, 43].
Органы зрения
Гипопаратиреоз ассоциирован с повышенным риском развития катаракты, распространенность данного осложнения составляет 27–55% [44–46]. Взаимосвязь катаракты и тетании была описана многими клиницистами еще в конце XIX в. Одним из первых, кто описал 15 случаев билатеральной катаракты у пациентов с тетанией, был Logetschnikowl [47]. В исследовании, проведенном Q.L. Huang в Китае в 1989 г., гипокальциемическая катаракта описана у 32 из 38 пациентов с гипопаратиреозом [48]. Изменения, протекающие в хрусталике, авторы напрямую связывали с уровнем кальция в плазме, а не с длительностью течения гипопаратиреоза. Лабораторные исследования указывали на прямую пропорциональную зависимость кальциемии и внутриглазной жидкости.
В датском исследовании у пациентов с гипопаратиреозом, развившимся не в результате хирургического вмешательства, выявлено увеличение риска развития катаракты в 4,21 раза (95% CI 2,13–8,34) по сравнению с группой контроля. Однако у пациентов с послеоперационным гипопаратиреозом риск возникновения катаракты существенно не отличается от населения в целом. Таким образом, предполагается, что возраст начала и/или длительность заболевания являются важными факторами риска развития данного осложнения [2, 26]. В исследовании S. Saha и соавт. отмечено, что пациенты с идиопатическим гипопаратиреозом и катарактой были значительно моложе, чем типичные пациенты с катарактой, а также имели признаки более тяжелого поражения задней капсулы и более высокую частоту поражения передней капсулы [46]. Гипопаратиреоз преимущественно ассоциирован с кортикальной катарактой (постепенное помутнение, начиная с периферии линзы), тогда как типичные возрастные катаракты, более вероятно, будут ядерными (постепенное замутнение центральной части линзы). Этиология и патогенез катаракты при гипопаратиреозе до конца не изучены, хотя установлена взаимосвязь с хронической гипокальциемией.
Папиллоэдема (отек диска зрительного нерва, вызванный повышением внутричерепного давления) также может наблюдаться у пациентов с гипопаратиреозом. Состояние улучшается при коррекции гипокальциемии [49].
Кожа и ее производные
При гипопаратиреозе происходит поражение кожи и ее производных, что проявляется в первую очередь сухостью кожи, хрупкостью ногтей, большей их подверженностью к онихолизису (отслаивание ногтя от мягких тканей ложа). В исследовании S. Sarkar и соавт. у 76% пациентов с хроническим гипопаратиреозом были выявлены те или иные поражения кожи и ее придатков: сухость кожи наблюдалась в 52% наблюдений, у 52–62% – потеря волос подмышечных и лобковых областей, 9,5% имели алопецию, у 38% отмечалась ломкость ногтей с последующим онихолизисом у 29% [50]. Описаны случаи тяжелого пустулезного псориаза, ассоциированного с гипокальциемией, с существенным улучшением на фоне достижения нормокальциемии [51].
Нейрокогнитивные изменения
Гипопаратиреоз связан с повышенным риском нейропсихических заболеваний [52]. В датской когорте пациентов риск госпитализации по поводу нейропсихических патологий, таких как депрессия или биполярное аффективное расстройство, был значительно увеличен в группе послеоперационного гипопаратиреоза (коэффициент риска 2,01, 95% CI 1,16–3,50) и гипопаратиреоза другой этиологии (отношение рисков 2,45; 95% CI 1,78–3,35), по сравнению с сопоставимыми по возрасту и полу группами контроля [35].
Критерии постановки диагноза
Диагноз гипопаратиреоза устанавливается при наличии гипокальциемии и гиперфосфатемии в сочетании с низким уровнем ПТГ сыворотки крови [53].
Для постановки диагноза используется определение уровня общего кальция в сыворотке крови не менее 2–3 раз с интервалом между исследованиями в 2 недели. В некоторых случаях, при изменениях концентрации плазменных белков, требуется корректировка кальция на уровень альбумина крови. Для расчета альбумин-скорректированного кальция используется формула: общий кальций плазмы (с поправкой) (ммоль/л) = измеренный уровень кальция плазмы (ммоль/л) + 0,02 × (40 – измеренный уровень альбумина плазмы (г/л)). При сомнительных результатах рекомендовано определение уровня ионизированной фракции кальция в сыворотке крови, который в норме находится в референсном диапазоне 1,03–1,29 ммоль/л.
Измерение ПТГ дает существенную информацию, но вместе с тем его результаты должны быть корректно интерпретированы, так как гипокальциемия может приводить к компенсаторному относительному стимулированию остаточной продукции ПТГ и маскировать истинный гипопаратиреоз. Таким образом, гипокальциемия на фоне нормальной концентрации ПТГ может быть поводом для динамического наблюдения и дообследования пациента.
Исключение вторичных причин гипокальциемии – гипомагниемии и дефицита витамина D – также должно производиться для правильной постановки диагноза [53].
Лечение хронического гипопаратиреоза
Лечение проводится всем пациентам с хроническим гипопаратиреозом с симптомами гипокальциемии и уровнем альбумин-скорректированного общего кальция менее 2,0 ммоль/л или ионизированного кальция сыворотки крови менее 1,0 ммоль/л. В случае бессимптомного течения хронического гипопаратиреоза и при уровне общего кальция выше 2,0 ммоль/л, но ниже референсного диапазона предлагается пробная терапия с последующей оценкой общего самочувствия (табл. 1, 2).
Таблица 1. Терапевтические цели по рекомендациям Европейского общества эндокринологов [53]
Уровень альбумин-скорректированного кальция крови
Поддержание на нижней границе или несколько ниже нижней границы референсного диапазона (2,11–2,65 ммоль/л) у пациентов без клинических симптомов гипокальциемии
Уровень суточной экскреции кальция (кальций в суточной моче)
Поддержание в пределах целевого диапазона
Уровень фосфора сыворотки крови
Поддержание на уровне верхней границы референсного диапазона
В пределах целевого диапазона
Уровень магния сыворотки крови
В пределах целевого диапазона
Уровень 25(ОН)витамина D
Как в общей популяции
>30 нг/мл (>75 нмоль/л)
Общее самочувствие и качество жизни
Информирование пациента о симптомах гипокальциемии и гиперкальциемии, осложнениях заболевания
Таблица 2. Лекарственные препараты для лечения гипопаратиреоза
Гиперкальциемия (гипокальциемия)
«Лишний» кальций, как и его недостача, не несет пользу для организма, вызывая патологии внутренних органов. Кальций относится к важнейшим «строительным» элементам, благодаря которому регулируются различные процессы в организме. Основная доля участвует в развитие скелета, в росте зубов, ногтей, волос.
Гиперкальциемия - повышенное содержание кальция может вызвать сбой в работе желудка, почек (снижение клубочковой фильтрации), сердечной мышце, нервной системе.
Гипокальциемия – пониженное содержание свободного кальция в крови может быть вызвана эндокринными заболеваниями, среди которых гипопаратиреоз (псевдогипопаратиреоз), тиреотоксикоз, феохромоцитома и паратирокрининовая недостаточность. Негативное влияние оказывают метастазы при новообразованиях, болезни почек, поджелудочной железы, сепсис.
Важно определить причины как избытка, так и нехватки элемента.
Причины
Основными причинами гиперкальциемии являются избыток паратгормона в организме (гиперпаратиреоз), онкология и длительное употребление препаратов кальция.
Гипокальциемия практически всегда развивается на фоне недостаточности паратгормона, за выработку которого отвечает верхняя и нижняя паращитовидная железа. Взаимодействуя с гормоном кальцитонином (щитовидка), регулируется обмен фосфора и кальция в организме.
Избыток кальция в равной степени, как и недостача, развиваются при отклонениях в работе органов и систем.
Симптомы
Первые признаки гиперкальциемии могут быть незаметными, и только случайный анализ крови укажет на проблемы. Появление явных симптомов повышения кальция в крови зависит от длительности такого состояния, скорости развития, тяжести основного заболевания.
Эти симптомы проявляются со стороны основных систем организма: нервной, мышечной, пищеварительной, мочевыделительной, сердечно-сосудистой, болезней глаз и кожи. У больного ухудшается память, появляется заторможенность, сонливость, депрессивные состояния, слабость и боль в мышцах, синдром беспокойных ног по ночам, снижение аппетита, запоры, тошнота, рвотный рефлекс и отрыжка. Возможно снижение веса на фоне панкреатита, желчнокаменной болезни, язвы желудка с повышенной кислотностью. Развивается артрит и артроз, подагра.
Гипокальциемия часто сочетается и с недостатком калия, что приводит к избыточной возбудимости нейронов. Как следствие, возникают судороги мышц (плеч, кистей, гортани, мимических мышц). Нарушается и кожная чувствительность, возникают ощущения жжения или онемения. Развивается геморрагический синдром, который проявляется повышенной кровоточивостью. Свертываемость крови снижается. Возникают дистрофические изменения в тканях, дефекты зубов, ломкость ногтей, тусклость волос, сухость кожи, нередко нарушается сердечный ритм, развивается катаракта.
Диагностика
При обнаружении симптомов гипокальциемии необходимо обратиться к эндокринологу. Для постановки диагноза, как правило, назначаются: общий анализ крови и мочи, электрокардиография, денситометрия (анализ плотности костной ткани), МРТ внутренних органов.
При гиперкальциемии также выполняются анализы крови и мочи. Кроме того, при рентгенографии грудной клетки, черепа и конечностей можно обнаружить костные повреждения.
Лечение
Начальную стадиюгиперкальциемии, причиной которой является неумеренное употребление продуктов и лекарственных препаратов, содержащих кальций, то проблему незначительного увеличения количества кальция в организме человека помогут решить:изменение рациона питания в сторону снижения количества продуктов, содержащих большое количества кальция. Корректировка доз, замена или отказ от лекарственных препаратов, содержащих кальций. При здоровых почках достаточное употребление воды, лучше дистиллированной (не больше 2-х месяцев).
Если же гиперкальциемия развилась на фоне тяжелых заболеваний, то лечение направлено на основное заболевание и очищение организма от излишнего кальция. При нормальной работе почек, обычно кальций вымывают с помощью мочегонных средств и внутривенно вводимогофизраствора. При тяжелых состояниях проводят гемодиализ (очищение крови от продуктов распада). Если процесс усиленного вывода кальция из костей не удается остановить, то применяют гормональные препараты.
Основная задача при гипокальциемии – восполнить дефицит кальция в организме. Кроме того, лечения направляется и на устранение причины заболевания. Так, при гипопаратиреозе (недостатке паратиреоидного гормона) назначают гормональную терапию. Хроническая форма гипокальциемии лечится регулярным приемом кальция в таблетках и витамина D. Кроме того, принимаются меры для нормализации уровня магния, калия и белка в крови.
Читайте также:
