Интрамедуллярный доступ. Переливания в костный мозг
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Аудиоквест о донорстве — экскурсия по центру крови с загадками!
Присоединяйся к самому уютному сообществу доноров!
При каких болезнях необходима трансплантация, с какими рисками может встретиться больной после лечения и как происходит процедура ТКМ.
Трансплантация костного мозга (ТКМ) — это замена неработающего костного мозга у пациента на здоровый. На самом деле, это перенос гемопоэтических стволовых клеток, которые в организме развиваются в лимфоциты, лейкоциты, эритроциты и тромбоциты, то есть образуют компоненты крови.
Костный мозг заменяют при лечении пациентов с тяжелыми формами онкогематологических заболеваний, например, лейкозов и лимфом, а также апластической анемии, врожденных иммунодефицитов, наследственных болезней обмена веществ.
Сама процедура не сложная, напоминает переливание крови. Но очень сложным является лечение больного до и после трансплантации — после сильнейшей химиотерапии он беззащитен перед любой инфекцией, кроме того, ему грозит опасное осложнение — реакция «трансплантат против хозяина». Это иммунный конфликт между клетками донора и пациента. Донорские Т-лимфоциты атакуют чужеродные для них клетки и ткани нового «хозяина». Чаще всего мишенями атаки являются кожа, слизистые оболочки, печень и кишечник реципиента.
Трансплантация костного мозга сопряжена с большим риском, и поэтому этот метод применяется только тогда, когда другие варианты лечения невозможны. ТКМ не дает стопроцентной гарантии, что болезнь не вернется. Но она дает шанс на жизнь.
Виды трансплантации костного мозга
После проведения химиотерапии костный мозг необратимо повреждается. Поэтому до лечения у пациента забирают часть клеток костного мозга, а после — возвращают.
Пациенту переливают клетки максимально совместимого донора. Прежде всего проверку на совместимость проходят родные пациента — брат или сестра. Родители, как правило, совместимы с ребенком на 50 %. Если родные не совместимы с пациентом, то донора ищут в регистрах доноров костного мозга.
Как проходит трансплантация
Существует три источника гемопоэтических стволовых клеток для трансплантации.
Забор клеток из костного мозга проходит под общей анестезией путем пункции (прокалывания. — Прим. ред. ) тазовых костей. Процедура занимает меньше часа, и уже вечером или на следующий день донор может покинуть больницу.
Такой забор выглядит почти как обычная сдача крови. Донор сидит несколько часов в кресле, и из одной его руки кровь забирают, пропускают через специальный аппарат, отделяющий стволовые клетки, и возвращают обратно в вену другой руки. За несколько дней до процедуры донору делают уколы — вводят специальные препараты, которые выгоняют гемопоэтические стволовые клетки из костного мозга в кровь.
Этот источник используется редко, хотя банки пуповинной крови существуют по всему миру, в том числе и в России.
Донор сам решает как ему сдать стволовые клетки — из костного мозга или периферической крови. Но врач всегда дает рекомендацию, что лучше подходит для пациента.
Интрамедуллярный доступ. Переливания в костный мозг
Периферический венозный доступ
Показания:
1. Длительная инфузионная терапия.
2. Частые внутривенные вливания.
3. Экстракорпоральная терапия.
4. Повышенный риск катетеризации центральных вен.
5. Необходимость проведения наркоза.
Противопоказания. Любое патологическое состояние периферической вены: флебиты, тромбофлебиты, инфицирование места пункции.
Катетеризация через локтевую ямку. Минимальная длина катетера — 600 мм. После пункции в вену вводят на 2—4 см катетер и распускают жгут.
Катетеризация через подмышечную вену. Минимальная длина катетера — 600 мм. Частота успешных катетеризации — 90 %. После пункции вводят катетер, положение которого определяют рентгенографически. Из осложнений иногда отмечается преходящая боль.
Видео техника постановки периферического венозного катетера
Центральный венозный доступ
Показания:
1. Длительная инфузионная терапия.
2. Измерение центрального венозного давления. Преимущества
Основное достоинство — быстрое разведение раствора кровью и предотвращение раздражения стенки вены благодаря быстрому кровотоку. Возможность введения больших объемов ин-фузионных растворов. Кроме того, необходимо отметить малую вероятность выпадения катетера из вены (тщательная фиксация катетера у места вкола препятствует его слишком далекому продвижению, исключая опасность перфорирования стенки правого предсердия и возникновения летального гемоперикарда).
Центральный венозный катетер вводят через подключичную, подмышечную или яремную вены. Для контроля положения катетера и исключения пневмоторакса проводят рентгенографию.
Признаки правильного нахождения катетера в центральной вене: по катетеру должна поступать кровь, при соединении катетера с манометром уровень давления колеблется соответственно с дыхательными движениями, данные рентгенографии (если кончик катетера перфорировал стенку сосуда и находится вне его, вокруг него будет видно облачко контрастного вещества).
Катетеризация через подключичную вену. Минимальная длина катетера — 200 мм. После успешного выполнения пункции через иглу по направлению к сердцу вводят J-образный проводник. Он не должен встречать сопротивления. Если это происходит, проводник извлекают и проверяют нахождение иглы, создавая разрежение в шприце: при интенсивной струе крови повторяют введение проводника. После продвижения проводника производят извлечение иглы, расширяют пункционное отверстие скальпелем, вводят расширитель по проводнику на 3—4 см. Затем расширитель извлекают и вводят центральный венозный катетер по проводнику (при правостороннем доступе на длину 150 мм, при левостороннем — на 180 мм). Удаляют проводник, фиксируют катетер шелковыми швами к коже и начинают инфузию. Помимо общих осложнений венепункции и катетеризации, может наблюдаться осложнение в виде неправильного нахождения катетера:
• в правом предсердии или правом желудочке. При таком положении могут возникать нарушения ритма сердечных сокращений. Это связано с раздражением стенок правых отделов сердца катетером. В данном случае подтягивают катетер, пока он не попадет в верхнюю полую вену. При этом нарушения сердечного ритма проходят;
• в яремной или грудной вене. Необходимо повторное введение проводника в катетер, удаление катетера, а по проводнику вводят длинный внутривенный катетер. После подтверждения нахождения его в вене проводник можно ввести в верхнюю полую вену, изменив положение пациента — подтягивание руки в каудальном направлении и поворачивание головы и шеи в сторону катетеризации.
Катетеризация внутренней яремной вены. После успешной венепункции через иглу вводят J-образный проводник (метод Сельдингера), затем извлекают иглу, расширяют пункционное отверстие и вводят по проводнику центральный венозный катетер (справа на длину 90 мм, слева — на 120 мм). Затем извлекают проводник. После подтверждения правильности нахождения катетера (аспирацией крови) начинают инфузию. Фиксируют катетер шелковыми швами к коже, накладывают стерильную повязку. Осложнения могут наблюдаться те же, что и в предыдущем варианте (неправильное положение катетера и нарушение сердечного ритма). Иногда отмечается синдром Горнера — птоз, миоз и энофтальм вследствие раздражения каротидного клубочка, при повреждении иглой или гематомой шейной части симпатического ствола, расположенного позади сонной артерии, но вне сонного влагалища. Обычно это состояние самостоятельно проходит и не требует специальной терапии. К факторам, затрудняющим катетеризацию внутренней яремной вены, относятся ожирение, короткая толстая шея у пациента, гиповолемия.
Целесообразность проведения этого метода — в тесной анатомической связи между воронкообразными синусами костного мозга и региональными сосудами.
Для внутрикостного переливания крови используются кости с достаточным количеством губчатого вещества (грудина, эпифизы трубчатых костей, пяточные кости, крылья подвздошных костей).
Интрамедуллярно можно переливать кровь, кровезаменители и другие препараты.
Применение. Наиболее широко используется в педиатрической практике (что обусловлено мягкостью эпифизарных участков кости), когда другие способы оказались безуспешными, а время не позволяет произвести венесекцию, при затруднении применения обычных способов трансфузии. У детей до 3 лет не проводится трансфузия в пяточную кость в связи с недостаточной ее васкуляризацией и слабым оттоком крови из нее.
Преимущества. Прочная фиксация иглы в кости позволяет длительно вводить необходимое количество жидкости, не опасаясь осложнений в виде флебитов и тромбофлебитов, эмболий, особенно при необходимости транспортировки беспокойных больных с системой для трансфузий.
Техника внутрикостного переливания достаточно проста, необходимы лишь специальные иглы для внутрикостной пункции.
Есть 2 способа внутрикостного введения — струйный и капельный. При капельном скорость введения составляет 5—20 капель в минуту. На переливание 200—300 мл крови нужно 12 ч, поэтому данный способ интрамедуллярного вливания не получил широкого распространения. При струйном способе трансфузия проводится под давлением, скорость введения — 20—25 мл/мин, однако при струйных внутрикостных трансфузиях наблюдается болезненность, вызванная давлением на губчатую субстанцию. Болевой синдром менее выражен при трансфузии в плоские кости (крылья подвздошной кости и грудину).
Осложнения. Редко при пункции грудины возможно проникновение иглы в загрудинное пространство с возможным повреждением внугренних органов. Во избежание этого необходимо применять иглы с оградительной муфтой, установленной на определенном уровне (у взрослых — 1—1,2 см, у детей — 0,4—0,6 см). Безопаснее вливания в подвздошные и большеберцовые (передняя внутренняя плоская поверхность, на 1 см ниже бугристости) кости.
Ход пункции. При пункции костного мозга трубчатых костей предпочтение отдается большой берцовой на 2—3 см ниже ее бугристости. Нижняя треть данной кости также может быть использована. Под местной анестезией под углом 60—90 ° вводят иглу срезом вверх и прокалывают мягкие ткани. Затем иглу наклоняют к периферии и вращательным движением в сочетании с быстрым надавливанием вводят в компактный слой кости. Признак проникновения иглы в губчатое вещество — уменьшение сопротивления. Вводят новокаин, затем начинают трансфузию.
Аспирация костного мозга подтверждает правильность положения иглы. Другим признаком правильного положения иглы является устойчивое вертикальное положение иглы в кости и свободная инфузия 5—10 мл жидкости. После проникновения иглы в костный мозг производят ее фиксацию.
Для доступа к костному мозгу грудины применяют стернальную иглу—иглу Кассирского. Место прокола обезболивают 2 %-ным раствором новокаина (послойно: от кожи методом лимонной корки до надкостницы). После прокола кортикального слоя активным сверлящим движением игла должна неподвижно стоять в кости. При этом можно производить несколько проколов в разных местах для ускорения переливания (через 2—3 иглы). Извлекают мандрен, насаживают шприц с 1 %-ным раствором новокаина и вводят 5—10 мл внутрикостно. После этого вместо шприца к игле присоединяют приготовленную систему и приступают к гемотрансфузии. Осложнения
1. Инфильтрация. В этом случае извлекают иглу и вводят в новом месте.
2. Воспаление мягких тканей. Удаляют иглу и проводят лечение антибиотиками.
3. Остеомиелит. Назначают необходимые медикаменты.
4. Компартмент-синдром — введение жидкости в фасциальное влагалище. При этом осложнении производят фасциотомию.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Артериальный доступ. Пункция артерий
Как и при венозном доступе, доступ через артериальное русло применяется с различными целями:
• для внутриартериального переливания крови;
• при катетеризации артерий.
Для внутриартериальной инфузии используют сосуды, наиболее близкие к сердцу. Внутриартериальное переливание крови технически сложнее, чем внутривенное. Кроме того, возможны осложнения в виде повреждения и тромбирования артериальных стволов. В связи с этим в настоящее время данный метод практически не применяется.
Показания:
• клиническая смерть вследствие массивной невосполненной кровопотери;
• терминальное состояние при шоках любой этиологии (АД составляет 60 мм рт. ст. и ниже);
• нет доступа к венам.
Преимущества. Данный доступ позволяет переливать достаточное количество трансфузионной среды в сосудистое русло в максимально сжатые сроки. Непосредственное снабжение кровью сосудов головного мозга и коронарных сосудов. Рефлекторная стимуляция сердечной деятельности. Кроме того, необходимо отметить, что диаметр игл при артериальном доступе значительно меньше, чем при венозном.
Пункция артерий
Необходимость в данной манипуляции возникает при:
• получении проб артериальной крови;
• прямой регистрации артериального давления;
• введении контрастных веществ в случаях проведения определенных методов обследования.
Наиболее часто используется пункция лучевой и бедренной артерий.
Пункция лучевой артерии
Применяется чаще всего, так как в этом случае даже при нарушении кровообращения в лучевой артерии обычно не изменяется кровоснабжение кисти. Перед пункцией надо убедиться в нормальном функционировании локтевой артерии и ее анастомозов с ладонной дугой — тест Аллена на адекватность коллатерального кровообращения: пережимают локтевую и лучевую артерии пальцами так, чтобы кровь по венам оттекла от кисти и она побледнела. Больного просят несколько раз сжать и разжать ладонь. При этом ладонь приобретает мертвенно-бледный оттенок. Освобождают локтевую артерию, и при достаточном коллатеральном кровообращении, несмотря на пережатую лучевую артерию, нормальный цвет кожи восстанавливается через 5—10 с. Если же окраска руки не вернется за это время к исходной, тест Аллена считается отрицательным, что указывает на окклюзию лучевой артерии.
Анатомия. Лучевая и локтевая артерии являются ветвями плечевой артерии и снабжают кровью кисть через поверхностную и глубокую ладонную дугу. Лучевая артерия расположена вдоль латерального края предплечья, пальпируется на запястье у дистального конца лучевой кости. Здесь она покрыта лишь фасцией и кожей.
Ход пункции. Кисть разгибают в лучезапястном суставе, укладывают на валик, определяют пульсацию артерий. Кожу и подкожную клетчатку инфильтрируют раствором анестетика, так как пункция артерий является болезненной для пациента процедурой. Анестезия устраняет также артериальный спазм. Сосуд фиксируют между указательным и средним пальцами, иглу вводят в проксимальном направлении под углом 45° к горизонтальной плоскости. При медленном приближении к артерии возникает ощущение передаточной пульсации. Иглу продвигают до появления крови. Более опытный врач может пунктировать артерию под прямым углом, что снижает до минимума травму артерии. На нахождение иглы в артерии указывает поступление в шприц алой пульсирующей крови.
Пункция бедренной артерии
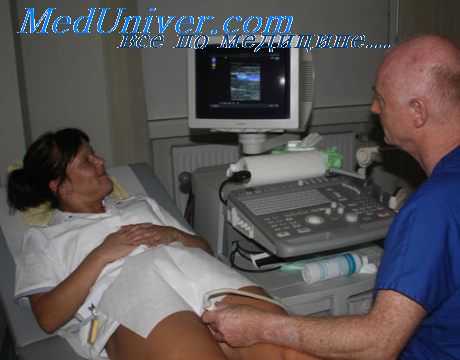
Анатомия. Бедренная артерия является продолжением ствола наружной подвздошной артерии. Артерия пересекает середину линии, проведенной от передней верхней ости подвздошной кости к лонному сочленению. Медиальнее артерии лежит бедренная вена, оба сосуда проходят вместе в скарповском треугольнике.
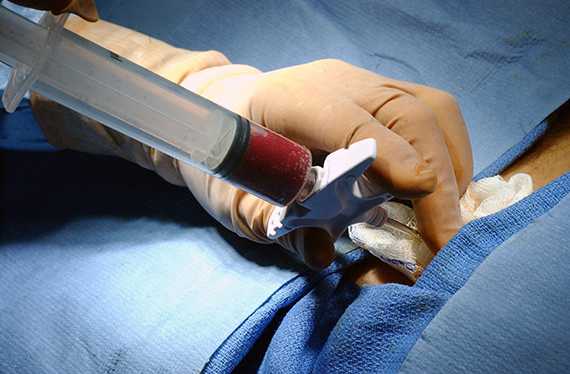
Ход пункции. Бедренная вена пунктируется у пупартовой связки (паховой). Используют крупную иглу диаметром 1,2 мм.
Для удобства манипуляции иглу насаживают на шприц. Средним и указательным пальцами левой руки прощупывают пульсацию стенки сосуда. Иглу вводят между пальцами срезом вниз во избежание прокола противоположной стенки и направляют под небольшим углом к коже. Как только игла проникает в просвет артерии, кровь под сильным давлением поступает в шприц. После этого шприц отсоединяют и приступают к дальнейшим необходимым мероприятиям (трансфузия, катетеризация).
Учебное видео анатомии бедренной артерии и ее ветвей
Как устроено донорство костного мозга: мифы, страхи, побочные эффекты
Это кроветворная ткань, которая находится в крупных костях человека. В костном мозге есть гемопоэтические (кроветворные) стволовые клетки (ГСК), когда они делятся и созревают — образуются все виды клеток крови: эритроциты, лейкоциты, тромбоциты. ГСК — отправная точка для процесса кроветворения в организме. Процесс их деления практически ничем не ограничен: из небольшого числа ГСК может появиться множество «дочерних» клеток, они будут делиться дальше, созревать, а из них образовываться другие клетки крови.
Из-за такой способности ГСК к делению, они чувствительны к цитостатической химиотерапии и облучению. Поэтому процесс кроветворения может нарушиться во время лечения онкологических заболеваний (у людей, проходящих высокодозную химиотерапию, как правило, этот процесс останавливается). Если ввести такому пациенту подходящие ГСК, они смогут заселить костный мозг пациента своими «дочерними» клетками и восстановить кроветворение. Соответственно, цель врачей — собрать достаточное количество ГСК у здорового человека (донора) и пересадить их больному (реципиенту).
А как его достают? Большим шприцем из позвоночника?
Костный мозг — не спинной, поэтому никто не будет выкачивать у доноров стволовых клеток жидкость из позвоночника. Собрать клетки можно двумя способами. Первый и самый распространенный — взять их из крови. В таком случае донору предварительно на протяжении нескольких дней вводят подкожно препарат — стволовые факторы роста, что стимулирует выход ГСК из костного мозга в кровь.
Сам забор клеток из крови очень похож на обычное донорство компонентов крови, например, тромбоцитов. Человека сажают в кресло, из вены берут кровь, она фильтруется в аппарате. Дальше машина забирает себе стволовые клетки, а все остальное возвращает обратно донору. Процесс длится несколько часов.
Во втором случае берут не кровь, а сам костный мозг. Для этого донору делают общую анестезию, шприцем прокалывают тазовую кость и берут литр смеси костного мозга и крови (это не более 5 % всего костного мозга). После из взятой смеси выделяют стволовые клетки. Операция длится примерно полчаса, а донор в этом случае около двух дней проводит в стационаре. После процедуры могут быть болезненные ощущения, которые снимаются обезболивающими.
Второй вариант используется существенно реже, когда врачам не удается собрать периферические, то есть циркулирующие в крови, ГСК. Поскольку он сложнее, соглашаются на него в основном родственники нуждающегося в трансплантации. Впрочем, донор сам может выбрать способ забора клеток.
По данным американской компании Be The Match, которая курирует самый большой регистр (банк) доноров костного мозга в мире, хирургическое вмешательство для забора стволовых клеток требуется в 23 % случаев. По другим цифрам — американского Института юстиции — хирургическая процедура делается в 30 %, а в 70 % — стволовые клетки забирают через кровь.
Любой ли костный мозг подойдет больному или он чем-то отличается?
Нет, костный мозг у каждого свой. Найти себе донора с подходящими стволовыми клетками сложнее, чем с кровью. Иногда среди родственников пациента может оказаться потенциальный донор костного мозга, но так бывает только в 50 % случаев. Если среди родных нет никого подходящего, нужно искать человека с таким же HLA-генотипом (это цифровой показатель генов, он отвечает за тканевую совместимость).
Найти донора можно через регистры (банки) доноров костного мозга. В них содержатся данные людей, прошедших фенотипирование — исследование клеток и генотипа — и согласившихся стать донорами ГСК.
А как выглядят банки костного мозга?
Это не огромные больницы с генетическими материалами, а электронные базы, компьютерная сеть, в которой хранится информация о генотипе потенциальных доноров и больных. Система определяет, насколько совместимы донор и реципиент.
Совместимость у всех разная. У каждой клетки человека есть свой набор рецепторов — главный комплекс гистосовместимости. Рецепторы находятся на поверхности клетки, и по ним можно определить информацию о белках, которые находятся внутри. Так клетки собственной иммунной системы могут вовремя определять нарушения среды внутри клетки и устранять их или сигнализировать о них. До какого-то момента иммунная система способна таким образом распознавать наличие опухоли.
по теме

Лечение
Зафиксирован второй случай излечения от ВИЧ. На самом деле он третий
Для трансплантации необязательна совместимость групп и резус-факторов крови, важнее именно генетическая совместимость. Среди идеально подходящего неродственного донора и родственного донора, совпадающего не по всем пунктам, врачи выберут, скорее всего, последнего, потому что с ним ниже вероятность отказа от донации.
Порой больному подходят сразу 50-70 доноров, но бывает, что «генетический близнец» в регистре вовсе не находится. В последнем случае можно попробовать организовать донорские акции, чтобы больше людей прошли типирование, но в любом случае, если подходящего донора нет в банке, помочь пациенту не получится. Каждый год не менее трех тысяч людей умирают, потому что не смогли найти себе подходящего донора.
Пациент и донор с одним и тем же этническим происхождением вероятнее подойдут друг другу. Чем больше людей проходит типирование, тем больше в регистрах разных генетических данных, а значит, выше вероятность совместимости пациента и донора.
По данным американской компании Be The Match, больше всего проблем с поиском донора костного мозга у темнокожих людей, индейцев, уроженцев Аляски, азиатов, коренных гавайцев и других жителей островов Тихого океана, латиноамериканцев и метисов. Американский Институт юстиции сообщает, что афроамериканцы, у которых нет родственного донора, находят себе подходящего только в 25 % случаев, при этом, если донора нашли, в 80 % случаев это единственный вариант в реестре. Для азиатов этот показатель равен 40 %, для латиноамериканцев — 45 %, для европейцев — 75 %. Конкретный процент для метисов в статистике не приводится, но институт уточняет, что для них ситуация гораздо хуже.
Зачем нужны доноры костного мозга?
Еще один большой реестр доноров костного мозга в нашей стране находится в ведении «Русфонда» — Национальный регистр доноров костного мозга имени Васи Перевощикова. Он существует с 2013 года и объединяет 12 региональных российских регистров и один казахский. На 31 октября 2019 года в нем состояли 29 178 доноров костного мозга.
Семочкин приводит пример, что зачастую кавказцы не могут найти своего «генетического двойника» в европейской базе. Но у них больше детей в семье, поэтому выше вероятность найти родственного донора. Огромная проблема с поиском доноров и у малочисленных этносов, например, жителей Крайнего Севера. Как правило, найти донора им не удается.
Единственное решение проблемы — вступление в национальный регистр как можно большего количества людей разных национальностей. Как объясняет Семочкин, затраты на трансплантацию клеток и все остальные процедуры российского пациента с российским же донором не превышают 160 000 рублей. В то же время процедуры и трансплантация с донором из европейского банка требуют порядка 20 000 евро. Государство не может выделить такие деньги, у пациентов их тоже, как правило, нет — финансирование ложится на благотворительные фонды.
Как стать донором?
В России стать донором может любой здоровый гражданин РФ без хронических заболеваний в возрасте от 18 до 45 лет, в некоторых случаях — до 50 лет. Возраст имеет значение: чем моложе донор, тем выше концентрация клеток в трансплантате и их «качество».
Студентка магистратуры МГИМО Ирина стала донором костного мозга в конце октября этого года. До этого она с 18 лет регулярно сдавала кровь и тромбоциты в донорских организациях. Три года назад она прочитала колонку Валерия Панюшкина «Встреча» о том, как познакомились донор и реципиент, и окончательно решила сдать костный мозг.
Первый шаг — сдача крови на типирование. Это можно сделать в любой из крупных частных медицинских лабораторий или в лабораториях некоторых медицинских центров или регистров. Посмотреть полный список центров, позволяющих попасть в банк «Русфонда», можно здесь.
Ирина выбрала Национальный медицинский исследовательский центр гематологии. Там она сдала около 10 миллилитров крови на типирование и подписала соглашение о вступлении в регистр. Оно ни к чему не обязывает донора — можно отказаться в любой момент. Но это важно для реципиента — за 10 дней до пересадки стволовых клеток проводится высокодозная химиотерапия, которая полностью уничтожает кроветворную и иммунную системы. Поэтому отказ в последнюю минуту может быть губителен для того, кто ждет трансплантации.

«В поисках исцеления». Что нового было на конференции CROI-2019?
«Я тогда почувствовала большую ответственность. Стояла на перекрестке и думала: а вдруг меня сейчас собьет машина, и я не смогу сдать. Меня это не то чтобы особо напрягало, но я стала отвечать на все звонки с незнакомых номеров, мало ли», — вспоминает она.
Через два года Ирине в мессенджер с неизвестного номера написали, что она подошла пациенту (из России), позвали на расширенное типирование, а также сдать анализы на ВИЧ и гепатит. Результаты анализов она ждала еще пять дней, параллельно врачи обследовали остальных подходящих доноров. Ответ прислали также в мессенджере: совместимость Ирины с пациентом 9 из 10, а у другого донора 10 из 10, врачи выбрали его.
Спустя полгода ей снова позвонили, оказалось, что пересадка так и не состоялась, а донор все еще был нужен. Она приехала в центр гематологии, поговорила с врачом, сдала кровь на биохимию, ВИЧ, сифилис, сделала флюорографию и ЭКГ. Через несколько дней позвали на уколы. Количество уколов зависит от веса донора, в среднем, делают 1-2 укола в день на протяжении трех дней. Ирине назначили дважды в день. Родителям она не стала говорить про свое донорство — не поняли бы. Поэтому приходилось прятать шприцы с лекарством в упаковках от зубной пасты в холодильнике.
По словам девушки, побочные эффекты были незначительные: на второй день появилась небольшая ломота в костях, «будто провела ночь в неудобной кровати», на третий — ощущение «тяжелой головы». Все это время врачи были на связи. Медицинские организации одинаково заботятся и о доноре, и о реципиенте: с момента прохождения необходимых для сдачи процедур донор формально числится как пациент при госпитализации, даже если не лежит в больнице, а сидит дома, как Ирина.
Можно ли донору знакомиться с реципиентом?
Да, но через два года и только если обе стороны согласны. За два года станет понятно, смог ли костный мозг донора прижиться у реципиента. В некоторых европейских странах и США этот срок составляет один год. А в Испании донорам и реципиентам запрещено видеться на протяжении всей жизни. Анонимность обеспечивает безопасность. Если они познакомятся сразу после донации, а через месяц костный мозг не приживется, то родственники больного могут «отомстить» донору, обвинить его в чем-то, в чем он не виноват. Анонимность позволяет избежать этого. С другой стороны такая мера позволяет избегать шантажирования родственников реципиента и вымогательства у них денег.
Донорство костного мозга проводится безвозмездно, можно узнать лишь пол и возраст больного, а также передать что-то анонимное в знак поддержки. Ирина передала открытку, на которой изображены руки, держащие кофейную чашку, на фоне гор. «Я там написала: поправляйся, я в тебя верю. Никакую информацию о себе нельзя указывать, мне даже сказали писать в настоящем времени, чтобы не было окончаний прошедшего времени, по которым можно определить род», — рассказывает Ирина.
Потенциальную встречу с реципиентом девушка не представляет. По количеству взятых у нее стволовых клеток и предполагаемой массе тела, она считает, что ее реципиент — мужчина средних лет. «Я не хочу, чтобы он чувствовал себя обязанным, да и о чем мы будем разговаривать? Я бы хотела, чтобы эта встреча произошла на каком-то мероприятии, в медицинском центре, например. Так мне было бы легче».
Трудно ли восстановиться после донорства костного мозга?
Пообщаться с корреспондентом Ирина смогла уже через пару дней после донации: «Мне важно, чтобы мои друзья и другие люди видели, что я сдала костный мозг и со мной все нормально. Я не лежу после этого в реанимации».
Донор отдает малую часть своего костного мозга — 5 % стволовых клеток здорового человека достаточно для восстановления кроветворения у больного. Потеря части стволовых клеток никак не ощущается, а их объем полностью восстанавливается в течение семи-десяти дней. Оставшиеся в крови донора ГСК самостоятельно обратно всасываются в костный мозг. Повторное донорство возможно уже через три месяца после забора клеток, то есть сдать костный мозг можно несколько раз за жизнь.
На каком уровне находится трансплантация стволовых клеток в России?
По словам Сергея Семочкина, сама российская система пересадки костного мозга очень хорошая, но проблема в нехватке учреждений, делающих трансплантацию, в России их — единицы. Недостаточно учреждений, квалифицированных сотрудников, нет государственного финансирования. После трансплантации реципиент должен еще несколько лет — минимум два года — получать терапию на подавление иммунных реакций. Например, если пациент из региона, а костный мозг ему пересаживали в Санкт-Петербурге, то дальнейшее ведение пациента должно проходить в его регионе. Но это сложно, объясняет Семочкин, врачей в регионах к этому не готовят, они не понимают, что делать. В итоге люди вынуждены постоянно обращаться в федеральный центр, а это тормозит трансплантацию следующих пациентов.
Читайте также:
