Капацитация сперматозоидов. Гиперактивация и акросомальная реакция
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Воспалительные заболевания желез мочеполового тракта, и прежде всего хронический простатит, относятся к наиболее частым причинам бесплодия у мужчин. Тщательное выявление и успешное лечение данного патологического процесса – это путь к восстановлению утраченной способности к зачатию. В обзоре рассматриваются вопросы влияния воспалительного процесса, антибактериальной терапии и их последствий на сперматогенез. Для устранения негативных эффектов лечения, а также для ускорения восстановления показателей спермограммы предложено использовать комбинированную терапию антиоксидантными препаратами.
- КЛЮЧЕВЫЕ СЛОВА: мочеполовой тракт, сперматогенез, АндроДоз
Воспалительные заболевания желез мочеполового тракта, и прежде всего хронический простатит, относятся к наиболее частым причинам бесплодия у мужчин. Тщательное выявление и успешное лечение данного патологического процесса – это путь к восстановлению утраченной способности к зачатию. В обзоре рассматриваются вопросы влияния воспалительного процесса, антибактериальной терапии и их последствий на сперматогенез. Для устранения негативных эффектов лечения, а также для ускорения восстановления показателей спермограммы предложено использовать комбинированную терапию антиоксидантными препаратами.
Инфекционно-воспалительные заболевания предстательной железы (простатит) – это одна из причин мужского бесплодия. При этом более чем у 65% пациентов отмечается ухудшение параметров спермы, связанное с клиническими симптомами хронического простатита. Инфекционно-воспалительная интоксикация прежде всего вызывает изменения биологической активности эякулята – снижение жизнеспособности и подвижности сперматозоидов, а также их морфологической структуры [1, 2].
Воспалительные заболевания половых органов и урогенитальные инфекции отрицательно влияют на мужскую фертильность. Во-первых, воспалительные заболевания предстательной железы и семенных пузырьков изменяют физические свойства семенной плазмы. Предстательная железа продуцирует около 30% семенной жидкости, обеспечивающей жизнеспособность сперматозоидов, их транспорт и оплодотворяющую способность. В этой связи можно предположить, что изменения секреторной активности железы могут нарушить способность сперматозоидов к оплодотворению.
Во-вторых, воспалительный процесс запускает аутоиммунные механизмы антиспермального иммунитета, который воздействует на сперматозоиды, вызывая различные морфофункциональные их изменения, а также ухудшает связь сперматозоидов с яйцеклеткой. Последнее в свою очередь негативно влияет на последующие стадии развития плодного яйца.
В-третьих, лейкоцитоспермия, вызванная воспалением, повышает скорость перекисного окисления липидов. В нетяжелых случаях это приводит к преждевременной капацитации и акросомальной реакции сперматозоидов, а в серьезных случаях – к прямому повреждению сперматозоидов с развитием некроспермии (отсутствие жизнеспособности сперматозоидов).
Лейкоцитоспермия – это наиболее частое проявление простатита, которое вызывает уменьшение количества и снижение подвижности сперматозоидов в эякуляте. Кроме того, продолжительность заболевания и морфологические дефекты сперматозоидов взаимосвязаны.
В норме количество лейкоцитов в эякуляте не должно превышать 1,0 × 10 6 /л. Среди мужчин, состоящих в бесплодном браке, лейкоцитоспермия, то есть повышенное число лейкоцитов в эякуляте, обнаруживается в 10–20% случаев. Повышенное количество лейкоцитов является важным показателем воспалительных заболеваний половых органов. Однако четкая закономерность между присутствием лейкоцитов и выраженностью симптомов или степенью изменений в предстательной железе прослеживается не всегда. Тем не менее количество лейкоцитов в семенной плазме у бесплодных пациентов выше, чем у фертильных мужчин. Лейкоцитоспермия также служит неблагоприятным прогностическим фактором при экстракорпоральном оплодотворении.
Исследования последних лет позволили уточнить характер воздействия лейкоцитоспермии на функции сперматозоидов. Одной из основных причин, приводящих к нарушению мужской репродуктивной функции, считают избыточную продукцию активных форм кислорода [3]. Активные формы кислорода – это окислители с высокой реакционной способностью, принадлежащие к классу свободных радикалов. Ввиду своей неустойчивости окислители реагируют со многими биохимическими веществами, такими как липиды, аминокислоты, углеводы, белки и ДНК. Несмотря на то что наличие свободных радикалов в сперматозоидах обнаружили еще в 1943 г. [4], их роль в мужской репродуктивной физиологии была описана только в 1989 г. [5], и в настоящее время исследования в этой области продолжаются.
Роль активных форм кислорода во время вторжения, адгезии и размножения микроорганизмов в мужском генитальном тракте в значительной степени не установлена. Известно, что нормальная функция сперматозоидов (капацитация, гиперактивация, акросомальная реакция, а также слияние и оплодотворение с ооцитами) возможна только при низком уровне свободных радикалов [6, 7]. Избыток лейкоцитов, приводящий к росту активных форм кислорода, запускает капацитацию и акросомальную реакцию в более ранние сроки, что приводит к нарушению их оплодотворяющей способности [8]. Другими словами, высокий уровень активных форм кислорода вызывает каскад патологических состояний, которые отрицательно влияют на функцию сперматозоидов [9]. От 40 до 80% пациентов с бесплодием имеют высокий уровень активных форм кислорода [10].
Следует отметить, что выявление повышенного уровня активных форм кислорода, генерируемых лейкоцитами при воспалении, вызванном простатитом, играет важную роль при подготовке к искусственному оплодотворению.
Появляется все больше доказательств того, что сперматозоиды защищены от пагубных эффектов активных форм кислорода мощными антиоксидантами, содержащимися в семенной плазме. Защитные способности семенной плазмы имеют значительные индивидуальные колебания. В том случае, когда производство активных форм кислорода превышает возможности системы антиоксидантной защиты по их нейтрализации, возникает окислительный стресс.
Окислительный стресс существенно ухудшает сперматогенез, что может привести к мужскому бесплодию [11, 12], а также считается одной из причин нарушения денатурации ДНК в одноцепочечной ДНК и двунитевых разрывов ДНК [13].
В семенной плазме бесплодных мужчин уровень антиоксидантов значительно ниже, чем у фертильных мужчин. При бесплодии, связанном с повышенным уровнем кислородных радикалов в сперме, терапевтический эффект может оказать прием антиоксидантов, снижающих уровень активных форм кислорода. Поэтому тщательное выявление и успешное лечение даже бессимптомно протекающих хронических простатитов – это путь к восстановлению утраченной способности к зачатию.
В стандартной терапии простатита чаще всего применяются антибактериальные препараты, которые с различной эффективностью устраняют бактериоспермию и лейкоцитоспермию. Однако и сам воспалительный процесс, и антибиотикотерапия могут влиять на сперматогенез и другие параметры спермы. В литературе описаны различные исследования, которые демонстрируют негативное влияние антибиотиков как на сперматогенез, так и на фертильность мужчин в целом [1]. Так, было описано токсичное воздействие антибиотиков группы фторхинолонов на сперматозоиды.
В исследовании, в котором оценивалось влияние приема некоторых фторхинолонов на мужскую фертильность, было продемонстрировано ухудшение показателей спермы. Это проявлялось снижением количества эякулята, подвижности и концентрации сперматозоидов, значительно сократилась выработка лактатдегидрогеназы тканью яичка. Данные эффекты были дозозависимы [14].
В другом исследовании токсическое воздействие на репродуктивную систему оказывал ципрофлоксацин, снижая концентрацию сперматозоидов, их подвижность и жизнеспособность. Ципрофлоксацин вызывал существенное уменьшение числа сперматогенных клеток (сперматогоний, сперматоцитов, сперматид и сперматозоидов) в семенных канальцах [15].
Использование энрофлоксацина имело негативные последствия для репродуктивной системы, что было продемонстрировано в эксперименте на мышах-самцах. Этот препарат снижал подвижность эпидидимальных сперматозоидов. Кроме того, на фоне приема энрофлоксацина было увеличено количество аномальных сперматозоидов. Иными словами, препарат нарушал сперматогенез, вызывая снижение подвижности сперматозоидов и морфологические аномалии [16].
Было проведено исследование влияния ципрофлоксацина на ткань яичка самцов морской свинки. Авторы выявили уменьшение веса яичек и концентрации сперматозоидов в эякуляте, а также снижение уровня тестостерона, зависящие от продолжительности приема и используемых дозировок ципрофлоксацина [17].
В другом исследовании оценивались последствия приема гентамицина и офлоксацина для ткани яичка. И гентамицин, и офлоксацин значительно снижали массу яичка, придатка яичка и семенных пузырьков. Согласно результатам эксперимента, аминогликозиды (гентамицин, неомицин, стрептомицин) и фторхинолоны (офлоксацин) неблагоприятно воздействовали на параметры спермы и мужской репродуктивной системы. Только ципрофлоксацин не оказывал какого-либо значительного влияния на подвижность сперматозоидов [18]. Экспериментальные исследования показали, что ципрофлоксацин даже в высоких дозах способен купировать бактериальные инфекции с минимальным токсическим воздействием на функциональное состояние сперматозоидов.
Приведенные результаты исследований демонстрируют токсическое воздействие антибиотиков на мужскую репродуктивную систему. Однако, несмотря на негативное влияние антибактериальной терапии на показатели спермограммы, выраженное в той или иной степени, иных подходов к терапии инфекционно-воспалительных заболеваний урогенитального тракта в настоящее время нет.
Таким образом, при наличии инфекционно-воспалительных заболеваний урогенитального тракта неблагоприятное воздействие на мужскую репродуктивную систему оказывают, с одной стороны, инфекционно-воспалительный процесс, вызывающий окислительный стресс, проявляющийся повреждением структуры сперматозоидов, с другой – антибактериальная терапия, также сопровождающаяся снижением репродуктивного потенциала пациентов.
В настоящее время имеется достаточное количество работ, посвященных роли антиоксидантов в восстановлении мужской фертильности. Известно, что различные антиоксиданты являются некой системой обороны, которая включает ферментативные и неферментативные механизмы защиты. Роль антиоксидантов семенной плазмы – защита от активных форм кислорода, сдерживание их концентрации в нормальном физиологическом диапазоне [19]. Другими словами, антиоксиданты в семенной плазме и сперматозоидах поддерживают устойчивое состояние уровня активных форм кислорода в сперме путем преобразования свободных радикалов в безопасные «нереагирующие» вещества.
Антиоксидантная активность определяется зрелостью сперматозоида, имеющего цитоплазму. Поскольку во всех клетках организма человека, как правило, именно цитоплазма является основным источником антиоксидантов, ее физиологическое минимальное содержание в зрелом сперматозоиде создает предпосылки для дефицита как антиоксидантной защиты, так и эндогенных механизмов восстановления.
Как известно, общая антиоксидантная мощность спермы у пациентов с лейкоцитоспермией и простатитом снижена [20], поэтому дефицит антиоксидантной системы может компенсироваться различными антиоксидантными комплексами [21].
В последнее время L-карнитин и L-ацетил-карнитин, способные защитить клеточную мембрану от свободных радикалов, приобрели большое значение в лечении мужского бесплодия [22, 23]. Карнитин также участвует в энергетическом обеспечении сперматозоидов через бета-окисление длинноцепочечных жирных кислот в митохондриях [24]. Кроме того, он обладает антиапоптотическим эффектом [25].
Качество спермы зависит не только от содержания L-карнитина, но и от поступления в организм витаминов и некоторых аминокислот, например, аргинина (1-амино-4-гуанидино-валериановая кислота) и коэнзима Q10.
Аргинин является важнейшим регулятором сердечно-сосудистой, иммунологических, нейромедиаторных систем и печеночной функции. До 80% аргинина содержится в белках семенной жидкости, а его дефицит может являться причиной патозооспермии.
Коэнзим Q10 (убихинон) по строению близок к витамину К, содержится в большинстве тканей человеческого организма. Кофермент Q10 защищает репродуктивную систему от негативного действия свободных радикалов. Прием коэнзима Q10 позволяет увеличить количество подвижных сперматозоидов.
Вирусные и бактериальные инфекции часто ассоциируются с дефицитом макро- и микроэлементов, в том числе с дефицитом незаменимого микроэлемента селена. Селен необходим для нормального функционирования как адаптивного, так и врожденного иммунитета, способствует пролиферации и дифференциации CD4+ Т-лимфоцитов в сторону Т-хелперов, поддерживая тем самым острый клеточный иммунный ответ [26].
Антиоксидантной и потенциальной антивирусной активностью также обладает витамин Е [27]. Он предотвращает повреждение клеточных стенок, нейтрализуя пероксид водорода и другие активные формы кислорода, а также необходим для роста новых клеток и нормального функционирования иммунной системы. Доказано, что прием витамина Е снижает «тяжесть» окислительного стресса в ткани яичек, повышает подвижность сперматозоидов и положительно влияет на их способность проникать в яйцеклетку. Наблюдается эффект синергизма при одновременном приеме витамина E, ретинола и селена за счет взаимного предотвращения окисления (разрушения) как в кишечнике, так и в тканях. Иначе говоря, при употреблении вместе эти вещества проявляют более выраженную эффективность в более низких дозах.
Цинк – это жизненно важный микроэлемент. Он абсолютно необходим для клеточного дыхания, утилизации кислорода, воспроизведения генетического материала (ДНК и РНК), поддержания целости клеточных стенок и обезвреживания свободных радикалов. В организме человека цинк концентрируется во всех органах и тканях, в том числе в яичках, придатках яичек, в предстательной железе, в достаточно большом количестве содержится в сперме. Он запускает и поддерживает процессы производства мужского полового гормона – тестостерона и активизирует сперматогенез. Цинк активирует глутатионпероксидазу, которая необходима для нормального созревания и подвижности сперматозоидов, а также участвует в регуляции активности других ферментов спермоплазмы, способствует регуляции процессов коагуляции и разжижения эякулята.
Цинк и витамин A биохимически взаимозависимы: витамин А способствует усвоению цинка, а без цинка невозможно усвоение витамина А. Одновременный прием цинка и витамина А актуален при мужском бесплодии и аномалиях сперматогенеза, обусловленных различными факторами, в частности инфекционными заболеваниями. Витамин А (ретинол) – важное звено антиоксидантной системы, поскольку он защищает клеточные мембраны от окисления, влияет на синтез белков и поддерживает репродуктивные функции. Наличие витамина А в семенной жидкости также необходимо для нормального сперматогенеза и поддержания подвижности сперматозоидов.
Перечисленные активные вещества входят в состав комплекса АндроДоз, который производится швейцарской компанией DSM Nutritional Products и отвечает самым высоким стандартам качества. Следует отметить, что в комбинации компоненты комплекса АндроДоз действуют намного сильнее и достигают более выраженного клинического эффекта, чем по отдельности.
Особенно перспективным для предотвращения окислительного стресса и снижения его негативного влияния на сперматогенез является совместное одновременное применение жирорастворимых и водорастворимых антиоксидантов, однако при использовании обычных технологий это представляется трудновыполнимым.
Сочетание жирорастворимых и водорастворимых антиоксидантных компонентов оказалось возможным благодаря использованию нанотехнологии Actielease в производстве жирорастворимых субстанций АндроДоза (коэнзима Q10, витаминов Е и А). Данной технологией достигается микрокапсулирование или разделение активных ингредиентов на микроскопические наночастицы, что в сочетании с особой полисахаридной матрицей обеспечивает водорастворимость и стабильность, оптимальную концентрацию компонентов состава АндроДоза, а также равномерное замедленное высвобождение активных веществ в организме.
Таким образом, пациентам, получающим антибактериальную терапию по поводу инфекционно-воспалительного процесса урогенитального тракта, желающим сохранить или максимально быстро восстановить свою фертильность, рекомендовано использование антиоксидантов в комплексной терапии.
По нашим наблюдениям, антиоксидантные комплексы позволяют устранить дисбаланс активных форм кислорода, восстановив антиоксидантную емкость спермы, что в свою очередь способствует восстановлению моторики и устранению дефектов ДНК сперматозоидов. Включение антиоксидантов в лечение пациентов с инфекционно-воспалительными заболеваниями может предотвратить окислительный стресс и индуцированное повреждение ДНК, вызванное как токсическим действием антибиотиков, так и самим воспалительным процессом.
Рекомендуется проведение дальнейших исследований в этой области для получения достоверной информации о преимуществе комбинированной терапии (антибиотики в сочетании с антиоксидантами) и достижения высокой эффективности лечения бесплодия у мужчин, что особенно актуально для пациентов, прибегающих к экстракорпоральному оплодотворению, когда важна скорость восстановления фертильности.
Акросомная реакция
Бесплодие может быть связано с нарушением различных этапов взаимодействия сперматозоидов с яйцеклеткой: отсутствием нормальной акросомной реакции и неспособностью внедряться в защитную оболочку яйцеклетки (zona pellucida).
Акросомная реакция представляет собой экзоцитоз, т.е. выброс, протеолитических ферментов (акрозин, гиалуронидаза и др.), которые содержатся в специальной органелле сперматозоида – акросоме. Физиологическая акросомная реакции происходит после связывания сперматозоида с zona pellucida.
В результате защитная оболочка в этом участке растворяется и происходит контакт соответствующих рецепторов сперматозоида с лигандами яйцеклетки, затем плазматические мембраны яйцеклетки и сперматозоида сливаются, в цитоплазму яйцеклетки проникают ядро и центриоль сперматозоида, а его мембрана встраивается в мембрану яйцеклетки. Происходит активация яйцеклетки и ее второе редукционное деление. В хроматине сперматозоида начинается обратная замена протаминов на гистоны. Отцовские и материнские хромосомы объединяются, происходит первое деление оплодотворенной яйцеклетки…
Нормальная акросомная реакция и последующий контакт с оолеммой - не только необходимый этап проникновения сперматозоида в яйцеклетку, но и стимул для ее активации и полноценного функционирования.
Акросома начинает формироваться в яичке в процессе спермиогенеза – превращения круглых сперматид в сперматозоиды, - но завершает формирование в придатке яичка (эпидидимис).
В сперме содержатся вещества-ингибиторы, препятствующие преждевременной активации сперматозаидов – «капацитации», - процессе, придающим им способность оплодотворять яйцеклетку. Действие этих факторов устраняется после проникновение сперматозоидов в женский половой тракт. Там же начинается действие стимулирующих факторов женского тракта: прогестерона, лигандов маннозы и др.
Акросомная реакция в норме должна произойти именно при контакте сперматозоида с zona pellucida. Но нередко при этом возникают нарушения.
Можно выделить три типа нарушений акросомной реакции:
преждевременная акросомная реакция до встречи с яйцеклеткой - избыточность спонтанной реакции;
отсутствие выброса акрозина при контакте с zona pellucida - недостаточность индуцированной реакции;
сочетанный тип нарушений – много сперматозоидов теряют акросому до встречи с яйцеклеткой, а оставшиеся не способны к выбросу ферментов при контакте с zona pellucida.
Преждевременная реакция препятствует оплодотворению, потому что утративший необходимые ферменты сперматозоид не сможет преодолеть защитную оболочку; кроме того «отреагировавший» сперматозоид живет очень короткое время. Сперматозоид, в котором вообще не произошла акросомная реакция, также не может оплодотворить, потому что не сможет преодолеть zona pellucida. Первый тип нарушений можно условно назвать «перезрелый» сперматозоид, второй – «недозрелый».
Обычное морфологическое исследование сперматозоидов при выполнении стандартной спермограммы не позволяет обнаружить нарушения акросомной реакции.
Для оценки акросомной реакции используют:
флюоресцентную микроскопию со специальным окрашиванием;
проточную цитометрию с использованием специальных меток;
определение продукции акрозина фракцией подвижных сперматозоидов.
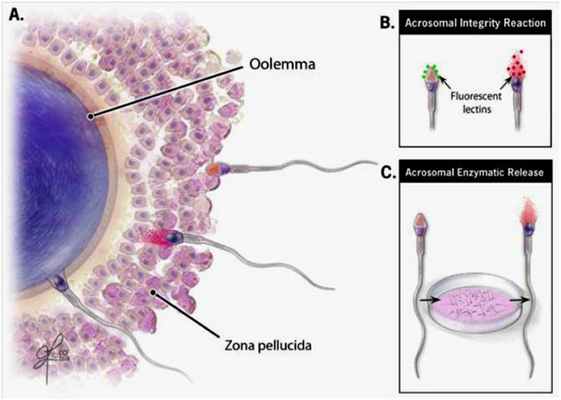
В лабораторных условиях акросомную реакцию следует оценивать после инкубирования фракции подвижных сперматозоидов в специальной среде, вызывающей их капацитацию.
Принято считать, что нормальную акросомную реакцию инициирует повышение уровня внутриклеточного кальция. Индуцирование выброса кальция с помощью ионофора кальция — один из путей протестировать способность капацитированного сперматозоида подвергаться акросомной реакции. Этот принцип лежит в основе анализа, называемого индуцированной акросомной реакцией, или тестом на акросомную реакцию после выброса ионофора (ARIC-test). В лабораторных исследованиях для этого применяют ионофор А23187.
В качестве метки мы применяем рекомендуемые Руководством ВОЗ (2010) флуоресцентные меченые лектины Pisum sativum и Arachis hypogaea (можно также использовать моноклональные антитела против акросомного антигена CD46). Определяем процент сперматозоидов, у которых прошла спонтанная акросомная реакция (АР% спонт.) и тех, у которых акросомная реакция произошла после добавления ионофора А23187 (АР% индуц.). Разница между этими величинами дает долю сперматозоидов, потенциально способных претерпевать акросомную реакции после контакта с зоной – т.е. индуцируемость акросомной реакции (АР% индуцируемость). Это наиболее важный показатель, характеризующий полноценность акросомной реакции. Согласно рекомендациям ВОЗ (2010), эта величина должна быть не менее 15% (по нашим данным статистически «выпадающими» являются значения менее 16% и больше 55%).
Другой применяемый нами метод – энзиматический, - основан на оценке количества акрозина, продуцируемого миллионом подвижных сперматозоидов. Но нашим данным у фертильных мужчин диапазон «невыпадающих» значений для этого показателя составляет 50-250 МЕ/млн.
Нарушения акросомной реакции могут иметь место у пациентов с олиго-, астено- и/или тератозооспермией, но так же при формальной «нормозооспермии». Акросомная реакция часто нарушена у пациентов с АСАТ, у пациентов с уменьшенным эпидидимисом и низким содержанием карнитинов и альфа-гликозидазы в сперме, на фоне оксидативного стресса сперматозоидов (в результате утраты эластичности мембраны вследствие снижения доли ненасыщенных жирных кислот при действии активных радикалов), при действии некоторых веществ (альфа-хлоргидрин, госсипол) и лекарственных средств (нифедипин, верапамил, орнидазол).
Лечение пациентов с нарушениями акросомной реакции основано на заместительной терапии карнитинами, применении антиоксидантов в случае оксидативного стресса, ингибиторов ангиотензин-превращающего фермента, применении препаратов, препятствующих росту уровня внутриклеточного кальция в случае избыточной акросомной реакции, или способствующих повышению внутриклеточного кальция в случае недостаточности индуцированной акросомной реакции.
Методом выбора является применение ЭКО ИКСИ. Однако следует убедиться, что отсутствуют нарушения структуры хромосом – повышенная фрагментация ДНК и нарушение соотношения гистоны/протамины, поскольку такие дефекты могут приводить к неразвивающимся беременностям и аномалиям развития даже при использовании ВРТ.
Доктор мед. наук, профессор В.А.Божедомов
Несколько цитат о значении оценки акросомной реакции при мужском бесплодии:
«…Тест оценки акросомной реакции позволяет оценивать оплодотворяющую способность половых клеток и может быть рекомендован во всех случаях тератозооспермии с дефектами головок сперматозоидов, или когда отсутствовала фертилизация ооцитов в программах ЭКО…»
Mori R., Sabanegh Jr E. // Male infertility: Contemporary clinical approaches, andrology, ART & antioxidants / S.J.Parekattil, A.Agarwal (Ed.), 2012, Springer Science+Busines Media: 21.
«…Описана “недостаточность акросомной реакции“, когда меньше 15% процентов сперматозоидов реагируют на ионофор Ф23187 и “преждевременная акросомная реакция“, когда больше 20% сперматозоидов претерпевают акросомную реакцию до контакта с ионофором…»
Yeung C.-H., Cooper T.G. // Andrology: Male Reproductive Health and Disfunction. 3rd. E.Nieschlag., H.M.Behre, S.Nieschlag (Ed.), 2010: 145.
«…В случаях тератозооспермии или олигозооспермии некоторые пациенты могут иметь сперматозоиды с нарушенной реакцией их связывания с zona pellucida. Другие мужчины могут иметь сперматозоиды, которые проявляют нормальное связывание с zona pellucida, но нарушение при тесте с акросомной реакцией…»
По WHO laboratory manual for the examination and processing of human semen / Editor-in-chief Dr. Trevor G. Cooper - 5th ed. 2010: 154.
«…Проточная цитометрия обеспечивает объективную и эффективную процедуру количественной оценки акросомного статуса сперматозоидов человека. »
Капацитация сперматозоидов. Гиперактивация и акросомальная реакция
Капацитация сперматозоидов. Гиперактивация и акросомальная реакция
Сразу же после проникновения в женские половые пути сперматозоиды не способны к оплодотворению яйцеклетки, несмотря на их активную подвижность. Совокупность физиологических изменений, претерпеваемых сперматозоидами в процессе их движения по женскому репродуктивному тракту, называют капацитацией.
Капацитация, впервые описанная в 1951 г. независимо друг от друга Ченгом (США) и Остином (Австралия), оказалась необходимым условием для оплодотворения. Считают, что инициация и завершение капацитации происходят в шейке матки. На молекулярном уровне начало капацитации знаменуется удалением холестерина с плазматической мембраны сперматозоидов, повышением текучести мембраны, вхождением ионов и изменением мембранного потенциала сперматозоидов, гиперполяризацией мембраны, интенсификацией тирозинового фосфорилирования, изменениями в системе «аденилатциклаза — цАМФ», ядре и акросоме.
У человека капацитация может быть смоделирована in vitro в специальной культуральной среде, состав которой имитирует электролитные пропорции жидкости маточных труб. Большинство капацитационных сред содержит энергетические субстраты (такие, как пируват, лактат и глюкоза), рецептор холестерина (например, сывороточный альбумин), NaHCO3, кальций, калий и изотонический раствор натрия хлорида.
Гиперактивация и акросомальная реакция сперматозоидов
Капацитация как процесс, происходящий на молекулярном уровне, протекает как в головке (акросомальная реакция), так и в хвосте сперматозоида (изменение характера двигательной активности, именуемое гиперактивацией). Гиперактивация происходит до акросомальной реакции. Энергичный характер движений, приобретаемый при гиперактивации, — результат физиологических изменений, происходящих в сперматозоиде. По сравнению со сперматозоидами, содержащимися в семенной жидкости, скорость, интенсивность и амплитуда жгутиковых биений, а также средняя ширина биений (латеральное биение головки) выше в капацитированной сперме.
Такой характер движений позволяет сперматозоидам перемещаться в вязком секрете маточных труб и преодолевать сопротивление трех преград на его пути (яйценосного холмика, лучистого венца и БО), окружающих яйцеклетку. Гиперактивация служит прогностическим фактором для ЭКО: ее низкий уровень предполагает мужское бесплодие и слабое связывание с белочной оболочкой (БО).
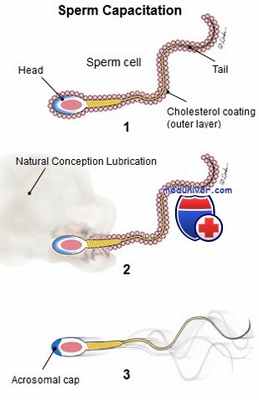
Передняя поверхность сперматозоидов покрыта акросомой, содержащей несколько гидролитических ферментов, в том числе протеазы, фосфатазы, арилсульфатазы и фосфолипазы. Наиболее изучены из этих ферментов гиалуронидаза и акрозин. Оболочки, окружающие ядро сперматозоида, представлены ядерной мембраной, внутренней акросомальной мембраной, наружной акросомальной мембраной и плазматической мембраной. В процессе акросомальной реакции происходит слияние плазматической и наружной акросомальной мембран, что способствует высвобождению содержимого акросомы, необходимому для процессов, предшествующих оплодотворению.
Акросомальная реакция может способствовать распознаванию, адгезии и слиянию с ооцитом, по крайней мере, по трем механизмам:
• экстернализация лигандных белков (например, CD46 на внутренней акросомальной мембране);
• миграция белка через жидкостную мембрану для достижения мест связывания (например, РН-20);
• конформационные изменения исходных мембранных белков.
Понимание процессов капацитации от момента появления спермы в женских репродуктивных путях до проникновения сперматозоида в ооцит предполагает клиническое применение полученных знаний в различных областях репродуктивной медицины. Тот факт, что после капацитации продолжительность фертильного периода сперматозоидов, находящихся в маточной трубе, укорачивается, представляет интерес с точки зрения усиления фертильности.
Капацитация спермы in vitro с помощью удаления семенной плазмы и инкубации отмытой спермы в культуральной среде с оптимальной температурой в СО2-инкубаторе обеспечивает строгий контроль момента оплодотворения, этот метод применяют при лечении некоторых видов бесплодия. Существует несколько методов определения состояния акросомы сперматозоидов человека:
• методы, использующие трансмиссионную электронную микроскопию, которая позволяет изучить акросому на ультраструктурном уровне;
• методы, использующие световую микроскопию, с окрашиванием спермы специфическими флюоресцирующими лектинами растительного происхождения или различными красителями;
• методы, использующие флюоресцент-активируемые сортеры клеток и флюоресцеиновые моноклональные антитела или лектины.
Влияние протеолитических ферментов на систему антиоксидантной защиты эякулята у мужчин с бесплодием в браке
В 30–75% случаев причины мужского бесплодия остаются невыясненными и считаются идиопатическими. Изучение влияния свободных радикалов на генеративную функцию мужчин представляет значительный интерес. С учетом немаловажной роли гиалуронидазы в проникновении сперматозоида в яйцеклетку нами было принято решение оценить препарат Лонгидаза, обладающий ферментативной протеолитической (гиалуронидазной) активностью пролонгированного действия. В исследование нами включены 48 пациентов-мужчин с нарушением фертильности идиопатического генеза. Пациенты были разделены на 2 равные группы (по 24 человека), пациентам 1-й группы рекомендовано проведение попыток зачатия в течение года без дополнительного лечения. Пациентам 2-й группы назначен препарат Лонгидаза по предложенной схеме. В ходе наблюдения у пациентов 2-й группы отмечено значимое улучшение показателей системы антиоксидантной защиты эякулята, что сопровождалось повышением оплодотворяющей способности эякулята и увеличением количества зачатий на 29,1%.
Введение. С каждым годом прогрессирующее снижение репродуктивной способности мужчин, находящихся в бесплодном браке, приобретает все большую клиническую и социальную значимость. Частота бесплодного брака, по данным эпидемиологических исследований, представленных ВОЗ, составляет 8–29% в различных популяциях среди супружеских пар детородного возраста и имеет тенденцию к увеличению [1]. Кроме того, у 10% пар отмечается мертворождение, в 10–25% парам не удается зачать более одного ребенка [2].
Интерес к мужской инфертильности обусловлен тем, что в 40–50% случаев причиной бесплодия в браке является нарушение репродуктивной системы мужчин. Причем в последние годы отмечается тенденция к снижению сперматогенной функции [3]. В 30–75% случаев причины мужского бесплодия остаются невыясненными и считаются идиопатическими [4–6]. Между тем даже установление вероятных этиологических факторов (варикоцеле, инфекционно-воспалительные процессы, воздействие токсических веществ и др.) не дает оснований утверждать, что именно они служат причиной бесплодия.
В последние годы фактором, снижающим мужскую фертильность, стали считать гиперпродукцию активных форм кислорода (АФК): озона, свободных радикалов, перекиси водорода [7–9]. В небольших количествах АФК необходимы для нормальной регуляции функции сперматозоидов, их гиперактивации и акросомальной реакции [10, 11]. Однако избыточная продукция АФК обусловливает повреждение мембраны сперматозоидов, снижение их подвижности и нарушение оплодотворяющей способности [12–15]. Кроме того, АФК непосредственно повреждают ДНК хромосом [16–18] и инициируют апоптоз сперматозоидов [19], что в конечном счете приводит к бесплодию [20–22]. Как часто оксидативный стресс имеет место и насколько выражено повышение продукции АФК при различных этиологически значимых состояниях, потенциально снижающих фертильность мужчин, остается неясным. Изучение влияния свободных радикалов на генеративную функцию мужчин представляет значительный интерес.
В процессе взаимодействия мужской и женской половых клеток в них происходит ряд изменений. Для спермиев характерны явления капацитации и акросомальная реакция. Капацитация представляет собой процесс активации спермиев, происходящий в яйцеводе под влиянием слизистого секрета его железистых клеток. В механизмах капацитации большое значение принадлежит гормональным факторам, прежде всего прогестерону (гормон желтого тела), активизирующему секрецию железистых клеток яйцеводов. После капацитации следует акросомальная реакция, в ходе которой из сперматозоидов выделяются ферменты – гиалуронидаза и трипсин, играющие важную роль в процессе оплодотворения. Гиалуронидаза расщепляет гиалуроновую кислоту, содержащуюся в блестящей зоне. Трипсин расщепляет белки цитолеммы яйцеклетки и клеток лучистого венца. В резу.
А.И. Неймарк , Б.А. Неймарк , Н.А. Ноздрачев , В.М. Брюханов , А.Ю. Плотникова , Д.А. Подпружникова , А.А. Никулина
Эффективность спематона* при мужском бесплодии
Н. А. Нашивочникова, В. Н. Крупин, С. А. Селиванова
ГБОУ ВПО «НижГМА» Минздрава РФ (ректор – засл. деятель науки, проф. Б. Е. Шахов), Нижний Новгород
Автор для связи: Н. А. Нашивочникова – ассистент кафедры урологии им. Е. В. Шахова ГБОУ ВПО «НижГМА» Представлены результаты приема спематона 39 мужчинами из бесплодных пар с различными формами патоспермии (астено-, олиго-, тератозооспермия). Показано, что эффект за первые 3 месяца приема спематона обусловлен преимущественно нормализацией акросомальной реакции сперматозоидов. Установлено, что спематон благодаря содержанию L-карнитина, цинка, витамина Е способствует восстановлению нарушенной индуцируемости акросомной реакции.
Ключевые слова: акросомная реакция, бесплодие, L-карнитин, спематон
Введение. Как известно, основные показатели фертильности спермы – общая концентрация сперматозоидов в эякуляте, их подвижность и морфология. Бесспорным является факт, что помимо подвижности, жизнеспособности и концентрации сперматозоидов в процессе оплодотворения яйцеклетки важнейшую роль играет акросомная реакция. В 5–10% случаев причиной бесплодия служит нарушение спонтанной и/или индуцированной акросомной реакции [1]. Однако оценка акросомной реакции сперматозоидов в рутинных исследованиях не проводится.
Известно, что основные показатели спермограммы в значительной мере подвержены воздействию различных как эндогенных, так и экзогенных факторов. В литературе достаточно сведений о влиянии различных факторов на подвижность сперматозоидов как непосредственно в самом эякуляте, так и в половом тракте женщины: pH спермы и содержимого влагалища, концентрации минеральных веществ и фруктозы в эякуляте, перитонеальной жидкости, ее клеточного, цитокинового, электролитного состава и др. [2]. Среди множества методов медикаментозной терапии мужского бесплодия использованию препаратов L-карнитина и цинка уделяется значительное внимание [3–6], однако нет четкого объяснения механизма влияния этих препаратов на показатели спермограмм.
Цель настоящего исследования – выяснить влияние биологически активной добавки к пище спематон (Свидетельство о государственной регистрации №RU.77.99.11.003.E.018281.06.11 от 02.06.2011) на функциональные характеристики сперматозоидов, включая акросомную реакцию.
Материалы и методы. В исследование вошли 65 мужчин из бесплодных пар. Критерии включения: отсутствие беременности в браке (более года половой жизни без контрацепции); отсутствие клинических и лабораторных признаков воспалительного процесса в половых железах; отсутствие инфекций репродуктивного тракта (Chlamydia rachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Trichomonas vaginalis), определяемых методом полимеразной цепной реакции; отсутствие аутоиммунных реакций против сперматозоидов, сопровождающихся выработкой антиспермальных антител; концентрация сперматозоидов не менее 10 млн/мл; отсутствие эякуляторных нарушений; отсутствие выраженных соматических заболеваний.
Все пациенты получали Спематон перорально 1 раз в день перед едой. Прием Спематона был начат за 3 месяца до предполагаемого зачатия. Это связано с тем, что время созревания сперматозоидов составляет 72 дня и вещества, положительно влияющие на сперматогенез, должны поступать в организм в течение всего этого периода.
Исследование спермы проведено в соответствии с требованиями ВОЗ [7]: определяли концентрацию, подвижность и долю нормальных форм, методом MAR выявляли долю сперматозоидов, покрытых антиспермальными антителами. Для оценки спонтанной и индуцированной ионофором кальция — антибиотиком А 23187 акросомной реакции использовали способ двойного флюоресцентного окрашивания сперматозоидов [8]. Нарушениями акросомной реакции считали показатели спонтанной акросомной реакции более 20%, индуцированность — менее 15% [9].
В дальнейшем из исследования были исключены 26 пациентов, у половых партнерш которых в процессе обследования были установлены явные факторы женского бесплодия: нарушения овуляции, непроходимость маточных труб, распространенный эндометриоз. У 39 мужчин, вошедших в анализируемую группу, имели место различные формы патоспермии (олиго-, астено-, тератозооспермия). Полученные лабораторные данные обработаны методами вариационной статистики при помощи t-критерия Стьюдента для независимых и парных значений, χ2 и критерия знаков.
Результаты. За 3 месяца лечения, что соответствует продолжительности цикла сперматогенеза, беременность наступила у половых партнерш 8 (20,5%) пациентов.
Каких-либо побочных действий, связанных с приемом Спематона обследованными пациентами, зафиксировано не было.
Таблица
Показатели акросомной реакции сперматозоидов на фоне приема Спематона (М±σ)
| Акросомная реакция | Исходный уровень | Через 1 мес | Через 3 мес |
| Спонтанная, % | 18,8±2,1 | 18,2±3,6 | 17,5±1,1 |
| Индуцированная, % | 20,1±1,4 | 36,7±3,2 | 42,8±4,7 |
| Индуцированность, % | 10,2±2,6 | 34,9±3,8 | 40,4±3,9 |
Полученные нами данные убедительно свидетельствуют, что наступление беременности на фоне приема Спематона обусловлено главным образом влиянием его компонентов на функциональные характеристики сперматозоидов, поскольку концентрация, подвижность и морфология сперматозоидов в этот период фактически не изменились. Наиболее наглядны при этом изменения индуцируемости акросомной реакции. Именно показатель индуцируемости акросомной реакции характеризует количество сперматозоидов, действительно способных преодолеть блестящую оболочку и оплодотворить яйцеклетку [13]. Полученные результаты легко объяснить давно известными данными, будто сперматозоиды приобретают оплодотворяющую способность только после 2-недельного продвижения через придаток и «дозревания» в семенных пузырьках [14, 15]. Есть основания считать, что дефицит специфических компонентов, таких как L-карнитин, цинк, витамин Е, нарушает капацитацию, а добавление их при лечении способно восстанавливать утраченные функции сперматозоидов.
Заключение. Таким образом, Спематон, содержащий L-карнитин, цинк, витамин Е, способствует восстановлению нарушенной индуцируемости акросомной реакции сперматозоидов, при этом эффект проявляется уже через 1 мес от начала его приема.
Литература
- Морозов П.Г. Состояние акросомальной системы спермиев при некоторых видах мужского бесплодия: Автореф. канд. дисс. Киев, 1990.
- Йен С.С.К., Джаффе Р.Б. Репродуктивная эндокринология: в 2 т. М.: Медицина, 1998;704.
- Costa M., Canale D, Filicori M.D., Iddio S., Lenzi A. L-carnitine in idiopathic asthenozoospermia: a multicenter study. Andrologia 1994; 26(3): 155–159.
- Micic S. Effects of L-carnitine on sperm motility and number in infertile men [abstract]. 16th World Congress on Fertility and Sterility. San Francisco, Oct 4 1998.
- Mieie S., Lalie N., Bojanie N., Nale D.J. Carnitine therapy of oligospermic men. 25th Annual Meeting program and abstracts, 7–11.05.2000. Boston: American Society of Andrology 2000.
- Vicari E., Calogero A.E. Effects of treatment with carnitines in infertile patients with prostato-vesiculo-epididymis.
- WHO laboratory manual for the examination of human sperm and semen-cervical mucus interaction. WHO, 4 edition. Cambridge: University Press 1999;128.
- Nikolaeva M.A., Golubeva E.L., Kulakov V.I., Sukhikh G.T. Evaluation of stimulus-induced acrosome reaction by two-color flow cytometric analysis. Mol Hum Reprod 1998; 4(3):243–250.
- Tesarik J. Acrosome reaction testing. Report of the consensus workshop on advanced diagnostic andrology techniques. ES-HRE, Andrology Special Interest Group. Hum Reprod 1996; 11:1463–1479.
- Chang M.C. The meaning of sperm capacitation: A historical perspective. J Androl 1984; 5: 45–50.
- Henkel R., Franken D.R., Habenicht U.-F. Zona pellucida as physiological trigger for the induction of acrosome reaction Andrologia 1998;30(4–5):275–280
- Yudin A.I., Cherr G.N., Vandevoort C.A., Overstreet J.W. Rearrangement of the PH-20 protein on the surface of macaque spermatozoa following expozure to anti-PH-20 antibodies or binding to zona pellucida Mol. Reprod. and Dev. 1998;50(2):207–220.
- Божедомов В.А., Николаева М.А., Теодорович О.В. Нормализация акросомальной реакции сперматозоидов в результате комплексной терапии карнитином, фруктозой и лимонной кислотой. Проблемы репродукции. 2003;6:49–52.
- Tournade A. Difference de motilite des spermatozoides preleves dans les clivers segments de lepididyme. CR Soc. Biol. 1993;74:738.
- Young W.C. A study of the function of epididymis. III. Functional changes undergone by spermatozoa during their passage through the epididymis and vas deferens in the guinea-pig. J Exp. Biol. 1991;8:151–162.
Efficiency of spematon in male infertility
N.A. Nashivochnikova, V.N. Krupin, S.A. Selivanova
SBEI HPE "NizhSMA" of RMPH (Rector – Honored Scientist, Professor B.E. Shakhov)
Author for contacts: N.A. Nashivochnikova – Teaching Assistant at the Department of Urology n.a. E. V. Shakhov SBEI HPE "NizhSMA" of RMPH The article presents the results of the application of spematon in 39 men from infertile couples with different forms of pathospermia (asthenozoospermia, oligozoospermia, teratozoospermia). It is shown that the effect in the first 3 months of use of spematon is mainly associated with normalization of acrosome reaction of sperm cells. It was established that spematon, due to content of L-carnitine content, zinc, vitamin E, contributes restoration of induction of acrosome reaction.
Key words: acrosome reaction, infertility, L- carnitine, spematon
Читайте также:
