Кинетика и коэффициент загрузки миозина
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Молекулы миозина и актина, взаимодействуя друг с другом, образуют актомиозиновый комплекс, в котором и разыгрываются основные события, приводящие к созданию силы, вызывающей сокращение мышцы. В покоящейся мышце миозиновые мостики не проявляют АТФазной активности, поскольку тропомиозин и белки тропонинового комплекса препятствуют взаимодействию головок миозина с нитью актина. Активация актомиозинового комплекса инициируется ионами Са 2+ . Концентрация Са 2+ в цитоплазме мышечной клетки в покое (расслабленная мышца) составляет менее 0,1 мкм, что гораздо ниже концентрации Са 2+ в межклеточной жидкости. Это обусловлено работой специального фермента – кальциевого насоса саркоплазматического ретикулума, который, используя энергию молекул АТФ (АТP), перекачивает Са 2+ из цитоплазмы в специальные цистерны. Под действием нервного импульса ионы Са 2+ выходят из кальциевых цистерн и связываются с ТnC. Это приводит к структурным изменениям остальных белков тропонинового комплекса. В конечном итоге изменяется положение тропомиозина относительно нити F-актина, и теперь головка миозина может связываться с актином. Тянущая сила, вызывающая смещение миозина вдоль нитей актина, возникает за счет структурных изменений в каталитическом центре миозина после гидролиза молекулы АТФ. Миозин напоминает механическое устройство, в котором головка и шейка миозинового мостика играют роль своеобразного рычага, позволяющего увеличить амплитуду смещения миозинового хвоста. Этот рычаг одним из своих концов опирается на актиновую нить, другой конец рычага соединен с хвостом молекулы миозина (рис. 3). После гидролиза АТФ и диссоциации Фн (Рi) и AДФ (ADP) из каталитического центра в головке миозина происходят структурные перестройки, в результате которых зацепленная за нить актина головка миозина поворачивается на угол a = 30–40°, увлекая за собой хвост миозина (рис. 3). Так возникает сила, вызывающая скольжение толстых нитей миозина вдоль нитей актина.
Рис. 3. Схема, показывающая изменение положения головки миозина (S1) относительно тонкой нити в ходе структурных перестроек актомиозинового комплекса, которые приводят к возникновению силы, тянущей хвост миозина
При структурных перестройках в каталитическом центре фрагмента S1 смещения атомов в активном центре сравнительно невелики. Однако они вызывают значительное перемещение хвоста миозина (3–5 нм для миозина скелетных мышц). Это происходит из-за того, что рычаг, передающий смещение от каталитического центра к хвосту миозина, имеет неравные плечи: активный центр S1 находится гораздо ближе к точке опоры, чем место соединения шейки с хвостом миозиновой нити (рис. 3). Интересно, что у молекул миозина, принадлежащих различным классам, амплитуда смещения хвоста за один рабочий шаг может заметно отличаться. Это определяется тем, что длина рычага у разных форм миозина не одинакова (рис. 2, в; см. № 41/2003). Так, например, у молекул миозина V, выполняющего функции транспортного белка, шейка в несколько раз длиннее, чем у миозина скелетных мышц (миозина II). Поворот головки миозина V на угол 30–40° приводит к смещению хвоста на расстояние 20 нм, что приблизительно в пять раз больше рабочего шага миозина скелетных мышц.
Рабочий цикл актомиозинового комплекса
Рис. 4. Цикл структурных превращений актомиозинового комплекса, приводящих к смещению молекулы миозина вдоль нити актина
В процессе сокращения мышцы каждая головка миозина совершает многократные повороты, периодически изменяя угол своего наклона относительно нити актина. В расслабленной мышце миозиновый мостик отделен от актиновой цепи (рис. 4, состояния 7 и 2). Свободная головка миозина обладает определенной подвижностью. За счет шарниров, расположенных в местах соединения фрагментов S1 и S2, угол ее наклона относительно хвоста может изменяться. При связывании молекулы АТФ с миозином его головка остается отсоединенной от актина (рис. 4, состояние 7). Затем молекула АТФ расщепляется на AДФ и Фн (рис. 4, переход из состояния 7 в состояние 2), которые остаются прочно связанными с каталитическим центром. Вслед за гидролизом АТФ головка миозина присоединяется к актиновой нити: сначала образуется слабая связь (состояние 3), затем возникает более прочная связь (состояние 4), но миозиновый мостик остается пока неподвижным. Прочное связывание головки миозина с актином приводит к высвобождению фосфата Фн из активного центра (переход из состояния 4 в состояние 5). Изменения, происходящие в каталитическом центре после диссоциации Фн, вызывают усиление связи миозина с актином и появление силы, вызывающей поворот мостика в сторону хвоста (переход из состояния 5 в состояние 6). В результате хвост миозина смещается вдоль нити актина, и длина саркомера уменьшается. После этого молекула AДФ высвобождается из каталитического центра, что приводит к отсоединению головки миозина от актина и завершению цикла структурных преобразований (переход из состояния 7 в состояние 1). В результате многократно повторяющихся циклов гидролиза АТФ возникает направленное скольжение нитей миозина и актина друг относительно друга.
Кооперативная и индивидуальная «трудовая деятельность» миозина
В мышечных волокнах молекулы миозина работают не индивидуально, а кооперативно, в составе крупных макромолекулярных ансамблей. В миофибриллах молекулы миозина собраны в жгуты, из которых выступает множество миозиновых мостиков в сторону нитей актина (рис. 1; см. № 41/2003). Установлено, что во время сокращения мышцы в каждый момент времени лишь небольшая часть мостиков (10–15%) находится в контакте с нитями актина. Это значит, что каждый из мостиков большую часть времени проводит в свободном состоянии и не создает тянущей силы. Однако молекулы миозина, у которых мостики отсоединены от актиновых нитей, при сокращении саркомера перемещаются вместе с остальными молекулами миозинового жгута. Это приводит к тому, что каждый мостик не просто шагает вдоль нити, равномерно ступая между соседними звеньями актиновой цепи, а как бы прыгает вдоль нее. Длина таких прыжков составляет 36–38 нм (рис. 5, а), что многократно превышает размер индивидуального шага (S = 4 нм). Таким образом, сокращение мышечных волокон обеспечивается за счет кооперативной работы большого количества молекул миозина, собранных в толстые нити. Движение пучка молекул миозина вдоль нити актина можно сравнить с перетаскиванием бревна большой группой работников, из которых лишь небольшая часть тружеников (10–15%) опирается ногами на землю, в то время как остальные работники в это время висят на бревне, не касаясь земли. Подобно мостикам миозина, работники периодически меняются ролями, однако в каждый момент времени активно работает лишь небольшая часть тружеников, несущих бревно вместе с висящими на нем товарищами (рис. 5, б).
Рис. 5. Схема перемещения молекулы миозина вдоль нити актина
Немышечные формы подвижности
Кооперативный способ работы молекул миозина, характерный для скелетных мышц, встречается также в некоторых других сократительных системах. Известна, однако, большая группа моторных белков, которые работают индивидуально: механохимические превращения у них протекают равномерно, а перемещение происходит отдельными шагами, без длинных прыжков. К таким молекулярным моторам относятся некоторые классы немышечных миозинов, работающих в клетках животных и растений в качестве переносчиков мембранных частиц.
Простейшие молекулы миозина, выполняющие работу индивидуальных переносчиков (например, миозин класса I), имеют глобулярную головку и короткий хвост. Двигаясь вдоль актиновой нити цитоскелета, молекула-переносчик может тащить за собой органеллу, к которой она прикрепляется своим хвостом.
Движение органелл легко наблюдать в некоторых крупных клетках, таких как гигантские клетки зеленой водоросли Nitella.
Интересна структурная организация транспортной системы, обеспечивающей циркуляцию цитоплазмы в клетках зеленых водорослей. На периферии клетки, рядом с плазматической мембраной, находится слой хлоропластов, которые примыкают к неподвижному кортикальному слою, содержащему пучки актиновых нитей.
Молекулы миозина равномерно перемещаются вдоль нитей актина, совершая круговое движение внутри клетки. При этом они увлекают за собой сравнительно крупные органеллы (митохондрии, эндоплазматический ретикулум, ядра и др.), которые перемещаются со скоростью 50–75 мкм/с. Благодаря такому движению в гигантской клетке водоросли возникает циркуляция слоя цитоплазмы между кортикальным слоем и мембраной вакуоли. За счет циркуляции цитоплазмы содержимое клетки перемешивается гораздо быстрее, чем это происходило бы за счет простой диффузии.
Гигантские клетки зеленых водорослей достигают длины 2–5 см, поэтому без принудительной циркуляции цитоплазмы молекулам белков потребовалось бы около 10 дней для диффузии от одного конца клетки к другому.
Некоторые формы биологической подвижности до сих пор остаются загадкой. К ним относятся, например, явления, связанные с движением хлоропластов в цитоплазме клеток водорослей и высших растений. Одно из них наблюдается при освещении растений: хлоропласты быстро перемещаются внутри клетки, собираясь вблизи клеточной стенки. Другое было открыто в 1839 г. французским ученым Донне, который показал, что в капле протоплазмы, выдавленной из клетки зеленой водоросли Chara, хлоропласты могут часами вращаться (один оборот за 2–3 с) в одном и том же направлении. Вращение хлоропластов наблюдалось также в цитоплазме интактных клеток водорослей. В.П. Скулачев с сотрудниками показал, что вращение хлоропласта – это энергозависимый процесс, который поддерживается за счет разностей концентраций ионов водорода внутри и снаружи хлоропласта. Возникает, однако, вопрос: что заставляет вращаться хлоропласты, которые, в отличие от бактерий, не имеют на своей наружной поверхности вращающихся жгутиков? Связано ли вращение хлоропластов в цитоплазме с существованием у них специальных пропеллеров, подобных тем, которые недавно были обнаружены у некоторых цианобактерий, или же оно каким-то загадочным образом связано с функционированием многочисленных АТФсинтазных комплексов – самых маленьких электромоторов? Ответы на эти и многие другие вопросы, касающиеся подвижности различных биологических структур, еще предстоит получить.
Кинезин
Кинезин – один из самых простых механохимических белков. В клетках он обеспечивает перемещение различных органелл (митохондрий, лизосом) и супермолекулярных частиц. У дрожжей найдено шесть белков, похожих на кинезин. В клетках мышей обнаружено более 20 подобных белков. Двигаясь вдоль микротрубочек (рис. 6), молекула кинезина может тянуть за собой сравнительно крупные субклеточные частицы.
Тубулиновые микротрубочки построены из глобулярных белков двух типов (- и -тубулин), которые, чередуясь, образуют линейные полимеры (протофиламенты). Из 13 протофиламентов, расположенных по кругу, получаются микротрубочки диаметром около 30 нм, с которыми непосредственно взаимодействуют молекулы кинезина.
По структурным и биохимическим свойствам кинезин напоминает миозин. Молекула кинезина представляет собой димер, образованный двумя одинаковыми полипептидными цепями. Так же как у миозина, с одной стороны каждой полипептидной цепи кинезина формируется глобулярная головка, соединенная со сравнительно длинным хвостом.
Размеры головки невелики: 7,5 х 4,5 х 4,5 нм. Хвосты двух мономерных цепей сплетены вместе, а наклоненные в разные стороны головки образуют своеобразную рогатину, которая непосредственно взаимодействует с мономерами микротрубочки, вдоль которой перемещается кинезин (рис. 6).
Рис. 6. Схема перемещения молекулы кинезина вдоль микротрубочки, состоящей из мономеров тубулина и . Буквами Т и D обозначены головки кинезина, с которыми связаны соответственно АТР или ADP. В исходном положении (состояние 1) головка кинезина, не связанная с микротрубочкой, содержит молекулу ADP. Другая головка, которая в это время контактирует с микротрубочкой, свободна от нуклеотидов. После связывания АТР второй головкой изменяется конформация молекулы кинезина, в результате чего первая головка, содержащая ADP, смещается вправо (переход 1--->2). После отсоединения ADP свободная головка связывается с микротрубочкой (переход 2--->3). Затем происходят гидролиз АТР и отсоединение фосфата (Рi), в результате чего головка, с которой связана молекула ADP, отходит от микротрубочки (переход 3--->4).
В конечном положении (состояние 4) углы наклона головок кинезина относительно микротрубочки такие же, как в исходном состоянии 1, но при этом молекула кинезина оказывается смещенной вдоль микротрубочки на расстояние, соответствующее двум мономерным звеньям тубулина и тубулина
Каждая из двух головок кинезина обладает АТФазной активностью. Связывание и гидролиз молекулы АТФ в активном центре кинезина, а также последующие события, вызванные отсоединением AДФ и Фн от активного центра, сопровождаются изменением положений головок относительно тубулиновых мономеров, в результате чего кинезин перемещается вдоль микротрубочки.
Работа головок кинезина хорошо скоординирована: связывание и гидролиз молекулы АТФ одной головкой димерного комплекса способствует освобождению молекулы AДФ из активного центра другой головки. Головки кинезина попеременно связываются с мономерными звеньями микротрубочки. На рис. 6 показана одна из наиболее вероятных схем работы кинезина, которая объясняет, каким образом происходит перемещение кинезина вдоль микротрубочек.
В ходе структурных перестроек моторных участков кинезина угол наклона головок относительно микротрубочки изменяется, вследствие чего кинезиновый димер смещается вдоль микротрубочки. Это движение по своему характеру напоминает перемещение двуногого существа – головки кинезинового димера попеременно опираются на тубулиновые глобулы микротрубочки.
До сих пор не совсем понятно, каким образом молекула кинезина «шагает». Весьма вероятно, что на определенной стадии происходит поворот рычагов относительно хвоста кинезинового димера (рис. 6). В этом случае движение кинезинового димера вдоль микротрубочки можно было бы сравнить с движением вальсирующего человека, который перемещается в танцевальном зале, периодически совершая повороты на 180° вокруг ноги, опирающейся на пол. После каждого такого поворота танцор переступает на другую ногу, совершая тем самым поступательное движение в пространстве. Один шаг димерного комплекса кинезина приводит к его смещению вдоль микротрубочки на расстояние S = 8 нм. Длина шага S в точности соответствует размеру двух мономерных глобул (-тубулина и -тубулина), из которых построена микротрубочка.
Молекула кинезина обычно совершает не менее 100 шагов, прежде чем отделиться от микротрубочки. Кинезин движется с поразительно высокой скоростью. За одну секунду он делает приблизительно 100 шагов, перемещаясь за это время на расстояние 800 нм. При этом сила, развиваемая одной молекулой кинезина, составляет величину около 6 пН. Если бы такой мощностью в расчете на единицу массы обладали автомобильные моторы, они легко могли бы разгонять машины до скоростей, существенно превышающих скорость звука.
Коэффициент полезного действия кинезинового мотора также велик. Совершаемая им за один шаг работа равна 48 пН•нм, что составляет примерно 60% от энергии, выделяемой при гидролизе одной молекулы АТФ. Работая в качестве индивидуального молекулярного извозчика, кинезин может совершать перемещения на очень большие расстояния (до 1 мм).
Заключение
Мы рассмотрели механизмы работы всего лишь двух молекулярных моторов, которые ответственны за сократительную активность, подвижность и транспортные процессы в клетке. Этими примерами далеко не ограничивается число моторных белков. Одних только механохимических белков типа миозина в клетках различных организмов насчитывается более 15 семейств и свыше 84 видов.
Многие принципиально важные детали механохимических процессов, происходящих при работе актомиозинового и кинезинового комплексов, стали понятными благодаря недавним успехам в изучении молекулярной структуры их моторных белков методом рентгеноструктурного анализа. С высоким разрешением получены картины пространственного строения моторных участков миозина, кинезина, динеина и родственных им механохимических белков.
Другим важным достижением в исследовании молекулярных моторов явилась разработка новых биофизических методов регистрации подвижности белков, которые позволили непосредственно наблюдать за движением отдельных моторных белков и их фрагментов.
Кинетика и коэффициент загрузки миозина
• АТФазный цикл является наиболее консервативным для всех миозинов
• Кинетика АТФазного цикла различных миозинов настроена для выполнения специфических биологических функций
• Миозины с высоким коэффициентом загрузки проводят большую часть продолжительности цикла в присоединенном к актину состоянии
• Миозины с низким коэффициентом загрузки проводят большую часть времени в отсоединенном от актина состоянии
• Некоторые миозины с высоким коэффициентом загрузки являются процессивными и «шагают» по актиновым филаментам на большие расстояния
Все миозины используют механохимический принцип. Однако моторные домены различных изоформ миозина характеризуются биохимическим и механическим свойствами, которые обладают определенной «настройкой» для выполнения опеределенной роли в клетке. Эти свойства миозинов суммированы на рисунках ниже.
Например, отдельные миозины, работающие индивидуально или небольшими группами и способные перемещать органеллы по актиновым филаментом на большие расстояния, обладают свойствами, отличающимися от миозинов, работающих в организованных филаментах, генерирующих большие усилия и поддерживающих высокую скорость сокращения (например, мышц).
Специфические свойства различных миозинов проявляются в различиях в константе скорости, которые определяют переходы между различными этапами АТФазного цикла, а не различиями в основных путях АТФазной реакции. Разные константы скорости приводят к разным скоростям, с которыми миозины проходят через АТФазный цикл и к различным их коэффициентам загрузки. Под коэффициентом загрузки понимают часть общего времени АТФазного цикла, в течение которой индивидуальный мотор обычно прочно связан с актином.
Миозины, работающие в виде комплекса из многих моторов, обычно имеют низкие коэффициенты загрузки. В миозиновом филаменте, содержащем сотни моторных доменов (например, в толстом филаменте мышц), каждый мотор должен быть присоединен к актину, выполнить цикл рабочего хода и затем быстро отсоединиться от актина, не мешая другим миозинам в той же сборке.
Если один из миозиновых моторов остается связанным с актином слишком долго, он будет препятствовать другим миозинам в сборке выполнять рабочий ход и ингибировать быстрое скольжение, которое необходимо для мышечного сокращения.
До отсоединения от актинового филамента миозины с высоким коэффициентом загрузки способны выполнять вдоль него многочисленные шаги. Рассмотрим димерный миозин (например, миозин-V), который транспортирует органеллу вдоль актинового филамента. Если бы оба его моторных домена отсоединились от актина, то под действием термических сил молекула миозина ушла бы с трека. Поэтому, чтобы происходил транспорт, по крайней мере один мотор все время должен быть связанным с актином.
Считают, что эти процессивные двухглавые миозины имеют скоординированную АТФазную активность двух головок, позволяющую им легко и синхронно двигаться.
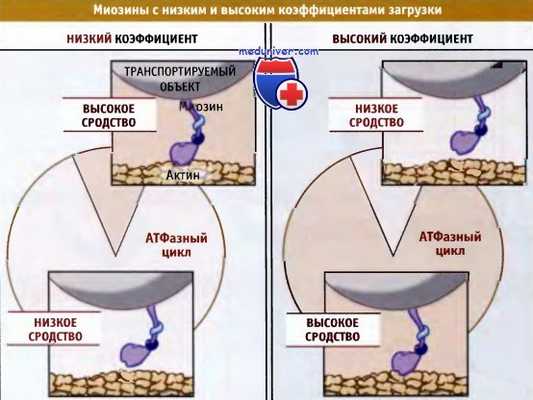
Коэффициент загрузки представляет собой часть времени в АТФазном цикле
в течение которого миозиновый мотор остается связанным с актином.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Миозиновые белки являются преобразователями энергии, которые используют АТФ для обеспечения подвижности и генерации силы, направленных вдоль актиновых филаментов
• Миозиновая подгруппа молекулярных моторов на основе актина включает в себя по меньшей мере 18 классов, причем для многих белков существует несколько изоформ
• Одни миозины обеспечивают сокращение мышц и клеток, в то время как другие обеспечивают поддержку формы мембран и везикулярный транспорт
• Миозины играют ключевую роль в регуляции формы и полярности клеток
• Миозины участвуют в процессах передачи сигнала и реализации сенсорных ощущений
Миозины представляют собой белковые моторы, использующие энергию гидролиза связанного АТФ для генерации силы, обеспечивающей подвижность вдоль актиновых филаментов. Миозины хорошо известны из-за своей роли в мышечном сокращении. Однако экспрессия миозина не ограничивается только мышцами. Эта большая группа белков, которые экспрессируются практически во всех клетках эукариот.
Различные ее представители характеризуются структурными и биохимическими особенностями, которые предназначаются для специфических клеточных нужд.
Миозиновая группа молекулярных моторов на основе актина состоит по меньшей мере из 18 классов (или семейств), причем во многих классах белки имеют несколько изоформ. Классы различаются по результатам филогенетического анализа аминокислотных последовательностей. Все миозины, за исключением миозина VI, движутся по направлению к оперенному концу актиновых филаментов. Типы и количество миозинов, которые экспрессируются в данной клетке или организме, существенно различаются.
Например, в клетках дрожжей Saccharomyces cerevisiae экспрессируются пять миозинов, принадлежащих к трем разным классам, а у человека присутствуют сорок генов из двенадцати семейств.
Представители семейства миозинов участвуют в выполнении существенных и разнообразных клеточных функций. Для них характерно наличие трех общих доменов (головной или моторный домен, регуляторный и хвостовой домены), которые эволюционировали таким образом, что приобрели характеристики, позволяющие им выполнять в клетке различные специфические механические и регуляторные функции. Моторный и регуляторный домены управляют подвижностью, хвостовой домен участвует в полимеризации миозина и в связывании с другими клеточными компонентами, необходимыми для транспорта.
Достигнут большой прогресс в выяснении клеточных функций миозинов и их регуляции с участием моторных и хвостовых доменов. В таблице ниже представлены функции различных семейств миозина, другая таблица ниже суммирует свойства миозиновых доменов, а последняя таблица ниже содержит сведения об экспрессии миозинов человека. Все известные миозины можно подразделить на четыре больших функциональных группы.
Миозины, обеспечивающие мышечное и клеточное сокращение. Изоформы семейства миозин II генерируют усилия, вызывающие сокращение скелетных, сердечных и гладких мышц. Они также обеспечивают функционирование сократительного кольца при цитокинезе, миграцию клеток и прочие процессы, связанные с сократительной способностью клетки.
Миозины, обеспечивающие процессы мембранного и везикулярного транспорта. Моторы микротрубочек осуществляют цитозольный транспорт мембранных везикул на дальние расстояния. Однако некоторые миозины играют существенную роль в транспорте на короткие расстояния и в регуляции распределения везикул и органелл. Например, процессивный мотор миозин-V транспортирует пигментные органеллы, обеспечивающие окраску кожи и волос, в то время как другие миозины, например изоформы миозина-I, -VI, -IX, и -X, участвуют в формировании и транспорте везикул при эндоцитозе и фагоцитозе Миозины, играющие ключевую роль в регуляции формообразования и полярности клеток.
Миозины необходимы для образования и функционирования богатых актином специализированных поверхностных образований, таких как филоподии, стереоцилии и псевдоподии. Например, некоторые изоформы миозина-I связывают липиды мембраны с актиновым цитоскелетом и обеспечивают сокращение мембранных протрузий, богатых актином; изоформы миозина-П обеспечивают сокращение стресс-фибрилл и актиновых филаментов кортикального слоя клеток, участвующих в поддержании формы клетки; миозин-VII обеспечивает сокращаемую связь между актиновым цитоскелетом и внеклеточными матриксами.
Миозины, участвующие в процессах передачи сигнала и реализации сенсорных ощущений. Миозин участвует в процессе передачи сигнала за счет ассоциации с сигнальными белками. Например, миозин-I регулирует активность ряда кальциевых каналов, миозин III взаимодействует с сигнальными молекулами фоторецепторов глаза, миозин-IX, по-видимому, регулирует активность Rho, и миозин-XVI направляет фосфатазу в специфические области клетки. Также миозины играют важную роль в реализации сенсорных ощущений. Известны мутации в генах, кодирующих синтез миозинов-VI, -VII и -XV. Они служат причиной потери слуха, которая происходит из-за нарушений в актин-содержащих структурах клеток сенсорных волосков внутреннего уха.
В последующих статьях на сайте мы рассмотрим структуру миозина, основные механизмы генерации усилий для всех охарактеризованных миозинов, и связь этих свойств с биологической ролью содержащих их клеток.
Свойства 18 семейств миозинов.
Перечислены организмы, в которых они экспрессируются, и функции этих белков.
Для некоторых миозинов функции неизвестны. Структурные и кинематические свойства семейств миозинов Экспрессия белков семейств миозинов в клетках человека
Рабочий ход миозина и плечо его рычага
• Один миозиновый мотор генерирует усилие, достаточное для транспорта биологических молекул и везикул (несколько пиконьютон)
• Рабочий ход миозина пропорционален длине «плеча рычага»
Хотя миозин является ферментом, катализирующим гидролиз АТФ в АДФ и Фн, биологически значимым продуктом этой реакции является не АДФ и Фн, а физическая сила. В растворе физиологической концентрации количество работы, высвобождающейся при гидролизе молекулы АТФ, составляет примерно 80 pN-нм, где pN сокращение, применяющееся для обозначения пиконьютона (10 -12 ньютон), а нм обозначает длину в нанометрах (10 -9 метра).
Для справки отметим, что один pN приблизительно соответствует весу одного эритроцита, а 1 нм радиусу спирали ДНК Миозины способны превращать в полезную работу около 50% всей энергии, высовобождающейся при гидролизе АТФ. Остальная энергия рассеивается в виде тепла. Таким образом, миозин фактически генерирует порядка 40 pN-нм на одну молекулу АТФ. Это не очень большая энергия, однако она в 10 раз превышает термическую энергию температуры тела.
Этой энергии также оказывается достаточно для транспортировки молекулой миозина органеллы по цитоплазме. Однако для выполнения более понятного уровня работы, которая должна совершаться в ткани мышц, вместе должны работать много миллионов молекул миозина. Например, для того чтобы поднять с пола и поставить на стол корзинку с зеленью, необходимо приложить усилие 50 Nm.
Усилие, которое способна развивать одна молекула миозина, было рассчитано из данных, полученных методом оптической силовой спектроскопии. Этот метод позволяет регистрировать усилие, которое развивает одна молекула миозина при движении по актиновому филаменту.
Различные изоформы миозина генерируют примерно 5-10 pN на молекулу гидролизованного АТФ (объединенное усилие). Хотя все миозины генерируют примерно одинаковые усилия, количество времени, в течение которого различные миозины остаются прочно связанными с актиновым фи-ламентом после выполнения рабочего хода, как следует из данных измерений биохимической кинетики, сильно различается.
Вместе с тем, унитарная величина усилия, т. е. расстояние, на которое движется молекула миозина при гидролизе молекулы АТФ, сильно варьирует. Измерения одной молекулы также позволяют измерять унитарную величину усилия и послужили поддержкой для механизма плеча рычага при движении миозина. Величина усилия миозина также зависит от угла, на который поворачивается регуляторный домен, и показывает, что миозины с более длинными регуляторными доменами обладают более длинными величинами усилия, чем миозины с короткими регуляторными доменами.
Скорость скольжения (v) миозина равняется расстоянию (d), пройденному за единицу времени (Т), и v = d/t. Поэтому миозин с большим усилием будет обладать более быстрой скоростью движения, чем миозин имеющий ту же самую АТФазную скорость, но меньший размер усилия.
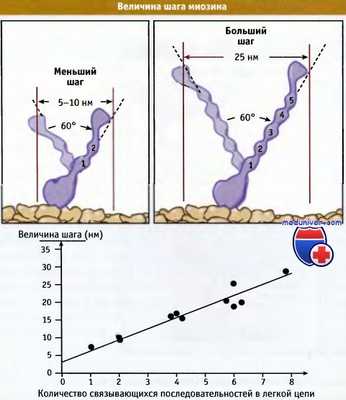
Расстояние, которое проходит миозин в расчете на затраченную молекулу АТФ,
зависит от длины плеча рычага (регуляторного домена).
Миозин в мышечных волокнах
Дана характеристика молекулы миозина: длина, толщина и молекулярная масса. Описана также структура молекулы миозина: головок и хвоста. Подробно описано формирование толстого филамента путем самосборки и факторы, отрицательно влияющие на этот процесс.
Основу толстого филамента саркомера (миофибриллы) составляет белок миозин. Впервые белок миозин был выделен из скелетных мышц в начале XX века.
Характеристика молекулы миозина
Молекула белка миозина (миозина II типа), который участвует в сокращении саркомера, имеет молекулярную массу 500 кДа. Длина молекулы равна 150 нм, а толщина – 2 нм. Молекула миозина образована четырьмя полипептидными цепями, две из которых (тяжелые) имеют молекулярную массу по 200 кДа, а две – легкие 20 и 17 кДа.
Рис. 1. Состав и структура молекулы миозина
Состав и структура молекулы миозина
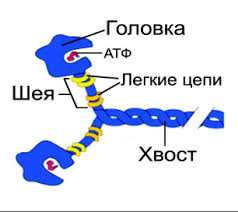
Молекула миозина состоит из «хвоста» или «стержня» и двух «головок» (рис.1). Хвост миозина состоит из двух цепей, каждая из которых свернута в α-спираль. Две α-спирали дополнительно скручены в суперспираль. Эта суперспираль является стержнем (хвостом) миозиновой молекулы. Ее длина равна 135 нм.
На верхнем конце стержня две нити расходятся, сплетаются с дополнительными двумя легкими цепями и формируют две миозиновые головки. За счет головок длина миозиновой молекулы достигает 150 нм , а толщина – 2 нм. По этим характеристикам молекула миозина превосходит все молекулярные структуры, имеющиеся в природе.
Соединение между головкой и стержнем молекулы миозина подобно шарниру. Это позволяет головкам наклоняться и прикрепляться к молекулам актина.
АТФ-азная активность миозина
В 1939 году советскими учеными В.А. Энгельгардом и М.Н. Любимовой было установлено, что молекула миозина обладает АТФ-азной активностью, то есть участвует в реакции гидролиза АТФ – основной реакции энергообеспечения мышечной деятельности энергией. Позже было установлено, что на каждой миозиновой головке имеются центры. В одном из них находится фермент АТФ-аза. Другой центр предназначен для связывания головки миозина с тонким филаментом (рис.2).
Рис.2. Молекула миозина состоит из двух длинных полипептидов (тяжелых цепей), формирующих две глобулярные головки и стержнеобразный хвост, участвующий в образовании толстого филамента. Головки содержат актин-связывающие участки (А) и моторные области (М), где происходит связывание и расщепление АТФ. Вблизи головок с тяжелыми цепями ассоциированы две пары легких цепей, одна из которых содержит участок фосфорилирования (Ф).
В настоящее время на основе степени активности фермента АТФ-азы производится разделение мышечных волокон на типы.
Формирование толстого филамента
Несколько сотен миозиновых молекул способны самопроизвольно собираться в пучок. При таком объединении молекулы миозина располагаясь параллельно друг другу с некоторым сдвигом образуют своеобразный «ствол» (рис.2). Толщина «ствола» составляет 11-14 нм. В середине «ствола» переплетаются хвосты молекул миозина, а с двух концов «ствола» торчат головки. Это и есть толстый филамент (рис. 3 и рис.4).
Рис.3. Молекула миозина и толстый филамент Рис.4. Толстый филамент
Установлено, что агрегация (самосборка) толстого филамента очень чуствительна к рН саркоплазмы. Если рН саркоплазмы находится вне физиологических значений (рН = 7,2-7,5), самосборка толстых филаментов происходит нерегулярно и возникают очень длинные разветвляющиеся структуры (Дж. Бендолл, 1970). Из этого следует, что синтез белков, пока в мышечных волокнах много молочной кислоты (лактата) отставлен, так как могут синтезироваться «неправильные» толстые филаменты, саркомеры и миофибриллы.
Читайте также:
