Клиника и признаки транспозиции магистральных сосудов.
Добавил пользователь Евгений Кузнецов Обновлено: 09.01.2026
Течение тетрады фалло. Клиника и признаки тетрады фалло.
Во внутриутробном периоде тетрада Фалло не оказывает влияния на развитие плода. Схема кровообращения аналогична таковой при атрезии легочной артерии. Синхронная работа обоих желудочков обеспечивает адекватный системный кровоток, а плацента — оксигенацию. Степень легочного стеноза и гипоплазии легочных артерий варьируют в значительной степени, а процесс их формирования продолжается вплоть до родов и в первые месяцы жизни ребенка. Это определяет необходимость повторных эхокардиографических исследований плода. Родоразрешение в специализированном учреждении, располагающем возможностями для инфузии простагландинов и последующего хирургического лечения, рекомендуется при выраженной обструкции легочного кровотока и гипоплазии легочных артерий. Порок относится ко 2-й категории тяжести.
В постнатальном периоде тетрада Фалло основным прогностически неблагоприятным фактором является артериальная гипоксемия, воздействующая как на общее состояние пациента, так и на миокард. В соответствии с этим течение бледной формы тетрады Фалло относительно благоприятно, а классическая форма тетрады Фалло протекает более тяжело. В последнем случае хроническая гипоксия приводит к дисфункции органов, отставанию ребенка в физическом и умственном развитии, ранней смертности. Уже к 3-6 годам можно выявить жировую дистрофию миокарда.
Наиболее тяжелое течение отмечают при варианте порока с агенезией легочного клапана. У некоторых из этих пациентов сердечная недостаточность развивается еще внутриутробно; 60% из них умирают в перинатальном периоде от водянки, респираторных проблем или сопутствующей врожденной патологии.
Всего на первой неделе жизни погибают около 6% больных с тетрадой Фалло, к 6 мес - 14%, к концу года - до 25%, к 40 годам - 95%. Высокая смертность в первые недели жизни обычно отмечается при выраженной гипоплазии легочных сосудов.

Клиническая симптоматика тетрады фалло.
Дети с тетрадой Фалло обычно имеют нормальные показатели развития при рождении. Однако у большинства вскоре развивается умеренный центральный цианоз. Выраженный цианоз свидетельствует о крайней степени обструкции легочного кровотока, в частности — об атрезии легочной артерии. Из ранних симптомов следует отметить продолжительный систолический шум изгнания, выслушивающийся на основании сердца слева от грудины. При нарастании стеноза шум становится короче и мягче. У больных с атрезией легочной артерии шум может полностью отсутствовать или слышен функционирующий ОАП. В случаях с большими коллатералями можно выслушать их шум на спине.
При агенезии легочного клапана шум имеет пансистолический характер с низкочастотным диастолическим компонентом слева от грудины, а клиническая картина характеризуется триадой: затруднение дыхания, сердечная недостаточность и цианоз. У этих больных легко развиваются ателектазы и пневмонии вследствие сдавления расширенной легочной артерией прилегающих бронхов. В некоторых случаях может потребоваться искусственная вентиляция легких для компенсации дыхательной недостаточности.
Общим правилом при тетраде Фалло является то, что раннее появление выраженной симптоматики свидетельствует о неблагоприятной анатомии порока (гипоплазия легочной артерии, атрезия легочного клапана, выраженный инфундибулярный стеноз, гипоплазия левого желудочка). Пациенты с такой анатомией составляют группу критических больных (около 35%), которым требуется проведение интенсивной терапии и оперативного вмешательства вскоре после рождения.
Спектр проявлений гипоксемии достаточно широк: от умеренного цианоза до затяжного гипоксического статуса. Характерными для тетрады Фалло являются одышечно-цианотические (гипоксические) приступы. Приступ начинается часто после крика, кормления или дефекации. Ребенок становится беспокойным, усиливаются одышка и цианоз, затем нарастает вялость, пропадает шум над областью сердца. В тяжелых случаях возможны апноэ и потеря сознания, судороги. Развитие приступов связано со спазмом инфундибулярного отдела правого желудочка, в результате чего возрастает сброс венозной крови в аорту и усиливается гипоксия ЦНС. Исходя из такого механизма понятно, что при атрезии легочной артерии нет основы для возникновения приступов. У этих больных усиление цианоза связано с закрытием или относительным стенозом сосудов, кровоснабжающих легкие (ОАП, коллатерали), и обычно переходит в гипоксический статус, редко купирующийся самостоятельно.
Следует отметить, что анемия играет существенную роль в клинической симптоматике заболевания. С одной стороны, она уменьшает видимый цианоз, скрывая тяжесть заболевания, а с другой - уменьшает возможность доставки кислорода к органам. В результате гипоксические приступы у пациентов с анемией возникают чаще, протекают тяжелее и чреваты мозговыми осложнениями.
- Вернуться в оглавление раздела "Кардиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Клиника и признаки транспозиции магистральных сосудов.
Транспозиция магистральных артерий. Виды транспозиций магистральных артерий.
Центральный цианоз часто является первым симптомом врожденного порока сердца. В данной главе приведены ВПС, для которых артериальная гипоксемия — ведущий синдром, несмотря на то, что некоторым из них свойственна также сердечная недостаточность. Причины гипоксемии при ВПС следующие: 1) шунт крови справа налево; 2) уменьшение легочного кровотока; 3) разобщение малого и большого кругов кровообращения.
Транспозиция магистральных артерий (ТМА) представляет собой порок, при котором аорта отходит от морфологически правого желудочка и несет венозную кровь к тканям организма, а легочная артерия отходит от морфологически левого желудочка и несет артериальную кровь к легким.
Среди новорожденных частота транспозиции магистральных сосудов составляет 0,22-0,33 на 1000, среди всех ВПС — 6—7%, среди критических ВПС - до 23%.
Нарушения гемодинамики во многом определяются конкретно представленным вариантом порока:
1) ТМА с интактной межжелудочковой перегородкой;
2) ТМА с интактной межжелудочковой перегородкой и сужением выводного отдела левого желудочка;
3) ТМА с ДМЖП;
4) ТМА с ДМЖП и сужением выводного отдела левого желудочка.

Дефект межжелудочковой перегородки добавляет к симптомам гипоксемии симптомы объемной перегрузки желудочков, легочный стеноз ограничивает легочный кровоток. Однако основой патологии во всех случаях является анатомическое разделение малого и большого кругов кровообращения. При этом венозная кровь, притекающая в правый желудочек, поступает в аорту и, пройдя большой круг кровообращения (БКК), через полые вены вновь возвращается в правые отделы сердца. Артериальная кровь, притекающая в левый желудочек, поступает в легочную артерию и, пройдя малый круг кровообращения (МКК), через легочные вены вновь возвращается влевые отделы сердца. Таким образом, в БКК постоянно циркулирует кровь с низким содержанием кислорода, а в МКК - с высоким.
У больных с транспозицией магистральных сосудов существует резкий контраст между газовым составом крови в легочных венах и аорте. Так как газообмен в легких не нарушен, в оттекающей от них крови р02 может достигать 110 ммрт. ст., а рС02 составляет 15-25 мм рт. ст. В то же время в системной «артериальной» крови рО, редко превышает 35 мм рт. ст., а рС02 равно приблизительно 45 мм рт. ст. Придыхании 100% кислородом системное рО, обычно поднимается не более чем на 5—10 мм рт. ст. и отражает величину межциркуляторного смешивания крови.
Величина легочного кровотока определяется анатомией порока. При простой транспозиции магистральных сосудов он несколько усилен за счет увеличения минутного объема сердца как одного из механизмов компенсации гипоксемии. Значительная гиперволемия МКК возникает при большом диаметре ОАП или сопутствующем ДМЖП. При сужении выхода из левого желудочка легочный кровоток уменьшен.
Фетальная ЭхоКГ.
Так как транспозиция магистральных сосудов не сопровождается кардиомегалией и редко сочетается с хромосомными аномалиями, процент ее выявления при акушерском скрининге не превышает 19%. Правильное заключение возможно, если исследуются выводные тракты желудочков. При этом выявляют параллельное, а не перекрещивающееся положение магистральных сосудов. В дальнейшем устанавливают, что аорта отходит от морфологически правого, а легочная артерия — от морфологически левого желудочка.
Естественное течение транспозиции магистральных сосудов. В силу особенностей внутриутробного кровообращения транспозиция магистральных сосудов практически не влияет на развитие плода, верхняя и нижняя половины тела оксигенируются адекватно.
В случаях, когда диагноз поставлен, следует обратить внимание на функцию овального окна и ОАП. В 4-6% наблюдений уже пренатально можно выявить симптомы их рестриктивности (фиксированное выбухание межпредсердной перегородки в левое предсердие, малый диаметр ОАП с высокоскоростным потоком крови в нем), приводящей к ранней неонатальной смертности. Родоразрешение рекомендуется проводить в учреждении, располагающем возможностями для терапии простагландинами и выполнения процедуры Рашкинда. Порок относится ко 2-й категории тяжести.
В большинстве случаев ребенок рождается в срок, с нормальным весом. В первые часы после рождения не возникает обычного для новорожденных резкого перераспределения крови в сторону легких и отсутствует возврат большого объема крови из них в левое предсердие. Кроме того, в правом желудочке сохраняется повышенное давление, так как он изгоняет кровь в аорту. В результате давление в правом предсердии сохраняется более высоким, чем в левом и клапан овального окна не закрывается. Кроме того, через ОАП существует двунаправленный поток крови (в систолу — из легочной артерии в аорту, в диастолу — из аорты в легочную артерию). Данные механизмы поддерживают некоторое время удовлетворительную системную оксигенацию крови. Однако уже через несколько часов развивается дефицит кислорода, усиливаются анаэробный метаболизм и продукция лактата, истощаются запасы гликогена. Развиваются метаболический ацидоз и нарушения функции различных органов. Это сопровождается быстрой гибелью больных: 30% умирают на первой неделе жизни, 50% — в периоде новорожденности и 90% — в течение первого года жизни.
Транспозиция магистральных сосудов
Транспозиция магистральных сосудов – тяжелая врожденная патология сердца, характеризующаяся нарушением положения главных сосудов: отхождением аорты от правых отделов сердца, а легочной артерии – от левых. Клинические признаки транспозиции магистральных сосудов включают цианоз, одышку, тахикардию, гипотрофию, сердечную недостаточность. Диагностика транспозиции магистральных сосудов основана на данных ФКГ, ЭКГ, рентгенологического исследования органов грудной клетки, катетеризации полостей сердца, вентрикулографии. Методами оперативной коррекции транспозиции магистральных сосудов служат паллиативные вмешательства (баллонная атриосептостомия) и радикальные операции (Мастарда, Сеннинга, Жатене, Растелли, артериального переключения).
Общие сведения
Транспозиция магистральных сосудов – врожденный порок сердца, анатомическую основу которого составляет неправильное расположение аорты и легочной артерии относительно друг друга и их обратное отхождение от желудочков сердца. Среди различных ВПС транспозиция магистральных сосудов составляет 7–15%; в 3 раза чаще встречается у мальчиков. Транспозиция магистральных сосудов входит в число «большой пятерки» - наиболее часто встречающихся врожденных аномалий сердца, наряду с дефектом межжелудочковой перегородки, коарктацией аорты, открытым артериальным протоком, тетрадой Фалло.
В кардиологии транспозиция магистральных сосудов относится к критическим порокам сердца синего типа, не совместимым с жизнью, поэтому требует хирургического вмешательства в первые недели жизни.
Причины транспозиции магистральных сосудов
Аномалии развития магистральных сосудов формируются в первые 2 месяца эмбриогенеза в результате хромосомных аберраций, неблагоприятной наследственности или отрицательных внешних воздействий. Экзогенными факторами могут выступать вирусные инфекции, перенесенные беременной (ОРВИ, краснуха, ветряная оспа, корь, эпидемический паротит, герпес, сифилис), токсикозы, радиоактивное облучение, лекарственные вещества, алкогольная интоксикация, полигиповитаминоз, заболевания матери (сахарный диабет), возрастные изменения в организме женщины старше 35 лет. Транспозиция магистральных сосудов встречается у детей с синдромом Дауна.
Непосредственные механизмы транспозиции магистральных сосудов до конца не изучены. По одной из версий, порок обусловлен неправильным изгибом аортально-пульмональной перегородки в процессе кардиогенеза. Согласно более современным представлениям, транспозиция магистральных сосудов является результатом неправильного роста субаортального и субпульмонального конуса при разветвлении артериального ствола. При закладке сердце в норме резорбция инфундибулярной перегородки приводит к формированию аортального клапана кзади и книзу от клапана легочной артерии, над левым желудочком. При транспоцизии магистральных сосудов процесс резорбции нарушается, что сопровождается расположением клапана аорты над правым желудочком, а клапана легочной артерии - над левым.
Классификация транспозиции магистральных сосудов
В зависимости от количества сопутствующих коммуникаций, выполняющих компенсирующую роль, и состояния малого круга кровообращения различают следующие варианты транспозиции магистральных сосудов:
1. Транспозиция магистральных сосудов, сопровождающаяся гиперволемией или нормальной величиной легочного кровотока:
- с дефектом межпредсердной перегородки или открытым овальным окном (простая транспозиция)
- с ДМЖП
- с открытым артериальным протоком и наличием дополнительных коммуникаций.
2. Транспозиция магистральных сосудов, сопровождающаяся уменьшением легочного кровотока:
- со стенозом выносного тракта левого желудочка
- с ДМЖП и стенозом выносного тракта левого желудочка (сложная транспозиция)
В 80% случаев транспозиция магистральных сосудов сочетается с одной или несколькими дополнительными коммуникациями; у 85-90% больных порок сопровождается гиперволемией малого круга кровообращения. Для транспозиции магистральных сосудов характерно параллельное расположение аорты относительно легочного ствола, тогда как в нормальном сердце обе артерии перекрещиваются. Чаще всего аорта находится впереди легочного ствола, в редких случаях сосуды располагаются в одной плоскости параллельно, или аорта локализуется кзади от легочного ствола. В 60% наблюдений обнаруживается D-транспозиция – положение аорты справа от легочного ствола, в 40%- L-транспозиция – левостороннее положение аорты.
Особенности гемодинамики при транспозиции магистральных сосудов
С позиций оценки гемодинамики важно различать полную транспозицию магистральных сосудов и корригированную. При корригированной транспозиции аорты и легочной артерии имеет место желудочково-артериальная и предсердно-желудочковая дискордантность. Другими словами, корригированная транспозиция магистральных сосудов сочетается с инверсией желудочков, поэтому внутрисердечная гемодинамика осуществляется в физиологическом направлении: в аорту поступает артериальная кровь, а в легочную артерию венозная. Характер и выраженность гемодинамических нарушений при корригированной транспозиции магистральных сосудов зависят от сопутствующих пороков – ДМЖП, митральной недостаточности и др.
Полная форма сочетает в себе дискордантные желудочково-артериальные взаимоотношения при конкордантном взаимоотношении других отделов сердца. При полной транспозиции магистральных сосудов венозная кровь из правого желудочка поступает в аорту, разносится по большому кругу кровообращения, а затем вновь поступает в правые отделы сердца. Артериальная кровь выбрасывается левым желудочком в легочную артерию, по ней – в малый круг кровообращения и вновь возвращается в левые отделы сердца.
Во внутриутробном периоде транспозиция магистральных сосудов практически не нарушает фетальное кровообращение, поскольку легочный круг у плода не функционирует; циркуляция крови осуществляется по большому кругу через открытое овальное окно или открытый артериальный проток. После рождения жизнь ребенка с полной транспозицией магистральных сосудов зависит от наличия сопутствующих коммуникаций между малым и большим кругом кровообращения (ООО, ДМЖП, ОАП, бронхиальных сосудов), обеспечивающих смешение венозной крови с артериальной. При отсутствии дополнительных пороков дети погибают сразу после рождения.
При транспозиции магистральных сосудов шунтирование крови осуществляется в обоих направлениях: при этом, чем больше размер коммуникации, тем меньше степень гипоксемии. Наиболее благоприятными являются случаи, когда ДМПП или ДМЖП обеспечивают достаточное смешивание артериальной и венозной крови, а наличие умеренного стеноза легочной артерии предотвращает чрезмерную гиперволемию малого круга.
Симптомы транспозиции магистральных сосудов
Дети с транспозицией магистральных сосудов рождаются доношенными, с нормальным или несколько повышенным весом. Сразу после рождения, с началом функционирования отдельного легочного круга кровообращения, нарастает гипоксемия, что клинически проявляется тотальным цианозом, одышкой, тахикардией. При транспозиции магистральных сосудов, сочетающейся с ОАП и коарктацией аорты, выявляется дифференцированный цианоз: синюшность верхней половины тела выражена в большей степени, чем нижней.
Уже в первые месяцы жизни развиваются и прогрессируют признаки сердечной недостаточности: кардиомегалия, увеличение размеров печени, реже – асцит и периферические отеки. При осмотре ребенка с транспозицией магистральных сосудов обращает внимание деформация фаланг пальцев, наличие сердечного горба, гипотрофия, отставание в моторном развитии. При отсутствии стеноза легочной артерии переполнение кровью малого круга кровообращения приводит к частому возникновению повторных пневмоний.
Клиническое течение корригированной транспозиции магистральных сосудов без сопутствующих ВПС длительное время бессимптомное, жалобы отсутствуют, ребенок развивается нормально. При обращении к кардиологу обычно выявляется пароксизмальная тахикардия, атриовентрикулярная блокада, шумы в сердце. При наличии сопутствующих ВПС клиническая картина корригированной транспозиции магистральных сосудов зависит от их характера и степени гемодинамических нарушений.
Диагностика транспозиции магистральных сосудов
Наличие у ребенка транспозиции магистральных сосудов обычно распознается еще в родильном доме. Физикальное обследование выявляет гиперактивность сердца, выраженный сердечный толчок, который смещен медиально, расширенную грудную клетку. Аускультативные данные характеризуются усилением обоих тонов, систолическим шумом и шумом ОАП или ДМЖП.
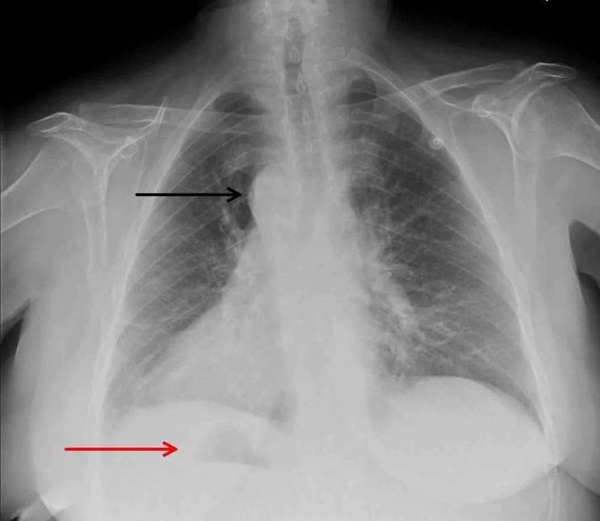
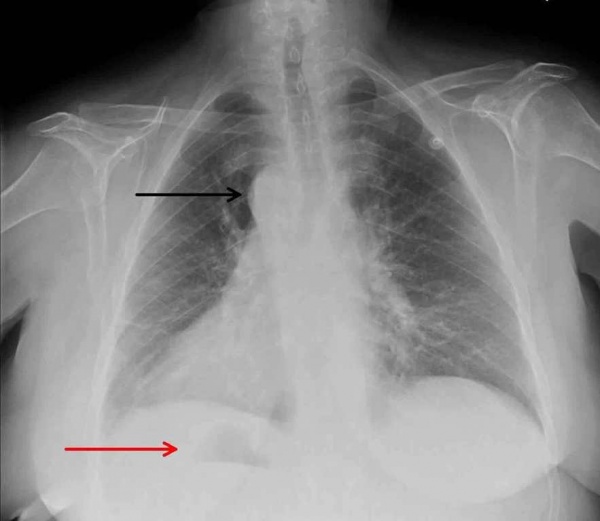
У детей в возрасте 1-1,5 месяцев по ЭКГ обнаруживаются признаки перегрузки и гипертрофии правых отделов сердца. При оценке рентгенографии грудной клетки высокоспецифичными признаками транспозиции магистральных сосудов являются: кардиомегалия, характерная конфигурация тени сердца яйцеобразной формы, узкий сосудистый пучок в переднезадней проекции и расширенный в боковой проекции, левое положение дуги аорты (в большинстве случаев), обеднение рисунка легких при стенозе легочной артерии или его обогащение при дефектах перегородки.
Эхокардиография показывает аномальное отхождение магистральных сосудов, гипертрофию стенок и дилатацию камер сердца, сопутствующие дефекты, наличие стеноза легочной артерии. С помощью пульсоксиметрии и исследования газового состава крови определяются параметры насыщения крови кислородом и парциальное давление кислорода: при транспозиции магистральных сосудов SО2 менее 30%, PaO2 - менее 20 мм рт.ст. При зондировании полостей сердца обнаруживается повышенное насыщение крови кислородом в правом предсердии и желудочке и пониженное в левых отделах сердца; одинаковое давление в аорте и правом желудочке.
Рентгеноконтрастные методы исследования (вентрикулография, атриография, аортография, коронарография) визуализируют патологическое поступление контраста из левых отделов сердца в легочную артерию, а из правых - в аорту; сопутствующие дефекты, аномалии отхождения венечных артерий. Транспозицию магистральных сосудов следует отличать от тетрады Фалло, атрезии легочной артерии, атрезии трикуспидального клапана, гипоплазии левых отделов сердца.
Лечение транспозиции магистральных сосудов
Всем пациентам с полной формой транспозиции магистральных сосудов показано экстренное оперативное лечение. Противопоказанием служат случаи развития необратимой легочной гипертензии. До операции новорожденным проводится медикаментозная терапия простагландином Е1, помогающим сохранить артериальный проток незаращенным и обеспечить адекватный кровоток.
Паллиативные вмешательства при транспозиции магистральных сосудов необходимы в первые дни жизни для увеличения размера естественного или создания искусственного дефекта между малым и большим кругами кровообращения. К такого рода операциям относятся эндоваскулярная баллонная атриосептостомия (операция Парка–Рашкинда) и открытая атриосептэктомия (резекция межпредсердной перегородки по Блелоку–Хенлону).
К числу гемокорригирующих вмешательств, выполняемых при транспозиции магистральных сосудов, относятся операции Мастарда и Сеннинга - внутрипредсердное переключение потоков артериальной и венозной крови с помощью синтетической заплаты. При этом топография магистральных артерий остается прежней, по внутрипредсердному туннелю из легочных вен кровь поступает в правое предсердие, а из полых вен - в левое.
Варианты анатомической коррекции транспозиции магистральных сосудов включают различные способы артериального переключения: операцию Жатене (пересечение и ортотопическую реплантацию магистральных сосудов, перевязку ОАП), операцию Растелли (пластику ДМЖП и устранение стеноза легочной артерии), артериальное переключение с пластикой МЖП. Специфическими послеоперационными осложнениями, сопровождающими коррекцию транспозиции магистральных сосудов, могут служить СССУ, стеноз устьев легочных и полых вен, стеноз выносящих трактов желудочков.
Прогноз транспозиции магистральных сосудов
Полная транспозиция магистральных сосудов – критический, несовместимый с жизнью порок сердца. При отсутствии специализированной кардиохирургической помощи половина новорожденных погибает в первый месяц жизни, более 2/3 детей – к 1 году от тяжелой гипоксии, недостаточности кровообращения и нарастания ацидоза.
Хирургическая коррекция простой транспозиции магистральных сосудов позволяет достичь хороших отдаленных результатов в 85–90% случаев; при сложной форме порока – в 67% случаев. После операций пациенты нуждаются в наблюдении кардиохирурга, ограничении физических нагрузок, профилактике инфекционного эндокардита. Важное значение имеет пренатальное выявление транспозиции магистральных сосудов с помощью фетальной ЭхоКГ, соответствующее ведение беременности и подготовка к родам.
В некоторых наблюдениях, наоборот, отмечают повышенное беспокойство пациентов, связанное с гипоксией ЦНС. При сочетании транспозиции магистральных сосудов с предуктальной коарктацией аорты и ОАП возможен дифференцированный цианоз (нижняя половина туловища более розовая, чем верхняя, так как в нее из легочной артерии через ОАП поступает оксигенированная кровь).
При наличии большого ДМЖП диагноз может быть затруднен в первые несколько дней, так как имеется только незначительный цианоз, сердце остается небольшим, а шум отсутствует. Однако на 2—3-й неделе, по мере снижения резистентности легочных сосудов нарастают симптомы сердечной недостаточности с развитием кардиомегалии, одышки, увеличением печени, хрипами в легких. При ограниченном легочном кровотоке (легочном стенозе) одышка выражена меньше.
Другой причиной сердечной недостаточности является выраженная гипоксия миокарда, так как в коронарные артерии из аорты поступает венозная кровь. Одышечно-цианотические приступы для транспозиции магистральных сосудов нехарактерны.
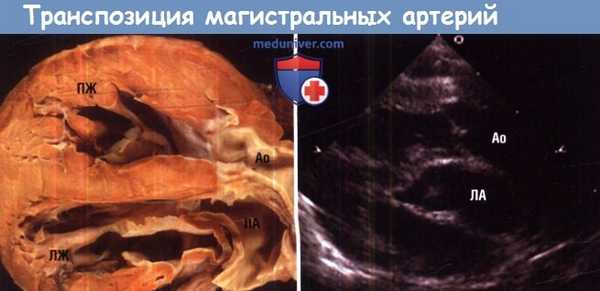
Транспозиция магистральных артерий из парастернальной позиции по длинной оси.
Обратите внимание на параллельное расположение аорты (Ао) и легонной артерии (ЛА).
ЛЖ — левый желудонек; ПЖ — правый желудочек.
Электрокардиограмма неспецифична, у новорожденных соответствует норме с обычным отклонением электрической оси сердца вправо. В последующем могут появиться и персистировать признаки гипертрофии правого желудочка и предсердия. При ДМЖП или ОАП с увеличенным легочным кровотоком появляются симптомы гипертрофии обоих желудочков.
Рентгенографическая картина легких может меняться по мере роста ребенка. У новорожденных легочный рисунок нормальный. К концу первого месяца в большинстве случаев отмечается усиление легочного рисунка по артериальному типу (особенно при сопутствующих ОАП и ДМЖП), реже возникают симптомы венозного застоя. Тень сердца несколько расширена в поперечнике, имеет характерный овоидный вид («яйцо, лежащее на боку») (рис. 4-3, А). Сосудистый пучок в передне-задней проекции узкий, в боковой — широкий. При сопутствующем ДМЖП специфический характер конфигурации сердца теряется.
Эхокардиографическая диагностика основана на идентификации морфологии желудочков и отходящих от них магистральных сосудов. Характерен параллельный ход выводных отделов желудочков и обоих сосудов в проекции длинной оси левого желудочка. При этом определяется отхождение легочной артерии от левого желудочка с наличием митрально-легочного продолжения.
Анализируют также величину и функцию открытого овального окна, наличие ОАП, ДМЖП и легочного стеноза, других сопутствующих патологий (наиболее значимая — коарктация аорты).
Декстрокардия
Декстрокардия — это аномалия внутриутробного развития, при которой большая часть сердца расположена с правой стороны грудной клетки. Изолированная форма патологии протекает бессимптомно и выявляется во время профосмотров. При сочетании декстрокардии с другими пороками отмечаются цианоз или бледность кожи, слабость, судороги. Диагностика включает физикальный осмотр, ЭКГ, эхокардиографию, рентгенографию грудной клетки. При необходимости проводят инвазивные исследования — ангиокардиографию, катетеризацию сердца. Лечение неосложненной декстрокардии не требуется. При наличии угрожающих жизни аномалий назначают их оперативную коррекцию с последующей реабилитацией больных.
МКБ-10
Термин «декстрокардия» образован из двух слов: латинского «dexter» (правый) и греческого «kardia» (сердце). Относится к редким аномалиям: частота встречаемости в разных регионах колеблется от 1:8000 до 1:25000 новорожденных. В России распространенность декстрокардии составляет 3,3% от всех аномалий положения органа. Декстрокардию следует отличать от декстрапозиции сердца — приобретенного патологического состояния, которое возникает при смещении органа (вследствие левостороннего гидроторакса, опухоли, правостороннего ателектаза).
Причины декстрокардии
Развитие заболевания связывают с генетическим дефектом, проявляющимся на этапе внутриутробного формирования органов плода. У страдающих декстрокардией выявлены специфические мутации генов HAND, ZIC3Shh, ACVR2, Pitxz. Наибольшее признание получила теория аутосомно-рецессивного наследования порока: аномальное положение сердца носит семейный характер, повторяется через 1-2 поколения.
Помимо семейной предрасположенности, в процессе мутаций генетического материала доказано участие тератогенных факторов. Экзогенные тератогены подразделяются на 3 основных группы по характеру воздействия:
- физические (ионизирующее излучение);
- химические (алкоголь, лекарственные препараты);
- биологические (бактериальные и вирусные инфекции).
Эндогенные причины включают гинекологические и экстрагенитальные заболевания беременной, тяжелые токсикозы.
Патогенез
В основе декстрокардии лежит нарушение процессов эмбриогенеза на ранних стадиях внутриутробного развития. В норме на 1-2 месяце беременности формирующаяся сердечная трубка начинает изгибаться влево. При наличии типичных для декстрокардии мутаций происходит аномальное искривление этой трубки в правую сторону. При этом нарушается дальнейшее формирование эмбриона, может изменяться позиция других висцеральных органов, чаще всего печени и селезенки.
Классификация
С учетом особенностей закладки органа в эмбриональном периоде выделяют 3 варианта аномалии:
- правосформированное праворасположенное сердце (изолированная декстрокардия);
- левосформированное праворасположенное («зеркальная» форма);
- неопределенно сформированное праворасположенное.
Врачи-кардиологи при изучении вопроса аномалии положения сердца используют классификацию, которая учитывает локализацию других органов. Варианты декстрокардии:
- Простая инверсия сердца. Форма аномалии, при которой наблюдается зеркальное расположение сердца, однако анатомия других органов грудной и брюшной полостей не изменена. Встречается крайне редко.
- Частичная инверсия внутренних органов. При таком варианте декстрокардии аномально расположены сердце и ряд внутренних органов. Чаще вправо перемещены селезенка, печень.
- Тотальня инверсия внутренних органов. Декстрокардия, которая сопровождается обратным расположением всех органов грудной клетки и живота. Редкая аномалия, которая выявляется с частотой 1 случай на 15-20 тысяч населения.
Симптомы декстрокардии
Изолированная форма, которая не сочетается с другими сердечными аномалиями, не имеет клинических проявлений. Специфические жалобы обычно отсутствуют. Состояние обнаруживается в детском или взрослом возрасте при проведении профилактических осмотров, обращении за врачебной помощью по другой причине. Люди с декстрокардией чаще других страдают болезнями нижних дыхательных путей: трахеитами, бронхитами.
Клинические симптомы возникают при наличии других аномалий висцеральных органов или возникновении на фоне декстрокардии кардиальной патологии. Пациенты ощущают постоянную слабость и повышенную утомляемость, не проходящую после сна. Их периодически беспокоят приступы учащенного сердцебиения, головокружения. Кожные покровы становятся бледными, иногда возникает синеватый оттенок кожи вокруг рта, на пальцах рук.
Сочетание декстрокардии и врожденных сердечных пороков проявляется яркой клинической картиной уже в раннем детском возрасте. Для «белых» пороков характерна постоянная бледность кожи, при «синих» формах наблюдаются акроцианоз или тотальный цианоз. Появляются одышечно-цианотические приступы: ребенок становится беспокойным, кожа холодная, дыхание хриплое и прерывистое.
Осложнения
Неосложненная сердечными пороками декстрокардия не представляет серьезной опасности для жизни и здоровья. При присоединении синдрома Картагенера развивается прогрессирующая дыхательная недостаточность, формируются обширные гнойно-воспалительные очаги в легочной паренхиме. Сложности возникают при оказании неотложной реанимационной или хирургической помощи больным, поскольку зеркальная анатомия затрудняет постановку диагноза.
Если декстрокардия комбинируется с аномалиями формирования сердечных структур или магистральных сосудов, возможны серьезные осложнения. Гемодинамические нарушения при «синих» пороках быстро прогрессируют в течение первых месяцев жизни ребенка. Хроническая гипоксия чревата необратимым повреждением мозга, снижением интеллекта, инвалидностью. При отсутствии квалифицированной кардиохирургической помощи высок риск летального исхода.
Диагностика
Опытный терапевт-кардиолог может заподозрить декстрокардию уже на первичном приеме при физикальном исследовании. В ходе пальпации предсердечной области верхушечный толчок обнаруживается справа от грудины. Перкуторно врач отмечает смещение границ сердечной тупости вправо, при аускультации выслушиваются изменения сердечных тонов. При подозрении на декстрокардию назначают полное обследование, в которое включены следующие методы:
- ЭКГ. Электрокардиография является наиболее простым и информативным исследованием для подтверждения декстрокардии. На кардиограмме отмечаются отклонение электрической оси сердца вправо, отрицательные зубцы Р и Т, высокоамплитудные зубцы R в правых грудных отведениях.
- Рентгенография ОГК. На рентгенограмме визуализируется смещение сердечной тени вправо, при комбинированных аномалиях изменяются контуры магистральных сосудов. Чтобы подтвердить транспозицию проводится рентгенография органов брюшной полости.
- УЗИ сердца и сосудов. Эхокардиография выполняется для оценки функциональной способности аномально расположенного сердца. На ЭхоКГ видна структура сердечной стенки, скорость кровотока, фракция выброса.
- Дополнительные исследования. В качестве подготовки к хирургической коррекции пороков развития показаны ангиокардиография или катетеризация сердечных полостей. Для выявления сопутствующих патологий зеркально расположенных внутренних органов рекомендуют КТ брюшной полости.

Лечение
Консервативная терапия
Аномальное расположение сердца без дополнительных заболеваний не сопровождается расстройствами гемодинамики и не требует лечения. При развитии сердечно-сосудистых заболеваний терапию проводят так же, как и для больных с отсутствием декстрокардии. При сочетании аномалии с синдромом Картагенера назначается симптоматическая терапия, предполагающая прием ингаляционных и топических назальных кортикостероидов, бета-адреномиметиков.
Хирургическое лечение
Оперативное вмешательство показано при сочетанных пороках развития сердца, транспозиции магистральных сосудов. Срок выполнения операции устанавливают с учетом вида порока и тяжести нарушений гемодинамики. Если угрожающие жизни состояния отсутствуют, хирургическую коррекцию откладывают до 3-6-летнего возраста ребенка. Когда декстрокардия сочетается с тяжелыми пороками (например, тетрадой Фалло), вмешательство проводят в максимально ранние сроки.
Реабилитация
В современной кардиологии применяют трехэтапную реабилитационную программу для пациентов, которые перенесли операцию по коррекции аномалий сердечно-сосудистой системы. Медицинский этап занимает первые дни-недели после хирургического вмешательства. Затем приступают к физической и психофизиологической реабилитации, которая включает массаж, ЛФК, физиотерапию. Заключительный этап — социально-трудовая реабилитация взрослых больных.
Прогноз и профилактика
Изолированные формы декстрокардии не влияют на качество жизни, не повышают риск развития других заболеваний. Прогноз благоприятный. Комбинированные пороки протекают более тяжело, но при проведении своевременного и комплексного лечения удается добиться полной медицинской и социальной реабилитации пациентов. Профилактические мероприятия направлены на устранение тератогенных факторов, медико-генетическое консультирование беременных.
3. Декстрокардия с транспозицией органов (situs inversus). Е. Г. Несукай, С. В. Федькив, Н. С. Поленова, А. А. Даниленко// Здоровье Казахстана. – 2016.
4. Организационное планирование третьего этапа реабилитации детей с врожденными пороками сердца различных возрастных групп. Л.А. Бокерия, Е.Б. Милиевская, С.М. Крупянко, М.Н. Неведрова. Менеджер здравоохранения. – 2015.
Читайте также:
