Кровообращение при пороке сердца. Нарушения кровотока при пороке сердца
Добавил пользователь Евгений Кузнецов Обновлено: 24.01.2026
Недостаточность левого желудочка. Гемодинамика при митральном стенозе и митральной недостаточности
а) Недостаточность левого желудочка и развитие отека легких. На ранних стадиях аортального стеноза или недостаточности аортального клапана способность левого желудочка адаптироваться к возросшей нагрузке предотвращает развитие гемодинамических нарушений у больных в состоянии покоя, поэтому патологический процесс может достичь значительной степени, прежде чем больной узнает, что страдает тяжелым сердечным заболеванием (в то время как систолическое давление в левом желудочке в покое уже возросло до 200 мм рт. ст. при аортальном стенозе или систолический объем левого желудочка уже увеличился вдвое при недостаточности аортального клапана).
В дальнейшем, вступив в критическую стадию развития процесса, левый желудочек оказывается не в состоянии обеспечивать потребности организма. Вследствие этого левый желудочек расширяется, сердечный выброс начинает падать; недостаточность левого желудочка ведет к застою крови в левом предсердии и в легких. Давление в левом предсердии нарастает, и если оно превысит 25-40 мм рт. ст., развивается отек легких.
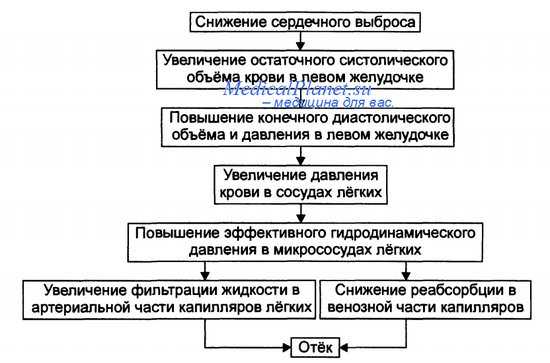
Схема развития отека легких при сердечной недостаточности
б) Гемодинамика при митральном стенозе и митральной недостаточности. При митральном стенозе затруднено движение крови из левого предсердия в левый желудочек, а при митральной недостаточности часть крови, которая заполняет левый желудочек во время диастолы, возвращается во время систолы назад в левое предсердие, вместо того чтобы поступать в аорту. Следовательно, и в том, и в другом случаях уменьшается эффективное движение крови из левого предсердия в левый желудочек.
1. Отек легких при пороках митрального клапана. Переполнение кровью левого предсердия сопровождается повышением внутрипредсердного давления, что в результате приводит к тяжелому отеку легких. Обычно смертельный отек легких не возникает до тех пор, пока давление в левом предсердии не превысит 25-40 мм рт. ст., потому что лимфатическая система легких компенсаторно увеличивается в несколько раз и чрезвычайно быстро отводит жидкость от легочной ткани.
2. Расширение левого предсердия и развитие фибрилляции предсердий. Высокое давление в левом предсердии при пороках митрального клапана ведет к прогрессирующему увеличению полости предсердия и растяжению его стенки. При этом значительно увеличивается путь прохождения возбуждающего импульса по миокарду предсердия, согласно механизму изложенному в отдельной статье на сайте - просим вас пользоваться формой поиска выше. Таким образом, на поздних стадиях порока митрального клапана (особенно при митральном стенозе), как правило, развивается фибрилляция предсердий. Это еще больше снижает эффективность насосной функции сердца и ускоряет развитие сердечной недостаточности.
3. Компенсаторные механизмы на ранних стадиях порока митрального клапана. Так же, как при развитии приобретенных пороков аортального клапана или врожденных пороках сердца, при митральных пороках происходит увеличение объема крови в организме. Причиной этого является уменьшение экскреции соли и воды почками. Увеличение объема крови ведет к повышению венозного возврата крови к сердцу, что способствует компенсации сниженной насосной функции сердца. Благодаря компенсаторным процессам сердечный выброс долгое время сохраняется на достаточном уровне и падает только на поздних стадиях развития заболевания, несмотря на повышение давления в левом предсердии.
Поскольку давление в левом предсердии растет, кровоток в сосудистой системе легких замедляется, начинается застой крови в легких. Кроме того, начинающийся отек легких вызывает сужение легочных артериол. Оба эти фактора ведут к увеличению систолического давления в легочной артерии и в правом желудочке сердца иногда до 60 мм рт. ст., что в 2 раза выше нормы. Развивается гипертрофия правого желудочка, что частично компенсирует растущую нагрузку на правые отделы сердца.
Врожденные пороки сердца
Врожденные пороки сердца – группа заболеваний, объединенных наличием анатомических дефектов сердца, его клапанного аппарата или сосудов, возникших во внутриутробном периоде, приводящих к изменению внутрисердечной и системной гемодинамики. Проявления врожденного порока сердца зависят от его вида; к наиболее характерным симптомам относятся бледность или синюшность кожных покровов, шумы в сердце, отставание в физическом развитии, признаки дыхательной и сердечной недостаточности. При подозрении на врожденный порок сердца выполняется ЭКГ, ФКГ, рентгенография, ЭхоКГ, катетеризация сердца и аортография, кардиография, МРТ сердца и т. д. Чаще всего при врожденных пороках сердца прибегают к кардиохирургической операции – оперативной коррекции выявленной аномалии.
Общие сведения
Врожденные пороки сердца - весьма обширная и разнородная группа заболеваний сердца и крупных сосудов, сопровождающихся изменением кровотока, перегрузкой и недостаточностью сердца. Частота встречаемости врожденных пороков сердца высока и, по оценке различных авторов, колеблется от 0,8 до 1,2% среди всех новорожденных. Врожденные пороки сердца составляют 10-30% всех врожденных аномалий. В группу врожденных пороков сердца входят как относительно легкие нарушения развития сердца и сосудов, так и тяжелые формы патологии сердца, несовместимые с жизнью.
Многие виды врожденных пороков сердца встречаются не только изолированно, но и в различных сочетаниях друг с другом, что значительно утяжеляет структуру дефекта. Примерно в трети случаев аномалии сердца сочетаются с внесердечными врожденными пороками ЦНС, опорно-двигательного аппарата, ЖКТ, мочеполовой системы и пр.
К наиболее частым вариантам врожденных пороков сердца, встречающимся в кардиологии, относятся дефекты межжелудочковой перегородки (ДМЖП – 20%), дефекты межпредсердной перегородки (ДМПП), стеноз аорты, коарктация аорты, открытый артериальный проток (ОАП), транспозиция крупных магистральных сосудов (ТКС), стеноз легочной артерии (10-15% каждый).
Причины врожденных пороков сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
Внутриутробное поражение плода вирусом краснухи наиболее часто вызывает триаду аномалий – глаукому или катаракту, глухоту, врожденные пороки сердца (тетраду Фалло, транспозицию магистральных сосудов, открытый артериальный проток, общий артериальный ствол, клапанные пороки, стеноз легочной артерии, ДМЖП и др.). Также обычно имеют место микроцефалия, нарушение развития костей черепа и скелета, отставание в умственном и физическом развитии.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.
Классификация врожденных пороков сердца
Существует несколько вариантов классификаций врожденных пороков сердца, в основу которых положен принцип изменения гемодинамики. С учетом влияния порока на легочный кровоток выделяют:
- врожденные пороки сердца с неизмененным (либо незначительно измененным) кровотоком в малом круге кровообращения: атрезия аортального клапана, стеноз аорты, недостаточность легочного клапана, митральные пороки (недостаточность и стеноз клапана), коарктация аорты взрослого типа, трехпредсердное сердце и др.
- врожденные пороки сердца с увеличенным кровотоком в легких: не приводящие к развитию раннего цианоза (открытый артериальный проток, ДМПП, ДМЖП, аортолегочный свищ, коарктация аорты детского типа, синдром Лютамбаше), приводящие к развитию цианоза (атрезия трехстворчатого клапана с большим ДМЖП, открытый артериальный проток с легочной гипертензией)
- врожденные пороки сердца с обедненным кровотоком в легких: не приводящие к развитию цианоза (изолированный стеноз легочной артерии), приводящие к развитию цианоза (сложные пороки сердца – болезнь Фалло, гипоплазия правого желудочка, аномалия Эбштейна)
- комбинированные врожденные пороки сердца, при которых нарушаются анатомические взаимоотношения между крупными сосудами и различными отделами сердца: транспозиция магистральных артерий, общий артериальный ствол, аномалия Тауссиг-Бинга, отхождение аорты и легочного ствола из одного желудочка и пр.
В практической кардиологии используется деление врожденных пороков сердца на 3 группы: пороки «синего» (цианотического) типа с веноартериальным шунтом (триада Фалло, тетрада Фалло, транспозиция магистральных сосудов, атрезия трехстворчатого клапана); пороки «бледного» типа с артериовенозным сбросом (септальные дефекты, открытый артериальный проток); пороки с препятствием на пути выброса крови из желудочков (стенозы аорты и легочной артерии, коарктация аорты).
Нарушения гемодинамики при врожденных пороках сердца
В результате выше названных причин у развивающего плода может нарушаться правильное формирование структур сердца, что выражается в неполном или несвоевременном закрытии перепонок между желудочками и предсердиями, неправильном образовании клапанов, недостаточном повороте первичной сердечной трубки и недоразвитии желудочков, аномальном расположении сосудов и т. д. После рождения у части детей остаются открытыми артериальный проток и овальное окно, которые во внутриутробном периоде функционируют в физиологическом порядке.
При врожденных пороках сердца бледного типа с артериовенозным сбросом вследствие гиперволемии развивается гипертензия малого круга кровообращения; при пороках синего типа с веноартериальным шунтом у больных имеет место гипоксемия.
Около 50% детей с большим сбросом крови в малый круг кровообращения погибают без кардиохирургической помощи на первом году жизни от явлений сердечной недостаточности. У детей, перешагнувших этот критический рубеж, сброс крови в малый круг уменьшается, самочувствие стабилизируется, однако постепенно прогрессируют склеротические процессы в сосудах легких, обусловливая легочную гипертензию.
При цианотических врожденных пороках сердца венозный сброс крови или ее смешение приводит к перегрузке большого и гиповолемии малого круга кровообращения, вызывая снижение насыщения крови кислородом (гипоксемию) и появление синюшности кожи и слизистых. Для улучшения вентиляции и перфузии органов развивается коллатеральная сеть кровообращения, поэтому, несмотря на выраженные нарушения гемодинамики, состояние больного может длительное время оставаться удовлетворительным. По мере истощения компенсаторных механизмов, вследствие длительной гиперфункции миокарда, развиваются тяжелые необратимые дистрофические изменения в сердечной мышце. При цианотических врожденных пороках сердца оперативное вмешательство показано уже в раннем детском возрасте.
Симптомы врожденных пороков сердца
Клинические проявления и течение врожденных пороков сердца определяется видом аномалии, характером нарушений гемодинамики и сроками развития декомпенсации кровообращения.
У новорожденных с цианотическими врожденными пороками сердца отмечается цианоз (синюшность) кожных покровов и слизистых оболочек. Синюшность усиливается при малейшем напряжении: сосании, плаче ребенка. Белые пороки сердца проявляются побледнением кожи, похолоданием конечностей.
Дети с врожденными пороками сердца обычно беспокойные, отказываются от груди, быстро устают в процессе кормления. У них появляется потливость, тахикардия, аритмии, одышка, набухание и пульсация сосудов шеи. При хроническом нарушении кровообращения дети отстают в прибавлении веса, росте и физическом развитии. При врожденных пороках сердца обычно сразу поле рождения выслушиваются сердечные шумы. В дальнейшем обнаруживаются признаки сердечной недостаточности (отеки, кардиомегалия, кардиогенная гипотрофия, гепатомегалия и др.).
Осложнениями врожденных пороков сердца могут стать бактериальный эндокардит, полицитемия, тромбозы периферических сосудов и тромбоэмболии сосудов головного мозга, застойные пневмонии, синкопальные состояния, одышечно-цианотические приступы, стенокардитический синдром или инфаркт миокарда.
Диагностика врожденных пороков сердца
Выявление врожденных пороков сердца осуществляется путем комплексного обследования. При осмотре ребенка отмечают окраску кожных покровов: наличие или отсутствие цианоза, его характер (периферический, генерализованный). При аускультации сердца нередко выявляется изменение (ослабление, усиление или расщепление) сердечных тонов, наличие шумов и пр. Физикальное обследование при подозрении на врожденный порок сердца дополняется инструментальной диагностикой - электрокардиографией (ЭКГ), фонокардиографией (ФКГ), рентгенографией органов грудной клетки, эхокардиографией (ЭхоКГ).
ЭКГ позволяет выявить гипертрофию различных отделов сердца, патологическое отклонение ЭОС, наличие аритмий и нарушений проводимости, что в совокупности с данными других методов клинического обследования позволяет судить о тяжести врожденного порока сердца. С помощью суточного холтеровского ЭКГ-мониторирования обнаруживаются скрытые нарушения ритма и проводимости. Посредством ФКГ более тщательно и детально оценивается характер, длительность и локализация сердечных тонов и шумов. Данные рентгенографии органов грудной клетки дополняют предыдущие методы за счет оценки состояния малого круга кровообращения, расположения, формы и размеров сердца, изменений со стороны других органов (легких, плевры, позвоночника). При проведении ЭхоКГ визуализируются анатомические дефекты перегородок и клапанов сердца, расположение магистральных сосудов, оценивается сократительная способность миокарда.
При сложных врожденных пороках сердца, а также сопутствующей легочной гипертензии, с целью точной анатомической и гемодинамической диагностики, возникает необходимость в выполнении зондирования полостей сердца и ангиокардиографии.
Лечение врожденных пороков сердца
Наиболее сложной проблемой в детской кардиологии является хирургическое лечение врожденных пороков сердца у детей первого года жизни. Большинство операций в раннем детском возрасте выполняется по поводу цианотических врожденных пороков сердца. При отсутствии у новорожденного признаков сердечной недостаточности, умеренной выраженности цианоза операция может быть отложена. Наблюдение за детьми с врожденными пороками сердца осуществляют кардиолог и кардиохирург.
Специфическое лечение в каждом конкретном случае зависит от разновидности и степени тяжести врожденного порока сердца. Операции при врожденных дефектах перегородок сердца (ДМЖП, ДМПП) могут включать пластику или ушивание перегородки, рентгенэндоваскулярную окклюзию дефекта. При наличии выраженной гипоксемии детям с врожденными пороками сердца первым этапом выполняется паллиативное вмешательство, предполагающее наложение различного рода межсистемных анастомозов. Подобная тактика улучшает оксигенацию крови, уменьшает риск осложнений, позволяет провести радикальную коррекцию в более благоприятных условиях. При аортальных пороках выполняется резекция или баллонная дилатация коарктации аорты, пластика аортального стеноза и др. При ОАП производится его перевязка. Лечение стеноза легочной артерии заключается в проведении открытой или эндоваскулярной вальвулопластики и т. д.
Анатомически сложные врожденные пороки сердца, при которых радикальная операция не представляется возможной, требуют выполнения гемодинамической коррекции, т. е. разделения артериального и венозного потоков крови без устранения анатомического дефекта. В этих случаях могут проводиться операции Фонтена, Сеннинга, Мастарда и др. Серьезные пороки, не поддающиеся оперативному лечению, требуют проведения пересадки сердца.
Консервативное лечение врожденных пороков сердца может включать в себя симптоматическую терапию одышечно-цианотических приступов, острой левожелудочковой недостаточности (сердечной астмы, отека легких), хронической сердечной недостаточности, ишемии миокарда, аритмий.
Прогноз и профилактика врожденных пороков сердца
В структуре смертности новорожденных врожденные пороки сердца занимают первое место. Без оказания квалифицированной кардиохирургической помощи в течение первого года жизни погибает 50-75% детей. В периоде компенсации (2-3 года) смертность снижается до 5%. Ранее выявление и коррекция врожденного порока сердца позволяет существенно улучшить прогноз.
Профилактика врожденных пороков сердца требует тщательного планирования беременности, исключения воздействия неблагоприятных факторов на плод, проведения медико-генетического консультирования и разъяснительной работы среди женщин групп риска по рождению детей с сердечной патологией, решения вопроса о пренатальной диагностике порока (УЗИ, биопсия хориона, амниоцентез) и показаниях к прерыванию беременности. Ведение беременности у женщин с врожденными пороками сердца требует повышенного внимания со стороны акушера-гинеколога и кардиолога.
Пороки сердца у беременных
Пороки сердца у беременных — это врожденные или приобретенные анатомические аномалии сердечных клапанов, отверстий, внутрикардиальных перегородок, аорты и легочной артерии, течение которых может осложниться при гестации или ухудшить ее прогноз. Проявляются слабостью, утомляемостью, сонливостью, тяжестью в ногах, одышкой, сердцебиениями, периферическими отеками, сухим кашлем. Диагностируются при помощи эхокардиографии, ЭКГ, фонокардиографии. Для лечения используют антибиотики, гликозиды, диуретики, периферические вазодилалаторы, β-адреноблокаторы, антитромботические средства. Операции выполняют в исключительных случаях по показаниям.
МКБ-10
Причины
Аномалии строения клапанного аппарата, перегородок, отверстий и отходящих магистральных сосудов обычно возникают задолго до начала гестации. Однако изменения гемодинамики, характерные для периода беременности, могут проявить кардиологическое заболевание или усугубить его клиническую картину. Наиболее распространенными причинами пороков сердца, обнаруживаемых у беременных, являются:
- Воспаление эндокарда и миокарда. В 80-85% случаев аномалии строения сердца развиваются вследствие ревматического поражения. Реже они становятся результатом инфекционного эндокардита другого генеза, сифилиса, специфических воспалительных изменений при диффузных заболеваниях соединительной ткани (склеродермии, системной красной волчанке, ревматоидном артрите).
- Врожденные дефекты. До 7,3-8,0% кардиальных пороков являются дизэмбриогенетическими либо наследуемыми по аутосомно-рецессивному, аутосомно-доминантному типам. Чаще других у беременных наблюдаются признаки открытого аортального протока, дефектов межпредсердной и межжелудочковой перегородок, стеноза легочной артерии, коарктации аорты, транспозиции магистральных сосудов.
У некоторых пациенток вторичная функциональная недостаточность клапанов возникает на фоне кардиологических заболеваний, которые сопровождаются перегрузкой желудочков или расширением фиброзного кольца клапанных структур (гипертонической болезнью, симптоматической артериальной гипертензией, дилатационной кардиомиопатией, кардиосклерозом, инфарктом миокарда).
Патогенез
Механизм развития патологических проявлений при пороках сердцах у беременных зависит от особенностей конкретной аномалии, однако в гестационном периоде возникает ряд общих нагрузочных и адаптационных гемодинамических факторов, влияющих на течение сердечно-сосудистого заболевания. С 10 по 32 неделю объем крови, циркулирующей в сосудистом русле, увеличивается на 30-35%, что в сочетании с повышением гидростатического капиллярного давления приводит к возрастанию количества внеклеточной жидкости на 5-6 л. Одновременно с этим усиливается работа левого желудочка, что сопровождается увеличением ударного и минутного объемов на 35-50%, ростом систолического и пульсового давления, снижением диастолического давления на руках. В конце второго-третьем триместрах возникает физиологическая тахикардия до 85-90 сокращений сердца в минуту.
Классификация
В зависимости от происхождения пороки сердца, выявляемые у беременных, бывают врожденными и приобретенными. С учетом локализации различают изолированные митральные, аортальные, трикуспидальные аномалии, повреждения клапанов легочной артерии, дефекты внутрисердечных перегородок, комбинированные и сочетанные поражения. По характеру патологических изменений выделяют стеноз (сужение), недостаточность (расширение), аномальные отверстия, транспозиции сосудов.
Большое прогностическое значение в систематизации пороков имеет выраженность сердечной недостаточности: при I (скрытой) стадии ее признаки появляются только при физических нагрузках, при IIА отмечаются умеренно выраженные симптомы в покое, усиливающиеся при движении, при IIБ — в покое определяются значительные нарушения гемодинамики, для III (дистрофической) характерны органные метаболические расстройства. На основании этого критерия различают четыре степени риска осложнений у беременных, страдающих пороками сердца:
- Iстепень. Риск отсутствует. Признаков сердечной недостаточности нет, давление в легочной артерии нормальное, ревматический процесс неактивен. Отделы сердца и толщина миокарда не изменены. Вероятность осложненного течения гестации не отличается от показателей в общей популяции. Беременность не противопоказана.
- IIстепень. Умеренно повышенный риск. Отмечаются скрытая сердечная недостаточность и I степень активности ревматизма, умеренное увеличение давления в системе легочной артерии. Отделы сердца незначительно или умеренно утолщены и дилатированы. Беременность допускается, но возможно ухудшение состояния пациентки.
- IIIстепень. Высокий риск акушерских и кардиологических осложнений. Определяются сердечная недостаточность IIА ст., ревматизм II-III степени активности, легочная гипертензия, нарушения ритма. Отделы сердца гипертрофированы и расширены. Большинству пациенток гестацию рекомендуется прервать до 12 недели.
- IVстепень. Крайне высокий риск материнской летальности из-за кардиологических и акушерских осложнений. Диагностируется сердечная недостаточность IIБ-III ст., значительная легочная гипертензия, выраженная систолическая дисфункция левого желудочка, цианоз. Беременность обычно прерывают независимо от сроков.
Симптомы пороков сердца у беременных
Клинические признаки зависят от типа анатомических дефектов, длительности заболевания и функциональной состоятельности миокарда. Пациентки с кардиологическими пороками жалуются на повышенную утомляемость, сонливость, ощущение слабости в мышцах, тяжесть в ногах. При нагрузках наблюдаются одышка, перебои, сердцебиения. У больных с выраженной недостаточностью кровообращения перечисленные симптомы также отмечаются в покое. Возможно появление бледности или цианотичности кожных покровов, отеков в области стоп, голеностопных суставов, голеней, возникновение приступов сердечной астмы с сухим кашлем или откашливанием небольшого количества слизистой мокроты, иногда содержащей прожилки крови.
Осложнения
Пороки со значительной декомпенсацией работы сердца являются ведущей причиной материнской смертности, которая может достигать 150-200 случаев на 100 тыс. живорождений, занимают второе место по показателям перинатальной летальности (12-29%). Основные акушерские осложнения при аномалиях строения сердца — самопроизвольные аборты, преждевременные роды, ранний токсикоз, гестозы, HELLP-синдром, дискоординация и слабость родовой деятельности, коагулопатические кровотечения в послеродовом периоде. Практически у каждой пятой беременной несвоевременно изливаются околоплодные воды.
В каждом втором случае беременности (кроме пациенток с риском I степени) отмечаются признаки задержки развития и гипоксии плода, вызванные хронической плацентарной недостаточностью. У женщин, имеющих врожденные сердечные аномалии, чаще рождаются дети с такой же кардиологической патологией. При пороках сердца повышается вероятность развития клинически значимых нарушений ритма, требующих специальной терапии, сердечно-сосудистых осложнений (тромбоэмболии, инфаркта миокарда, инсульта), эндокардита.
Диагностика
Поскольку врожденные и приобретенные пороки сердца могут протекать субклинически, в 27% случаев они впервые диагностируются именно в период беременности. Кроме традиционных физикальных исследований (перкуссии и аускультации сердца) при постановке диагноза используют современные инструментальные методы, позволяющие визуализировать анатомические дефекты и оценить функциональные возможности сердечно-сосудистой системы. Наиболее информативными для диагностики пороков сердца у беременных считаются:
- Эхокардиография. Совокупное использование различных УЗИ-методик (одномерной и двухмерной ЭхоКГ), доплеровского сканирования дает возможность исследовать состояние клапанного аппарата, оценить толщину сердечных стенок и объем полостей, выполнить фазовый анализ и оценку сократимости. С помощью этого метода также определяются пороки крупных сосудов (грудной аорты и др.).
- Электрокардиография. ЭКГ применяют для скрининга нарушений частоты и регулярности сердечного ритма, изменений проводимости, выявления возможных острых и хронических повреждений миокарда, осложняющих клиническую картину и ухудшающих прогноз беременности при пороке сердца. По показаниям исследование дополняют суточным мониторированием ЭКГ и фонокардиографией.
Из-за возможных повреждающих воздействий на плод беременным с анатомическими пороками сердца не рекомендуется проводить рентгенологические исследования и МРТ. В порядке исключения при подготовке к кардиовмешательствам допустимо зондирование полостей сердца. Для оценки состояния электролитного баланса и свертывающей системы показано определение концентрации калия и натрия в сыворотке крови, коагулограмма. Дифференциальная диагностика проводится с функциональными шумами в сердце при анемии, вегетососудистой дистонии, ИБС с развитием аневризмы, гипертонической болезнью у беременных, миокардитом, токсическими кардиомиопатиями, миокардиодистрофией, кардиомегалией. Кроме акушера-гинеколога к сопровождению беременной привлекается кардиолог. При необходимости пациентку осматривают кардиохирург, ревматолог, инфекционист, невропатолог, гематолог.
Лечение пороков сердца у беременных
При кардиологических пороках существует три критических периода гестации, во время которых рекомендована плановая госпитализация. На 10-12 неделях возможно обострение ревматизма за счет физиологического снижения иммунитета и уменьшения секреции кортикостероидов. Именно на этом сроке принимается решение о возможности пролонгации беременности. На 26-32 неделях сердечно-сосудистая система пациентки испытывает наибольшие нагрузки, что требует дополнительной коррекции терапии. За 2-3 недели до родов возможно развитие или усугубление сердечной недостаточности под действием перегрузочных гемодинамических факторов, которые следует учитывать при выборе способа родоразрешения.
Основными терапевтическими задачами являются профилактика акушерских осложнений, купирование обострений и рецидивов у больных ревматизмом, предупреждение расстройств ритма и проводимости. Адекватное медикаментозное лечение является предпочтительным для ведения большинства беременных женщин с пороками сердца, включая пациенток с сердечной недостаточностью. Лекарственные средства для фармакотерапии подбираются кардиологом индивидуально. Обычно беременным назначаются:
- Антибактериальная терапия. 10-14-дневные профилактические курсы полусинтетических пенициллинов показаны женщинам с ревматическими пороками из I и II групп риска. Антибиотики применяют по показаниям с учетом активности ревматического процесса и при необходимости дополняют глюкокортикоидами.
- Тиазидные и петлевые диуретики. Обеспечивают уменьшение объема циркулирующей крови при недостаточной сократительной активности желудочков. При левожелудочковой недостаточности средства комбинируют с препаратами, которые уменьшают приток крови в камеры сердца, и периферическими вазодилататорами.
- Сердечные гликозиды. При отсутствии легочной гипертензии такие медикаменты поддерживают сердечный выброс и адекватную перфузию различных органов и систем, в том числе фетоплацентарного комплекса. С помощью гликозидов также можно купировать тахисистолическую фибрилляцию предсердий.
- Нитраты. Благодаря депонированию крови в венах большого круга кровообращения средства этой группы снижают преднагрузку на сердце, что позволяет уменьшить признаки венозной легочной гипертензии и застоя крови в малом круге. Недостатком применения нитратов является возможное уменьшение сердечного выброса.
- β-адреноблокаторы. Препараты, снижающие силу сокращений миокарда, рекомендованы беременным с синусовой тахикардией, при которой увеличивается давление в полости левого предсердия, возникает застой крови в легочном круге кровообращения. Могут применяться при тахисистолической фибрилляции предсердий.
- Антикоагулянты. С учетом срока беременности и результатов тромбоэластограммы женщинам с сердечными пороками назначают низкомолекулярные гепарины, антиагреганты в комбинации с периферическими вазодилататорами, улучшающими капиллярный кровоток. Во время родов введение гепарина прекращают.
При наличии показаний выполняются малоинвазивные операции (эндоваскулярная баллонная дилатация аортального стеноза и пр.) и закрытая митральная комиссуротомия. Открытые хирургические вмешательства по протезированию клапанов с выключением естественного кровообращения проводятся только при угрозе жизни женщины и невозможности чрескожной коррекции аномалии.
При наличии порока сердца предпочтительны программированные естественные роды в дневное время суток с введением гормонально-энергетического комплекса для профилактики аномальной родовой деятельности и максимальным нарастающим обезболиванием с использованием масочного наркоза и эпидуральной анальгезии. Для бережного родоускорения применяется амниотомия. В родах допустимо назначение утеротоников, спазмолитиков, антигипоксантов. Потуги в период изгнания выключаются при высокой активности ревматизма, комбинированных и сочетанных пороках, стенозах, нарушениях кровообращения.
При обнаружении активного ревматического процесса, признаков нарушения кровообращений, развитии поздних гестозов, плацентарной недостаточности с хронической гипоксией или задержкой развития плода родоразрешение выполняется досрочно на 34-37 неделях. Абсолютными показаниями к проведению кесарева сечения являются терапевтически резистентная прогрессирующая сердечная недостаточность, III степень активности ревмокардита, аневризма аорты, коарктация аорты с выраженной гипертензией, полное нарушение атриовентрикулярной проводимости, использование искусственного водителя ритма, подострое течение септического эндокардита, пороки с нагрузкой преимущественно на левые отделы сердца, сопутствующая акушерская патология (крупный плод, узкий таз, неправильное положение ребенка).
Прогноз и профилактика
Исход беременности и родов при пороках сердца зависит от варианта анатомического дефекта, наличия нарушений кровообращения, активности ревматизма (при аномалиях ревматического происхождения). Абсолютными противопоказаниями к вынашиванию ребенка считаются сочетанные и комбинированные виды пороков, единый желудочек, коарктация аорты, выраженный аортальный стеноз, сочетание анатомических аномалий с бактериальным эндокардитом, тахиаритмией, легочной гипертензией 2-3 степени, синдром Эйзенменгера, синдром Марфана с увеличением диаметра корня аорты более 4,5 см, предшествующая послеродовая кардиомиопатия. Прогноз также ухудшается при выраженных степенях сужения (недостаточности) сердечных клапанов и по мере увеличения возраста беременной – после 30 лет вероятность развития недостаточности кровообращения повышается вдвое.
В остальных случаях при планировании беременности необходимо учитывать рекомендации кардиолога, на прегравидарном этапе максимально компенсировать порок и купировать ревматическую лихорадку, по показаниям выполнить операцию по коррекции порока до зачатия. Беременным показана ранняя постановка на учет в женской консультации, диетотерапия с достаточным потреблением белка, микроэлементов и витаминов, ограничением количества жидкости и поваренной соли. Рекомендованы дозированные физические нагрузки, нормализация режима работы и отдыха, профилактическое использование растительных препаратов с седативным эффектом.
1. Ведение беременных с врожденными пороками сердца/ Волчкова Н.С., Субханкулова С.Ф., Субханкулова А.Ф.// Вестник современной клинической медицины. — 2016 — Т. 9, вып. 4.
3. Врожденные пороки сердца и беременность/ Дашкевич В.Е., Кирильчук М.Е.// Международный медицинский журнал. – 2011 - №1.
Кровообращение при пороке сердца. Нарушения кровотока при пороке сердца
Декомпенсация пороков сердца. Причины нарушения кровообращения при пороках сердца
Нарушение компенсации порока (декомпенсация) развивается из-за ряда причин, подрывающих сложную систему описанных выше физиологических механизмов, которые способствуют сохранению кровообращения на достаточной высоте.
Мы укажем на ряд основных причин, которые приводят к нарушению кровообращения при пороках сердца.
1. В процессе интракардиальной компенсации порока тот или иной отдел сердца гипертрофируется в большей или меньшей степени в зависимости от величины и характера клапанного поражения и от состояния всего организма. Гипертрофированный мускул требует усиленного кровоснабжения и при неблагоприятных обстоятельствах (повышенной психо-физической нагрузке, недостаточном питании и пр.) может оказаться в состоянии гипоксии наряду с другими нарушениями обмена веществ, свойственными утомленной мышце.
2. Условия труда и быта, связанные с определенными психо-физическими напряжениями, предъявляющими ко всему организму, а следовательно, и к сердечно-сосудистому аппарату, повышенные требования, играют известную роль в возникновении декомпенсации. У каждого больного коэфициент напряжения, ведущий к нарушению кровообращения, вполне индивидуален и колеблется в связи с эволюцией патологического процесса в сердце и с изменением состояния организма.
Частным, но весьма существенным моментом, относящимся к условиям труда и быта, является равномерное чередование работы и отдыха на протяжении дня. Надо иметь в виду также достаточность и полноценность сна. Иногда плохо переносят ночную работу больные с пороками сердца.

3. Нарушение питания (недостаточная калорийность пищи, малое количество полноценного белка, авитаминозы, особенно, по-видимому, авитаминозы комплекса В), подрывая питание сердечной мышцы — основного элемента мотора кровообращения, является существенным фактором декомпенсации. Сюда можно отнести и расстройство кроветворения различной этиологии и патогенеза, нарушение обмена веществ (ожирение) и другие процессы, ведущие к «дистрофии» миокарда.
4. Инфекционные болезни, особенно те, при которых чаще всего поражается миокард (тифы, грипп и прежде всего ревматизм и др.), нередко способствуют возникновению декомпенсации порока.
5. Благодаря тесной связи органов кровообращения и дыхания поражение респираторного аппарата нередко влечет тяжелые расстройства кровообращения при пороках сердца: бронхиолиты, массивные пневмонии, экссудативныи плеврит переобременяют главным образом правый желудочек. С. П. Боткин приводит в «Клинических лекциях» случай, когда возникший экссудативный плеврит оказался прямой причиной смертельного исхода.
О значении нервных регуляторных аппаратов мы уже упоминали.
6. Увеличенная частота сердечных сокращений (тахикардия), являясь признаком наступившей декомпенсации, в свою очередь ведет к дальнейшему истощению сократительной способности миокарда, так как укорачивает фазу восстановления (диастолу).
Тахикардия, сопутствующая базедовой болезни, имеет такое же патогенетическое значение в развитии декомпенсации. Однако тиреотоксикоз, воздействуя на нервно-мышечный аппарат сердца и на все формы обмена веществ, безотносительно к тахикардии, влечет расстройство функций сердца и приводит иногда к возникновению мерцательной аритмии, роль которой освещена ниже.
7. Нарушения ритма сердечной деятельности также могут способствовать возникновению декомпенсации порока.
При пороках сердца встречаются все формы нарушений сердечного ритма. Они имеют различные патогенез, достигают различной выраженности, оказывают своеобразное влияние на кровообращение и иногда приводят к декомпенсации порока.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Основной задачей кровообращения является снабжение клеток и тканей организма кровью. Наличие в крови достаточного количества кислорода и способность тканей к его усвоению оказывают мощное воздействие на всю сложную систему механизмов кровообращения.
Между протоплазмодинамикой тканей, напряжением обмена веществ и деятельностью механизмов кровообращения устанавливается постоянная взаимосвязь: с одной стороны, возросшая деятельность организма повышает потребность тканей в питательных продуктах, приносимых с кровью, и предъявляет к сердечно-сосудистой системе повышенные запросы, а с другой — болезненное состояние аппарата кровообращения нарушает нормальную протоплазмодинамику тканей, извращает обмен веществ в них и расстраивает их функцию. При нормальной работе механизмов кровообращения почти вся кровь, притекающая к сердцу во время диастолы, покидает сердце во время систолы, заполняя большой и малый круг кровообращения.
Существует взаимозависимость между продолжительностью диастолы, а следовательно, степенью расширения и наполнения сердца и мощностью его систолы. Состояние миокарда, рациональность затраты им энергетических материалов, что связано с тренированностью организма, может обеспечить при надобности значительное нарастание систолы сердца. Удлинение диастолы важно еще и в том отношении, что в покоящейся мышце происходят процессы ассимиляции нужных для акта сокращения энергетических материалов.

Тренированность организма сказывается в отношении сердца в том, что при физическом усилии нарастающая потребность в количестве циркулирующей крови удовлетворяется увеличением систолического объема крови без учащения ударов сердца, чего не бывает у нетренированного организма. Учащение же сердечных сокращений невыгодно, так как при этом уменьшается диастолическая, репаративная (восстановительная) фаза — фаза отдыха. У спортсменов, как правило, в покое наблюдается заметная брадикардия.
Если отток крови от сердца определяется силой сердечного сокращения и количеством выбрасываемой крови (в среднем 60 мл), а также степенью тонуса артериол, то приток крови к сердцу зависит и от тонуса вен (в связи с нормальным функционированием веномоторного центра), и от добавочных факторов венозного кровообращения (грудного и диафрагмального дыхания, сокращения скелетной мускулатуры и пр.). Нормальное артериальное давление (120/75 мм ртутного столба) и нормальное венозное давление (80—100 мм водяного столба) обеспечиваются правильным соотношением притока и оттока крови при нормальном количестве ударов сердца (65—75 в минуту).
Существенным моментом является достаточная быстрота кровотока и достаточное количество циркулирующей крови, а также способность тканей в нормальном количестве использовать приносимый кровью кислород. При выключении значительного количества циркулирующей крови, скоплении ее в так называемых депо (селезенка, печень, подсосочковые пространства кожи и др.) может нарушиться приток крови к сердцу, что имеет место при шоке и коллапсе.
Читайте также:
- Сочетанные переломы лучевой и локтевой костей. Диагностика и лечение
- Наследственный синдром Меньера: клиника, диагностика и эпидемиология
- Выбор контрацептивов. Гормональные контрацептивы.
- Буциндолол при сердечной недостаточности. Побочные эффекты бета-адреноблокаторов
- Лекарства вызывающие ортостатическую гипотензию
