Лекарства при опухолях. Фармакология онкологических заболеваний
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Зачастую первым и единственным симптомом онкологических заболеваний является боль. Она причиняет пациенту мучения, снижает качество жизни, приводит к депрессивным расстройствам, суицидальным намерениям и действиям.
В «Евроонко» направление медицины боли развито очень хорошо. Наши врачи применяют все доступные методы, в том числе инновационные.
Трехступенчатая система коррекции болевого синдрома
Основным методом лечения боли в онкологии является медикаментозная терапия. В практике работы «Евроонко» используется трехступенчатая система обезболивания из ненаркотических и наркотических анальгетиков, которая позволяет эффективно купировать болевой синдром и держать его под контролем. Мы учитываем рекомендации Всемирного института боли (FIPP WIP, USA), Европейской Федерации Международной Ассоциации Изучения Боли (EF IASP).
Метод заключается в последовательном применении анальгетиков возрастающей силы действия в сочетании с адъювантной терапией по мере увеличения интенсивности боли. Важным принципом является начало фармакотерапии немедленно при появлении первых же признаков боли, пока не развилась сложная цепная реакция, которая приводит к хроническому болевому синдрому. Переход на более сильное обезболивающее производится, когда все препараты предыдущей ступени неэффективны в своих максимальных дозировках.
Виды обезболивающих препаратов
Также в качестве анальгетиков часто применяют кортикостероиды — препараты гормонов коры надпочечников. Они оказывают мощное противовоспалительное действие, особенно важное при болях, вызванных компрессией нерва, при головной боли, обусловленной внутричерепной гипертензией, а также костных болях.
Для каждого пациента препараты подбираются индивидуально, поэтому универсальной схемы не существует.
На любом этапе противоболевой терапии анальгетики необходимо принимать постоянно по часам. Доза корректируется с учетом вида и интенсивности болевых ощущений. Если препарат становится неэффективным, желательно заменить его на альтернативное средство аналогичной силы, но рекомендовать его пациенту, как более мощное.
В качестве анальгетиков часто применяют кортикостероиды — препараты гормонов коры надпочечников. Они оказывают мощное противовоспалительное действие, особенно важное при болях, вызванных компрессией нерва, при головной боли, обусловленной внутричерепной гипертензией, а также костных болях.
Анестезиолог-реаниматолог Вадим Сергеевич Соловьев об опиоидных анальгетиках:

Наши врачи следуют принципам терапии боли, провозглашенным ВОЗ:
- «Через рот» (перорально) — означает, что следует исключить все инъекционные формы анальгетиков, проводить терапию с использованием неинвазивных лекарственных форм (таблетки, капсулы, сиропы, трансдермальные терапевтические системы, ректальные формы препаратов и т. д.).
- «По часам» — анальгетики следует назначать регулярно по схеме, в соответствии с длительностью эффекта препарата, не дожидаясь развития сильной боли, исключая возможность «прорывов» боли.
- «По восходящей» — подбор препаратов для обезболивания осуществляется от неопиоидных анальгетиков при слабой боли, «мягкими» опиоидами при умеренной боли и сильными опиоидными анальгетиками при сильной боли, по мере нарастания интенсивности боли, в соответствии с «лестницей обезболивания ВОЗ»
- «Индивидуальный подход» — предполагает необходимость «индивидуального» подбора анальгетика и основан на селективном выборе наиболее эффективного анальгетика в нужной дозе с наименьшими побочными эффектами для каждого конкретного пациента с учетом особенностей его физического состояния.
- «С вниманием к деталям» — предполагает учет особенностей и деталей каждого пациента, безусловно, назначение ко-анальгетиков и адъювантных средств, по мере возникновения необходимости в них, проведение мониторинга за больными.
Как облегчить боль: описание этапов трехступенчатой схемы
Терапия «слабой боли»
Пациенту назначают неопиоидные анальгетики: НПВС (Ибупрофен, Диклофенак, Кетопрофен и пр.), Парацетамол. При выборе препарата учитываются токсичность для печени и почек, присущие всем неопиоидным анальгетикам, а также токсичность для желудка неселективных НПВС, риски со стороны сердечно-сосудистой системы при применении селективных НПВС. Применение препаратов первой линии целесообразно сопровождать адъювантной и симптоматической терапией: блокаторы ионной помпы, кортикостероиды, спазмолитики, бензодиазепины, антигистаминные препараты и др.

Терапия «умеренной» боли
Пероральный путь введения препаратов является предпочтительным, если пациент может принимать препараты через рот. Для пациентов со слабой или умеренно выраженной болью, у которых адекватный контроль боли не достигается регулярным пероральным приемом парацетамола или нестероидных противовоспалительных препаратов, добавление опиоидного анальгетика может обеспечить достижение эффективного обезболивания без неблагоприятных побочных эффектов. В качестве альтернативы возможно использование низких доз опиоидных анальгетиков (например, морфина, ТТС фентанила).
Терапия «сильной» боли
Как часто возникает боль при раке?
Боль возникает у 30% больных раком, которые получают лечение, и у 60–90% больных в связи с прогрессированием болезни. Основные источники возникновения боли при раке:
- собственно рак (45–90%);
- сопутствующие воспалительные реакции, приводящие к спазму гладкой мускулатуры (11–25%);
- боль в области послеоперационной ране после хирургического вмешательства (5–16%);
- сопутствующая патология, например, поражения суставов, артрит (6–11%), невралгия (5–15%).
Болевые синдромы при раке группируют:
- По происхождению болевого потока: висцеральные, соматические, невропатические, психогенные.
- По качественной субъективной оценке: жгучие, колющие, режущие, сверлящие, пульсирующие.
- По интенсивности: оценивают по специальным шкалам.
- По продолжительности: острые и хронические.
- По локализации: абдоминальные, кардиалгии, люмбалгии, мышечно-суставные и другие.
В связи со значительными различиями механизмов возникновения болевых ощущений, не существует универсального анальгетика для купирования всех видов болевых синдромов. Лечение всегда должно быть индивидуальным.
В чем причина неудач в лечении боли?
В силу отсутствия специальной подготовки по лечению боли даже у онкологов, а также в силу восприятия рака как инкурабельного заболевания, даже врачи-специалисты зачастую не осознают, что болью при раке можно управлять.
У 80–90% пациентов боль можно полностью ликвидировать, а у остальных ее интенсивность можно значительно ослабить. Для этого врачу необходимо учитывать каждый из источников и механизмов боли для подбора адекватной обезболивающей терапии при раке.
В клинической практике мы постоянно сталкиваемся с типичными ошибками при лечении болевого синдрома: неоправданно ранним назначением наркотических анальгетиков, применение чрезмерных дозировок препаратов, несоблюдение режима назначения анальгетиков.
Технологии управления хроническими болевыми синдромами
«Евроонко» оснащена всем необходимым оборудованием, включая индивидуальные носимые помпы, аппараты для дозированного введения. Клиника имеет требуемые законодательством Российской Федерации лицензии и разрешения. У нас функционирует хорошо оснащенное отделение терапии болевых синдромов, в нем работают врачи-специалисты в области медицины боли.

Воспользуйтесь быстрыми ссылками, чтобы узнать об интересующем вас методе обезболивания:
Обезболивание при раке 4 стадии позволяет значительно улучшить качество жизни пациента, уменьшить, а в большинстве случаев предотвратить страдания. Это помогает подарить неизлечимому больному дополнительное время, в течение которого он может активно общаться с родными и близкими, провести последние дни жизни без мучительных симптомов.
Обезболивающие пластыри
Это способ трансдермального введения препарата. Пластырь содержит четыре слоя: защитная полиэфирная пленка, резервуар с действующим веществом (например, с фентанилом), мембрана, корректирующая интенсивность выделения и липкий слой. Пластырь можно наклеить в любом месте. Фентанил высвобождается постепенно на протяжении 3 суток. Действие наступает уже через 12 часов, после удаления концентрация лекарственного вещества в крови медленно снижается. Дозировка может быть разная, ее подбирают индивидуально. Пластырь назначают, как правило, в самом начале третьей ступени обезболивания при онкологии.
Спинальная анестезия
При спинальной анестезии лекарство вводят в спинномозговой канал, субарахноидально. Это приводит к временному «выключению» тактильной и болевой чувствительности. Введение требует от врача определенного опыта. В качестве средств для обезболивания используют местные анестетики и опиоидные анальгетики. Эффект длительный и выраженный. В основном используется при оперативных вмешательствах, при острой, невыносимой боли, имеет ряд побочных эффектов на сердечно-сосудистую, дыхательную системы.
Эпидуральная анестезия
Более щадящий по сравнению с предыдущим метод. Лекарство вводят в пространство, где формируются спинномозговые нервы. Препараты аналогичны спинальной анестезии. Эпидуральная анестезия используется, чтобы на долгое время снять боль, когда оральный и парентеральный методы введения уже не приносят результатов.
Катетеризационные методики
Катетеризационные методики позволяют обеспечивать длительное качественное обезболивание. Внедрение постановки порт-систем в эпидуральное и субарахноидальное пространство с применением местных, наркотических и адъювантных препаратов позволяют на продолжительное время избавится от болевого синдрома и снизить применение других анальгетиков, имеющих свои побочные эффекты.
Нейролизис через ЖКТ при помощи эндосонографии
Нейролизис (невролиз) — это процесс разрушения ноцицептивного (болевого) нервного пути.
Одним из наиболее эффективных методов является нейролизис чревного (солнечного) сплетения, которое располагается в забрюшинном пространстве в верхнем отделе живота и осуществляет иннервацию органов брюшной полости: желудка, печени, желчевыводящих путей, поджелудочной железы, селезенки, почек, надпочечников, толстого и тонкого кишечника до селезеночного изгиба.
Введение анальгетика происходит трансгастрально — через ЖКТ, точность обеспечивает эндоскопический ультразвуковой контроль. Такие методы местного обезболивания применяются, к примеру, при раке поджелудочной железы с эффективностью до 90%. Обезболивающий эффект способен сохраняться более нескольких месяцев, в то время как наркотические анальгетики классическим способом пришлось бы вводить постоянно.

Введение препаратов в миофасциальные триггерные пункты
Миофасциальный болевой синдром выражается в спазме мышц и появлении в напряженных мышцах болезненных уплотнений. Они называются триггерными точками и болезненны при нажатии. Инъекции в триггерную зону снимают боль и улучшают подвижность участка тела. Цель инъекций в триггерные точки — «разорвать» болевой круг «боль-спазм-боль». Ими с успехом лечат спазмы множества групп мышц, особенно в области рук, ног, поясничного отдела и шеи, головы. Часто используют в качестве дополнительной терапии при фибромиалгиях и головных болях напряжения.
Фасциальные блокады и блокады нервов и сплетений
Такой же качественный эффект обеспечивают фасциальные блокады и блокады нервов и сплетений.
Блокада нерва или нервного сплетения предусматривает введение препарата около нерва, который связан с пораженным органом и вызывает боль. Процедуры периферических блокад выполняются опытными специалистами при помощи ультразвуковой навигации, что позволяет более точно вводить анальгетический препарат в необходимое место, не затрагивая и не повреждая нервные структуры.
Использование в процессе блокады гормональных препаратов позволяет устранить боль на долгое время, а многократная блокада может убрать боль на несколько месяцев. В зависимости от вида анестетика, процедуру проводят раз в год, раз в полгода или каждую неделю. Еще один плюс — минимальное количество негативных последствий.
Радиочастотная абляция
В основе этой технологии лежит выборочная термокоагуляция определенных нервов специальными электродами. Зона поражения аккуратно контролируется, позволяя воздействовать на очень небольшие участки, не повреждая расположенные рядом двигательные и чувствительные нервы. Восстановление после процедуры происходит очень быстро и почти без последствий, что позволяет пациенту вернуться к нормальной жизни.
Процедура может выполняться без госпитализации. Радиочастотное разрушение дает длительный эффект, который может длиться до года и более.
Частота развития осложнений и побочных эффектов очень мала. Если боль возобновляется, лечение может быть проведено повторно.
Пациенты с очевидными психическими нарушениями, с вторичными болями или наркотической зависимостью — это неподходящий контингент для нейродеструктивных манипуляций. Такие пациенты могут продолжать жаловаться на боли, даже если процедура проведена успешно. У пациента должен быть сформирован реалистический взгляд на исход лечения. Он должен понимать, что целью является уменьшение боли, а не полное ее устранение.
Перед нейродеструктивной процедурой обязательно проведение диагностической блокады. Хороший эффект от диагностической блокады может прогнозировать удовлетворительный результат нейродеструкции. Тем не менее, такую же диагностическую блокаду нужно повторить, по крайней мере, еще один раз, даже если ослабление боли было значительным, чтобы свести на нет эффект плацебо.
Если результат не совсем ясен, следует использовать дифференциальное блокирование. У пациентов с распространенной или мультилокальной болью результат лечения обычно не оправдывает ожидания. Пациент должен осознавать, что воздействие на один участок может не привести к достижению желаемого эффекта и, возможно, потребуется дополнительная деструкция для максимально возможного уменьшения боли.
Врачи «Евроонко» о радиочастотной аблации:

Следует избегать проведения процедуры на смешанных нервах, поскольку это может привести к потере кожной чувствительности и мышечной слабости. Деафферентационные боли могут усугубляться при деструкции поврежденного нерва. В том случае, когда боль имеет центральное происхождение (спинальная или выше), деструкция периферического нерва может вызывать увеличение болевой перцепции за счет элиминации входящего стимула. Лучшая альтернатива в этом случае — это нейроаугментация с TENS или стимуляция спинного мозга.
Нейрохирургические вмешательства
В ходе процедуры нейрохирург перерезает корешки спинномозговых или черепных нервов, по которым проходят нервные волокна. Тем самым мозг лишается возможности получать болевые сигналы. Разрезание корешков не приводит к утрате двигательной способности, однако может затруднить ее.
Анальгезия, контролируемая пациентом (PCA)
Этот вид обезболивания основан на простом правиле: пациент получает анальгетики тогда, когда он этого хочет. В основу схемы положено индивидуальное восприятие боли и необходимость приема анальгетиков. В европейских странах РСА принята в качестве стандарта постоперационного обезболивания. Метод прост и относительно безопасен. Однако пациентам необходимо проходить тщательный инструктаж.
PCA наиболее эффективна при использовании катетерных методов (эпидуральная, спинальная анестезия, блокада нервных сплетений с установкой катетера), а также порт-систем, как венозных, так и эпидуральных и интратекальных.
Обезболивающие при раке желудка
Неприятные ощущения и боли испытывают примерно 70% пациентов, страдающих раком желудка. Как правило, боль локализуется в животе, но по мере прогрессирования опухоли может возникать и в других местах: в спине, ребрах, костях. В качестве симптома паранеопластического синдрома или побочного эффекта химиотерапии могут возникать нейропатические боли.
Помимо трехступенчатой системы, для борьбы с болью и дискомфортом при раке желудка применяют бензодиазепины, антидепрессанты, препараты гормонов коры надпочечников (преднизолон, дексаметазон), снотворные, антипсихотические средства. При болях в костях и патологических переломах назначают бисфосфонаты.
Врач может провести два вида нервных блокад:
Блокаду нервных сплетений можно проводить с помощью анестетиков и препаратов, которые временно повреждают нервы. При невролизе вводят препарат, который разрушает сплетение.
Обезболивающие при раке легких
Причиной боли в грудной клетке при раке легких может быть сама опухоль или перенесенное хирургическое вмешательство. Другие возможные причины:
- Метастазы в головном мозге приводят к головным болям.
- Метастазы органов брюшной полости приводят к болям в животе.
- Метастазы в костях приводят к костным болям, патологическим переломам.
- Паранеопластический синдром приводит к нейропатическим болям в разных частях тела. — один из побочных эффектов химиотерапии.
Помимо обезболивающих уколов при онкологии легких с НПВС и наркотическими анальгетиками, помогают другие препараты, нервные блокады, лучевая терапия, паллиативные хирургические вмешательства.
Лекарства при опухолях. Фармакология онкологических заболеваний
Лекарства для лечения опухоли - цитостатики
Опухоль (новообразование) состоит из клеток, которые пролиферируют независимо от, образно выражаясь, врожденного «строительного плана» организма. При злокачественной опухоли (рак) опухолевая ткань прорастает в здоровые окружающие ткани, разрушая их, или отделившиеся опухолевые клетки образуют вторичные опухоли (метастазы) в других органах. Лечение требует удаления всех злокачественных клеток (радикальная терапия).
Если это невозможно, замедляют рост опухоли, что приводит к увеличению жизни пациента или улучшению качества жизни (паллиативная терапия). Химиотерапия осложнена тем, что злокачественные клетки являются эндогенными и почти не обладают специфическими метаболическими свойствами.
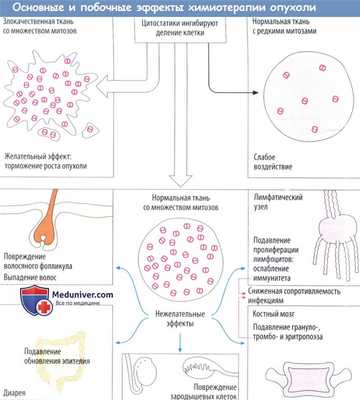
Цитостатики — это цитотоксические вещества, которые поражают в основном пролиферирующие или делящиеся (митотические) клетки. Повреждаются преимущественно быстро делящиеся злокачественные клетки. Нарушение митотических процессов не только замедляет рост опухоли, но и приводит к апоптозу (запрограммированная гибель клетки). Ткани с низкой скоростью митоза практические не поражаются, как и большинство здоровых тканей. Тем не менее это касается и злокачественных опухолей, состоящих из медленно дифференцирующихся клеток.
Цитостатическая терапия, несомненно, оказывает повреждающее действие на ткани с физиологически высокой частотой митозов. Следовательно, развиваются типичные побочные эффекты.
Выпадение волос происходит в результате повреждения волосяных фолликулов; расстройства со стороны ЖКТ, например диарея вследствие недостаточного восполнения энтероцитов, период жизни которыхограничен несколькими днями; тошнотой рвота в результате стимуляции хеморецепторов самого заднего поля ромбовидной ямки рвотного центра; снижение резистентности к инфекции в результате ослабления иммунной системы. Кроме того, цитостатики вызывают миелосупрессию. Восполнение клеток крови зависит от митотической активности стволовых и дочерних клеток костного мозга.
При остановке пролиферации миелоидного ростка в первую очередь поражаются гранулоциты с коротким периодом жизни (нейтропения), затем — тромбоциты крови (тромбопения) и, наконец, эритроциты с большим периодом жизни (анемия). Бесплодие вызвано подавлением сперматогенеза или созревания фолликула. Большинстве цитостатиков нарушает метаболизм ДНК. Это повышает риск повреждения генома здоровых клеток (мутагенный эффект). Возможно, с ним связано развитие лейкоза через несколько лет после цитостатической терапии (корциногенный эффект). Более того, весьма вероятно появление врожденных пороков развития при необходимости использовать цитостатики во время беременности (тератогенный эффект).
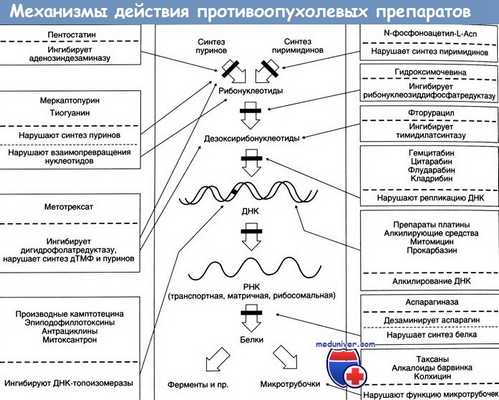
Цитостатики имеют разные механизмы действия:
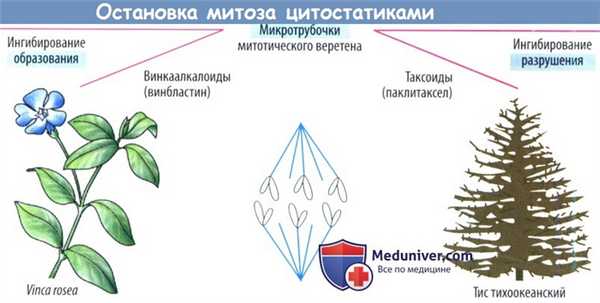
а) Повреждение митотического веретена. Сократительные белки веретенного аппарата разводят реплицированные хромосомы перед делением клетки. Данный процесс нарушают так называемые яды митотического веретена (см. также колхицин), которые останавливают митоз в метафазе за счет нарушения превращения микротрубочек в веретенные нити. Они состоят из белков α- и β-тубулина. Излишние трубочки отрезаются, давая возможность субъединицам тубулина рециркулировать.
Винка алкалоиды винкристин и винбластин (получаемые из барвинка розового, Vinca rosea) ингибируют полимеризацию субъединиц тубулина в микротрубочки. Повреждение нервной системы является ожидаемой нежелательной реакцией в результате нарушения управляемыми микротрубочками аксональных транспортных механизмов.
Паклитаксел, получаемый из коры тиса тихоокеанского (Taxus brevifolia), ингибирует расхождение микротрубочек и индуцирует образование атипичных микротрубочек, что препятствует повторному сбору тубулина в правильно функционирующие микротрубочки. Полусинтетическим производным является доцетаксел.
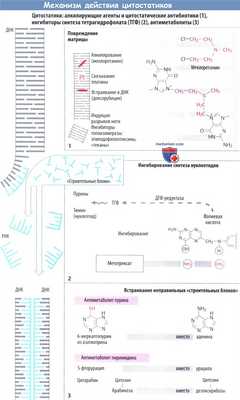
б) Ингибирование синтеза ДНК и РНК. Митозу предшествует репликация хромосом (синтез ДНК) и повышенный синтез белка (синтез РНК). Имеющаяся ДНК (серый цвет) служит в качестве матрицы для синтеза новой ДНК (голубой цвет) или РНК. Синтез новых нуклеиновых кислот ингибируется следующими механизмами.
в) Повреждение матрицы. Алкилирующие цитостатики являются реактивными веществами, которые переводят алкильные остатки на ДНК через ковалентную связь. Например, мехлоретамин (азотистый иприт) способен образовывать перекрестную связь между двумя цепями ДНК, отдавая атомы хлора. Правильное считывание генетической информации поэтому становится невозможным. Другими алкилирующими агентами являются хлорамбуцил, мелфалан, циклофосфамид, ифосфамид. ломустин, тиотепа, митомицин, прокарбазин, дакарбазин и темозоломид.
К специфическим нежелательным реакциям относятся необратимый фиброз легких у бусульфана и геморрагический цистит, вызванный метаболитом циклофосфамида акролеином (предупреждается месной, натрия 2-меркаптоэтансульфонатом). Платиносодержащие противоопухолевые средства (цисплатин, карбоплатин и оксалиплатин) высвобождают платину, которая связывается с ДНК.
г) Цитостатические антибиотики встраиваются в двунитевую ДНК, что приводит к разрыву нити (как у блеомицина). Антрациклиновые антибиотики даунорубицин и адриамицин (доксорубицин) вызывают кардиомиопатию. Кроме того, блеомицин вызывает фиброз легких. Эпирубицин и идарубицин разработаны с целью снижать кардиотоксичность. Трабектин, который тоже встраивается в двунитевую ДНК, не является антибиотиком; его получают из асцидии.
д) Разрыв нити вызывает ингибирование топоизомеразы. Эпиподофиллотоксины этопозид и тенопозид взаимодействуют с топоизомеразой II,в функции которой входят расщепление, перенос и вторичное закрытие нитей ДНК. Эти препараты вызывают разрыв нити за счет ингибирования повторного закрытия. «Теканы» топотекан и иринотекан являются производными камптотецина, получаемыми из фруктов китайского дерева (Camptotheca acuminata). Они ингибируют топоизомеразу I, которая вызывает разрыв однонитевой ДНК.
е) Ингибирование синтеза нуклеотидного основания. Тетрагидрофолиевая кислота (ТГФ) необходима для синтеза как пуриновых оснований, так и тимидина. ОбразованиеТГФ из фолиевой кислоты происходит при участии ДГФ-редуктазы. Аналог фолата метотрексат ингибирует активность фермента. Клеточные запасы ТГФ истощаются. Эффект этих антиметаболитов можно устранить путем введения фолиевой кислоты (5-формил-ТГФ, лейковорин, фолинат кальция).
Гидроксимочевина (гидроксикарбамид) ингибирует рибонуклеотидредуктазу, которая обычно превращает рибонуклеотиды в дезоксирибонуклеотиды, которые затем используются как «строительные блоки» ДНК.
ж) Встраивание ложных «строительных блоков». Неестественные нуклеотидные основания (6-меркаптопурин, 5-фторурацил) и патологические нуклеозиды с измененными сахарами (цитарабин, гемцитабин) измененным основанием (кладрибин) или с обоими измененными компонентами (флударабин, капецитабин) действуют как антиметаболиты. Они ингибируют синтез ДНК/РНК или вызывают синтез ложных нуклеиновых кислот.
6-меркаптопурины образуются в результате биотрансформации неактивного предшественника азатиоприна. Урикостатик аллопуринол ингибирует распад 6-меркаптопурина, поэтому при одновременном введении двух препаратов требуется снижение дозы последнего.
з) Комбинированная терапия. Цитостатики часто применяются по сложным терапевтическим схемам разработанным для улучшения эффективности и переносимости лечения.
и) Поддерживающая терапия. Химиотерапия рака поддерживается адъювантными препаратами. Следующие препараты используются против рвоты, вызванной цитостатиками:
1) дексаметазон в качестве основного препарата;
2) антагонист 5-НТ3 ондонсегрон (при ранней рвоте);
3) антагонист NK1-рецепторов апрепитант, который эффективен против поздней рвоты с началом более чем через 24 ч. При угнетении костного мозга используют гранулоцитарный и гранулоцитарно-макрофагальный колониестимулирующие факторы (филграстим и ленограстим). Поврежденную слизистую оболочку восстанавливают палифермином, рекомбинантным человеческим фактором роста кератиноцитов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Снятие боли при раке. Какие анальгетики выбрать?
Снятие боли — чрезвычайно важный аспект лечения рака. Раковая боль может возникать внутри, тогда она нередко плохо локализована и изменчива; в костях и конечностях (например, при костных метастазах),тогда она постоянна и локализована; и нередко обостряться ночью, или «стрелять», при нервных расстройствах. Чаще всего пациенты имеют более чем одну причину боли.
Первый шаг в лечении — сделать аккуратную клиническую оценку боли, которую пациент испытывает, и определить ее очаг, степень и продолжительность. При определении главных проблем и наблюдении прогрессирования боли во времени полезно использовать график оценки боли.
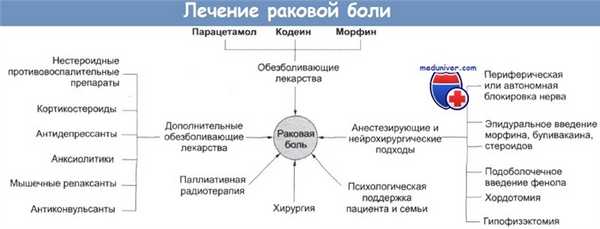
Не существует идеального анальгетика, и большинству пациентов в течение болезни требуются лекарства разной силы и дозы. Довольно удобно разделять анальгетики на три класса, в соответствии с силой их действия.
1. Легкие анальгетики. В эту группу входят аспирин, парацетамол и нестероидные противовоспалительные препараты. Они полезны для лечения в длительные периоды времени. Аспирин и нестероидные противовоспалительные препараты (такие как индометацин, ибупрофен) особенно полезны при боли в костях.
Побочные эффекты включают в себя диспепсию (расстройство пищеварения) и внутренние кровотечения в желудочно-кишечном тракте. Анальгетики этой группы комбинируют с веществами из более сильнодействующих классов (например, аспирин в комбинации с таблетками папаверетума (омнопона)). Недавно стали доступны внутривенные введения парацетамола, приводящие к более высокой пиковой концентрации этого препарата в плазме по сравнению с пероральным приемом и более ярко выраженному обезболивающему эффекту, сравнимому, как утверждается, с эффектом 10 мг морфина, введенного внутримышечно.
2. Умеренные анальгетики включают кодеин, оксикодон, пентазоцин и дипипанон. Эти вещества более эффективны, чем легкие анальгетики, но обладают большими побочными действиями, в частности вызывают запор. Декстропропоксифен иногда используется в комбинации с парацетамолом, но этот препарат (копроксамол) недавно был снят с рынка в Великобритании.
Оксикодон чрезвычайно ценен, так как доступен в виде свечей. Пентазоцина следует избегать — он часто вызывает галлюцинации. Частично его эффект ослабляет действие морфина, и поэтому он не рекомендуется к применению в комбинации с опиатами.
3. Сильные анальгетики. Эти вещества, включающие в себя морфин и синтетические аналоги (синтетические и полусинтетические производные), обладают мощным болеутоляющим действием и являются главной опорой обезболивающей терапии для пациентов с беспрестанной болью. Они повторяют действие эндогенных медиаторов в мозге, известных как опиоидные пептиды.
Почти все пациенты с серьезной раковой болью требуют регулярного приема анальгетиков этого типа. Полезные агенты включают в себя аналоги морфина, такие как диаморфин, морфин и кодеин; производные фенилпиперидина, такие как метадон, петидин, фентанил и экстропропоксифен; производные тебаина, такие как бупренорфин; и бензоморфаны, например пентазоцин. Обычный морфин и диаморфин активны только в течение четырех часов и должны приниматься каждые четыре часа, но сейчас уже стали доступны таблетки морфин сульфата долгого действия.
Выбор и дозирование опиоидных анальгетиков должны определяться из потребностей пациента. Например, многие больные чувствуют себя комфортно и избавляются от боли при регулярных малых дозах (10-20 мг каждые 4 ч) морфина или диаморфина, в то время как другим требуется доза в 20 раз выше. Существуют другие препараты с широким диапазоном применяющихся доз, что является следствием различной степени фармакологической толерантности, которая очень быстро развивается.
Для большинства пациентов пероральный прием лекарств является подходящим и эффективным, хотя абсорбция проходит медленно, и различается для разных лекарств. Для пациентов с, например, полным разрушением от рака глотки или пищевода подойдет альтернативный прием лекарств. Подъязычный бупренорфин может быть полезной альтернативой, но он ухудшает влияние морфина и поэтому не должен ни внезапно заменяться морфином, ни приниматься с ним совместно. Лечение ректальными свечами оксикодона или морфина может быть высокоэффективным.
В очень редких случаях, если и пероральный, и ректальный прием лекарств недоступны, свечи могут даваться вагинально.
Изредка необходимо регулярное внутривенное лечение опиатами. Подкожные или внутривенные введения диаморфина полезны, если введение препарата другими способами оказывается неудовлетворительным. Диаморфин предпочтительнее благодаря своей высокой растворимости, что позволяет использовать малые объемы при инъекции. Использование анальгетиков «по требованию» может позволить пациенту легче контролировать снятие боли. Очень редко регулярное эпидуральное применение морфина может быть необходимо для снятия серьезной, локализованной боли, но такое лечение не должно рассматриваться как длительное до тех пор, пока другие способы регулярного приема опиатов не будут опробованы.
Длительный прием морфина, доступного в таблетках, — очень важное пополнение семейства опиатов. Так как и морфин, и диаморфин должны приниматься часто в течение дня, доступность морфина длительного действия имеет большое значение, особенно для активного пациента. Когда в лечении происходит переход от диаморфина к морфину длительного действия, соотношение доз диаморфина к морфину должно быть 2:3, поэтому пациенту, принимающему, скажем, диаморфин 20 мг каждые 4 ч (полная ежедневная доза составляет 120 мг), будет требоваться ежедневно 180 мг морфина или морфина длительного действия 90 мг дважды в день. Гидроморфон НС1, полусинтетическое опиоидное производное, может быть полезным при лечении пациента с аллергией на морфин, и доступен в виде препаратов, которые долго высвобождаются (принимать каждые 12 ч).
Трансдермальные наклейки фентанила (полусинтетического опиоида) при начальной дозе 25 мг/ч (для пациента, который раньше не принимал опиоиды) или соответствующей дозе для пациентов, принимающих морфин, могут предложить хороший контроль над болью с меньшей вероятностью запора, тошноты и сонливости в течение дня, а также более полезны для пациентов с тошнотой.
Все пациенты, которые лечатся регулярным приемом опиоидов, нуждаются в советах, как избежать запоров. Регулярный прием слабительных обычно (но не всегда) необходим в данной ситуации, и такие лекарства могут даваться в дозах, превышающих нормальные. Довольно эффективен регулярный прием дантрона в комбинации с долоксамером (или капсул). Стандартная ежедневная доза, составляющая 10-15 мл (или от одной до трех капсул), в разделенных ежедневных дозах, может быть недостаточной для пациентов, принимающих большие дозы морфина, и в таком случае допустима более сильная смесь. К другим важным, но менее стойким побочным действиям опиоидных анальгетиков относятся тошнота, рвота и безразличие.
Хотя безразличие обычно исчезает со временем, тошнота может сохраняться и требует лечения. Галоперидол также эффективен, как циклизин, хотя фенотиазины обладают большим успокаивающим эффектом.

Противоопухолевые препараты
Противоопухолевые препараты пугают онкологических пациентов непредсказуемостью позитивного и частого негативного действия. Большинство пациентов предпочло бы остановиться на хирургическом лечении или облучении, но эти строго локальные методы не всегда технически возможны. На все опухолевые очаги системно удается воздействовать только лекарственными препаратами, поскольку они проникают всюду, где есть кровь вне зависимости от способа введения.
Что такое противоопухолевые препараты и как они работают?
Все убивающие злокачественные клетки препараты можно называть противоопухолевыми, не смотря на существенную разнородность лекарственных молекул и механизм повреждающего действия. Большинство противоопухолевых препаратов влияет на деление клеток, нарушая структуру их ДНК или веретена, помогающего развести хромосомы в образующиеся дочерние клетки. Вероятно, цитостатики повреждают не только геном, лучше всего изучено их действие образование сшивок между частями одной нити ДНК и двумя параллельными нитями, заплетенными в спираль. У клетки есть способы для восстановления малого повреждения генетического аппарата, но при существенном нарушении она вынуждена уйти в сторону апоптоза — смерти.
Клеточные популяции в опухолевом узле очень разнородны: какие-то клетки только собираются делиться, другие уже вошли в процесс и активно синтезируют две копии структур для дочерней клеточки, некоторые находятся в покое, а часть после завершения жизненной программы устремилась к гибели. Считается, что находящиеся в состоянии покоя клеточные популяции устойчивы к агрессии противоопухолевых лекарств, зато делящиеся и планирующие войти в эту фазу — самые чувствительные к химиопрепаратам. Делящиеся клетки составляют фракцию опухолевого роста, чем она крупнее, тем агрессивнее рак и одновременно более чувствителен к противоопухолевому воздействию.
Классификация и виды противоопухолевых средств
Противоопухолевые лекарства представлены химиотерапевтическими препаратами, то есть цитостатиками, эндокринными или гормональными средствами, таргетными препаратами. Все они различаются механизмом инициации клеточной смерти.
Цитостатики используются с 1946 года и представлены несколькими группами лекарственных средств:
- алкилирущие получили свое название от химической реакции, реализующей ведущий механизм повреждения — алкилирование, то есть замену атома водорода нуклеиновых кислот нитей ДНК на алкильную группу лекарства с образованием связок и деформацией структуры;
- антиметаболиты прекращают жизнедеятельность клетки, вмешиваясь в её метаболизм и подменяя собой структурные компоненты нуклеиновых оснований ДНК и РНК или блокируя участвующие в синтезе этих оснований ферменты;
- противоопухолевые антибиотики тоже формируют ДНК-сшивки, а традиционное для антибактериальных препаратов противовоспалительное и противомикробное действие у них практически равно нулю;
- препараты растительного происхождения очень разнородны, преимущественный механизм действия — нарушение клеточного деления, общее у них одно — их выделили из растительного сырья, а позже стали синтезировать химическим способом, удешевляя и облегчая процесс производства;
- различные препараты невозможно было отнести к четырём основным группам ни по одному объединяющему критерию.
Алкилирующие средства
Это самые первые противораковые лекарства, начавшие историю химиотерапии. Ярчайшие представители группы — циклофосфамид, нитрозометилмочевина и производные платины.
Алкилирование противоопухолевыми агентами ДНК приводит к разрывам её цепи и сшиванию с закрученной в параллельную спираль второй нитью, образуемые сшивки не хаотичны — в определенном месте и с конкретным нуклеотидом. В конечном итоге предотвращается репликация, то есть сборка второго комплекта структур для разделения клетки. Принципиально алкилирование возможно в любую фазу клеточного цикла, но особенно активно осуществляется во время синтеза.
Препараты этой группы обладают широким противоопухолевым спектром, используются в терапии рака, в том числе сарком и онкогематологических процессов.
Циклофосфамид, более привычное торговое наименование циклофосфан, применяется более 60 лет в качестве компонента полихимиотерапии, в одиночку используется при злокачественных заболеваниях крови и лимфатической ткани. Вводится разными способами: в таблетках, внутривенно и внутримышечно. Для местного применения бесполезен, потому что активируется исключительно в ткани печени, куда попадает с кровью.
Редкая особенность препарата ифосфамида — наличие антидота уромитексана, защищающего слизистую мочевого пузыря от повреждений.
Первое производное платины — цисплатин было синтезировано в середине XIX века, а в клинику пришло в последней четверти прошлого века. Препарат легко проникает в клетки, потому что его молекула не заряжена ни положительно, ни отрицательно, чем и обусловлена его высокая агрессивность в отношении множества злокачественных процессов. Сегодня применяются уже три поколения платиновых производных, при неизменно высокой активности существенно различаются побочные эффекты.
Препараты нитрозометилмочевины преимущественно используются при злокачественных новообразованиях ЦНС и в онкогематологии.
Противоопухолевые препараты растительного происхождения
Вещества растительного происхождения представлены несколькими группами:
- винкаалкалоиды выделены из растения барвинок, у всех четырёх лекарственных средств идентичный механизм противоопухолевого действия — нарушение белка тубулина и вследствие этого остановка клеточного митоза;
- таксаны немногочисленны, первоначально был выделен из коры тихоокеанского тисового кустарника паклитаксел, а через 15 лет уже из игл европейского тиса добыли доцетаксел, сегодня таксаны наполовину синтетические, кроме высокой эффективности они стали первенцами среди слишком дорогих химиопрепаратов;
- камптотецины добывают из южно-китайского ниссового кустарника, препарат нарушает фермент топоизомеразу, не позволяя раскрутиться суперспирали ДНК, сегодняшние полусинтетические аналоги камптотецина топотекан используются при опухолях ЦНС, иринотекан незаменим в схемах химиотерапии карцином толстой кишки, легкого и яичников;
- эпиподофиллотоксины — полусинтетические аналоги смолы из корней американской мадрагоры и самый яркий представитель подгруппы — этопозид оказался эффективнее природного аналога.
Противораковые препараты нового поколения
Противоопухолевое действие цитостатиков обнаруживали почти случайно, таргетные препараты синтезируют на основе научных исследований. Таргетные препараты работают «точечно», блокируя важный внутриклеточный элемент, понуждая к клеточной гибели. Эту группу также называют ингибиторами за подавление ими клеточных процессов. Особенность лекарственных средств в невозможности полного уничтожения опухоли, как правило, они приостанавливают размножение популяции, поэтому используются вместе с цитостатиками.

Иммуноонкологические средства способствуют восстановлению естественной иммунной защиты организма, подавленной злокачественной опухолью. Средства отличаются от стандартных иммунных препаратов, аналогом которых были вырабатываемые организмом цитокины — интерферон и интерлейкин. Лекарства, как и таргетные, создаются целенаправленно на основе фундаментальных достижений науки. Иммунотерапия сдвинула с мертвой точки лечение меланомы, устойчивой к цитостатикам, мало чувствительный рак легкого и желудка, почечноклеточную карциному и рак печени.
Препараты на гормональной основе
Эндокринная терапия призвана снизить выработку половых гормонов или не допустить их внутрь опухолевой клетки, дабы исключить стимуляцию роста чувствительного к уровню гормонов злокачественного процесса.
Классификация эндокринных препаратов по механизму действия:
- центральные, подавляющие выработку гормонов гипофиза, регулирующих синтез эндокринных веществ половыми клетками, и главные представители группы — агонисты ЛГРГ;
- периферические — снижают функцию половых желез или нарушают в жировой ткани работу фермента ароматазы, отвечающего за трансформацию тестостерона в эстроген — группа ингибиторов ароматазы;
- клеточные — связывающиеся на мембране с рецептором и не пропускающие гормоны внутрь клетки и по своей сути антигормоны, как антиэстроген тамоксифен.
Применяются гормональные противоопухолевые лекарства при карциномах молочной и предстательной железы, а также некоторых вариантах рака тела матки, несущие на своей клеточной поверхности специальные рецепторы гормонов. Как правило, лечение рассчитано на несколько лет, поскольку реализация противоопухолевого эффекта очень медленная.
Побочные явления
Точка приложения противоопухолевых препаратов — клетка, причём не только опухолевая, но и нормальная, поэтому при противоопухолевой терапии закономерны осложнения. Спектр побочных эффектов каждого препарата изучен, но токсические проявления у отдельного пациента строго индивидуальны и непредсказуемы по интенсивности.
Даже препараты одной подгруппы при общем механизме действия имеют разные точки приложения, к примеру, очень небольшие отличия в строении алкалоидов барвинка винкристин и винбластин обернулись существенными различиями в спектре активности и токсичности, их применяют при разных болезнях. Скопированный с натурального растительного винбластина синтетический аналог виндезин, по биологическому действию и осложнениям больше походит на винкристин. Структурно схожий с природными винкаалкалоидами и полностью синтетический винорелбин по спектру действия и токсичности совсем не походит на натуральные аналоги.
Противоопухолевые лекарства не гарантируют 100% результата, раковые клетки уникальны в способности самовосстановления и скорости воспроизводства популяции.
Искусство химиотерапии — это не только умелый подбор оптимальной комбинации, обещающей максимально возможный результат, но и минимизация программных осложнений лекарственного лечения. В нашей Клинике не только помогают каждому пациенту легче перенести химиотерапию, но заблаговременно по индивидуальной программе, учитывающей все особенности организма, готовят к курсу лечения.
Препараты для химиотерапии
В настоящее время существует более сотни препаратов для химиотерапии рака (химиопрепаратов). Они различаются по химической структуре и механизмам действия, благодаря этому врач-химиотерапевт может подобрать наиболее оптимальное сочетание препаратов для конкретного пациента, в зависимости от типа, стадии рака и других факторов.
Как работают химиопрепараты?
Несмотря на разные механизмы действия, все химиопрепараты работают в одном направлении: они нарушают клеточный цикл, останавливают размножение раковых клеток и вызывают их гибель.
Противопоказания к химиотерапии
Несмотря на потенциальную пользу, которую способны принести химиопрепараты, некоторым пациентам они противопоказаны из-за высокого риска тяжелых побочных эффектов. К основным противопоказаниям относят тяжелую тромбоцитопению, острые инфекции с высокой температурой, тяжелые нарушения со стороны сердечно-сосудистой системы, легких, печени, почек, первый триместр беременности, перенесенные серьезные операции, пожилой возраст, сильное истощение.
Перед началом курса химиотерапии врач должен тщательно оценить состояние пациента, выявить имеющиеся у него проблемы со здоровьем и связанные с ними потенциальные риски.
Противопоказания к применению противоопухолевых препаратов бывают не только абсолютными, но и относительными. Химиотерапию проводить можно, но только с соблюдением некоторых условий:
- Снизить дозы, подобрать препараты, которые наиболее безопасны.
- Использовать один препарат химиотерапии вместо комбинации из двух и более.
- Перед началом курса провести лечение и устранить имеющиеся проблемы со здоровьем.
- Выждать некоторое время, например, после перенесенной операции или пока не стихнет инфекция.
В каждом случае требуется индивидуальный подход.
Типы химиопрепаратов
Препараты для химиотерапии делят на группы, в зависимости от химической структуры и механизма действия. Один и тот же препарат может работать разными способами и относиться к разным группам. Зная, к какой группе относится химиопрепарат, врач может прогнозировать лечебные и побочные эффекты, правильно спланировать курс лечения.

Цитостатики и цитотоксические препараты
Традиционно противоопухолевые препараты делят на две группы:
- останавливают размножение раковых клеток и запускают в них процесс запрограммированной клеточной смерти — апоптоз. К этой группе относят, в частности, фторурацил, цисплатин, доксорубицин.
- Цитотоксические (цитотоксины) повреждают ядро, оболочку и другие компоненты клетки, приводят к её гибели.
Также в настоящее время существуют таргетные препараты, которые нарушают жизнедеятельность и размножение опухолевых клеток путем воздействия на определенные молекулы-мишени, и иммунопрепараты, которые задействуют ресурсы противоопухолевого иммунитета.
Алкилирующие агенты
Самая старая группа средств для химиотерапии. Они так названы потому, что могут алкилировать различные молекулы, включая ДНК, РНК и белки. Препарат связывается с молекулой ДНК и приводит к ее разрыву во время удвоения в процессе деления клетки. В итоге запускается процесс запрограммированной клеточной гибели — апоптоз.
Алкилирующие агенты атакуют клетки на любой стадии клеточного цикла. Химиотерапия данными средствами эффективна при многих типах рака: легких, яичников, молочной железы, а также при саркомах, множественных миеломах, болезни Ходжкина, лимфоме, лейкемии.
Представители группы: цисплатин, карбоплатин, дакарбазин, хлорамбуцил, оксалиплатин, темозоломид.
Антиметаболиты
Эти препараты атакуют опухолевые клетки на стадии удвоения хромосом во время деления. Они нарушают синтез новых РНК и ДНК, занимая места нуклеотидов — «звеньев», из которых состоят цепочки нуклеиновых кислот. Антиметаболиты эффективны в качестве химиотерапии при раке кишечника, яичников, молочной железы, лейкемии.
Представители группы: 5-фторурацил, 6-меркаптопурин, капецитабин, гемцитабин, метотрексат.
Противоопухолевые антибиотики
Напоминают антибактериальные препараты, которые используются для лечения инфекций. Эти химиопрепараты повреждают ДНК опухолевых клеток и нарушают их размножение. Существуют разные группы антибиотиков для химиотерапии, одна из них — антрациклины. Эти препараты нарушают функции ферментов, которые необходимы для удвоения ДНК.
Представители антрациклинов: доксорубицин (адриамицин), эпирубицин, даунорубицин, идарубицин.
Представители противоопухолевых антибиотиков, не являющихся антрациклинами: блеомицин, митоксантрон, митомицин-С, актиномицин D.
Ингибиторы топоизомеразы
Молекула ДНК состоит из двух цепочек, закрученных в спираль. Для того чтобы скопировать ее во время деления клетки, спираль нужно «распутать». За эту функцию отвечает особый фермент топоизомераза. Существуют средства для химиотерапии, которые блокируют его, тем самым нарушая процессы клеточного деления. Ингибиторы топоизомеразы эффективны при раке желудка и кишечника, яичников, легких, при лейкозах.
Представители группы: топотекан, иринотекан, этопозид, тенипозид, митоксантрон.
Ингибиторы митоза
Средства для химиотерапии из этой группы имеют растительное происхождение. Они блокируют деление клеток, нарушая функцию микротрубочек и некоторых белков-ферментов. Ингибиторы митоза применяют для лечения рака молочной железы, легких, миеломы, лимфомы, лейкозов.
Представители группы: доцетаксел, паклитаксел, винбластин, винкристин.
Винкаалкалоиды
Первые ингибиторы митоза из этой группы — винбластин и винкристин — были выделены из растения барвинок розовый (Vinca rosea). Затем на основе винбластина были созданы полусинтетические соединения для химиотерапии — винорелбин и виндезин. Основной механизм действия этих препаратов состоит в том, что они связывают с белком тубулином в составе микротрубочек и не дают ему полимеризоваться. Деление клеток останавливается.
Также винкаалкалоиды нарушают другие клеточные процессы: изменяют обмен аминокислот и некоторых других веществ, влияют на синтез нуклеиновых кислот, жиров, клеточное дыхание.
Таксаны
Эти препараты начали широко применяться для химиотерапии с 90-х годов прошлого столетия. Первым был получен 1960-х годах паклитаксел из экстракта тихоокеанского тиса (Taxus brevifolia). В 1980-х годах из экстракта хвои европейского тиса (Taxus baccata) удалось выделить более мощный препарат — доцетаксел.
Таксаны тоже влияют на микротрубочки, но не так, как винкаалкалоиды. Они, напротив, ускоряют полимеризацию тубулина, впоследствии препятствуют его деполимеризации и распаду микротрубочек. Из-за этого также нарушается деление клеток.
Глюкокортикостероиды
Глюкокортикостероиды, или глюкокортикоиды, представляют собой препараты гормонов коры надпочечников. Они обладают многими функциями, в частности, принимают участие в регуляции обмена веществ, подавляют иммунные реакции и воспаление. Также эти препараты обладают противоопухолевыми свойствами. Иногда глюкокортикоиды используют для поддерживающей терапии. Они помогают устранить вызванную противоопухолевыми препаратами тошноту и рвоту, предотвратить аллергические реакции.
Представители группы: метилпреднизолон, преднизон, дексаметазон.
Лекарства для химиотерапии, которые не относятся к каким-либо группам
Некоторые химиопрепараты не входят ни в одну группу и обладают собственными механизмами действия. Например, ингибитор протеосом бортезомиб, фермент L-аспарагиназа.
Принципы применения препаратов для лечения рака
Для того чтобы обеспечить необходимую эффективность химиотерапии, нужно придерживаться некоторых правил:
- Как можно более раннее начало лечения. Пациент должен начать получать химиопрепараты сразу же, как только выявлены показания к их применению. К сожалению, в российских государственных клиниках дела с этим обстоят не лучшим образом. Зачастую не сразу удается попасть на прием к врачу и пройти необходимые обследования. Крупные онкологические центры постоянно сильно загружены, и пациентам приходится ждать своей очереди, чтобы начать лечение. Но рак не станет ждать, он прогрессирует, и со временем прогноз может ухудшиться. В «Евроонко» доступны все группы препаратов, и мы всегда начинаем терапию в кратчайшие сроки.
- Применение комбинаций препаратов. Обычно назначают 2–3 химиопрепарата с разными механизмами действия.
- Правильный подбор схемы химиотерапии. Разные типы рака обладают неодинаковой чувствительностью к тем или иным противоопухолевым препаратам. Врачи ориентируются на протоколы лечения. Эти документы составлены на основе результатов научных исследований с участием тысяч пациентов по всему миру, и в них расписаны сочетания препаратов, которые с наибольшей вероятностью будут эффективны при тех или иных злокачественных опухолях. На случай, если терапия первой линии не помогает, предусмотрены «запасные» варианты.
- В максимально короткие сроки нужно создать в тканях оптимальную концентрацию химиопрепарата и затем поддерживать её. Для этого важно правильно определиться с дозировками и частотой введений. Химиотерапию проводят циклами: больному вводят препараты, а затем дают некоторое время (обычно 1–3 недели) на «передышку». Курс может состоять из нескольких циклов.
- При неоперабельном раке лечение продолжают, пока препараты работают или не начинают вызывать тяжелые побочные эффекты.
- Пациент должен переносить химиотерапию комфортно. В «Евроонко» постоянно контролируют его состояние, проводят необходимые исследования и анализы, вводят противоопухолевые препараты под прикрытием поддерживающей терапии.
Дозировки
Подбор оптимальной дозы химиопрепаратов можно в какой-то степени сравнить с хождением по канату. Если дозировка будет слишком низкой, лечение станет недостаточно эффективным и ухудшится прогноз, а если слишком высокой, можно получить тяжелые осложнения. Ситуация осложняется тем, что «канат» у каждого пациента разной «толщины» — это зависит от размеров тела, индивидуальной способности организма метаболизировать лекарство.
Обычно дозировку химиопрепаратов рассчитывают, основываясь на площади поверхности тела или весе пациента. Также нужно учитывать общее состояние здоровья, сопутствующие заболевания.
Способы введения в организм
Чаще всего химиопрепараты вводят внутривенно или перорально (от латинского per os — «через рот»). Но существуют и другие пути введения:
- Подкожные и внутримышечные инъекции.
- Интратекально — в спинномозговую жидкость.
- Внутрибрюшинно — в брюшную полостью. При канцероматозе брюшины применяется современная методика HIPEC (гипертермическая интраперитонеальная химиотерапия), когда после удаления из брюшной полости всех крупных очагов её промывают подогретым раствором химиопрепарата, чтобы уничтожить оставшиеся мелкие очаги.
- Внутриплеврально — в плевральную полость, окружающую легкие.
- Внутриартериальная химиотерапия — непосредственно в артерию, питающую опухоль. При этом можно использовать высокие дозы химиопрепаратов: они почти не проникают в системный кровоток и не вызывают серьезных побочных эффектов.
- Введение в мочевой пузырь с помощью катетера.
Когда больному требуется лечение в течение длительного времени, в «Евроонко» применяют имплантируемые венозные порт-системы. Под кожу подшивают небольшой резервуар, одна из стенок которого представлена специальной мембраной, и соединяют его катетером с веной. В дальнейшем лекарства вводят с помощью иглы, которой прокалывают кожу и находящуюся под ней мембрану.
Эффективность препаратов, применяемых при химиотерапии
Для того чтобы судить об эффективности химиотерапии, обычно нужно провести не менее 2–3 циклов лечения. Затем выполняют исследования, которые помогают визуализировать и измерить опухоль, проводят анализы на онкомаркеры. Возможен один из четырех результатов:
- Полный ответ. Опухоль исчезла, уровень онкомаркера снизился и находится в пределах нормы.
- Частичный ответ. Опухоль уменьшилась, уровень онкомаркера при этом также может снизиться.
- Стабильное состояние: размеры и количество опухолей, уровень онкомаркера не изменились.
- Прогрессирование на фоне лечения: опухоль продолжает расти, появляются новые очаги, уровень онкомаркера повышается.
Если лечение эффективно, его продолжают по прежней схеме. В противном случае комбинации химиопрепаратов нужно менять.
Побочные эффекты применения химиопрепаратов
Химиотерапия вызывает различные побочные эффекты. Симптомы могут возникать спустя некоторое время после начала лечения и даже по завершении курса. Одни из них быстро проходят, другие сохраняются в течение длительного времени. Степень их выраженности тоже бывает разной, это зависит от многих факторов, таких как возраст, состояние здоровья пациента, тип, доза и способ введения химиопрепарата, параллельный прием других лекарств.
Вы можете подробно узнать о возможных побочных эффектах химиопрепаратов на этой странице.
Что такое персонализированная химиотерапия?
За последние годы подходы к классификации злокачественных опухолей несколько изменились. Раньше ученые могли лишь рассматривать раковые клетки под микроскопом, сейчас появилась возможность изучать их молекулярно-генетические характеристики. Клетки могут выглядеть одинаково, но иметь разный набор изменений в генах. В них вырабатываются разные вещества, которые по-разному помогают им выживать, размножаться, защищаться от агрессии иммунитета.
Если рассматривать рак на молекулярно-генетическом уровне, то окажется, что двух одинаковых опухолей практически не существует. Каждый пациент индивидуален, каждому нужен свой подход при выборе комбинации химиопрепаратов. Такое лечение называется персонализированным. Оно наиболее эффективно, так как в нем реализован важнейший принцип медицины: «лечить не болезнь, а больного».
Сейчас молекулярно-генетические исследования, которые помогают назначить персонализированную химиотерапию, доступны далеко не в каждой клинике. Но за ними — будущее онкологии.
Таргетная терапия и иммунотерапия: «усовершенствованные» химиопрепараты
Возможность изучать молекулярно-генетические характеристики рака привела к появлению относительно новой группы противоопухолевых средств — таргетных препаратов. Эти «снайперы» действуют на конкретные молекулы, которые необходимы злокачественным опухолям для роста, выживания, защиты от иммунитета. В отличие от классических химиопрепаратов, таргетные препараты не действуют на здоровые клетки, реже вызывают тяжелые побочные эффекты.
Большие надежды современные ученые и врачи-онкологи возлагают на иммунопрепараты. Эти лекарственные средства используют возможности иммунной системы, чтобы уничтожать раковые клетки.
Развитие онкологии не останавливается. Ученые продолжают работать над созданием новых противоопухолевых препаратов. Некоторые лекарства сейчас проходят клинические испытания. К сожалению, создание и проверка новых препаратов — процесс долгий и недешевый. Тем не менее, прогресс есть, а значит, есть и надежда для онкологических больных.
Препараты для восстановления после химиотерапии
Как мы уже упоминали, химиопрепараты атакуют не только опухолевые, но и здоровые клетки. После курса лечения в той или иной степени могут пострадать разные органы. Это неизбежное зло, с которым приходится мириться, чтобы уничтожить раковые клетки.
Для более быстрого и полноценного восстановления после химиотерапии каждый пациент получает индивидуальную программу лечения. В первую очередь усилия направлены на восстановление состава крови, нормализацию работы печени, почек, сердца, борьбу с депрессией и другими психоэмоциональными проблемами.
Выбор препаратов для восстановительного лечения после химиотерапии довольно большой. Важно не забывать и о таких «скучных» мерах, как правильный образ жизни, питание, полноценный сон и отдых, физическая активность. БАДы тоже могут быть полезны, но если вы решили принимать их, сначала нужно проконсультироваться с лечащим врачом.
Читайте также:
