Локализация опухолей индуцированных радиацией. Особенности радиационного канцерогенеза
Добавил пользователь Валентин П. Обновлено: 29.01.2026
В данной статье рассматривается радиочувствительность опухолей, его значение в лучевой терапии, а также процессы и способы радиомодификации. В основе лучевой терапии лежат понятия о действии различных видов ионизирующего излучения, а также возможности целенаправленного изменения эффектов облучения с помощью применения методов радиомодификации. В настоящее время в лучевой терапии методы радиомодификации позволяют, с одной стороны, путем применения радиосенсибилизаторов повысить эффективность облучения злокачественных опухолей, а с другой – увеличить защиту здоровых тканей при применении радиопротекторов. К способам радиомодификации относятся сочетание лучевой терапии с химиопрепаратами, гипертермией, повышение кислорода в опухолевых тканях, в том числе применение электрон-акцепторных соединений, искусственная гипергликемия, - это способы, повышающие радиочувствительность опухолей; гипоксирадиотерапия, применение модификаторов биологических реакций, - это способы, понижающие радиочувствительность нормальных тканей. Знания о радиочувствительности опухолей и нормальных тканей имеет существенное значение в лучевой терапии. Важен правильный выбор лучевой терапии, так как это играет ведущую роль в эффективности лечения опухолей, результатах выживаемости, частоте возникновения осложнений и рецидивов злокачественных новообразований, качества жизни. Благодаря знанию всех способов радиомодификации имеются реальные возможности улучшения результатов лучевой терапии путем управления радиочувствительности злокачественных новообразований с помощью радиомодифициующих агентов, что ведет к расширению радиокурабельности опухолей.
1. Асатурян М.А. и др. Основы и клиническое применение лучевой терапии //Лучевая диагностика и лучевая терапия: учеб. пособие / под ред. Г.Е. Труфанова.- СПб.: ВМедА, 2005. – С. 106-134.
2. Асатурян М.А. и др. Современные принципы лучевой терапии злокачественных опухолей // Сб. учеб. пособий по актуальным вопросам лучевой диагностике и лучевой терапии / под ред. Г.Е. Труфанова. – СПб.: Элби-СПб, 2004. – С. 253-271.
3. Ганцев Ш.Х. Онкология: учебник для студентов медицинских вузов. – 2-е изд., испр. и доп. – М.: ООО «Медицинское информационное агентство», 2006. – 488 с.: ил.
4. Труфанов Г.Е., Асатурян М.А., Жаринов Г.М., Малаховский В.Н. Лучевая терапия: учебник / под ред. Труфанова Г.Е. – М.: ГЭОТАР –Медиа, 2013. – 208 с.: ил.
5. Шайн А.А. Онкология: учебник для студентов медицинских вузов. Тюмень: Издат. центр «Академия»,2004. 544 с.
Введение: Степень восприимчивости к излучению называют радиочувствительностью. Клетки, ткани, органы человека в разной степени чувствительны к облучению. Радиочувствительность тканей и клеток не является величиной постоянной, она меняется в зависимости от состояния организма и от действия внешних факторов, а также от уровня пролиферативной активности органов и тканей. Согласно заключению экспертов ВОЗ, успех лучевой терапии примерно на 50% зависит от радиочувствительности опухоли, на 25% от аппаратного оснащения, на 25% от выбора рационального плана лечения и точности его воспроизведения от сеанса к сеансу облучения[3].
Цель: разделение опухолей по степени восприимчивости к ионизирующему излучению; изучение факторов, от которых зависит радиочувствительность; рассмотрение всех способов радиомодификации.
С целью представления о радиочувствительности различных опухолей и тканей приведем таблицу 13.
Степень восприимчивости к ионизирующему излучению
Неходжкинская лимфома, лимфогранулематоз, лейкемия, семинома, мелкоклеточный рак легкого, опухоли головы и шеи, дисгерминома, опухоль Юинга
Кроветворная, лимфоидная ткань, сперматогенный эпителий, эпителий фолликулов яичников, эпителий ротоглотки, кожа
Опухоли молочной железы, немелкоклеточный рак легкого, аденокарцинома желудочно-кишечного тракта, рак шейки матки, рак предстательной железы
Железистый аппарат желудка, толстой кишки, молочной железы, эпителий слизистой тонкой кишки
Фибросаркома, остеогенная саркома, хондросаркома, рак почки, нейрогенные опухоли
Хрящевая, костная, мышечная, фиброзная ткани
Из данной таблицы следует, что наиболее чувствительны к облучению кроветворная, лимфоидная ткань, сперматогенный эпителий, эпителий фолликулов яичников, эпителий ротоглотки, кожа. Далее по степени радиочувствительности идут железистый аппарат желудка, толстой кишки, молочной железы, эпителий слизистой тонкой кишки хрящевая, костная, мышечная, фиброзная ткани. К радиочувствительным опухолям относят неходжкинская лимфома, лимфогранулематоз, лейкемия, семинома, мелкоклеточный рак легкого, опухоли головы и шеи, дисгерминома, опухоль Юинга. Промежуточной радиочувствительностью обладают опухоли молочной железы, немелкоклеточный рак легкого, аденокарцинома желудочно-кишечного тракта, рак шейки матки, рак предстательной железы. Резистентными являются фибросаркома, остеогенная саркома, хондросаркома, рак почки, нейрогенные опухоли. Несмотря на то, что в данной таблице отмечены железистый аппарат желудка, толстой кишки, эпителий слизистой тонкой кишки, обладающие промежуточной радиочувствительностью, при опухолях с локализацией в этих органах лучевую терапию применяют редко либо вовсе не применяют, так как опухоли данных локализаций подвижны из-за перистальтических движений желудка и кишечника[4]. А при раке печени не применяют лучевую терапию из-за низкой толерантности печени к ионизирующему излучению[5].
Радиочувствительность злокачественной опухоли к ионизирующему излучению определяется большим числом факторов: возрастом, состоянием больного, формой роста, гистологическим типом новообразования, состоянием тканей, окружающих опухоль, соотношением в опухоли клеточных и стромальных элементов, скоростью репопуляции клеток, степенью оксигенации тканей, наличием некротических участков и гипоксических клеток[3].
Рассмотрим некоторые факторы, влияющие на чувствительность опухолей:
- На чувствительность опухоли к излучению влияет степень дифференцировки клеток: чем менее дифференцированы клетки, тем выше радиочувствительность опухоли. Например, мелкоклеточный рак легкого намного чувствительный к облучению, чем плоскоклеточный рак или аденокарцинома этого же органа.
- Степень повреждающего действия зависит от фазы клеточного цикла, в которой находятся пролиферирующие клетки в момент облучения: наибольшей чувствительностью обладают клетки в фазе G2 и M, меньшей – находящиеся в фазах G1 и S.
- Чувствительность к излучению в значительной мере зависит от клеточного состава злокачественной опухоли.
Способы радиомодификации. Достижения в области радиобиологии – изучение прямого и косвенного действия радиации – привели к исследованию процессов радиомодификации.
Прежде чем перейти к способам радиомодификации необходимо знать некоторые понятия о радиомодификации: Радиомодификация – это целенаправленное изменение чувствительности тканей к облучению. Радиомодифицирующие агенты – это физические и химические факторы, с помощью которых эффективность лучевых воздействий может быть повышена путем усиления радиопоражаемости опухоли и ослабления лучевых реакций нормальных тканей. Радиосенсибилизация лучевого воздействия – это процесс, при котором различные способы приводят к увеличению поражения тканей под влиянием облучения. Радиопротекция - действия, направленные на снижение поражающего эффекта ионизирующего излучения. Соответственно радиопротекторы – это вещества, снижающие радиочувствительность.
На основании выше сказанного способы радиомодификации можно разделить на две большие группы. Первая группа это способы, повышающие радиочувствительность опухолей или, другими словами, повышающие радиопоражаемость, вторая группа – способы, понижающие радиочувствиетльность нормальных тканей.
Подробно рассмотрим каждую группу.
Первая группа способов, повышающих радиочувствительность опухолей:
- Чувствительность опухоли ионизирующего излучения можно повысить, сочетая лучевую терапию с приемом некоторых химиопрепаратов. Используя химиопрепараты в качестве синхронизаторов клеточного цикла (5-фторурацил, платидиам, винкристин и др.), можно на некоторое время задерживать опухолевые клетки в фазе S. Затем большинство клеток синхронно вступает в наиболее радиочувствительные фазы G2 и М, и именно в этот период желательно производить облучение опухоли.
В фазе митоза, наиболее чувствительной к излучению, клетку задерживают винкаалколоиды и таксаны. Гидроксимочевина тормозит цикл в фазе G1. Препараты платины при сочетании с лучевым воздействием тормозят процессы восстановления повреждений опухолевых клеток. Митомицин С – влияет на радиорезистентные клетки в состоянии гипоксии. Применение его в сочетании с лучевой терапией при злокачественных новообразованиях головы и шеи значительно повышает выживаемость больных.
- Терморадиотерапия – сочетание ионизирующего излучения с гипертермией. Повышение местной температуры в опухоли до 42-44 °С вызывает гибель многих клеток злокачественного новообразования. Осуществляют с помощью генераторов электромагнитного излучения в СВЧ-, УВЧ-диапазонах. Используют при лечении больных меланомой, рака прямой кишки, молочной железы, опухоли головы и шеи, саркомы костей и мягких тканей.
- Сочетание лучевой терапии с повышением содержания в опухоли кислорода. Содержание кислорода в опухоли удается повысить искусственным путем. Для этого применяют облучение больных с использованием для дыхания чистого кислорода при обычном давлении (оксигенорадиотерапия) либо в барокамере под давлением 3-4 атм. (оксигенобарорадиотерапия). Особенно эффективно при лучевой терапии недифференцированных опухолей головы и шеи.
В качестве модифицирующего агента также используют электрон-акцепторные соединения (ЭАС) – метронидазол, мизонидазол, имитирующие функцию кислорода – его сродство к электрону.
- Сочетание лучевой терапии с искусственной гипергликемией. В связи с активным поглощением и накоплением опухолевой тканью глюкозы крови, введение глюкозы больному приводит к временной гипергликемии. Что, в свою очередь, приводит к снижению рН в опухолевых клетках. Следовательно, будет повышаться радиочувствительность за счет нарушения процессов пострадиационного восстановления в кислой среде. Поэтому гипергликемию обуславливает значительное усиление противоопухолевого действия ионизирующего излучения.
На основании данных о способах радиосенсибилизации рассмотрим частоту использования трех основных методов повышения радиочувствительности (оксигенобарорадиотерапия, терморадиотерапия, химиолучевая терапия) при различных видах опухолей (табл.2)[1,2].
Локализация опухолей индуцированных радиацией. Особенности радиационного канцерогенеза
Локализация опухолей определяется преимущественно характером распределения инкорпорированного радиоактивного вещества по организму. При поражении 90Sr наиболее часто развиваются остеосаркомы и лейкозы, при поражении 137Cs— лейкозы, при поражении 131I — опухоли щитовидной железы.
Судя по литературным данным, у людей латентный период лучевого канцерогенеза колеблется от 5 до 20 лет.
Общепризнано, что опухоли, индуцированные внешним облучением и инкорпорированными радиоактивными веществами, морфологически не отличаются от соответствующих спонтанных новообразований. Это подтверждается гистологическими, гистохимическими и электронно-микроскопическими наблюдениями.
В частности, при так называемой гистологической аккомодации клеток альвеолярного эпителия, которая, как правило, возникает в зоне роста опухолей легких радиационной и другой этиологии, выявляется повышенная активность дегидрогеназ цикла Кребса, диафораз, а также снижение активности щелочной фосфатазы [Куршакова Н. П., 1967; Коваленко В. Л., 1975].
Существенно, что значительная гетерогенность в активности окислительно-восстановительных ферментов и содержания нуклеиновых кислот в отдельных зонах опухоли была вначале обнаружена в новообразованиях, индуцированных радиоактивными веществами [Иванов А. Е., Куршакова Н. Н., 1969], а затем и в различных спонтанных опухолях.
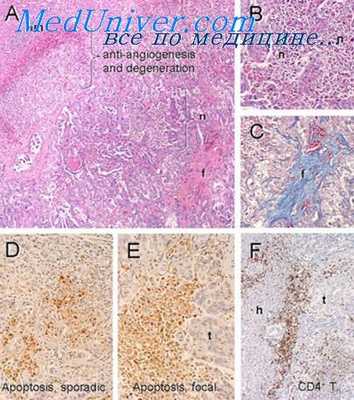
К сожалению, электронно-микроскопических исследований по радиационному канцерогенезу мало. Внимание онкологов было больше направлено на изучение ультраструктурных изменений в опухолевых клетках, облученных in vivo или in vitro. Тем не менее некоторые данные позволяют предположить, что каких-либо принципиальных различий в ультраструктурной организации опухолевых клеток при радиационном, спонтанном или другом канцерогенезе не существует.
В частности, у крыс в клетках раковой опухоли щитовидной железы, вызванной общим внешним облучением, инкорпорированием 131I или метилтиоурацила, были отмечены одинаковые ультраструктурные изменения в виде редукции зернистой цитоплазматической сети, пластинчатого комплекса, микроворсинок и перераспределения рибосом [Одинокова В. А. и др., 1974]. Установлено, что ульстрзструктурная организация клеток облученных первичных культур фибробластов является отражением поведения ДНК и не отличается от возникающей при «спонтанном» озлокачествлении их [Махотин Ю. В., 1971].
Вместе с тем заслуживает внимания тот факт, что при лучевом канцерогенезе не прослеживается прямой связи между временем повышения частоты хромосомных мутаций н временем появления первых опухолей. В частности, в печени после локального облучения в дозе 5000 Р первые опухоли появляются значительно позже, чем возникает увеличение мутаций в гепатоцитах на фоне последующего снижения или вторичного повышения числа мутаций [Ким В. X., 1973].
Другой особенностью лучевого канцерогенеза является преобладание незрелых форм опухолей, одновременное возникновение множественных очагов опухолевого роста из разных или однотипных тканей в одном и том же организме.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Радиационный канцерогенез. Классификация первично множественных опухолей по Г. Г. Непряхину
При разработке проблемы радиационного канцерогенеза в тканях центральной нервной системы также установлена роль гормонального дисбаланса в реализации бластомогенного воздействия ионизирующего излучения. В результате проведенных нами экспериментов путем внутримозгового введения источника ионизирующей радиации малой активности (гранулы Со-60; 15—30 мккюри) удалось получить истинные мозговые опухоли у кроликов и собак (И. Н. Цимант, Д. М. Абдурасулов, Г. М. Локтионов, А. Г. Столярова и М. М. Сатаев, 1964, 1966; Д. М. Абдурасулов и И. Н. Димант, 1966).
Хотя эти экспериментальные результаты еще далеки от непосредственного перенесения их в клинику, все же они показывают, что под действием одного бластомогенного фактора возникают первично множественные злокачественные опухоли различной тканевой принадлежности и в органах различных систем. В этом отношении наблюдения сотрудников нашего института согласуются с уже известными экспериментальными фактами получения первично множественных злокачественных опухолей при воздействии на организм животных таких канцерогенных веществ, как орто-аминоазотолуол, 2-ацетиламинофлуорен, нитрозамины и др. (Л. М. Шабад, 1947; И. М. Нейман, 1961, и др.).
Все указанные направления в изучении этиопатогенеза первично множественных злокачественных опухолей стоят в настоящее время в центре внимания многих исследователей. Однако в организме человека, с чрезвычайно сложными направлениями его жизнедеятельности, при наличии огромного числа вредоносных экзогенных и эндогенных факторов, пока невозможно учесть все многочисленные и разнообразные реакции, имеющие место в процессе возникновения первично множественных злокачественных опухолей. Поэтому при изучении этиопатогенеза злокачественных опухолей вообще и первично множественных раков, в частности, следует учитывать и ряд других факторов.
Должны быть продолжены наблюдения о значении наследственности, дизонтогенетических нарушений, иммунологических сдвигов и ряда других факторов, могущих иметь значение в патогенезе множественных злокачественных опухолей.
По мере накопления непрерывно увеличивающегося числа наблюдений первично множественных злокачественных опухолей возникла естественная необходимость их группировки и классификации, которые опубликовываются в литературе. Большинство из них основывается на анатомических признаках. Уже в классификации Неркорн (1901, цит. по Е. А. Цель, 1947) предусматриваются множественные опухоли одного органа, системы органов, парных органов, и, наконец, различные по строению опухоли разных, не зависящих друг от друга органов. В последующих классификациях Ханзе-ман, Эгли, Харбиту, Борста, Ратнера и Воротилкина, Шим-мельбуша и других (цит. по Е. А. Цель, 1947) с некоторыми дополнениями и видоизменениями проводится по существу то же анатомическое разделение.
Ценность всех этих классификаций состоит в том, что они подчеркивают необходимость разграничения первично множественных злокачественных опухолей по двум признакам: по их локализации (в одном органе, органах одной системы, парных органах и органах различных анатомически и функционально непосредственно не связанных систем) и по гистологическому их строению (одинаковому и различному).
Эти принципы группировки проведены Г. Г. Непряхиным, изучившим сводные патологоанатомические материалы о первично множественных злокачественных опухолях. Собранные в литературе 487 случаев он разделил на следующие группы и подгруппы.
I. Собственно первично множественные злокачественные опухоли.
1) саркомы (одного и того же гистологического строения):
а) в одном и том же органе или ткани;
б) в различных органах.
2) раки (одного и того же гистологического строения) :
а) в одном и том же органе или ткани;
б) в различных органах.
II. Сочетания различных злокачественных опухолей друг с другом.
1) сочетания сарком и раков:
а) в одном и том же органе или ткани;
б) в различных и парных органах.
2) сочетания трех различных злокачественных опухолей (сарком, раков и других).
3) сочетания сарком и других (кроме рака) злокачественных опухолей.
4) сочетания различных раков друг с другом:
а) в одном и том же органе;
б) в различных и парных органах.
5) сочетания рака с другими (кроме сарком) злокачественными опухолями.
Приведенная группировка ценна в том отношении, что она предусматривает четкое разделение опухолей не только по тканевому происхождению, но и по гистологической структуре; до известной степени учитывается локализация их по органам и тканям. Вместе с тем, в этой схеме недостаточно детализирована локализация опухолей — не предусмотрена группа поражений парных органов, группа поражений различных органов одной системы, а для некоторых сочетаний не рассматривается и органная локализация. Кроме того, вызывает сомнение предлагаемое автором разделение первично множественных злокачественных опухолей на собственно первично множественные и на сочетания различных злокачественных опухолей.
В результате этого, например, раки органов желудочно-кишечного тракта одной гистологической структуры рассматриваются как собственно первично множественные, а раки тех же органов различной гистологической структуры анализируются как сочетания. Если такой отрыв в какой-то степени оправдан с чисто патологоанатомической точки зрения, то с этим нельзя согласиться в клинических наблюдениях и в особенности при изучении патогенеза первично множественных злокачественных опухолей. В предложенных позднее группировках, предназначавшихся для клинических наблюдений, указанные недостатки частично устранены и предложены дополнительные критерии разделения первично множественных злокачественных опухолей.
Ионизирующая и естественная радиация как причины развития рака - лучевой канцерогенез
Жесткое излучение вызывает разрывы цепочек ДНК и хромосомные аберрации, такие как фрагментация участков, делеция или транслокация генов. В большинстве случаев такие хромосомные нарушения ведут к гибели клетки в процессе деления. Однако механизмы злокачественной трансформации под действием излучения изучены довольно слабо.
Экстраполировать наблюдения за жертвами ядерных бомбардировок, получивших огромные дозы облучения, на оценки риска фоновой радиоактивности бывает чрезвычайно трудно. Средняя доза, получаемая, например, при контакте с токсическими отходами, составляет, по разным оценкам, около 0,001 мЗв (миллизиверт), а максимальная — 0,3 мЗв. Средняя поглощенная доза при рентгенологических обследованиях составляет 0,3 мЗв (что сопоставимо с фоном космической радиации).

Для среднестатистического индивидуума ежегодная доза поглощенного от всех источников излучения составляет в Великобритании величину порядка 2,5 мЗв. Оценено, что увеличение смертности от облучения составляет величину порядка 3-5 случаев на каждые 100 тыс. мЗв поглощенной дозы. Таким образом, можно подсчитать, что жесткое излучение ответственно примерно за 2000 смертей из 160 тыс. ежегодно умирающих от рака в Великобритании. Одним из наиболее значимых факторов природного радиационного фона является газ радон, который особенно опасен в плане вызывания рака легких.
В то же время фоновая радиация гораздо менее значимый фактор риска в заболеваемости раком легких, чем курение или промышленные загрязнения атмосферы. С другой стороны, жесткое излучение может вызывать саркомы костных и мягких тканей, что является основной причиной ограничения применения радиотерапии на детях, больных раком. Дальнейшее обсуждение рассматриваемых вопросов приводится в отдельной подробной статье на нашем сайте (используйте форму поиска на главной странице).
Световое излучение в ультрафиолетовой области (УФ) может быть причиной развития рака кожи. При световой экспозиции ДНК клеток поглощает фотоны, что ведет к образованию тиминовых димеров.
В здоровом организме такие пиримидиновые димеры довольно быстро удаляются за счет действия клеточных систем репарации. К возникновению мутаций могут привести ошибки самой системы репарации. Так ошибка в исправлении поврежденого гена р53 может привести к тому, что с него будет считываться дефектный белок р53. Появление дефектного белка в свою очередь ведет к нарушению механизма клеточного деления.
В пигментном слое ошибки систем репарации ДНК являются фатальными, так как могут привести к развитию индуцированного ультрафиолетом рака кожи.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Научная электронная библиотека

Представления о молекулярно-клеточных механизмах онкогенной трансформации клеток претерпели значительную эволюцию на протяжении XX века и до настоящего времени [18, 20, 25, 32, 34].
Как указывалось выше, инициирующими этиологическими факторами малигнизации клетки являются разнообразные по природе группы канцерогенов химической, физической, биологической природы, в том числе вирусы, гормоны и генотоксические продукты их метаболизма [13, 26, 63].
Естественно, что при чрезвычайной гетерогенности этиологических факторов неоплазий не могла сформироваться достаточно быстро доминирующая концепция механизмов развития онкогенной трансформации клеток, их активации или промоции опухолевого роста с последующей опухолевой прогрессией. В ранних концепциях канцерогенеза делали акцент на эпигеномных механизмах развития неоплазий, и, безусловно, ряд положений этого направления носит не только исторический характер, но может быть в определенной степени ассоциирован с современными вирусо-генетической и онкогенной теориями канцерогенеза.
Согласно данным ряда исследователей, первичное изменение свойств цитоплазматической мембраны под влиянием канцерогенных углеводородов, онкогенных вирусов является одним из пусковых механизмов последующего изменения генетического аппарата и нарушений регуляции их митотического цикла [108]. Эта концепция канцерогенеза была актуальна в период обнаружения отсутствия контактного ингибирования опухолевых клеток в монослойной культуре.
Как оказалось далее, в механизмах контактного ингибирования клеток важная роль отводится активации мембранной аденилциклазы и увеличению уровня цАМФ, тормозящего митотическую активность клеток. Понижение концентрации цАМФ в мембранах клеток под влиянием различных канцерогенов ведет к неконтролируемой митотической активности. Эта точка зрения имела определенную значимость в понимании пусковых механизмов канцерогенеза, поскольку для многих гормонов, регулирующих метаболизм клеток, их митотическую активность, характерен преимущественно мембранный тип рецепции (АКТГ, СТГ, инсулин, пролактин и др.).
Практически одновременно с мембранной концепцией канцерогенеза создавались митохондриальная и лизосомальная теории развития неоплазий, согласно которым актомиозиновый белок митохондриальных мембран оказывается аномальным у малигнизированных клеток и утрачивает чувствительность к регулирующим влияниям АТФ; при этом гликолитическая реакция опухолевой клетки стимулируется митохондриальными факторами, поступающими постоянно в гиалоплазму, а возрастание концентрации АТФ не подавляет этот процесс.
Со временем митохондриальная теория канцерогенеза утратила свою актуальность, однако факт чрезмерной интенсификации гликолитических реакций, даже в условиях достаточной оксигенации опухолевых клеток, наличие обратного эффекта Пастера остаются неоспоримыми и характерными признаками метаболического атипизма опухолевых клеток. Наименее веской оказалась теория так называемого «лизосомального» канцерогенеза, согласно которой канцерогены вызывают лабилизацию мембран лизосом, активизацию и выход в цитоплазму гидролаз, в частности, ДНК-азы, обеспечивающей разрыв двойной связи ДНК и развитие опухолевой трансформации клеток. Однако, как известно, лизосомы – очень реактогенные субклеточные образования, проницаемость мембран которых резко возрастает под влиянием различных патогенных факторов экзогенного и эндогенного происхождения, далеко не всегда являющихся канцерогенами [32].
Одним из классических признаков неоплазий является нарушение регуляции дифференцировки и митотической активности клеток, в связи с чем указанная проблема затрагивается в той или иной форме в разных концепциях [1]. Однако до настоящего времени одной из ведущих концепций канцерогенеза является мутационная теория, согласно которой все канцерогены обладают мутагенной активностью, хотя не все мутагены являются канцерогенами.
Практически все изученные канцерогены индуцируют разрывы фосфодиэстеразных связей в молекуле ДНК. Вначале канцерогены интенсивно связываются с ДНК чувствительных клеток. Обнаружена прямая корреляция между чувствительностью животных и их органов к малигнизирующему действию веществ и степенью их связывания с ДНК [42].
Показано, что многие химические канцерогены способны к интеркаляции между основаниями ДНК с последующим сдвигом «рамки считывания» генетической информации. Установлено, что канцерогены различных классов взаимодействуют активно с нуклеиновыми основаниями ДНК; при этом ослабляется связь основания с сахарами, возникают гидролиз, денатурация ДНК. Горячими точками при индукции канцерогенами мутации сдвига «рамки считывания» являются полипуриновые участки ДНК. Возникновение повреждения под влиянием химических канцерогенов (полициклических углеводородов, ароматических аминов и амидов, алкилирующих соединений) может индуцировать процесс генетической рекомбинации, конверсии генов [66].
В последующие годы важная роль в развитии онкогенной трансформации клеток и опухолевой прогрессии отведена свободным радикалам. Учитывая значимость индукции избыточных концентраций свободных радикалов в канцерогенезе, необходимо прежде всего остановиться на активации процессов липопероксидации, инициируемой активными формами кислорода (АФК) и в то же время являющейся источником образования значительного количества вторичных эндогенных свободных радикалов [7, 8].
Как известно, активные формы кислорода вступают во взаимодействие с полиненасыщенными жирными кислотами (ПНЖК): линолиевой, линоленовой, арахидоновой – важнейшими компонентами фосфолипидов биологических мембран. Отрыв водорода от молекулы ПНЖК при участии АФК приводит к перемещению двойных связей с образованием гидроперекисей диеновых коньюгатов, которые затем метаболизируются во вторичные (малоновый диальдегид) и третичные продукты липопероксидации [66]. Перекисное окисление липидов затрагивает прежде всего фосфолипиды цитоплазматических мембран клеток, нарушая при этом энергозависимый трансмембранный перенос субстратов, процессы межклеточного взаимодействия. Биологическая активность АФК связана с синтезом простагландинов, лейкотриенов окислительной модификацией белков, нуклеиновых кислот, липидов. Одним из проявлений окислительной модификации белка является инактивация около 240 ферментов, в частности, СОД, ацетил-КоА-гидролазы, каталазы, миелопероксидазы, цитохрома Р450 [22, 66].
Дезинтеграция белка в основном возникает под влиянием гидроксильного радикала, образующегося в организме в процессе реакции взаимодействия супероксида и перекиси водорода с металлами переменной валентности. Объектами окисления в молекуле ДНК под влиянием гидроксильного радикала являются углеводные компоненты, фосфатные группировки, азотистые основания. Наиболее чувствительным к окислительной деструкции азотистым основанием является гуанин, модифицированные формы которого составляют 45 % от общего количества окисленных оснований [83, 95].
Установлено, что чувствительность к фрагментации сахарно-фосфатного остатка ДНК под влиянием АФК оказалось более высокой, чем полипептидного остова белково-пептидных субстанций. Гидроксильный радикал, действуя на ДНК, может отрывать атом водорода от дезоксирибозофосфата, что ведет к его расщеплению и освобождению азотистых оснований. При этом образуются высокотоксичные производные альдегиды.
Данные, опубликованные в последние годы, убедительно свидетельствуют о том, что активные формы кислорода, оксид азота и его производные в сочетании с инфекционными патогенными факторами, бактериями и вирусами, являются ключевыми факторами канцерогенеза [2, 35, 36].
Детальный обзор литературы по этому вопросу приведен в работе Х. Маеда, Т. Акаике (1998). Кислородные радикалы, а также оксид азота могут повреждать ДНК, вызывая мутацию. Мутагенный и канцерогенный эффекты указанных соединений резко возрастают при одномоментной, избыточной продукции, сопровождающейся их взаимодействием с образованием пероксинитрита. Последний участвует в различных внутриклеточных метаболических процессах: нитровании остатков тирозина в белках, подавлении транспорта электронов в митохондриях, в окислении тиоловых соединений. Пероксинитрит является ДНК-расщепляющим агентом. Вышеуказанные химические реакции с участием пероксинитрита могут инициировать апоптоз, мутации, онкогенную трансформацию клеток.
Как указывалось выше, в механизмах индукции канцерогенеза важная роль отводится онкогенным ДНК- и РНК-содержащим вирусам, способным инкорпорировать свою ДНК или ДНК-копию в геном хозяина с последующей возможной онкогенной трансформацией клетки в случае экспрессии протоонкогенов.
Установлено, что РНК-содержащие онкогенные вирусы являются членами семейства ретровирусов, характеризуются наличием липидной оболочки и двух односпиральных РНК, фермента РНК-зависимой ДНК-полимеразы, необходимой для репродукции вируса. Наличие этого фермента обеспечивает обратную транскрипцию вирусной РНК- в ДНК-копию, интегрирующую с геномом клетки [71].
Группа РНК-содержащих вирусов включает следующие разновидности: непатогенную для человека группу вирусов (род А); медленно трансформирующийся вирус гормонзависимой карциномы молочной железы морских свинок и, возможно, человека (род В); дефектные быстро трансформирующиеся и недефектные медленно трансформирующиеся вирусы (род С); род Д – включает вирусы приматов и вирус перевиваемых раковых клеток человека.
ДНК-содержащие онкогенные вирусы подразделяются на следующие семейства:
1. Семейство Poxviridae, содержит, в частности, вирус контагиозного моллюска человека.
2. Семейство Herpes viridae, к которому относится вирус Эпштейн-Барра человеа, вызывающий лимфому Беркитта, цитомегаловирус человека – тип 5.
3. Семейство Adenoviridae – представителями которого являются аденовирусы человека.
4. Семейство Papovaviridae, представителями которого являются вирусы папилломы крыс, хомяков, обезьян, человека.
ДНК-содержащие вирусы внедряют свою ДНК в геном хозяина при участии ферментов эндонуклеаз и липаз, а за счет наличия генов – промоторов – вирусы инициируют транскрипцию генов, следующих за ДНК-вирусами. Последствия внедрения ДНК-вирусов в геном хозяина зависят от зоны инкорнации: интронов, экзонов, протоонкогенов, антионкогенов. Если ДНК-содержащие вирусы встраивают в геном хозяина клетки регуляторы экспрессии протоонкогенов, возможна малигнизация клетки [54].
Механизмы онкогенной трансформации клеток под влиянием ДНК-содержащих вирусов могут быть весьма разнообразны: за счет индукции ранних онкобелков, так называемых Т-антигенов, усиления экспрессии рецепторов экзогенных ростовых факторов. Большие и средние Т-белки ряда ДНК-содержащих вирусов выключают контактное ингибирование пролиферации клеток, препятствуют действию антионкогена р53.
Как известно, вирусо-генетическая теория Л.А. Зильбера явилась основной для формирования современной онкогенной теории канцерогенеза. На смену вирусогенетической теории канцерогенеза пришли теории онкогенов, протоонкогенов и антионкогенов [30, 31, 65, 120].
В настоящее время, очевидно, что в опухолевой трансформации клеток, возникающей под влиянием различных индукторов канцерогенеза, принципиально участвуют следующие категории генов:
1. Онкогены- стимуляторы функций.
2. Гены роста и пролиферации клеток (Myc, Ras, Los, ABL и другие).
3. Антионкогены (потеря функции).
4. Гены, отвечающие за программированную смерть клетки (апоптоз):
– отменяющие программированную смерть: Bcl-2 (стимуляция функций);
– гены смерти клеток – р53 (потеря функции).
Онкогены как специфический химический материал, кодирующий информацию об определенном химическом продукте, впервые были идентифицированы в составе ретровирусов. Геном типичного не трансформирующего ретровируса представляет собой две молекулы односпиральной РНК. Основные гены вируса относятся к трем регионам: gag кодирует структурные белки вирион частицы, env– белки оболочки вириона, ген pol – несет информацию об обратной транскрипции. Последний обеспечивает образование ДНК- копии на матрице РНК-вируса.
Согласно гипотезе онкогенов, гены ретровирусов, попавшие в геном человека в процессе эволюции, переходят по наследству в ряде поколений, проявляют себя в раннем онтогенезе, а затем подавляются внутриклеточными репрессорами. С возрастом под влиянием различных канцерогенов физической, химической, биологической природы возникают экспрессия вирусных онкогенов и усиление продукции ими онкобелков, ответственных за малигнизацию клетки. Онкогенные свойства нетрансформирующих ретровирусов обусловлены наличием в их геноме V-онкогенов, причем большинство из 50 V-онкогенов имеют клеточные прототипы – С-протоонкогены.
Высказывается мысль, что ретровирусы не только могут вносить в определенные позиции клеточного генома V-онкогены, но и способны быть промоторами для усиленной экспрессии протоонкогенов клеток. Считается, что в ходе совместной эволюции ретровирусов и клеток происходят захват клеточных протонкогенов вирусами и их перенос [24].
Развитие теории онкогенов нашло отражение в концепции Темина (1972) о протовирусах, протоонкогенах, согласно которой предсуществующий аналог вируса не является результатом инфекции, а нормальным клеточным геном, необходимым для роста и онтогенеза клеток, причем нормальные клетки не содержат вирусных онкогенов, но зависят от контролируемой экспрессии их клеточных аналогов.
В механизмах развития неоплазий онкогенные ретровирусы играют неоднозначную роль: различают быстро- и медленно-трансформирующие вирусы. Быстротрансформирующие вирусы дефектны по структуре, утратили часть своих поздних репликативных генов и приобрели взамен видоизмененные клеточные гены-V-онкогены, которые и вызывают неопластическую трансформацию при повторной интеграции в клеточный геном. Для полного цикла репликации этим вирусом требуются вирусы-помощники. Клеточные протоонкогены являются прототипами V-онкогенов, консервативными регуляторами клеточной дифференцировки.
Встраивание быстро-трансформирующего реторовируса может либо привести к экспрессии в клетке V-онкогена, либо вирусные промоторы и энхансеры встраиваются рядом с протоонкогенами клетки, вызывая их экспрессию.
Медленно-трансформирующие ретровирусы вызывают в эксперименте рак молочной железы и хронические лейкозы; они способны самостоятельно реплицироваться в клетки, не содержат V-онкогенов, способны к «вставочному» мутагенезу. При этом возникает гиперэкспрессия клеточного протоонкогена.
Таким образом, встраивание ретровирусов в геном клетки приводит к гиперэкспрессии протоонкогенов, переход их в онкогены с последующей малигнизацией клетки [20, 23, 30, 64].
Что касается механизмов индукции неоплазий химическими канцерогенами с точки зрения современных теорий канцерогенеза – протоонкогенов, онкогенов, антионкогенов, то необходимо остановиться на анализе лишь некоторых работ, посвященных данной проблеме.
Как известно, химические канцерогены, подобно биологическим, способны вызывать развитие мутаций и активацию протоонкогенов [25, 64]. Под влиянием химических канцерогенов возможна онкогенная трансформация в процессе амплификации ДНК. Установлено, что амплификация гена резистентности на фоне воздействия цитостатиков нередко возникает при раке кишечника и является причиной устойчивости неоплазий к химиотерапии. При ряде онкологических заболеваний желудочно-кишечного тракта возникает амплификация онкогенов erbB2, mys, SRS. Индукция развития опухолей нитрозмочевиной связана с амплификацией и активацией N-ras; в опухолях, индуцированных гамма-облучением, активен Ras-H. В ходе химического канцерогенеза отмечено гипометилирование протоонкогена Ras-H, приводящего к развитию генной мутации.
В опухолях, индуцированных химическими канцерогенами, отмечены транскрипции ряда других онкогенов (c-ras и c-mys), связанные с гипометилированием протоонкогена либо его амплификацией. В ходе химического канцерогенеза нарушается зависимость экспрессии c-mys (но не c-ras) от клеточного цикла. Таким образом, многие химические соединения или физические воздействия, а также вирусы могут вызывать мутации ДНК, не летальные для клеток и провоцирующие экспрессию протоонкогенов или депрессию антипротоонкогенов [108]. Последнее приводит к трансформации нормальной клетки в опухолевую.
Эпигенетический механизм канцерогенеза связан с нарушением регуляции клеточного роста, функции клетки и экспрессии генов без повреждения генома. При эпигенетическом канцерогенном эффекте эндогенных или экзогенных канцерогенных факторов возникает инактивация белков-продуктов антипротоонкогенов или активация пострецепторных передатчиков ростовых факторов. Такое воздействие, как правило, не вызывает неоплазии, но усиливает ростовые эффекты, способствует пролиферации мутантного клона и формированию распознаваемой неоплазии. Эффект канцерогенов-мутагенов называют инициирующим, а коканцерогенов – активирующим.
Таким образом, в настоящее время очевидны следующие механизмы активации протоонкогенов:
1) амплификация протоонкогенов, в результате чего резко возрастает их общая активность, что может привести к малигнизации клетки;
2) мутации протоонкогенов, приводящие к их активации, и ингибиция антипротоонкогенов;
3) транслокация протоонкогенов в локус с функционирующим промотором;
4) аддукция промотора рядом с протоонкогеном. В качестве промотора могут выступать ДНК-копии определенных участков онкорнавирусов, а также мобильные генетические структуры, способные перемещаться и встраиваться в различные участки генома.
В геноме человека предполагается наличие около 100 протоонкогенов, выполняющих следующие функции:
1) кодирование ростовых факторов, их рецепторов и пострецепторных передатчиков;
2) кодирование блокаторов запрограммированной гибели клеток, контактного ингибирования пролиферации.
Трансформация протоонкогенов в онкогены приводит к их экспрессии и синтезу онкобелков. При этом онкобелки продуцируются перманентно в увеличенном количестве или в качественно измененном состоянии.
Ниже представлены несколько групп протоонкогенов, антионкогены, и кодируемые ими белки [30, 31, 32].
Читайте также:
- Симптомы герпетического стоматита и его лечение
- Воспаление предстательной железы. Причины воспаления простаты
- Рецидивирующий кариес. Прогрессирование кариеса зубов. Профилактика кариеса зубов.
- Сосудистые опухоли глаза. Кавернозная гемангиома орбиты
- Посмертное взятие анализов у новорожденных. Посмертные биопсии
