Лучевая диагностика перидурального фиброза
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Стеноз позвоночного канала является заболеванием, включает сочетание сужения позвоночного канала согласно либо компьютерной томографии(КТ), либо магнитно-резонансной томографии(МРТ) либо рентгенографии позвоночника (спондилографии) и характерных клинических симптомов. При проведении МРТ лицам старше 60 лет отмечено, что 21 % из них имел рентгенологические признаки сужения позвоночного канала на поясничном уровне. Лишь треть (33 %) предъявляли характерные для стеноза жалобы.
Внедрение в широкую клиническую практику КТ и МРТ привело к значительному увеличению диагностики данной патологии.
Классификация
- По анатомическим критериям различают
- центральный стеноз — уменьшение расстояния от задней поверхности тела позвонка до ближайшей противоположной точки на дужке у основания остистого отростка
- латеральные стенозы — сужение корешкового канала и межпозвонкового отверстия до 4 мм и менее
- врождённый или идиопатический стеноз; ахондроплазию
- приобретённый стеноз
- комбинированный стеноз — любое сочетание врождённого и приобретённого стеноза
Эпидемиология
Стеноз позвоночного канала на поясничном уровне является весьма распространённым заболеванием. Его частота резко возрастает у людей старше 50 лет и в данной возрастной группе составляет от 1.8 до 8 %. По данным датских авторов, стеноз поясничного отдела позвоночника встречается с частотой 272 случая на 1000000 населения в год. Ежегодно по поводу данной проблемы в скандинавских странах оперируется 9,7 на 100 000 населения.
Этиология
Врождённый стеноз обусловлен анатомическими особенностями строения позвоночника у человека и проявляется
- укорочением дуги позвонков
- ахондроплазией (увеличение толщины дуги позвонка, укорочение ножки и уменьшение высоты тела позвонка)
- хрящевой и фиброзной диастематомиелией
Причины возникновения приобретённого стеноза различны. Основными являются:
- деформирующий спондилоартроз с гипертрофией межпозвонковых суставов, образованием краевых остеофитов
- оссифицированные грыжи межпозвонковых дисков
- гипертрофия и оссификация жёлтой связки
- болезнь Форестье (диффузный идиопатический гиперостоз ревматоидной природы)
- болезнь Бехтерева
- спондилолистез дегенеративно-дистрофического генеза
- ятрогенный стеноз — образование субарахноидальных спаек и/или послеоперационных рубцов
- «стальной стеноз» — внедрение металлических конструкций в просвет позвоночного или радикулярного канала
Центральный стеноз возникает за счёт патологических процессов в анатомических структурах формирующих позвоночный канал (в частности межпозвонковых дисках, межпозвонковых суставах, жёлтой связке, задней продольной связке), в котором содержатся спинномозговой мешок с включенными в него нервными корешками.
Латеральный стеноз может возникать в одной или нескольких из трёх анатомических зон: зоне входа (латеральном рецессусе), средней зоне и зоне выхода (межпозвонковом отверстии).
Патогенез
Патофизиологические механизмы, вызывающие развитие характерных жалоб, обусловлены сочетанием трёх групп факторов — повышения эпидурального давления, асептического воспаления и ишемии. Возникновение каждого из них обусловлено хроническим сдавлением нервно-сосудистых структур позвоночного канала.
За счёт хронической компрессии возникает несоответствие кровотока к нервным структурам позвоночного канала. Уровень поступающей крови снижается и соответственно возникает ишемия нервного корешка (при латеральном стенозе) и конского хвоста (cauda equina) (при центральном). При комбинированном стенозе наблюдается сочетание ишемии как конского хвоста, так и нервного корешка. Отмечено, что явления ишемии вызывают процессы демиелинизации, образование спаек между мягкой и арахноидальной мозговыми оболочками, развитие интерстициального фиброза и рубцово-спаечного эпидурита.
Потребность в кислороде возрастает при усилении биохимических процессов. Этим объясняется тот факт, что жалобы на боли в спине и/или ногах, слабость при стенозе позвоночного канала возникают при ходьбе.
Несоответствие объёма нервно-сосудистых структур объёму позвоночного канала вызывает повышение эпидурального давления и как следствие вызывает возникновение воспалительного процесса. Эпидуральное давление повышается при ходьбе, что вызывает продукцию эктопических нервных импульсов и проявляется возникновением болевых ощущений
При сгибании высота межпозвонкового отверстия увеличивается на 12 %, при разгибании уменьшается на 15 %. Этим объясняется характерная жалоба, которая состоит в регрессе боли вплоть до полного исчезновения при присаживании, нагибании. Более того, на основании этого симптома проводят дифференциальную диагностику между нейрогенной (при стенозе позвоночного канала) и сосудистой перемежающейся хромотой. Так, при нейрогенной перемежающейся хромоте в отличие от сосудистой человек может достаточно долго работать на велотренажере, не испытывают жалоб при длительном вождении автомобиля.
Стеноз позвоночного канала как следствие остеохондроза
Наиболее часто приобретённый стеноз позвоночного канала является последней 4-й стадией остеохондроза позвоночника. Её возникновение характеризуется тем, что на фоне нестабильности позвоночно-двигательного сегмента (3-я стадия остеохондроза) развиваются компенсаторные процессы направленные на его стабилизацию. К ним относятся разрастание костной ткани в виде остеофитов, артроз межпозвонковых суставов. Межпозвонковые суставы ограничивают как позвоночный канал, так и зоны входа нервного корешка, промежуточную зону и межпозвонковое отверстие. Соответственно разрастание межпозвонковых суставов приводит к сужению вышеуказанных анатомических образований и соответственно к развитию стеноза.
Клиника
При исследовании группы больных со стенозом позвоночного канала на поясничном уровне отмечено, что ведущими жалобами являются:
- боль в спине (95 %)
- синдром нейрогенной перемежающейся хромоты (91 %)
- радикулярная боль в одной или двух ногах (71 %)
- слабость в одной или двух ногах (33 %)
У больных, которые отмечали сочетание боли в ноге и пояснице 70 % отмечали одинаковую интенсивность боли в ноге и пояснице, у 25 % преобладала боль в ногах. В 58 % случаев боль имелась в одной ноге и в 42 % она была двусторонней. У большинства больных отмечалась радикулопатия нескольких нервных корешков. В основном боль при стенозе позвоночного канала распространяется в дерматомах L5 (91 %) и SI (63 %), реже в дерматомах L1-L4 (28 %).
В монографии Зозули Ю. А. и соавторов приведена таблица частоты встречаемости различных жалоб у больных со стенозом позвоночного канала.
частота встречаемости %
Люмбалгия (боль в пояснице)
Нейрогенная перемежающаяся хромота
Симптомы натяжения (Лассега, Вассермана и др.)
Нарушение чувствительности в ногах
Ишиалгия (боль в ноге)
Гипотрофия мышц нижних конечностей
Нарушения чувствительности в аногенитальной зоне
Крампи икроножных мышц
Нарушение функции тазовых органов
Нейрогенная перемежающаяся хромота является патогномоничным симптомом, позволяющим ещё до проведения дополнительных методов обследования предположить наличие стеноза позвоночного канала. Для неё характерно появление боли при ходьбе, которая регрессирует при присаживании либо наклонении туловища вперёд. После этого человек снова может пройти определённую дистанцию до появления болезненных ощущений. В положении сидя больной может выполнять любую работу (велотренажёр, вождение автомобиля) без возникновения боли. Интенсивность нейрогенной перемежающейся хромоты оцениваается в расстоянии (метрах), которое может пройти человек до появления боли.
Диагностика
Диагноз стеноза позвоночного канала может быть установлен на основании сочетания клинических жалоб и сужения просвета позвоночного канала соответственно данным дополнительных методов исследования.
Сужение позвоночного канала (переднезадний размер менее 12 мм) может быть выявлено согласно магнитно-резонансной томографии, компьютерной томографии и рентгенографии (спондилографии) позвоночника.
Лечение
Лечение стеноза позвоночного канала может быть консервативным и оперативным.
Консервативное лечение
Консервативное лечение включает в себя назначение анталгических, сосудистых, противовоспалительных препаратов. Однако оно является недостаточно эффективным в лечении стеноза позвоночного канала, так как приводит к улучшению самочувствия у 32—45 % больных.
Хирургическое лечение
Хирургическое лечение стеноза позвоночного канала имеет ряд особенностей. Во-первых, имеется несколько типов операций применяемых при стенозе:
- декомпрессивная ламинэктомия
- установка стабилизирующих систем
- установка систем межостистой фиксации
Во-вторых стеноз, позвоночного канала часто сочетается с другими видами патологии позвоночника, такими как нестабильность и грыжи межпозвонковых дисков.
Декомпрессивная ламинэктомия
Декомпрессивная ламинэктомия включает в себя резекцию структур, которые приводят к сдавлению нервного корешка и/или конского хвоста (cauda equina) задним доступом, а именно остистого отростка. дуг позвонков, жёлтой связки, межпозвонковых суставов.
В историческом аспекте декомпрессивная ламинэктомия была первым типом операций, применяемых для лечения стеноза позвоночного канала.
В то же время проведение декомпрессивной ламинэктомии имеет целый ряд недостатков, которые приводят к её недостаточной эффективности. Так вследствие данной операции происходит удаление тех структур, которые формируют третью опорную колонну позвоночника по Денису или вторую опорную колонну позвночника по Holdsworth. Результатом в большом количестве случаев становится развитие нестабильности позвоночника, что приводит к неудовлетворительным результатам лечения, синдрому неудачно оперированного позвоночника. Различные источники указывают на 13—43 % риск развития нестабильности после проведения декомпрессивной ламинэктомии.
Недостаточная эффективность декомпрессивной ламинэктомии, вследствие развития нестабильности позвоночника, привела к её дополнению во многих случаях стабилизирующими операциями.
Стабилизирующие операции
Сторонники фиксации позвоночника после ламинэктомии ссылаются на биомеханические данные. Обнаружено, что ламинэктомия приводит к увеличению объёма движения при флексии на 16 % (Р < 0,05), экстензии на 14 % (Р < 0,04) аксиальной ротации на 23 % (Р < 0,03). При флексии натяжение фиброзного кольца диска после интерламинарной декомпрессии увеличивается на 20 %, а после ламинэктомии на 130 %.
Дополнение декомпрессивной ламинэктомии системами стабилизации (передними или задними) значительно улучшило результаты хирургического лечения стеноза позвоночного канала.
В то же время применение стабилизирующих систем не лишено недостатков. Кроме возможных осложнений, во время их установки, возникают нарушения биомеханики соседних со стабилизируемыми позвоночно-двигательных сегментов, которые проявляются их гипермобильностью. Это в свою очередь приводит к развитию, так называемой «болезни смежного уровня». Она включает в себя развитие спондилолистеза, стеноза позвоночного канала, переломов, сколиоза.
Недостаточная эффективность декомпрессивной ламинэктомии за счёт развития нестабильности позвоночника, развитие «болезни смежного уровня» при дополнении декомпрессии установкой стабилизирующих систем привело к поиску альтернативных методов хирургического лечения стеноза позвоночного канала.
Системы межостистой фиксации
Концепция динамической стабилизации основывается на том, что пусковым механизмом стеноза позвоночного канала является уменьшение высоты межпозвонкового диска вследствие дегенеративных изменений, что в свою очередь, обусловливает перераспределение осевой нагрузки с передних опорных столбов на задние (до 70 %). Использование динамической межостистой фиксации обеспечивает снижение нагрузки на задние опорные столбы и расширение площади позвоночного канала, что способствует уменьшению или исчезновению люмбалгического синдрома, обусловленного фасет-синдромом.
Техника установки систем межостистой динамической фиксации заключается в проведении задней декомпрессии (системы Cophlex, DIAM, WALLIS), с последующей установкой в межостистый промежуток имплантатов, которые с одной стороны восстанавливают заднюю опорную колонну (по Денису) позвоночника, а с другой сохраняют возможность сгибания и разгибания как в оперируемом так и в смежных позвоночно-двигательных сегментах.
Эффективность оперативных вмешательств по поводу стеноза позвоночного канала, в которых совмещены микрохирургическая декомпрессия и динамическая межостистая стабилизация, составляет 87 %, они позволяют значительно сократить сроки восстановления трудоспособности.
Особенностью систем межостистой динамической фиксации является возможность осуществление как сгибания, так и разгибания в позвоночно-двигательном сегменте, что предотвращает развитие у больных «болезни смежных уровней»
При установке имплантатов в межостистый промежуток также уменьшается нагрузка на межпозвонковые суставы, происходит аксиальная декомпрессия корешков вследствие увеличения высоты межпозвонковых отверстий. Уменьшение нагрузки на суставы способствует релаксации связочного аппарата
Противопоказанием к применению межостистой динамической стабилизации является нестабильность в позвоночно-двигательном сегменте. Поскольку они стабилизируют лишь задние опорные столбы (по Денису), то их лечебный эффект при данной патологии оказывается недостаточным.
На данный момент в медицине используются следующие системы межостистой динамической фиксации — Coflex (Co-promotes flexion) — синоним U-имплантат, DIAM (Device for Intervertebral Assisted Motion), Wallis (Wall Inter Spinously placed), X-Stop (eXtension Stop), In-Space и Aperius.
Особенности хирургического лечения стеноза сочетающегося с нестабильностью
При сочетании стеноза позвоночного канала с нестабильностью позвоночника применение лишь декомпрессии или систем межостистой динамической фиксации неприемлемо, так как вызовет нарастание нестабильности и ухудшение самочувствия больного.
При нестабильности в сочетании со стенозом позвоночного канала методом выбора является применение стабилизирующих систем (как передних, так и задних)
Особенности хирургического лечения стеноза позвоночного канала в сочетании с межпозвонковыми грыжами
Сужение позвоночного канала приводит к тому, что появление даже небольшой по размерам протрузии межпозвонкового диска переводя состояние субкомпенсации в декомпенсации. Резкое нарастание клинических проявлений, вызванных грыжей межпозвонковых дисков свидетельствует о сочетании её с сужением позвоночного канала.
Данное сочетание требует проведения микродискэктомии, особенностью которой является широкая резекция костных структур (межпозвонкового сустава, полудуги позвонка) вызывающих сужение позвоночного канала.
Лучевая диагностика перидурального фиброза
Лучевая диагностика перидурального фиброза
а) Терминология:
1. Синонимы:
• Эпидуральный фиброз, рубцовые изменения эпидурального пространства
2. Определения:
• Рубцовые изменения эпидурального пространства после операции на поясничном отделе позвоночника
• Один из компонентов синдрома неудачного вмешательства на позвоночнике (СНВП)б) Визуализация:
1. Общие характеристики:
• Наиболее значимый диагностический признак:
о Инфильтрация эпидуральной/периневральной клетчатки мягкотканной плотности (интенсивности сигнала)
• Локализация:
о Эпидуральное пространство на уровне ранее проведенного вмешательства
• Размеры:
о От нескольких миллиметров до 1 -2 см
• Морфология:
о Мягкие ткани с ровными границами, обычно не сдавливающие соседние структуры2. Рентгенологические данные:
• Рентгенография:
о Неспецифические послеоперационные изменения, признаки перидурального фиброза напрямую не видны3. КТ при перидуральном фиброзе:
• Бесконтрастная КТ:
о Неспецифическая акцентуация мягких тканей эпидурального пространства
• КТ с КУ:
о Эпидуральный мягкотканный процесс:
- После внутривенного контрастирования накапливает контраст4. МРТ при перидуральном фиброзе:
• Т1-ВИ:
о Изменения перидуральных мягких тканей:
- Изоинтенсивность сигнала
- Нередко окружают корешок спинного мозга
- Иногда могут напоминать объемный процесс
о Рубцовые изменения могут содержать фрагменты межпозвонкового диска
о Послеоперационные изменения задних элементов позвонка
о Изменения могут сопровождаться расширением дуральной воронки соответствующего корешка (цикатризация)
• Т2-ВИ:
о Вариабельная интенсивность сигнала
о Типично некоторое усиление сигнала относительно сигнала межпозвонкового диска
• Т1-ВИ с КУ:
о Гомогенное контрастное усиление сразу после введения контраста:
- Контрастное усиление может сохраняться в течение нескольких лет
- Информативность МРТ без КУ и с КУ в дифференциальной диагностике перидурального фиброза и грыжи диска составляет 96%
о Корешки спинного мозга в зоне фиброза также могут характеризоваться контрастным усилением5. Несосудистые интервенционные рентгенологические исследования:
• Миелография:
о Неспецифический экстрадуральный дефект наполнения в колонне контраста6. Рекомендации по визуализации:
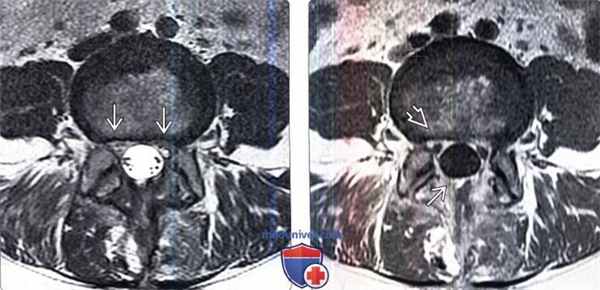
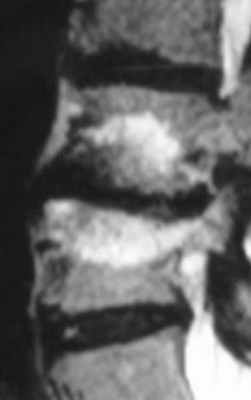
• Режим Т1-ВИ FS (без контрастирования и с КУ) может отличаться более высокой чувствительностью в отношении диагностики перидурального фиброза и его дифференциальной диагностики с грыжей диска![МРТ при перидуральном фиброзе]()
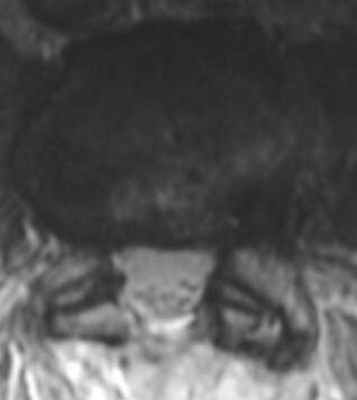
(Слева) Аксиальный срез, Т2-ВИ: небольшой двусторонний постляминэктомический дефект и замещение вентральной эпидуральной клетчатки изоинтенсивной тканью. Признаков объемного воздействия на дуральный мешок или грыжи диска не видно.
(Справа) На аксиальном Т1-ВИ с КУ у этого же пациента отмечается контрастное усиление сигнала мягких тканей в области ляминэктомии и умеренное диффузное усиление тканей в вентральном отделе эпидурального пространства и вокруг корешков.в) Дифференциальная диагностика перидурального фиброза:
1. Рецидивная грыжа диска:
• Отсутствие центрального контрастного усиления при исследовании сразу после введения контраста:
о Периферическое контрастное усиление встречается достаточно часто
• Отсроченное центральное контрастное усиление при исследовании через 30 минут и позже после введения контраста:
о Диффузия контраста в диск2. Эпидуральный абсцесс/флегмона:
• Могут характеризоваться гомогенным контрастным усилением эпидурального пространства
• Абсцессы обычно характеризуются периферическим контрастным усилением
• Типичные клинические и лабораторные признаки инфекции (ускорение СОЭ, увеличение уровня С-реактивного белка)3. Псевдоменингоцеле:
• Скопление СМЖ в дорзальных мягких тканях, исходящее из операционного ложа4. Послеоперационная гематома:
• Промежуточная интенсивность Т1-сигнала в остром и подостром периоде
• Низкоинтенсивное в Т2 объемное образование эпидурального пространства в области операции
• Объемное воздействие на дуральный мешок/корешки5. Арахноидит:
• Скученность корешков спинного мозга по периферии дурального мешка при арахноидите II типа, который может быть своеобразным интрадуральным продолжением перидурального фиброза
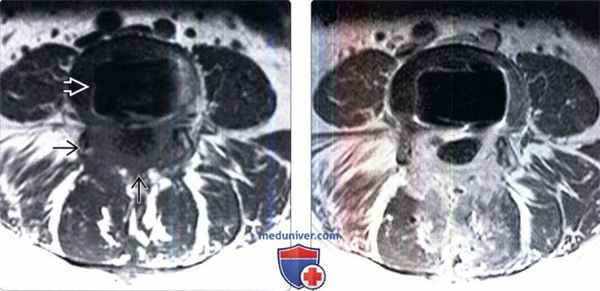
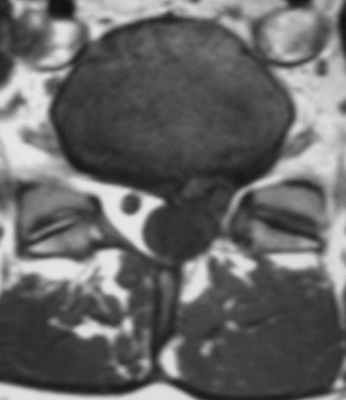
• Картина может напоминать эпидуральный фиброз![МРТ при перидуральном фиброзе]()
(Слева) Аксиальный срез, Т1-ВИ, пациента, которому ранее выполнялся задний межтеловой спондилодез (PLIF): дуральный мешок окружен широкой зоной низкой интенсивности сигнала, представляющей собой перидуральный фиброз. В области межтелового пространства определяется артефакт, связанный с установленным сюда межтеловым кейджем.
(Справа) На аксиальном Т1-ВИ с КУ у этого же пациента отмечается диффузное контрастное усиление зоны эпидурального фиброза, вызывающего минимальную деформацию дурального мешка. В толще фиброзных тканей замурованы выходящие на этом уровне корешки спинного мозга.г) Патология:
1. Общие характеристики:
• Этиология:
о Распространенность фиброза связана с обширностью операционной травмы мягких тканей
о Определенную роль в развитии рубцовых изменений может играть характер воспалительного ответа организма
о Рубцовые изменения могут быть источником компрессии, ирритации или избыточной тракции корешков спинного мозга:
- Нарушение кровоснабжения
- Нарушение аксоплазматического транспорта
• Генетика:
о Связь отсутствует
• Сочетанные изменения:
о Ищите возможные признаки арахноидита
• Послеоперационные рубцовые изменения являются частью нормального репаративного ответа организма
• Может существовать бессимптомно; наличие связи между этим процессом и клинической симптоматикой остается предметом дебатов
• Перидуральный фиброз:
о До 14 случаев СНВП
о Большинство пациентов с в той или иной мере выраженной клинической симптоматикой никаких жалоб не предъявляют
о Вопрос о том, является ли это состояние источником рецидива болевого синдрома, остается спорным
о В одном проспективном исследовании (1996) показано, что у пациентов с распространенным перидуральным фиброзом рецидивы корешкового болевого синдрома встречаются в 3,2 раза чаще, чем у пациентов с менее выраженными рубцовыми изменениями; в других исследованиях подобной связи обнаружить не удалось (2008)2. Макроскопические и хирургические особенности:
• Рубцовая ткань, окружающая дуральный мешок и корешки спинного мозга на уровне операции3. Микроскопия:
• Организация послеоперационной гематомы с образованием плотной волокнистой соединительной ткани, источником которой являются глубокие слои паравертебральных мышц
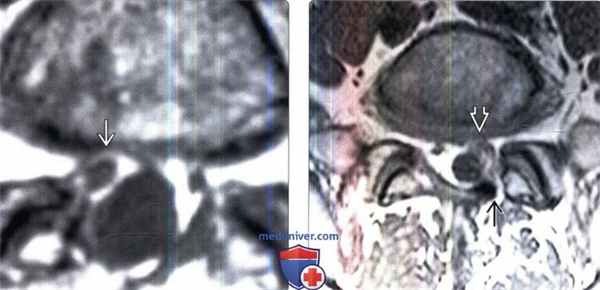
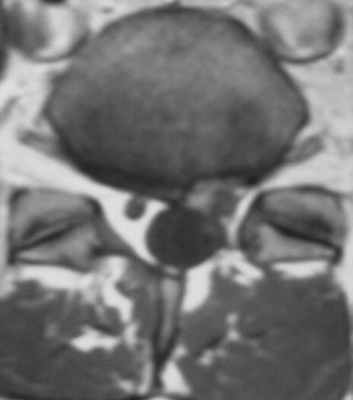
• Фиброзная ткань может распространяться в сторону дурального мешка, быть спаянной с твердой мозговой оболочкой и корешками![МРТ при перидуральном фиброзе]()
(Слева) Аксиальный срез, Т1-ВИ: правосторонний гемиляминэктомический дефект и утолщение правой дуральной воронки корешка с ее периферическим контрастным усилением, связанное с цикатризацией.
(Справа) На аксиальном Т1-ВИ определяется небольшой левосторонний гемиляминэктомический дефект. Левый корешок S1 окружен мягкотканными изменениями, которые тем не менее не оказывают объемного воздействия на дуральный мешок.д) Клинические особенности:
1. Клиническая картина перидурального фиброза:
• Наиболее распространенные симптомы/признаки:
о Боль в нижней части спины или корешковый болевой синдром
о Онемение
о Слабость мышц
о Частота рецидивов боли в спине/корешкового болевого синдрома через шесть месяцев после дискэктомии составляет 10%
о Причины рецидивов болевого синдрома:
- Рецидив грыжи диска
- Новая грыжа диска на другом уровне
- Перидуральный фиброз
• Особенности клинической картины:
о Взрослый пациентсжалобами на постепенно развившуюся боль в нижней части спины и анамнезом ранее уже проводившегося и эффективного хирургического вмешательства по поводу грыжи диска2. Демография:
• Возраст:
о Взрослые
• Пол:
о М = Ж
• Эпидемиология:
о В мире ежегодно выполняется около миллиона операций на позвоночнике
- 3/4 из них включают декомпрессию поясничных корешков или корешков конского хвоста
- Перидуральный фиброз рассматривается как причина 3-5% случаев СНВП3. Течение заболевания и прогноз:
• Хроническое течение СНВП
• Ревизионные вмешательства эффективны в 30-35% случаев (12-100% по данным различных авторов)
• Эффективность ревизионных вмешательств ниже в случаях, когда во время операции обнаруживается только эпидуральный фиброз и не обнаруживаются грыжи дисков
• Электростимуляция спинного мозга эффективна в 50-70% случаев4. Лечение перидурального фиброза:
• Симптоматическое лечение, включающее физиотерапию и различные варианты обезболивающей терапии
• Перирадикулярные инъекции кортикостероидов и местных анестетиков
• Имплантация электродов для электростимуляции спинного мозга
• Хирургическая резекция рубцовых тканей выполняется редкое) Диагностическая памятка:
1. Следует учесть:
• Наличие у пациента с СНВП только фиброзных изменений эпидурального пространства на уровне ранее выполненного вмешательства является противопоказанием к ревизионным операциям, поскольку результаты таких ревизионных вмешательств обычно неудовлетворительные
• Наилучшие результаты ревизионных вмешательств наблюдаются у пациентов с грыжами дисков на других, отличных от ранее оперированного, уровнях
• Промежуточные результаты наблюдаются у пациентов с рецидивом грыж на ранее уже оперированном уровне:
о Результаты лучше, чем при ревизионных вмешательствах по поводу только рубцовых изменений без вмешательства на диске, но хуже по сравнению с операциями по поводу новых грыж на другом уровне2. Советы по интерпретации изображений:
• Классическая картина: обычно утолщенные корешки, окруженные накапливающими контраст мягкими тканями
• Основной задачей лучевых методов диагностики является исключение рецидива грыжи межпозвонкового диска или других причин СНВП (например, опухоли конуса/терминальной нити спинного мозга)СОВРЕМЕННЫЙ ВЗГЛЯД НА КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ЭПИДУРАЛЬНОГО ФИБРОЗА ПОСЛЕ ПОЯСНИЧНЫХ ДИСКЭКТОМИЙ
Представлен обзор литературы, посвященный проблеме эпидурального фиброза после поясничных дискэктомий в аспекте его клинического значения. Проанализированы причины и механизмы развития эпидурального спаечного процесса, описаны особенности его клинической манифестации. Рассмотрены возможности современных методов диагностики послеоперационного эпидурального фиброза. Показана необходимость профилактики и дооперационного прогнозирования риска возникновения компрессионного эпидурального фиброза.
Ключевые слова
Об авторах
Список литературы
1. Асс Я.К. Пояснично-крестцовый радикулит (Клиника и хирургическое лечение). М., 1971.
2. Бакланов А.Н. Синдром оперированного позвоночника // IV съезд нейрохирургов России: Тез. докл. М., 2006. С. 8–9.
3. Благодатский М.Д., Солодун Ю.В. Об аутоиммунном компоненте воспалительных реакций при корешковых синдромах поясничного остеохондроза // Журн. неврол. и психиатр. им. Корсакова. 1988. Т. 88. Вып. 4. С. 48–51.
4. Болховитинова Л.А., Павлова М.Н. Келоидные рубцы. М., 1977.
5. Васильева О.В., Герасимова М.М. Уровень провоспалительных цитокинов у больных пояснично-крестцовыми радикулопатиями с грыжами межпозвонковых дисков // IX Всерос. съезд неврологов: Тез. докл. Ярославль, 2006. С. 246.
6. Волокитин В.В. Диагностика и лечение болевого синдрома при компрессионных формах поясничного остеохондроза: Автореф. дис. … канд. мед. наук. М., 2005.
7. Гельфенбейн М.С. Международный конгресс, посвященный лечению хронического болевого синдрома после операций на поясничном отделе позвоночника «Pain management’98» (Failed back surgery syndrome) // Нейрохирургия. 2000. № 1–2. С. 65.
8. Герман Д.Г., Сокол Т.В. К клинике и диагностике дискогенных эпидуритов // Вопросы неврологии. Баку, 1988. С. 34–37.
9. Горбунов Н.С., Николаев В.Г. Общая, частная и локальная конституция // Актуальные вопросы интегративной антропологии: Тез. докл. науч. конф. Красноярск, 2001. С. 18–21.
10. Гуща О.А., Шевелев И.Н., Арестов С.О. Опыт эндоскопических вмешательств при патологии позвоночника // Вопр. нейрохир. им. Н.Н. Бурденко. 2007. № 2. С. 26–32.
11. Джаубаев М.О., Путягин С.В., Очеленко Л.Н. Профилактика спаечной болезни после аппендэктомии. Ставрополь, 1998.
12. Драгун В.М., Заблоцкий Н.У., Омар Р.О. и др. Сравнительный анализ результатов хирургического лечения больных с грыжами межпозвонковых дисков на пояснично-крестцовом отделе позвоночника // Поленовские чтения: Тез. докл. Всерос. научн.-практ. конф. СПб., 2007. С. 108–109.
13. Дривотинов Б.В., Ходосовская В.М. Роль аутоиммунных реакций в патогенезе рецидивов и ремиссий корешкового болевого синдрома при поясничном остеохондрозе // Иммунодиагностика и иммунотерапия в онкологии и хирургии: Тез. докл. Всесоюз. конф. Томск, 1981. С. 251–252.
14. Дубяга А. К вопросу о патогенезе, клинике и лечении спаечной болезни: Автореф. дис. … канд. мед. наук. Пермь, 1972.
15. Земская А.Г., Мусихин В.Н. Клиника, диагностика и лечение поясничного остеохондроза, осложненного эпидуритом. Л., 1989.
16. Золина Е.И. Структурные особенности эпидуральной клетчатки позвоночного канала // Научно-методические вопросы преподавания и изучения мягкого остова: Тез. докл. II Всесоюз. симп. Горький, 1973. С. 160–161.
17. Ирхо Р.К. Хронические спинальные эпидуриты (патологическая анатомия, клиника, лечение): Автореф. дис. … д-ра мед. наук. Красноярск; Л., 1960.
18. Исаева Н.В., Булыгин Г.В., Дралюк М.Г. Иммуногенетические аспекты послеоперационного рубцово-спаечного эпидурита // Сибирский мед. журн. № 4. 2007. С. 28–30.
19. Клиорин А.И. Генетика, конституциология и медицина — перспективы дальнейшего синтеза // Международные мед. обзоры. 1994. № 4. С. 225–228.
20. Комаров О.А., Викторов В.В. Прогнозирование спаечной болезни брюшины у детей // Скорая мед. помощь. 2004. № 3. С. 89–90.
21. Коновалов Н.А. Прогнозирование микрохирургического лечения грыж межпозвонковых дисков на пояснично-крестцовом уровне: Автореф. дис. … канд. мед. наук. М., 1999.
22. Кущаев С.В., Педаченко Е.Г. Профилактика рубцово-спаечного эпидурита (эпидурального фиброза) при поясничных микродискэктомиях // III съезд нейрохирургов России: Тез. докл. СПб., 2002. С. 262–263.
23. Латышева В.Я., Антонов И.П. Иммунологические аспекты патогенеза поясничного остеохондроза с неврологическими проявлениями // Вопросы иммунологии. Витебск, 1982. С. 108–109.
24. Лебедев А.С. Отдаленные результаты хирургического лечения грыж межпозвонковых дисков и пути их улучшения: Автореф. дис. … канд. мед. наук. СПб., 2002.
25. Луцик А.А. Повреждения и заболевания позвоночника и спинного мозга // Хирургия позвоночника и спинного мозга: Новокузнецк, 1995. С. 3–10.
26. Матвеев В.И., Древаль О.Н., Пархисенко Ю.А. и др. Постдискэктомический синдром. Воронеж, 2005.
27. Минаев С.В. Влияние системной энзимотерапии на течение моделированного спаечного процесса в брюшной полости у крыс // Детская хирургия. 2003. № 2. С.28–31.
28. Михайлов М.К., Володина Г.И., Ларюкова Е.К. Дифференциальная рентгенодиагностика заболеваний позвоночника. Казань, 1993.
29. Мусалатов Х.А., Аганесов А.Г. Хирургическая реабилитация корешкового синдрома при остеохондрозе поясничного отдела: Микрохирургическая и пункционная дискэктомия. М., 1998.
30. Никитюк Б.А. Генетические маркеры – конституция – клиника // Генетические маркеры в антропогенетике и медицине. Хмельницкий, 1988. С. 152–169.
31. Николаев В.Г., Николаева Л.В., Николаева Н.Н. Методология современной клинической антропологии // Сибирское мед. обозрение. 2006. № 1. С. 50–54.
32. Олейник А.Д. Поясничный остеохондроз (вопросы эпидемиологии, трудоспособности, патогенеза и прогноза хирургического лечения): Автореф. дис. … д-ра мед. наук. СПб., 2004.
33. Омар Р.О. Болевые корешковые синдромы на смежных уровнях у больных, ранее оперированных по поводу дегенеративно-дистрофических заболеваний пояснично-крестцового отдела позвоночника: Автореф. дис. … канд. мед. наук. СПб., 2006.
34. Орел А.М. Рентгенодиагностика позвоночника для мануальных терапевтов: Системный анализ рентгенограмм позвоночника. Рентгенодиагностика аномалий развития позвоночника. Т. 1. М., 2006.
35. Павлинов Б.Г. О соединительно-тканных образованиях эпидурального пространства позвоночного канала // Закономерности морфогенеза и регенерации в норме, патологии и индивидуальном развитии. Свердловск, 1978. С. 32–33.
36. Пинегин Б.В., Рублевская И.В., Хаитов Р.М. Аутоиммунная концепция остеохондроза позвоночника и целесообразность применения иммунокорригирующих препаратов // Вестн. новых мед. технологий. 2000. Т. 7. № 1. С. 92–95.
37. Попелянский Я.Ю. Ортопедическая неврология (вертеброневрология). М., 2003.
38. Сак Л.Д. Малоинвазивная хирургия при остеохондрозе позвоночника: Автореф. дис. … д-ра мед. наук. Новосибирск, 2000.
39. Самотокин Б.А., Верховский А.И. Послеоперационные рецидивы неврологических синдромов поясничного остеохондроза и их хирургическое лечение // Вопр. нейрохирургии им. Н.Н. Бурденко. 1983. № 6. С. 30–34.
40. Сапин М.Р., Селин Ю.М. Учение о нервной системе — неврология // Анатомия человека. М., 1993. Т. 2. С. 268–471.
41. Симонович А.Е., Байкалов А.А. Хирургическое лечение рецидивов болевых синдромов после удаления грыж поясничных межпозвонковых дисков // Хирургия позвоночника. 2005. № 3. С. 87–92.
42. Сипухин Я.М., Мурзин В.Е., Артюшенко В.С. Контрастное исследование эпидурального пространства // Вестн. рентгенологии и радиологии. 1983. № 6. С. 25–29.
43. Скляренко О.В., Сороковиков В.А., Калинина С.А. Комплексное лечение болевого синдрома в поясничном отделе позвоночника на фоне послеоперационного рубцово-спаечного эпидурита // VII Поленовские чтения: Тез. докл. Всерос. научн.-практ. конф. СПб., 2008. С. 160.
44. Скоромец А.А., Скоромец А.П., Скоромец Т.А. и др. Спинальная ангионеврология. СПб.; М., 2003.
45. Скоромец А.А., Скоромец Т.А., Шумилина А.П. Остеохондроз дисков: новые взгляды на патогенез неврологических синдромов // Неврологический журн. 1997. № 6. С. 53–55.
46. Смирнов Л.Н. Морфология нервной системы. Госмедиздат УССР, 1935.
47. Тагер И.Л. Рентгенодиагностика заболеваний позвоночника. М., 1983.
48. Филатов Д.Н. Современные аспекты лучевой диагностики поясничного остеохондроза // Молодые ученые — здравоохранению региона: Тез. докл. науч.-практ. конф. Саратов, 2003. С. 160–161.
49. Фраерман А.П., Шимбарецкий А.Н. Причины рецидива болевого синдрома после операций по поводу грыж межпозвонковых поясничных дисков // Плановые оперативные вмешательства в травматологии и ортопедии. СПб., 1992. С. 79–83.
50. Хайбуллин Р.Г., Хайбуллина З.Р., Ишмуратов Г.В. и др. Хирургическое лечение реци-дивирующего пояснично-крестцового радикулита // Поленовские чтения: Тез. докл. СПб., 2007. С. 132–133.
51. Хелимский А.М. Хронические дискогенные болевые синдромы шейного и поясничного остеохондроза. Хабаровск, 2000.
52. Холин А.В. Магнитно-резонансная томография при заболеваниях центральной нервной системы. СПб., 1999.
53. Чаплыгин В.И. Рубцово-спаечные процессы в области позвоночного канала у больных поясничным остеохондрозом (клиника, диагностика, лечение и профилактика): Автореф. дис. … канд. мед. наук. Омск, 1973.
54. Чепой В.М. Воспалительные и дегенеративные заболевания позвоночника. М., 1978.
55. Черемисин В.М., Аносов Н.А., Чесноков В.В. О диагностике и лечении реактивного асептического спинального эпидурита // Врачебное дело. 1993. № 1. С. 102–104.
56. Шакало Ю.А. Возрастная анатомия эпидурального пространства шейного отдела спинного мозга человека: Автореф. дис. … канд. мед. наук. Красноярск, 2006.
57. Шантырь В.Ю. Осложнения оперированного позвоночника и их диагностика: Автореф. дис. … канд. мед. наук. М., 2000.
58. Шантырь В.Ю., Ахадов Т.А., Оноприенко Г.А. Магнитно-резонансная томография в диагностике ранних послеоперационных осложнений после хирургического лечения дегенерации межпозвонковых дисков // Нейрохирургия. 1999. № 3. С. 19–25.
59. Шевелев И.Н., Гуща А.О., Коновалов Н.А. и др. Использование эндоскопической дискэктомии по Дестандо при лечении грыж межпозвонковых дисков поясничного отдела позвоночника // Хирургия позвоночника. 2008. № 1. С. 51–57.
60. Шмидт И.Р. Остеохондроз позвоночника: Этиология и профилактика. Новосибирск, 1992.
61. Шуваева О.Б. Клинический полиморфизм рецидивирующих болевых синдромов после оперативного вмешательства при компрессионной радикулопатии на пояснично-крестцовом уровне // Журн. невролог. и психиатр. 2005. № 11. С. 11–15.
62. Шустин В.А., Парфенов В.Е., Топтыгин С.В. и др. Диагностика и хирургическое лечение неврологических осложнений поясничного остеохондроза. СПб., 2006.
63. Шютце Г., Куртце Г., Гроль О. и др. Эпидуроскопия // Анестезиология и реаниматология. 1996. № 4. С. 62–64.
64. Annertz M., Jonsson B., Stromqvist B., et al. No relationship between epidural fibrosis and sciatica in the lumbar postdiscectomy syndrome. A study with contrast-enhanced magnetic resonance imagine in symptomatic and asymptomatic patients // Spine. 1995. Vol. 20. P. 449–453.
65. Aydin Y., Ziyal I.M., Duman H., et al. Clinical and radiological results of lumbar microdiscectomy technique with preserving of ligamentum flavum comparing to the standard microdiscectomy technique // Surg. Neurol. 2002. Vol. 57. P. 5–14.
66. BenDebba M., Augustus van Alphen H., Long D.M. Association between peridural scar and activity-related pain after lumbar discectomy // Neurol. Res. 1999. Vol. 21. Suppl. 1. P. S37–S42.
67. Benoist M., Ficat C., Baraf P., et al. [Postoperative sciatica from epidural fibrosis and lumbar arachnoiditis. Results of 38 repeat operations] // Rev. Pheum. Mal. Osteoartic. 1979. Vol. 46. P. 593–599. French.
68. Benoist M., Ficat C., Baraf P., et al. Postoperative lumbar epiduroarachnoiditis. Diagnostic and therapeutic aspects // Spine. 1980. Vol. 5. P. 432–436.
69. Cervellini P., Curri D., Volpin L., et al. Computed tomography of epidural fibrosis after discectomy: a comparison between symptomatic and asymptomatic patients // Neurosurgery. 1988. Vol. 23. P. 710–713.
70. Cooper R.G., Mitchell W.S., Illingworth K.J., et al. The role of epidural fibrosis and defective fibrinolysis in the persistence of postlaminectomy back pain // Spine. 1991. Vol. 16. P. 1044–1048.
71. Cortelazzi L., Raffaeli W., Боков А.Е. Применение эпидурального адгезиолизиса в лечении радикулярного болевого синдрома, обусловленного рубцово-спаечным процессом в эпидуральном пространстве // Поленовские чтения: тез. докл. Всерос. науч.-практ. конф. СПб., 2008. С. 117.
72. Coskun E., Suzer T., Topuz O., et al. Relationships between epidural fibrosis, pain, disability and psychological factors after lumbar disc surgery // Eur. Spine J. 2000. Vol. 9. P. 218–223.
73. Fan Y.F., Chong V.F. MRI findings in failed back surgery syndrome // Med. J. Malaysia. 1995. Vol. 50. P. 76–81.
74. Fan Y.F., Chong V.F., Tan S.K. Failed back surgery syndrome: differentiating epidural fibrosis and recurrent disc prolapse with Gd-DTPA enhanced MRI // Singapure Med. J. 1995. Vol. 36. P. 153–156.
75. Fiume D., Sherkat S., Callovini G.M., et al. Treatment of the failed back surgery syndrome due to lumbo-sacral epidural fibrosis // Acta Neurochir. Suppl. (Wien). 1995. Vol. 64. P. 116–118.
76. Floris R., Spallone A., Aref T.Y., et al. Early postoperative MRI findings following surgery for herniated lumbar disc // Acta Neurochir. (Wien). 1997. Vol. 139. P. 169–175.
77. Gasinski P., Radek M., Jozwiak J., et al. [Peridural fibrosis in lumbar disc surgery — pathogenesis, clinical problems and prophylactic attempts] // Neurol. Neurochir. Pol. 2000. Vol. 34. P. 983–993. Polish.
78. Georgy B.A., Hesselink J.R., Middleton M.S. Fat-suppression contrast-enhanced MRI in the failed back surgery syndrome: a prospective study // Neuroradiology. 1995. Vol. 37. P. 51–57.
79. Groen R.J., Groenewegen H.J., van Alphen H.A., et al. Morphology of the human internal vertebral venous plexus: a cadaver study after intravenous Araldite CY 221 injection // Anat. Rec. 1997. Vol. 249. P. 285–294.
80. Gutmann G. X-Ray diagnosis of spinal dysfunction // Man. Med. 1970. Vol. 8. P. 73–76.
81. Hedtmann A. [The so-called post-discotomy syndrome — failure of intervertebral disc surgery?] // Z. Orthop. Ihre. Grenzgeb. 1992. Vol. 130. P. 456–466. German.
82. Heithoff K.B., Burton C.V. CT evaluation of the failed back surgery syndrome // Orthrop. Clin. North. Am. 1985. Vol. 16. P. 417–444.
83. Hoppenstein R. A new approached to the failed back syndrome // Spine. 1980. Vol. 5. P. 371–379.
84. Isla A., Alvarez F. [Spinal epidural fibrosis following lumbar disсectomy and antiadhesion barrier] // Neurocirugia (Astur). 2001. Vol. 12. P. 439–446. Spanish.
85. Kayaoglu C.R., Calikoglu C., Binler S. Re-operation after lumbar disc surgery: results in 85 cases // J. Int. Med. Res. 2003. Vol. 31. P. 318–323.
86. Long D.M. Failed back surgery syndrome // Neurosurg. Clin. N. Am. 1991. Vol. 2. P. 899–919.
87. Maroon J.C., Abla A., Bost J. Association between peridural scar and persistent low back pain after lumbar discectomy // Neurol. Res. 1999. Vol. 21. P. S43–S46.
88. Neill S. Computed tomography in failed back syndrome // Radiogr. Today. 1991. Vol. 57. P. 9–12.
89. Park J.B., Chang H., Kim Y.S. The pattern of interleukin-12 and T-helper types 1 and 2 cytokine expression in herniated lumbar disc tissue // Spine. 2002. Vol. 27. P. 2125–2128.
90. Richter H.P., Kast E., Tomczak R., et al. Results of applying ADCON-L gel after lumbar diskectomy: the German ADCON-L study // J. Neurosurg. 2001. Vol. 95. P. 179–189.
91. Richardson J., McGurgan P., Cheema S., et al. Spinal endoscopy in chronic low back pain with radiculopathy. A prospective case series // Anaesthesia. 2001. Vol. 56. P. 454–460.
92. Robertson J.T. Role of peridural fibrosis in the failed back: a review // Eur. Spine J. 1996. Vol. 5. P. S2–S6.
93. Ross J.S. MR imaging of the postoperative lumbar spine // MRI Clin. N. Am. 1999. Vol. 7. P. 513–524.
94. Ross J.S., Obuchowski N., Modic M.T. MR evaluation of epidural fibrosis: proposed grading system with intraand inter-observer variability // Neurol. Res. 1999. Vol. 21. P. 23–26.
95. Sasiadek M., Gasiorek D., Turek T. [The value of CT in diagnosis of low back pain syndromes] // Chir. Narzadow. Ruchu. Ortop. Pol. 1995. Vol. 60. P. 459–464. Polish.
96. Seelig W., Nidecker A. [Pain following operation of the lumbar spine. The “failed back surgery sundrome”] // Z. Orthop. Ihre. Grenzgeb. 1989. Vol. 127. P. 346–353. German.
97. Sen O., Gokcel A., Kizilkilic O., et al. The relation between serum levels of osteoprotegerin and postoperative epidural fibrosis in patients who underwent surgery for lumbar disc herniation // Neurol. Res. 2005. Vol. 27. P. 452–455.
98. Talbot L. Failed back surgery syndrome // BMJ. 2003. Vol. 327. P. 985–986.
99. Theresse S.M. Stump speaking // JAMA. 1999. Vol. 85. P. 3–5.
100. Van Goethem J.W., van de Kelft E., Biltjes I.G., et al. MRI after successful lumbar discectomy // Neuroradiology. 1996. Vol. 38. P. 90–96.
101. Yaksich I. Failed back surgery syndrome: problems, pitfalls and prevention // Ann. Acad. Med. Singapore. 1993. Vol. 22. P. 414–417.
Лучевая диагностика синдрома оперированного позвоночника
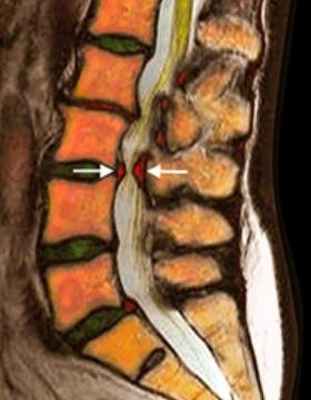
![стеноз в пояснице в цвете]()
МРТ поясничного отдела позвоночника. Т2-взвешенная сагиттальная МРТ. Стеноз позвоночного канала.
Оценка состояния поясничного отдела позвоночника после операции составляет важную и сложную задачу. МРТ СПб позволяет выбирать место обследования после операции. От правильной трактовки выявленных изменений зависит выбор дальнейшей тактики лечения пациента. Современный взгляд на проблему может быть назван «междисциплинарным», так как требует кооперации специалистов разного профиля: спинальных хирургов (нейрохирургов), лучевых диагностов, специалистов-реабилитологов (физиотерапевтов и т.д.).
Состояние позвоночника в раннем послеоперационном периоде
В первые дни после операции наблюдается отёк мягких тканей и их пропитывание кровью. Масс-эффект в этот период может симулировать неудалённую грыжу. Часто такие находки при МРТ позвоночника называют «псевдогрыжей». Известно, что её наличие и размеры не коррелируют с отдалёнными послеоперационнымти изменениями. Отёк исчезает примерно через 3 недели после операции, хотя псевдогрыжи сохраняются в течение 2 мес. и даже дольше.
В первые месяцы после операции отмечаются повышенный сигнал на Т2-взвешенных МРТ от костного мозга, замыкательных пластинок и пульпозного ядра. Это отражает отек и асептическое воспаление. До 6 месяцев после операции сохраняется реактивный эпидурит, арахноидит и дисцит. Они видны как контрастное усиление оболочек, эпидурального пространства и замыкательных пластин. Нарушение гематоэнцефалического барьера приводит также и к контрастированию корешка. У большей части пациентов в ответ на операцию наблюдается контрастирование дугоотростчатого сустава, сохраняющееся больше 6 мес.
После 6 мес. реактивный отёк и воспаление стихают, диск постепенно приобретает типично низкую интенсивность сигнала и в нём появляется линия фиброза. К 6 мес. отёк в переднем эпидуральном пространстве сменяется фиброзом, который у большинства пациентов уже не уменьшается в объёме, либо уменьшается очень незначительно в течение первого года после операции.
Синдром оперированного позвоночника
У части пациентов после операции дискэктомии в разные сроки возникает синдром оперированного позвоночника или FBSS (failed back syndrome или постламинэктомический синдром). Это совокупность неприятных болевых, психологических и соматических симптомов, которые возникли после проведенной операции на позвоночнике. Развитие инновационных хирургических технологий, методов визуализации, новых имплантов и протезов для хирургии позвоночника, вызвало многократный рост оперативной активности в вертеброгии. Так если в 2003 г. в США в выполнено 250 000 спондилодезов, то в 2006г. уже 500 000 подобных операции. Рост операций на позвоночнике наблюдается во всем мире, в том числе и в нашей стране. Количество осложнений, которые вписываются в «синдром оперированного позвоночника» колеблется от 15 до 34 %. Существенный разброс в статистике связан с разными причинами: подбором больных для операционного лечения, типом операции, реабилитационными мероприятиями и оценкой состояния после операции. Клиническое ухудшение по сравнению с дооперационным состоянием находится в пределах 1-10%. Отмечены закономерность, что отсутствие верифицированной корешковой боли до операции и возраст старше 50 лет увеличивает вероятность развития синдрома оперированного позвоночника. Основные причины рецидивного болевого синдрома приведены ниже:
- Непосредственно связанные с операцией, встречаются относительно часто:
- Адгезивный арахноидит, асептический эпидурит
- Инфекции – спондилодисцит
- Ятрогенные – повреждение корешка во время операции
- Послеоперационное состояние – эпидуральный фиброз, стеноз позвоночного канала (отверстия) с компрессией корешка – свыше 50% случаев, неустраненная нестабильность ПДС
- рецидив грыжи диска
- неправильная хирургическая тактика – не тот уровень операции, неправильно расценен источник боли, не удалена грыжа диска, не диагностирован или не учтен стеноз позвоночного (корешкового) канала или фасет-синдром
- Не связанные с грыжей диска и операцией, встречаются редко:
- первичные опухоли и метастазы в позвонки,
- заболевания позвоночника – остеопороз и компрессионные переломы, воспалительные заболевания суставов (ревматоидный артрит, синдром Рейтера и т.д.)
- иррадиация болей при панкреатите, расслаивающей аневризме брюшной аорты, раке предстательной железы
Ближайшее осложнение операции – бактериальный спондилодисцит. Его частота по данным литературы составляет 0-12% (в среднем 1-3%). Настораживать должно усиление болевого синдрома и воспалительная реакция крови. При МРТ видна размытость замыкательных пластинок и отёк костного мозга. Эти симптомы неспецифичны, так как реактивный асептический дисцит выглядит так же. Формирование эпидурального абсцесса происходит позже, когда клинические проявления уже очевидны.
![]()
МРТ позвоночника. Постдискэктомический асептический спондилодисцит. Сагиттальная Т2-взвешенная МРТ.
Отдалённые последствиями дискэктомии являются сужение отверстия за счёт низкого диска (его остатка) и гипертрофии дугоотростчатого сустава; эпидуральный фиброз с нарушением питания диска.
Истмический спондилолистез и боковой стеноз позвоночного канала составляют свыше 50% причин рецидивных болей. При уменьшении высоты диска в первую очередь страдает боковой (субартикулярный) карман – место входа корешка в межпозвоночный канал. Причиной болей служит отёк корешка. Он возникает при нарушении венозного оттока из-за компрессии заднего корешка, обычно, остеофитом. Причиной болей может быть и фасет-синдром, который наряду с сакроилеитом хорошо известен при спондилоартропатиях.
Следовательно, основные причины возникновения синдрома оперированного позвоночника – хирургические: неполноценное устранение компримирующих факторов и недостаточный объем декомпрессии нервных структур при стенозе ПК, а также недооценка нестабильности ПДС.
Адгезивный арахноидит – самая плохо изученная причина рецидивного болевого синдрома. Часто термины «арахноидит» и «менингит» используют как равнозначные, что по сути своей неверно. Менингит – это диффузное воспаление оболочек мозга, как правило, бактериальной этиологии. Арахноидит ограничивается только паутинной оболочкой и связан с неспецифической воспалительной реакцией. Сведения о нём в литературе очень противоречивые, от полного отрицания его существования, до абсолютизации его значения. Клинические проявления люмбо-сакрального арахноидита в зарубежной литературе часто обозначают как “Regional complex pain disorder” (RCPD), а у нас чаще как «каузалгия». Послеоперационный арахноидит приводит к слипанию корешков и формированию “пустого” дурального мешка. Это состояние отражает не только расположение корешков, но и их атрофию вследствие нарушения питания.
После стихания реактивного эпидурита остаётся грануляционная ткань, из которой постепенно формируется эпидуральный фиброз и мягкотканный рубец. Выраженность эпидурального фиброза зависит от свойств тканей, типа и объёма операции (гемиламинэктомия, малоинвазивная и т.п.). Само по себе развитие эпидурального фиброза не является патологическим состоянием. Однако, если фиброз муфтообразно охватывает корешок, он нарушает его питание. Предположительно, что с фиброзом связано около 8% рецидивных болей. Скорее всего, между выраженностью фиброза и вероятность рецидивного болевого синдрома имеется корреляция, что замечено не всеми исследователями.
Рецидивные грыжи дисков после ламинэктомии составляют 15-20% и несколько ниже после микрохирургических операций, что примерно в 2 раза чаще эпидурального фиброза. Рецидивной считается выявленная грыжа на уровне операции, на той же или противоположной стороне, после безболевого интервала не меньше 6 мес. В литературе имеются весьма противоречивые сведения о факторах риска рецидива грыжи. Есть данные, что при диабете рецидивы грыжи встречаются чаще, но это подтверждается не всеми исследованиями. Показано, что курение усугубляет вероятность возникновения рецидивов грыжи дисков. Отсутствие фрагмента диска в грыже (диффузный пролапс фиброзного кольца) связано с более высокой частотой её рецидивов после операции.
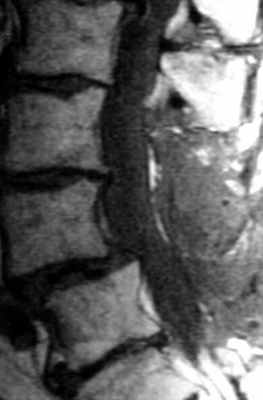
Дифференциальная диагностика между фиброзом и рецидивной грыжей является ключевым моментом для выбора тактики лечения. Интенсивность сигнала на неконтрастированных МРТ позвоночника у них одинаковая. Грыжа является продолжением диска, и она обычно отграничивается гипоинтенсивной задней продольной связкой. Однако при секвестрации эта связь теряется и подобно фиброзу секвестр может располагаться в стороне от диска. Ретракция дурального мешка в сторону образования косвенно указывает на фиброз, компрессия дурального мешка характернее для грыжи. Эти признаки имеют очень невысокую степень специфичности. Диск и грыжа образования бессосудистые, грануляционная ткань и фиброз, напротив, содержат сосуды. Поэтому при МРТ они контрастируются, что позволяет отличать рубец от рецидивной грыжи. Контрастирование связано с наличием васкуляризации. Точность метода МРТ превышает 90%. Проблема состоит в том, что рецидивная грыжа и эпидуральный фиброз не исключают друг друга, а часто сосуществуют. Это существенно затрудняет постановку правильного МРТ диагноза.
![]()
![]()
МРТ поясничного отдела позвоночника оперированного пациента. Эпидуральный фиброз. Т1-зависимая МРТ до и после контрастирования. Корешок S1 не компримирован.
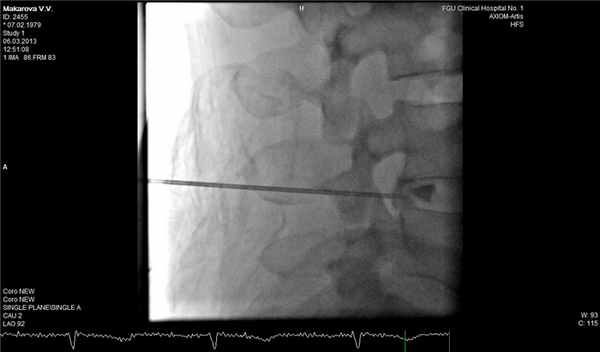
В трудных для диагностики случаях можно дополнительно к МРТ позвоночника применить дискографию, которая достоверно подтвердит или опровергнет диагноз рецидивной грыжи диска. Эпидурография также может быть полезна для оценки состояния корешка в позвоночном канале.
![]()
![]()
Фораминальная рецидивная грыжа 5 мм. Дискография.
![]()
Сдавление корешка L4 в корешковом канале, несмотря на малые размеры грыжи. Эпидурография.
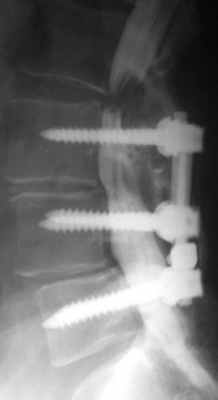
Послеоперационная нестабильность позвоночника обычно наступает после больший объемных операций (ламинэктомия), сопровождаемых резекцией суставных отростков. Эти состояния, как правило, сопровождаются сильным болевым синдромом, как вертеброгенным, так и корешковым.
![]()
![]()
![]()
Нестабильность после декомпрессивной ламинэктомии. Рентгенография и МРТ позвоночника в сагиттальной и аксиальной плоскостях. Ламинэктомия на нескольких уровнях, постламинэктомический спондилолистез и дефект дуг.
Применение жестких фиксирующих систем при спондилодезах «выключают» один или несколько позвоночно-двигательных сегментов из кинематической цепи позвоночного столба. Смежные сегменты испытывают значительную механическую перегрузку, что приводит к преждевременной деградации дисков и суставов смежного уровня, разрастанию соединительной ткани, компенсаторной гипертрофии дугоотростчатых суставов, приводящих к развитию сегментарного стеноза. Рецидивная грыжа диска и неустраненный стеноз позвоночного канала требуют повторного хирургического вмешательства.
![]()
Синдром смежного уровня. Стеноз позвоночного канала выше уровня стабилизации. Миелография.
МРТ поясничного отдела позвоночника. Синдром смежного уровня. Нестабильность позвоночного сегмента выше уровня стабилизации.
![]()
МРТ поясничного отдела позвоночника. Рецидивная грыжа диска. Т2-зависимые МРТ в сагиттальной и аксиальной плоскостях.
![]()
Неустранённый стеноз позвоночного канала. Миелография.
Лечение синдрома оперированного позвоночника
Лечение синдрома оперированного позвоночника сложная задача, которая должна решаться силами группы специалистов – психотерапевта, физиотерапевта, ревматолога, нейрохирурга, специалиста по лечению боли (Pain Manager), рентгенолога. Прежде всего, необходимо точно выявить источник генерации боли при синдроме оперированного позвоночника. Алгоритм исследования больного включает нейроортопедический осмотр, специальное рентгеновское исследование (включая функциональные снимки, миелографию, дискографию), МРТ исследование, клинический и биохимический анализ крови, нейромиографию. Решение о виде лечения принимается коллегиально и оформляется в виде консилиума. МРТ в СПб оперированного позвоночника мы проводим в тесной связанных с нейрохирургами, но в ряде случаев (клаустрофобия, металлические имплантаты) приходится делать исследование в открытом МРТ .
Согласно принятой концепции «нарастающего радикализма» начинают лечение с консервативных методов, а при отсутствии эффективности последних применяют хирургические методы.
Алгоритм лечения синдрома оперированного позвоночника:
- Консервативное лечение (физиотерапия, ЛФК, массаж, НПВП) с привлечением смежных специалистов – ревматолога, психотерапевта, физиотерапевта.
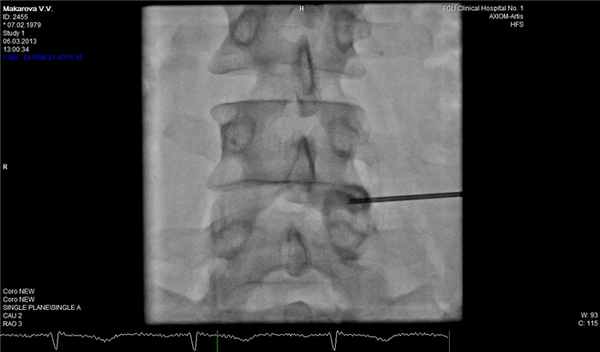
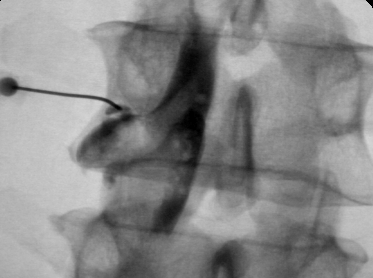
- Эпидуральные иньекции стероидов и анестетиков под контролем ЭОП
- Применение минимально инвазивных техник для устранения источника боли (лазерная абляция и денервация, радиочастотная денервация)
- Повторная открытая операция с устранением достоверно выделенной причины боли (с оценкой всех рисков), устранение сегментарной нестабильности позвоночника.
- Применение методов постоянной нейростимуляции для блокирования нейропатической боли
- Применение программированных помп для интратекального введения опиоидов
При выборе оперативных методов лечения предпочтение должно отдаваться минимально-инвазивным видам операций, существенно снижающим риски возникновения послеоперационного рубцово-спаечного арахноидита.
Читайте также: