Лучевая терапия для лечения онкологического заболевания
Добавил пользователь Алексей Ф. Обновлено: 09.01.2026
В лечении опухолей, чаще всего, пациента пугает возможная операция. Он ищет и находит метод, который обещает разрушение опухоли и/или ее метастазов бесконтактным способом – это радиохирургия (radiosurgery). Задача данного материала - рассказать о том, в каких случаях радиохирургия (в современном ее понимании) покажет максимальную эффективность, сможет ли она полностью заменить хирургическое вмешательство. Также мы постараемся ответить на большинство вопросов, связанных с этим методом лечения опухолей: что из себя представляет, сколько стоит, где проводится в России, как записаться и др.
Практика показывает, что каждый из материалов о современных методах лечения рака, если он выходит спустя хотя бы пару лет после публикации предыдущей версии, должен быть дополнен информацией об успехах в применении данного метода и расширении списка видов рака, при которых этот метод лечения демонстрирует эффективность. Поэтому рассмотрим, что же представляет собой радиохирургия по состоянию на середину 2018 года.
Как радиохирургия лечит опухоли?
Вначале – немного теории. В основе радиохирургии (в названии метода “радио” означает не радиоволны, а “радиация”) лежит прицельное подведение высокой дозы ионизирующего излучения в границы опухоли.
Ключевое отличие от лучевой терапии - разовая доза радиации, доставляемая в организм. При радиохирургии она настолько высока, что вызывает гибель клеток за один сеанс (в ряде случаев может потребоваться несколько сеансов радиохирургии – фракций). Фактически, опухоль перестает существовать в организме (с биологической точки зрения) – после воздействия высокой дозы радиации она превращается в массив клеток, подлежащих “утилизации” естественными процессами в организме. Это дает право использовать слово “хирургия” в названии метода лечения.
Но облучается не весь организм. Важным преимуществом радиохирургии является принцип создания зоны высокой дозы облучения в сложной форме, повторяющей форму опухоли. Достигается это за счет сложения доз в точках пересечения отдельных пучков радиации, направляемых в тело человека по особой траектории. Современная радиохирургия, в отличие от поставленной задачи и типа оборудования, на котором выполняется лечение, может использовать несколько сотен различных тонких пучков излучения.
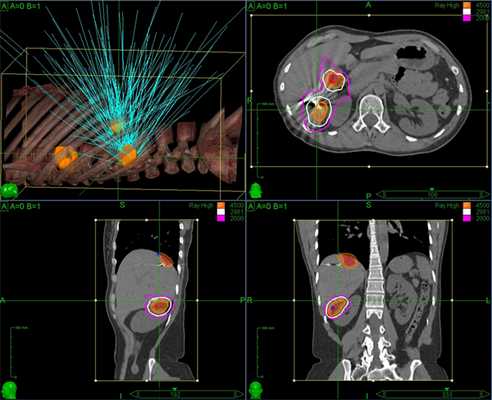
Наиболее наглядным визуальным примером того, как работает радиохирургия, является визуализация плана лечения на Кибер-ноже: зоны высокой дозы радиации (внутри оранжевого контура) сформированы из точек пересечения одиночных тонких пучков излучения (бирюзовые линии)
Каждый из тонких пучков радиации, проходящих через различные точки организма, подводит к здоровым тканям, лежащим на его траектории лишь небольшую долю от вызывающей гибель опухолевых клеток дозы радиации (так называемая “толерантная доза”). Рассчитывая и корректируя траекторию каждого из пучков на цифровом плане лечения, лучевой терапевт и медицинский физик “оберегают” от облучения критически важные органы и структуры организма, на которые воздействие радиации необходимо свести к нулевому значению. Это ствол головного мозга, хрусталик глаза, слюнные железы, сердечная мышца, мочевой пузырь и т.д.
Радиохирургия - это высокоточное воздействие на ткани опухоли дозой излучения, вызывающей гибель клеток. При этом окружающие ткани получают лишь часть радиации - высокая доза складывается в точках пересечения лучей.
Виды радиохирургии
По локализации опухолей, которые подвергаются облучению, радиохирургия разделяется на два основных типа:
- для лечения опухолей мозга (stereotactic radiosurgery, SRS)
- лечение опухолей, локализованных за пределами головного мозга (stereotactic body radiotherapy, SBRT)
Такая классификация не имеет важности для пациента, а лишь отражает хронологию развития технологий радиохирургии: первым устройством для радиохирургии, получившим широкое применение, стал Гамма-нож, использовавший принцип стереотаксиса (позиционирование по трехмерной системе координат, заданной жесткой рамой, прикрепляемой к черепу) для лечения опухолей головного мозга. Впоследствии, с появлением способов радиохирургии, при которых позиционирование выполняется без жесткой рамки (Кибер-нож, высокоточные линейные ускорители), стало возможно лечение опухолей в любой точке организма.
Более полезной для пациента будет информация о различиях между технологиями радиохирургии - она позволит понять, какое действие будет оказывать назначаемый врачом метод лечения на опухоль и на здоровые ткани.
Основные технологии радиохирургии, получившие распространение в мировой онкологии:
- Гамма-нож (Gamma Knife);
- Кибер-нож (CyberKnife);
- линейный ускоритель (TrueBeam STx, Novalis Tx и др.).
Радиохирургия на Гамма-ноже
Будучи первым аппаратом, доказавшим эффективность в широкой клинической практике, Гамма-нож и сегодня не утратил своей важности в лечении опухолей головы и шеи, ряда функциональных нарушений и сосудистых патологий. Стереотаксическая рама задает систему координат, относительно которой позиционируется положение опухоли и здоровых тканей, мощный компьютер рассчитывает прохождение каждого из 201 лучей таким образом, чтобы на пересечении лучей сформировать “изоцентр” - шарообразную зону высокой (радиохирургической) дозы ионизирующего излучения. Комбинируя изоцентры, врач создает зону сложной пространственной формы, отвечающую форме самой опухоли.
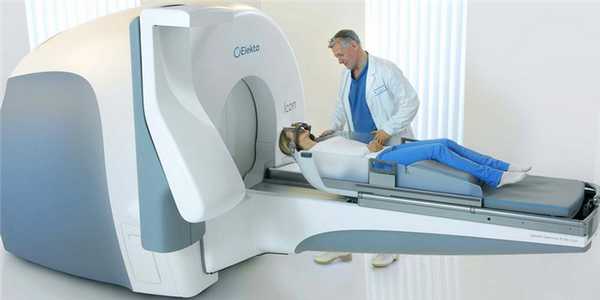
Радиохирургия на Гамма-ноже - безопасное и комфортное лечение опухолей головы и шеи
Гамма-нож использует энергию изотопов кобальта. Ввиду особенностей конструкции, Гамма-нож используется исключительно для разрушения опухолей головы и шеи.
Радиохирургия Кибер-нож
Кибер-нож (CyberKnife), в разработке которого принимал непосредственное участие Джон Адлер, ученик создателя Гамма-ножа Ларса Лекселла, решил задачу распространения возможностей радиохирургии и на локализованные вне пределов головы опухоли. Основные отличия Кибер-ножа от Гамма-ножа - использование энергии линейного ускорителя вместо изотопов кобальта, а также система трехмерного позиционирования, не имеющая привязки к стереотаксической рамке.
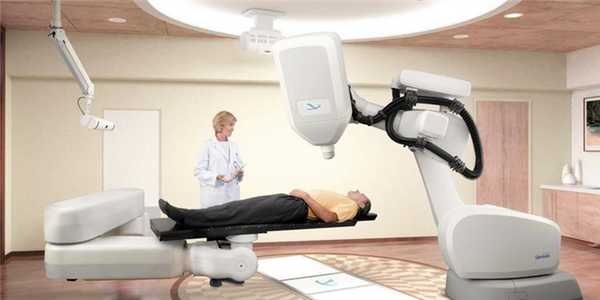
Кибер-нож, роботизированная радиохирургия - сложное технологическое решение задачи лечения опухолей любой локализации
Система координат Кибер-ножа рассчитывается либо от статичных анатомических элементов (чаще всего, это кости черепа), либо от рентгенконтрастной “метки”, крошечного золотого зерна, вживляемого в подвижную опухоль (обычно, проводится во время биопсии для уменьшения травматичности подготовительной части лечения) и не требующего извлечения. В отличие от неподвижного Гамма-ножа, Кибер-нож направляет каждый отдельный пучок ионизирующего излучения по произвольной траектории, что достигается подвижному модулю компактного линейного ускорителя, размещенного на роботизированном манипуляторе. Управляет оборудованием мощный вычислительный комплекс, который, используя данные системы слежения, позволяет компенсировать смещения пациента. Это упрощает фиксацию (анестезия, как и в случае с лечением Гамма-ножом, не требуется), а также позволяет проводить лечение подвижных органов (легкие, печень, простата).
Радиохирургия на линейном ускорителе
Развитие систем визуализации позволило соединить в конструкции современного линейного ускорителя модули отслеживания положения опухоли и высокоточной доставки ионизирующего излучения. Точность доставки и отслеживание положения опухоли в реальном времени позволяет подводить более высокие, радиохирургические дозы радиации точно в границы опухоли, используя традиционную конструкцию линейного ускорителя с поворотным гентри. Подобная модификация современного оборудования (Центр радиохирургии МИБС использует TrueBeam STx от Varian) позволяет провести радиохирургию гораздо более крупных опухолей (по сравнению с возможностями Кибер-ножа), независимо от их локализации.
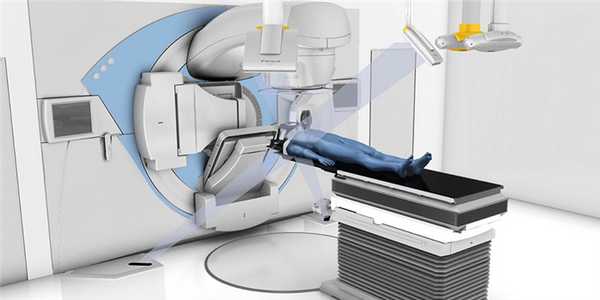
TrueBeam STx – один из линейных ускорителей, на котором выполняется радиохирургия в МИБС
Основные “мишени”: что лечит радиохирургия?
Одинаково успешно радиохирургия применяется как для лечения первичных опухолей, так и для лечения их рецидивов и метастазирования. Учитывая неинвазивный характер процедуры, радиохирургия часто становится последним шансом для пациента, состояние организма которого не позволит провести очередное хирургическое вмешательство.
Гамма-нож, из-за особенностей конструкции, лечит опухоли головы и шеи, а также метастазы данной локализации. Кибер-нож успешно справляется с лечением небольших опухолей, в том числе подвижных, а также метастазов, независимо от их локализации. Линейный ускоритель в “радиохирургической” комплектации успешно применяется для лечения объемных опухолевых поражений, в том числе спинальных опухолей, затрагивающих несколько отделов позвоночника.
Особенно следует отметить возможности радиохирургии в лечении метастазов в головном мозге: хирургия из-за объемного поражения или тяжелого состояния пациента не показана, а химиопрепараты практически не проникают через защищающий мозг гематоэнцефалический барьер. Еще одно преимущество радиохирургии - возможность лечения радиорезистентных опухолей и метастазов (в том числе, почечно-клеточный рак и его метастазы, остеосаркомы и т.д.), при которых традиционная лучевая терапия малоэффективна.
В редких случаях олигометастатического поражения (ограниченное количество метастазов) применение методов радиохирургии может иметь более высокий эффект, чем введение препаратов химиотерапии, при более высоком уровне качества жизни - в первую очередь, за счет отсутствия присущих химиотерапевтическому лечению побочных эффектов.
Радиохирургия: важный элемент сочетанного лечения опухолей
Основной вопрос пациентов, обращающихся за лечением: “Может ли радиохирургия вылечить рак без химии и операции?”. Правильный ответ, чаще всего, “нет”. Несмотря на высокие темпы развития и технического совершенствования, радиохирургия остается важным компонентом комплексного подхода к лечению онкологического заболевания, его рецидивов и метастазов.
Наиболее оптимальный состав лечения, с точки зрения сочетания эффективности лечения, его доступности (финансовой и технологической), качества жизни пациента во время лечения и по его завершению, зависит от внушительного количества факторов.
Тип заболевания, тип опухоли, ее локализация, сопутствующие заболевания и общее состояние пациента, возраст, пол и даже наличие детей - все это и масса других факторов должны быть учтены для того, чтобы оказать качественную онкологическую помощь.
Поэтому в МИБС решения о тактике лечения, с первого дня обращения пациента, принимаются на междисциплинарном консилиуме, в состав которого включаются врачи различных специальностей, как собственные, так и привлеченные узкие специалисты. Стоимость лечения складывается из стоимости радиохирургии (прямо зависит от объема опухолевого поражения, сложности формы опухоли, выбранного метода радиохирургии) а также стоимости остальных составляющих, предусмотренных тактикой лечения.
Существенно упрощает процесс лечения в МИБС тот факт, что возможности наших врачей не ограничены выбором какого-либо одного метода радиохирургии - в МИБС работают и Кибер-нож, и Гамма-нож, и высокоточный линейный ускоритель.
При этом комплексное лечение, в которое входит радиохирургия, лекарственная терапия (не только химиотерапия, но и таргетное лечение, иммунотерапия) и оперативные вмешательства, может быть полностью проведено в рамках единого процесса внутри МИБС. При необходимости, на базе клиники МИБС в России может быть проведен только этап высокотехнологичной онкологической помощи - радиохирургия, а остальное лечение - по месту жительства пациента (по согласованию с лечащим врачом). Такой подход повышает доступность современной онкологической помощи гражданам из различных регионов России, и расширяет географию деятельности МИБС за счет иностранных пациентов, которых привлекает максимальная эффективность лечения, обеспеченность нашего центра современными технологиями лечения рака и умеренная стоимость лечения.
Радиохирургия: ограничения
Это более правильное определение, чем “противопоказания”. Прямых противопоказаний для радиохирургии, ввиду неинвазивности процедуры, нет. Наибольшее ограничение в радиохирургии связано с лечением опухолей головного мозга - при наличии значительных отеков, либо при значительном объеме опухоли, распад которой может привести к отеку, проведение радиохирургического вмешательства следует отложить.
Наиболее частым ограничением для начала лечения на Гамма-ноже и др. является целесообразность проведения лечения. В одном случае разрушение крупного метастаза на 4-й стадии рака может иметь паллиативный эффект и повысить качество жизни, в другом случае лечение рака легкого, при локализации опухоли незначительного размера в удобном для хирургического доступа месте, с точки зрения финансов более целесообразно. Каждый случай требует индивидуального рассмотрения.
Если Вам или Вашим близким показано лечение рака - обратитесь в Центр радиохирургии МИБС чтобы получить предварительное заключение о возможности лечения в конкретном случае.
Не давайте болезни новых шансов - оформите обращение прямо сейчас!

Иванов Павел Игоревич
Заведующий отделением нейрорадиологии.
Нейрохирург высшей категории, кандидат медицинских наук.
Действительный член Всемирного Общества пользователей Гамма-Ножа (LGKS).
Действительный член Европейского Общества функциональной и стереотаксической нейрохирургии (ESSFN).
Действительный член Образовательного комитета Международного Общества Стереотаксической Радиохирургии (ISRS) .
Доцент кафедры нейрохирургии Военно-Медицинской Академии им. С.М. Кирова.
Частые вопросы
Нет, пациент, проходящий курс лучевого лечения, безопасен для окружающих и сам не является источником излучения.
Когда применяется лучевая терапия?
Лучевая терапия может быть использована для лечения практически любого вида опухолей, включая рак мозга, груди, шейки и тела матки, гортани, легкого, поджелудочной железы, простаты, кожи, позвоночника, желудка, сарком мягких тканей. Также облучение может быть использовано в терапии лейкемии и лимфомы. Доза облучения зависит от различных факторов, включая морфологический диагноз, наличия близлежащих органов или тканей, которые могут быть повреждены облучением.
Лучевая терапия также применяется для устранения или ослабления тяжелых симптомов основного заболевания (паллиативная лучевая терапия) – например, очень сильные боли в костях. Показания к применению лучевой терапии очень широки. Этот вид лечения может применяться как самостоятельно, так и в сочетании с двумя другими основными способами лечения онкологических заболеваний – хирургией и химиотерапией. В ряде стран лучевая терапия применяется у 80% пациентов, страдающих онкологическими заболеваниями, на том или ином этапе лечения и в различных комбинациях с другими типами лечебного воздействия. При этом, конечно же, форм реализации лучевой терапии существует крайне много (тип воздействия, методика, доза) и их выбор зависит от основного заболевания, его стадии и многих индивидуальных особенностей течения заболевания пациента.
В чем разница между дистанционной и контактной лучевой терапией (брахитерапией)?
При проведении дистанционной лучевой терапии используются специализированные установки для облучения, при этом нет непосредственного контакта тела пациента с облучающим устройством. При контактной лучевой терапии (брахитерапия) облучение проводится с помощью введения непосредственно в опухоль радиоактивного объекта (аппликаторы и зерна, содержащие радиоактивный препарат).
Как врач определяет дозу облучения?
Лучевая терапия в медицине применяется для лечения различных заболеваний уже много десятилетий. За это время было накоплено огромное количество данных по переносимости тканями организма разных доз радиации, а также по степени воздействия на опухолевые образования. Эти данные были хорошо изучены и систематизированы, а в последние 15-20 лет,линейных ускорителей и возможностью унификации методик лечения в большинстве клиник, появилась возможность выработать так называемые стандарты или клинические руководства по лечению того или иного заболевания. В большинстве случаев эти стандарты являются международными, то есть апробированными и признанными во многих странах мира. Такие руководства или стандарты учитывают вид заболевания, его стадию, предшествовавшее лечение ив зависимости от этих исходных факторов рекомендуют применять ту или иную тактику дальнейшего лечения. В части лучевой терапии предписывается доза облучения, режим облучения (то есть сколько фракций, с каким промежутком, какой разовой дозой и пр.), области, подлежащие облучению (например, регионарные лимфоузлы дополнительно к основному очагу). Эти руководства содержат в себе обобщенный положительный опыт в части лучевой терапии тех или иных образований, приводящий к максимальному контролю над опухолью и минимально возможному риску осложнений со стороны нормальных тканей. Эти документы служат основным руководством к клиническому действию врачей и задают основную тактику ведения больного. Однако все случаи заболеваний индивидуальны и стандартная терапия может и должна быть адаптирована с учетом особенностей и состояния каждого из пациентов, мастерство врача как раз и состоит в том, чтобы подобрать максимально эффективное (радикальное, как часто говорят) лечение с наименьшими, по возможностями, осложнениями.
Понятно, что одно руководство не может быть всеобъемлющим и содержать рекомендации по всем видам лучевого воздействия. Кроме того, методики облучения, объемы и тактика хирургического удаления совершенствуются и меняются, появляются новые препараты для химиотерапии. Все это требует взаимной коррекции методик сочетанного лечения онкологических заболеваний.
Как излучение действует на раковые клетки? Почему лучевая терапия имеет лечебный эффект?
Ионизирующее излучение пагубно воздействует на ДНК раковой клетки. ДНК погибает и раковые клетки, которые до сих пор безудержно размножались, теряют способность к делению. Через некоторое время патологические клетки погибают и рассасываются. Клетки здоровых тканей имеют меньшую чувствительность к ионизирующему излучению и при правильном подборе дозы восстанавливаются и продолжают функционировать.
Что является источником энергии при дистанционной лучевой терапии?
Энергия может поступать с рентгеновскими или гамма-лучами. Оба метода являются формами электромагнитного излучения.
Рентгеновские лучи создаются аппаратами – линейными ускорителями. В зависимости от количества энергии в рентгеновских лучах, последние могут быть использованы для уничтожения раковых клеток на поверхности тела (низкий энергетический уровень) и в более глубоких структурах (высокий энергетический уровень). По сравнению с другими типами излучения, рентгеновские лучи могут облучать достаточно большую область.
Гамма-лучи продуцируются, когда изотопы некоторых элементов (иридий и кобальт 60) высвобождают лучистую энергию при распаде. Каждый элемент распадается с определенной скоростью и каждый высвобождает разное количество энергии, что определяет глубину проникновения в тело.
Какие методы используются или изучаются для увеличения эффективности дистанционной лучевой терапии?
Используются следующие методики:
Лучевая терапия, модулированная по интенсивности (IMRT, ЛТМИ). Это новый тип трехмерной конформной лучевой терапии, при котором используются пучки излучения (обычно, рентгеновские лучи) разных интенсивностей для доставки различных доз облучения в малые области тела в одно время. Технология позволяет облучить опухоль более высокими дозами и меньше повредить соседние нормальные ткани. В некоторых случаях таким способом можно облучать пациента каждый день высокими дозами, т.о. сокращая время лечения, улучшая его результат и уменьшая побочные эффекты.
Излучение исходит из линейного ускорителя, укомплектованного многостворчатым коллиматором, необходимым для формирования излучения. Оборудование может вращаться вокруг пациента, т.о. пучки излучения, идеально подогнанные к форме опухоли, могут направляться под лучшими углами.
Эта новая технология используется для лечения опухолей мозга, головы и шеи, носоглотки, груди, печени, легкого, простаты и матки. Вскоре будут известны отдаленные результаты лечения.
Кто проводит лучевую терапию в медицинских учреждениях?
Лучевой терапией занимается команда, состоящая из онколога-радиолога, медицинского физика и рентгенолаборанта. Радиолог определяет области облучения, дозы и режим облучения, планирует наблюдение за пациентом и поддерживающую терапию после завершения курса лучевой терапии. Совместно с медицинскими физиками врач радиолог выбирает методику облучения, задает дозные ограничения на критические структуры и нормальные ткани, участвует в подготовке больного к лечению (создаются индивидуальные фиксирующие приспособления, вакуумные матрасы, термопластические маски). Медицинский физик отвечает за техническую сторону процесса облучения (создание оптимального плана облучения, расчет дозного распределения, контроль качества работы оборудования). Рентгенолаборанты отделения лучевой терапии– это те люди, которые ежедневно встречают пациента и проводят сеанс лучевой терапии. Они проводят пациента в процедурную лучевой терапии, укладывают его на стол лечебной установки, используя индивидуальные средства иммобилизации этого пациента, проверяют точность укладки с помощью средств рентгеновской визуализации. После того, как подготовительный этап выполнен, оператор проводит лечение по индивидуальному плану облучения этого пациента, который загружен в лечебный аппарат. Рентгенолаборант – это тот человек, которого вы видите каждый день в течение курса лечения. Это связующее звено между вами и вашим врачом. Рентгенолаборант как никто другой хорошо знает особенности вашей укладки, есть ли сложности в реализации плана, каково ваше самочувствие день ото дня, и именно этот медицинский работник первым сообщает о возможных проблемах лечащему врачу.
Часто лучевую терапию комбинируют с химиотерапией, тогда она является частью общей схемы лечения пациента. Онколог-радиолог также взаимодействует с онкологом-педиатром, хирургом, лучевым диагностом, морфологом и другими специалистами для выработки идеальной тактики ведения пациента.
Что такое радиосенсибилизаторы и радиопротекторы?
Радиосенсибилизаторы и радиопротекторы - это химические и физические агенты, которые изменяют чувствительность клетки к облучению. Радиосенсибилизаторы - это вещества, которые делают раковые клетки более чувствительными к облучению (например, кислород). Некоторые противоопухолевые препараты, такие как 5-фторурацил, цисплатин, темодал также обладают свойствами радиосенсибилизаторов.
Радиопротекторы это препараты, защищающие нормальные клетки от излучения. Эти препараты стимулируют репарацию (восстановление) ДНК нормальных клеток. Одним из таких препаратов является амифостин (Ethyol®).
В чем разница в лучевой терапии на современных линейных ускорителях и гамма-машинах и линейных ускорителях предыдущих поколений?
Лучевая терапия с применением гамма-машин, (кроме установки Гамма нож – золотого стандарта радиохирургического лечения), в настоящее время практически не применяется в развитых странах. Это связано с крайне низкой точностью облучения опухоли на установках такого типа и частым лучевым поражением окружающих здоровых тканей. Линейные ускорители предыдущих поколений тоже не приспособлены для высокоточного облучения. Самые современные линейные ускорители дают техническую возможность подать высокую дозу радиации непосредственно в опухоль и избежать поражения рядом расположенных жизненно-важных органов и структур, что резко улучшает прогноз.
Почему мы должны делать лучевую терапию за деньги, если в нашем городе мы можем это сделать бесплатно?
Во-первых, в РФ существует огромный недостаток современных линейных ускорителей, в связи с чем, больные часто вынуждены ожидать своей очереди на лучевую терапию месяц и более. Вместе с тем сроки проведения лучевой терапии крайне важны и определены протоколами лечения.
Мы всегда соблюдаем Американские и Европейские протоколы лечения. Соблюдение протоколов повышают ваши шансы на благоприятный исход терапии.
Во-вторых, лучевая терапия требует очень скрупулезного выполнения ряда манипуляций: таких как проверка положения пациента перед лечением и даже во время такового. Кроме того применение современных методик облучения, занимает достаточно большое время. Однако в условиях огромного дефицита лучевой техники во всех государственных учреждениях на лечение одного больного выделяется всего несколько минут (иногда всего 5-7 минут), что не позволяет использовать все возможности современной техники. Возможность уделить каждому пациенту необходимое количество времени, позволяет нам использовать все преимущества нашей современной техники.
Наконец, наличие в нашей команде медицинских физиков высочайшего уровня, позволяет нам создавать планы лечения максимально адаптированных для каждого конкретного больного.
Лечение опухолей в Беларуси
ГУ "Республиканский научно-практический центр онкологии и медицинской радиологии имени Н.Н. Александрова" представляет собой единый научно-лечебно-учебный комплекс. В его состав входят 4 научных отдела и 10 научных лабораторий, 20 стационарных и 11 диагностических отделений. На базе Центра функционирует кафедра онкологии БелМАПО. Число сотрудников – 2034, врачей – 444, из них 189 высшей категории и 117 первой, 24 доктора и 74 кандидата медицинских и биологических наук, 11 профессоров и член-корреспондент Национальной академии наук Беларуси.
В клинике Центра (830 коек) обследуются и получают лечение более 19 000 онкологических пациентов в год.
Методы лечения онкологических заболеваний
Специалисты Центра владеют всеми наиболее эффективными и применяемыми в мировой практике методами хирургического, лучевого, химиотерапевтического, комбинированного и комплексного лечения всех форм и локализаций злокачественных опухолей.
Хирургические методы лечения
В 20-ти прекрасно оборудованных операционных выполняется более 12 тыс. сложных операций в год при опухолях головы и шеи, молочной железы, легкого, пищевода, желудка, толстой и прямой кишки, мочеполовых органов, костей и мягких тканей. Широко применяются видеоассистированные, пластические, реконструктивные, органосохраняющие и симультанные операции. Сложные оперативные вмешательства выполняются при эффективном обезболивании.
Лучевая терапия
Четыре современных линейных ускорителя позволяют проводить лучевую терапию с модуляцией интенсивности дозы, стереотаксическую (радиохирургия), 3- и 4-мерную конформную лучевую терапию. При лучевой терапии используются также гамма-терапевтический аппарат и 2 комплекса для контактной лучевой терапии (брахитерапии).
Химиотерапия, гормонотерапия, таргетная терапия
Применяются все принятые в мировой практике схемы и программы химиотерапевтического и гормонального лечения опухолей, в том числе таргетная терапия.
Дополнительные методы лечения
При необходимости лечение дополняется радиочастотной абляцией опухолей и применением модифицирующих воздействий (гипертермия, фотодинамическая терапия). Центр имеет необходимые для работы государственные лицензии и сертификаты.
Лечение иностранных граждан
В РНПЦ ОМР им Н.Н. Александрова оказываются различные медицинские услуги при обследовании и лечении пациентов из стран ближнего и дальнего зарубежья. Ежегодно в Центре проходят обследование и необходимое лечение более 2000 онкологических пациентов из зарубежных стран (Российской Федерации, Украины, Азербайджана, Грузии, Казахстана, Узбекистана, Армении, Литвы, Республики Молдовы, Таджикистана, Латвии, Эстонии, Болгарии, Венгрии, Ливии, США, Великобритании, Венесуэлы, Ирака). Услугами Центра по клиническим испытаниям лекарственных препаратов, оборудования, инструментария (по направлению Центра экспертиз и испытаний в здравоохранении) пользуются многие фирмы и учреждения Российской Федерации, Литвы, США, Нидерландов, Китая, Великобритании, Кипра, Польши, Чехии, Израиля, Швейцарии, Германии, Болгарии.
Лучевая терапия

Лучевая терапия (ЛТ) – один из локальных (местных) способов лечения онкологических заболеваний, при котором точно подведенные высокие дозы облучения (радиации) используются для уничтожения опухолевых клеток. Подобное излучение, но в гораздо меньших дозах, применяется при проведении рентгенологических исследований, например, флюорографии, компьютерной томографии (КТ) и так далее. Для проведения ЛТ применяются рентгеновские лучи, гамма-лучи и заряженные частицы.
Как работает лучевая терапия?
Для деления любой клетки, как нормальной, так и опухолевой, необходимо «дублирование» цепочек ДНК (особые молекулы, которые используются для хранения генетической информации в клетках). Принцип действия ЛТ основан на её повреждающем действии на цепочки ДНК, за счет прямого разрушения связей между основаниями ДНК или образования заряженных частиц (свободных радикалов). Клетки с поврежденным ДНК не способны размножаться, поэтому они вступают в клеточный цикл (начинают процесс деления), клетка останавливается «на половине пути» и погибает. Следствием этого является то, что ЛТ не способна уничтожить опухолевые клетки мгновенно, их гибель происходит постепенно, в течение дней или недель после проведения облучения.
Облучение повреждает не только опухолевые, но и нормальные клетки, что является причиной развития нежелательных явлений и осложнений проведения ЛТ (подробнее – ниже). Врач-радиолог обязательно учитывает данный факт при планировании лечения, стараясь максимально защитить нормальные ткани за счет точного подведения пучка облучения, а также ограничения дозы облучения – максимальная переносимая доза радиации для здоровых тканей выше, чем для опухоли.
Для чего применяется лучевая терапия?
Применение ЛТ может уничтожать опухолевые клетки или замедлять их рост. ЛТ применяется как самостоятельный метод лечения, а также и в составе комплексной терапии – в сочетании с хирургическим и/или лекарственным методами. Можно выделить две основные цели её проведения:
- Лечение онкологического заболевания – когда предполагается, что пациент может быть вылечен от болезни. В зависимости от вида злокачественного новообразования, ЛТ может быть использована:
- Как основной метод лечения – «ЛТ по радикальной программе». Подобный подход широко применяется при раке предстательной железы, шейки матки, влагалища, головы и шеи, других опухолях наружной локализации, а также опухолях центральной нервной системы, лимфоме Ходжкина и так далее;
- Адъювантная (вспомогательная) ЛТ применяется для уничтожения опухолевых клеток, которые потенциально могли остаться после хирургического лечения. Данный вид ЛТ проводится после радикального хирургическго удаления злокачественного новообразования. Это необходимо для снижения риска развития рецидива опухоли.
- Кроме того, иногда применяется неоадъювантная (предоперационная) ЛТ, которая проводится для уменьшения опухолевой массы с целью достижения возможности полного хирургического удаления опухоли.
Какие бывают виды лучевой терапии?
Выделяют дистанционную (наружную) ЛТ и внутриполостную ЛТ. Для проведения дистанционной ЛТ используют внешние источники облучения, пример того, как они могут выглядеть представлен на Рисунке 1 (изображен линейный ускоритель). При их работе электрическая энергия применяется для создания пучка высокоэнергетических субатомных частиц, которые и оказывают основные эффекты лучевой терапии. При проведении этого вида лечения облучению подвергается только та часть тела, в которой расположена опухоль.
![]()
Рисунок 1. Пример внешнего вида устройства
для проведения дистанционной лучевой терапииПри внутренней лучевой терапии (брахитерапия) источник радиоактивного облучения помещается внутрь человеческого тела. Для этого применяются различные радиоактивные материалы и способы их размещения. Например, при раке предстательной железы радиоактивный материал размещают внутри опухолевой ткани (такой вид лечения также называют интерстициальной брахитерапией). При проведении брахитерапии при раке шейки матки источник радиоактивного излучения размещают непосредственно в полости матки.
Используемые при проведении этого вида лечения радиоактивные изотопы помещают внутрь небольших частиц, которые вводятся в необходимое место с помощью специальных устройств, например катетеров или игл. В процессе естественного полураспада радиоактивных изотопов высвобождается радиоактивная энергия, которая и оказывает противоопухолевое действие. После завершения процесса распада, введенные элементы перестают быть радиоактивными и не оказывают какого-либо вредного действия на окружающие ткани.
В некоторых случаях применяют сочетание дистанционной и внутренней ЛТ, данный подход получил название «сочетанная» лучевая терапия.
Отдельным подвидом ЛТ является системная лучевая терапия. Для этого применяют радиофармацевтические препараты, например, моноклональные антитела (особые молекулы, которые распознают «мишени» в опухолевой ткани и прикрепляются к ним), соединенные с радиоактивными молекулами. Такой подход применяется для точной доставки облучения к опухолевым клеткам. Другим примером является проведение терапии радиоактивным йодом (131I) у пациентов с диагнозом рака щитовидной железы. Клетки щитовидной железы захватывают изотопы радиоактивного йода и гибнут вследствие облучения.
Каким образом осуществляется подготовка к лучевой терапии?
Перед проведением лучевой терапии врач-радиолог определяет необходимые дозы ЛТ и планирует какой объем ткани попадет в зону облучения, после чего выполняется «разметка».
«Разметка» - создание внешних ориентиров для тех тканей, которые должны попасть в зону облучения. Наиболее часто для этой цели используется ультразвуковое исследование (УЗИ) или компьютерная томография (КТ). Данные, полученные в ходе этих исследований, используются для того, чтобы понять точное расположение и размеры опухоли, а также её взаимоотношение с окружающими тканями. После завершения этапа планирования на тело пациента могут наноситься специальные метки, которые в дальнейшем станут внешними ориентирами при проведении ЛТ. В объем облучаемой ткани включается опухоль, а также небольшое количество здоровой ткани вокруг нее.
После завершения этапа планирования лучевой терапевт оценивает необходимую дозу облучения и необходимое количество дозы ЛТ. Доза ЛТ наиболее часто измеряется в греях (Гр). Как правило, проведение ЛТ занимает достаточно длительный срок, облучение проводится 5 дней в неделю, и продолжается в течение нескольких неделю. Одна доза (фракция) дается 1 раз в день. Это служит двум основным целям: дать время нормальным тканям восстановится после повреждающего действия ЛТ, одновременно повышая вероятность того, что наибольшее количество опухолевых клеток окажется уязвимыми к ней.
Доза облучения, которая дается за один сеанс, обозначается термином «разовая очаговая доза (РОД)», курсовая доза – «суммарная очаговая доза (СОД»). Вы можете встретить данные аббревиатуры в вашей медицинской документации. Разделив СОД на РОД вы узнаете какое количество фракций облучения было или будет использовано в процессе вашего лечения.
Можно ли проходить повторные курсы лучевой терапии?
Если какая-либо часть тела подвергалась воздействию ЛТ и уже получила максимальные переносимые для здоровой ткани дозы, повторное облучение этой зоны противопоказано вследствие опасности развития необратимого повреждения здоровой ткани. В то же время, если возникает необходимость проведения ЛТ на другую зону, это может быть выполнено при наличии соответствующих показаний.
Каковы возможные побочные эффекты лучевой терапии?
Вследствие повреждающего действия на нормальные ткани, ЛТ вызывает ряд побочных эффектов. Они могут быть ранними (острыми), возникающими на фоне лечения или вскоре после его завершения, и отсроченными (хроническими), развитие которых может происходить спустя месяцы или даже годы после завершения ЛТ.
Индивидуальный риск развития острых и отсроченных побочных эффектов предсказать невозможно. Возникающие побочные эффекты зависят от облученного участка тела, разовой и суммарной использованных доз, а также наличия хронических заболеваний, вредных привычек, образа жизни, наследственной предрасположенности, а также точности соблюдения рекомендаций лечащего врача.
Острые нежелательные явления обусловлены повреждением быстро делящихся клеток нормальных тканей, к ним относятся раздражение кожных покровов в зоне облучения, нарушение функции слюнных желез, потеря волос при облучении головы или шеи, проблемы с мочеиспусканием при облучении нижних отделов живота. Большинство острых явлений проходят спустя некоторое время после завершения ЛТ.
Часто на фоне проведения ЛТ пациенты отмечают повышенную утомляемость и развитие общей слабости, возможно также развитие тошноты и/или рвоты, особенно в случае облучения области живота и головного мозга. Для предотвращения их развития применяются специальные противорвотные лекарственные препараты. Обязательно сообщите своему врачу, если у вас отмечается тошнота и/или рвота на фоне ЛТ.
К поздним осложнения лучевой терапии, которые, в прочем, отмечаются не у всех больных, относят:
- Развитие фиброза – замещение нормальной ткани соединительной тканью, которая по своей структуре аналогично рубцам. В зависимости от облученной зоны это может приводить к снижению функционального состояния легких, нарушению подвижности конечностей, проблемам с мочеиспусканием и/или стулом;
- Повреждение кишечника, приводящее к хронической диарее;
- Ухудшение памяти после облучения головного мозга;
- Бесплодие;
- Очень редко наблюдается развитие вторичных опухолей в зоне облучения. Так, у девочек и молодых женщин, получавших терапию на область грудной клетки по поводу лимфомы Ходжкина (лимфогранулематоз) отмечается повышенный риск развития рака молочной железы.
Около 50% онкологических пациентов проходят лучевую терапию на том или ином этапе своего лечения.
Что такое лучевая терапия? Словарь радиотерапевта
![]()
Елена Ивановна Тюряева, онколог и радиотерапевт НМИЦ онкологии им. Н.Н. Петрова, рассказала о возможностях современной лучевой терапии и ее значении в борьбе с онкологическими заболеваниями.
Когда появилась лучевая терапия?
В 1896 году в Вене доктор Фройнд впервые в мире применил рентгеновское излучение не для диагностики заболевания, а для лечения поверхностно расположенного доброкачественного образования. Несколькими годами позднее супруги Пьер и Мария Кюри открыли радиоактивный радий, который стал использоваться для контактной радионуклидной терапии.
За 125 лет лучевая терапия, проделав огромный путь совершенствования, получила широкое применение и вышла на качественно новый уровень. По мнению экспертного сообщества, в настоящее время не менее 60-70 % всех онкологических пациентов нуждается в лучевой терапии.
Что такое лучевая терапия?
Лучевая терапия – это процесс использования ионизирующего излучения для лечения различных заболеваний, прежде всего, онкологических. Это один из самых высокотехнологичных методов терапии, объединяющий инженерно-технические разработки, физико-математические модели и достижения информационных технологий. Лучевая терапия требует специалистов-радиотерапевтов знаний в области биологии, анатомии, радиобиологии, лучевой диагностики и общей онкологии.
Цели лучевой терапии
Задача лучевой терапии – достижение максимально возможного воздействия на опухоль и зоны ее клинического и субклинического распространения с высокой степенью точности и минимальными последствиями для окружающих тканей и органов. Цель лучевой терапии – разрушение опухолевой массы, в идеале приводящее к ее ликвидации или уменьшению размеров и метастатического потенциала, замедлению роста, что способствует продлению жизни и улучшению ее качества.
Лучевая терапия может использоваться на разных этапах лечения:
- Предоперационная (т.н. индукционная, или неоадъювантная)
- Интраоперационная – в ходе оперативного вмешательства
- Послеоперационная (адъювантная)
- Самостоятельная (дефинитивная)
Предоперационная лучевая терапия
Задача предоперационной лучевой терапии — максимальное уменьшение объема опухоли, предотвращение попадания опухолевых клеток в лимфатическую или кровеносную систему, снижение риска развития отдаленных метастазов. При большинстве типов опухолей наиболее часто используется тандем лучевой и химиотерапии. Такое комбинированное воздействие позволяет в дальнейшем выполнить радикальное вмешательство с полным удалением новообразование. В ряде случаев предоперационная лучевая/химиолучевая терапия может приводить к полному регрессу опухоли, таким образом оказываясь самостоятельным методом лечения. Достижение полного клинического регресса, доказанное рентгенологическими методами (КТ, МРТ, ПЭТ-КТ) и подкрепленное данными биопсии, увеличивает возможность отсрочки или отказа от операции. Так, для опухолей прямой кишки, с полным клиническим ответом на химиолучевую терапию, получила признание концепция «waitandsee», т.е. «жди и наблюдай», закрепленная в международных и национальных стандартах лечения.
Интраоперационная лучевая терапия
Интраоперационная лучевая терапия – это облучение ложа опухоли сразу же после удаления ее хирургическим путем, непосредственно в операционном поле. Это действенный метод снижения риска развития местного рецидива. Интраоперационная лучевая терапия используется при опухолях молочной железы, при саркомах мягких тканей и даже при новообразованиях ЖКТ. Этот метод очень эффективен, но не лишен недостатков. Во-первых, для ее проведения необходимы специальные мобильные и компактные лучевые установки, которые могут располагаться в операционной. Во-вторых, однократная доза облучения может оказаться недостаточной, а объем интраоперационно облучаемых тканей достаточно ограничен. Интраоперационная лучевая терапия не позволяет воздействовать на пути лимфоотока. Трудно обеспечить точность дозиметрического планирования. Лучевая процедура увеличивает время пребывания пациента под наркозом и общую продолжительность вмешательства. Поэтому чаще интраоперационная лучевая терапия является составной частью сочетанного облучения, этапом комплексного лечения.
Послеоперационная лучевая терапия
Послеоперационная лучевая терапия – это воздействие на зону удаленной опухоли и пути лимфооттока для того, чтобы предотвратить возможность распространения отдельных опухолевых клеток в ходе хирургического вмешательства, т.е. снижения рисков развития местных и отдаленных метастазов. Послеоперационная лучевая терапия бывает необходима и после обширных операций, и после малоинвазивных вмешательств. В настоящее время наиболее часто применяется в лечении рака молочной железы, сарком мягких тканей, опухолей головы и шеи.
Самостоятельная или дефинитивная лучевая терапия
Самостоятельная лучевая/химиолучевая терапия показана в тех случаях, когда ее эффективность сравнима с радикальным оперативным лечением, т.е. при раннем раке, или, напротив, когда радикальное вмешательство невозможно – при наличии общих противопоказаний или из-за распространенности опухоли. В настоящее время рассматривается в качестве альтернативного метода лечения ранних опухолей голосового отдела гортани, ряда новообразований кожи. Наибольшее применение нашла в лечении рака предстательной железы. В сочетании с химиотерапией успешно используется при ранних опухолях пищевода, анального канала. Химиолучевое лечение является ведущим методом лечения рака шейки матки.
Наконец, лучевая терапия применяется для устранения симптомов опухолевого заболевания, таких, как боль, нарушение глотания и др. (симптоматическая лучевая терапия) или сдерживания опухолевого процесса (паллиативная лучевая терапия).
Технология лучевой терапии
Последовательность лечебных мероприятий для каждого больного принимается на онкологическом консилиуме в составе хирурга-онколога, химиотерапевта и радиотерапевта. Определив показания к лучевому лечению, врач-радиотерапевт формулирует общий план лечения: продолжительность курса, режим фракционирования дозы (доза за один сеанс облучения), суммарную дозу облучения, необходимость одновременного химиолучевого лечения, применения радиомодификаторов. Проведению сеансов облучения предшествуетэтап предлучевой подготовки.
Предлучевая подготовка включает:
- Компьютерную (рентген) топометрию
- Контуринг мишени и смежных органов
- Дозиметрическое планирование
Компьютерная топометрия
Создание индивидуальной дозиметрической карты облучения начинается с компьютерной топометрии, которую проводит врач-рентгенолог совместно с радиотерапевтом. На компьютерном томографе-симуляторе, с теми же фиксирующими приспособления и в том же положении, в котором будет проводиться лечение, сканируется область анатомического расположения опухоли (грудная клетка, брюшная полость, головной мозг и т.д.). Оцениваются структурные и анатомические особенности — локализация опухоли, протяженность объема, взаимоотношение со смежными органами, плотность внутренних тканей. Во время этой процедуры на кожу больного выносятся графические ориентиры –метки для центрации пучков излучения, которые в дальнейшем позволят ускорить навигацию в процессе проведения сеансов лечения. Последовательность компьютерных сканов передается на планирующую станцию для создания индивидуального плана облучения.
Контуринг мишени и смежных органов
Дальше наступает этап обработки полученных изображений. Сканы импортируются в планирующую систему, где врач-радиотерапевт с помощью врача-рентгенолога производит выделение очертаний (оконтуривание) опухолевой мишени, всех смежных органов в каждом полученном скане. На основании совокупности объемных изображений в дальнейшем производится расчет дозных нагрузок в ходе лечения на опухоль и соседние органы с учетом их толерантности к облучению.
Дозиметрическое планирование
После завершения оконтуривания, оценки расположения опухоли и смежных органов, наступает этап дозиметрического планированиякурса лучевого лечения, который выполняется медицинскими физиками.Дозиметрическое планирование – это подбор количества и условий формирования пучков излучения, их пространственного размещения для того, чтобы подвести к опухоли максимально возможную терапевтическую дозу с минимальными последствиями для соседних органов. Современные медицинские ускорители, обладающие многолепестковыми коллиматорами, позволяют формировать поля сложной конфигурации, максимально точно соответствующие объему и форме облучаемой мишени, производя т.н. конформное облучение. Исходя из поставленных задач, оптимальный охват мишени может быть спланирован с использованием 3D многопольного облучения с объемно-модулируемой интенсивностью (IMRT) или дуговой модулируемой интенсивностью пучка излучения (VMAT).
На изображении представлен пример 3D многопольного излучения. Видно, что для облучения опухоли используется 3 пучка.
![]()
Средства иммобилизации пациента
Для того, чтобы осуществлять точную подачу ионизирующего излучения к облучаемой мишени, необходимо четко воспроизводить то положение, в котором шел процессе подготовки к лучевому лечению, т.е. компьютерная топометрия и дозиметрическое планирование. Это обеспечивается разнообразными средствами для укладки, иммобилизации пациента. Они могут быть в виде разных штатных дек с подголовниками, креплениями, валикамии подставками для рук, ног, таза. Есть и индивидуальные средства. Например, вакуумные матрасы и термопластические маски, фиксирующие индивидуальные формы тела пациента в положении облучения. Эти приспособления позволяют избегать смещения облучаемой зоны из-за непроизвольных движений пациента.
Виды лучевой терапии
Дистанционная лучевая терапия
Особое внимание в настоящее время приковано к протонной терапии. Первый в России клинический центр протонной терапии был построен в Санкт-Петербурге. Преимущество метода состоит в особенности тяжелых заряженных частиц (протонов). Протоны максимально высвобождают энергию торможения в конце пути своего пробега, причем спад дозы от 90% до 20% происходит на дистанции 2-5 мм. Такая возможность концентрации дозы в конце пробега частицы позволяет не только наилучшим образом сконцентрировать дозу, но и минимизировать лучевую нагрузку на ткани по ходу пучка и за патологическим очагом. Протонная терапия актуальна в онкоофтальмологии, радионейрохирургии, и особенно для пациентов детского возраста. В настоящее время сфера применения протонной терапии расширяется, однако пока использование метода существенно ограничивается его высокой стоимостью.
Современной технологией дистанционного облучения является стереотаксическая лучевая терапия – метод высокопрецизионного крупнофракционного облучения опухолей размером не более 5 см. В отличие от радиохирургии, разработанной для лечения опухолей головного мозга, использующей однократное облучение, общее число фракций при стереотаксическом облучении варьирует от 1 до 5-6. Разовая очаговая доза составляет от 8 Гр до 20 Гр, суммарная эквивалентная поглощенная доза от 50 Гр до 150 Гр, что существенно выше, чем при классическом варианте фракционирования лучевой терапии. Гамма-нож — один из видов лучевых установок для стереотаксического облучения новообразований головного мозга. Ускорители с микролепестковыми коллиматорами позволяют производить стереотаксическое облучение любых очагов (головной мозг, предстательная железа, легкое, кости, печень, поджелудочная железа, лимфоузлы, мягкие ткани). При стереотаксическом облучении обязательно учитываются смещения очага, возникающие при дыхании. Для этого запись КТ-изображений при КТ-симуляции производится с синхронизацией дыхательного цикла (4D лучевая терапия).
Контактная лучевая терапия
При контактной лучевой терапии или брахитерапии, источник излучения вводится внутрь пораженного органа. Преимущества такого вида терапии – это короткий курс, высокая точность и низкая нагрузка на смежные органы, что очень важно для дальнейшего качества жизни пациентов. Для брахитерапии используются различные радиоактивные источники – изотопы кобальта (Co⁶⁰), иридия (Ir¹⁹²), цезия (Cs¹³⁶).
Контактная лучевая терапия имеет разновидности: аппликационная, внутриполостная, внутритканевая и радионуклиднаялучевая терапия.
Аппликационная лучевая терапия
При аппликационной лучевой терапии источник располагается на поверхности облучаемого наружного объекта (кожа).
Внутриполостная лучевая терапия
При внутриполостной лучевой терапии источник подводят напрямую к опухоли в полости органа. Наиболее часто применяется при раке прямой кишки, анального канала, пищевода, при внутрибронхиальных образованиях. Внутриполостная или внутрипросветная брахитерапия чаще используется как этап сочетанной лучевой терапии, до или после дистанционного облучения. Однако нередко брахитерапия как самостоятельный метод достаточна после малоинвазивных операций при ранних стадиях рака. При паллиативном лечении рака пищевода брахитерапия — эффективный способ устранения дисфагии (расстройства акта глотания).
Внутритканевая лучевая терапия
При внутритканевой лучевой терапии источник вводят в ткани самой опухоли. Внутритканевая брахитерапия наиболее распространена при опухолях предстательной железы, широко используется при облучении молочной железы, при опухолях головы и шеи и при новообразованиях в печени.
Радионуклидная лучевая терапия
В радионуклидной или радиоизотопной терапии источником излучения является радиофармпрепарат, который после введения в организм пациента избирательно накапливается в опухолевых тканях. Наибольшее распространениенашли РФП, содержащие радионуклиды йода I¹³¹ (рак щитовидной железы), I¹²⁵(в виде гранул для лечения рака предстательной железы), стронция Sr⁸⁹ (костные метастазы). Недостатками, ограничивающими использование радионуклидной терапии, являются узкий терапевтический диапазон , ограниченная возможность точного дозиметрического планирования, неприменимость многофракционного облучения. С учетом количества абсолютных ограничений стоимость метода достаточно высока.
Перспективы лучевой терапии
Основными векторами дальнейшего развития лучевой терапии являются усовершенствование методик визуально ориентированного подведения дозы, влияние на радиочувствительность опухолевых клеток с помощью радиомодификаторов, применений комбинаций лучевого лечения с новыми химио- и иммунотерапевтическими агентами.
![Что такое лучевая терапия? Словарь радиотерапевта]()
![]()
Беседовала
Анастасия Башкова
практикант отдела по связям с общественностью НМИЦ онкологии им. Н. Н. Петрова
Санкт-Петербургский государственный университет
Высшая школа журналистики и массовых коммуникацийЧто вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Читайте также:
- МРТ тазобедренного сустава в продольной проекции в норме
- Причины устойчивости опухолевых клеток к химиотерапии
- Рентгенограмма, КТ, МРТ при внесуставном переломе пяточной кости
- Пластмассы в челюстно-лицевой ортопедии. Свойства ортопедической пластмассы.
- Диастолические шумы при аортально-митральных пороках. Пресистолический шум у верхушки сердца