Лучевые признаки синдрома фето-фетальной трансфузии
Добавил пользователь Валентин П. Обновлено: 18.12.2025
Прием пациенток из г.Челябинска осуществляется в плановом порядке по предварительной записи (будние дни с 9:30 до 10:30), после получения печати и даты дородовой госпитализации при личном обращении. При себе необходимо иметь: паспорт, полис ОМС, диспансерная книжка (обследования УЗИ).
Для госпитализации в ОПБ обязательно наличие обследований (с учетом срока беременности):
Анализ крови на сифилис (RW) — в 1ом, 2ом, 3ем триместре беременности.
Анализ крови на ВИЧ, парентеральные вирусные гепатиты (HBsAg, HCV) — в 1ом (при постановки на учёт) и 3ем триместре беременности.
Список документов и вещей, необходимых для госпитализации в отделение:
- Все пациенты при плановой госпитализации должны предъявлять результаты обследования методом ПЦР или экспресс-тест на COVID-19, срок годности анализа на COVID-19 - 48 часов с момента забора.
- Паспорт гражданина РФ.
- Диспансерная книжка беременной женщины.
- Полис обязательного медицинского страхования.
- СНИЛС.
- Удобная для Вас одежда (халат, сорочка, майка, шорты, тренировочный костюм, носки и др. - кроме вещей из шерсти).
- Моющиеся (резиновые) тапочки.
- Предметы личной гигиены (зубная щетка и паста, шампунь, гель-душ, одноразовые прокладки и др.).
- Полотенце.
- Мобильный телефон, ноутбук, плеер.
- Эластические компрессионные чулки.
- Не рекомендовано наличие гель-лака и ювелирных украшений (затрудняется работа медицинкого оборудования).
Для новорожденного женщина приносит на роды:
- 2 шапочки хлопчатобумажные (без завязок).
- 2 пары хлопчатобумажных носочков.
- Электронный термометр.
! Вещи должны быть выстиранными, проглаженными и упакованы в чистый, неиспользованный ранее пакет.
Партнерские роды
Желающим присутствовать на партнерских родах необходимо иметь:
- Флюорографическое обследование легких (ФОГ), давностью не более 6 месяцев.
- Вторую обувь
- Одноразовую хирургическую одежду – шапочку, маску, хирургический костюм – приобретается в аптеках.
- Результат обследования методом ПЦР или экспресс-тест на COVID-19, срок годности анализа на COVID-19 - 48 часов с момента забора.
Федеральный закон №323 от 21.11.2011
Статья 51 пункт 2.
Отцу ребенка или иному члену семьи предоставляется право при наличии согласия женщины с учетом состояния ее здоровья присутствовать при рождении ребенка, за исключением случаев оперативного родоразрешения, при наличии в учреждении родовспоможения соответствующих условий (индивидуальных родовых залов) и отсутствии у отца или иного члена семьи инфекционных заболеваний. Реализация такого права осуществляется без взимания платы с отца ребенка или иного члена семьи.
P.S. В оказании медицинской помощи возможно участие обучающихся по профессиональным образовательным программам медицинского образования
Лучевые признаки синдрома фето-фетальной трансфузии
Лучевые признаки синдрома фето-фетальной трансфузии
а) Терминология:
• Осложнение беременности монохориальной двойней, вызванное внутриутробной трансфузией крови от плода-донора к плоду-реципиенту через артериовенозные анастомозы плаценты
• Стадия СФФТ определяется объемом амниотической жидкости, размерами мочевого пузыря, показателями допплерометрии и наличием водянки плода
б) Лучевая диагностика:
• Плод-донор:
о Маловодие, диагностируемое при длине МВК о Признак «кокона», характеризующийся выраженным маловодием, небольшими размерами и фиксированным положением плода-донора
о Как правило, присутствуют нарушения гемодинамики при допплеровском исследовании ПА плода-донора
• Плод-реципиент:
о Многоводие, диагностируемое при длине МВК >80 мм в 100 мм в >20 нед.
о Нарушения гемодинамики при допплеровском исследовании сосудов, обычно затрагивающие венозный проток и ПВ
о Кардиомиопатия вследствие перегрузки объемом
о Атрезия и стеноз легочной артерии - 9,6% случаев
• Согласно результатам исследования СФФТ, проведенного Национальными институтами здравоохранения США, установлено, что наибольшей прогностической ценностью в отношении смерти плода-реципиента обладает кардиомиопатия
(Слева) Дискордантная монохориаль-ная двойня. Однонаправленное артериовенозное шунтирование бедная кислородом кровь от плода-донора с гиповолемией и задержкой роста В (маловодие) направляется к плоду-реципиенту с гиперволемией (многоводие).
(Справа) УЗИ в 17 нед. 5 дней. Определяется симметричное распределение амниотической жидкости вокруг тонкой перегородки между плодами Разница длин МВК >40 мм позволяет заподозрить СФФТ. Критерием диагностики СФФТ является маловодие одного плода (80 мм). (Слева) Тот же случай. Повторное УЗИ в 27 нед. Предельно выраженное многоводие В. Перегородка между плодами не визуализируется, поскольку она «обернута» вокруг плода-донора. Двигательная активность плода-донора отсутствует, плода-реципиента - повышена.
(Справа) Асимметричное распределение амниотической жидкости вокруг плодов: маловодие (красные «х»), многоводие (белые «х»). Выполнена лазерная коагуляция анастомозов. Спустя 1 нед. после операции произошел преждевременный разрыв плодных оболочек, родились живые недоношенные дети.
в) Патологоанатомические особенности:
• Практически во всех случаях беременности монохориальной двойней присутствуют сосудистые анастомозы плаценты
• СФФТ развивается при асимметричном артериовенозном шунтировании между плодами
г) Клинические особенности:
• Во всех случаях беременности монохориальной двойней выполняют измерение МВК каждые 2 недели начиная с 16 нед.
• Тактика ведения беременности определяется стадией СФФТ
• Методом выбора при II—IV стадии СФФТ при развивающейся беременности является лазерная коагуляция в
Редактор: Искандер Милевски. Дата обновления публикации: 12.11.2021
Оптимизация обследования детей, перенесших фето-фетальный трансфузионный синдром
Цель исследования: оптимизировать обследование детей из монохориальных диамниотических двоен в раннем возрасте в зависимости от того, перенесли ли они синдром фето-фетальной трансфузии (СФФТ).
Дизайн: сравнительное проспективное когортное наблюдение.
Материалы и методы. Проведено наблюдение за 60 недоношенными детьми из монохориальных диамниотических двоен с гестационным возрастом 26 недель 0–6 суток — 32 недели 0–6 суток. Основную группу (группу I) составили 30 детей, перенесших СФФТ и его внутриутробную хирургическую коррекцию. В группу сравнения (группу II) вошли 30 детей, у которых СФФТ не было. Промежуточные контрольные точки — сроки катамнестического (проспективного) наблюдения: 1-я точка — рождение (26 нед 0–6 суток — 32 нед 0–6 суток); 2-я точка — 6 мес корригированного возраста; 3-я точка — 12 мес корригированного возраста; 4-я точка — 18 мес корригированного возраста. Всем детям выполняли диффузионно-тензорную магнитно-резонансную томографию с трактографией. В качестве основных исходов сочетанной перинатальной патологии у детей в обеих когортах фиксировалась частота грубых органических поражений центральной нервной системы (ЦНС) и негрубых резидуальных (функциональных) нарушений.
Результаты. Согласно данным МР-трактографии, изучаемые показатели у детей групп I и II в 6 месяцев корригированного возраста значимо не различались, кроме среднего коэффициента диффузии (average diffusion coefficient, ADC) справа задней ножки внутренней капсулы. В возрасте 12 месяцев у младенцев, перенесших СФФТ, отмечались значимые снижение показателя FA в средней трети ствола мозолистого тела (р = 0,034) и валике мозолистого тела справа (р = 0,001), повышение значения ADC в валике мозолистого тела справа (р = 0,0001). Выявлена тенденция к повышению FA у детей основной группы в изучаемых параметрах внутренней капсулы, значимо более высокий показатель FA справа зафиксирован в колене внутренней капсулы (р = 0,0001). В возрасте 18 месяцев корригированного возраста значения FA справа средней трети ствола мозолистого тела у пациентов, перенесших СФФТ, были значимо ниже, чем в группе сравнения. Показатели ADC справа задней ножки и колена внутренней капсулы, а также средней трети ствола мозолистого тела были существенно выше в группе I, чем в группе II.
Структура исходов перинатальной патологии у пациентов, достигших 18 месяцев корригированного возраста: грубая органическая патология ЦНС у детей группы I зафиксирована значительно чаще — 14 (46,7) против 5 (16,7%) в группе II (р < 0,05); негрубые резидуальные проявления перинатальной патологии ЦНС отмечены у 15 (50,0%) детей группы сравнения и у 13 (43,3%) младенцев основной группы (р >0,05), условно здоровыми признаны 10 (33,3%) пациентов группы II и только 3 (10,0%) ребенка группы I (р < 0,05).
Заключение. Дети из монохориальных диамниотических двоен, перенесшие СФФТ, составляют группу риска нарушения темпов миелинизации проводящих путей в 18 месяцев корригированного возраста. Определена прогностическая значимость СФФТ и темповой задержки созревания проводящих путей кортикоспинального тракта и задней таламической лучистости, доказана необходимость динамического контроля процесса миелинизации проводящих путей головного мозга у детей из группы риска.
Вклад авторов: Павличенко М.В. — разработка концепции и дизайна исследования, сбор и обработка материала, написание текста рукописи, ответственность за целостность всех частей статьи; Косовцова Н.В. — разработка концепции и дизайна исследования, редактирование рукописи, утверждение окончательного варианта статьи; Зырянов М.Н., Липацев Ю.А. — проведение магнитно-резонансной трактографии, интерпретация результатов; Маркова Т.В. — статистическая обработка материала, выполнение работы по систематизации материала; Поспелова Я.Ю. — сбор литературных данных, выполнение работы по систематизации материала.
Конфликт интересов: авторы заявляют об отсутствии возможных конфликтов интересов.
Широкое внедрение в практику ВРТ, успехи преодоления бесплодия привели к повышению частоты монохориального многоплодия [1–3] . При данном виде многоплодия велика вероятность возникновения осложнений у женщины, плодов, новорожденных и детей раннего возраста [4–6] . Высокие заболеваемость и смертность детей из монохориальных диамниотических двоен обусловлены особенностями ангиоархитектуры монохориальной плаценты. Морфологической основой развития трансфузионного синдрома является функционирование плацентарных анастомозов [7–9] .
Современные возможности фетальной хирургии повышают вероятность сохранения жизни обоих плодов, однако вопрос о влиянии преодоленного трансфузионного синдрома на здоровье ребенка нуждается в дополнительном изучении и уточнении [10, 11] . Поскольку у недоношенных детей из монохориальных диамниотических двоен наиболее высок уровень инвалидности по нервно-психическим заболеваниям [12, 13] , целью нашей работы стала оптимизация обследования детей из монохориальных диамниотических двоен в раннем возрасте в зависимости от того, перенесли ли они синдром фето-фетальной трансфузии (СФФТ).
МАТЕРИАЛЫ И МЕТОДЫ
Проведено наблюдение за развитием недоношенных детей из монохориальных диамниотических двоен от рождения до достижения возраста 18 месяцев с проведением магнитно-резонансной трактографии.
- гестационный возраст 26 недель 0–6 суток — 32 недели 0–6 суток;
- монохориальная диамниотическая беременность;
- родители — жители Екатеринбурга и Свердловской области;
- принадлежность пациентов к славянской этнической группе.
Для всех пациентов родителями оформлялось информированное согласие на включение в исследование.
- дети из дихориальных диамниотических двоен;
- дети из троен;
- наличие серьезных врожденных пороков развития, не связанных с СФФТ (врожденных пороков сердца и ЖКТ);
- выявление наследственных (генетических) заболеваний у детей.
- отказ родителей на очередном этапе от последующего наблюдения;
- переезд семьи в другой регион России или за границу.
В исследование включены 60 недоношенных новорожденных из монохориальных диамниотических двоен. Основную группу (группу I) составили 30 пациентов, перенесших СФФТ и его внутриутробную хирургическую коррекцию методом лазерной коагуляции плацентарных анастомозов в сроке 22–24 недели гестации. В группу сравнения (группу II) вошли 30 детей, у которых СФФТ не было.
Наблюдаемые дети родились в 2019–2020 гг. в ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России (директор — д. м. н. Галина Борисовна Мальгина). Все они выхаживались в стационаре второго этапа указанной медицинской организации и до достижения конечной точки наблюдения (18 месяцев постменструального возраста, ПМВ) в декретированные сроки госпитализировались в стационар отделения детской реабилитации для дообследования и проведения лечебных мероприятий.
Промежуточные контрольные точки — сроки катамнестического (проспективного) наблюдения:
1-я точка — рождение (26 нед 0–6 суток — 32 нед 0–6 суток, гестационный возраст равен ПМВ);
2-я точка — 6 мес корригированного возраста (64 нед ПМВ);
3-я точка — 12 мес корригированного возраста (88 нед ПМВ);
4-я точка — 18 мес корригированного возраста (112 нед ПМВ).
- осмотр и физикальное обследование;
- общеклинические лабораторные исследования;
- инструментальные исследования (нейросонография с ультразвуковой доплерометрией, электроэнцефалограмма-видеомониторинг, МРТ головного мозга с МР-трактографией).
Диффузионно-тензорную МРТ с трактографией (МР-трактографию) проводили на томографе Signa HDxt 1.5Т (General Electric, США) с индукцией магнитного поля 1,5 Тл. Исследование включало 2D BRAVO Т1 последовательность (TR/ТЕ — 8,4/3,1 мс, толщина среза — 1,2 мм, непрерывно, FOV — 24 × 24 см, матрица — 200 × 200, аксиальная плоскость), Т2 FLAIR (TR/ТЕ — 9002,0/135,6 мс, толщина среза — 4 мм, непрерывно, FOV — 24 × 24 см, матрица — 288 × 56, аксиальная плоскость). Диффузионно-тензорные изображения были получены с использованием следующих параметров: TR/ТЕ — 9000,0/94,9 мс, матрица — 96 × 96; толщина среза — 2,5 мм, непрерывно, максимальный коэффициент диффузии (b-value) — 1000 с/мм 2 , без наркоза и седации, в период естественного дневного сна.
Полученные данные обрабатывались на рабочей станции AW версии 4.3, где проводили измерения среднего коэффициента диффузии (average diffusion coefficient, ADC) и фракционной анизотропии (fractional anisotropy, FА) в выделенных симметричных областях (region of interest, ROI) с использованием инструментов программного обеспечения Functools рабочей станции AW версии 4.3. Проводилась трехмерная реконструкция проводящих путей головного мозга. Результаты оценивались совместно со специалистами отделения биофизических и лучевых методов исследований.
Для оценки моторных и сенсорных путей исследовали кортикоспинальный тракт и заднюю таламическую лучистость. Кортикоспинальный тракт оценивали на уровне передней ножки, задней ножки и колена внутренней капсулы. Для оценки комиссуральных межполушарных волокон проводили измерения мозолистого тела на следующих уровнях: колено мозолистого тела, средняя и задняя треть ствола, а также валик мозолистого тела. Для каждой исследуемой анатомической структуры выделялись области интереса (ROI). Количество пикселей соответствовало размерам анатомической области на данном срезе. Для основной группы и группы сравнения показатели FA и ADC были получены в аналогичных анатомических структурах.
Возрастные периоды выбраны с учетом стадий миелинизации по R.B. Dietrich (1988): младенческая стадия — до 6 мес, переходная стадия — 8–12 мес, ранняя взрослая стадия — 10–31 мес жизни.
Восстановительное лечение (абилитация) всех пациентов включало:
- нейропротекторы и противосудорожные средства по индивидуальным показаниям;
- кинезиотерапию (лечебную физкультуру, массаж, тактильно-кинестетическую стимуляцию);
- гидротерапию;
- иглорефлексотерапию;
- физиотерапию — токолечение, теплолечение, сухую иммерсию;
- семейно-ориентированное психологическое сопровождение (работу с перинатальным психологом).
В качестве основных исходов сочетанной перинатальной патологии у детей в обеих когортах фиксировалась частота:
- грубых органических поражений ЦНС, таких как детский церебральный паралич, судорожный синдром, выраженная задержка психомоторного развития;
- негрубых резидуальных (функциональных) нарушений — темповой задержки психомоторного развития, вегето-висцеральных нарушений.
В связи с ограниченным контингентом больных и небольшой длительностью наблюдения гендерные различия не фиксировали.
Этическая экспертиза осуществлена в соответствии с процедурой комплексной экспертной оценки полного конкурсного цикла Российского фонда фундаментальных исследований, предусмотренной для исследования по данному направлению.
За время наблюдения нежелательных явлений не было. Все пациенты перенесли исследование удовлетворительно.
Обработка цифрового материала выполнена с использованием пакета компьютерной программы Statistica 10.0 for Windows ХР, BioStat в соответствии с общепринятыми методами медицинской статистики. Количественные данные (FA и ADC) представлены в формате медианы (Me) и стандартного отклонения (m). Рассчитывали также непараметрические показатели: χ 2 , критерий Фишера, отношения рисков. Различия считали статистически значимыми при р ≤ 0,05.
В настоящее время диффузионно-тензорная МРТ с трактографией (МР-трактография) прочно вошла в клиническую практику, с ее помощью совершенствуются подходы к диагностике заболеваний в детской неврологии благодаря уникальным возможностям клинико-нейровизуализационных сопоставлений. Трактография головного мозга — диагностический метод, основанный на диффузионно-тензорной МРТ (МР-трактографии), позволяющий визуализировать ориентацию и целостность проводящих путей головного мозга in vivo. Еще несколько лет назад трактография была предметом научных исследований, в настоящее время этот метод становится доступным [14, 15] .
При оценке тяжести перинатальных энцефалопатий у наблюдаемых детей из монохориальных диамниотических двоен мы учитывали следующие показатели: оценку по шкале Апгар, тяжесть состояния при рождении, неврологические синдромы в постнатальном периоде, характер патологических изменений по данным нейросонографии, результаты доплерометрии.
Таблица 1
Частота диагностированных перинатальных энцефалопатий у пациентов
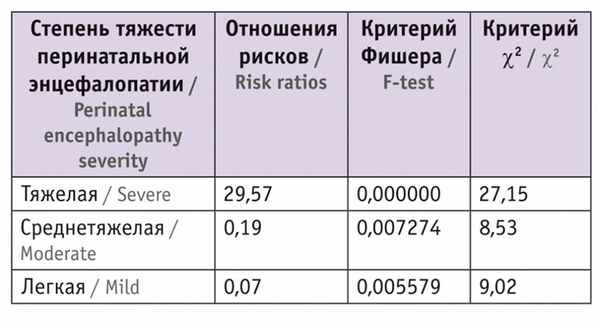
СФФТ вызывает развитие гемодинамических нарушений у плодов, что может спровоцировать гибель нейронов, снижение как общего числа нейронов, так и количества правильно миелинизированных аксонов. С целью диагностики целостности и направления проводящих каналов головного мозга у изучаемых детей была проведена диффузионно-тензорная МРТ с трактографией в возрасте 6, 12, 18 месяцев корригированного возраста ( табл. 2–4 ).
Таблица 2
Показатели магнитно-резонансной трактографии у младенцев в 6 месяцев корригированного возраста
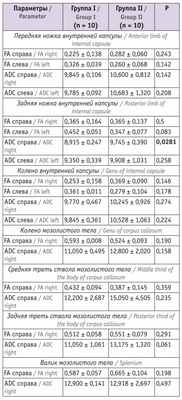
Примечание. Здесь и в таблицах 3, 4: ADC — средний коэффициент диффузии (average diffusion coefficient) (единица измерения — –10 3 мм/с), FА — коэффициент фракционной анизотропии (fractional anisotropy).
Таблица 3
Показатели магнитно-резонансной трактографии у младенцев в 12 месяцев корригированного возраста
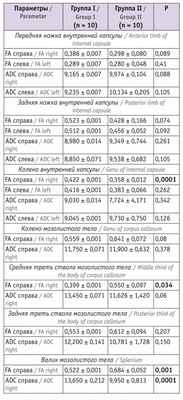
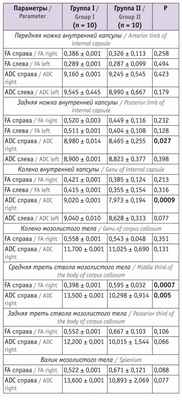
Таблица 4
Показатели магнитно-резонансной трактографии у младенцев в 18 месяцев корригированного возраста
Согласно представленным в таблице 2 данным, исследуемые показатели у детей групп I и II значимо не различались, кроме показателя ADC справа задней ножки внутренней капсулы. У детей в возрасте 12 мес значимые различия в изучаемых параметрах выявлялись чаще (см. табл. 3 ).
При анализе изучаемых показателей в возрасте 12 месяцев у младенцев, перенесших СФФТ, отмечались значимые снижение показателя FA в средней трети ствола мозолистого тела и валике мозолистого тела справа, повышение значения ADC в валике мозолистого тела справа. Выявлена тенденция к повышению FA у детей основной группы в изучаемых параметрах внутренней капсулы, значимо более высокий показатель FA справа зафиксирован в колене внутренней капсулы. Значения ADC в колене, передней и задней ножках внутренней капсулы в основной группе и группе сравнения существенно не различались.
В возрасте 18 месяцев корригированного возраста значения FA справа средней трети ствола мозолистого тела у пациентов, перенесших СФФТ, были значимо ниже, чем в группе сравнения. Показатели ADC справа задней ножки и колена внутренней капсулы, а также средней трети ствола мозолистого тела были существенно выше в группе I, чем в группе II.
Структура исходов перинатальной патологии у пациентов, достигших 18 месяцев корригированного возраста: грубая органическая патология ЦНС у детей группы I зафиксирована значительно чаще — 14 (46,7) против 5 (16,7%) в группе II (р < 0,05); негрубые резидуальные проявления перинатальной патологии ЦНС отмечены у 15 (50,0%) детей группы сравнения и у 13 (43,3%) младенцев основной группы (р >0,05), условно здоровыми признаны 10 (33,3%) пациентов группы II и только 3 (10,0%) ребенка группы I (р < 0,05). Случаев оформления инвалидности по неврологической патологии не было.
Проведенный нами анализ подтверждает значимость базового критерия — задержки темпов миелинизации кортикоспинального тракта и задней таламической лучистости у недоношенных детей из монохориальных диамниотических двоен, перенесших СФФТ, в определении прогноза развития отсроченных неврологических нарушений, особенно грубой органической патологии ЦНС. Полученные значимые различия при относительно небольшой численности наших когорт и ограниченном сроке исследования свидетельствуют о том, что требуется дальнейшее изучение состояния здоровья недоношенных детей, перенесших СФФТ.
В настоящее время все больше возрастает необходимость в неинвазивном бесконтактном получении информации о характере регионарных и очаговых процессов, происходящих в головном мозге ребенка, как на диагностическом этапе, так и в процессе лечения заболеваний ЦНС у детей различных возрастных групп. В этом отношении новые перспективы открывает метод МР-трактографии [16, 17] . МР-трактография мозга у детей в различные возрастные периоды обладает рядом особенностей. У новорожденных реконструкция проводящих путей затруднена из-за малонаправленного характера диффузии на фоне незавершенной сформированности. Тяжелое состояние новорожденного ребенка, ИВЛ могут стать препятствиями для проведения данной диагностической процедуры. Малые размеры головного мозга требуют использования уменьшенной величины вокселя, что снижает интенсивность получаемых сигналов и затрудняет реконструкцию трактограмм [18, 19] .
Процесс миелинизации мозга (увеличение содержания липидов и уменьшение содержания воды в оболочках нервных путей) начинается на пятом месяце внутриутробного развития и продолжается активно до 2 лет. В этом возрасте миелинизация мозга является ключевым компонентом неврологического развития, она коррелирует с увеличением сенсорных, моторных и когнитивных способностей, тесно связана с неврологической функциональной зрелостью [20] .
Недоношенные новорожденные из монохориальных диамниотических двоен, перенесшие синдром фето-фетальной трансфузии (СФФТ), составляют группу риска нарушения миелинизации проводящих путей, по результатам магнитно-резонансной трактографии. Определена прогностическая значимость СФФТ и темповой задержки созревания кортикоспинального тракта и задней таламической лучистости, доказана необходимость динамического контроля за процессом миелинизации у детей из группы риска. Ранняя диагностика повреждения, своевременный подбор абилитационной и реабилитационной терапии повышают шансы успешного лечения и благоприятных отдаленных исходов у недоношенных детей из монохориальных диамниотических двоен. Предполагается продолжить медицинское сопровождение семей недоношенных детей из монохориальных диамниотических двоен, перенесших СФФТ, с целью этапной коррекции неврологических нарушений и улучшений показателей здоровья и психомоторного развития.
Отделение фетальной хирургии
ЦПСиР, являясь ведущим акушерским стационаром города, в течение 20 лет оказывает специализированную помощь пациенткам с иммуноконфликтной беременностью.
В составе ЦПСиР имеется консультативно – диагностическое отделение, где ведут прием высококвалифицированные врачи акушеры - гинекологи, к которым из женских консультаций города Москвы, Московской области, а также различных регионов страны направляются беременные с резус-сенсибилизацией. У большинства из этих пациенток развивается гемолитическая болезнь плода (ГБП). Диагностика гемолитической болезни плода основывается на результатах комплексного обследования состояния матери и плода, которое включает изучение анамнеза, определение титра резус-антител, эхографию с фето-и и плацентометрию, исследование сердечной деятельности и биофизического профиля плода (БФПП), околоплодных вод, крови плода, полученной с помощью кордоцентеза. Тактика ведения беременности при иммунологической несовместимости крови матери и плода направлена на раннюю диагностику ГБП, выявление степени сенсибилизации, проведение лечебных мероприятий и определение оптимальных сроков родоразрешения.

Коноплянников Александр Георгиевич
Главный акушер - гинеколог города Москвы. Доктор медицинских наук, профессор кафедры акушерства и гинекологии РНИМУ им. Н.И. Пирогова, врач высшей категории
Кордоцентез
Обследование беременных с указанной акушерской патологией в ЦПСиР целесообразно начинать с 20 недель гестации. Однако, пациенткам с отягощенным акушерским анамнезом (антенатальной гибелью детей от гемолитической болезни, рождением детей с тяжелыми формами этого заболевания) необходимо обращаться в центр уже в 18 недель. Именно в этом сроке специалисты центра при ультразвуковом сканировании могут выявить первые признаки гемолитической болезни плода, своевременно поставить диагноз. Однако более точным методом выявления ГБП и определения ее тяжести является исследование крови плода, полученной путем кордоцентеза – пункции пуповины. Эта диагностическая манипуляция производится врачами ЦПСиР в дневном стационаре с 24 недель беременности. Показаниями к кордоцентезу являются наличие ультразвуковых маркеров ГБП, титр антител 1:16 и выше, отягощенный анамнез. Полученную кровь плода исследуют для определения группы крови и резус принадлежности, уровня гемоглобина и гематокрита, эритроцитов и билирубина, кислотно-щелочного равновесия. На основании полученных данных определяется дальнейшая тактика ведения беременности. При резус-отрицательной крови у плода дальнейшее наблюдение за беременной продолжается в амбулаторных условиях как за несенсибилизированной пациенткой и для ее родоразрешения не требуется госпитализация в специализированный стационар. При резус положительной крови плода и наличии данных, свидетельствующих и наличии ГБП, необходимо начинать патогенетическое лечение этого заболевания.
К сожалению, традиционные методы терапии этой патологии (десенсибилизирующая терапия, гемосорбция и плазмоферез, внутривенное введение растворов иммуноглобулинов) являются неэффективными, и их применение часто приводят к потери времени для проведения патогенетического лечения, развитию тяжелых некурабельных форм заболевания. В настоящее время единственным эффективным методом лечения тяжелых форм гемолитической болезни плода является операция внутриутробного переливания крови, которое с успехом в течение многих лет производят специалисты ЦПСиР. Для проведения этой операции беременную госпитализируют в отделение патологии центра. Целью данной манипуляции является повышение уровня гематокрита, снижение риска развития отечной формы ГБП, дальнейшее пролонгирование беременности на 2 -3 недели (время функционирования введенных эритроцитов). Показаниями к внутриутробному переливанию крови плоду является снижение в пуповинной крови показателей гемоглобина и гематокрита на 15% и более по сравнению с гестационной нормой. Нередко указанную манипуляцию проводят несколько раз на протяжении беременности. Необходимость повторных переливаний крови плоду определяется сроком беременности и уровнем посттрансфузионного гематокрита, поскольку при ГБП скорость снижения гематокрита составляет в среднем 1% в сутки. Внутриутробные переливания крови допустимо проводить до 32 недель беременности. После этого срока решается вопрос о досрочном родоразрешении.
В ЦПСиР накоплен большой опыт проведения данной операций: ежегодно в центре проводится от 70 до 80 внутриутробных переливаний крови. Этот метод лечения гемолитической болезни является уникальным и в городе Москве производится только специалистами ЦПСиР.
Преждевременные роды – это проблема, которая часто сопровождает иммуноконфликтную беременность. В структуре ЦПСиР важное место занимает детская реанимация, располагающая возможностью выхаживать не только детей с эсктримально низкой массой тела, но и недоношенных детей с тяжелыми формами гемолитической болезни новорожденных. Эти дети получают комплексное лечение ГБ, включающее гематрансфузию в условиях операционной сразу после проведенной их матерям операции кесарева сечения, далее заменное переливания крови в условиях детской реанимации, а также инфузионную и фототерапию.
Алгоритм обследования и лечения пациенток и резус сенсибилизацией, разработанный и внедренный в ЦПСиР, позволил снизить перинатальные потери в 1,5 раза, сократить число преждевременно родившихся детей, количество детей с тяжелыми формами гемолитической болезни, уменьшить частоту и кратность применения заменного переливания крови у новорожденных с ГБ, а также позволил добиться рождения здоровых детей с пациенток с большим количеством перинатальных потерей, обусловленных резус сенсибилизацией и ГБ.
Однако проблема резус сенсибилизации до настоящего времени не является решенной. Врачи консультативно – диагностического отделения ЦПСиР ежедневно принимают новых пациенток, страдающих этой акушерской патологией. Это связано с отсутствием проведения профилактических мероприятий в других лечебных учреждениях, несмотря на то, что меры профилактики всем известны и давно внедрены в практику лечебной работы ЦПСиР.
В ЦПСиР всем пациенткам с резус отрицательной кровью и отсутствием резус-антител в сыворотке крови при сроке гестации 28 недель, при угрозе прерывания беременности, сопровождающейся кровяными выделениями из половых путей, независимо от срока гестации, после инвазивных процедур (биопсия хориона, амниоцентеза, кордоцентеза), самопроизвольного или искусственного прерывания беременности, внематочной беременности, а также после родов резус положительным плодом, вводят антирезус иммуноглобулин.

Бугеренко Андрей Евгеньевич
Кандидат медицинских наук. Доцент кафедры акушерства и гинекологии факультета фундаментальной медицины МГУ
Cиндром фето-фетальной трансфузии
Желанная беременность – радость для будущих родителей. Беременность двойней – двойная радость. Но для акушера это даже не двойные проблемы, а проблемы в квадрате. Особенно это касается монохориальной двойни. Хотя частота таких беременностей невелика, зато помимо проблем, присущих многоплодной беременности как таковой, имеются серьезные осложнения, присущие исключительно монохориальному типу плацентации.
Одним из таких тяжелых осложнений монохориальной двойни является синдром фето-фетальной трансфузии (СФФТ). Возникновение этого осложнения, как правило, заканчивается гибелью обоих плодов до сроков, в которых возможно выхаживание преждевременно родившихся детей.
Cиндром фето-фетальной трансфузии, известный также как фето-фетальный трансфузионный синдром ( twin-to-twin transfusion syndrome, TTTS) возникает в связи с наличием сосудистых плацентарных анастомозов, соединяющих кровеносные системы плодов между собой. Частота возникновения СФФТ по данным разных авторов колеблется от 5 до 25% от числа беременностей с монохориальным типом плацентации. Дисбаланс обмена крови по анастомозам приводит к оттоку крови от одного близнеца (донора) к другому (реципиенту). Это тяжелая патология, при которой вероятность интранатальной гибели плодов достигает 80-100%.
СФФТ впервые в 1882 году описал немецкий акушер Friedrich Schatz. Но несмотря на такую длительную историю, для подавляющего большинства врачей поликлинического звена здравоохранения как диагностика, так и тактика ведения пациенток с проявлениями СФФТ является "terra incognita", что приводит в результате к неблагоприятному завершению беременности.
Кратко о патогенезе развития СФФТ:
Дисбаланс обмена крови по анастомозам приводит к оттоку крови от одного близнеца (донора) к другому (реципиенту). У близнеца-донора развивается гипоксия (вследствие недостаточности плацентарного кровообращения), гиповолемия со снижением артериального давления. Вследствие этих факторов задерживается внутриутробное развитие, снижается объем околоплодных вод, и часто развивается выраженная анемия с уровнем гемоглобина менее 80 г/л. Наиболее частым следствием тяжелой антенатальной гипоксии является формирование, так называемой, скрытой сердечной недостаточности, когда показатели ударного и минутного объемов кровообращения существенно не меняются, но ряд индексов диастолической функции свидетельствуют о поражении миокарда плода. Плод-реципиент, напротив, получает слишком много крови, у него развивается гиперволемия, что увеличивает пред- и постнагрузку на сердце, это может привести в дальнейшем к сердечной недостаточности. В условиях гиперволемии у плода-реципиента появляются отёки, повышается артериальное давление, развивается гипертрофия миокарда. Организм плода в ответ на увеличение объема циркулирующей крови (ОЦК) выделяет избыточное количество воды через органы мочевыводящей системы, что приводит к выраженному многоводию. Из-за высокого содержания в крови эритроцитов появляется высокий риск развития тромбозов. Полицитемия у близнеца-реципиента обуславливает повышенный гематокрит, составляющий 60% и более или уровень гемоглобина выше 220 г/л в любой момент на первой неделе жизни новорожденного. Близнецу с полицитемией угрожают расстройства дыхания, сердечной деятельности, поражение центральной нервной системы.
При внутриутробной гибели одного плода при СФФТ с вероятностью 25% существует риск развития осложнений другого плода. Подобные осложнения в виде некрозов головного мозга и паренхиматозных органов считаются следствием острой ишемии и гипотензии, возникающими из-за шунтирования крови от живого плода умирающему. Перинатальная смертность плода-реципиента после смерти плода-донора составляет около 50% при сроке беременности до 34.
Для своевременной диагностики СФФТ необходимо прежде всего правильно определить тип плацентации на ранних сроках беременности, когда это не представляет трудности. Наличие Т-признака (в отличие от λ-признака при бихориальной беременности) является поводом для пристального УЗ-мониторирования данной беременности в сроки манифестации СФФТ (с 14 недель). Характерными ультразвуковыми признаками развития СФФТ являются: нарастающее многоводие в амниотической полости реципиента, определяющееся как вертикальный размер наибольшего водного кармана от 8 см и более до 20 недель гестации, и превышающий 10 см с 20 по 26 неделю; для донора характерно олигоурическое маловодие или агидрамнион и отсутствие эхо-тени мочевого пузыря. Могут возникнуть трудности в дифференциальной диагностике СФФТ с другим серьезным осложнением монохориальной двойни - синдромом изолированной задержки роста плода (иЗРП), но это уже является прерогативой специализированного акушерско-гинекологического стационара.
Единственным патогенетически оправданным методом лечения СФФТ является фетоскопическая лазерная коагуляция анастомозов (ФЛКА). Методика заключается в фетоскопическом (через оптическую систему малого диаметра) трансабдоминальном введении лазерного световода в амниотическую полость плода-реципиента под контролем УЗИ. Эндоскопическая лазерная коагуляция позволяет осуществлять обследование плаценты вдоль всей межплодовой перегородки, выявить и произвести коагуляцию анастомозирующих сосудов. Таким образом, поступление крови от одного близнеца другому прекращается, баланс поступления крови к обоим плодам восстанавливается, и близнецы в дальнейшем развиваются нормально. Операция заканчивается дренированием околоплодных вод до нормализации их количества. Эффективность эндоскопической лазеркоагуляционной терапии СФФТ (рождение хотя бы одного живого ребёнка) составляет от 80 до 90 %, возможно пролонгирование беременности в среднем на 10-12 недель, что приводит к снижению внутриутробной гибели плодов.
В Центре планирования семьи и репродукции ДЗ Москвы фетоскопические операции проводятся с 2005 года, на данный момент выполнено более 100 вмешательств. Наличие специального оборудования позволяет проводить ФЛКА в сроки беременности от 15 до 25 недель при стадии ФФТС вплоть до 4.
Вмешательство мы проводим под регионарной анестезией. Тщательно осматриваются плоды, амниотическая перегородка и особенно пересекающие её сосуды на плодовой поверхности плаценты. Такие сосуды прослеживаются до их концевых ветвей, которые, собственно, и могут соединятся с аналогичными ветвями со стороны второго плода. Оценивается не только количество, но и характер, а самое главное – диаметр анастомозов. Это очень важно для правильного порядка коагуляции. Сначала «перекрывается» кровоток в крупных артерио-венозных и артерио-артериальных анастомозах. Затем – коагулируются более мелкие и мельчайшие анастомозы. За время операции по ним часть крови возвращается к донору, улучшая его прогноз.
При правильно и без осложнений выполненной лазерной коагуляции анастомозов прогноз благоприятный у подавляющего количества пациенток. В настоящее время эффективность наших фетоскопических операций аналогична данным мировой литературы (благоприятный исход беременности в 80-85% наблюдений).
Фето-фетальный трансфузионный синдром
Фето-фетальный трансфузионный синдром
МКБ-10 коды
Описание
Фето. Фетальный трансфузионный синдром (ФФТС) - тяжелое осложнение многоплодной монохориальной беременности, при которой из - за анастомозов в сосудистой сети плаценты возникает дисбаланс кровотока у плодов. Проявлениями служит диспропорциональность развития близнецов, многоводие в пузыре «рецепиента» при маловодии у «донора», ряд серьезных пороков развития обоих плодов, их внутриутробная гибель. Диагностика производится на основании картины ультразвуковых исследований, эхокардиографии и допплерографии, выполняемых обычно во второй половине беременности. Для сохранения беременности осуществляют лазеркоагуляцию плацентарных анастомозов, периодическое амниодренирование, окклюзию пуповины более пострадавшего плода для сохранения другого.
Фето-фетальный трансфузионный синдром
Дополнительные факты
Синдром фето-фетальной трансфузии встречается исключительно при монозиготной двойне (крайне редко - тройне), когда близнецы объединены общим хорионом. Официальная статистика свидетельствует, что это осложнение возникает у 17,5% женщин, беременность которых носит монохориальных характер. Ряд исследователей полагает, что встречаемость синдрома значительно выше, однако часто он приводит к самопроизвольному аборту на ранних сроках вынашивания ребенка («скрытая смертность»). Уровень перинатальной смертности при ФФТС высокий и в некоторых регионах достигает 65-100%, примерно 12-15% всех случаев внутриутробной гибели при многоплодной беременности обусловлено этим состоянием.
Причины
Морфологической предпосылкой для развития фето-фетального трансфузионного синдрома является наличие в хорионе анастомозов между сосудистыми сетями обоих плодов. При монохориальной беременности они выявляются в 60-90% и могут быть поверхностными и глубокими. Поверхностные вено-венозные и артерио-артериальные анастомозы способны транспортировать кровь в обоих направлениях (в зависимости от давления) и выравнивают объемы крови между близнецами. Строение глубоких анастомозов таково, что артериальная кровь, поступающая в котиледон плаценты из системы одного ребенка, переходит в венозную сеть другого. Предполагается, что превалирование количества глубоких сосудистых соединений в хорионе над числом поверхностных и становится причиной появления синдрома.
Факторы, приводящие к возникновению большего количества глубоких анастомозов, на сегодняшний момент неизвестны. Предполагается, что они возникают из-за патологии формирования плаценты «донора», в результате чего сосудистое сопротивление в ней растет, и формируются шунты, связывающие его с сосудами «реципиента». Обсуждается возможность влияния позднего разделения близнецов, тератогенных факторов, недостаточного кровоснабжения матки женщины. Выяснение точных причин ФФТС осложняется поздней диагностикой этого состояния и непредсказуемостью его появления.
Патогенез
Считается, что возникновение фето-фетального трансфузионного синдрома может произойти на разных сроках вынашивания, причем позднее возникновение осложнения благоприятней в прогностическом отношении. Иная точка зрения заключается в том, что предпосылки для ФФТС возникают еще на этапе разделения плодов (4-12 дни гестации), а выраженность и срок появления дальнейших нарушений зависит от количества глубоких анастомозов и степени дисбаланса кровообращения близнецов. Первоначально возникает простой переток крови от «донора» к «реципиенту», который не отражается на скорости развития и других характеристиках обоих плодов.
Уменьшение объема циркулирующей крови у близнеца-донора постепенно приводит к явлениям плацентарной недостаточности – внутриутробной гипоксии, задержке развития. Нарушается работа почек и снижается выделение мочи, что становится причиной уменьшения объемов мочевого пузыря и появления маловодия. Последний фактор оказывает влияние на скорость развития тканей легких, замедляя формирование дыхательной системы. При отсутствии лечения происходит внутриутробная гибель плода по причине гипоксии и тяжелого недоразвития основных органов и систем.
Близнец-реципиент при этом испытывает значительный прилив крови, уровень его ОЦК увеличивается, что повышает нагрузку на сердечно-сосудистую систему и почки. Это приводит к гипертрофии правых отделов сердца, общей кардиомегалии, внутриутробной недостаточности трехстворчатого клапана. Объем мочевого пузыря увеличивается, возникает многоводие. Изменение объема околоплодных вод у близнецов может быть незаметно в случае общего плодного пузыря (монохориальная моноамниотическая беременность). Внутриутробная или интранатальная смерть «реципиента» при отсутствии лечения наступает из-за пороков сердца и почек.
Классификация
Выделяют несколько степеней развития фето-фетального трансфузионного синдрома, основываясь на тяжести состояния плодов и разнице их основных показателей (КТР, объем околоплодных вод). По мере прогрессирования ФФТС нарушения беременности нарастают таким образом, что каждая стадия включает в себя патологии всех предыдущих этапов заболевания. Современная классификация выделяет пять стадий развития синдрома:
• 1 стадия. Ультразвуковыми исследованиями регистрируется только разница в объеме околоплодных вод между близнецом-донором (маловодие) и реципиентом (многоводие). Ранним следствием этого служит появление складок амниотической перегородки, что регистрируется уже на 11-17 неделе гестации (наиболее ранний признак ФФТС). В случае моноамниотической беременности 1-я стадия может не определяться.
• 2 стадия. На фоне разницы в объемах околоплодных вод у плода-донора не определяется наполнение мочевого пузыря, диагностируется его заметное отставание в развитии (КРТ и масса меньше более чем на 20%, нежели у «реципиента»). У последнего визуализируется значительный по объему и эхогенности мочевой пузырь.
• 3 стадия. Возникают прогрессирующие нарушения сердечно-сосудистой системы у обоих плодов, что проявляется изменением допплерометрической и эхокардиографической картины. У реципиента возникает кардиомегалия, недостаточность трехстворчатого клапана, расширение легочного ствола.
• 4 стадия. Развиваются признаки водянки плода-реципиента – отек всего тела, увеличение размеров печени, селезенки, накопление жидкости в полостях.
• 5 стадия. Диагностируется при внутриутробной смерти одного или обоих плодов.
Стадийность ФФТС не имеет четкой привязки к сроку беременности – при неблагоприятном и раннем развитии осложнения признаки 1-й стадии могут выявлять на 14-17 неделе. В акушерстве при синдроме считается важной границей срок в 25 недель гестации, так как появление нарушений ранее часто приводит к прерыванию беременности даже при лечении. Нередко принимается решение о сохранении только одного (более жизнеспособного) ребенка, тогда врачебное вмешательство может производиться в ущерб его близнецу.
Клиническая картина
Субъективных проявлений ФФТС не имеет, его обнаруживают при скрининговых ультразвуковых исследованиях. Беременные с такой патологией чаще, чем в норме, имеют гипертонус матки и другие состояния, угрожающие прерыванием вынашивания ребенка. Ряд исследователей допускает, что значительная часть самопроизвольных абортов при многоплодной беременности обусловлена ФФТС до его обнаружения. Осложнения патологии (внутриутробная смерть) могут проявляться болью в животе и груди, профузным маточным кровотечением либо появлением кровянистых выделений из влагалища. На поздних сроках признаком гибели близнецов является прекращение их движений (замирание).
Возможные осложнения
Наиболее тяжелым осложнением синдрома фето-фетальной трансфузии является внутриутробная гибель обоих плодов. Отсутствие лечебных мер приводит к перинатальной смерти в 100% (при развитии ФФТС до 25-ти недель гестации) и в 80-90% - при его более позднем возникновении. Различные методы лечения повышают выживаемость как минимум одного ребенка. К осложнениям состояния также относят риск развития детского церебрального паралича у выживших детей - вероятность такого исхода колеблется от 5 до 20%. Редкими осложнениями является внутриутробная гибель плода с инфицированием или мумификацией трупа.
Диагностика
Обнаружение ФФТС происходит при плановом УЗИ беременной, уже при выявлении монохориальной многоплодной беременности женщина вносится в группу риска. УЗИ-признаки заболевания обнаруживаются после 16-й недели (крайне редко – после 11-12-й), затем для подтверждения диагноза и мониторинга состояния плодов назначают дополнительные методы исследования. С их помощью определяют прогностические перспективы фето-фетального трансфузионного синдрома и собираются данные для возможного лечения.
• УЗ. Скрининг. При ФФТС особенно информативен во втором и третьем триместре. В зависимости от стадии с его помощью при этой патологии выявляют многоводие у реципиента (увеличение глубины наибольшего кармана вод, не соответствующее норме по сроку), увеличение размеров мочевого пузыря, на терминальных этапах – пороки развития органов и водянку (анасарку). У донора посредством УЗИ определяются маловодие (глубина кармана вод не более 20 мм), уменьшение размеров мочевого пузыря.
• Ультразвуковая фетометрия. У близнеца-донора возникает отставание в росте, несоответствие фетометрических показателей (лобно-затылочного размера, окружности головы, живота, грудной клетки, длины трубчатых костей скелета) сроку беременности. Разница в основных параметрах между плодами при ФССТ превышает 20%.
• Допплерометрия плода. Патологические изменения кровотока определяются с 3-й стадии ФФТС. К ним относят разницу систолодиастолического отношения в артериях пуповины плодов свыше 0,4, реверсный конечно-диастолический поток у донора. У плода-реципиента допплерометрия определяет аномальный венозный кровоток в пуповине, увеличение скорости потока крови в легочной артерии.
• Эхокардиография плода. Выявляет поздние проявления ФФТС, которые определяются у близнеца-реципиента. Это гипертрофия правых отделов сердца, кардиомегалия, недостаточность трехстворчатого клапана, уменьшение выброса правого желудочка.
Лечение
Прогноз
Фето-фетальный трансфузионный синдром характеризуется неблагоприятным прогнозом – при отсутствии лечения и регулярного наблюдения у акушера-гинеколога это состояние практически всегда приводит к гибели плодов и самопроизвольному прерыванию беременности. Результативность хирургического вмешательства зависит от многих факторов: стадии развития ФФТС, срока беременности, наличия или отсутствия сопутствующих патологий у женщины. Довольно часто лечебные меры приходится производить в ущерб более пострадавшему ребенку для сохранения другого. Профилактика развития синдрома не разработана, так как неизвестны причины его возникновения.
Читайте также:
