Мутации гонадотропиновых генов. Мутации субъединиц ЛГ и ФСГ
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Для цитирования: Абляева Э.Ш. Индукция суперовуляции в программах вспомогательных репродуктивных технологий у женщин старшего репродуктивного возраста. Влияние экзогенного лютеинизирующего гормона на результативность программ вспомогательных репродуктивных технологий. РМЖ. Мать и дитя. 2015;23(14):821.
Клинические особенности пациенток старшей возрастной группы
В репродуктивной медицине к пациенткам старшего репродуктивного возраста принято относить женщин старше 35 лет. Каждый год Европейская ассоциация репродукции человека и эмбриологии (ESHRE) и Российская ассоциация репродукции человека (РАРЧ) публикуют свои отчеты по количеству проведенных программ вспомогательных репродуктивных технологий (ВРТ), показателям наступления беременности и другим по различным странам и регионам в соответствии с принятым ESHRE делением по возрастам — до 34, 35–39 и более 40 лет. В нашей стране, согласно отчетам РАРЧ за , число пациенток старшего репродуктивного возраста, участвовавших в программах ВРТ, колеблется: в стандартной программе экстракорпорального оплодотворения (ЭКО) — в интервале от 31,6 до 42,9%; в программах с использованием метода интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ) — от 40,4 до 45,9% [1].
Как видно из приведенных данных, доля пациенток старшего и позднего репродуктивного возраста в программах ЭКО/ИКСИ составляет более 1/3 [1], при этом половина из них — женщины старше 40 лет [1, 2]. Они составляют значительную часть пациенток с неэффективными исходами программ ВРТ. В старшей возрастной группе показатели наступления беременности достоверно ниже, чем у женщин моложе 35 лет, а также у женщин с хорошим ответом яичников [1–3, 6]. У этой категории отмечаются уменьшение способности к зачатию в расчете на один менструальный цикл (МЦ), снижение эффективности программ ВРТ. Частота рождения живого ребенка у пациенток с субоптимальным ответом на стимуляцию суперовуляции ниже, чем у больных с хорошим ответом [7, 8]. Деление по возрастам пациенток с бесплодием в программах ВРТ имеет свои обоснования в связи с постепенной утратой женщинами фолликулярного (овариального) резерва.
Фолликулярный резерв отражает способность яичников отвечать на стимуляцию ростом фолликулов, содержащих яйцеклетки. В процессе старения репродуктивный потенциал женщины снижается как за счет истощения запаса фолликулов в яичниках, так и ухудшения качества яйцеклеток. С момента рождения у девочки в результате запрограммированного апоптоза начинается массовая атрезия фолликулов, заложенных в яичниках во внутриутробном периоде, которая продолжается вплоть до наступления менопаузы. Пик потери фолликулярного резерва приходится на возраст 37–38 лет с известными колебаниями. Таким образом, происходит возрастное снижение фолликулярного резерва. Существуют многочисленные исследования, посвященные изучению различных показателей для оценки фолликулярного резерва и прогнозирования ответа яичников на стимуляцию: возраст, длительность МЦ, количество антральных фолликулов, объем яичников, уровень в крови фолликулостимулирующего гормона (ФСГ), ингибина В, тестостерона [9–12].
В практической деятельности фолликулярный резерв оценивается прежде всего по эхографическим данным: количеству антральных фолликулов в яичниках и биохимическому показателю — уровню антимюллерова гормона (АМГ) в периферической крови. Считается, что АМГ может быть лучшим предиктором овариального ответа, чем такие показатели, как возраст, уровень ФСГ, эстрадиол, ингибин [4, 9, 10].
Безусловно, врач должен учитывать возраст и анамнез пациентки: наличие операций на яичниках и матке, исходы предыдущих программ ВРТ, еще до осмотра пациентки врача должны насторожить сведения об укорочении МЦ на 2–3 дня в течение последних нескольких месяцев. Пороговое значение уровня АМГ, по которому можно прогнозировать нормальный ответ на стимуляцию (>4 фолликулов) с результативностью 98%, — 1,26 нг/мл.
Хороший и «бедный» ответы яичников
Выделяют пациенток с хорошим, нормальным и так называемым «бедным», или плохим, ответом яичников на стимуляцию суперовуляции в циклах ЭКО. Хорошим ответом принято считать образование 5 и более преовуляторных фолликулов на введение стандартных доз ФСГ и агонистов без необходимости повышения дозы гонадотропинов. Для нормального овариального резерва характерны уровни ФСГ не более 10 МЕ/л, ингибина В — не менее 40 пг/мл, АМГ — не менее 1,0 нг/мл, число антральных фолликулов в яичниках — 4–5. «Бедный» (низкий, плохой) ответ — это недостаточная или субоптимальная реакция яичников на введение больших доз (более 300 МЕ/сут) гонадотропинов при стимуляции суперовуляции, при которой не удается обеспечить рост и созревание более 3 фолликулов. Такую реакцию яичников на индукторы овуляции в англоязычной литературе принято обозначать термином «бедный» («poor»), или «низкий» («low»), ответ.
Женщин, имеющих «бедный» ответ яичников, называют poor responder, в русскоязычной профессиональной среде таких пациенток часто называют «бедные ответчики».
По различным оценкам, число женщин с «бедным» ответом на введение препаратов ФСГ составляет около 10–30% [1, 2, 4, 13]. Большинство пациенток poor responder — это женщины старшей возрастной группы.
По данным et al. [13], у 15% пациенток отмечается плохой ответ яичников, характеризующийся ростом менее 5 фолликулов, несмотря на повышение суточной дозы ФСГ до 450 МЕ, еще у 15% женщин отмечается рост более 5 фолликулов, но при этом требуется усиленная и более длительная стимуляция ФСГ для продолжения и завершения роста фолликулов. Таких пациенток авторы выделяют в отдельную группу — медленного ответа на введение ФСГ — «гипоответчиков» [13, 14].
Следует отметить, что у женщин с «бедным» ответом образуется повышенное число анеуплоидных эмбрионов по сравнению с пациентками с нормальным ответом того же возраста; часто встречающиеся анеуплоидии — моносомии и трисомии — указывают на старение яичников [15].
Другими признаками снижения овариального резерва являются уменьшение числа антральных фолликулов и объема яичников, повышение уровня ФСГ, снижение значений ингибина В. К числу пациенток poor responder относятся также женщины с операциями на яичниках и матке. Удаление даже небольших миоматозных узлов, эмболизация маточных артерий по поводу миомы матки, тубэктомии очень часто приводят к снижению фолликулярного резерва яичников.
В силу разнообразных причин (медицинских, социальных) число женщин старшего репродуктивного возраста, особенно в крупных городах, обращающихся в репродуктивные клиники для лечения бесплодия, растет.
Практическим врачам, которые являются своеобразным фильтром для направления пациенток старшей возрастной группы с бесплодием в клинику репродукции, необходимо помнить, что реализация репродуктивной функции женщины ограничена ее фолликулярным резервом. Успех лечения бесплодия во многом определяется способностью яичников отвечать на стимуляцию суперовуляции и, в немалой степени, — грамотной и конструктивной позицией амбулаторной сети.
Согласно теории клеток — гонадотропинов (интегральное взаимодействие лютеинизирующего гормона (ЛГ) и ФСГ в обеспечении оптимального роста фолликула и овуляции), ФСГ вызывает образование антрального фолликула и рост фолликулов, а ЛГ имеет важное значение для преантральной стадии, стимулирует продукцию андрогенов клетками теки фолликулов [16]. Действие ФСГ на гранулезные клетки осуществляется посредством связывания с рецептором ФСГ. Далее, под влиянием стимуляции ФСГ, андрогены преобразуются в эстрогены в гранулезных клетках фолликулов. Приблизительно на день МЦ гранулезные клетки под воздействием ФСГ индуцируют выработку . ЛГ играет критически важную роль в регуляции заключительной стадии созревания яйцеклетки. Таким образом, синергизм между ФСГ и ЛГ необходим для стероидогенеза в яичниках и последующего развития фолликула, овуляции и лютеинизации лидирующего фолликула [17].
Генетический полиморфизм. Роль ЛГ
Реакция яичников на стимуляцию зависит не только от возраста, но и от генетических факторов. Для понимания особенностей ответа яичников на введение гонадотропинов необходимо знание о полиморфизме рецепторов генов ФСГ и ЛГ [18, 19]. ЛГ и ФСГ являются гетеродимерами, состоящими из субъединиц — α и β. Cубъединица α идентична у ЛГ и ФСГ, а β-субъединица определяет специфичность действия каждого из гормонов. Активность гормона проявляется при объединении субъединиц в димер. Рецепторы этих гормонов располагаются в мембранах и по структуре весьма схожи.
Наибольшее количество мутаций, влияющих на функцию гонад, выявлено в генах рецепторов ЛГ и ФСГ. В генах, кодирующих ФСГ и его рецептор, обнаружено несколько мутаций. Более медленный ответ на стимуляцию ФСГ [18] отмечается у пациенток с полиморфизмом гена рецептора к ФСГ. Для гена β-субъединицы ЛГ тоже характерен полиморфизм. Кроме нормального гена обнаружены еще 2 аллельных варианта, наиболее частым вариантом является v-β-ЛГ. В различных этнических группах v-β-ЛГ встречается с различной частотой — от 0 до 52%: к примеру, в Италии — в 12–13%, в Китае — в 14% случаев; считается, что в нормальной популяции встречаемость данного гена составляет около 1% [20]. Короткодействующий вариант v-β-ЛГ обладает меньшей биологической активностью.
С. Alviggi et al. [10] показали, что v-β-ЛГ чаще выявляют у женщин с повышенным потреблением экзогенного рекомбинантного человеческого ФСГ (рФСГ) в программах ВРТ во время стимуляции яичников и небольшим числом полученных яйцеклеток по сравнению с женщинами с нормальным потреблением и ответом на рФСГ. Авторы считают, что субоптимальный ответ яичников на рФСГ можно объяснить меньшей биологической активностью ЛГ [10].
Добавление ЛГ при проведении протоколов овариальной стимуляции
Совершенствование протоколов контролируемой овариальной стимуляции (КОС), особенно с учетом гетерогенности характеристик пациенток, всегда было объектом пристального внимания исследователей. Для улучшения исходов ВРТ у пациенток с «бедным» ответом проводились многочисленные исследования [2–5, 6, 8, 13, 14]. Хотя эффективность монотерапии рчФСГ при использовании ВРТ доказана, опубликованные результаты клинических исследований свидетельствуют о преимуществах дополнительного назначения рекомбинантного ЛГ (рЛГ) пациенткам с недостаточной эффективностью терапии рФСГ [22–27].
Стимуляция только препаратами ФСГ у «бедных ответчиц» приводит к росту небольшого числа фолликулов, недостаточному развитию эндометрия, низкой частоте имплантации и клинической беременности. По данным et al. [13], около 30% пациенток имеют недостаточный ответ на индукцию суперовуляции препаратами ФСГ в длинных протоколах с применением агонистов. Сниженный ответ на ФСГ может быть связан с ятрогенным дефицитом ЛГ, вызванным применением агонистов. Для того чтобы добиться полноценного роста фолликулов у пациенток с «бедным» ответом, как правило, используются более 3000–3500 МЕ ФСГ на цикл. Повышенные дозы ФСГ у таких пациенток обеспечивают достаточную зрелость фолликулов и позволяют получить необходимое число яйцеклеток, готовых к оплодотворению.
et al. [13] выдвинули гипотезу, которая заключается в том, что потребность в повышенных дозах ФСГ служит индивидуальным биологическим маркером, косвенным, но высокоспецифичным, дефицита ЛГ, который нельзя выявить путем измерения уровня ЛГ в крови. Эта гипотеза поддерживается исследованием Р. Humaidan et al. [28]. Авторы показали, что назначение экзогенного ЛГ эффективно у женщин с сывороточной концентрацией ЛГ >1,99 МЕ/л на день КОС, следовательно, наличие менее биоактивного ЛГ может вызывать повышение сывороточных концентраций гормона [27, 28]. Резистентность яичников клинически может проявляться в виде медленного или «бедного» ответа на контролируемую препаратами ФСГ стимуляцию яичников, которая часто встречается у женщин старшего репродуктивного возраста. Добавление экзогенного ЛГ в ходе КОС при нормогонадотропном бесплодии при ЭКО является дискуссионным с момента появления ВРТ. Главный вопрос связан с необходимостью добавления экзогенного ЛГ на уровне финального созревания ооцитов для завершения фолликулогенеза и подготовки эндометрия к имплантации. Интерес к терапии ЛГ объясняется тем, что в современных протоколах стимуляции концентрация эндогенного ЛГ ниже, чем в естественном МЦ. Применение аналогов гонадотропин (ГнРГ), как агонистов, так и антагонистов, вызывает временное, иногда значительное снижение уровня сывороточного ЛГ. У некоторых пациенток содержание эндогенного ЛГ временно становится даже ниже уровня, чем у женщин с гипогонадотропным гипогонадизмом [28, 30–34].
Можно считать доказанным, что добавление ЛГ может повысить чувствительность яичников к ФСГ, индуцировать секрецию эстрадиола преовуляторным фолликулом, улучшая тем самым рост эндометрия; защитить клетки кумулюса от апоптоза, обеспечить ранние этапы оплодотворения, стимулировать позднюю лютеинизацию фолликула и выработку достаточного количества прогестерона. Совершенно бесспорным является назначение препаратов при гипогонадотропном состоянии пациентки [24].
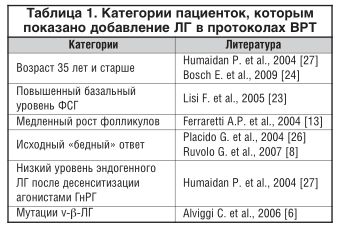
В результате многочисленных исследований были определены другие категории пациенток, нуждающихся в добавлении экзогенного ЛГ в программах ВРТ: старшего репродуктивного возраста, с повышенным базальным уровнем ФСГ, медленным ростом фолликулов, низким овариальным резервом, генетическим полиморфизмом ЛГ (табл. 1).
Поскольку мочевые гонадотропины также содержат в своем составе ЛГ, возникает вопрос относительно выбора гонадотропных препаратов между мочевыми и рекомбинантными для стимуляции суперовуляции в программах ВРТ у пациенток с «бедным» ответом.
В различных исследованиях проводился сравнительный анализ применения мочевых и рекомбинантных гонадотропинов (табл. 2).
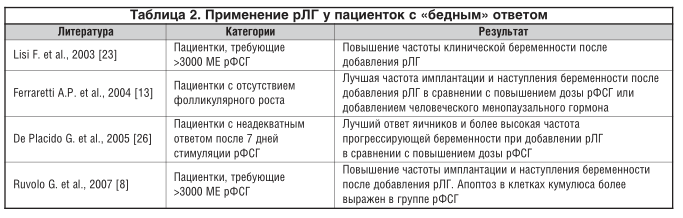
Результаты систематического обзора и метаанализа et al. [34] данных о применении экзогенного рЛГ в программах ВРТ у женщин старшего репродуктивного возраста показали, что добавление рЛГ у этой категории женщин может повышать частоту имплантации и клинической беременности.
Применение перговериса в программах ВРТ
Перговерис — первый препарат, содержащий комбинацию рФСГ и рЛГ, появился в 2007 г. как итог многочисленных лабораторных и клинических исследований, направленных на повышение результативности программ ВРТ у определенных категорий пациенток. Рекомбинантные фоллитропин-α (рФСГ) и лутропин-α 75 (рЛГ) содержатся в препарате в соотношении 2:1 (150 МЕ: 75 МЕ). Исследования биоэквивалентности подтвердили, что фармакокинетические характеристики фоллитропина-α и лутропина-α, вводимые в комбинации, сохраняют те же свойства, что и по отдельности [36]. Оба активных вещества находятся в одной ампуле, не требуют раздельного дозирования и смешивания с растворителем и применяются в виде одной подкожной инъекции. В этом отношении перговерис вполне удобен и эргономичен для пациенток (RESOLVE) [35].
В настоящее время имеется достаточно данных об эффективности и безопасности комбинации рФСГ и рЛГ в соотношении 2:1 в препарате перговерис. Эта комбинация является оптимальной для применения в клинической практике. В 1997 г. Европейской группой по изучению рЛГ проведено базовое исследование по подбору доз, и подтверждена наиболее высокая эффективность стимуляции овуляции при соотношении гонадотропинов ФСГ и ЛГ 2:1 [37]. Исследователи показали, что ежедневное введение 75 ME рЛГ и 150 ME рФСГ эффективно у большинства женщин и обеспечивает оптимальный рост фолликулов и максимальный рост эндометрия. Небольшой части пациенток может потребоваться доза до 225 МЕ/сут, но даже в этой дозе рЛГ не оказывал иммуногенного действия и хорошо переносился [37]. Рекомендуемый режим лечения начинается с назначения 300 ME рФСГ 1 р./сут в течение 5–7 дней. Начиная с дня овариальной стимуляции вместо рФСГ начинают введение ампул препарата перговерис (300 ME рФСГ и 150 ME рЛГ). Возможно назначение ампул перговериса (300 ME рФСГ и 150 ME рЛГ) в 1 сут начиная с первого дня КОС, следующей за десенситизацией гипофиза.
Лечение продолжается до необходимого уровня развития фолликула, определяемого по концентрации эстрогенов в сыворотке крови и результатам УЗИ. При увеличении дозы рФСГ следует иметь в виду, что его суточная доза не должна превышать 450 ME.
В в 29 немецких медицинских центрах ВРТ проводилось наиболее крупное многоцентровое наблюдательное исследование по применению перговериса, 58,7% участниц исследования были старше 35 лет. В этом исследовании частота наступления клинической беременности в расчете на перенос эмбрионов составила 27,5%. В в Испании проводилось другое многоцентровое проспективное наблюдательное исследование, включавшее 19 центров ВРТ с участием пациенток с «бедным» ответом яичников. У всех пациенток стартовая доза перговериса была 300 рФСГ и 150 рЛГ. Частота клинической беременности составила 33,2% в расчете на перенос эмбрионов.
В этих исследованиях была показана достаточно высокая частота наступления клинической беременности у пациенток с субоптимальным ответом яичников на стимуляцию овуляции. K. Buler et al. провели сравнительное исследование эффективности терапии комбинированного применения рФСГ и рЛГ с мочевыми гонадотропинами, имеющими в длинных протоколах с агонистами. Показано, что потребление ФСГ в группе комбинации рФСГ и рЛГ в фиксированном соотношении 2:1 оказалось значительно ниже, а число беременностей на цикл и на перенос, частота имплантации были достоверно и значительно выше, чем в группе мочевых гонадотропинов, имеющих . Чтобы выяснить, наблюдается ли этот эффект в протоколах как с агонистами, так и антагонистами ГнРГ, требуются дополнительные исследования.
Таким образом, можно сделать вывод, что у всех пациенток, которым необходимо экзогенное введение ЛГ, наблюдается положительный эффект, у пациенток старше 35 лет. Применение перговериса для индукции суперовуляции в программах ВРТ у пациенток старше 35 лет с «бедным» ответом и/или низким уровнем ЛГ является высокоэффективным методом лечения бесплодия.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Полиморфизмы генов рецепторов гормонов репродуктивной сферы
Биологический эффект любого гормона на клетку-мишень осуществляется через комплекс гормон-рецептор, то есть, чтобы возник клеточный ответ, необходимо, чтобы гормон вступил в соединение с рецептором. Несмотря на многообразие гормонов и рецепторов в организме человека, все рецепторы делятся на 2 типа — мембранные и внутриклеточные. А функциональные характеристики выражаются либо в способности связываться с гормоном, либо в нарушенной функции проведения сигнала.
Рецепторы гонадотропных гормонов гипоталамуса и гипофиза являются рецепторами клеточной мембраны и представляют из себя G-протеин. Как и все белки в организме они кодируются определенными генами. Полиморфизмы (выражаются в замене однонуклеотидных последовательностей в ДНК), затрагивающие кодирующие части этих генов, нередко приводят к аминокислотным заменам в молекуле белка и появлению белков-рецепторов с искаженными функциональными свойствами.
Ген LHCGR кодирует рецептор лютеинизирующего гормона (ЛГ). Рецепторы ЛГ в организме женщины расположены на тека-лютеиновых клетках яичника, рецепторы играют решающее значение для поддержания теки, созревания фолликулов и овуляции. LHR-опосредованные сигналы играют важную роль в ответе яичников на введение экзогенного ФСГ.
Известно, по крайней мере, 300 полиморфизмов гена LHCGR, которые оказывают значительное влияние на половое развитие и фертильность. Мутации гена рецептора ЛГ бывают двух типов: активирующие и инактивирующие рецептор. Активирующая мутация у мальчиков вызывают преждевременное половое развитие, которое может начинаться в возрасте до 1 года, при другой мутации до 4-х лет. У женщин фенотипическое проявление активирующих мутаций в гене рецептора ЛГ не отмечено.
Инактивирующие мутации (8 мутаций) гена рецептора ЛГ вызывают нарушение проведения сигнала при воздействии ЛГ, либо приводят к уменьшению способности рецептора связываться с ЛГ. Инактивирующие мутации определяют целый спектр клинических проявлений. Самые тяжелые – это вследствие гомозиготного носительства этих мутаций. Проявляются в период дифференцировки мужского пола в эмбриогенезе. Может формироваться мужской псевдогермафродитизм ( нарушен синтез тестостерона тестикулами из-за гипоплазии клеток Лейдига или полного их отсутствия). При мягких формах патологии, в отличие от классического варианта мужского псевдогермафродитизма, формируется гипогонадизм с выраженной гипоплазией наружных половых органов. И здесь очень важна дифференциальная диагностика с гипогонадизмом у мужчин, обусловленным мутацией в другом гене - в гене β-субъединицы ЛГ. У женщин гомозиготное носительство мутантных аллелей гена рецептора ЛГ сопровождается незначительным изменением фенотипа. Но при этом может отмечаться первичная аменорея и бесплодие.
GNRHR - ген рецептора гонадотропин-рилизинг-гормона (ГнРГ, GNRH) расположен на 14 хромосоме (14q21.1). Иследование важно для дифференциальной диагностики таких клинических форм, как идиопатический гипогонадотропный гипогонадизм (ИГГ). Клиническая картина гипогонадотропного гипогонадизма у мужчин характеризуется снижением либидо, отсутствием лицевого оволосения, редким лобковым оволосением, уменьшенной массой яичек. Половое созревание начинается в возрасте 16 лет. У женщин наблюдается первичная аменорея и бесплодие. Наружные гениталии и молочные железы развиты нормально.
Мутации гонадотропиновых генов. Мутации субъединиц ЛГ и ФСГ
МГУ им. М.В. Ломоносова, Москва
МГУ им. М.В. Ломоносова, Москва
МГУ им. М.В. Ломоносова, Москва;
ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
МГУ им. М.В. Ломоносова, Москва
Роль генетических факторов в патогенезе гипогонадотропного гипогонадизма
Журнал: Проблемы эндокринологии. 2014;60(6): 38‑44
МГУ им. М.В. Ломоносова, Москва
На сегодняшний день диагностика гипогонадизма использует данные рентгенологического и лабораторного (биохимического) исследований, на основании которых в большинстве случаев пациентам ставится диагноз идиопатической формы заболевания. Однако в последнее время выявлен целый ряд генов, нарушение функции которых приводит к развитию гипогонадизма. Таким образом, диагностика гипогонадизма может быть расширена путем включения генотипирования различных форм заболевания, что в некоторых случаях может способствовать выбору тактики лечения. Настоящий обзор посвящен установлению роли генов-кандидатов изолированного гипогонадотропного гипогонадизма в патогенезе заболевания.
МГУ им. М.В. Ломоносова, Москва
МГУ им. М.В. Ломоносова, Москва
МГУ им. М.В. Ломоносова, Москва;
ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
МГУ им. М.В. Ломоносова, Москва
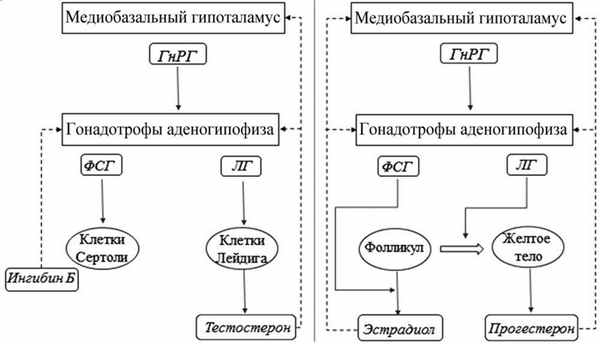
Физиологическое действие гипоталамо-гипофизарно-гонадной оси основывается на пульсирующей гипоталамической секреции гонадолиберина (ГнРГ), нарушение которой является причиной редких заболеваний, объединяемых под термином гипогонадизм. Отсутствие ГнРГ приводит к дезактивации рецептора на поверхности гонадотрофов аденогипофиза и выпадению стимулирующего действия на синтез и высвобождение гонадотропинов (ЛГ и ФСГ) в общий кровоток. Дефицит ЛГ и ФСГ обусловливает отсутствие гаметогенеза и синтеза половых стероидов. Таким образом, нормальное функционирование репродуктивной системы зависит от скоординированной работы трех звеньев: аркуатных ядер гипоталамуса, гонадотрофов гипофиза и гонад (рис. 1). Рисунок 1. Регуляция синтеза и секреции половых гормонов у мужчин (слева) и женщин (справа). Сплошными стрелками показан стимулирующий эффект, пунктирными стрелками — ингибирующий.
В зависимости от сроков возникновения различают врожденный и приобретенный гипогонадизм, а в зависимости от уровня поражения - первичный (поражение самих гонад) и вторичный (гипоталамо-гипофизарный) гипогонадизм. Существует также классификация, разделяющая поражения гипофиза и гипоталамуса на вторичный и третичный уровень соответственно [1]. Определение содержания гонадотропинов (ЛГ, ФСГ) в сыворотке позволяет диагностировать гипер- или гипогонадотропный гипогонадизм.
Гипогонадотропный гипогонадизм (ГГ) характеризуется задержкой или отсутствием полового созревания и, как следствие, бесплодием. Врожденный или идиопатический гипогонадотропный гипогонадизм (ИГГ) - гетерогенное заболевание. Встречаемость этого синдрома составляет 1:5000-1:10 000 у мужчин и 1:50 000-1:100 000 у женщин. Традиционно ИГГ подразделяют на две формы: в сочетании с аносмией или гипосмией (синдром Каллмана - СК) и с нормальным обонянием (нИГГ) [2]. СК обусловлен нарушением нормальной миграции нейронов ГнРГ из области обонятельного нерва в гипоталамус.
В основе ИГГ в большинстве случаев лежат генетические нарушения [3]. Исследование генетической составляющей в формировании гипогонадизма необходимо для усовершенствования диагностики различных его форм и выбора оптимальной схемы лечения, включая сроки терапевтического вмешательства. Алгоритм обследования пациентов программы ЭКО также должен учитывать результаты генетических исследований.
Ключевую роль в нервной регуляции репродуктивной функции играет гонадолиберин. Внутриутробное развитие гипоталамо-гипофизарной оси и миграция нейронов ГнРГ одинакова у мужчин и женщин. ГнРГ-секретирующие нейроны возникают в обонятельной плакоде приблизительно на 4-5-й [4] или на 5-й неделе [5] эмбрионального развития. На 6-й неделе они начинают мигрировать вдоль нервных терминальных волокон и обонятельного тракта в гипоталамус. Их развитие в большей степени связано с нормальным развитием обонятельных луковиц [5]. На 9-й неделе ГнРГ-секретирующие нейроны мигрируют через передний мозг в медиобазальный гипоталамус, где начинают секрецию гормона [4]. В то же время происходит развитие гонадотрофов, секретирующих ЛГ и ФСГ. Гипоталамо-гипофизарный аппарат становится функциональным к 15-й неделе беременности [5].
ГнРГ из нейронов медиобазального гипоталамуса по аксонам, проецирующимся в срединное возвышение, поступает в гипофизарные портальные сосуды [8] и с током крови попадает в аденогипофиз, где взаимодействует со специфическими рецепторами на поверхности гонадотрофов [9], обеспечивая импульсное высвобождение ЛГ и ФСГ. Эпизодическая секреция ГнРГ необходима для поддержания нормальной секреции ЛГ и ФСГ гипофизом. Частота и амплитуда импульсов ГнРГ зависят от концентрации половых гормонов, которые по механизму отрицательной обратной связи действуют как на уровне гипоталамуса, так и гипофиза (см. рис. 1). Высвобождение ГнРГ и гонадотропинов происходит с частотой приблизительно 1 импульс в час. Непрерывный выброс ГнРГ приведет к десенсибилизации рецепторов на поверхности гонадотрофов с последующим уменьшением секреции ЛГ и ФСГ [10]. Регуляция высвобождения ГнРГ у женщин является циклической, а у мужчин - тонической.
Нарушение секреции ГнРГ, служащее причиной ГГ, может происходить по двум причинам:
1) вследствие нарушения онтогенеза и миграции ГнРГ-секретирующих нейронов; 2) вследствие нарушения гипоталамической секреции гормона.
Генетическая составляющая гипогонадотропного гипогонадизма
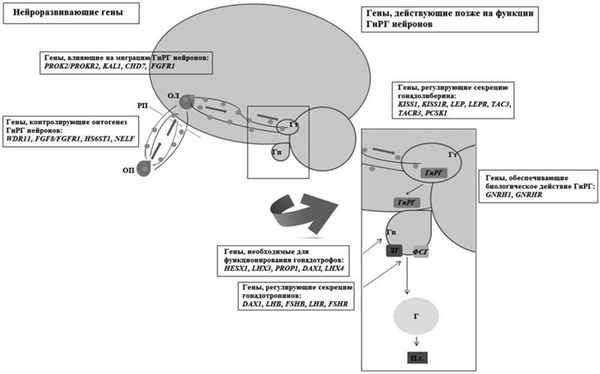
ГГ - полигенное заболевание. Гены-кандидаты, ассоциированные с данным заболеванием, можно разделить на следующие группы [5]: нейроразвивающие гены (контролирующие онтогенез нейронов ГнРГ и влияющие на их миграцию) и гены, определяющие функцию ГнРГ-нейронов (регулирующие секрецию ГнРГ и обеспечивающие его биологический эффект). Классификацию можно продолжить, выделив в самостоятельную группу гены, детерминирующие функционирование гонадотрофов и регулирующие секрецию гонадотропинов (рис. 2). Рисунок 2. Схематическое представление работы генов, ассоциированных с ИГГ. ОП — обонятельная плакода; РП — решетчатая пластинка; ОЛ — обонятельная луковица; Гт — гипоталамус; Гп — гипофиз; Г — гонады; ГнРГ — гонадолиберин; ЛГ и ФСГ — лютеинизирующий и фолликулостимулирующий гормоны; П.г. — половые гормоны.

В настоящее время около 65% случаев ИГГ остаются без выявленной генетической причины. Нами составлена таблица всех известных на сегодня генов-кандидатов с указанием их молекулярной функции и непосредственного участия в формировании заболевания (см. таблицу).
Нейроразвивающие гены
Функции как минимум пяти генов - WDR11, FGFR1/FGF8, NELF, HS6ST1 - необходимы для правильной эмбриональной дифференциации нейронов ГнРГ. Продукт гена WDR11 играет важную роль в развитии обонятельных нейронов [11], а также непосредственно участвует в процессе развития нейронов ГнРГ. Гены FGF8 и FGFR1 кодируют соответственно фактор роста фибробластов (FGF8) и его рецептор и непосредственно участвуют в онтогенезе нейронов ГнРГ. Снижение экспрессии FGF8 ингибирует дифференцировку клеток-предшественников в нейроны ГнРГ [12, 13]. Ген FGFR1 участвует в спецификации нейронов в обонятельной плакоде [14]. Для активации FGFR1-пути требуется связывание белка FGF8 с рецептором FGFR1 и гепарансульфатом (HS) [15], который является компонентом внеклеточного матрикса и модулирует межклеточные связи, важные для развития нервной системы [16, 17]. Ген HS6ST1 участвует в развитии нейронов и в нейронном ветвлении [18]. Ген NELF стимулирует миграцию нейронов ГнРГ в обонятельную луковицу [19].
Гены, влияющие на миграцию ГнРГ нейронов
Существуют два типа нейронов ГнРГ, присутствующих в гипоталамусе: нейроны ГнРГ1 и ГнРГ2. Однако только нейроны ГнРГ1 задействованы в функционировании гипоталамо-гипофизарно-гонадной системы. Нейроны ГнРГ2 играют роль лишь нейромодуляторов, непосредственно не участвуя в контроле становления репродуктивной системы [21].
Группа генов - PROK2/PROKR2, KAL1, CHD7, FGFR1 контролирует миграцию нейронов ГнРГ1 от места эмбрионального происхождения в гипоталамус. Продукт гена FGFR1 влияет на развитие обонятельной луковицы и на миграционную активность нейронов ГнРГ1 [12]. Гены PROK1/PROKR1 и PROK2/PROKR2 кодируют компоненты прокинетицитиновой системы, состоящей из двух почти идентичных (на 85%) рецепторов (PROKR1 и PROKR2) и двух их лигандов (PROK1 и PROK2). Пара рецептор-лиганд PROKR2/PROK2 участвует в нейрогенезе обонятельной луковицы [22]. Ген CHD7 кодирует АТФ-зависимый ремодулятор, влияющий на структуру хроматина и экспрессию генов и играет важную роль в регуляции эмбрионального развития. По-видимому, CHD7 регулирует экспрессию генов KAL1, FGFR1, PROK2 и PROKR2 [23]. Ген KAL1, кодирующий белок аносмин-1, играет определенную роль в дальнейшей миграции нейронов: при входе нейронов ГнРГ в обонятельную луковицу и при установлении контакта между входящими обонятельными аксонами и центральными нейронами луковицы. Мутации в гене KAL1 не влияют на нейрогенез нейронов ГнРГ1 в носовой плакоде [19], но в отсутствие функционального белка KAL1 происходит (как следствие нарушения нормальной синаптической связи) ретроградная дегенерация обонятельного нерва, в результате чего нарушается миграция нейронов ГнРГ [4]. Таким образом, потеря основного миграционного пути, сформированного первичными обонятельными аксонами, объясняет основные симптомы СК.
Ген SEMA3A необходим для формирования нейронной системы ГнРГ. Недостаток белка ухудшает расположение нейронов ГнРГ в гипоталамусе, что приводит к нарушению нейроэндокринного механизма регуляции полового развития [6].
Гены, регулирующие секрецию ГнРГ
Комплексы рецептор-лиганд KISS1/KISS1R, TAC3/TACR3, LEP/LEPR и ген PCSK1 кодируют белки, способствующие активации нейронов ГнРГ1, и, тем самым, регулируют секрецию ГнРГ [12, 24]. Ген KISS1 кодирует белок кисспептин. Пара рецептор-лиганд KISS1/KISS1R оказывает стимулирующий эффект на высвобождение ГнРГ и последующий синтез гонадотропинов. KISS1-секретирующие нейроны чувствительны к эстрогену и вовлечены в механизм отрицательной и положительной обратной связи [12]. У пациентов с нИГГ из-за мутаций в гене KISS1R серьезно снижается амплитуда импульсов ЛГ, но сохраняется нормальная их частота [15]. Однако мутации в гене KISS1R - чрезвычайно редкая причина ГГ [15].
Продукт гена TAC3 - нейрокинин B через рецептор NK3R (TACR3) регулирует частоту выброса ГнРГ в гипоталамо-гипофизарно-портальную систему [25]. Функционирование системы генов TAC3/TACR3 необходимо для нормальной эмбриональной секреции гонадотропинов. Механизмы, посредством которых мутации в этих генах влияют на центральную нейроэндокринную регуляцию полового созревания и репродукции у людей, плохо изучены [12].
Влияние лептина (ген LEP) на секрецию ГнРГ может быть опосредовано (по крайней мере, частично) продукцией кисспептиновых нейронов (Kp), которые играют фундаментальную роль в модуляции секреции ГнРГ [26]. Kp-нейроны чувствительны к количественному содержанию лептина в гипоталамусе: лептин стимулирует экспрессию гена KISS1 [27]. Кроме того, лептин уменьшает экспрессию нейропептида Y (NPY) в аркуатном ядре гипоталамуса, что, в свою очередь, уменьшает ингибирование ГнРГ [26]. Показано, что пара генов LEP/LEPR стимулирует выброс ЛГ и ФСГ с помощью азотной активации синтазы [28].
Продуктом гена PCSK1 является нейроэндокринная конвертаза 1 (NEC1), катализирующая процессинг прогормонов. В частности, она вовлечена в процессинг проопиомеланокортина, действующего на секрецию ГнРГ [27, 29].
Гены, обеспечивающие биологическое действие ГнРГ
Пара рецептор-лиганд GNRH1/GNRHR обеспечивает биологическое действие ГнРГ, регулирует синтез и секрецию ЛГ и ФСГ [28]. Рецептор, взаимодействуя с ГнРГ, активирует фосфолипазу С и мобилизует внутриклеточный кальций в гонадотрофах гипофиза, приводя к высвобождению гонадотропинов [4, 5, 30].
Гены, участвующие в функционировании гонадотрофов гипофиза
Гены HESX1, PROP1, DAX1 (NROB1), LHX3 и LHX4 участвуют в функционировании гонадотрофов гипофиза [1, 31]. Мутации в гене DAX1 приводят к снижению как гипоталамической секреции ГнРГ, так и гипофизарной выработки гонадотропинов [4, 32-34]. К другим генам, регулирующим секрецию ЛГ и ФСГ, относятся пары лиганд-рецептор LHB/LHR и FSHB/FSHR. Дефицит гонадотропинов обусловлен нарушением синтеза β-субъединиц лютропина (ген LHB) и фоллитропина (ген FSHB), так как β-субъединица определяет специфические свойства гормонов (узнавание рецептора, иммунные свойства). Мутации в гене LHB приводят к расстройству овуляции у женщин и дефициту тестостерона у мужчин, и, как результат, к ГГ [35]. Мутации в гене FSHB приводят к развитию первичной аменореи [32].
Заключение
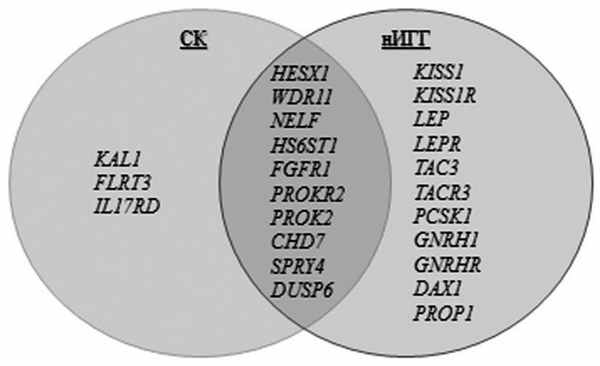
Таким образом, гены, ассоциированные с заболеванием, можно разделить на участвующие в патогенезе нИГГ и участвующие в патогенезе СК (рис. 3). Рисунок 3. Участие генов в формировании нИГГ и СК. Круг генов-кандидатов ИГГ, по-видимому, будет расширяться. Истинная распространенность генетических аномалий у пациентов пока не установлена. Из-за клинически фенотипического разнообразия форм ИГГ выявление истинных причин заболевания в каждом конкретном случае должно основываться на анализе биохимических показателей и генетических взаимодействий.
Гипогонадотропный гипогонадизм у женщин: причины возникновения, подходы к диагностике и лечению
Формирующийся в результате нарушения синтеза и/или секреции гонадотропинов гипогонадотропный гипогонадизм может быть органическим (т.е. формирующимся в результате анатомо-функциональных расстройств гипоталамо-гипофизарной области при различных новообразованиях хиазмально-селлярной локализации) или функциональным, приобретенным или врожденным (мутации гена рецептора ГнРГ, β-субъединицы ФСГ; генов SF-1, DAX-1, нарушения в генах рецепторов ЛГ и ФСГ и пр.). В формировании функциональных нарушений принимают участие нейропептид Y (NPY), кортикотропин-рилизинг-гормон (КРГ), лептин, грелин и β-эндорфин. Диагностика заболевания включает определение гонадотропинов, исключение гиперпролактинемии и других эндокринных расстройств, ультразвуковое исследование матки и яичников, магнитно-резонансную томографию головного мозга. При длительности аменореи более года показано исследование плотности костной ткани. При выявлении причин гипогонадотропного гипогонадизма в первую очередь необходимо их устранение (например, ликвидация стресса, исключение физических нагрузок, восстановление нормальной массы тела, или лечение опухолей гипофиза и т.д.), что может приводить к восстановлению менструальной функции и фертильности. Однако в большинстве случаев при стойкой гипоэстрогении у пациенток с гипогонадотропным гипогонадизмом показана эстроген-гестагенная терапия в циклическом режиме, для длительного применения эффективной и безопасной является комбинация 17β-эстрадиола 2 мг и дидрогестерона 10 мг.
Ключевые слова
«Гипогонадотропным» (или «центральным», «вторичным») называют гипогонадизм, формирующийся в результате нарушения синтеза и/или секреции гонадотропинов. Гипогонадотропный гипогонадизм может быть приобретенным или врожденным заболеванием, органическим или функциональным. Приобретенные органические формы гипогона-дотропного гипогонадизма развиваются в результате анатомо-функциональных расстройств гипоталамо-гипофизарной области при различных новообразованиях хиазмально-селлярной локализации (опухолях гипофиза, краниофарингиомах, и пр.) или других повреждениях (например, при формировании «пустого» турецкого седла) [1]. При этом могут возникать как органические нарушения нейронных путей гипоталамуса, так и изменения непосредственно в клетках аденогипофиза, что, в конечном счете, проявляется развитием функциональной несостоятельности гонадотрофов с нарушением секреции гонадотропинов. Снижение синтеза и секреции гонадотропинов может наблюдаться при геморрагических и ишемических инфарктах гипофиза, гранулематозных и инфильтративных заболеваниях с поражением гипоталамо-гипофизарной области (саркаидозе, туберкулезе, гистиоцитозе Х и др.). Кроме того, возможно развитие аутоиммунного поражения ткани гипофиза – так называемый лимфоцитарный гипофизит [2], при котором происходит диффузная инфильтрация ткани гипофиза лимфоцитами и лимфоидными элементами с развитием деструкции нормальных гипофизарных клеток. Этот процесс может сопровождаться недостаточностью тропных гормонов, в том числе и гонадотропинов. Центральный гипогонадизм может также являться следствием черепно-мозговой травмы (развивается примерно у 25% лиц, перенесших тяжелую или средне-тяжелую травму головного мозга) [3].
Функциональная гонадотропная недостаточность (или так называемая «функциональная гипоталамическая аменорея») является причиной примерно 30–35% случаев вторичной аменореи. В этих случаях причиной гипогонадизма становится снижение частоты и/или амплитуды импульсной секреции гонадотропин-рилизинг-гормона (ГнРГ), возникающее в отсутствие органического поражения гипоталамо-гипофизарной области [4]. Диагностическими критериями функциональной гонадотропной недостаточности можно считать отсутствие менструаций более 6 мес на фоне низких (
Одной из самых распространенных причин функциональной гонадотропной недостаточности является хронический стресс («психогенная» или «стрессорная» аменорея). Другими причинами также считаются чрезмерные физические нагрузки (профессиональный спорт) и критическое снижение массы тела, крайняя форма которого наблюдается при нервной анорексии [4, 5].
В формировании функциональной гипоталамической аменореи принимают участие различные нейропептиды: нейропептид Y (NPY), кортикотропин-рилизинг-гормон (КРГ), лептин, грелин и β-эндорфин, влияющие на секрецию ГнРГ. Патогенез функциональной аменореи при стрессе, избыточных физических нагрузках и потере массы тела сходен, хотя при различных заболеваниях являются ведущими те или иные нарушения секреции нейропептидов. Например, при физических нагрузках и потере массы тела в бóльшей степени наблюдается нарушение секреции NPY, при стресс-индуцированной аменорее и на фоне физических нагрузок – чрезмерная активация КРГ и т.д.
В патофизиологии стрессовой аменореи важную роль играет КРГ. У женщин с функциональной аменореей отмечается повышение секреции КРГ по сравнению со здоровыми женщинами [6], что, с одной стороны, считается косвенным подтверждением хронического стресса, а с другой – фактором нарушения секреции ГнРГ/гонадотропинов. Повышенная секреция КРГ прямо подавляет электрофизиологическую активность импульсного генератора ГнРГ [7]. Кроме того, повышение продукции КРГ стимулирует выработку адренокортикотропного гормона (АКТГ) и β-эндорфина, обладающих самостоятельным ингибирующим действием на гипоталамо-гипофизарно-гонадную ось [8]. При аменорее, индуцированной стрессом и физическими нагрузками, отмечается бóльшее повышение опиодергической активации по сравнению с аменореей на фоне потери массы тела [4].
У пациенток функциональной аменореей на фоне снижения массы тела также отмечается снижение базальной концентрации NPY [15]. Есть предположения, что NPY может быть основным кандидатом на роль координатора питания и репродукции на уровне центральной нервной системы [16]. Кроме того, в патогенезе функциональной аменореи при потере массы тела участвует грелин, который также подавляет активность гипоталамо-гипофизарно-гонадной оси. Высокие концентрации грелина были отмечены после потери массы тела, индуцированной диетой или хирургическим вмешательством, при неадекватном пищевом поведении (даже на фоне нормального калоража) и при отрицательном энергетическом балансе [17, 18]. Концентрации грелина у женщин с неврогенной анорексией и аменореей значительно выше, чем у здоровых худеньких женщин [19]. Высокие концентрации грелина могут быть ответственны за продолжение аменореи после восстановления нормальной массы тела и нормализации концентраций лептина [20, 21].
Среди спортсменок особенно часто нарушения менструального цикла возникают у гимнасток, балерин, ныряльщиц и легкоатлеток, бегущих на длинные дистанции. У этих пациенток отмечается активизация секреции КРГ, β-эндорфина и грелина [22], а также крайне низкие концентрации лептина [23].
Врожденные нарушения секреции гонадотропинов, проявляющиеся гипогонадизмом, могут быть вызваны генетическими дефектами, которые обна-руживаются на разных уровнях гипоталамо-гипофизарно-гонадной оси: нарушения секреции ГнРГ (с аносмией – синдром Каллмана, без аносмии – изолированный гипогонадотропный гипогонадизм), мутации гена рецептора ГнРГ, приводящие к снижению его активности; мутации β-субъединицы ФСГ; дефекты в гонадотрофах (мутации генов SF-1, DAX-1), нарушения в генах рецепторов ЛГ и ФСГ [24]. Большинство выявляемых врожденных случаев – спорадические, хотя встречается и Х-сцепленное наследование. Известны дефекты по меньшей мере двух аутосомных генов, приводящих к недостаточности ГнРГ [25]. Генетические мутации непосредственно самих молекул гонадотропинов ЛГ и ФСГ встречаются крайне редко.
Нарушения центральной регуляции синтеза и/или секреции гонадотропинов приводят к снижению уровня половых стероидов и развитию клинической симптоматики гипогонадизма. У пациенток с гипогонадизмом отмечаются нарушения регулярности менструального цикла по типу олиго/опсоменореи или аменореи (в 100% случаев), бесплодие, атрофические изменения слизистой оболочки гениталий, приводящие к урогенитальным расстройствам (до 70% случаев), гипоплазия молочных желез (40–60% случаев), скудное половое оволосение (20– 40%) [26, 27]. Кроме того, дефицит эстрогенов приводит к развитию остеопении той или иной степени (86% пациенток) и дислипидемических нарушений (до 45% пациенток) [28]. Вазомоторные нарушения, ассоциирующиеся с дефицитом эстрогенов в постменопаузе, возникают при центральном гипогонадизме редко – не более 10% случаев, однако бывают ярко выраженными и существенно ухудшают самочувствие женщины.
Начальные диагностические исследования включают определение содержания эстрадиола в сыворотке крови (для подтверждения гипоэстрогении), определение уровней ФСГ, ЛГ и пролактина для дифференциальной диагностики между центральным и яичниковым уровнями поражения гипоталамо-гипофизарно-овариальной оси и исключения гиперпролактинемического гипогонадизма. Обязательно нужно провести определение уровней ТТГ и свободного тироксина для исключения нарушений функции щитовидной железы как причины менструальной дисфункции. Ультразвуковое исследование органов малого таза уточнит исходное состояние матки и яичников, а также будет простым и доступным методом контроля проводимого лечения. Для пациенток с первичной аменореей обязательно исследование кариотипа для исключения или диагностики генетических отклонений. Учитывая тот факт, что нарушения функции репродуктивной системы могут быть следствием органического поражения гипоталамо-гипофизарных структур, пациенткам с низкими уровнями гонадотропинов показано проведение МРТ головного мозга для исключения опухолей хиазмально-селлярной области [29, 30].
Женщинам с длительностью аменореи более года показано исследование минеральной плотности костной ткани (МПК), оптимальным методом обследования является дуальная энергетическая рентгеновская абсорбциометрия. По нашим данным, у большинства пациенток (58%) с изолированным гипогонадотропным гипогонадизмом часто отмечаются сниженные показатели МПК как в шейке бедра, так и в поясничных позвонках, поэтому целесообразно проводить исследование обеих точек скелета [31]. По нашим данным, для пациенток с гипопитуитаризмом более характерно снижение МПК именно в позвоночнике (-2,5 SD по Z-критерию у 50% пациенток), поэтому этот отдел скелета является более важным для исследования [28, 31].
Дополнительные исследования могут включать биохимический анализ крови (определение показателей липидного спектра, ферментов печени, показателей минерального обмена), определение содержания других тропных гормонов гипофиза, а также необходимые лабораторно-инструментальные исследования, направленные на уточнение эндокринных нарушений, сопутствующих гипогонадизму.
В ряде случаев лечение заболеваний, сопровождающихся гипогонадизмом, приводит к восстановлению менструального цикла, и длительной заместительной терапии половыми гормонами в таких случаях не требуется. При функциональных нейроэндокринных расстройствах для восстановления нормальной менструальной функции необходимо исключение причин возникновения заболевания (ликвидация стресса, исключение физических нагрузок) и/или восстановление нормальной массы тела. Хирургическое, медикаментозное и/или лучевое лечение гормонально-активных опухолей гипофиза может приводить к восстановлению менструальной функции и фертильности. Так, например у женщин с гиперпролактинемическим гипогонадизмом лечение агонистами дофамина в подавляющем большинстве случаев (до 70% случаев) позволяет добиться нормализации функции репродуктивной системы [32]. В тех случаях, когда восстановить нормальный уровень половых стероидов не удается (например, после удаления опухолей хиазмально-селлярной области, при синдроме «пустого» турецкого седла), необходимо назначить лечение, направленное на восстановление менструальной функции, а также на предотвращение развития отдаленных последствий гипоэстрогении. Кроме того, отсутствие адекватной терапии половыми стероидами существенно снижает качество жизни пациенток с гипогонадотропным гипогонадизмом, особенно если присутствуют и другие виды гипофизарной недостаточности [33].
Для женщин репродуктивного возраста принципы гормональной терапии основываются на восстановлении нормального уровня половых стероидов и поддержании регулярных циклов. Последовательное примененеие эстрогенов в постоянном адекватном дозовом режиме позволяет добиться регрессии симптомов гипоэстрогении, сочетание с прогестинами в циклическом режиме предупреждает пролиферативное воздействие эстрогенов на эндометрий и молочные железы. С этих позиций для пациенток с гипогонадотропным гипогонадизмом наиболее оптимальной для проведения длительного лечения является комбинация 17β-эстрадиола и дидрогестерона – аналога прогестерона, не теряющего своей активности при пероральном введении [28, 31, 33]. Принимать гормоны предпочтительно непрерывно, в двухфазном циклическом режиме: первые 14 дней принимают перорально 2 мг 17β-эстрадиола, следующие 14 дней – 2 мг 17β-эстрадиола и 10 мг дидрогестерона (дюфастон).
17β-эстрадиол оказывает положительное влияние на состояние урогенитального тракта, показатели липидного спектра крови и плотность костной ткани в различных отделах скелета. Дидрогестерон не обладает побочными гормональными эффектами и не оказывает отрицательного влияния на свертывающую систему крови, углеводный и липидный обмены. Более того, есть данные о том, что применение дидрогестерона в сочетании с 17β-эстрадиолом усиливает защитный эффект эстрогенов на сердечно-сосудистую систему [34].
Показанием к назначению эстрогенгестагенной терапии пациенткам той группы является необратимое нарушение менструальной функции, отсутствие возможности восстановления менструального цикла.
Длительный (более 5 лет) опыт применения комбинации 2 мг 17β-эстрадиола и 10 мг дидрогестерона (дюфастон) у пациенток с гипогонадотропным гипогонадизмом свидетельствует о высокой эффективности и безопасности такого лечения. На фоне гормонального лечения у женщин существенно снижалось число жалоб, улучшалось общее состояние, отмечалось статистически значимое снижение содержания холестерина, триглицеридов, ионизированного кальция и щелочной фосфатазы, повышение МПК в поясничных позвонках на 8–10% и в проксимальной части бедра до 5–6% [28, 31]. Кроме того, на фоне гормональной терапии этими половыми стероидами отмечено существенное повышение качества жизни пациенток [33]
Эстрогенгестагенную терапию женщинам с гипогонадотропным гипогонадизмом желательно проводить до 50 лет – то есть до возраста предполагаемой менопаузы. После этого рубежа подходы к проведению заместительной гормональной терапии должны быть такими же, как и для всех женщин в климактерическом периоде. Необходимо учесть, что женщины с длительным анамнезом гипогонадизма имеют более высокий риск развития остеопороза. Одной из наиболее важных задач современной клинической эндокринологии является нормализация метаболических изменений, возникающих при недостаточном содержании тех или иных гормонов в организме больного человека. Неполноценность гормонального баланса может сопровождаться различной симптоматикой и, в конечном итоге, приводить к значительному ухудшению качества жизни. Гипогонадизм является полиэтиологическим заболеванием, возникающим на фоне различных вариантов нарушений синтеза и секреции гонадотропинов. В большинстве случаев диагноз может быть подтвержден рутинными гормональными исследованиями без проведения специальных фармакодинамических тестов. Эстрогенгестагенная терапия должна проводиться большинству женщин с центральным гипогонадизмом. Своевременная диагностика гипогонадизма и назначение адекватного лечения помогут существенно улучшить качество жизни женщин репродуктивного возраста с гипоталамо-гипофизарными заболеваниями.
Список литературы
Об авторах / Для корреспонденции
Читайте также:
- Хроническая алкогольная энцефалопатия. Клиника хронической энцефалопатии при алкоголизме
- Неврома Мортона - лучевая диагностика
- Неаллергический ринит
- Гиповолемический ( постгеморрагический ) шок. Этиология гиповолемического шока. Патогенез постгеморрагического шока.
- Противозачаточные инъекции с прогестином
