Натрия вальпроат при эпилепсии. Этосуксимид, бензодиазепины, габапентин, ломотриджин при эпилепсии
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Эпилепсия – распространенное неврологическое заболевание, которым страдает более 50 млн человек во всем мире. В частности, в России приблизительно1 млн лиц с эпилепсией, а в Украине – 500 тыс.
Частота новых случаев заболеваний в год в мировом масштабе составляет в среднем 0,4 случая на 1 тыс. населения (0,04%), однако отмечаются колебания в разные периоды жизни: в детском возрасте – 0,9, в среднем возрасте – 0,2, старше 60 лет – 0,6 на 1 тыс. населения.
Таким образом, каждый 20й человек в мире переносит, по крайней мере, один эпилептический припадок в жизни (что составляет 5% населения земного шара). Каждый 150й человек страдает эпилепсией, у 2030% больных заболевание носит пожизненный характер. Из 40 млн лиц с эпилепсией в мире более 75% не получают адекватного лечения.
Широкий выбор противоэпилептических препаратов (ПЭП) должен в значительной мере улучшать лечение эпилепсии, однако реальное положение дел не подтверждает этих ожиданий. Эпидемиологические демографические исследования в популяциях, где количество получающих специфическую терапию пациентов составляет 015%, демонстрируют частоту спонтанных ремиссий в 3046% случаев [13]. А, к примеру, в Великобритании, в наблюдаемой на протяжении 1114 лет типичной популяции получающих ПЭП пациентов, частота ремиссий составляет 47%, то есть несущественно отличается от таковой в слаборазвитых странах, где эпилепсию практически не лечат [46].
Основной задачей противоэпилептической терапии является полный контроль приступов при отсутствии нежелательных побочных реакций и негативного влияния на качество жизни больного. В известном смысле лечение эпилепсии – это балансирование между эффективностью препарата и возможными при его применении побочными эффектами. Конечно, всем врачам хотелось бы всегда иметь доступ к ПЭП с высокой эффективностью и максимально хорошей переносимостью.
Рекомендации Международной противоэпилептической лиги 2006 г. по начальной монотерапии эпилептических припадков и синдромов завершаются мало обнадеживающим заключением о тревожащем дефиците правильно проведенных рандомизированных контролируемых исследований лекарсвенных средств для терапии эпилептических припадков, что не позволяет делать выводы об их эффективности и переносимости. Единственная практическая рекомендация по лечению формулируется общим положением: «Окончательный выбор препарата для индивидуального пациента должен включать знания о его эффективности, с учетом других переменных, таких как безопасность и переносимость, фармакокинетика, имеющиеся лекарственные формы и стоимость» [12].
• отсутствием феномена толерантности («привыкания») и низким риском аггравации эпилептических приступов;
• широким выбором лекарственных форм (сироп, таблетки, таблетки пролонгированного действия, раствор для внутривенного введения);
Количество препаратов, используемых для лечения эпилепсии, значительно возросло в течение последних 10 лет и продолжает увеличиваться быстрыми темпами. В настоящее время существует достаточно широкий выбор ПЭП с самыми разными механизмами действия. Всемирная организация здравоохранения (ВОЗ) рассматривает как «необходимые» следующие шесть ПЭП: карбамазепин, вальпроат натрия, фенитоин, фенобарбитал, диазепам и этосуксимид. Согласно ВОЗ, необходимыми являются препараты, удовлетворяющие требованиям улучшения здоровья у большинства больных конкретной популяции (в данном случае это популяция больных эпилепсией).
Несмотря на большое количество ПЭП, невролог в ежедневной практике использует 12 препарата. Попрежнему «золотым стандартом» в лечении эпилепсии считают вальпроат (соль вальпроевой кислоты) [7,8].
Безусловно, определение термина «противоэпилептический препарат первой очереди выбора» зависит от национальных предпочтений и доступности средства в той или иной стране. Кроме того, выбор приоритетных медикаментов может меняться также в связи с внедрением в практику новых ПЭП. Рекомендации Европейской экспертной группы для терапии эпилепсии у детей представлены в таблице 1.
| Таблица 1. ПЭП, показанные для использования в виде монотерапии |
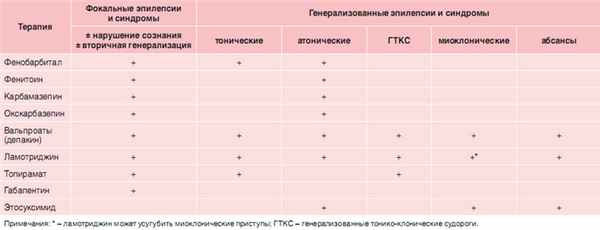 |
Проанализировав рекомендации ведущих национальных и интернациональных организаций за период 20002005 гг., N. Payakachat et al. [13] пришли к выводу, что наиболее адекватными клинической практике являются рекомендации Национального института клинического качества Великобритании (NICE). Согласно этому документу, лечение эпилепсии рекомендуется начинать с традиционных препаратов (вальпроата или карбамазепина), в случае, если нет индивидуальных противопоказаний. Аналогичные рекомендации содержатся в стандартах по лечению эпилепсии РФ, причем в них вальпроевая кислота (ВПК) стоит первой по порядку выбора [14]. Этот выбор подтверждается также рядом международных и национальных консенсусов экспертов (табл. 2) [1517].
| Таблица 2. Терапия эпилепсии у детей: рекомендации Европейской экспертной группы (2007) |
Хотя ВПК традиционно считается золотым стандартом в лечении генерализованных припадков, появление новых препаратов и их исследование в сравнении с традиционными повторно ставят перед врачом вопрос о том, с какого лекарственного средства следует начинать терапию вновь диагностированной эпилепсии с генерализованными приступами. Рассмотрению этого вопроса посвящены рекомендации Международной противоэпилептической лиги 2006 г. [12].
Таким образом, после проведения специальных исследований и метаанализов, методические рекомендации и экспертные консенсусы последних лет убедительно показывают, что ВПК, несмотря на возникновение большого количества новых ПЭП, остается препаратом выбора для лечения как неклассифицированных, так и всех видов генерализованных и фокальных припадков. Как уже отмечалось, рандомизированные контролируемые испытания строятся на оценке эффективности лечения типов приступов, в то время как в практической терапии эпилепсии у конкретного больного следует исходить из принципа лечения формы эпилепсии или эпилептического синдрома. Дело в том, что в случае одного и того же типа припадков терапия препаратом может при одной форме эпилепсии вызывать ремиссию, а при другой – утяжелить ее течение. Наиболее типичным в этом отношении является влияние карбамазепина, который вызывает улучшение во время лечения фокальных приступов при симптоматической эпилепсии, однако при идиопатических он нередко неэффективен или же приводит к утяжелению.
У детей первых 3 лет жизни без проведения ЭЭГвидеомониторинга сложно отличить фокальные приступы от генерализованных (клинически они очень похожи). У значительного числа детей точная диагностика формы эпилепсии невозможна на ранних этапах обследования, а иногда и позже, даже несмотря на применение самых сложных диагностических методов. Кроме того, именно для детского возраста характерно чрезвычайное разнообразие эпилептических синдромов, границы между ними иногда бывают стертыми, одни синдромы могут эволюционировать в другие и т. д. В таких клинических ситуациях рекомендуется назначение ПЭП, эффективных при широком спектре состояний и обладающих низким потенциальным риском аггравации приступов, то есть вальпроата.
Препаратом первого выбора для детей попрежнему остаются вальпроаты и топирамат. При парциальных припадках: первая линия лечения – вальпроат и карбамазепин, вторая – ламотриджин, леветирацетам; при ювенильной миоклонической эпилепсии: первая линия терапии – вальпроат и ламотриджин, вторая – топирамат, карбамазепин не рекомендован. Аналогичная ситуация – и при абсансах, синдроме Леннокса – Гасто и фебрильных судорогах. Исключение составляют только судороги новорожденных (в этом случае прерогатива отдается фенобарбиталу и бензодиазепину), а также эпистатус, при котором целесообразно внутривенное введение бензодиазепинов, вальпроатов и барбитуратов.
Относительно юношеской миоклонической эпилепсии, несмотря на превалирующее большинство мнений о первом выборе ВПК, некоторые рекомендации наравне с вальпроатами содержат предложения по поводу использования у женщин топирамата и ламотриджина, ссылаясь, в частности, на то, что последние обладают меньшим тератогенным эффектом [19, 20]. Между тем релевантные данные по сравнительной оценке тератогенеза для топирамата на сегодняшний день отсутствуют, а касательно ламотриджина отчасти пересмотрены [21, 22]. В отношении ВПК есть убедительные данные, что при дозах не более 1000 мг/сут частота тератогенеза не отличается от средней популяционной. Юношеская миоклоническая эпилепсия чрезвычайно чувствительна к вальпроату. В большинстве случаев суточная доза 500 мг, принимаемая на ночь, достаточна для контроля всех типов припадков [24]. Существует многолетнее наблюдение за контролем припадков при дозе 300 мг/сут. Применение низких дозировок в монотерапии сводит риск возможных неблагоприятных гендерных эффектов к средней частоте в общей популяции. По данным большинства авторов, вальпроаты вызывают ремиссию при юношеской миоклонической эпилепсии в 8590% случаев [25, 26]. Альтернативные препараты нового поколения – леветирацетам, топирамат и ламотриджин – в начальной терапии, по данным исследований, дают ремиссию в 3080% [19, 27]. Сочетание большей стоимости, меньшей в сравнении с вальпроатом частотой ремиссии и задержки достижения лечебного эффекта, а также большего сравнительного риска побочных явлений при назначении топирамата и ламотриджина (последний может также аггравировать юношескую миоклоническую эпилепсию [7]) делает нецелесообразным их использование в качестве средств первого выбора.
Возможно, широта терапевтического спектра вальпроата натрия обусловлена множественными механизмами действия ВПК. По словам E. Perucca, ВПК должна считаться не только ГАМКергическим препаратом, но и веществом с разными и сложными механизмами действия [ 23]. E. Perucca перечисляет следующие механизмы действия ВПК:
• увеличивает синтез и выделение ГАМК, тем самым потенцируя ГАМКергическую передачу в отдельных зонах головного мозга;
• уменьшает выделение возбуждающих аминокислот, гидроксимасляной кислоты и ослабляет возбуждение нейронов, обусловленное активацией NметилDаспартатных рецепторов глутамата;
• оказывает прямое влияние на возбуждение мембран, включая блокаду вольтажзависимых натриевых каналов;
• модулирует дофамин и серотонинергическую передачу (этот механизм используется для обеспечения эффективности препарата при психиатрических расстройствах и других неврологических нарушениях, помимо эпилепсии).
Результаты проведенного метаанализа всех публикаций в базах данных MedLine, Current Contents и Cochrain за 19402005 гг. в отношении генерализованных тоникоклонических припадков определяют вальпроаты как препараты выбора у детей и взрослых. Хотя карбамазепин, фенитоин и окскарбазепин упоминаются также как лекарственные средства для возможной начальной терапии у взрослых, указывается, что они могут вызывать утяжеление приступов, так что их применение требует осторожности. При абсансах препаратами выбора признаются ВПК, этосуксимид и ламотриджин. Однако последние два уступают вальпроату по скорости достижения терапевтического эффекта, поэтому приоритет при абсансах остается за вальпроатом.
Нерекомендуемыми медикаментами изза возможности аггравации припадков указаны карбамазепин, фенитоин, фенобарбитал, тиагабин, вигабатрин и окскарбазепин (табл. 3) [10].
| Таблица 3. ПЭП, потенцирующие аггравацию [12] |
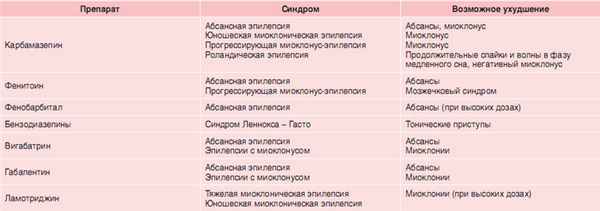 |
Неопределенность выводов о том, с какого препарата начинать лечение эпилепсии с генерализованными припадками, стимулировала проведение крупномасштабного независимого (не спонсированного фирмамипроизводителями) мультицентрового рандомизированного контролируемого исследования SANAD. В проспективном испытании 716 пациентов с первично генерализованными припадками или неустановленным типом приступов, разделенных на три равные группы, каждая из которых получала монотерапию вальпроатом, ламотриджином или топираматом, вальпроат в лечении любых типов припадков оказался значительно лучше как по переносимости, чем топирамат, так и по эффективности, чем ламотриджин. По результатам исследования, можно сделать однозначный вывод, что вальпроат является препаратом первого выбора для генерализованной и неклассифицированной эпилепсии [18].
В Украинском медицинском центре реабилитации детей с органическим поражением нервной системы МЗ Украины (Т.П. Ярмолюк, В.Ю. Мартынюк, А.Н. Надоненко) проанализированы 230 историй болезни детей с эпилепсией, из которых 116 принимали препараты вальпроевой кислоты (депакин), 96 – топирамат, остальные 18 – ламотриджин, бензодиазепины, вигабатрин и др.
В качестве монотерапии вальпроат использовали у 56% детей, в сочетании с топираматом – у 18%, ламотриджином – у 8%, карбамазепином – у 11%, в других комбинациях – у 7%. Вальпроаты чаще применяли при генерализованных припадках (57%), при этом общая эффективность лечения достигала 76%, при фокальных формах (37%) она составила 52%.
Таким образом, золотым стандартом в лечении эпилепсии у детей при всех типах припадков являются препараты вальпроевой кислоты. В детском возрасте отдается предпочтение применению брендового препарата (депакин).
Натрия вальпроат при эпилепсии. Этосуксимид, бензодиазепины, габапентин, ломотриджин при эпилепсии
Натрия вальпроат при эпилепсии. Этосуксимид, бензодиазепины, габапентин, ломотриджин при эпилепсии
Натрия вальпроат применяют для уменьшения частоты тонико-клонических приступов, особенно абсансов. Подобно фенитоину и карбамазепину, натрия вальпроат взаимодействует с Na+-каналами, а также увеличивает содержание ГАМК в мозге при длительном применении. Концентрации натрия вальпроата в крови не коррелируют с терапевтическими эффектами.
Неблагоприятные эффекты: желудочно-кишечные расстройства и, что более важно, печеночная недостаточность. Гепатотоксичность при использовании вальпроата наблюдается чаще, чем у других противоэпилептических препаратов. Печеночные пробы не позволяют предсказать гепатотоксичность.
Этосуксимид — средство выбора для лечения абсансов. Полагают, что препарат ингибирует низкопороговые токи Са2+ (Т-токи) в таламусе, что, как думают, является источником абсансов. Концентрации этосуксимида в плазме не коррелируют с терапевтической эффективностью.
Неблагоприятные эффекты этосуксимида: гастроинтестинальные расстройства, сонливость, летаргия, эйфория, уртикарные повреждения кожи и, наиболее важно, лейкопения; в редких случаях возможна депрессия костного мозга.
Бензодиазепины
Клоназепам эффективен при абсансах и миоклонусе, в то время как диазепам и лоразепам эффективно контролируют эпилептический статус (непрерывные приступы). Бензодиазепины увеличивают ГАМК-индуцированную С1"-проводимость, что, вероятно, обусловливает их противоэпилептическую активность.
Общий неблагоприятный эффект бензодиазепинов — угнетение. Внутривенное введение диазепама может угнетать дыхание, поэтому при терапии эпилептического статуса должен быть доступен аппарат искусственной вентиляции легких. Повторные приступы могут повреждать мозг и быть опасными для жизни, поэтому эпилептический статус необходимо контролировать.
Роль новых противоэпилептических средств — габапентина и ламотриджина — в терапии приступов еще не определена.
Габапентин — высоколипофильная молекула. Препарат был разработан для подражания эффектам ГАМК в ЦНС. Это полезная дополнительная терапия для пациентов с парциальными приступами, имеющая мало неблагоприятных эффектов, кроме сонливости, головокружения и усталости.
Ламотриджин предназначен для использования при парциальных приступах и действует на Na+-каналы. Известны следующие неблагоприятные эффекты препарата: головокружение, атаксия, нарушение зрения и гастроинтестинальные расстройства.
Ламотриждин метаболизируется в печени, образуя глюкурониды. Назначение одновременно фенитоина, карбамазепина или уменьшенной дозы фенобарбитала укорачивает период полувыведения ламотриджина в сыворотке с 24 до 15 час, возможно стимулируя конъюгацию ламотриджина с глюкуроновой кислотой в печени. Напротив, натрий вальпроат ингибирует метаболизм ламотриджина и увеличивает его период полувыведения до 60 час.
Другие новые противоэпилептические средства: агонист ГАМК-рецептора зонизамид, но точный механизм действия этого препарата в уменьшении приступов неясен. Зонизамид имеет длительный период полувыведения в плазме (около 15 час). Наиболее частые неблагоприятные эффекты: сонливость, анорексия, головокружение, головная боль, тошнота и раздражительность. Недавно для лечения эпилепсии был предложен блокатор Na+-канала оксарбазепин наряду с фосфенитоином, ингибиторами нейронального обратного захвата ГАМК тиагабином и леветирацетамом (точный механизм действия последнего остается неизвестным).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Влияние противоэпилептических лекарственных препаратов на уровень стероидных гормонов
Эпилепсия представляет собой одно из самых распространенных неврологических заболеваний в мире, которым страдают около 50 млн человек всех возрастов по всему миру, по данным Всемирной организации здравоохранения. Значительное число пациентов с данным заболеванием - женщины репродуктивного возраста. Известно, что противоэпилептические препараты влияют на уровни стероидных гормонов. Данная проблема мало изучена, а появление новых противоэпилептических препаратов в практике требует дальнейшего углубленного изучения.
Введение
Эпилепсия и противоэпилептические препараты (ПЭП) могут комплексно воздействовать на репродуктивную систему, приводя к снижению фертильности как у женщин, так и у мужчин, а также вызывая различные эндокринные расстройства [1]. В настоящее время ПЭП используются не только для лечения эпилепсии, но и при следующих заболеваниях: невропатическая боль и фибромиалгия, мигрень, тревожные и биполярные расстройства, шизофрения, эссенциальный тремор [2]. Известно, что ПЭП имеют ряд побочных эффектов на эндокринную систему, влияя на метаболизм половых гормонов посредством индукции или ингибирования микросомальных ферментов печени (см. таблицу) [1].

Система цитохрома P-450 (CYP) представляет суперсемейство гемопротеинов, состоящих из белка с ковалентно связанным гемом, обеспечивающим присоединение кислорода. Эти соединения повсеместно встречаются у животных, растений, грибов и бактерий. У млекопитающих ферменты CYP присутствуют во всех тканях с наибольшей концентрацией в печени и тонком кишечнике. Эти мембраносвязанные белки, которые имеются в большом количестве в микросомах фракции печени, играют решающую роль в метаболизме чужеродных соединений, в т.ч. лекарственных средств. CYP также присутствуют во внутренних мембранах митохондрий стероидогенных тканей, таких как кора надпочечников, яички, яичники, молочная железа и плацента, участвуют в синтезе и деградация эндогенных стероидных гормонов [3].
ПЭП классифицируются по принципу их действия [4]:
1. Средства, блокирующие Na+ каналы: дифенин, ламотриджин, топирамат, карбамазепин, натрия вальпроат.
2. Средства, блокирующие Ca2+ Т-типа: этосуксимид, триметин, натрия вальпроат.
3. Средства, активирующие ГАМК-ергическую систему: бензодиазепины, фенобарбитал, натрия вальпроат, вигабатрин, тиагабин.
4. Средства, понижающие активность глутаматергической системы: ламотриджин, топирамат.
Из данной классификации понятно, что некоторые препараты могут иметь несколько механизмов действия. Кроме того, ПЭП могут по-разному взаимодействовать с ферментами печени, тем самым влияя на метаболизм половых гормонов.
В зависимости от этого ПЭП подразделяются на несколько групп.
1. Фермент-индуцирующие препараты: карбамазепин, фенитоин, фенобарбитал и примидон являются индукторами ферментов широкого спектра действия, поскольку они стимулируют активность многих ферментов цитохрома Р-450 (CYP), а также уридин-глюкуронилтрансфераз (УГТ) и эпоксидгидролазы. Окскарбазепин, эсликарбазепина ацетат, фелбамат, руфинамид, топирамат (в дозах >200 мг/сут/) обладают более слабыми фермент-индуцирующими свойствами и могут стимулировать более ограниченный диапазон CYP и/или УГТ изоферментов [5].
2. Фермент-ингибирующие препараты: среди часто используемых ПЭП вальпроевая кислота может считаться ингибитором ферментов широкого спектра действия, поскольку она ингибирует активность ферментов UGT (UGT1A4 и UGT2B7), а также CYP2C9 и в меньшей степени CYP2C19 и CYP3A4 [5].
3. Неэнзиминдуцирующие препараты: бензодиазепины, габапентин, леветирацетам, ламотриджин, тиагабин, вигабатрин, зонизамид, прегабалин, лакозамид, клобазам, топирамат в дозе менее 200 мг/сут. Эти препараты не метаболизируются системой цитохрома P-450 [6].
Метаболизм половых гормонов происходит в два этапа: первый включает окисление, восстановление, гидролиз; второй включает глюкуронирование, ацетилирование, присоединение глутатиона. Трансформация концентрации ключевых ферментов изменяет скорость метаболизма половых гормонов. Реакции первого этапа протекают с помощью группы изоферментов цитохрома Р-450 (CYP450). Таким, понимание данных процессов необходимо для оценки влияния ПЭП на процесс метаболизма половых гормонов путем индукции экспрессии генов семейства CYP [7].
Фермент-индуцирующие препараты
Предположение, что изменение уровней половых гормонов в сыворотке крови женщин, страд.
Детские формы антиэпилептических препаратов
Информация только для специалистов в сфере медицины, фармации и здравоохранения!

Противоэпилептические препараты, появившиеся в 70-х годах прошлого века, разрешены для применения в любом возрасте. Однако способ их применения у детей отличается от такового у взрослых: для поддержания терапевтической концентрации, из-за особенностей обмена веществ, детям часто нужны более высокие дозировки на кг массы тела. К тому же у детей иная структура эпилепсий. В связи с этим появилась потребность в разработке специальных детских лекарственных форм.
Для новых противоэпилептических препаратов установлен порядок регистрации. Сначала лекарство регистрируют как дополнительный препарат для применения у взрослых, а затем, по мере накопления опыта, препарат регистрируют и для детей разных возрастных групп в качестве дополнительной терапии или монотерапии. По мере регистрации, соответственно, разрабатываются новые, в том числе детские, лекарственные формы.
Лекарственные формы противоэпилептических препаратов, предназначенные для детей, должны соответствовать следующим требованиям:
· легко дозироваться при назначении детям с небольшой массой тела. Это особенно важно в том случае, когда препарат требует медленной титрации от начальной дозы к терапевтической (карбамазепин, ламотриджин, топирамат), и необходимо повышать дозу с меньшим шагом в мг по сравнению со взрослым пациентом;
· обладать приятным вкусом;
· быть удобными для приема (в идеале, детская лекарственная форма должна допускать прием 1-2 раза в сутки, как и форма для взрослого пациента);
· быть биоэквивалентными препаратам для взрослых.
В настоящее время используются следующие детские или допустимые для применения у детей лекарственные формы противоэпилептических препаратов:
· сиропы и суспензии;
· растворы для орального приема, капли;
· таблетки с меньшим, по сравнению с формами для взрослых, количеством действующего вещества, в том числе жевательные и растворимые;
· специальные лекарственные формы для приема с пищей.
Последние лекарственные формы наиболее перспективны, так как по своим фармакокинетическим показателям приближаются к таблеткам для взрослых.
Сноска 1. Специальные лекарственные формы для приема с пищей наиболее перспективны, так как по своим фармакокинетическим показателям приближаются к таблеткам для взрослых.
Показанием для применения детских лекарственных форм у взрослых являются трудности с глотанием у больных эпилепсией.
Вальпроаты
Препараты вальпроевой кислоты применяются начиная с первого года жизни ребенка. Они показаны при любых формах эпилепсии, а также могут использоваться для профилактики повторных фебрильных судорог в тех случаях, когда интермиттирующая терапия недостаточно эффективна. Суточные дозы вальпроата у детей выше, чем у взрослых: средняя доза у детей младшего возраста составляет 15-45 мг, у детей старшего возраста и взрослых – 15-30 мг, максимальная – до 60 мг на кг массы тела. При применении доз выше средних рекомендуется проводить измерение концентрации препарата в крови, а также контролировать возникновение возможных побочных эффектов.
В Российской Федерации к применению у детей разрешены следующие лекарственные формы препаратов вальпроевой кислоты: сиропы депакин и конвулекс, капли конвулекс, ожидается появление препарата депакин хроносфера.
Депакин сироп (компании Sanofi-aventis) со вкусом вишни содержит в 1 мл 57,64 мг вальпроата натрия. В качестве подсластителя используется сахароза, что следует учитывать, если пациент находится на кетогенной диете. Для дозирования используется двойная мерная ложка с объемами, соответствующими дозам 100 и 200 мг.
Конвулекс сироп со вкусом малины и персика (компании Gerot Lannaher) содержит в 1 мл 50 мг вальпроата натрия. В качестве подсластителя используются натрия сахарин и натрия цикламат, что делает препарат более удобным при применении у детей, находящихся на кетогенной диете или страдающих сахарным диабетом. Для дозирования используется мерный стаканчик.
При дозировании вальпроата в форме сиропа на практике родители часто используют обычный или дозировочный шприц, которым иногда комплектуются сиропы детских жаропонижающих средств. Оценивая дозу препарата, которую получает ребенок, в этом случае следует помнить, что в 1 мл сиропов разных фирм содержится разное количество вальпроата натрия.
Сноска 2. Оценивая дозу препарата, которую получает ребенок, следует помнить, что в 1 мл сиропов разных фирм содержится разное количество вальпроата натрия.
Все сиропы имеют общий недостаток - содержат большое количество вспомогательных веществ: подсластителей, вкусовых добавок, ароматизаторов. Этого недостатка лишен конвулекс в каплях для приема внутрь, содержащий 300 мг вальпроата натрия в 1 мл очищенной воды. Препарат не содержит других вспомогательных веществ, что снижает риск развития аллергической реакции на компоненты лекарственной формы. В одной капле содержится 10 мг вальпроата натрия. Препарат очень удобен для точного подбора дозы у младенца.
Выбор жидкой формы вальпроата определяется и вкусовыми предпочтениями маленького пациента. У некоторых младенцев сиропы могут вызывать срыгивание, и тогда предпочтительнее использовать капли, а детям постарше, наоборот, вкус чистого вальпроата натрия может не понравиться, и в этом случае назначают сироп.
Основным недостатком жидких форм вальпроата является необходимость применения 3 раза в сутки через равные промежутки времени. Пока ребенок маленький и постоянно находится под контролем у матери, это не вызывает затруднений, но как только возникает необходимость посещения детского учреждения, требуется переход на лекарственную форму, допускающую двукратный прием. Особенности фармакокинетики вальпроатов в зависимости от лекарственной формы представлены в таблице.
Таблица. Время достижения пика концентрации у различных форм депакина [1]
Лекарственная форма
Время достижения пика концентрации
Сироп, капсулы*, таблетки без оболочки*
2-3 ч после приема
Таблетки с кишечнорастворимой оболочкой (депакин энтерик)
3-5 ч после приема
5-10 ч после приема
* Данные лекарственные формы сняты с производства.
Кишечнорастворимая форма вальпроата (депакин энтерик, конвулекс в капсулах) предназначена для снижения действия вальпроата на желудок у чувствительных к нему пациентов. Препарат назначается 2-3 раза в сутки, и его можно использовать только в том случае, если расчетная суточная доза препарата составляет 600 мг и выше, в противном случае необходимо применять либо жидкую, либо ретардированную форму. Кишечнорастворимые таблетки необходимо глотать целиком. Назначение ребенку половины таблетки является ошибкой, так как разрушение оболочки лишает препарат защитных свойств, а фармакокинетические параметры могут отличаться от установленных для целой таблетки.
Сноска 3. Кишечнорастворимые таблетки необходимо глотать целиком. Назначение ребенку половины таблетки является ошибкой.
Максимальная концентрация значительно ниже при применении ретардированных форм, что снижает размах колебаний концентрации препарата в плазме во время лечения. Ретардированные формы вальпроата (депакин хроно, конвулекс, таблетки пролонгированного действия) являются делимыми и легко ломаются по риске пополам, таким образом, минимальная разовая доза вальпроата составляет 150 мг. Делить таблетку на 3 и более частей не рекомендуется, так как это может привести к ошибке в дозировании. Ретардированные формы вальпроата можно применять 1-2 раза в день, однако не рекомендуется их применение у детей с массой тела менее 17 кг.
Перспективной лекарственной формой, позволяющей совместить легкость применения с самого раннего возраста со свойствами препарата пролонгированного действия, является депакин хроносфера.
Депакин хроносфера представляет собой сыпучие гранулы пролонгированного действия диаметром около 400 µm, содержащие смесь вальпроата натрия и вальпроевой кислоты по 100, 250, 500, 750 и 1000 мг в пересчете на вальпроевую кислоту и расфасованные в трехслойные пакетики. Пакетики имеют цветовую кодировку. Суточная доза принимается в один или два приема. Содержимое пакетика высыпается на поверхность мягкой пищи или жидкости (йогурт, сок) холодной или комнатной температуры и проглатывается не разжевывая. Препарат депакин хроносфера можно назначать и взрослым пациентам, однако в первую очередь он хорошо подходит детям и людям с затрудненным глотанием.
Препарат биоэквивалентен таблеткам депакина хроно. Прием пищи не влияет на биодоступность препарата. Маленький размер гранул повышает площадь контакта препарата с мембранами слизистой оболочки, что снижает концентрацию препарата на единицу поверхности и теоретически при клиническом применении должно приводить к улучшению переносимости со стороны желудочно-кишечного тракта по сравнению с другими формами выпуска вальпроатов.
Особенностью побочных действий вальпроата у детей является более высокий риск развития вальпроевой гепатопатии и энцефалопатии, в особенности при политерапии. В качестве антидота назначается L-карнитин [1]. Вальпроат противопоказан при митохондриальных болезнях.
Ламотриджин
Ламотриджин - ламиктал (компании GSK), ламолеп (компании Gedeon-Richter) разрешен для применения у взрослых и детей с 12 лет для лечения эпилепсии с парциальными и генерализованными припадками, включая тонико-клонические судороги, а также припадки при синдроме Леннокса-Гасто в составе комбинированной терапии или монотерапии. У детей от 2 до 12 лет показания для применения препарата те же, однако начинать лечение ламотриджином надо в составе комбинированной терапии, в случае успеха переходя к монотерапии.
В качестве первичной монотерапии у ребенка от 2 до 12 лет ламотриджин может быть назначен для лечения типичных абсансов.
Ламотриджин часто назначается в качестве второго препарата пациенту, получающему один из препаратов вальпроевой кислоты, что создает определенные трудности при титрации дозы маленьким детям. Строго следовать схеме титрования дозы необходимо для снижения риска развития синдромов Стивенса-Джонсона и Лайелла, при этом рекомендована доза 0,15 мг на кг массы тела 1 раз в сутки в 1-2 недели. Жевательные/растворимые таблетки ламиктала (компании GSK), содержащие 5 мг ламотриджина, являются единственной детской формой ламотриджина. Если рассчитанная суточная доза у пациентов, принимающих препараты вальпроевой кислоты, составляет 2,5-5 мг (то есть вес ребенка составляет не менее 16 кг), то таблетки ламикталапо 5 мг можно принимать через день в течение первых 2 недель. Если рассчитанная суточная доза у пациентов, принимающих препараты вальпроевой кислоты, менее 2,5 мг, ламиктал назначать не следует.
При сочетании ламотриджина с вальпроатом у детей, по сравнению со взрослыми, более высок риск развития сыпи [2]. Медленная титрация снижает риск развития тяжелых сыпей, не влияя на общую частоту их возникновения [2]. Если при применении ламотриджина сыпь не появилась к моменту окончания титрации дозы, то в дальнейшем риск появления кожных осложнений минимален.
Карбамазепин
Карбамазепин - тегретол (компании Novartis Pharma), финлепсин (компании AWD) можно назначать детям начиная с первого года жизни. Препарат используют для лечения эпилепсии: сложных или простых парциальных эпилептических приступов (с потерей или без потери сознания)? с вторичной генерализацией или без нее, а также для купирования генерализованных тонико-клонических приступов. Карбамазепин противопоказан при абсансах и миоклонических приступах. Для детей препарат выпускается в форме сиропа тегретола, содержащего в 5 мл 100 мг карбамазепина. В качестве подсластителя используется натрия сахарин. Целесообразно делить суточную дозу сиропа на 2-3 приема, а для детей более старшего возраста предпочтительнее использовать ретардированные формы карбамазепина. Для того, чтобы избежать дозозависимых побочных эффектов, рекомендуется медленно титровать дозу.
Окскарбазепин
Окскарбазепин — трилептал (компании Novartis Pharma) показан для лечения простых и сложных парциальных эпилептических приступов с вторичной генерализацией или без нее у детей в возрасте от 1 месяца и старше и взрослых и для лечения генерализованных тонико-клонических приступов у взрослых и детей в возрасте от 2 лет и старше. Препарат можно использовать для проведения монотерапии, в том числе первой, или в составе комбинированной терапии [3].
Трилептал для детей выпускается в форме суспензии для приема внутрь, содержащей в 1 мл 60 мг окскарбазепина, во флаконах по 100 или 250 мл в комплекте с дозировочным шприцем. В качестве подсластителя используется натрия сахарин.
Детям более старшего возраста можно назначать таблетированную форму трилептала, выпускаемого по 150, 300, 600 мг. Таблетки делятся по риске, и, таким образом, минимальная разовая доза трилептала в таблетках составляет 75 мг. Дозы сиропа и таблеток эквивалентны, поэтому независимо от формы выпуска препарат назначают 2 раза в сутки.
Топирамат
Топирамат разрешен к применению у детей старше 2 лет и взрослых как в качестве монотерапии (в том числе для лечения впервые диагностированной эпилепсии), так и в составе комбинированной терапии для лечения парциальных или генерализованных тонико-клонических припадков и припадков, связанных с синдромом Леннокса-Гасто. Препарат требует постепенного титрования дозы. Лечение детей начинают с дозы 0,5-1 мг на кг массы тела перед сном. Через 1-2 недели добавляют аналогичную утреннюю дозу, затем дозу повышают с интервалом в 1-2 недели на 0,5-1 мг на кг массы тела в сутки. При непереносимости такого режима дозу можно повышать на меньшую величину или увеличивать интервалы. Медленное титрование препарата снижает риск развития побочных действий со стороны ЦНС. Величина дозы и скорость ее повышения определяются клинической эффективностью терапии. При монотерапии топираматом у детей старше 2 лет рекомендуемый диапазон доз составляет 3-6 мг на кг массы тела в сутки. До последнего времени не было лекарственной формы, позволяющей титровать дозу у детей младшего возраста, так как таблетки топамакса неделимы, а минимальный размер таблетки топирамата (топамакса, тореала) составлял 25 мг. Но недавно компания Janssen-Cilag, производящая топамакс, зарегистрировала новую лекарственную форму: капсулы по 15, 25 или 50 мг. В капсуле содержатся гранулы, предназначенные для посыпания небольшого количества мягкой пищи, например йогурта. Содержимое капсулы высыпается на продукт непосредственно перед употреблением. Также капсулу можно проглотить целиком. Топамакс вне зависимости от лекарственной формы назначают 2 раза в сутки.
К побочным действиям, возникающим преимущественно у детей, относятся изменение поведения, необучаемость, а также олигогидроз, который может приводить к длительному субфебрилитету и требует отмены препарата.
Леветирацетам
В 2008 г. была снижена граница возраста, с которого разрешено применять леветирацетам — кеппру (компании ЮСБ). На сегодняшний день препарат показан в качестве монотерапии (в том числе первичной) при лечении парциальных припадков со вторичной генерализацией или без таковой у подростков старше 16 лет и взрослых со вновь диагностированной эпилепсией, а также в составе комплексной терапии при лечении парциальных припадков со вторичной генерализацией или без таковой у детей старше 4 лет и взрослых, миоклонических судорог у взрослых и у подростков старше 12 лет с ювенильной миоклонической эпилепсией, и первично-генерализованных тонико-клонических припадков у подростков старше 12 лет и взрослых с идиопатической генерализованной эпилепсией.
Габапентин
Габапентин - нейронтин (компании Pfizer), тебантин (компании Gedeon Richter), конвалис (компании «Лекко») показан как препарат для лечения нейропатической боли у взрослых в возрасте 18 лет и старше; для монотерапии парциальных приступов с вторичной генерализацией и без нее у детей в возрасте старше 12 лет и взрослых; как дополнительное средство при лечении парциальных судорог с вторичной генерализацией и без нее у детей в возрасте 3 лет и старше и взрослых.
Другие препараты
Этосуксимид (суксилеп (компании Jenapharm)) применяется для лечения пикнолептических абсансов, миоклонико-астатических приступов, миоклоний при юношеской миоклонической эпилепсии. Препарат также эффективен при негативном миоклонусе и может быть использован при явлении вторичной билатеральной синхронизации на ЭЭГ. Для детей рекомендованная дозировка составляет 20-40 мг, для взрослых – 10-30 мг/кг массы тела в сутки. В России представлена единственная лекарственная форма - суксилеп в виде капсул, содержащих 250 мг действующего вещества, по 120 капсул во флаконе. Капсулы рекомендуется проглатывать целиком, запивая водой. Кратность приема – 1-3 раза в сутки, в зависимости от переносимости однократной дозы. Капсулы рекомендуется назначать детям с 6 лет и старше. Детям более младшего возраста этосуксимид назначают в виде жидкой лекарственной формы, однако в настоящее время на российском фармацевтическом рынке такая форма отсутствует.
Фенобарбитал применяют при неонатальных судорогах у детей с первых дней жизни, кроме того, его свойство сильного индуктора микросомальных ферментов печени позволяет использовать его для лечения желтухи новорожденных. Большой период полувыведения позволяет назначать препарат 1-2 раза в день. Рекомендованная суточная доза фенобарбитала составляет 1-5 мг/кг массы тела. В качестве лекарственных форм для детей раньше использовали порошки на заказ и таблетки, содержащие 5 мг фенобарбитала. Однако в последние десятилетия применение фенобарбитала в детской эпилептологии ограничено из-за развития когнитивных побочных эффектов. То же самое касается и других барбитуратов (бензонала, примидона). Также крайне редко детям назначается применявшийся ранее в составе смесей с фенобарбиталом и вспомогательными веществами фенитоин (дифенин).
Заключение
Первыми детскими формами противоэпилептических препаратов были прописи для изготовления порошков на заказ с детскими дозировками, например, популярные в прошлом смеси Серейского и Воробьева, адаптированные для детей. Затем появились таблетки с детскими дозировками, сиропы, суспензии и растворы. Наиболее современными детскими формами являются гранулы, предназначенные для приема с пищей. К достоинствам данных препаратов относится отсутствие неприятного вкуса, а также то, что их можно принимать два раза в сутки. На сегодняшний день таких форм две: депакин хроносфера и топамакс в капсулах.
Сноска 4. Наиболее современными детскими формами являются гранулы, предназначенные для приема с пищей. На сегодняшний день таких форм две: депакин хроносфера и топамакс в капсулах.
Повышению эффективности лечения, улучшению переносимости препарата и снижению риска некомплаентности способствуют правильный выбор лекарственной формы для ребенка с учетом его возраста, вкусовых предпочтений, риска развития аллергической реакции, а также подбор схемы приема препарата в соответствии с его фармакокинетическими параметрами.
1. Perucca E. Pharmakological and therapeutic properties of valproate. A summary after 35 year of clinical experience. / CNS Drugs 2002; 16(10): 695-714.
3. Белоусова Е.Д., Трифонова О.Е. Дорофеева М.Ю. Трилептал в лечении эпилепсии у детей. / Вестник педиатрической фармакологии и нутрициологии, 2007, Т. 4,4, С:40-44.
Антиконвульсанты: классификация и механизмы действия
По современному определению Международной противоэпилептической лиги и Международного бюро по эпилепсии 2005 г. (ILAE, IBE, 2005), «эпилепсия — это расстройство (заболевание) головного мозга, характеризующееся стойкой предрасположенностью к генерации (развитию) эпилептических припадков, а также нейробиологическими, когнитивными, психологическими и социальными последствиями этого состояния». Эпилепсия является одним из наиболее распространенных заболеваний нервной системы. Во всем мире распространенность эпилепсии составляет 4–10/1000 человек, что соответствует 0,5–1,0 % в популяции. [1]
В Международной классификации эпилептических припадков выделяют два основных вида: генерализованные и парциальные. К генерализованным относятся тонико-клонические, тонические, клонические, миоклонические припадки и абсансы; к парциальным — простые, сложные и вторично-генерализованные. Однако большое разнообразие припадков не всегда позволяет отнести их к одному из этих видов приступов, поэтому выделена еще одна рубрика — «неклассифицированные» припадки, к которым относят 9–15 % припадков. [2] В настоящее время для дифференцирования приступов пользуются классификацией, принятой в 1981 году в Киото, Япония. Умение правильно дифференцировать приступы — необходимый компонент рационального подбора противосудорожной терапии.
Классификация форм эпилепсии весьма обширна, однако глобально можно разделить всю эпилепсию в соответствии с этиологией на:
1. Идиопатическую (генетическая (наследственная) предрасположенность при отсутствии других возможных причин заболевания); [3]
2. Симптоматическую (причиной развития заболевания становится повреждение головного мозга вследствие различных факторов, действующих во время беременности и после родов: пороки развития головного мозга (преимущественно пороки развития коры большого мозга — кортикальные дисплазии); внутриутробные инфекции; хромосомные синдромы; наследственные болезни обмена веществ; гипоксически-ишемическое поражение мозга в перинатальном периоде (во время родов, в последние недели беременности, в первую неделю жизни ребенка); инфекционные заболевания нервной системы (менингиты, менингоэнцефалиты); черепно-мозговая травма; опухоли, дегенеративные заболевания нервной системы); [3]
3. Криптогенную (эпилептические синдромы, этиология которых неизвестна или неясна. Само слово «криптогенный» переводится как тайный, скрытый. Данные синдромы еще не удовлетворяют требованиям идиопатической разновидности, однако они не могут быть причислены и к симптоматической эпилепсии).
Механизм действия противосудорожных препаратов (антиконвульсантов) до конца не изучен. Во многом это объясняется недостаточной изученностью эпилепсии как таковой, поскольку зачастую причину судорожных приступов выяснить не удается.
Важное значение в развитии эпилептогенной активности головного мозга имеет нарушение баланса между тормозными (ГАМК, глицин) и возбуждающими нейромедиаторами (глутамат, аспартат). Для возбуждающих аминокислот имеются специфические рецепторы в головном мозге — NMDA- и АМРА-рецепторы, связанные в нейронах с быстрыми натриевыми каналами. Установлено, что содержание глутамата в тканях мозга в области эпилептогенного очага увеличено. Вместе с тем, содержание ГАМК в тканях мозга больных эпилепсией понижено. [4]
Классифицируют противоэпилептические средства, обычно, исходя из их применения при определенных формах эпилепсии: [4]
I. Генерализованные формы эпилепсии
- Большие судорожные припадки (grand mal; тонико-клонические судороги):
Натрия вальпроат. Ламотриджин, Дифенин, Топирамат,
Карбамазепин, Фенобарбитал, Гексамидин.
- Эпилептический статус:
Диазепам, Клоназепам, Дифенин-натрий,
Лоразепам, Фенобарбитал-натрий, Средства для наркоза.
- Малые приступы эпилепсии (petit mal; absense epilepsia):
Этосуксимид, Клоназепам, Триметин,
Натрия вальпроат, Ламотриджин.
- Миоклонус-эпилепсия:
Клоназепам, Натрия вальпроат, Ламотриджин.
II. Фокальные (парциальные) формы эпилепсии
Карбамазепин, Ламотриджин, Клоназепам, Тиагабин,
Натрия вальпроат, Фенобарбитал, Топирамат, Вигабатрин,
Дифенин, Гексамидин, Габапентин.
Также существует классификация по “поколениям” препаратов:
I — Антиконвульсанты 1-го поколения
Фенобарбитал, Фенитоин, Карбамазепин,
Вальпроевая кислота, Этосуксимид.
II — Антиконвульсанты 2-го поколения
Фелбамат, Габапентин, Ламотриджин, Топирамат, Тиагабин,
Окскарбазепин, Леветирацетам, Зонизамид, Клобазам, Вигабатрин.
III — Антиконвульсанты 3-го поколения (новейшие, многие в стадии клинического исследования)
Бриварацетам, Валроцемид, Ганаксолон, Караберсат, Карисбамат, Лакосамид, Лозигамон, Прегабалин, Ремацемид, Ретигабин, Руфинамид, Сафинамид, Селетрацетам, Соретолид, Стирипентол, Талампанел, Флуорофелбамат, Фосфенитоин, Эсликарбазепин, DP- вальпроевая кислота.
В настоящем посте будут рассматриваться основные препараты I и II поколений.
Кроме того, классифицировать противоэпилептические средства можно исходя из принципов их действия:
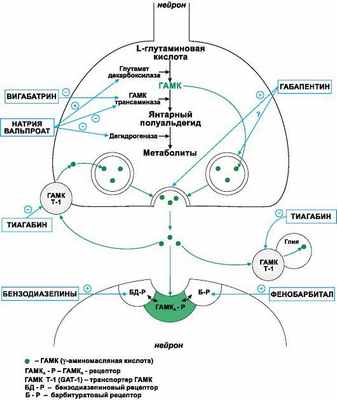
Рисунок 1. | Сайты действия различных препаратов на метаболизм ГАМК
I. Средства, блокирующие натриевые каналы:
Дифенин, Ламотриджин, Топирамат,
Карбамазепин, Натрия вальпроат.
II. Средства, блокирующие кальциевые каналы Т-типа:
Этосуксимид, Триметин, Натрия вальпроат.
III. Средства, активирующие ГАМК-ергическую систему:
1. Средства, повышающие аффинитет ГАМК к ГАМК-А-рецепторам Бензодиазепины, Фенобарбитал, Диазепам, Лоразепам, Клоназепам, Топирамат.
2. Средства, способствующие образованию ГАМК и препятствующие ее инактивации
Натрия вальпроат
3. Средства, препятствующие инактивации ГАМК
Вигабатрин
4. Средства, блокирующие нейрональный и глиальный захват ГАМК
Тиагабин
IV. Средства, понижающие активность глутаматергической системы:
1. Средства, уменьшающие высвобождение глутамата из пресинаптических окончаний
Ламотриджин
2. Средства, блокирующие глутаматные (АМPА) рецепторы
Топирамат
Блокаторы натриевых каналов
Карбамазепин (Тегретол, Финлепсин) является производным иминостильбена. Противосудорожное действие препарата обусловлено тем, что он блокирует натриевые каналы мембран нервных клеток и снижает способность нейронов поддерживать высокочастотную импульсацию, типичную для эпилептогенной активности; блокирует пресинаптические натриевые каналы и препятствует высвобождению медиатора. Препарат метаболизируется в печени, повышает скорость собственного метаболизма за счет индукции микросомальных ферментов печени. Один из метаболитов — карбамазепин-10,11-эпоксид — обладает противосудорожной, антидепрессивной и антиневралгической активностью. Выводится в основном почками (более 70 %). Побочные эффекты: потеря аппетита, тошнота, головная боль, сонливость, атаксия; нарушение аккомодации; диплопия, нарушения сердечного ритма, гипонатриемия, гипокальциемия, гепатит, аллергические реакции, лейкопения, тромбоцитопения, агранулоцитоз (требуется контроль картины крови). Существует риск развития тератогенного действия. Карбамазепин повышает скорость метаболизма, вследствие чего снижает в крови концентрацию некоторых лекарственных веществ, в том числе, противоэпилептических препаратов (клоназепама, ламотриджина, натрия вальпроата, этосуксимида и др.).
Фенитоин (Дифенин) является производным гидантоина. Противосудорожное действие: блокада натриевых каналов; уменьшение вхождения в нейроны ионов натрия; нарушение генерации и распространения высокочастотных разрядов; снижение возбудимости нейронов, препятствие их активации при поступлении к ним импульсов из эпилептогенного очага. Для предупреждения судорожных припадков фенитоин назначают внутрь в виде таблеток. Фенитоин-натрий применяют для купирования эпилептического статуса, вводят внутривенно.
Фенитоин интенсивно связывается с белками плазмы крови (на 90 %). Метаболизируется в печени, основной неактивный метаболит — 5-(п-гидроксифенил)-5-фенилгидантоин — подвергается конъюгации с глюкуроновой кислотой. В основном выводится из организма почками в виде метаболитов. Побочные эффекты: головокружение, возбуждение, тошнота, рвота, тремор, нистагм, атаксия, диплопия, гирсутизм; гиперплазия десен (особенно у молодых людей), снижение уровня фолатов и мегалобластная анемия, остеомаляция (связано с нарушением метаболизма витамина D), аллергические реакции и др. Отмечено тератогенное действие. Вызывает индукцию микросомальных ферментов в печени и таким образом ускоряет метаболизм ряда лекарственных веществ (кортикостероиды, эстрогены, теофиллин), повышает их концентрацию в крови.
Ламотриджин (Ламиктал) блокирует натриевые каналы мембран нейронов, а также уменьшает выделение глутамата из пресинаптических окончаний (что связывают с блокадой натриевых каналов пресинаптических мембран). Побочные эффекты: сонливость, диплопия, головная боль, атаксия, тремор, тошнота, кожные высыпания. [5]
Блокаторы кальциевых каналов Т-типа
Этосуксимид (Суксилеп) относится к химическому классу сукцинимидов, которые являются производными янтарной кислоты. Противосудорожное действие: блокирует кальциевые каналы Т-типа, участвующие в развитии эпилептической активности в таламокортикальной области. Является препаратом выбора для лечения абсансов. Метаболизируется в печени. В основном выводится из организма почками в виде метаболитов и около 20 % от введенной дозы — в неизмененном виде. Побочные эффекты: тошнота, рвота, дискинезия; головная боль, сонливость нарушения сна, снижение психической активности, состояние тревоги, аллергические реакции; редко — лейкопения, агранулоцитоз.
Механизм действия некоторых противоэпилептических средств включает несколько компонентов и не установлено, какой из них является преобладающим, вследствие чего эти препараты трудно отнести к одной из вышеприведенных групп. К таким препаратам можно отнести вальпроевую кислоту, топирамат.
Вальпроевая кислота (Ацедипрол, Апилепсин, Депакин) применяется также в виде вальпроата натрия. Противосудорожное действие: 1) блокирует натриевые каналы нейронов и снижает возбудимость нейронов в эпилептогенном очаге; 2) ингибирует фермент, метаболизирующий ГАМК (ГАМК-трансаминаза) + повышает активность фермента, который участвует в синтезе ГАМК (глутаматдекарбоксилаза); увеличивает содержание ГАМК в тканях головного мозга; 3) блокирует кальциевые каналы. Выводится главным образом почками в виде конъюгатов с глюкуроновой кислотой или в виде продуктов окисления. Побочные эффекты: тошнота, рвота, диарея, боли в желудке, атаксия, тремор, кожные аллергические реакции, диплопия, нистагм, анемия, тромбоцитопения, ухудшение свертываемости крови, сонливость. Препарат противопоказан при нарушении функции печени и поджелудочной железы.
Топирамат (Топамакс) обладает сложным, до конца не выясненным механизмом действия. Он блокирует натриевые каналы, а также увеличивает действие ГАМК на ГАМК-А-рецепторы. Снижает активность рецепторов возбуждающих аминокислот (предположительно, каинатных). Препарат используется для дополнительной терапии парциальных и генерализованных тонико-клонических судорог в сочетании с другими противоэпилептическими средствами. Побочные эффекты: сонливость, заторможенность, снижение аппетита (анорексия), диплопия, атаксия, тремор, тошнота. [5]
Средства, повышающие ГАМК-ергическую активность
Фенобарбитал (Люминал) взаимодействует со специфическими местами связывания (барбитуратными рецепторами), находящимися на ГАМК-А-рецепторном комплексе и, вызывая аллостерическую регуляцию ГАМК-А-рецептора, повышает его чувствительность к ГАМК. При этом увеличивается открытие хлорных каналов, связанных с ГАМК-А-рецептором, — больше ионов хлора поступает через мембрану нейрона в клетку и развивается гиперполяризация мембраны, что приводит к снижению возбудимости нейронов эпилептогенного очага. Кроме того, полагают, что фенобарбитал, взаимодействуя с мембраной нейрона, вызывает изменение ее проницаемости и для других ионов (натрия, калия, кальция), а также проявляет антагонизм в отношении глутамата. Метаболизируется в печени; неактивный метаболит (4-оксифенобарбитал) выделяется почками в виде глюкуронида, около 25 % — в неизмененном виде.
Побочные эффекты: гипотония, аллергические реакции (кожная сыпь), ощущение разбитости, сонливость, депрессия, атаксия, тошнота, рвота. Фенобарбитал вызывает выраженную индукцию микросомальных ферментов печени и поэтому ускоряет метаболизм лекарственных веществ, в том числе ускоряется метаболизм самого фенобарбитала. При повторных применениях вызывает развитие толерантности и лекарственной зависимости.
Бензодиазепины (Клоназепам) стимулируют бензодиазепиновые рецепторы ГАМК-А-рецепторного комплекса; повышается чувствительность ГАМК-А-рецепторов к ГАМК и происходит увеличение частоты открытия хлорных каналов, стимулируется поступление в клетку большего числа отрицательно заряженных ионов хлора, следствием чего является гиперполяризация нейрональной мембраны и усиление тормозных эффектов ГАМК. Побочные эффекты: усталость, головокружение, нарушение координации движений, мышечная слабость, депрессивные состояния, нарушения мышления и поведения, аллергические реакции (кожная сыпь). При длительном применении у детей клоназепам может вызвать нарушения умственного и физического развития. При парентеральном введении возможны угнетение дыхания (вплоть до апноэ), гипотензия, брадикардия. Вигабатрин (Сабрил) является структурным аналогом ГАМК и необратимо ингибирует ГАМК-трансаминазу, разрушающую ГАМК. Увеличивает содержание ГАМК в головном мозге. Вигабатрин обладает широким спектром противосудорожного действия, используется для профилактики больших судорожных припадков, эффективен при парциальных судорогах.
Габапентин (Нейронтин) создавался как липофильный структурный аналог ГАМК для стимуляции ГАМКА-рецепторов в головном мозге. Однако ГАМК-миметической активностью не обладает, но оказывает противосудорожное действие. Механизм действия не ясен, предполагается, что препарат способствует высвобождению ГАМК, не исключена возможность блокады транспортных систем возбуждающих аминокислот. Габапентин применяют как дополнение при лечении парциальных судорог. Препарат эффективен при нейропатических болях. Побочные эффекты: сонливость, головокружение, атаксия, тремор, головная боль. [5]
Читайте также:
