Нефротический синдром - причины, патогенез
Добавил пользователь Morpheus Обновлено: 28.01.2026
Нефротический синдром у детей: причины, диагностика
При нефротическом синдроме тяжёлая протеинурия приводит к снижению плазменного альбумина и отёкам. Причина состояния неизвестна, но некоторые случаи вторичны по отношению к системным заболеваниям типа пурпуры Шёнлейна-Геноха и другим васкулитам (например, СКВ), инфекционным заболеваниям (например, малярии) или аллергии (например, на укусы пчёл).
Клинические симптомы нефротического синдрома:
• периорбитальные отёки (особенно по утрам) — самый ранний признак;
• отёки мошонки, вульвы, ног и лодыжек;
• асцит;
• одышка из-за плеврального выпота и брюшного растяжения.
Стероидчувствительный нефротический синдром
У 85-90% детей с нефротическим синдромом протеинурия разрешается при проведении терапии глюкокортикоидами (стероидчувствительный нефротический синдром). У этих детей не развивается почечная недостаточность. Данный вариант более характерен для мальчиков, нежели для девочек, для азиатских детей, чем для представителей европеоидной расы. Выявлена слабая связь с атопией. Часто провоцируется инфекциями дыхательных путей. Особенности, наводящие на мысль о стероидчувствительном нефротическом синдроме:
• возраст от 1 до 10 лет;
• отсутствие макрогематурии;
• нормальное АД;
• нормальные уровни комплемента;
• нормальная функции почек.
Методы исследования детей при проявлении нефротического синдрома:
• Белок в моче — с помощью тест-полосок (экспресс-анализ).
• Полный анализ крови и СОЭ.
• Мочевина, электролиты, креатинин, альбумин.
• Уровни фракций комплемента — С3 и С4.
• Титры АСЛО и мазок из зева.
• Микроскопия и культуральное исследование мочи.
• Концентрация натрия в моче.
• Маркёры гепатита В.
Ведение детей с нефротическим синдромом
Наиболее широко используемый протокол подразумевает первоначальное применение пероральных глюкокортикоидов (60 мг/м2 в день в пересчёте на преднизолон), если нет атипичных симптомов. После 4 нед доза уменьшается до 40 мг/м2 в альтернирующем режиме в течение 4 нед и затем применение глюкокортикоидов прекращается. В среднем белок исчезает из мочи за 11 дней.
Однако имеются современные данные, что продление начального курса стероидов приблизительно до 6 мес с постепенным переходом на альтернирующий режим приёма ведёт к сокращению числа детей, у которых часто развиваются вторичные рецидивы или стероидзависимые формы, и эта схема всё более и более заменяет стандартный протокол.
У детей с нефротическим синдромом возможны несколько серьёзных осложнений при манифестации или рецидиве.
• Гиповолемия. В течение начальной стадии формирования отёков внутрисосудистый компартмент жидкости может уменьшаться. Ребёнок с гиповолемией, как правило, жалуется на абдоминальную боль и может чувствовать слабость. Возникают периферическая вазоконстрикция и задержка натрия мочи.
Увеличение периферических отёков, оценённых клинически и ежедневным взвешиванием, может причинить дискомфорт и приводить дыхательным нарушениям. Тяжёлые состояния, возможно, нуждаются в лечении с применением внутривенного альбумина. Необходимо следить за использованием коллоидов, поскольку могут возникнуть отёк лёгких и гипертензия от перегрузки объёмом, а также мочегонными средствами, которые могут сами вызвать или ухудшить гиповолемию.
• Тромбоз. Состояние гиперкоагуляции из-за потери антитромбина с мочой, тромбоцитоз, который может быть усилен стероидной терапией, усиленный синтез факторов свёртывания и увеличение вязкости крови вследствие повышенного гематокрита предрасполагают к тромбозу. Возникает, как правило, артериальный тромбоз, который может затронуть мозговое, висцеральное кровообращение и кровоснабжение конечностей с потенциально катастрофическими последствиями.
• Инфекционные осложнения. Дети с рецидивами находятся в группе риска из-за опасности развития инфекции капсулированными бактериями, особенно Pneumococcus. Может развиться перитонит.
• Гиперхолестеринемия (гиперлипидемия). Состояние коррелирует обратно пропорционально относительно содержания альбуминов сыворотки, но причина гиперлипидемии полностью не понятна.
Прогноз нефротического синдрома у детей
Рецидивы идентифицированы родителями при тестировании мочи. Побочные эффекты терапии кортикостероидами можно уменьшить переходом на альтернирующий режим. Если рецидивы возникают часто или требуется высокодозная терапия, желательно привлечение детского нефролога, поскольку необходимо рассмотреть возможность лечения другими препаратами. Левамизол как иммуномодулятор может поддерживать ремиссию. Восьминедельный курс алкилирующими агентами (например, циклофосфамидом или хлорамбуцилом) поддерживает ремиссию у 25-30% детей со стероидозависимыми формами в течение 2 лет.
Циклоспорин поддерживает ремиссию приблизительно у 75% пациентов до тех пор, пока принимается пациентами, но почти всегда возникают рецидивы, когда приём препарата прекращается. На микофенолата мофетил возлагаются большие надежды.
Прогноз гормонорезистентного нефротического синдрома. Эти дети должны быть переданы под наблюдение детского нефролога. Коррекция отёков проводится мочегонной терапией, ограничением соли, ингибиторами АПФ и иногда НПВС, которые могут уменьшить протеинурию.
Прогноз врожденного нефротического синдрома. Врождённый нефротический синдром проявляется в первые 3 мес жизни. Он встречается редко. Наиболее распространённая форма наследуется рецессивно, частота встречаемости гена наиболее высокая в финской популяции. Состояние сопровождается высокой смертностью обычно из-за осложнений в форме гипоальбуминемии, а не почечной недостаточности. Развивающаяся альбуминурия настолько тяжёлая, что для её контроля порой необходима двусторонняя нефрэктомия, что неизбежно вызывает потребности в диализе, который продолжается до тех пор, пока ребёнок не вырастет и не возникнут условия для трансплантации почек.
Нефротический синдром:
• Клинические симптомы — отёк (периорбитальный, мошонки или вульвы, ног и лодыжек), асцит, плевральный выпот.
• Диагноз выставляется на основании массивной протеинурии и низкого уровня альбуминов в плазме.
Стероидочувствительный нефротический синдром:
• Характерные особенности — проявление в возрасте 1-10 лет, отсутствие макрогематурии и АГ, фракции комплемента и функциональные пробы почек в пределах нормы.
• Лечение — пероральные глюкокортикоиды, биопсия почек проводится при отрицательном ответе на терапию и атипичном течении.
• Осложнения — гиповолемия, тромбоз, инфекция (чаще пневмококковая), гиперхолестеринемия (гиперлипидемия).
• Прогноз — может наступить полное выздоровление. В противном случае наблюдаются рецидивы, как частые, так и редкие.
Если ребёнок страдает отёками, проверьте его на протеинурию, чтобы диагностировать нефротический синдром.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Нефротический синдром у детей
Нефротический синдром у детей — это симптомокомплекс, который клинически проявляется отеками и снижением диуреза. Лабораторные признаки патологии — протеинурия, гиперлипидемия, гипоальбуминемия и диспротеинемия. Синдром развивается при первичных гломерулопатиях, аутоиммунных, онкогематологических и сердечно-сосудистых заболеваниях. Для диагностики проводят анализы крови и мочи, биопсию почки, ЭхоКГ и ЭКГ. Лечение включает длительные курсы иммуносупрессорной терапии (глюкокортикоиды, алкилирующие агенты, ингибиторы кальциневрина) в комбинации с нефропротекторными, гипотензивными и мочегонными препаратами.
МКБ-10

Общие сведения
Распространенность нефротического синдрома составляет 12-16 случаев на 100 тыс. детского населения. Ежегодно нефрологи выявляют от 2 до 7 новых случаев заболевания на 100 тысяч пациентов младше 18 лет. Патология не относится к самостоятельным нозологическим единицам, а представляет собой один из синдромов почечных или внепочечных болезней. Актуальность этой проблемы в педиатрической практике обусловлена сложностью терапии и частыми случаями резистентности к лекарствам.

Причины
У детей чаще выявляются первичные формы нефротического синдрома, вызванные поражением клубочкового аппарата почек. В 85% морфологическим субстратом является болезнь минимальных изменений, до 5-7% составляет фокально-сегментарный гломерулосклероз, 4-6% отводится мезангиопролиферативному гломерулонефриту. Вторичный вариант заболевания имеет несколько этиологических факторов:
- Аутоиммунные процессы. Они сопровождаются образованием иммунных комплексов и провоспалительных цитокинов, которые откладываются в почечных капиллярах, нарушая работу фильтрационной системы органа. У детей причиной могут послужить системные васкулиты, системная красная волчанка, синдром Шегрена.
- Злокачественные опухоли. Почечные поражения возникают при лимфоме Ходжкина и неходжкинских новообразованиях, которые зачастую встречаются в детском возрасте. Среди менее распространенных онкологических факторов выделяют множественную миелому, солидные опухоли.
- Токсические повреждения почек. Нефротический синдром возможен при длительном и бесконтрольном приеме ребенком нестероидных противовоспалительных средств и некоторых антибиотиков. Поражение почек также наблюдается при отравлении солями тяжелых металлов, ядами змей и перепончатокрылых насекомых.
- Нарушения почечного кровотока. Повышенная секреция белка в мочу происходит при структурных повреждениях почечных клубочков на фоне тотальной ишемии. Она может быть вызвана тромбозом почечной вены, серповидно-клеточной анемией, злокачественной гипертензией.
- Врожденные гломерулопатии. У детей встречается синдром Альпорта, для которого характерны мутации коллагеновых волокон в базальных мембранах клубочков. Реже диагностируется болезнь Фабри, когда нефропатия связана с нарушениями метаболизма сфинголипидов.
Патогенез
На начальных этапах нефротического синдрома развивается протеинурия, вызванная повышением проницаемости почечного фильтра для белков. Это обусловлено структурно-функциональными повреждениями компонентов почечного клубочка. Большую роль в этом процессе имеют аутоиммунные механизмы: активированные Т-лимфоциты вырабатывают специфические цитокины, которые повреждают клеточные мембраны и «щелевые» контакты подоцитов.
Повышенная потеря белков с мочой снижает онкотический показатель крови. Как следствие, жидкость по градиенту давления начинает перемещаться из сосудистого русла в ткани. Таким образом формируются массивные нефротические отеки. Их интенсивность зависит от степени белковых потерь и активности компенсаторных механизмов. В 10% случаев отечный синдром развивается вследствие первичной задержки натрия в организме.
Симптомы
Для патологии типично острое начало, связь с перенесенной инфекцией, переохлаждением, вакцинацией или обострением хронической соматической болезни. Сначала ребенок жалуется на общую слабость, недомогание, сонливость и заторможенность. Реже беспокоят головные и абдоминальные боли, тошнота, снижение аппетита. У девочек-подростков бывают нарушения менструального цикла.
Основное проявление нефротического синдрома — отеки. Вначале они возникают на лице (утром) и на голенях (вечером, после длительной ходьбы), а затем постепенно распространяются по всему телу. Первоначально они мягкие, расположены симметрично, кожа над ними теплая и сухая. Параллельно с этим снижается количество суточной мочи. Периферические отеки дополняются полостными — асцитом, гидроперикардом, гидротораксом, что ухудшает состояние ребенка.
Осложнения
Негативные последствия нефротического синдрома вызваны потерей альбуминов, которые в норме выполняют ряд физиологических функций. Потеря иммуноглобулинов ухудшает иммунную защиту организма, что проявляется частыми респираторными инфекциями, рецидивирующими тонзиллитами и синуситами. Снижение количества трансферрина (переносчика железа) приводит к рефрактерной железодефицитной анемии.
Значимым осложнением для детей младшего возраста является потеря витамин-Д-связывающего белка. В результате формируется рахитоподобный синдром, нарушается минерализация и рост костей скелета. В редких случаях развивается повышенная кровоточивость из-за дефицита прокоагулянтов. При стероидорезистентном варианте болезнь в течение 5-10 лет прогрессирует до терминальной ХПН.
Диагностика
При физикальном осмотре детский нефролог обращает внимание на симметричность и расположение отеков, проводит аускультацию сердца и легких, определяет признаки асцита и увеличения печени. Симптомы не дают возможности установить клинический диагноз, поэтому врач назначает полное обследование. Составляющие диагностического комплекса:
- Анализ мочи. Патогномоничными признаками нефротического синдрома являются протеинурия более 50 мг/кг/сутки, соотношение протеин/креатинин более 2 и экскреция альбумина свыше 40мг/м 2 /час. Для исключения эритроцитурии и лейкоцитурии показан анализ по Нечипоренко. Функцию почек оценивают с помощью пробы Реберга.
- Анализ крови. При биохимическом исследовании выявляют уровень альбумина сыворотки менее 30 г/л, повышение уровня холестерина и триглицеридов, увеличение показателя креатинина. Уровни натрия и кальция крови снижаются, а калий может быть повышен. В коагулограмме наблюдается повышение фибриногена.
- ЭхоКГ. Ультразвуковая визуализация необходима для обнаружения гидроперикарда, морфометрических изменений крупных сосудов вследствие отеков. Также рекомендована ЭКГ, которая позволяет вовремя заметить нарушения ритма и проводимости, связанные с электролитными нарушениями.
- Биопсия почки. Пункционный забор материала выполняется при нефротическом синдроме у младенцев до 1 года и подростков старше 12 лет, а также при неэффективности стандартной медикаментозной терапии. Биоптаты подвергают световой, электронной и иммунофлюоресцентной микроскопии.
Лечение нефротического синдрома у детей
Дети с острым нефротическим синдромом подлежат обязательной госпитализации на 2-3 недели. Двигательная активность при этом не ограничивается и соответствует самочувствию больного. В диете необходимо поддерживать высокий уровень белков, а подросткам с массивными отеками рекомендовано снизить потребление поваренной соли. При выраженных потерях протеинов назначается коррекция гомеостаза коллоидными и кристаллоидными растворами.
Основу патогенетического лечения детей с нефротическим синдромом составляет иммуносупрессивная терапия с применением глюкокортикоидов. Препараты уменьшают образование и поступление в патологический очаг воспалительных клеток, угнетают секрецию медиаторов воспаления, приостанавливают формирование токсических иммунных комплексов. Терапия глюкокортикоидами проводится в 3-х режимах:
- Постоянный. Показан в начале лечения, чтобы быстро достичь фазы ремиссии. Гормоны принимаются перорально в первой половине дня в суточной дозировке 1-2 мг/кг.
- Альтернирующий. Назначается после достижения ремиссии. Стандартные дозы глюкокортикоидов используются через день, чтобы сохранить клинический эффект, но снизить риски побочных реакций.
- Пульс-терапия. Применяется при тяжелом течении нефротического синдрома. Гормоны вводятся внутривенно капельно, чтобы в короткие сроки достичь высоких концентраций лекарства в крови.
При развитии тяжелых побочных эффектов на гормональные препараты или стероидорезистентном варианте заболевания переходят на другие виды иммуносупрессоров. В детской нефрологии наилучший результат показывают ингибиторы кальциневрина, алкилирующие агенты, некоторые моноклональные антитела к лимфоцитам. Они могут вызывать нефротоксичность, поэтому во время лечения врачи контролируют уровень СКФ.
Для устранения массивных отеков проводится терапия петлевыми диуретиками в возрастных дозировках. С целью ликвидации рефрактерных полостных отеков назначаются комбинации петлевых и тиазидных мочегонных. В качестве гипотензивных и нефропротекторных средств у детей лучше всего работают ингибиторы АПФ и блокаторы рецепторов ангиотензина. Коррекцию остеопении производят препаратами витамина Д.
Прогноз и профилактика
У детей с хорошим ответом на стероидную терапию в 95% наблюдается полное выздоровление без снижения функции почек. Менее благоприятный прогноз при стероидорезистентности, поскольку у таких пациентов высокий риск формирования хронической почечной недостаточности. Однако, своевременное применение иммуносупрессоров и нефропротекторов позволяет замедлить патологический процесс.
Первичная профилактика включает рациональное назначение лекарств, раннюю диагностику и терапию аутоиммунных процессов, избегание контактов с нефротоксическими веществами. Вторичная профилактика предполагает курсы гормональной терапии при обострении основной патологии либо в случае интеркуррентного заболевания. Это необходимо для предупреждения рецидивов нефротического синдрома.
4. Нефротический синдром у детей: определение и принципы терапии/ С.В. Бельмер, А.В. Малкоч// Лечащий врач. — 2004.
Нефротический синдром
Нефротический синдром – это симптомокомплекс, развивающийся на фоне поражения почек, включающий массивную протеинурию, нарушения белково-липидного обмена и отеки. Патология сопровождается гипоальбуминемией, диспротеинемией, гиперлипидемией, отеками различной локализации (вплоть до анасарки и водянки серозных полостей), дистрофическими изменениями кожи и слизистых. В диагностике важную роль играет клинико-лабораторная картина: изменения в биохимических анализах крови и мочи, ренальная и экстраренальная симптоматика, данные биопсии почки. Лечение нефротического синдрома консервативное, включающее назначение диеты, инфузионной терапии, диуретиков, антибиотиков, кортикостероидов, цитостатиков.
Нефротический синдром может развиваться на фоне широкого круга урологических, системных, инфекционных, хронических нагноительных, метаболических заболеваний. В современной урологии данный симптомокомплекс осложняет течение заболеваний почек примерно в 20% случаев. Патология чаще развивается у взрослых (30-40 лет), реже у детей и пожилых пациентов. Наблюдается классическая тетрада признаков: протеинурия (свыше 3,5 г/сут.), гипоальбуминемия и гипопротеинемия (менее 60-50 г/л), гиперлипидемия (холестерин более 6,5 ммоль/л), отеки. При отсутствии одного или двух проявлений говорят о неполном (редуцированном) нефротическом синдроме.
По происхождению нефротический синдром может быть первичным (осложняющим самостоятельные заболевания почек) или вторичным (следствием заболеваний, протекающих с вторичным вовлечением почек). Первичная патология встречается при гломерулонефрите, пиелонефрите, первичном амилоидозе, нефропатии беременных, опухолях почек (гипернефроме).
Вторичный симптомокомплекс может быть обусловлен многочисленными состояниями: коллагенозами и ревматическими поражениями (СКВ, узелковым периартериитом, геморрагическим васкулитом, склеродермией, ревматизмом, ревматоидным артритом); нагноительными процессами (бронхоэктазами, абсцессами легких, септическим эндокардитом); болезнями лимфатической системы (лимфомой, лимфогранулематозом); инфекционными и паразитарными заболеваниями (туберкулезом, малярией, сифилисом).
В ряде случаев нефротический синдром развивается на фоне лекарственной болезни, тяжелых аллергозов, отравлений тяжелыми металлами (ртутью, свинцом), укусов пчел и змей. Иногда, преимущественно у детей, причину нефротического синдрома выявить не удается, что позволяет выделить идиопатический вариант заболевания.
Среди концепций патогенеза наиболее распространенной и обоснованной является иммунологическая теория, в пользу которой свидетельствует высокая частота возникновения синдрома при аллергических и аутоиммунных заболеваниях и хороший отклик на иммуносупрессивную терапию. При этом образующиеся в крови циркулирующие иммунные комплексы являются результатом взаимодействия антител с внутренними (ДНК, криоглобулинами, денатурированными нуклеопротеидами, белками) или внешними (вирусными, бактериальными, пищевыми, медикаментозными) антигенами.
Иногда антитела образуются непосредственно к базальной мембране почечных клубочков. Осаждение иммунных комплексов в ткани почек вызывает воспалительную реакцию, нарушение микроциркуляции в клубочковых капиллярах, развитие повышенной внутрисосудистой коагуляции. Изменение проницаемости клубочкового фильтра при нефротическом синдроме ведет к нарушению абсорбции белка и его попаданию в мочу (протеинурия).
Ввиду массивной потери белка в крови развивается гипопротеинемия, гипоальбуминемия и тесно связанная с нарушением белкового обмена гиперлипидемия (повышение холестерина, триглицеридов и фосфолипидов). Появление отеков обусловлено гипоальбуминемией, снижением осмотического давления, гиповолемией, уменьшением ренального кровотока, усиленной продукцией альдостерона и ренина, реабсорбцией натрия.
Макроскопически почки имеют увеличенные размеры, гладкую и ровную поверхность. Корковый слой на разрезе бледно-серый, а мозговой - красноватый. Микроскопическое изучение тканевой картины почки позволяет увидеть изменения, характеризующие не только нефротический синдром, но и ведущую патологию (амилоидоз, гломерулонефрит, коллагенозы, туберкулез). Собственно нефротический синдром в гистологическом плане характеризуется нарушениями структуры подоцитов (клеток капсулы клубочков) и базальных мембран капилляров.
Признаки нефротического синдрома однотипны, несмотря на различие вызывающих его причин. Ведущим проявлением служит протеинурия, достигающая 3,5-5 и более г/сутки, причем до 90% выводимого с мочой белка составляют альбумины. Массивная потеря белковых соединений вызывает снижение уровня общего сывороточного белка до 60-40 и менее г/л. Задержка жидкости может проявляться периферическими отеками, асцитом, генерализованным отеком подкожной клетчатки (анасаркой), гидротораксом, гидроперикардом.
Прогрессирование нефротического синдрома сопровождается общей слабостью, сухостью во рту, жаждой, потерей аппетита, головной болью, тяжестью в пояснице, рвотой, вздутием живота, поносом. Характерным признаком служит олигурия с суточным диурезом менее 1 л. Возможны явления парестезии, миалгия, судороги. Развитие гидроторакса и гидроперикарда вызывает одышку при движении и в покое. Периферические отеки сковывают двигательную активность больного. Пациенты вялые, малоподвижные, бледные; отмечают повышенное шелушение и сухость кожи, ломкость волос и ногтей.
Нефротический синдром может развиваться постепенно или бурно; сопровождаться менее и более выраженной симптоматикой, что зависит от характера течения основного заболевания. По клиническому течению различаются 2 варианта патологии – чистый и смешанный. В первом случае синдром протекает без гематурии и гипертензии; во втором может принимать нефротически-гематурическую или нефротически-гипертоническую форму.
Осложнениями нефротического синдрома могут стать периферические флеботромбозы, вирусные, бактериальные и грибковые инфекции. В отдельных случаях наблюдается отек мозга или сетчатки, нефротический криз (гиповолемический шок).
Ведущими критериями распознавания нефротического синдрома служат клинико-лабораторные данные. Объективный осмотр выявляет бледные («перламутровые»), холодные и сухие на ощупь кожные покровы, обложенность языка, увеличение размеров живота, гепатомегалию, отеки. При гидроперикарде отмечается расширение границ сердца и приглушение тонов; при гидротораксе – укорочение перкуторного звука, ослабленное дыхание, застойные мелкопузырчатые хрипы. На ЭКГ регистрируется брадикардия, признаки дистрофии миокарда.
В общем анализе мочи определяется повышенная относительная плотность (1030-1040), лейкоцитурия, цилиндрурия, наличие в осадке кристаллов холестерина и капель нейтрального жира, редко – микрогематурия. В периферической крови – увеличение СОЭ (до 60-80 мм/ч), преходящая эозинофилия, увеличение числа тромбоцитов (до 500-600 тыс.), небольшое снижение уровня гемоглобина и эритроцитов. Нарушение свертываемости, выявляемые с помощью исследования коагулограммы, могут выражаться в небольшом повышении или развитии признаков ДВС-синдрома.
Исследование биохимического анализа крови подтверждает характерную гипоальбуминемию и гипопротеинемию (менее 60-50 г/л), гиперхолестеринемию (холестерин более 6,5 ммоль/л); в биохимическом анализе мочи определяется протеинурия свыше 3,5 г в сутки. Для выяснения степени выраженности изменений почечной ткани может потребоваться проведение УЗИ почек, УЗДГ почечных сосудов, нефросцинтиграфии.
С целью патогенетической обоснованности лечения нефротического синдрома крайне важно установление причины его развития, в связи с чем требуется углубленное обследование с выполнением иммунологических, ангиографических исследований, а также биопсии почки, десны или прямой кишки с морфологическим исследованием биоптатов.
Лечение нефротического синдрома
Терапия проводится стационарно под наблюдением врача-нефролога. Общими лечебными мероприятиями, не зависящими от этиологии нефротического синдрома, служат назначение бессолевой диеты с ограничением жидкости, постельного режима, симптоматической лекарственной терапии (диуретиков, препаратов калия, антигистаминных средств, витаминов, сердечных средств, антибиотиков, гепарина), инфузионное введение альбумина, реополиглюкина.
При неясном генезе, состоянии, обусловленном токсическим или аутоиммунным поражением почек, показана стероидная терапия преднизолоном или метилпреднизолоном (перорально или внутривенно в режиме пульс-терапии). Иммуносупрессивная терапия стероидами подавляет образование антител, ЦИК, улучшает почечный кровоток и клубочковую фильтрацию. Хорошего эффекта лечения гормонорезистентного варианта патологии позволяет добиться цитостатическая терапия циклофосфамидом и хлорамбуцилом, проводимая пульс-курсами. В период ремиссии показано лечение на специализированных климатических курортах.
Течение и прогноз тесно связаны с характером развития основного заболевания. В целом устранение этиологических факторов, своевременное и правильное лечение позволяет восстановить функции почек и достичь полной стабильной ремиссии. При неустраненных причинах синдром может принимать персистирующее или рецидивирующее течение с исходом в хроническую почечную недостаточность.
Профилактика включает раннее и тщательное лечение почечной и внепочечной патологии, которая может осложниться развитием нефротического синдрома, осторожное и контролируемое применение лекарственных средств, обладающих нефротоксическим и аллергическим действием.
Нефритический синдром
Нефритический синдром – это комплекс признаков почечной патологии, который включает отеки, гематурию и артериальную гипертензию. Возникает при разных формах гломерулярных нарушений: постинфекционном и быстропрогрессирующем гломерулонефрите, IgA-нефропатии, наследственных и аутоиммунных нефропатиях. Синдром проявляется отеками лица и нижних конечностей, выделением мочи цвета «мясных помоев», сильными головными болями. Для диагностики назначается УЗИ и КТ почек, пункционная биопсия, лабораторные анализы крови и мочи. Лечение гломерулярной патологии включает глюкокортикоиды, иммуносупрессоры, гипотензивные и нефропротективные препараты.


Острый нефритический синдром (ОНС), ассоциированный с гломерулонефритами, занимает 3-4 место в структуре почечной патологии. Заболевание преимущественно возникает у детей и людей молодого возраста, мужчины болеют в 2 раза чаще женщин. ОНС признан одним из наиболее опасных состояний в практической нефрологии, поскольку он чреват быстрым снижением почечной функции, тяжелыми сердечно-сосудистыми осложнениями. Не теряет актуальности разработка новых методов лечения и эффективных мер профилактики болезни.
Синдром формируется при всех вариантах гломерулонефрита – первичного воспаления почечных клубочков, которое протекает с вовлечением в процесс интерстиция, имеет тенденцию к прогрессированию. Среди острых форм заболевания преобладает постстрептококковый гломерулонефрит, возбудителями болезни также выступают энтерококки, герпесвирусы, токсоплазмы и шистосомы. Другие причины гломерулярных нарушений:
- IgA-нефропатия. Самая распространенная форма нефритического синдрома, которая возникает при накоплении иммунных комплексов в клубочках. Для болезни характерно постепенное и неуклонно прогрессирующее развитие. В группу риска относят подростков и молодых мужчин, представителей европеоидной и азиатской рас.
- Быстропрогрессирующий гломерулонефрит. Заболевание развивается при поражении более 50-60% клубочков, образовании в их мембранах характерных полулуний. Типично быстрое формирование развернутого ОНС, его прогрессирование до терминальной стадии почечной недостаточности за несколько месяцев.
- Люпус-нефрит. Почечная патология ‒ типичное проявление системной красной волчанки, которое обусловлено неспецифическим аутоиммунным повреждением. Нефритические симптомы развиваются на фоне утолщения базальных мембран клубочков, отложений фибрина, появления гиалиновых тромбов.
- Наследственный нефрит. Патология развивается при мутации гена COL4A3, которая в основном наследуется по Х-сцепленному механизму. Проявления ОНС возникают в детском возрасте, к 20-30 годам большинство людей имеют признаки хронической болезни почек.
- Ревматологические болезни. Помимо красной волчанки, поражение почечных клубочков провоцируется ревматоидным артритом, системной склеродермией, дерматомиозитом. Причиной патологии также выступают васкулиты: узелковый полиартериит, неспецифический аортоартериит.
- Другие причины. ОНС является клиническим вариантом дебюта нефропатии в 29% случаев антифосфолипидного синдрома, у 25% пациентов с криоглобулинемией. Около 20% больных пурпурой Шенляйна-Геноха имеют рецидивирующие формы поражения почек. Иногда клинико-лабораторный синдром развивается при алкогольной нефропатии.
Нефритический синдром наблюдается при неинфекционном поражении почек химическими агентами. Нефротоксическое действие имеет пыльца ядовитых растений, яды насекомых, органические растворители. Иммунное воспаление клубочков в редких случаях развивается после вакцинации и введения лечебных сывороток. Токсическим влиянием также обладают эндогенные опухолевые антигены.
Ключевым звеном развития нефритического синдрома считается отложение иммунных комплексов в почечных клубочках в промежутке между базальными мембранами и отростками подоцитов. Возникает выраженная воспалительная реакция, снижается скорость клубочковой фильтрации, в организме задерживаются вода и соли. Повышенный уровень натрия и активация РААС провоцируют увеличение объема внеклеточной жидкости.
В условиях гипергидратации усиливается сердечный выброс, происходит отек сосудистых стенок и увеличивается их чувствительность к катехоламинам, уменьшается выработка простагландинов и кининов. Такие механизмы вызывают стойкую артериальную гипертензию. Перераспределение жидкости с преимущественным депонированием в рыхлой клетчатке становится причиной отеков.
Воспалительный процесс повреждает капилляры клубочков и нарушает процессы фильтрации, в результате чего эритроциты и крупномолекулярные белки плазмы попадают в первичную мочу. В мочевом осадке появляются цилиндры, возникает микро- или макрогематурия. При нефротическом синдроме возможна асептическая лейкоцитурия, умеренная протеинурия, степень которой коррелирует с тяжестью поражения мембран клубочков.

Бурый или розовато-серый цвет мочи – специфический признак нефритического синдрома, который заставляет пациентов немедленно обращаться к врачу. Он сопровождается ноющими болями в пояснице, общей слабостью и недомоганием, уменьшением диуреза. Одновременно с этим появляются плотные нефритические отеки, которые максимально выражены на лице в утренние часы. При поражении сердца отечность возникает также на ногах.
Поражение сердечно-сосудистой системы манифестирует сжимающими головными болями, одышкой, неприятными ощущениями в области сердца. При резком повышении давления пациенты испытывают шум в ушах, головокружение, тошноту. Повреждение глазного дна проявляется мельканием «мушек», затуманиванием зрения. Клиническая картина дополняется нарушениями сна, повышенной мышечной и психической возбудимостью.
Особенности течения нефритического синдрома зависят от его первопричины. При быстропрогрессирующем гломерулонефрите ухудшение наступает стремительно: развивается олигурия, тошнота и рвота, заторможенность и другие нарушения сознания. В тяжелых случаях присоединяется уремический гастроэнтероколит, который нередко вызывает профузные желудочно-кишечные кровотечения.
Закономерным последствием нелеченого нефритического синдрома является почечная недостаточность, которая в 15-20% случаев завершается летальным исходом. Поражение кардиоваскулярной системы чревато отеком легких, сердечной астмой. Критическое повышение артериального давления увеличивает риск геморрагических инсультов, слепоты вследствие отслойки сетчатки глаза.
При развитии нефритического синдрома на фоне нефропатии беременных существует риск эклампсии ‒ тяжелого гестоза, протекающего с судорогами, потерей сознания, нарушениями маточно-плацентарной гемодинамики. На фоне генерализованного судорожного синдрома возможно развитие отека мозга и коматозного состояния, которое с трудом поддается коррекции.
Выяснением первопричины нефритического синдрома занимается врач-нефролог. При первичном осмотре определяется бледность и пастозность кожи, выраженные отеки, аускультативные признаки сердечной патологии. Диагностическую ценность имеют недавно перенесенные острые инфекции, контакты с химическими веществами. План расширенного обследования пациента включает следующие методы:
- УЗИ почек. Сонография используется для оценки структурных особенностей органа, исключения полостных и объемных образований. Для изучения скорости кровотока в почечных сосудах проводится допплерография.
- Лучевая диагностика. По показаниям программа исследования дополняется обзорной и внутривенной урографией, КТ почек. Диагностика функциональной активности органа выполняется методом изотопной ренографии.
- ЭКГ. Результаты электрокардиограммы показывают признаки гипертрофии левого желудочка. Для уточнения степени снижения сердечного выброса проводится эхокардиография.
- Биопсия почки. Пункционные биоптаты исследуются с помощью световой и электронной микроскопии для морфологической диагностики гломерулонефрита. С целью уточнения диагноза используется иммунофлюоресцентный анализ клеток.
- Осмотр глазного дна. Поражение сосудов при артериальной гипертензии проявляется феноменом «перекреста», сужением артериол. В тяжелых случаях наблюдается отек диска зрительного нерва и кровоизлияния в сетчатку.
- Анализы мочи. Патогномоничный признак ОНС – гематурия с появлением гломерулярных выщелоченных эритроцитов. Также диагностируется лейкоцитурия, неселективная протеинурия, гиалиновые и эритроцитарные цилиндры. В пробе Зимницкого определяется снижение относительной плотности мочи.
- Анализы крови. При биохимическом исследовании обнаруживается диспротеинемия, гиперглобулинемия, повышение активности фибриногена и плазмина. Иммунологическая диагностика выявляет циркулирующие иммунные комплексы, увеличенную комплементарную активность сыворотки.

Дифференциальная диагностика
При обнаружении нефритического синдрома проводится дифференциальная диагностика между острым и хроническим гломерулонефритом, острым лекарственным нефритом, почечной патологией на фоне системных соединительнотканных заболеваний. Сомнительные лабораторные данные требуют исключения пиелонефрита, тубулоинтерстициальных патологий, туберкулеза и амилоидоза почек.
Лечение нефритического синдрома
Обратное развитие почечной патологии достигается при устранении этиологического фактора, если это возможно. При интоксикациях назначаются экстракорпоральные методы очищения крови, применяются антидоты, отменяются нефротоксические лекарства. При паранеопластическом синдроме проводится комплексное лечение онкопатологии. Однако этиологический подход реализуется у небольшой части пациентов.
Чаще всего в клинической нефрологии применяется патогенетическая и симптоматическая терапия. В остром периоде нефритического синдрома необходим постельный режим. Для уменьшения отеков рекомендовано сократить употребление поваренной соли и контролировать объем выпиваемой жидкости, количество белка в рационе не должно превышать 0,75-1 г/кг веса. Схема фармакотерапии включает в себя:
- Глюкокортикоиды. Гормоны подавляют иммунное воспаление, они признаны препаратами выбора при гломерулярных поражениях. При их недостаточной эффективности применяются цитостатики и другие виды иммуносупрессоров.
- Кроворазжижающие препараты. Для улучшения реологических свойств крови и профилактики тромбозов назначается комбинация прямых антикоагулянтов и антиагрегантов. Прием лекарств проводится под контролем показателей коагулограммы.
- Нефропротекторы. Хороший эффект оказывают гипотензивные препараты, которые воздействуют на РААС и сосудистый тонус. При нефритическом синдроме назначаются ингибиторы АПФ и их более современные аналоги – блокаторы рецепторов ангиотензина II. Реже используются антагонисты кальция.
- Антибиотики. Противомикробные препараты назначаются при доказанной стрептококковой этиологии заболевания и наличии микроорганизмов в крови. При почечном туберкулезе показана длительная специфическая химиотерапия.
Исход болезни зависит от морфологического варианта поражения почек, своевременности терапии, развития хронической почечной недостаточности. Ввиду сложности этиопатогенеза нефритического синдрома большинству пациентов требуется длительная патогенетическая терапия, диспансерное наблюдение у нефролога, регулярный контроль функций почек. Профилактика заключается в раннем начале лечения нефропатологии, чтобы предупредить развитие ОПН и ХПН.
1. Методы исследования и клинические синдромы при поражении почек/ И.И. Шапошник, Н.А. Макарова, Д.В. Богданов, Л.В. Рябова. – 2019.
3. Нефритический синдром у детей: морфологические варианты и лечение/ А.Е. Наушабаева, Б.А. Абеуова, Г.Н. Чингаева// Педиатрическая нефрология. – 2012. – №2.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Нефротический синдром: причины появления, симптомы, диагностика и способы лечения.
Определение
Нефротический синдром (НС) – клинико-лабораторный симптомокомплекс, для которого характерна протеинурия (3,5 г/сут. и более), гипоальбуминемия (менее 30 г/л), гиперлипидемия и отеки.
Протеинурия – это превышение концентрации в моче белка.
Гипоальбумиемия – это снижение содержания альбумина в крови.
Гиперлипидемия – это аномально повышенный уровень липидов и/или липопротеинов в крови.
Причины появления нефротического синдрома
Нефротический синдром может развиться на фоне иммуновоспалительных, аутоиммунных, метаболических, токсических и наследственных патологий почек.
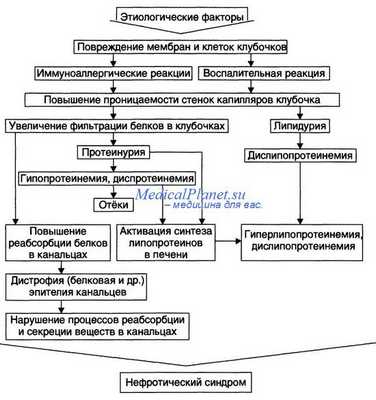
В основе НС лежит нарушение структуры или повреждение клубочков почек с последующим повышением их проницаемости для белков плазмы крови.
При заболеваниях иммуновоспалительного характера происходит ряд клеточных реакций иммунного воспаления с повреждением мембраны клубочка. Повышается проницаемость мембраны для белка, развивается массивная протеинурия, нефротический синдром.
При амилоидозе происходит отложение амилоида (белково-полисахаридного комплекса) в стенке капилляров клубочка и нарушение функции почек.
При сахарном диабете наблюдаются расстройства сосудистой проницаемости.
Воздействие некоторых лекарственных препаратов и солей тяжелых металлов на мембрану и клетки клубочка приводит к повреждению капиллярной стенки.
Генетические исследования показали, что в основе возникновения нефротического синдрома могут лежать мутации генов.
Основным признаком нефротического синдрома является массивная протеинурия с суточным выделением более 3,5 г белка. Вслед за значительной потерей белка с мочой снижается количество белка в крови – в частности альбумина (менее 35 г/л). Гипоальбуминемия, задержка натрия и воды в тканях приводят к отекам.
В ответ на снижение содержания альбуминов в сыворотке крови и потерю с мочой «фактора липолиза», способствующего распаду липидов, появляется гиперлипидемия (повышенное содержание в крови холестерина, β-липопротеидов, триглицеридов).
Нефротическая гиперлипидемия играет крайне негативную роль в развитии ишемической болезни сердца и инфаркта миокарда.
При нефротическом синдроме с мочой выводится и холекальциферолсвязывающий белок, потеря которого приводит к дефициту витамина D, нарушениям фосфорно-кальциевого обмена и риску развития остеопороза.
Изменяется содержание основных микроэлементов как в плазме, так и в клеточных элементах (снижается содержание кобальта, цинка, железа и трансферина). Развиваются изменения в свертывающей и противосвертывающей системах крови, а повышенная свертываемость крови усугубляет изменения, происходящие в почках.
Можно выделить следующие заболевания, способствующие или являющиеся фактором развития нефротического синдрома:
- гломерулонефрит;
- амилоидоз почек;
- системные заболевания (системная красная волчанка, ревматоидный полиартрит, пурпура Шенлейна-Геноха, микроскопический полиартериит, гранулематоз Вегенера и др.);
- сахарный диабет;
- лейкозы, лимфомы, миеломная болезнь; карциномы; меланома;
- воздействие нефротоксических лекарственных факторов (солей лития, нестероидных противовоспалительных препаратов и др.);
- аллергические реакции после укусов насекомых, змей;
- инфекционные факторы (бактерии, вирусы, простейшие, гельминты);
- некоторые наследственные заболевания (например, синдром Альпорта, болезнь Фабри);
- нефропатия беременных;
- тромбозы почечных вен и артерий, аорты, нижней полой вены.
- Врожденный и инфантильный нефротические синдромы:
- финского типа с первичным поражением базальных мембран клубочковых капилляров и микрокистозом канальцев (мутация гена NPHS1 на 19-й хромосоме);
- семейный (мутация гена NPHS2 на хромосоме 1q25-31);
- семейный аутосомно-доминантный стероидрезистентный нефротический синдром (мутация гена ACTN4);
- нефротический синдром при болезнях Дениса–Драша и Фрайзера (мутация гена WTI и сочетающийся с псевдогермафродитизмом).
- с минимальными изменениями в почечных клубочках;
- при фокально-сегментарном гломерулосклерозе/гиалинозе;
- при мембранопролиферативном гломерулонефрите;
- при мезангиопролиферативном гломерулонефрите;
- при фибропластическом гломерулонефрите;
- при мембранозной нефропатии;
- при гломерулонефрите различных морфологических типов, ассоциированным с Herpesviridae (вирусом простого герпеса 1-го и 2-го типов, цитомегаловирусом, вирусом Эпштейна–Барр).
- при внутриутробных инфекциях (токсоплазмозе, цитомегаловирусе, врожденном сифилисе и др.);
- при инфекционных заболеваниях (туберкулезе, гепатите В и С, сифилисе, синдроме приобретенного иммунодефицита и др.);
- при системных заболеваниях соединительной ткани, системных васкулитах;
- при болезнях обмена веществ;
- при тромбозе почечных вен;
- при наследственных болезнях и синдромах (Альпорта, Клиппеля–Треноне, галактосиалидозе, периодической болезни и др.);
- при хромосомных болезнях (синдроме Орбели, болезни Дауна и др.).
- стероидчувствительный,
- стероидрезистентный,
- стероидзависимый.
- легкой степени (альбумины сыворотки крови 25-30 г/л);
- умеренной степени (альбумины от 20 до 25 г/л);
- тяжелой степени (альбумины менее 20 г/л).
- без артериальной гипертензии, гематурии и азотемии;
- в сочетании с артериальной гипертензией и/или гематурией, и/или азотемией.
Клиническая картина при НС обусловлена функциональными нарушениями почек и других органов, наличием или отсутствием осложнений, а также сопутствующими заболеваниями.
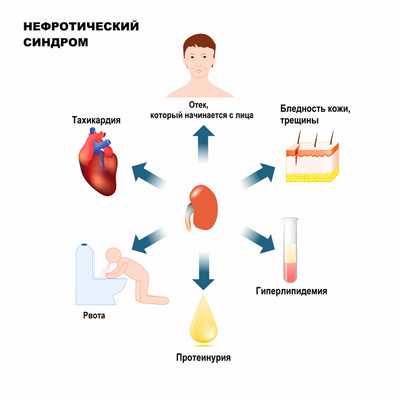
Больные обычно предъявляют жалобы на сонливость и быструю утомляемость, отсутствие аппетита, рвоту, диарею, отеки, онемение конечностей, выделение пенистой мочи.
Клинические проявления первичного НС обычно развиваются у детей в возрасте 2-7 лет. Заболевание может манифестировать на фоне инфекции или вакцинации.
Отеки при нефротическом синдроме могут быть локальными и или достигать степени анасарки (то есть располагаться по всему телу), развиваться постепенно или стремительно (в течение одного дня). Отеки при НС рыхлые, легко перемещаются и оставляют ямку при надавливании пальцем. При их длительном существовании кожа становиться бледной, сухой, атрофичной, на ней появляются бледные полосы растяжения (стрии) и трещины.
При НС происходят изменения во внутренних органах: печени, поджелудочной железе, щитовидной железе, надпочечниках, сердце. Развивается так называемая нефротическая кардиомиопатия, тахикардия.
![Отек.jpg]()
Диагностика нефротического синдрома
Основные мероприятия, проводимые для диагностики НС:
- клинический анализ крови с определением концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), лейкоформула и СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий.
Читайте также: