Невус Ямамото
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
В.В. Мордовцева (1), Ю.Ю. Сергеев (2)
1) Московский государственный университет пищевых производств, Москва, Россия; 2) Общество дерматоскопии и оптической диагностики кожи, Москва, Россия
Гало-феномен представляет собой появление венчика депигментации вокруг новообразований кожи различного генеза. Наиболее часто он наблюдается при меланоцитарных невусах и встречается у 1% населения. К редким и иногда единственным симптомам гало-феномена относят локальное обесцвечивание волос (лейкотрихия, полиоз). В статье приводится описание случая гало-невуса, располагающегося на волосистой части головы и проявляющегося локальной лейкотрихией, а также случай гало-феномена вокруг невуса сальных желез Ядассона. Приведен обзор литературы по гало-феномену, обсуждается дифференциальная диагностика лейкотрихии.
Ключевые слова: гало-феномен, гало-невус, невус Сеттона, невус сальных желез, дерматоскопия, регресс, лейкотрихия, полиоз
Введение
В 1916 г. американский дерматолог R.L. Sutton описал два случая необычного течения витилиго, предложив термин «leukoderma acquisitum centrifugum» [1]. В опубликованных наблюдениях были выявлены однотипные овальные очаги депигментации, причем в центральной части высыпаний у одного пациента располагалась папула коричневого цвета, у другого произошла частичная репигментация очагов. Аналогичные наблюдения встречались ранее в работах таких известных дерматологов, как F. Hebra и M. Kaposi [2], позднее были описаны и другими специалистами [3]. В настоящее время феномен появления венчика депигментации вокруг одного или нескольких меланоцитарных невусов известен как невус Сеттона, или гало-невус [4]. Распространенность гало-невусов в общей популяции составляет 1%, они встречаются преимущественно у детей и взрослых в молодом возрасте независимо от пола. Средний возраст больных на момент дебюта заболевания – 16 лет, предпочтительная локализация – кожа спины [5]. Показано, что не менее чем у 25% больных одновременно или последовательно появляются множественные гало-невусы [6].
Выделяют несколько последовательных клинических стадий развития гало-невуса. Вначале меланоцитарный невус окружается венчиком белого цвета (стадия I). Затем происходит постепенное изменение окраски пигментного образования на розовый или телесный цвет (стадия II, рис. 1). Дополнительным клиническим проявлением этой стадии является постепенное обесцвечивание волос (полиоз, лейкотрихия) в пределах образования. В дальнейшем меланоцитарный невус полностью регрессирует и на коже остается только депигментированное пятно (стадия III, рис. 2), которое с течением времени подвергается репигментации (стадия IV) [7]. Протяженность каждой стадии может сильно отличаться у разных пациентов. В результате наблюдения за пациентами с гало-невусами было показано, что более чем в половине случаев (51%) клиническая картина остается стабильной, характерной для I стадии, на протяжении 17 лет [8]. Полный регресс невуса и восстановление окрашивания занимает в среднем 7,8 года и отмечается лишь в 22,4% случаев. В остальных случаях отмечается полный или частичный регресс невуса с сохранением или частичной репигментацией белесоватого венчика [8].
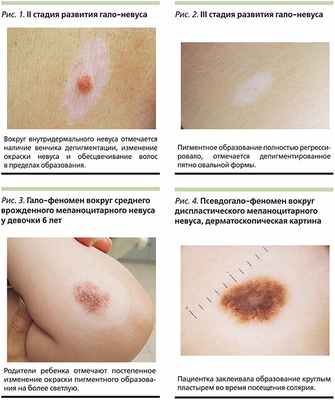
Венчик депигментации может возникнуть вокруг разных типов невусов, включая врожденные (рис. 3) и приобретенные – обычные, диспластические, голубые, веретеноклеточные (невус Спитц) [9]. Появление депигментированного венчика вокруг различных немеланоцитарных образований (базальноклеточный рак, себорейный кератоз, гистиоцитома, нейрофиброма) и некоторых дерматозов (саркоидоз, красный плоский лишай) описывают как гало-феномен [5, 10]. Известны случаи развития гало-феномена вокруг меланомы [11], что требует дифференциальной диагностики с самопроизвольным регрессом злокачественной опухоли [12] и искусственным «вызыванием» гало-феномена путем применения солнцезащитных средств или закрытия пигментных образований тканью во время инсоляции (рис. 4) [11]. Считается, что ширина депигментированного венчика варьируется от 5 мм до 5 см, причем в большинстве случаев имеется прямая зависимость между размером центрального образования и шириной венчика [11].
При дерматоскопическом осмотре наиболее часто выявляется глобулярная или гомогенная модель строения пигментного образования (рис. 5), более характерная для смешанных (эпидермо-дермальных) или внутридермальных меланоцитарных невусов [6]. В некоторых случаях дополнительно выявляются точечные вкрапления пигмента серого цвета (структуры регресса, рис. 6) и обесцвеченные волосы. Зона депигментации не имеет каких-либо особенных дерматоскопических признаков и представлена диффузным окрашиванием белого цвета. Модель строения гало-невуса остается стабильной в процессе его регрессирования – структуры бледнеют и постепенно замещаются естественным сосудистым рисунком кожи [14, 15].

В большинстве случаев диагноз основывается на результатах клинического осмотра и не требует проведения морфологической диагностики. В исследованиях были получены данные, позволяющие подразделить гистологические изменения на несколько стадий (табл. 1) [16].
В воспалительном инфильтрате гало-невусов преобладают CD8+-Т-лимфоциты (75–90%) и В-лимфоциты, что подтверждает иммуноопосредованный характер воспаления [17].
В ряде случаев при выраженной лимфоцитарной реакции может потребоваться иммуногистохимическое окрашивание на антиген S-100 для подтверждения меланоцитарной природы образования [18, 19].
Ниже приводим описание клинических случаев гало-невуса и гало-феномена из собственной практики.
Клинический случай 1
На прием в НИЦ «Клиника дерматологии» (клиническая база Общества дерматоскопии и оптической диагностики кожи) обратилась здоровая женщина Н. 27 лет с жалобами на появление пряди седых волос в теменной области. При осмотре было выявлено пигментное образование, представленное папулой розовато-коричневого цвета, в пределах которой отмечался рост пигментированных и депигментированных волос (рис. 7).
При дерматоскопическом осмотре образование было представлено глобулярной моделью строения и линейно-извитыми сосудами, характерными для внутридермального невуса (рис. 8). Депигментированные волосы определялись как в пределах образования, так и на некотором удалении от него. Осмотр остальных участков волосистой части головы и кожного покрова не выявил дополнительных депигментированных очагов. Учитывая доброкачественную природу меланоцитарного образования, пациентке было рекомендовано дальнейшее динамическое наблюдение.
Клинический случай 2
На прием в НИЦ «Клиника дерматологии» обратилась здоровая женщина Т. 36 лет для осмотра новообразований кожи в рамках скрининговой кампании по ранней диагностике рака кожи. Помимо обычных приобретенных меланоцитарных невусов на коже спины был выявлен депигментированный очаг диаметром 2,5×1,5 см, в центральной части которого определялись многочисленные сгруппированные папулы желтого цвета (рис. 9). При дерматоскопическом осмотре определялась характерная для невуса сальных желез картина, представленная округлыми структурами желтого цвета, окруженными линейными телеангиэктазиями [10]. С учетом отсутствия субъективных жалоб и доброкачественного характера процесса пациентке было рекомендовано дальнейшее динамическое наблюдение.
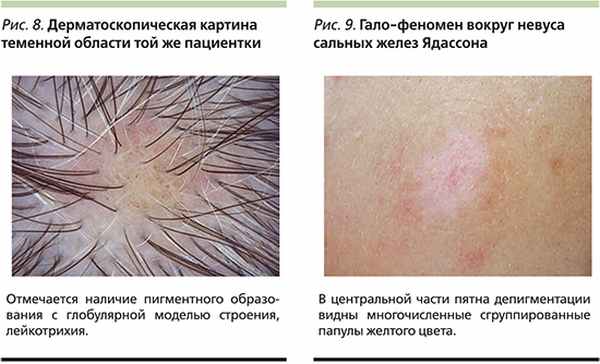
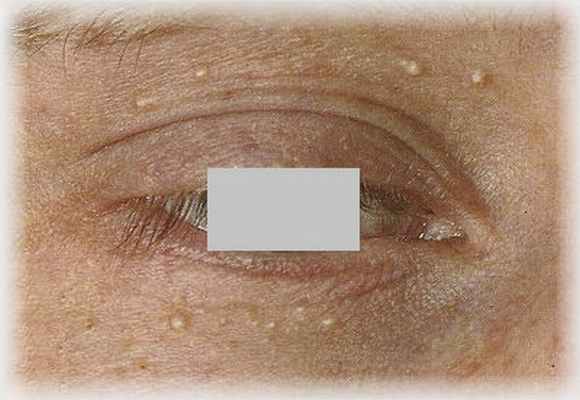
Обесцвечивание пряди волос как основной и единственный клинический симптом гало-невуса – явление чрезвычайно редкое. В мировой литературе представлены единичные случаи, аналогичные нашему наблюдению [5, 20–22]. Описаны в т.ч. случаи изолированного поражения ресниц в зоне невуса на веке [23, 24]. Тщательный осмотр больных с использованием дерматоскопического метода очень важен для подтверждения наличия пигментного образования и проведения дифференциальной диагностики (табл. 2) [25]. Представленный случай развития гало-феномена вокруг невуса сальных желез Ядассона, насколько нам известно, является первым описанием в отечественной и, возможно, в мировой литературе.
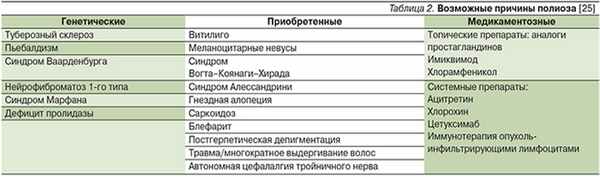
Причины возникновения гало-невусов точно неизвестны. Описаны семейные случаи [26] и развитие их на фоне таких заболеваний, как витилиго, атопический дерматит и аутоиммунный тиреоидит [6]. Кроме того, внезапное появление множественных гало-невусов в пожилом возрасте может быть связано с развитием первичной меланомы на другом участке тела, включая глазное яблоко [27]. Показана возможность развития множественных гало-невусов на фоне лечения интерфероном-β и биологическими препаратами (инфликсимаб, иматиниб, адалимумаб и др.), а также после чрезмерной, хоть и непродолжительной, инсоляции [28–30]. Описан единичный случай появления гало-невусов в качестве паранеопластического процесса на фоне развития карциноидной опухоли [31].
Витилиго сочетается с гало-невусами в 18–26% случаев, поэтому пациентов с гало-невусами рекомендуют осматривать с помощью лампы Вуда для лучшего выявления дополнительных очагов депигментации [5]. Несмотря на очевидное сходство обоих аутоиммунных процессов, патогенез гало-невусов считается более сложным и не рассматривается как простое распространение витилиго на область меланоцитарных новообразований [32–34].
Одновременное наличие гало-невусов не отражает активности витилиго или риск прогрессирования заболевания, а также не влияет на скорость репигментации в процессе лечения [35]. Вопрос, являются ли гало-невусы маркером повышенного риска развития витилиго, до сих пор не решен [6].
В настоящее время механизм развития периневусной депигментации рассматривают как аутоиммунный феномен регресса невуса. Предложена гипотеза о том, что в гало-невусах существуют т.н. меланоцитарные антигенные единицы, функционально связанные с центрально расположенным невусом, но невидимые клинически, поэтому, когда начинается иммуно-опосредованный процесс регресса невуса, вначале становится видимой потеря пигмента по периферии от основного образования [13, 19]. Возможным подтверждением существования меланоцитарных антигенных единиц является обнаружение у некоторых людей «спящих» гнезд меланоцитов в коже, окружающей невусы. Они не видны при общем осмотре, но определяются при дерматоскопическом исследовании как глобулярный рисунок, а при гистологическом – как мелкие внутриэпидермальные гнездные скопления меланоцитов [36].
Заключение
Гало-феномен является примером одного из возможных механизмов регрессирования новообразований кожи, преимущественно меланоцитарного генеза (гало-невусы). В классических случаях клиническая диагностика не представляет трудностей. Необычные варианты гало-феномена встречаются значительно реже и требуют проведения дифференциальной диагностики.
Литература
1. Sutton R.L. An unusual variety of vitiligo (Leukoderma centrifugum acquisitum). J. Cutan. Dis. 1916;34:797.
2. Herba F., Kaposi M. Diseases of the skin. London, The New Sydenham Society, 1874;3:180.
3. Feldman S., Lashinsky I.M. Halo nevus. Leukoderma centrifugum acquisitum (Sutton); leukopigmentary nevus. Arch. Derm. Syphilol. 1936;34(4):590–604. Doi: 10.1001/archderm.1936.01470160037005.
4. Цветкова Г.М., Мордовцева В.В., Вавилов А.М., Мордовцев В.Н. Патоморфология болезней кожи. Руководство для врачей. М., 200. С. 326–27.
7. Babu A., Bhat M.R., Dandeli S., Ali N.M. Throwing light onto the core of a halo nevus: a new finding. Indian J. Dermatol. 2016;61:238. Doi: 10.4103/0019-5154.177801.
8. Aouthmany M., Weinstein M., Zirwas M.J., Brodell R.T. The natural history of halo nevi: a retrospective case series. J. Am. Acad. Dermatol. 2012;67 (4):582–6. Doi: 10.1016/j.jaad.2011.11.937.
9. Mooney M.A., Barr R.J., Buxton M.G. Halo nevus or halo phenomenon? A study of 142 cases. J. Cutan. Pathol. 1995;22:342–8. Doi: 10.1111/j.1600-0560.1995.tb01417.x.
10. Сергеев Ю.В. Будни дерматолога. М., 2012. 668 с.
11. Suzuki N., Dalapicola M., Argenziano G., Lallas A., Longo C., Piana S., Ferrara G., Raucci M., Moscarella E. Halo and pseudo-halo melanoma. J. Am. Acad. Dermatol. 2016;74(4):e59–61. Doi: 10.1016/j.jaad.2015.09.027.
12. Сергеев Ю.Ю., Мордовцева В.В. Меланома кожи с явлениями регресса: описание клинического случая и обзор литературы. Клиническая дерматология и венерология. 2017;16 (5):36–41. Doi: 10.17116/klinderma201716536-41.
14. Kolm I., Di Stefani A., Hofmann-Wellenhof R., Fink-Puches R., Wolf I.H., Richtig E., Smolle J., Kerl H., Soyer H.P., Zalaudek I. Dermoscopy patterns of halo nevi. Arch. Dermatol. 2006;142(12):1627–32. Doi:10.1001/archderm.142.12.1627.
15. Kamińska-Winciorek G., Szymszal J. Dermoscopy of halo nevus in own observation. Advances in Dermatology and Allergology/Postȩpy Dermatologii i Alergologii. 2014;31(3):152–58. Doi:10.5114/pdia.2014.40963.
16. Bayer-Garner I.B., Ivan D., Schwartz M.R., Tschen J.A. The immunopathology of regression in benign lichenoid keratosis, keratoacanthoma and halo nevus. Clin. Med. Res. 2004;2(2):89–97.
17. Zeff R.A., Freitag A., Grin C.M., Grant-Kels J.M. The immune response in halo nevi. J. Am. Acad. Dermatol. 1997;37:620–24. Doi: 10.1016/S0190-9622(97)70181-6.
18. Weyant G.W., Chung C.G., Helm K.F. Halo nevus: review of the literature and clinicopathologic findings. Int. J. Dermatol. 2015;54(10):e433–35. Doi: 10.1111/ijd.12843.
19. Nedelcu R.I., Zurac S.A., Brînzea A., Cioplea M.D., Turcu G., Popescu R., Popescu C.M., Ion D.A. Morphological features of melanocytic tumors with depigmented halo: review of the literature and personal results. Rom. J. Morphol. Embryol. 2015;56(Suppl. 2):659–63.
20. Young L.C., Van Dyke G.S., Lipton S., Binder S.W. Poliosis overlying a nevus with blue nevus features. Dermatol. Online J. 2008;14(2):20.
21. Walker S., Lucke T.W., Burden A.D., Thomson J. Poliosis circumscripta associated with scalp naevi: a report of four cases. Br. J. Dermatol. 1999;140(6):1182–84.
23. Kay K.M., Kim J.H., Lee T.S. Poliosis of eyelashes as an unusual sign of a halo nevus. Korean J. Ophthalmol. 2010;24 (4):237–39. Doi: 10.3341/kjo.2010.24.4.237.
24. Vainstein G., Nemet A.Y. Unilateral poliosis of eyelashes. Ophthal. Plast. Reconstr. Surg. 2016;32(3):e73–4. Doi: 10.1097/IOP.0000000000000250.
25. Sleiman R., Kurban M., Succaria F., Abbas O. Poliosis circumscripta: overview and underlying causes. J. Am. Acad. Dermatol. 2013;69(4):625–33. Doi: 10.1016/j.jaad.2013.05.022.
26. Herd R.M., Hunter J.A. Familial halo naevi. Clin. Exp. Dermatol. 1998;23:68–9.
28. Kawaguchi A., Yamamoto T., Okubo Y., Mitsuhashi Y., Tsuboi R. Multiple halo nevi subsequent to a short period of sunbathing. J. Dermatol. 2015;42(5):543–44. Doi: 10.1111/1346-8138.12814.
29. Kuet K., Goodfield M. Multiple halo naevi associated with tocilizumab. Clin. Exp. Dermatol. 2014;39(6):717–19. Doi: 10.1111/ced.12385.
30. Maruthappu T., Leandro M., Morris S.D. Deterioration of vitiligo and new onset of halo naevi observed in two patients receiving adalimumab. Dermatol. Ther. 2013;26(4):370–72. Doi: 10.1111/dth.12002.
31. Dereure O., Guillon F., Guillot B., Guilhou J.J. Multiple halo naevi associated with carcinoid in a young man. Acta Derm. Venereol. 2004;84(6):495–96. Doi: 10.1080/00015550410020430.
32. Cohen B.E., Mu E.W., Orlow S.J. Comparison of childhood vitiligo presenting with or without associated halo nevi. Pediatr. Dermatol. 2016;33(1):44–8. Doi: 10.1111/pde.12717.
33. Schallreuter K.U., Kothari S., Elwary S., Rokos H., Hasse S., Panske A. Molecular evidence that halo in Sutton’s naevus is not vitiligo. Arch. Dermatol. Res. 2003;295:223–28. Doi: 10.1007/s00403-003-0427-2.
34. De Vijlder H.C., Westerhof W., Schreuder G.M.Th., De Lange P., Claas F.H.J. Difference in pathogenesis between vitiligo vulgaris and halo nevi associated with vitiligo is supported by an HLA association study. Pigment. Cell. Research. 2004;17:270–74. Doi:10.1111/j.1600-0749.2004.00145.x.
36. Scope A., Marghoob A.A., Chen C.S., Lieb J.A., Weinstock M.A., Halpern A.C. Dermoscopic patterns and subclinical melanocytic nests in normal-appearing skin. British J. Dermatol. 2009;160:1318–21. Doi:10.1111/j.1365-2133.2009.09073.x.
Об авторах / Для корреспонденции
Дермальные меланоцитозы
В статье описаны клинические случаи пациентов с невусом Ота, монгольским пятном. Многие из дермальных меланозов могут быть связаны с риском поражения органов слуха, зрения, нервной системы и развития меланомы. Поэтому таким пациентам необходимо диспансерн
Dermal melanocytosis V. D. Ljah, V. V. Gagiev, M. A. Ufimtseva, I. P. Nikulin, I. N. Vorozhejkina, A. S. Shubina, N. V. Simonova
The article describes the clinical cases of patients with nevus Ota, Mongolian spot. Many of dermal melanosis can be associated with a risk of damage to the organs of hearing, vision, nervous system and melanoma development. Therefore, such patients need dispensary observation and examination by narrow specialists. Methods of laser therapy for dermal melanocytosis are described.
Дермальные меланоцитозы объединяют группу меланоцитарных невусов, локализующихся в дерме, которые возникают в результате неполной миграции меланоцитов из неврального гребня, клинически проявляются интенсивной пигментацией серо-синего цвета. Дермальные меланоцитозы включают невус Ота, невус Ямамото, невус Хори, невус Ито, невус Хидано.
Невус Oтa (син. глазокожный меланоз, факоматоз Oта-Сато, синий офтальмоверхнечелюстной невус) относится к нейрокожным синдромам, представлен односторонним образованием пигментного невуса в области иннервации первой и второй ветвей тройничного нерва [1]. Невус Oтa назван по фамилии японского офтальмолога М. Ota (1939), который опубликовал исследование с клиническим описанием нескольких сот наблюдений невоидного заболевания кожи и глаз, которое назвал «черно-синюшным глазоверхнечелюстным невусом». Новообразование наблюдается преимущественно у лиц монголоидной расы, чаще у женщин. Невус Ота бывает врожденным, может появиться в детстве или в подростковом возрасте. В отличие от монгольского пятна у детей, невус Ота не регрессирует с возрастом [2]. Невус Oтa образован дермальными меланоцитами, которые в процессе эмбриональной миграции из ганглионарной пластинки не достигли эпидермиса, остались в дерме. Клинически проявляется темно-синим или почти черным пятном, равномерной окраски, локализующимся на лице периорбитально, на лбу, щеках, периназально в зоне иннервации I и II ветвей тройничного нерва. Характерно поражение слизистых оболочек глаз, носа, неба, гортани и глотки. В большинстве случаев новообразование располагается с одной стороны лица. По степени выраженности и преимущественной локализации различают четыре типа и два подтипа невуса Ота: 1-й тип — слабо выраженный (подтипы орбитальный и скуловой), 2-й тип — умеренно выраженный, 3-й тип — интенсивный, 4-й тип — двусторонний [1].
Описано сочетание невуса Oтa с нейросенсорной глухотой, гемиатрофией лица, деформацией затылка, врожденной катарактой и глаукомой. Открытоугольная глаукома отмечается в 9% у пациентов с невусом Oтa. F. T. Almeida и соавт. (2018) описали женщину, у которой невус Ота входил в симтомокомплекс пигменто-васкулярного факоматоза, проявляясь пятнами «портвейна», аномальными венами и прогрессирующим увеличением конечности в сочетании с синдромом Клиппеля–Треноне [3]. Крайне редко на месте невуса развивается меланома. S. Shima и соавт. (2018) представили редкий случай супратенториальной менингеальной меланомы, ассоциированной с ипсилатеральным невусом Oтa у 32-летнего мужчины [4].
Диагностика осуществляется на основании типичной картины и локализации невуса, его дифференцировки от меланомы. Проводится дерматоскопия, при необходимости — биопсия. Дерматоскопические признаки включают гомогенную аспидную (синевато-серую) пигментацию. Гистологически выявляются отдельные диффузно в верхнем и в среднем слоях дермы гиперпигментированные дендритные меланоциты, не образующие гнезд (рис. 1).
Невус Хори по клиническим признакам напоминает невус Ота, но имеет двустороннюю симметричную локализацию. R. M. Bhat и соавт. (2014) описали 42-летнего мужчину с невусом Хори, с двусторонней симметричной локализацией сине-серых пятен на коже лица, с поражением слизистой глаз, а также слизистой твердого неба [5]. Отличительной особенностью невуса Хори являются расположение в верхних и средних отделах дермы веретеновидных меланоцитов в отличие от невуса Ота, при котором меланоциты располагаются в средних и нижних слоях дермы.
Невус Ито (невус темно-синий дельтовидно-акромиальный) характеризуется серо-синей пигментацией в надключичных и лопаточных областях. Описано несколько случаев нейросенсорной тугоухости и развития на его месте меланомы [6].
Монгольское пятно (син. врожденный дермальный меланоцитоз, МП) (рис. 2) присутствует с рождения у 80,0–90,0% детей негроидной и монголоидной рас, у детей европеоидной расы встречается крайне редко [1].
Впервые МП описал немецкий профессор E. Baelz в 1885 г. и назвал его «Mongolen Flecke» [7]. Механизм образования МП такой же, как и при невусе Ота. Клиническая картина представлена ограниченным округлым или овальным пятном на задней поверхности нижней части туловища, преимущественно в пояснично-крестцовой области, равномерной тусклой серовато-синюшной или коричневой окраски, реже черной или зеленоватой. Диаметр достигает 5–15 см, но не более 5,0% поверхности тела. Наиболее интенсивная окраска наблюдается в возрасте 1 года, к 7–13 годам пятно исчезает и лишь изредка присутствует у взрослых [1, 7, 8]. Регресс высыпания объясняют тем, что меланоциты находятся в защитной внеклеточной волокнистой оболочке, с течением времени они ее теряют и пятна исчезают. Также исследователи отмечают, что механизмы персистенции дермальных меланоцитов включают в себя наличие избыточного количества факторов, местно-стимулирующих рост меланоцитов, нарушение процессов регуляции пролиферации меланоцитов в эпидермальном меланине и генетические факторы [7].
МП более 10 см могут быть связаны с нейрокристопатией. Термин «нейрокристопатия» относится к расстройству, характеризующемуся нарушениями миграции нейронов, роста и дифференцировки. Наиболее распространенным лизосомальным расстройством памяти, связанным с МП, является болезнь Херлера, сопровождаемая ганглиозидозом GM1. Помимо GM1-ганглиозидоза и мукополисахаридоза типа I (болезнь Херлера), о МП сообщалось в связи с мукополисахаридозом II типа (синдром Хантера), муколипидозом, болезнью Ниманна–Пика и маннозидозом [7, 8].
Невус Ямамото клинически схож с монгольским пятном, но локализуется на туловище или конечностях [5].
Лечение монгольского пятна и невуса Ямамото, как правило, не проводится [9]. M. Shirakawa и соавт. (2012) описали эффективное лечение монгольского пятна широкополосным импульсным светом (515–1200 нм) у семи пациентов в возрасте 0–7 лет [10]. Для удаления невуса Ота, невуса Хори, невуса Ито, невуса Хидано с успехом применяются лазерные технологии [11–13]. Описано эффективное применение лазеротерапии, в том числе лазера Nd:YAG-QS, работающего в диапазоне 1064/532 нм. Исследователи отмечают, что принцип действия лазера Nd:YAG-QS заключается в избирательном действии на пигмент, исключается возможность образования рубцов. Указано, что, в зависимости от интенсивности окраски невуса и его площади, для удаления необходимо провести от 5 до 20 процедур с интервалом в месяц. Y. Liu et al. (2018) в результате ретроспективного исследования, включающего оценку эффективности удаления невуса Ота у 224 пациентов с использованием лазерной системы Nd:YAG-QS, отмечают, что у 99,1% лиц был достигнут 75%-й эффект в среднем после 3,7 процедуры, лишь в 3,6% случаев наблюдался рецидив [14].
В исследовании X. Wen и соавт. (2016) провели оценку эффективности и переносимости удаления билатерального невуса Ота у 17 пациентов с использованием Nd:YAG-QS и Alex-QS (755 нм). Авторы указывают, что, при одинаковой клинической эффективности, переносимость пациентами удаления билатерального невуса Ота с применением лазера Nd:YAG-QS была выше, чем при использовании Alex-QS (755 нм) [15]. Также описано комбинированное использование неабляционного фракционного лазера Er:YAG (2940 нм) и Nd:YAG-QS как эффективный и безопасный метод терапии невуса Хори [16].
Таким образом, дермальные меланоцитозы, локализуясь на открытых участках тела, представляют не только медицинскую, но и социальную проблему, а также обуславливают необходимость обследования пациентов в связи с риском поражения органов слуха, зрения, нервной системы, динамического наблюдения для профилактики развития меланомы.
Литература
- Ламоткин И. А. Онкодерматология: атлас. Учебное пособие. M.: Лаборатория знаний, 2017. 878 с.
- Елькин В. Д., Митюковский Л. С., Лысов А. Ю. Практическая дерматоонкология. Справ. руководство по опухолям кожи, опухолеподобным заболеваниям и связанным с ними синдромам. М.: Практическая медицина, 2014. 480 с.
- Almeida F. T., Caldas R., Duarte M. D. L., Brito C. Port-wine stain as a clue for two rare coexisting entities // BMJ Case Rep. 2018. pii: bcr-2018–225721. DOI: 10.1136/bcr-2018–225721/.
- Shima S., Sato S., Moteki Y., Inoue T., Suzuki K., Niimi Y., Okada Y. Supratentorial Meningeal Melanoma with Nevus of Ota: A Case Report // No Shinkei Geka. 2018. 46 (2). P. 139–145.
- Bhat R. M., Pinto H. P., Dandekeri S., Ambil S. M. Acquired Bilateral Nevus of ota-like Macules with Mucosal Involvement: A New Variant of Hori’s Nevus // Indian J Dermatol. 2014. 59 (3). P. 293–296.
- Krieken J. H., Boom B. W., Scheffer E. Malignant transformation in a naevus of Ito. A case report // Histopathology. 1988.12 (1). P. 100–102.
- Gupta D., Thappa D. M. Mongolian spots // IJDVL. 2013. 79 (4). P. 469–478.
- Gupta D., Thappa D. M. Mongolian spots: How important are they? // World J Clin Cases. 2013. 1 (8). P. 230–232. DOI: 10.12998/wjcc.v1.i8.230.
- Horácek J. Pale blue Yamamoto nevus // Cesk Dermatol. 1974. 49 (1). P. 51–54.
- Shirakawa M., Ozawa T., Tateishi C., Fujii N., Sakahara D., Ishii M. Intense pulsed light therapy for aberrant Mongolian spots // Osaka City Med J. 2012. 58 (2). P. 59–65.
- Wong T. H. S. Picosecond Laser Treatment for Acquired Bilateral Nevus of Ota-like Macules // JAMA Dermatol. 2018. DOI: 10.1001/jamadermatol. 2018.2671.
- Belkin D. A., Jeon H., Weiss E., Brauer J. A., Geronemus R. G. Successful and safe use of Q-switched lasers in the treatment of nevus of Ota in children with phototypes IV–VI // Lasers Surg Med. 2018. 50 (1). P. 56–60.
- Nam J. H., Kim H. S., Choi Y. J., Jung H. J., Kim W. S. Treatment and Classification of Nevus of Ota: A Seven-Year Review of a Single Institution’s Experience // Ann Dermatol. 2017. 29 (4). P. 446–453
- Liu Y., Zeng W., Li D., Wang W., Liu F. A retrospective analysis of the clinical efficacies and recurrence of Q-switched Nd: YAG laser treatment of nevus of Ota in 224 Chinese patients // J Cosmet Laser Ther. 2018. 9. P. 1–5.
- Wen X., Li Y., Jiang X. A randomized, split-face clinical trial of Q-switched alexandrite laser versus Q-switched Nd: YAG laser in the treatment of bilateral nevus of Ota // J Cosmet Laser Ther. 2016. 18 (1). P. 12–15.
- Tian B. W. Novel treatment of Hori’s nevus: A combination of fractional nonablative 2,940-nm Er: YAG and low-fluence 1,064-nm Q-switched Nd: YAG laser // J Cutan Aesthet Surg. 2015. 8 (4). P. 227–229.
В. Д. Лях*,
В. В. Гагиев*,
М. А. Уфимцева** , 1 , доктор медицинских наук
И. П. Никулин*
И. Н. Ворожейкина*
А. С. Шубина**
Н. В. Симонова**
* ФГКУЗ 5 ВКГ ВНГ РФ, Екатеринбург
** ФГБОУ ВО УГМУ МЗ РФ, Екатеринбург
Дермальные меланоцитозы/ В. Д. Лях, В. В. Гагиев, М. А. Уфимцева, И. П. Никулин, И. Н. Ворожейкина, А. С. Шубина, Н. В. Симонова
Для цитирования: Лечащий врач № 11/2018; Номера страниц в выпуске: 24-26
Теги: кожа, монгольское пятно, лазерная терапия
Невус
Невус (пигментное пятно, пигментный невус, меланоцитарный невус) – доброкачественное новообразование, которое в большинстве случаев является врожденным пороком развития кожи.
На ограниченном участке образуется скопление особых клеток – невоцитов, которые содержат большое количество пигмента меланина.
Невоциты являются патологически измененными меланоцитами – клетками, которые в норме синтезируют меланин и придают окраску коже. Невоклеточный невус – синоним пигментного невуса. Родинка и невус – также идентичные понятия (сам термин происходит от латинского слова naevus – "родинка").
Лечением и профилактикой невусов занимается врач-дерматолог.
Виды невусов:
Меланоцитарные невусы отличаются большим разнообразием форм, цветов и размеров. До настоящего времени среди врачей нет однозначного мнения по поводу того, какие образования следует обозначать словом "невус".
Поэтому иногда невусами называют доброкачественные кожные опухоли, в которых не содержится пигмент меланин: Гемангиомы – сосудистые опухоли.
Особенно распространено понятие "клубничный невус" - гемангиома красного цвета, которая имеется у большинства новорожденных детей, и проходит в течение первого года жизни.
Также многие врачи оперируют таким понятием, как сосудистый невус.
Невусы сальных желез – в большинстве случаев расположены на голове, также не содержат меланина. Такое новообразование известно как сальный невус.
Иногда врожденными невусами у детей также называют тератомы (гамартомы), которые, по сути, являются врожденными опухолями, состоящими не только из кожи, но и из всех остальных тканей.
Анемичный невус – разновидность сосудистого невуса. Это участок кожи, на котором недоразвиты сосуды, поэтому он имеет более светлую окраску.
Настоящий меланоформный невус – это образование, которое происходит из измененных клеток-меланоцитов – невоцитов.
Различают следующие виды невусов:
Невоклеточный пограничный невус – простое пятно, которое не возвышается на коже, или слегка выступает над ее поверхностью. Пограничный невус имеет четкие контуры и коричневую окраску. Он может иметь различные размеры и располагаться на разных частях тела. При данном виде меланоформного невуса скопление клеток с пигментом находится между верхним (эпидермис) и средним (дерма) слоем коже – такое расположение обозначается как внутриэпидермальный невус.
Интрадермальный невус – наиболее распространенная разновидность меланоформного невуса. Он так называется, потому что скопление пигментных клеток находится в толще среднего слоя кожи – дерме.
Пигментный сложный невус кожи. Такой невус имеет вид родинки: он возвышается на кожей и может иметь различную окраску, от светло-коричневой до практически черной. Часто на нем растут жесткие волосы. Смешанный невус имеет гладкую поверхность, и может находиться на любой части тела.
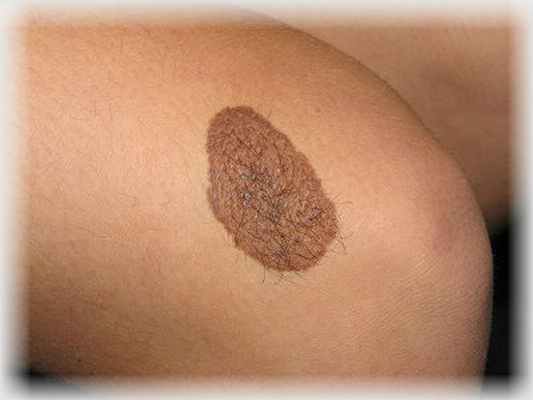
Внутридермальный невус. Также выступает над поверхностью кожи, но, в отличие от сложного невуса, имеет неровную, бугристую поверхность. Практически всегда расположен на голове или на шее, очень редко – на туловище. В большинстве случаев внутриэпидермальный невус появляется в возрасте 10 – 30 лет.
Со временем он как бы отделяется от кожи, и располагается на тонкой ножке. Часто затем он превращается в папилломатозный невус (бородавчатый невус). В нем образуется большое количество неровностей, складок и щелей, в которых скапливаются отмершие клетки верхнего слоя. Здесь могут скапливаться болезнетворные организмы, которые затем приводят к инфекционным процессам.
Голубой невус имеет характерную окраску, так как он связан с отложениями меланина под кожей. Голубые невусы характерны в основном для азиатских национальностей. Они немного возвышаются над кожей, плотные на ощупь, их поверхность всегда гладкая, на ней никогда не растут волосы. Голубой невус имеет небольшую величину, чаще всего не более пяти миллиметров.
Базальный невус также имеет вид родинки, но чаще всего он обладает обычным телесным цветом. Это – беспигментный невус.
Невус сетона (невус сеттона, невус саттона, гало невус) – особая разновидность дермального невуса, когда вокруг пигментного пятна находится участок кожи, полностью лишенный пигмента. Происхождение таких невусов пока до конца не изучено. Они часто сочетаются с витилиго (потерей кожей пигментов), меланомами. Чаще всего в области гало невуса имеется небольшое воспаление в коже.
Невус Ота. Располагается на лице, с одной стороны, в виде "грязных" пятен.
Невус Ита напоминает невус Ота, но он находится под ключицей, на груди, в области лопатки и шеи. Обе этих разновидности встречаются в основном у представителей азиатских народов.
Папилломатозный невус (бородавчатый невус). Похожий на папиллому невус часто имеет большие размеры, находится на голове или сзади на шее, но может располагаться и в иных местах. Он имеет неровную поверхность, как бородавка. Часто на нем растут волосы.
Невус Беккера (волосяной эпидермальный невус) – чаще сего возникает у мальчиков и юношей 10 – 15 лет. Сначала на теле образуется несколько мелких пятен, которые имеют светло-коричневую или коричневую окраску, и находятся рядом. Затем они сливаются и образуют пятна с неровными контурами размерами до 20 см. После этого пятна приобретают неровную бородавчатую поверхность, покрываются волосами. Считается, что к росту невусов Беккера приводит выброс в кровь большого количества мужских половых гормонов – андрогенов.
Линейный невус – новообразование, которое появляется с рождения. Представляет собой множество мелких узелков, от светлого до практически черного цвета, которые расположены на коже в виде цепочки. Линейный невус может занимать всего пару сантиметров, а может и всю руку или ногу. Иногда на нем растут волосы.
Невус глаза – пигментный невус, который расположен на радужной оболочке. Он хорошо заметен в виде пятна, которое может иметь разные размеры и форму. Также невус глаза может находиться на сетчатке: в этом случае он выявляется только во время осмотра офтальмологом.
- мелкие невусы, имеющие размеры 0,5 - 1,5 см;
- средние неводермальные невусы - 1,5 - 10 см;
- крупные пигментные невусы имеют размеры более 10 см;
- если невус располагается на целой области тела, занимая ее практически целиком, то он называется гигантским.
Со временем внешний вид пигментных невусов может изменяться. Меняется и их общее количество на теле: Далеко не всегда можно обнаружить невусы на теле новорожденного. Только у 4 – 10% детей грудного возраста можно выявить родинки. Если невусы с рождения имеют большие размеры, то они наиболее опасны в плане озлокачествления (перехода в меланому).
В подростковом возрасте (10–15 лет) дермальные невусы можно встретить у 90% лиц.
В среднем у человека в возрасте 20-25 лет на теле можно насчитать до 40 родинок.
После 30 лет на коже остается только 15 – 20 невусов.
У человека, достигшего 80 – 85 лет практически невозможно обнаружить невусы на теле. Такую динамику связывают с изменением гормонального фона в течение жизни человека.
Причины возникновения:
Многие исследователи склоняются к мысли, что абсолютно все пигментные невусы, даже те, которые появляются с возрастом, являются врожденными пороками развития кожи.
Нарушения, которые приводят к образованию этой доброкачественной опухоли, возникают еще в эмбриональном состоянии организма. До настоящего времени пока не изучены все врожденные причины образования диспластических невусов.
В качестве основных факторов можно выделить:
Колебания уровня половых гормонов в организме беременной женщины:
- прогестинов и эстрогенов.
- Инфекции мочеполовой системы у беременных. Воздействие на организм беременной женщины неблагоприятных факторов: токсичных веществ, излучений.
- Генетические нарушения. Под действием всех этих факторов нарушается развитие меланобластов – клеток, из которых впоследствии образуются меланоциты. В итоге меланобласты скапливаются на определенных участках кожи и трансформируются в клетки-невоциты.
Невоциты отличаются от нормальных меланоцитов двумя особенностями:
- У них нет отростков, по которым пигмент мог бы распространяться в другие клетки кожи;
- Диспластические невусы хуже подчиняются общим регулирующим системам организма, но, в отличие от раковых клеток, утратили эту способность не полностью.
- Гормональные перестройки организма. Это очень ярко проявляется в подростковом возрасте, когда на теле появляется большая часть невусов.
- Действие на кожу ультрафиолетовых лучей. Частые солнечные ванны и солярии способствуют росту пигментных пятен.
- Беременность. Как уже отмечалось выше, это связано с колебанием уровня половых гормонов в организме женщины.
- Менопауза.
- Прием контрацептивов.
- Воспалительные и аллергические заболевания кожи (угри, дерматиты, различные сыпи).
Диагностика невусов:
Перед врачом, который осуществляет диагностику невуса, стоит ряд важных задач:
- установить разновидность невуса и определить возможности его лечения;
- вовремя распознать начало процесса озлокачествления пигментного пятна;
- определить показания к проведению дополнительных методов диагностики.
Обследование пациента начинается классически с беседы и осмотра. Во время расспроса врач устанавливает важные подробности: когда появился неводермальный невус.
Особенно важно, имеется ли он с рождения, или возник с возрастом; как образование вело себя в течение последнего времени:
- увеличивалось ли в размерах,
- изменяло ли цвет, контуры, общий внешний вид;
- проводилась ли ранее диагностика и лечение, каков был результат

Непосредственный контакт с пациентом очень важен. Ни один профессиональный специалист не возьмется ставить диагноз и лечить невус по фото. После расспроса пациента следует осмотр. Доктор должен оценить форму, размер, расположение невуса, наличие на нем волос и иные особенности. После этого уже может быть поставлен точный диагноз и намечены определенные лечебные мероприятия.
При необходимости врачом назначаются дополнительные методы диагностики. Чаще всего применяются мазки с поверхности невуса. Абсолютными показаниями к данному исследованию является мокнутие, кровоточивость, трещины на поверхности пигментного пятна. Во время мазка получают материал, который затем изучают при помощи микроскопа.
Лабораторная диагностика применяется для установления процесса перерождения невуса в меланому. При озлокачествлении пигментного пятна в крови пациента появляются особые вещества – онкомаркеры. Их обнаружение позволяет точно установить диагноз, так как только при меланоме в крови определяются две молекулы, имеющие название TA90 и SU100. При других злокачественных опухолях выявляются другие онкомаркеры.
Для проведения анализа на онкомаркеры необходимы четкие показания: врач должен иметь веские основания подозревать переход невуса в меланому. Кроме того, само удаление дермального невуса может стать диагностической процедурой.
После того, как пигментное пятно удалено, врач отправляет его на гистологическое исследование. Маткриал осматривают под микроскопом и, в случае обнаружения злокачественного перерождения, пациента снова просят явиться в клинику.
Лечение невуса:
В настоящее время существует несколько методов лечения пигментных невусов, как хирургическим путем, так и альтернативными способами.
Показания определяются только лечащим врачом с учетом двух факторов:
Особенности самого пигментного пятна: разновидность, размеры, риск перехода в меланому.
Наличие в больнице необходимого оборудования
Хирургический метод
Удаление пигментного невуса хирургическим путем (при помощи скальпеля) – наиболее распространенная методика, так как она не требует специального оборудования и отличается надежностью.
Криодеструкция
Криодеструкция – метод, предусматривающий лечение невуса при помощи заморозки. После обработки низкими температурами пигментное пятно отмирает и превращается в струп (корочку), под которой растет новая нормальная кожа.Лечение невуса низкой температурой может осуществляться только в том случае, если он имеет небольшие размеры, и расположен поверхностно, но не сильно выступая над кожей.
Электрокоагуляция
Это методика, которая противоположна криокоагуляции. Иссечение невуса осуществляется под действием высокой температуры.Процедура болезненная, поэтому требует применения местной анестезии, а у детей – только общего наркоза.
Лазерная терапия
Удаление невусов лазером – метод лечения, который широко распространен в современных косметологических салонах. Он отлично подходит для того, чтобы удалять небольшие родинки в области лица, шеи и на других частях тела. Лазерное излучение отличается тем, что оно способно проникать в кожу на большую глубину в пределах точно заданной площади. При этом не образуется шрамов, ожогов, рубцов и других осложнений. Процедура безболезненна.
Радиохирургические методы
В последние годы радиохирургия все активнее используется в мировой медицине. Суть этих методик состоит в том, что специальным прибором, - радионожом (сургитроном) генерируется пучок радиоактивного излучения, который концентрируется только в области патологического очага, не нанося вреда здоровым окружающим тканям. Таким образом могут быть удалены практически любые доброкачественные и злокачественные опухоли, в том числе и пигментные невусы.
Некоторые особые показания Если имеется подозрение на злокачественное перерождение невуса, то используется, как правило, только хирургическое иссечение.
При этом удаляются все окружающие ткани, для предотвращения дальнейшего роста опухоли. Некоторые разновидности невусов лечатся только хирургическим путем.
Большинство методов лечения невусов проводится в нашей клинике опытными врачами-дерматологами. Для получения консультации и записи на прием, звоните или записывайтесь через форму.
Невус Ямамото
Рева И.В. 2, 1 Рева Г.В. 2 Ямамото Т. 1 Можилевская Е.С. 2 Даниленко М.В. 2 Новиков А.С. 2 Толмачёв В.Е. 2 Калинин О.Б. 2 Перерва О.В. 2 Маломан Н.В. 2 Гиря О.В. 2 Разумов П.А. 2 Грахова Н.В. 2
Изучена пролиферативная активность покровных эпителиоцитов слизистых оболочек желудочно-кишечного тракта, органов дыхания, выделительной системы, эпидермиса кожи, роговицы глаза. Установлено, что при физиологической регенерации эпителиальных пластинок в регуляции пролиферативной активности эпителиоцитов принимают участие эффекторные иммуноциты CD4, CD8, CD68, CD163, CD204, которые являются не только источниками факторов роста, но и осуществляют контроль за удалением повреждённых клеток. Выявлена динамика количества иммуноцитов как в возрастном аспекте, так и при репаративной регенерации на фоне микробной контаминации различной этиологии, при повреждении в результате термотравмы, а также при малигнизации. Представлены особенности репаративной регенерации покровных эпителиальных пластов слизистых оболочек различных систем органов человека и эпидермиса кожи в зависимости от локализации. Проведён количественный анализ иммуноцитов эпителиальных пластинок в зависимости от генома инфекционных патогенов. Установлена роль иммуноцитов в запуске апоптоза и малигнизации кератиноцитов.
1. Akita S., Akino K., Hirano A. Basic Fibroblast Growth Factor in Scarless Wound Healing.//Adv Wound Care (New Rochelle). 2013 Mar;2(2):44–49.
2. Almeida S., Ryser S., Obarzanek-Fojt M., Hohl D., Huber M. The TRAF-interacting protein (TRIP) is a regulator of keratinocyte proliferation // J Invest Dermatol. 2011 Feb;131(2):349–57.
3. Aragona M., Panciera T., Manfrin A., Giulitti S., Michielin F., Elvassore N., Dupont S., Piccolo S. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors // Cell. 2013 Aug 29;154(5):1047–59.
4. Calvo K.L., Ronco M.T., Noguera N.I., García F. Benznidazole modulates cell proliferation in acute leukemia cells // Immunopharmacol Immunotoxicol. 2013 Aug;35(4):478–86.
5. Camicia R., Bachmann S.B., Winkler H.C., Beer M., Tinguely M., Haralambieva E., Hassa P.O. BAL1/ARTD9 represses the anti-proliferative and pro-apoptotic IFNγ-STAT1-IRF1-p53 axis in diffuse large B-cell lymphoma // J Cell Sci. 2013 May 1;126(Pt 9):1969–80.
6. Hirobe T., Terunuma E. Reduced proliferative and differentiative activity of mouse pink-eyed dilution melanoblasts is related to apoptosis // Zoolog Sci. 2012 Nov;29(11):725–32.
7. Gao J.L., Lv G.Y., He B.C., Zhang B.Q., Zhang H., Wang N., Wang C.Z., Du W., Yuan C.S., He T.C. Ginseng saponin metabolite 20(S)-protopanaxadiol inhibits tumor growth by targeting multiple cancer signaling pathways // Oncol Rep. 2013 Jul;30(1):292–8.
8. Ershov V.A., Chirskiĭ V.S., Viazovaia A.A., Narv skaia O.V., Lisianskaia A.S. Activity of proliferative and apoptotic processes in the integration of human papillomavirus type 16 DNA into the cervical epithelium.//Arkh Patol. 2013 Mar-Apr;75(2):16–9.
10. Laptev M.V., Nikulin N.K. A mathematical model of paracrine regulation of the proliferative activity of epidermis with the participation of T-lymphocytes // Biofizika. 2010 Mar-Apr;55(2):361–74.
11. Samuels T.L., Pearson A.C., Wells C.W., Stoner G.D., Johnston N. Curcumin and anthocyanin inhibit pepsin-mediated cell damage and carcinogenic changes in airway epithelial cells // Ann Otol Rhinol Laryngol. 2013 Oct;122(10):632–41.
12. Shi H.L., Wu X.J., Liu Y., Xie J.Q. Berberine counteracts enhanced IL-8 expression of AGS cells induced by evodiamine // Life Sci. 2013 Nov 19;93(22):830–9.
13. Yuan Y., Zhang J., Cai L., Ding C., Wang X., Chen H., Wang X., Yan J., Lu J. Leptin induces cell proliferation and reduces cell apoptosis by activating c-myc in cervical cancer // Oncol Rep. 2013 Jun;29(6):2291–6.
14. Wang H., Sun Y., Liu S., Yu H., Li W., Zeng J., Chen C., Jia J. Upregulation of progranulin by Helicobacter pylori in human gastric epithelial cells via p38MAPK and MEK1/2 signaling pathway: role in epithelial cell proliferation and migration // FEMS Immunol Med Microbiol. 2011 Oct;63(1):82–92.
Покровные эпителиальные пласты различных систем органов человека подвергаются высокой антигенной нагрузке [11]. В первую очередь вредным влияниям подвергаются кератиноциты, и от их функциональной лабильности зависит уровень резистентности организма к повреждающим агентам [3]. Тем не менее в настоящее время практически отсутствуют данные об изменениях клеточного состава эпителиальных пластов эпидермиса кожи и слизистых оболочек не только в условиях репаративной регенерации, но также и при физиологической регенерации [1, 9]. Данные о возрастных особенностях иммунного гомеостаза и барьерных свойствах покровных эпителиев, несмотря на многочисленные исследования, пока не являются достаточными, чтобы управлять процессами заживления ткани с восстановлением её функции [5, 13]. Образование грубых и даже келоидных рубцов, сопровождающих гиперрегенерацию, трофических язв, образующихся на фоне гипорегенерации, свидетельствует о том, что изучение механизмов регенерации и контроля за этим процессом клеток иммунофагоцитарного звена, обеспечивающего наряду с кератиноцитами барьерные свойства покровных эпителиев, на современном этапе является одним из наиболее актуальных вопросов в современной хирургии, косметологии, гастроэнтерологии, онкологии [2, 6].
Цель исследования – совершенствование диагностики, лечения и прогнозирование исходов повреждений покровных эпителиев на основе анализа локального иммунного гомеостаза при микробной контаминации, термотравме, малигнизации.
Материал и методы исследования
Исследование было проведено с учётом положений Хельсинской декларации (2000) и с разрешением этического комитета ФГАОУ ВПО «Дальневосточный федеральный университет». Материалом послужили биоптаты кожи, слизистых оболочек ЖКТ, включая слизистую оболочку полости рта, органов дыхания, включая слизистую оболочку гайморовой пазухи, выделительной системы, а также слизистой оболочки шейки матки, взятые у пациентов по клиническим показаниям во время лечебных мероприятий.
Основным методом морфологического исследования явилось иммуногистохимическое фенотипирование на основе кластеров дифференцировки (Cluster of Differentiation – CD) предшественников дендритных клеток (СD11+ /СD303+), клеток Лангерганса (СD68+), интерстициальных макрофагов (СD163+), тучных клеток (СD204+), T-лимфоцитов (СD4+ /СD8+). Интенсивность пролиферативных процессов в эпителиальной пластинке оценивалась по митотическому индексу посредством маркера Ki-67: количество митозов на 100 клеток. Иммуноморфологическое исследование проводили в лаборатории патоморфологии университета г. Ниигата (Япония).
Кроме того, при анализе биопсий использовались рутинные методики (окраски гематоксилином и эозином, по Ван-Гизону, по Браше и альциановым синим), серебрение – для определения активности ядрышкового организатора рибосом, фазовоконтрастная и электронная микроскопия. В дополнение к биопсийному анализировался и цитологический материал – мазки-отпечатки слизистых оболочек различных систем органов.
Изучение гистологических срезов и мазков-отпечатков осуществлялось с помощью микроскопа Olympus BX52 с оригинальным программным обеспечением для морфометрии.
Статистическая обработка полученных данных, проверка статистической значимости различий между группами по параметрам распределения и сравнение групп выборок проведено с применением методов вариационной статистики, параметрических и непараметрических методов корреляционного анализа.
Результаты исследования и их обсуждение
Проведенные нами исследования по изучению закономерностей распределения эффекторных клеток CD68 в коже человека в условиях репаративной регенерации кожи после ожоговой травмы показали, что идентификация АПК CD68 происходит, как и в здоровой коже, только в эпидермисe [9]. В коже человека при термотравме сохраняется общая закономерность распределения иммуноцитов CD68, но количество клеток CD68 в эпидермисе кожи с термотравмой выше, чем в условиях физиологической регенерации (р < 0,01). Это может свидетельствовать о том, что миграция CD68 при репаративной регенерации в структуре кожи при ожогах подчиняется тем же механизмам, что и при физиологической, но в условиях повреждения кожи возникает повышенный запрос ткани на миграцию макрофагов для фагоцитоза некротизированных клеток, а также для защиты от контаминирующих микроорганизмов [10].
При HPV инфекции эпидермис и дерма подвергаются гипертрофии, появляются папилломатозные разрастания, эпидермис и прилежащий сосочковый слой инфильтрируются лейкоцитарным пулом клеток, как и в исследованиях других авторов [14]. Установлено, что при папилломавирусной инфекции одним из ключевых моментов в дисгенезе и нарушениях нормального хода регенерации эпидермальных пластов и дермы кожи может быть извращение антигенпрезентации и нарушений в дальнейшем иммунных клеточных взаимодействий [5]. При физиологическом старении снижается миграционная активность клеток CD68 в ответ на воздействие ФНО-а, на их поверхности уменьшается число молекул адгезии, продуктов генов главного комплекса гистосовместимости II класса и костимулирующих молекул, а продуцируемый кератиноцитами 1L-10 дополнительно угнетает антигенпрезентирующие функции дендритных клеток. Клинически это сочетается с подавлением контактной гиперчувствительности у пожилых лиц и снижением защитных реакций в ответ на контаминацию HPV [8]. Нарушение хода физиологической регенерации и появление участков гипертрофии связано с тропностью HPV к камбиальным клеткам эпидермиса, нарушением функции антигенпрезентации CD68, их расположением в подлежащей эпителию соединительной ткани на фоне снижения количества, а затем полного их отсутствия в эпителиальных пластах, что может свидетельствовать о нарушении антигенпредставления в структурах кожи человека и последующем снижении контроля за физиологической и репаративной регенерацией в целом, запуску процесса адаптивной гипертрофии в структурах кожи для сохранения барьерных свойств эпителия [12]. Высокая скорость пролиферации развивается на фоне несоответствия дифференцировки и специализации клеток дифферона кератиноцитов, хронической инфильтрации лейкоцитами соединительной ткани и нарушения вследствие гибели кератиноцитов в системе взаимодействия эффекторных иммуноцитов, а также апоптозу дифферона кератиноцитов эпидермиса [4] (таблица).
Читайте также:
