Обзор гемостаза
Добавил пользователь Евгений Кузнецов Обновлено: 15.01.2026
1. Баркаган З.С. Диагностика и контролируемая терапия нарушений гемостаза / З.С. Баркаган, А.П. Момот. – М.: Ньюдиамед, 2001. – 296 с.
3. Патофизиология: учебник: в 2-х томах / под ред. В.В. Новицкого, Е.Д. Гольдберга, О.И. Уразовой. – М.: ГЭОТАР-Медиа, 2009. – Т. 2. – С. 111.
Система гемостаза (haemostasis от греч. haima кровь и stasis – стояние) – совокупность биологических и биохимических механизмов, обеспечивающих сохранение жидкого состояния циркулирующей крови, поддержание целостности кровеносных сосудов и купирование кровотечения при их повреждении [3].
До настоящего времени для понимания механизмов гемостаза использовали «каскадную» модель (водопада) процесса свертывания крови. Она была предложена в 1964 г., двумя независимыми группами учёных (Davie E.W., Ratnoff O.D., Macfarlane R.G.), где процесс свертывания крови подразделяется на первичный, или сосудисто-тромбоцитарный, гемостаз и вторичный, или коагуляционный, гемостаз, с выделением в последнем «внешнего», «внутреннего» путей активации тромбина и «общего пути» (см. рис. 1). Своего рода третьим этапом свертывания крови является процесс лизиса кровяного сгустка (фибринового тромба) – фибринолиз [1]. Эта модель сохраняет свое значение только как отражение процессов свертывания крови in vitro. Ставшее классическим словосочетание «коагуляционный каскад» не совсем верно отражает суть функционирования системы гемостаза. «Каскад» подразумевает простую однонаправленную цепочку событий, в то время как в процессе коагуляции имеется множество перекрёстных реакций. С одной стороны, действуют силы самоусиления, в результате чего каждый предшествующий фактор вовлекает в процесс активации не такое же, а значительно большее количество молекул последующих факторов, а с другой стороны, механизм самоторможения [2].
«Каскадная» модель свертывания крови, объясняющая этапность процесса свертывания крови in vitro, не объясняет остановку кровотечения in vivo. Прежде всего, она не отвечает на вопрос, почему возможность образования протромбиназы (активатора тромбина) по одному пути не компенсирует поломку в другом. В последнее время получены убедительные данные о том, что в организме человека оба пути тесно связаны между собой и с тромбоцитами. На основе этих знаний разработана «клеточная» модель свёртывания крови (cell-based model of coagulation), призванная описать процессы гемокаогуляции in vivo и объяснить ограничения, которые необходимо учитывать при интерпретации результатов лабораторных коагуляционных тестов. Эта теория была предложена Н.Hoffman в 2001 г.[4].
Основные идеи современной концепции свертывания крови in vivo:
1. In vivo процесс свертывания крови является единым и связан с гемостатическими реакциями тромбоцитов. Тромбоциты не только участвуют в активации коагуляционных факторов, но и выполняют функцию регуляции всего процесса свертывания крови.
2. Коагуляционный процесс в физиологических условиях локализован зоной дефекта сосуда. Его нераспространению способствуют противосвертывающая система и нормально функционирующие эндотелиоциты.
3. Избыток тромбина в организме человека инактивируется антитромбином III, который также активен в отношении факторов XIIa, XIa, IXa, Xa.
4. Поддержанию крови в жидком состоянии способствуют ретикулоэндотелиальная система и гепатоциты посредством специфического удаления активированных факторов свертывания крови и фибриногена без какого-либо влияния на предшественники, путем ограничения распространения коагуляции при участии ингибитора пути тканевого фактора (tissue factor path way inhibitor, TFPI), тромбомодулина, гепариноподобных гликозаминогликанов поверхности эндотелиоцитов.
Современная модель вторичного гемостаза включает три фазы (см. рис. 2):
• инициации, или стартового сигнала (образуется комплекс «тканевой фактор (ТФ)/фактор VIIа» на поверхности субэндотелия в месте повреждения, что сопровождается продукцией тромбина);
• усиление процесса (под воздействием тромбина активируется целый ряд коагуляционных факторов);
• распространение процесса (формируются теназный (VIIIа/IXа) и протромбиназный (Vа/Xа/кальций/фактор III тромбоцитов) комплексы, что провоцирует так называемый тромбиновый взрыв и образование стабильного сгустка фибрина) [4].
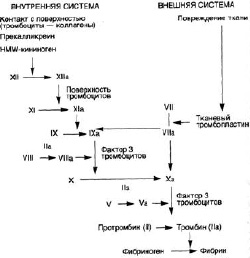
Рис. 1. Каскадная модель коагуляционного гемостаза (1964 г.)
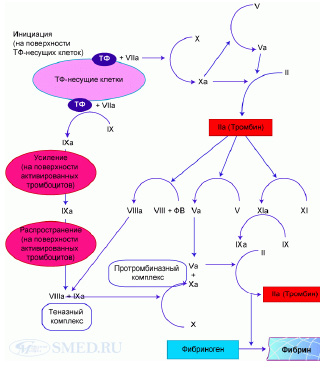
Рис. 2. Клеточная теория свёртывания крови (ТФ – тканевой фактор; ФВ – фактор Виллебранда)
Рассмотрим более подробно каждую фазу клеточной модели:
I. Инициация: в первую фазу (инициации) на поверхности клеток, содержащих ТФ, происходит активация ФVII (в физиологических условиях ТФ содержат фибробласты, гладкомышечные клетки сосудов; при воспалении ТФ-несущими становятся эндотелиальные клетки, моноциты; при ряде патологических состояний, включая антифосфолипидный синдром – нейтрофилы). При повреждении сосудистой стенки клетки, несущие ТФ, начинают контактировать с плазмой. Одновременно обнажаются субэндотелиальные структуры (коллаген), что приводит к скоплению в этой области тромбоцитов (адгезия). ТФ связывается с ФVII с образованием комплекса ТФ/ФVIIa. Этот комплекс локально на поверхности ТФ – несущих клеток активирует ФX и ФIX. Фактор IXa мигрирует и связывается с поверхностью тромбоцитов, в то время как фактор Xa остаётся на поверхности клеток, несущих ТФ (его переносу на поверхность тромбоцитов препятствуют плазменные ингибиторы (ИПТФ), АТ III, которые мгновенно инактивируют ФXa; на ФIXa ИПТФ не влияет, а АТ III – значительно слабее, чем на ФXa). Согласно клеточной модели, фактор IXa не играет существенной роли в первую фазу коагуляции. Фактор Xa активирует ФV. В результате, образовавшийся на поверхности ТФ-несущих клеток комплекс ФXa/ФVa расщепляет протромбин (ФII) с образованием небольшого количества тромбина (ФIIa) – ключевого фактора последующего усиления активации системы свёртывания.
II. Усиление: реакции фазы усиления (амплификации) происходят на поверхности тромбоцитов. Пространственное разделение процессов коагуляции (фаза инициации – на поверхности ТФ-несущих клеток, фаза усиления – на поверхности тромбоцитов) – один из механизмов ограничения их выраженности при отсутствии необходимости в свёртывании крови. Небольшое количество тромбина, образовавшегося в фазу инициации, активирует тромбоциты, факторы V, VIII и XI. Тромбин способствует высвобождению ФVIII из комплекса с фактором Виллебранда, в результате образуется ФVIIIa. Активированный ФXI (ФXIa) приобретает способность связываться с поверхностью тромбоцитов. Активированные небольшим количеством образовавшегося в фазу инциации тромбина факторы в следующую фазу (фазу распространения) обеспечивают формирование на тромбоцитарной матрице огромного количества тромбина, которое способно перевести фибриноген в фибрин. Таким образом, вышедший из фазы инциации тромбин выступает в качестве мощного усилителя коагуляции.
III. Распространение: в фазу распространения на поверхности активированных тромбоцитов формируются теназный (ФVIIIa/ФIXa) и протромбиназный (ФVa/ФXa) комплексы. ФVIII активируется в фазу усиления и фиксируется на тромбоцитах. ФIXa переносится на поверхность тромбоцитов с места активации (поверхность ТФ-несущих клеток) ещё в фазу инициации; дополнительное его количество образуется на тромбоцитах под действием образованного в фазу усиления ФXIa. Теназный комплекс на поверхности тромбоцитов активирует ФX, связанный со своим кофактором ФVa (пришедшим из фазы усиления). Образовавшийся протромбиназный комплекс обеспечивает лавинообразное нарастание уровня тромбина. Тромбин переводит фибриноген (ФI) в фибрин (ФIa), а также активирует ФXIII, обеспечивающий стабилизацию фибриновых нитей и образование множества ковалентных перекрёстных связей между ними [2].
Таким образом, ставшее классическим словосочетание «коагуляционный каскад» не совсем верно отражает суть функционирования системы гемостаза. «Каскад» подразумевает простую однонаправленную цепочку событий, в то время как в процессе коагуляции имеется множество перекрёстных реакций, что необходимо учитывать в диагностике и лечении патологии гемостаза.
Обзор гемостаза (Overview of Hemostasis)
Сосудистые факторы снижают кровопотерю, обусловленную травмой, с помощью механизма локальной вазоконстрикции (немедленная реакция на повреждение) и компрессии поврежденных кровеносных сосудов путем экстравазации крови в окружающие ткани. При повреждении сосудистой стенки происходят адгезия и агрегация тромбоцитов и генерация фибриновых полимеров из фибриногена; взаимодействие тромбоцитов с фибрином формирует тромб.
Тромбоциты
Ток крови, благодаря предотвращению агрегации тромбоцитов и расширению интактных кровеносных сосудов, сохраняется с помощью различных механизмов, к которым относятся высвобождаемые эндотелиальными клетками простациклин и оксид азота. Производство этих медиаторов прекращается при повреждении эндотелия сосудистой стенки. В этих условиях происходят адгезия тромбоцитов к поврежденной интиме сосудистой стенки и формирование тромбоцитарных агрегатов. Начальная адгезия тромбоцитов к волокнам коллагена связана с фактором Виллебранда (ФВ), который был предварительно секретирован и связан стимулированными эндотелиальными клетками. ФВ взаимодействует с рецепторами на поверхности тромбоцитарной мембраны (гликопротеин Ib/IX). Тромбоциты, которые зацепились за стенки сосуда, подвергаются активации. При этом тромбоциты высвобождают медиаторы агрегации, включая аденозин дифосфат (АДФ), из накопительных вакуолей.
Другие биохимические изменения, происходящие в результате активации тромбоцитов, включают
Гидролиз мембранных фосфолипидов
Мобилизацию внутриклеточного кальция
Фосфорилирование внутриклеточных белков
Арахидоновая кислота преобразуется в тромбоксан A2; эта реакция требует участия циклооксигеназы тромбоцитов и необратимо ингибируется аспирином и обратимо многими НПЗП (нестероидными противовоспалительными препаратами).
АДФ, тромбоксан A2 и другие медиаторы провоцируют агрегацию дополнительных тромбоцитов к поврежденному эндотелию и активируют их. Тромбоцитарные рецепторы АДФ включают рецептор P2Y12, который посылает сигналы для подавления аденилатциклазы, уменьшает уровень циклического аденозин монофосфата (цАМФ) и способствует активации рецептора гликопротеина IIb/IIIa (образующегося на поверхности мембраны активированного тромбоцита из гликопротеинов IIb и IIIa). Фибриноген связывается с гликопротеиновым комплексом IIb/IIIa расположенных рядом тромбоцитов и соединяет их друг с другом.
Сборка и активация коагуляционных комплексов и образование тромбина проходят на поверхности тромбоцитов. Тромбин превращает фибриноген в мономеры фибрина, а мономеры фибрина полимеризуются в полимеры фибрина, которые соединяют агрегированные тромбоциты в тромбоцитарно-фибриновые гемостатические пробки.
Плазменные факторы свертывания
Факторы свертывания крови воздействуют друг на друга на поверхности тромбоцитов и эндотелиальных клеток с целью производства тромбина, который превращает фибриноген в фибрин. Фибрин укрепляет тромб за счет формирования гемостатической пробки и ее закрепления.
При внутреннем пути свертывания фактор XII, высокомолекулярный кининоген, прекаликреин и активированный фактор XI (фактор XIa) взаимодействуют для производства активированного фактора IХa из фактора IX. Фактор IХa затем взаимодействует с фактором VIIIа и прокоагулянтными фосфолипидами (присутствуют на поверхности активированных тромбоцитов, эндотелиальных клеток и клеток тканей) для создания комплекса, активирующего Х.
При внешнем пути фактор VIIа и тканевой фактор (ТФ) непосредственно активируют фактор Х (и, возможно, также фактор IX – см. рисунок Пути свертывания крови Метаболические механизмы свертывания крови [Pathways in blood coagulation] и таблицу Компоненты реакции свертывания крови Составляющие реакций свертывания крови [Components of Blood Coagulation Reactions]).
Многие (или большинство) коагуляционных протеинов вырабатываются в эндотелиальных клетках сосудов, включая эндотелиальные клетки, выстилающие синусоиды печени. Некоторые коагуляционные белки также могут вырабатываться другими типами клеток (например, тканевым фактором фибробластами).
Метаболические механизмы свертывания крови
Активация внутреннего или внешнего пути стимулирует общий путь свертывания, что приводит к образованию фибринового сгустка. Общий путь активации состоит из трех шагов:
Протромбиназа вырабатывается на поверхности активированных тромбоцитов, эндотелиальных и других тканевых клеток. Протромбиназа представляет собой комплекс из фермента, фактора Ха и кофактора, фактора Va на поверхности прокоагулянтного фосфолипида.
Протромбиназа расщепляет протромбин до тромбина.
Тромбин стимулирует создание мономеров и полимеров фибрина из фибриногена и активирует растворимый фактор VIII и фактор XI. Тромбин также активирует фактор XIII – фермент, катализирующий образование более сильных ковалентных связей между мономерами фибрина.
Ионы кальция требуются для большинства реакций образования тромбина и, соответственно, кальций-хелатирующие агенты (например, цитрат, этилендиаминтетрауксусная кислота) используются в качестве антикоагулянтов в условиях in vitro. Витамин К-зависимые факторы свертывания крови (факторы II, VII, IX и X) в норме связываются с фосфолипидами с помощью кальциевых мостиков для участия в процессе свертывания крови. Реакции коагуляции не могут протекать должным образом при отсутствии витамина К. Витамин К-зависимые регуляторные белки свертывания включают протеины С, S и Z.
Хотя пути свертывания крови достаточно полезны для понимания механизмов и лабораторной оценки коагуляционных нарушений, в естественных условиях в процессе коагуляции не участвуют фактор XII, прокалликреин или высокомолекулярный кининоген. У людей с наследственным дефицитом этих факторов отсутствуют нарушения гомеостаза. У людей с наследственным дефицитом фактора XI может наблюдаться легкое или умеренное нарушение свертываемости крови. In vitro растворимый фактор XI может быть активирован тромбином. Однако между уровнем плазматического фактора XI и вероятностью или степенью кровотечения устойчивая связь отсутствует. Растворимый фактор IX может активироваться in vitro как фактором XIa, так и фактором VIIa/комплексами тканевого фактора.
В естественных условиях инициирование внешнего пути возникает, когда повреждение кровеносных сосудов приводит кровь к контакту с тканевым фактором на мембранах клеток в пределах и в окружении сосудистой стенки. Контакт с тканевым фактором запускает образование комплекса фактор VIIa/тканевой фактор, который активирует фактор X (и, возможно, фактор IX, внутренний фактор). Фактор IXa в комбинации со своим кофактором, фактором VIII на поверхности фосфолипидной мембраны также генерирует фактор Ха. Активация фактора X комплексами фактора IXa/VIIIa необходима для нормального гемостаза. Необходимость этого процесса для факторов VIII и IX объясняет, почему при гемофилии Гемофилия Гемофилия является общим наследственным нарушением свертываемости крови, вызванным недостатком фактора свертывания крови VIII или IX. Частоту и тяжесть кровотечений определяет степень дефицита. Прочитайте дополнительные сведения типа А (дефицит фактора VIII или фактора IX) или типа В (дефицит фактора IX) возникает кровотечение. Активация фактора X комплексами фактор VIIa/тканевой фактор на внешнем пути свертывания не генерирует достаточное количество тромбина (и фибрина) для предотвращения кровотечения у пациентов с тяжелыми формами гемофилии А или В.
Регуляторные механизмы уравновешивают процесс формирования тромбов. Нарушения системы гемостаза могут привести к повышенной кровоточивости или тромбозам.
Сосудистые факторы гемостаза
Тромбоциты
При помощи различных механизмов, к которым относятся высвобождаемые эндотелиальными клетками простациклин и окись азота, сохраняется ток крови, предотвращается образование тромбоцитарного стаза, расширяются интактные кровеносные сосуды. Производство этих медиаторов прекращается при повреждении эндотелия сосудистой стенки. В этих условиях происходят адгезия тромбоцитов к поврежденной интиме сосудистой стенки и формирование тромбоцитарных агрегатов. Начальная адгезия тромбоцитов к волокнам коллагена связана с фактором Виллебранда (ФВ), который был предварительно секретирован и связан стимулированными эндотелиальными клетками. ФВ взаимодействует с рецепторами на поверхности тромбоцитарной мембраны (гликопротеин Ib/IX). Тромбоциты, которые зацепились за стенки сосуда, подвергаются активации. При этом тромбоциты высвобождают медиаторы агрегации, включая аденозиндифосфат (АДФ), из накопительных вакуолей.
- Гидролиз мембранных фосфолипидов
- Ингибирование аденилатциклазы
- Мобилизацию внутриклеточного кальция
- Фосфорилирование внутриклеточных белков
Арахидоновая кислота преобразуется в тромбоксан A2; эта реакция требует участия циклооксигеназы и необратимо ингибируется аспирином и обратимо многими нестероидными противовоспалительными препаратами.
Сборка и активация коагуляционных комплексов и образование тромбина проходят на поверхности тромбоцитов. Тромбин превращает фибриноген в мономеры фибрина. Полимеры фибрина соединяют агрегированные тромбоциты для сохранения тромбоцитарно-фибриновой гемостатической пробки.
Плазменные факторы свертывания
Плазменные факторы свертывания крови воздействуют друг на друга с целью производства тромбина, который превращает фибриноген в фибрин. Фибрин укрепляет тромб за счет формирования гемостатической пробки и ее закрепления.
При внешнем пути фактор VIIа и тканевой фактор (ТФ) непосредственно активируют фактор Х (и, возможно, также фактор IX – см. рисунок Пути свертывания крови [Pathways in blood coagulation] и таблицу Компоненты реакции свертывания крови [Components of Blood Coagulation Reactions]).
Составляющие реакций свертывания крови
Номер или название фактора
Синоним
Назначение
Факторы плазмы
Предшественник тромбина, который превращает фибриноген в фибрин; активирует растворимые факторы V, VIII, XI и XIII; и связывается с тромбомодулином, активируя протеин С
Является витамин К-зависимым
Активируется до фактора Va – кофактора для ферментативного фактора Xa в комплексе фактор-Ха/Va/фосфолипид, который расщепляет протромбин до тромбина
Присутствует в альфа-гранулах тромбоцитов
- Протроминовая конвертаза вырабатывается на поверхности активированных тромбоцитов, эндотелиальных и других тканевых клеток. Протромбиновая конвертаза представляет собой комплекс из фермента, фактора Ха и кофактора, фактора Va на поверхности прокоагулянтного фосфолипида.
- Протромбиновая конвертаза расщепляет протромбин до тромбина.
- Тромбин стимулирует создание мономеров и полимеров фибрина из фибриногена. Тромбин также активирует фактор XIII – фермент, катализирующий образование более сильных ковалентных связей между мономерами фибрина, а также активирующий растворимый фактор VIII и фактор XI.
Ионы кальция требуются для большинства реакций образования тромбина и, соответственно, кальций-хелатирующие агенты (например, цитрат, этилендиаминтетрауксусная кислота) используются в качестве антикоагулянтов в условиях in vitro. Витамин К-зависимые факторы свертывания крови (факторы II, VII, IX и X) в норме связываются с фосфолипидами с помощью кальциевых мостиков для участия в процессе свертывания крови. Реакции коагуляции не могут протекать должным образом при отсутствии витамина К.
Хотя пути свертывания крови достаточно полезны для понимания механизмов и лабораторной оценки коагуляционных нарушений, в естественных условиях в процессе коагуляции не участвуют фактор XII, прокалликреин или высокомолекулярный кининоген. У людей с наследственным дефицитом этих факторов отсутствуют нарушения гомеостаза. У людей с наследственным дефицитом фактора XI наблюдается легкое или умеренное нарушение свертываемости крови. In vitro растворимый фактор XI может быть активирован тромбином. Между уровнем плазматического фактора XI и вероятностью или степенью кровотечения отсутствует устойчивая связь, хотя растворимый фактор IX может активироваться in vitro как фактором XIa, так и комплексом фактор VIIa/тканевой фактор.
В естественных условиях инициирование внешнего пути возникает, когда повреждение кровеносных сосудов приводит кровь к контакту с тканевым фактором на мембранах клеток в пределах и в окружении сосудистой стенки. Контакт с тканевым фактором запускает образование комплекса фактор VIIa/тканевой фактор, который активирует фактор X (и, возможно, фактор IX, внутренний фактор). Фактор IXa в комбинации со своим кофактором, фактором VIII на поверхности фосфолипидной мембраны также генерирует фактор Ха. Активация фактора X обоими путями необходима для нормального функционирования гемостаза. Необходимость этого процесса для факторов VIII и IX объясняет, почему при гемофилии А (дефицит фактора VIII или фактора IX) возникает кровотечение, несмотря на неповрежденный внешний путь коагуляции, инициированный комплексом фактор VIIa/тканевой фактор.
Регуляция процесса коагуляции
Ряд ингибиторных механизмов предотвращает неконтролируемую активацию реакций коагуляции, которая может привести к локальному тромбозу или диссеминированному внутрисосудистому свертыванию. Эти механизмы включают:
- Инактивация факторов свертывания
- Фибринолиз
- Печеночный клиренс активированных факторов свертывания
Инактивация факторов свертывания
Ингибиторы плазменных протеаз (антитромбин, ингибитор тканевого фактора, α2-макроглобулин, кофактор гепарина II) инактивируют ферменты коагуляции. Антитромбин ингибирует тромбин, фактор Xa, фактор XIa и фактор IXa.
Два витамин К-зависимых протеина, протеин С и свободный протеин S образуют комплекс, который путем протеолиза инактивирует факторы VIIIa и Va. Тромбин, соединяясь с рецептором на эндотелиальных клетках (тромбомодулин [CD141]) активирует протеин С. Активированный протеин С совместно со свободным протеином S и рецепторами протеина С эндотелиальных клеток протеолизует и инактивирует факторы VIIIa и Va.
Кроме присутствующих в норме инактиваторов, существует целый ряд антикоагулянтов, которые потенцируют инактивацию факторов свертывания (см. рисунок Антикоагулянты и сферы их действия [Anticoagulants and their sites of action]).
Гепарин усиливает активность антитромбина. Варфарин является антагонистом витамина К. Он ингибирует восстановление активной формы витамина К и, следовательно, ингибирует образование функциональных форм витамин К-зависимых факторов свертывания II, VII, IX и X (так же, как и протеины С и S). Нефракционированный гепарин (НФГ) и низкомолекулярные гепарины (НМГ) повышают активность антитромбина к инактивации факторов IIa (тромбин) и Xa. НМГ включают эноксапарин, дальтепарин и тинзапарин. Фондапаринукс представляет собой небольшие синтетические молекулы, содержащие основную пентасахаридную часть структуры гепарина; усиливает инактивацию фактора Ха (но не фактора IIа) антитромбином. Парентеральные прямые ингибиторы тромбина включают в себя аргатробан и лепирудин. Более новые пероральные антикоагулянты прямого действия включают ингибитор тромбина (дабигатран) и ингибитор фактора Ха (апиксабан, ривароксабан, эдоксабан). Применение этих препаратов, включая описание рисков, выгоды и нейтрализующих средств, обсуждается в разделах Руководства, касающихся фибрилляции предсердий, тромбоза глубоких вен (ТГВ) и тромбоэмболии легочной артерии (ТЭЛА).
Антикоагулянты и точки приложения действия
НМГ = низкомолекулярный гепарин; ТФ = тканевой фактор; НФГ = нефракционированный гепарин.
Фибринолиз
Отложение фибрина и фибринолиз должны быть сбалансированы для временного поддержания и последующего удаления гемостатического сгустка при восстановлении поврежденной сосудистой стенки. Фибринолитическая система растворяет фибрин при помощи плазмина, являющегося протеолитическим ферментом. Фибринолиз активируется посредством активаторов плазминогена, продуцируемых эндотелиальными клетками сосудов. Активаторы плазминогена и плазминоген (в плазме) связываются с фибрином, и активаторы плазминогена расщепляют плазминоген до плазмина (см. рисунок Фибринолитический путь [Fibrinolytic pathway]). Затем плазмин образует растворимые продукты распада фибрина, которые поступают в циркуляцию.
Фибринолитический путь
Отложение фибрина и фибринолиз должны быть сбалансированы во время восстановдения поврежденной стенки кровеносных сосудов. Поврежденные эндотелиальные клетки высвобождают активаторы плазминогена (тканевой активатор плазминогена, урокиназа), активирующие фибринолиз. Активаторы плазминогена расщепляют плазминоген в плазмин, который растворяет сгустки. Фибринолиз контролируется с помощью ингибиторов активатора плазминогена (PAI, например, PAI-1) и ингибиторов плазмина (например, α2-антиплазмина).
Существует несколько активаторов плазминогена:
- Тканевой активатор плазминогена(ТАП), производное эндотелиальных клеток, имеет низкую активность, когда находится в свободной форме в растворе, но его эффективность возрастает при взаимодействии с фибрином в непосредственной близости от плазминогена.
- Урокиназасуществует в одноцепочной и двухцепочной формах с различными функциональными возможностями. Одноцепочная урокиназа не способна активировать свободный плазминоген, но, как и ТАП, способна активировать плазминоген при взаимодействии с фибрином. Микроконцентрации плазмина расщепляют одноцепочечную урокиназу на двухцепочечную, которая активирует плазминоген в растворе, так же как и плазминоген, связанный с фибрином. Эпителиальные клетки в экскреторных протоках (например, почечные канальцы, протоки молочной железы) высвобождают урокиназу, которая в этих каналах является физиологическим активатором фибринолиза.
- Стрептокиназа, представляющая бактериальный продукт, не присутствующий в организме человека, является другим потенциальным активатором плазминогена.
Стрептокиназа, урокиназа и рекомбинантный ТАП (альтеплаза) используются в терапевтической практике с целью индукции фибринолиза у больных с острыми тромбозом.
Регулирование фибринолиза
Фибринолиз регулируется ингибиторами активатора плазминогена (ИАП) и ингибиторами плазмина, которые замедляют фибринолиз. ИАП-1, являясь наиболее важным ИАП, высвобождается из эндотелиальных клеток сосудов, инактивирует ТАП, урокиназу и активирует тромбоциты. Основным ингибитором плазмина является альфа-2-антиплазмин, который быстро инактивирует любой свободный плазмин, высвобождаемый из сгустка. Часть альфа2-антиплазмина также связывается с полимерами фибрина под действием фактора XIIIa во время образования сгустка. Это сшивание может предотвратить чрезмерную активность плазмина внутри сгустков.
Урокиназа и ТАП быстро выводятся печенью, что является другим механизмом предупреждения чрезмерного фибринолиза.
Таблица 13 факторов свертывания крови
Кровь является одной из важнейших частей человеческого организма. Эта жидкая субстанция питает все органы и ткани нашего тела. В норме у взрослого человека в теле от 3500 до 5000 мл крови. И чтобы это количество сохранялось, природой предусмотрен процесс остановки крови при ранениях. Рассмотрим факторы свертывания крови. Что такое гемостаз, и какое значение она имеет для жизни человека.
Что такое гемостаз
В нашем организме кровь должна поддерживаться в жидком состоянии, чтобы обеспечивать все органы и ткани необходимыми питательными элементами и кислородом. В то же время при необходимости жидкая субстанция должна превращаться в желеобразную, чтобы человек не умер от кровопотери. А после того, как желеобразный тромб выполнил свою миссию, он опять должен принять жидкое состояние. Этот процесс регулирования состояния крови называется гемостазом.
Гемостаз — это очень сложный механизм, в котором участвуют десятки веществ. Если в этом процессе происходит сбой, человек может столкнуться со многими заболеваниями, которые несут опасность для жизни. На гемостаз влияют факторы свертывания в крови.
Коагуляция
Коагуляция или свертываемость крови — это защитный механизм организма от большой кровопотери. Сегодня примерно половина человечества имеет проблемы с коагуляцией. Именно из-за них возникают такие страшные заболевания как тромбоз, инфаркт, инсульт, обширные кровотечения. Каждый десятый человек погибает в результате несвоевременного лечения данных патологий крови, а каждый второй вообще не подозревает у себя наличия нарушения коагуляции.
Коагуляция представляет собой последовательный ряд процессов, каждый из которых запускает следующий. При сбое на любом этапе свертывания возникает патология, которая препятствует нормальной свертываемости крови. Сегодня ученые выявили основные фазы свертывания крови, это:
- Возникновение протромбина.
- Возникновение тромбина.
- Активация фибрина.
Последней фазой остановки кровотечения является сужение и растворение тромба, который переходит в первоначально жидкое состояние.
Факторы влияющие на коагуляцию
За свертываемость крови в нашем организме отвечают две основные категории молекул – плазменные и тромбоцитарные. Плазменный гемостаз происходит при участии белков, которые участвуют в образовании тромба. Сколько факторов влияют на гемостаз? Таблица плазменных факторов состоит из 13 элементов, которые обозначаются в медицине римскими цифрами.
Каждый из этих компонентов выполняет свою роль в образовании фибрина.
Помимо пронумерованных факторов свертывания крови, существует еще несколько вспомогательных плазменных веществ, которые несут ответственность за реакцию всех компонентов.
Тромбоцитарные факторы свертывания крови — это составляющие тромбоцитов, относящиеся к компонентам, которые отвечают за свертываемость красных кровяных телец. Их в медицине насчитывается 10. При недостатке или избытке одного из компонентов происходит сбой в коагуляции и кровь свертывается медленнее нормы.
13 плазменных факторов
| № | Факторы | Подробное описание |
|---|---|---|
| 1 | Фибриноген | Производится в печеночной ткани, селезенке, костном мозге и лимфатических узлах человека. Отвечает за образование фибрина для создания сетчатой базы тромба. Плазма должна содержать от 2 до 4 г/л. |
| 2 | Протромбин | Производится в печеночной ткани при участии микроэлемента К. При недостатке этого витамина печенью производится неполноценный белок, который не может выполнять свои задачи в полной мере. |
| 3 | Тромбопластин (белок тканевый) | Содержится во внутренних органах человека. В крови находится в пассивном состоянии. Играет важную роль в активировании протромбина. |
| 4 | Ca | Обязательный фактор, свертывающий кровь. Играет роль во всех этапах коагуляции. Колличество в плазме в норме составляет от 0,09 до 0,1 г/л. Дефицит кальция выражается судорогами нижних конечностей. |
| 5 | Проакцелирин | Производится в печеночных тканях. Не зависим от уровня микроэлемента К в организме. Участвует в запуске метаморфозы протромбина и в синтезе протромбиназы (ф. десятый). Норма в плазме от 12 до 17 ед./мл. |
| 6 | Акцелирин | Имеет значение только пассивная форма — проакцелирин, которая активизируется при наличии тромбина. |
| 7 | Проконвертин (белок) | Относится к производным печеночной ткани. Активация наступает в начале цепи коагуляции при контакте с ранящей поверхностью. Участвует в синтезе тромбина и тканевой протромбиназы. Норма у взрослого человека в среднем 0,005 г/л. |
| 8 | А-глобулин (белок антигемофильный) | Норма у здорового человека от 0,01 до 0,02 г/л. Фактор свертывания крови VIII участвует в преобразовании протромбина. |
| 9 | В-глобулин (антигемофильный белок ф. Кристмаса) | Зависим от содержания микроэлемента К. Зарождается в печени. Один из самых значимых компонентов 10 фактора коагуляции. Отвечает за образование протромбиназы. Дефицит IX фактора ведет к кровоизлияниям. |
| 10 | Стюарта-Прауэра | Компонент напрямую зависит от третьего, седьмого и девятого факторов. Является основным фактором образования протромбиназы. |
| 11 | Компонент Розенталя | Предшественник тромбопластина. Активируется двенадцатым фактором. Не зависит от содержания витамина К. Синтезируется в печени. Содержание в крови около 0,005 г/л. |
| 12 | Хагемана | Контактное вещество активирует одиннадцатый фактор. Синтезируется в печени. |
| 13 | фибриназа | Тринадцатый фактор заставляет кровь свертываться. Его дефицит вызывает внутричерепные кровоизлияния. |
Также в коагуляции принимают участие дополнительные плазменные факторы свертывания крови.
К факторам свертывания в крови относятся компоненты: Виллебранда, Флетчера, Фитцджеральда. Эти составляющие участвуют в активации других факторов, и при их дефиците может нарушиться цепь коагуляции.
Дефицит одного или нескольких факторов свертывания крови ведет к развитию патологии под названием коагулопатия, которая представляет собой нарушение свертываемости крови. Коагулопатия может быть вызвана как наследственными, так и приобретенными причинами. К наследственным факторам развития заболевания относятся:
- Дефицит компонентов 8 и 9, 10 факторов.
- Дефицит компонентов 5, 7, 10 и 11 факторов.
- Дефицит компонентов других факторов.
- Синдром ДВС.
- Приобретенные ингибиторы.
- Дефицит факторов протромбина.
- Препараты гепарина и др.
Тромбоцитарные факторы
Тромбоцитарные факторы свертывания в крови содержатся непосредственно в тромбоцитах — красных кровяных тельцах. Сегодня ученые говорят, что их количество превышает 10, но точное число до сих пор остается под вопросом. В учебниках по медицине сегодня приводится 12 молекул свертываемости крови:
- Белок тромбина.
- Триггер фибрина акцелератор.
- Фосфолипопротеид.
- Ингибитор гепарина.
- Агглютинабелин.
- Ингибитор распада фибрина.
- Ингибитор распада протромбина.
- Ретрактозин.
- Серотонин.
- Котромбопластин.
- Активатор фибрина.
- АДФ отвечает за слипаемость тромбоцитов.
Факторы влияющие на свертываемость крови
Для того, чтобы поддерживать свое здоровье в порядке каждый человек должен знать факторы ускоряющие и замедляющие свертывание в крови. Эти знания помогут избежать развития опасных для жизни состояний и своевременно наладить систему коагуляции. Нарушение гемостаза на любой стадии может привести либо к обширным кровотечениям, либо к образованию тромбов. И то и другое опасно для жизни.
Низкая свертываемость крови. Это состояние опасно возникновением смертельных внутренних кровотечений. Причинами развития патологии могут стать:
- Генетические нарушения.
- Онкологические заболевания на поздней стадии.
- Препараты разжижающие кровь.
- Нехватка витамина К.
- Нехватка кальция.
- Заболевания печени.
Лечение данной патологии зависит от причин ее развития. Препараты назначает врач гематолог. Если причиной плохой свертываемости стало медикаментозное лечение, нужно ограничить прием лекарств или заменить их на более щадящие препараты.
Повышенная свертываемость крови. Данная патология опасна образованием тромбов сосудов, вен и артерий. При закупорке артерий происходит отмирание органов, которые она питает. Также опасность заключается в возможности отрыва тромба, который может закупорить жизненно важные артерии легких и сердца, это ведет к летальному исходу. Основными причинами развития этого нарушения являются:
- Инфекционные заболевания.
- Низкая физическая активность.
- Атеросклероз.
- Обезвоживание.
- Наследственные факторы.
- Сахарный диабет.
- Лишний вес.
- Беременность.
- Аутоиммунные заболевания.
- Стресс.
- Онкологические болезни.
- Артериальная гипертензия.
При лечении данной патологии главной целью врачей является снижение свертываемости крови до нормального уровня. Для этих целей используют специальные препараты — антикоагулянты. Их прием должен проходить под четким контролем лечащего врача. Сначала пациенту назначается курс гепарина, а затем проводят аспириновую терапию.
При наследственной тромбофелии аспирин назначается в малых дозах еще в младенчестве.
Анализ на функцию свертываемости крови необходимо проводить перед любым хирургическим вмешательством, чтобы исключить возможные осложнения. Также это исследование назначают беременным женщинам и при определенных жалобах пациентов. Обычно повышенная свертываемость наблюдается у пациентов пожилого возраста.
Если у вас обнаружили нарушение свертываемость крови, не нужно предаваться панике. Это значит, что вам необходимо более тщательно следить за своим здоровьем. Любое лекарственное средство нужно принимать только после консультации с врачом. Также необходимо сдавать все анализы, чтобы выяснить причину нарушения. Если не затягивать с лечением и выполнять все рекомендации доктора, болезнь быстро отступит и ваша жизнь вернется в здоровое русло.
Читайте также:
