Пернициозная анемия. Образование гемоглобина
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Пернициозная анемия. Образование гемоглобина
Нарушение созревания, связанное с недостаточным всасыванием витамина В12 из желудочно-кишечного тракта:
а) Пернициозная анемия. Распространенной причиной нарушения созревания красных клеток крови является недостаточное всасывание витамина В12 из желудочно-кишечного тракта. Это часто происходит при заболевании пернициозной анемией, при которой основной патологией является атрофический гастрит, нарушающий нормальную секреторную функцию желудка. Париетальные клетки желудочных желез секретируют гликопротеин, называемый внутренним фактором, который соединяется с витамином В12 пищи и делает этот витамин доступным для всасывания в кишечнике. Это происходит следующим образом: (1) внутренний фактор прочно связывается с витамином B12. В таком связанном состоянии витамин В12 защищается от переваривания желудочно-кишечными секретами; (2) находясь в связанном состоянии, внутренний фактор связывается со специфическими рецепторами на мембранах клеток щеточной каемки слизистой подвздошной кишки; (3) затем в течение следующих нескольких часов витамин В12 транспортируется в кровь путем пиноцитоза; в результате внутренний фактор и витамин вместе переносятся через мембрану. Следовательно, недостаток внутреннего фактора ведет к уменьшению доступности витамина В12 из-за нарушения всасывания витамина.
Сразу после всасывания из желудочно-кишечного тракта витамин B12 сначала накапливается в печени в большом количестве, затем медленно выделяется по мере потребности в нем костного мозга. Минимальное количество витамина B12, необходимое ежедневно для поддержания нормального созревания красных клеток крови, составляет всего 1-3 мкг, а нормальное накопление в печени и других тканях тела примерно в 1000 раз больше этого количества. Следовательно, обычно для развития анемии в связи с нарушением созревания эритроцитов недостаточность всасывания В12 должна продолжаться 3-4 года.
б) Недостаточность созревания, связанная с дефицитом фолиевой кислоты (птероилглутаминовой кислоты). Фолиевая кислота является нормальным компонентом овощей, некоторых фруктов и мяса (особенно, печени). Однако она легко разрушается во время приготовления пищи. Кроме того, люди с нарушением всасывания в желудочно-кишечном тракте, например при часто встречающемся заболевании тонкого кишечника, которое называют спру, обычно имеют серьезные затруднения всасывания и фолиевой кислоты, и витамина B12. Следовательно, во многих случаях причиной нарушений созревания является недостаточность всасывания в кишечнике и фолиевой кислоты, и витамина B12.
Формирование гемоглобина
Синтез гемоглобина начинается в проэритробластах и продолжается даже на стадии ретикулоцита красных клеток крови. Следовательно, когда ретикулоциты оставляют костный мозг и проходят в кровоток, они продолжают формировать минимальные количества гемоглобина в течение примерно следующего дня до тех пор, пока не станут зрелыми эритроцитами.
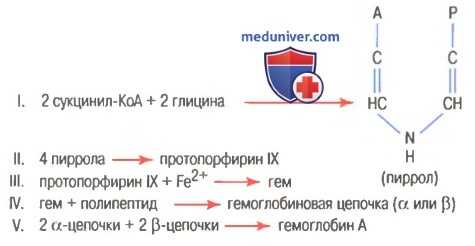
Образование гемоглобина
На рисунке выше показаны основные химические этапы формирования гемоглобина. Сначала сукцинил-КоА, формируемый в метаболическом цикле Кребса, связывается с глицином, образуя молекулу пиррола. В свою очередь, четыре молекулы пиррола объединяются, образуя протопорфирин IX, который затем соединяется с железом, формируя молекулу гема. Наконец, каждая молекула гема присоединяется к синтезируемому рибосомами длинному полипептиду глобину, формируя субъединицу гемоглобина, называемую гемоглобиновой цепочкой (для облегчения понимания просим вас изучить рисунок ниже). Каждая цепочка имеет молекулярную массу около 16000; в свою очередь, четыре такие цепочки свободно связываются вместе, формируя целую гемоглобиновую молекулу.
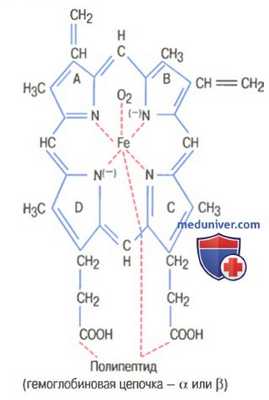
Основная структурная единица молекулы гемоглобина, представленная одной из четырех цепочек гемоглобина, которые связываются вместе, формируя молекулу гемоглобина
Существуют несколько легких вариаций гемоглобиновых цепочек в зависимости от аминокислотного состава полипептидной части субъединицы. Разные типы цепочек обозначают как альфа, бета, гамма и дельта. Наиболее распространенная форма гемоглобина взрослого человека — гемоглобин А. Он представляет собой комбинацию двух альфа-цепочек и двух бета-цепочек. Гемоглобин А имеет молекулярную массу 64458.
Поскольку каждая гемоглобиновая цепочка имеет простетическую группу в виде гема, содержащего атом железа, ясно, что каждая молекула гемоглобина, состоящая из четырех таких цепочек, содержит четыре атома железа. Каждый из них может свободно связываться с одной молекулой кислорода, обеспечивая возможность транспортировки каждой молекулой гемоглобина четырех молекул (или восьми атомов) кислорода.
Типы гемоглобиновых цепочек в молекуле гемоглобина определяют сродство гемоглобина к кислороду. Патологические изменения цепочек могут менять физические характеристики гемоглобиновой молекулы. Например, при серповидно-клеточной анемии в одном участке каждой из двух бета-цепочек аминокислота валин заменяется глутаминовой кислотой. При низком парциальном давлении кислорода этот тип гемоглобина формирует внутри эритроцитов вытянутые кристаллы, длина которых иногда достигает 15 мкм. Они делают практически невозможным прохождение эритроцитов через многие мелкие капилляры, и острые концы кристаллов, вероятно, разрывают клеточные мембраны, способствуя развитию серповидно-клеточной анемии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Высокий гемоглобин у женщин и мужчин. Почему гемоглобин выше нормы?
Гемоглобин - это сложное белковое соединение, в состав которого входит глобин и гема (соединение железа). Именно гема (атомы железа) делает нашу кровь красного цвета. Гемоглобин отвечает за процесс транспортировки кислорода или углекислого газа от легких к другим органам, поддерживает уровень рН крови. Из-за недостатка гемоглобина может нарушиться кислородный процесс, в результате чего клетки органов не получат необходимое количество кислорода и могут нарушиться функции обмена веществ. В человеческом организме гемоглобин бывает в трех формах:
- в соединении с кислородом - алого цвета, содержится в артериях;
- восстановленный, после передачи кислорода тканям;
- в соединении с углекислым газом - темно-вишневого цвета, содержится в венах.
Основными функциями гемоглобина являются:
- перенос кислорода от лёгких к клеткам тканей;
- перенос углекислого газа и протонов от тканей к лёгким;
- поддержание уровня рН крови.
Значение гемоглобина очень важно при диагностике ранних стадий многих тяжелых заболеваний, например сахарного диабета. Следует отметить, что для мужского и женского организмов норма гемоглобина отличается. У мужчин характерно более высокое количество гемоглобина, приблизительно 130-160 г/л, а для женщин норма будет при показаниях 120-140 г/л. В детских организмах, как правило, уровень гемоглобина несколько ниже нормы, что является вполне нормальным явлением.
Высокий гемоглобин как норма
Высокий уровень содержания гемоглобина характерно для крови людей, живущих в высокогорной местности или у альпинистов-профессионалов. Это природная реакция компенсации - таким образом, человеческий организм борется с недостаточным количеством кислорода, находящегося в воздухе. Повышение уровня гемоглобина можно наблюдать после продолжительных физических нагрузок и прогулок на природе по свежему воздуху. Однако помните, что высокий гемоглобин - не во всех случаях нормально.
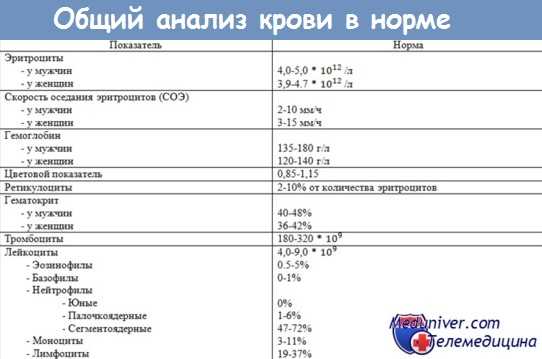
Общий анализ крови в норме
Высокий гемоглобин как проявление болезни
Причинами высоких показателей гемоглобина могут стать целый ряд заболеваний. Самые распространенные это - эритроцитоз, повышенное сгущение крови, наличие порока сердца, кишечная непроходимость, сердечная недостаточность, сахарный диабет.
Повышение уровня гемоглобина взаимосвязано со следующими состояниями:
- заболевания, связанные с повышением уровня эритроцитов;
- повышением кислородной ёмкости, вызванной гипоксией при сердечно-сосудистых патологиях;
- обезвоживанием организма;
- стрессом и физическими нагрузками;
- доброкачественными и злокачественными новообразованиями в печени, почках, центральной нервной системе;
- нарушением уровня гормонов;
- химическими отравлениями;
- ожогами;
- кишечной непроходимостью.
Пернициозная анемия
Одна из наиболее распространенных причин повышения уровня гемоглобина в крови - это недостаточное количество фолиевой кислоты и витамина В12. Пернициозная (злокачественная анемия) или болезнь Аддисона-Бирмера - пример такого заболевания.
Пернициозная анемия возникает на фоне родовой предрасположенности, заболеваний желудка (например, атрофического гастрита) в сочетании с нарушениями иммунных процессов. Эти процессы снижают возможность организма усваивать витамин В12. Самые чувствительные к дефициту витаминов В12- это костный мозг, а также ткани и клетки нервной системы.
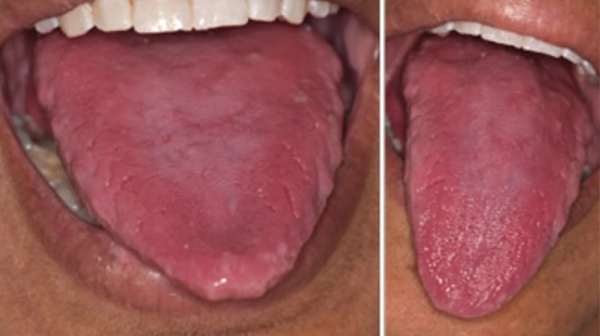
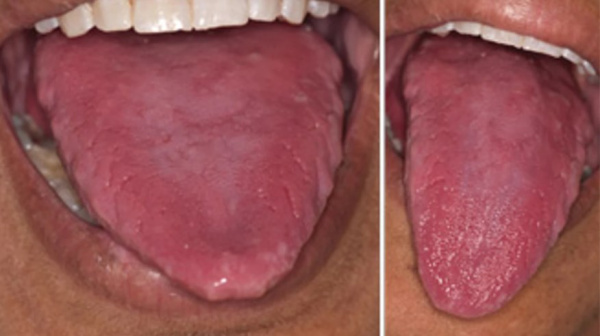
У человека, страдающего пернициозной анемией, появляются повышенные утомляемость и сонливость, отсутствие аппетита, частые боли в ротовой полости, неприятные ощущения на руках или ногах. Человек начинает худеть, происходит нарушение походки, может возникнуть нарушение зрения или проблемы со стороны мочеполовой системы. Во время обследования часто обнаруживается язык ярко-красного оттенка, бледная кожа, некоторая желтушность и признаки неврологических заболеваний.
Лабораторные исследования показывают пониженное содержание изменённых эритроцитов (клетки красной крови) при высоком содержании гемоглобина. Для лечения пернициозной анемии назначается витамин В12, который при своевременном обнаружении болезни даёт благоприятные результаты. Однако признаки нарушений нервной системы организма сохраняться дольше, если курс лечения пациента был начат через шесть месяцев с момента появления первых симптомов заболевания. Для пернициозной анемии, как и при многих других заболеваниях, важен вовремя поставленный диагноз.
Эритроцитоз
Эритроцитоз - состояние, в котором повышается уровень содержания эритроцитов и гемоглобина в крови человека. Заболевание эритроцитоз может носить наследственный характер, а также развиться в результате разнообразных нарушений внутренних органов.
Увеличение количества эритроцитов может возникнуть в результате заболеваний почек, а также после операции по пересадке почки.
Наследственный эритроцитоз - генетически возникшее заболевание, при котором происходит увеличение содержания эритроцитов. Такая болезнь может проходить абсолютно без характерных симптомов, а может сопровождаться внезапной усталостью, резкой головной болью или закупоркой сосудов кровеносной системы, вызванной высокой вязкостью крови. Во время курса лечения эритроцитоза происходит удаление избыточных эритроцитов и уменьшение вязкости с помощью разных терапевтических и лекарственных средств. При эритроцитозе, вызванном заболеванием легкого или сердца - сначала проводится лечение основного заболевания.
Что делать, если гемоглобин выше нормы?
В некоторых ситуациях возникает вопрос - как понизить гемоглобин в крови? Для того чтобы ответить на него, необходимо знать причину возникновения повышенного состояния, а главное устранить эту причину. Но всё это только после лабораторной диагностики и консультации с врачом.
Народные методы лечения сводятся к определенной овощной диете, применению пиявок и питью отваров целебных трав, которые помогут организму восстановить нормальный уровень гемоглобина. Можно также стать донором и сдавать кровь, так как будет происходить естественная замена молодой кровью. Для разжижения рекомендуют пить простую воду с добавлением лимона в течение трёх месяцев. В ежедневном рационе, пока проходит курс по нормализации уровня гемоглобина, должна присутствовать гречка, перловка и овес.
Пернициозная анемия ( Болезнь Аддисона-Бирмера , В12-дефицитная анемия )
Пернициозная анемия – нарушение красного ростка кроветворения, обусловленное недостатком в организме цианокобаламина (витамина В12). При В12-дефицитной анемии развивается циркуляторно-гипоксический (бледность, тахикардия, одышка), гастроэнтерологический (глоссит, стоматит, гепатомегалия, гастроэнтероколит) и неврологический синдромы (нарушение чувствительности, полиневриты, атаксия). Подтверждение пернициозной анемии производится по результатам лабораторных исследований (клинического и биохимического анализа крови, пунктата костного мозга). Лечение пернициозной анемии включает сбалансированную диету, внутримышечное введение цианокобаламина.
МКБ-10

Общие сведения
Пернициозная анемия – разновидность мегалобластной дефицитной анемии, развивающаяся при недостаточном эндогенном поступлении или усвоении в организме витамина В12. «Пернициозная» в переводе с латинского означает «опасная, гибельная»; в отечественной традиции такая анемия раньше называлась «злокачественным малокровием». В современной гематологии синонимами пернициозной анемии также служат В12-дефицитная анемия, болезнь Аддисона-Бирмера. Заболевание чаще возникает у лиц старше 40-50 лет, несколько чаще у женщин. Распространенность пернициозной анемии составляет 1%; вместе с тем, дефицитом витамина В12 страдает около 10% пожилых людей в возрасте старше 70 лет.

Причины пернициозной анемии
Ежесуточная потребность человека в витамине B12 равняется 1-5 мкг. Она удовлетворяется за счет поступления витамина с пищей (мясом, кисломолочными продуктами). В желудке под действием ферментов витамин В12 отделяется от пищевого белка, однако для усвоения и всасывания в кровь он должен соединиться с гликопротеином (фактором Касла) или другими связывающими факторами. Всасывание цианокобаламина в кровоток происходит в средней и нижней части подвздошной кишки. Последующий транспорт витамина В12 к тканям и гемопоэтическим клеткам осуществляется белками плазмы крови - транскобаламинами 1, 2, 3.
Развитие В12-дефицитной анемии может быть связано с двумя группами факторов: алиментарными и эндогенными. Алиментарные причины обусловлены недостаточным поступлением витамина В12 с пищей. Это может происходить при голодании, вегетарианстве и диетах с исключением животного белка.
Под эндогенными причинами подразумевается нарушение усвоения цианокобаламина вследствие дефицита внутреннего фактора Касла при его достаточном поступлении из вне. Такой механизм развития пернициозной анемии встречается при атрофическом гастрите, состоянии после гастрэктомии, образовании антител к внутреннему фактору Касла или париетальным клеткам желудка, врожденном отсутствии фактора.
Нарушение абсорбции цианокобаламина в кишечнике может отмечаться при энтерите, хроническом панкреатите, целиакии, болезни Крона, дивертикулах тонкого кишечника, опухолях тощей кишки (карциноме, лимфоме). Повышенное расходование цианокобаламина может быть связано с гельминтозами, в частности, дифиллоботриозом. Существуют генетические формы пернициозной анемии.
Всасывание витамина В12 нарушено у пациентов, перенесших резекцию тонкой кишки с наложением желудочно-кишечного анастомоза. Пернициозная анемия может быть ассоциирована с хроническим алкоголизмом, применением некоторых лекарственных средств (колхицина, неомицина, пероральных контрацептивов и др.). Поскольку в печени содержится достаточный резерв цианкобаламина (2,0-5,0 мг), пернициозная анемия развивается, как правило, только лишь спустя 4-6 лет после нарушения поступления или усвоения витамина В12.
В условиях недостаточности витамина В12 возникает дефицит его коферментных форм – метилкобаламина (участвует в нормальном протекании процессов эритропоэза) и 5-дезоксиаденозилкобаламина (участвует в метаболических процессах, протекающих в ЦНС и периферической нервной системе). Недостаток метилкобаламина нарушает синтез незаменимых аминокислот и нуклеиновых кислот, что приводит к расстройству образования и созревания эритроцитов (мегалобластному типу кроветворения). Они принимают форму мегалобластов и мегалоцитов, которые не выполняют кислородтранспортную функцию и быстро разрушаются. В связи с этим количество эритроцитов в периферической крови существенно сокращается, что приводит к развитию анемического синдрома.
С другой стороны, при дефиците кофермента 5-дезоксиаденозилкобаламина нарушается обмен жирных кислот, в результате чего накапливаются токсичные метилмалоновая и пропионовая кислоты, оказывающие непосредственное повреждающее действие на нейроны головного и спинного мозга. Кроме этого, нарушается синтез миелина, что сопровождается дегенерацией миелинового слоя нервных волокон – этим обусловлено поражение нервной системы при пернициозной анемии.
Симптомы пернициозной анемии
Тяжесть течения пернициозной анемии определяется выраженностью циркуляторно-гипоксического (анемического), гастроэнтерологического, неврологического и гематологического синдромов. Признаки анемического синдрома неспецифичны и являются отражением нарушения кислородтранспортной функции эритроцитов. Они представлены слабостью, снижением выносливости, тахикардией и ощущением сердцебиения, головокружением и одышкой при движении, субфебрилитетом. При аускультации сердца может выслушиваться шум «волчка» или систолические (анемические) шумы. Внешне отмечается бледность кожи с субиктеричным оттенком, одутловатость лица. Длительный «стаж» пернициозной анемии может приводить к развитию миокардиодистрофии и сердечной недостаточности.
Гастроэнтерологическими проявлениями В12-дефицитной анемии служат пониженный аппетит, неустойчивость стула, гепатомегалия (жировая дистрофия печени). Классический симптом, выявляемый при пернициозной анемии – «лакированный» язык малинового цвета. Характерны явления ангулярного стоматита и глоссита, жжение и болевые ощущения в языке. При проведении гастроскопии обнаруживаются атрофические изменения слизистой желудка, которые подтверждаются эндоскопической биопсией. Желудочная секреция резко снижается.
Неврологические проявления пернициозной анемии обусловлены поражением нейронов и проводящих путей. Больные указывают на онемение и скованность конечностей, мышечную слабость, нарушение походки. Возможно недержание мочи и кала, возникновение стойкого парапареза нижних конечностей. Осмотр невролога выявляет нарушение чувствительности (болевой, тактильной, вибрационной), повышение сухожильных рефлексов, симптомы Ромберга и Бабинского, признаки периферической полиневропатии и фуникулярного миелоза. При В12-дефицитной анемии могут развиваться психические нарушения – бессонница, депрессия, психозы, галлюцинации, деменция.

Диагностика пернициозной анемии
Кроме гематолога, к диагностике пернициозной анемии должны быть привлечены гастроэнтеролог и невролог. Дефицит витамина В12 (менее 100 пг/мл при норме 160-950 пг/мл) устанавливается при проведении биохимического исследования крови; возможно обнаружение Ат к париетальным клеткам желудка и к внутреннему фактору Касла. Для общего анализа крови типична панцитопения (лейкопения, анемия, тромбоцитопения). При микроскопии мазка периферической крови обнаруживаются мегалоциты, тельца Жолли и Кэбота. Исследование кала (копрограмма, анализ на яйца глистов) могут выявлять стеаторею, фрагменты или яйца широкого лентеца при дифиллоботриозе.
Проба Шиллинга позволяет определить нарушение всасывания цианокобаламина (по экскреции с мочой меченного радиоактивным изотопом витамина В12, принятого внутрь). Пункция костного мозга и результаты миелограммы отражают характерное для пернициозной анемии увеличение числа мегалобластов.
Для определения причин нарушения абсорбции витамина В12 в ЖКТ проводится ФГДС, рентгенография желудка, ирригография. В диагностике сопутствующих нарушений информативны ЭКГ, УЗИ органов брюшной полости, электроэнцефалография, МРТ головного мозга и др. В12-дефицитную анемию необходимо отличать от фолиеводефицитной, гемолитической и железодефицитной анемии.
Лечение пернициозной анемии
Установление диагноза пернициозной анемии означает, что пациент будет нуждаться в пожизненном патогенетическом лечении витамином В12. Кроме этого, показано регулярное (каждые 5 лет) проведение гастроскопии для исключения развития рака желудка.
С целью восполнения дефицита цианокобаламина назначаются внутримышечные инъекции витамина В12. Требуется коррекция состояний, приведших к В12-дефицитной анемии (дегельминтизация, прием ферментных препаратов, хирургическое лечение), а при алиментарном характере заболевания - диета с повышенным содержанием животного белка. При нарушении выработки внутреннего фактора Касла назначаются глюкокортикоиды. К гемотрансфузиям прибегают только при анемии тяжелой степени или признаках анемической комы.
На фоне терапии пернициозной анемии показатели крови обычно нормализуются через 1,5-2 месяца. Дольше всего (до 6 мес.) сохраняются неврологические проявления, а при поздно начатом лечении они становятся необратимыми.

Профилактика
Первым шагом на пути предотвращения пернициозной анемии должно стать полноценное питание, обеспечивающее достаточное поступление в организм витамина В12 (употребление мяса, яиц, печени, рыбы, молочных продуктов, сои). Необходима своевременная терапия патологий ЖКТ, нарушающих усвоение витамина. После хирургических вмешательств (резекции желудка или кишечника) необходимо проведение поддерживающих курсов витаминотерапии.
Больные с В12-дефицитной анемией входят в группу риска по развитию диффузного токсического зоба и микседемы, а также рака желудка, поэтому нуждаются в наблюдении эндокринолога и гастроэнтеролога.
Гемолитическая анемия
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
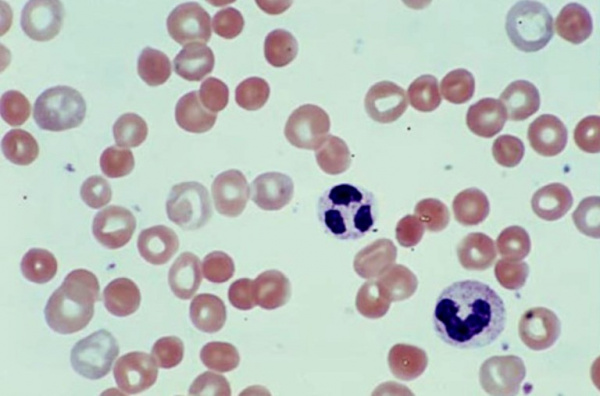
Гемолитическая анемия (ГА) - малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
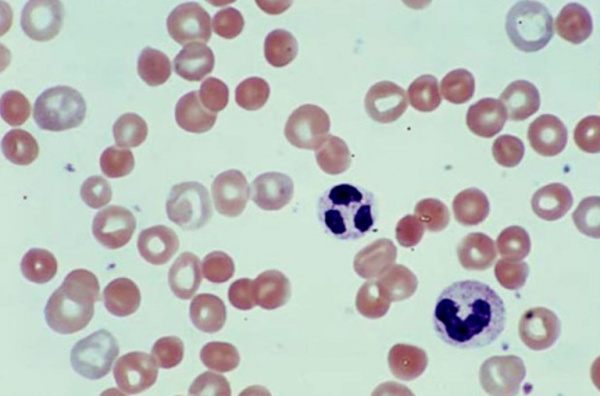
Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.

Патогенез
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии- анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические - анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом - обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще - Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий - талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.

Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
4. Клинические рекомендации по диагностике и лечению аутоиммунных гемолитический анемий/ Цветаева Н.В., Никулина О.Ф. - 2014.
Почечная анемия ( Нефрогенная анемия , Ренальная анемия , ЭПО-дефицитная анемия )
Почечная анемия – это осложнение хронической болезни почек (ХБП), вызванное недостаточным синтезом гормона эритропоэтина, стимулирующего кроветворение. Анемический синдром сопровождается слабостью, упадком сил, сонливостью, головокружением, тахипноэ при минимальной нагрузке, гипотонией. Лабораторные методы диагностики включают исследование уровня гемоглобина, эритроцитов, гематокрита, ретикулоцитов, ферритина, эритропоэтина, витаминов и других гематологических показателей. Антианемическая терапия основывается на назначении рекомбинантного эритропоэтина, препаратов железа, витаминов В9, В12. По показаниям проводятся гемотрансфузии.


Почечная (нефрогенная, ренальная, ЭПО-дефицитная) анемия – снижение уровня гемоглобина, гематокрита и количества эритроцитов у больных с ХПН. Распространенность анемии при ХБП составляет 47%: ее частота колеблется от 26,7% у пациентов с I стадией патологии до 75,5% у пациентов с V стадией. Нефрогенная анемия выявляется у 90% больных, получающих заместительную почечную терапию (ЗПТ). Проблема сопряжена с увеличением риска неблагоприятного исхода ХПН, поэтому поискам путей ее решения в современной нефрологии уделяется повышенное внимание.
Основной этиофактор нефрогенной анемии – ХБП и ассоциированные с ней нарушения функции почек. Обычно анемия развивается уже во II-III стадии ХБП при снижении клиренса креатинина ниже 60-40 мл/мин. Вследствие нефросклероза эндотелием проксимальных почечных канальцев вырабатывается недостаточное количество пептидного гормона эритропоэтина (ЭПО), который стимулирует образование и созревание красных клеток крови – эритроцитов.
Наряду с дефицитом эндогенного ЭПО значимую роль в этиопатогенезе почечной анемии играет резистентность костного мозга к стимулирующему эффекту эритропоэтина, а также снижение запасов или биодоступности железа в организме. Неэфективный эритропоэз отягощается накоплением продуктов обмена и ацидозом, который приводит к сокращению срока жизни эритроцитов, т. е. их преждевременному разрушению (гемолизу) в кровяном русле.
Фактора риска
Дополнительными факторами риска почечной анемии выступают различные варианты повреждения почек:
- хронический гломерулонефрит с мочевым синдромом;
- волчаночный нефрит;
- некротизирующий гломерулонефрит при ANCA-ассоциированном васкулите;
- токсико-аллергический тубулоинтерстициальный нефрит;
- быстропрогрессирующий нефрит;
- диабетический гломерулосклероз;
- нефротический синдром;
- обструктивная уропатия;
- мочекаменная болезнь.
Тяжесть ренальной анемии коррелирует со степенью снижения скорости клубочковой фильтрации (СКФ), стадией ХБП, нуждаемостью больных в гемодиализе. Анемический синдром у пациентов, получающих ЗПТ, усугубляется кровопотерями, связанными с многократным забором крови для анализов, процедурами гемодиализа, применением антикоагулянтов, уремической тромбоцитопатией.
Механизм развития и прогрессирования почечной анемии связан с неэффективным эритропоэзом вследствие дефицита эритропоэтина и железа, а также гемолизом эритроцитов на фоне почечного ацидоза.
В норме существует обратная зависимость между содержанием гематокрита (Ht) и синтезом эритропоэтина: снижение Ht стимулирует усиление выработки ЭПО и других факторов защиты тканей от гипоксического повреждения. При ХБП ввиду тубулоинтерстициального фиброза продукция ЭПО не увеличивается, что закономерно приводит к развитию почечной анемии.
Кроме этого, в условиях уремической интоксикации происходит подавление экспрессии гена эритропоэтина, укорочение продолжительности жизни эритроцитов в периферическом кровяном русле со 100-120 до 80 суток и менее. Супрессию эритропоэза усугубляет вторичный гиперпаратериоз, возникающий на фоне хронической почечной недостаточности.
Железодефицит при ХБП может быть абсолютным (вследствие кровопотерь, нарушения абсорбции железа в ЖКТ) или относительным (функциональным – при снижении циркуляции Fe в крови). Обе формы сопровождаются железодефицитным эритропоэзом и, как следствие, почечной анемией. Влияние на скорость прогрессирования и выраженность анемического синдрома оказывают провоспалительные цитокины (ИЛ-1, TNF-a, ИФН-γ), а также острофазовый белок гепсидин-25, угнетающие эритропоэз и снижающие биодоступность железа.

Тяжесть почечной анемии оценивается по общепринятым критериям. В зависимости от снижения концентрации гемоглобина выделяют три степени тяжести:
- легкая ‒ Hb ˂130 (муж.)/120 (жен.), но >90 г/л;
- средняя ‒ Hb в диапазоне 90-70 г/л;
- тяжелая ‒ Hb ˂70 г/л.
Симптомы почечной анемии
Клинические проявления коррелируют с тяжестью анемического синдрома. Симптомы нефрогенной анемии неспецифичны, но при ХБП они накладываются на признаки основной почечной патологии. Больного беспокоит упадок сил, постоянная сонливость, снижение толерантности к физическим нагрузкам, ухудшение умственной деятельности.
Отмечается зябкость и онемение конечностей, бледность слизистых и кожных покровов (желтушный оттенок при гемолизе). Пациенты жалуются на шум в ушах, систематическое головокружение. При тяжелой почечной анемии присоединяется сердцебиение, боль в груди, чувство нехватки воздуха, одышка при минимальных физических усилиях.
Хроническая болезнь почек проявляется болью в пояснице, дизурией, артериальной гипертензией. В поздних стадиях присоединяются отеки, головная боль, выраженное ухудшение самочувствия.
Декомпенсация состояния у пациента с почечной анемией может наступить после перенесенной инфекции, лихорадки, кровотечения, болевых синдромов, увеличивающих потребность тканей в кислороде. При этом развивается дыхательная недостаточность (вплоть до ОРДС), застойная сердечная недостаточность, гепатомегалия.
Многочисленными исследованиями доказана связь почечной анемии с сердечно-сосудистыми осложнениями: гипертрофией левого желудочка, повышенной частотой развития тяжелых аритмий, инфаркта миокарда, острой сердечной недостаточности. Летальность среди пациентов данной группы существенно выше, чем среди больных без анемии.
Диагноз почечной анемии ставится на основании анамнестических сведений (наличие ХБП) и лабораторных критериев. Больным необходимы консультации врача-нефролога, гематолога. Диагностические лабораторные показатели включают:
- ОАК. В клиническом анализе крови определяется снижение количества эритроцитов и ретикулоцитов, концентрации Hb и Ht. Эритроцитарные индексы остаются в пределах нормы.
- Анализ витаминов и микроэлементов. Исследуются показатели обмена железа (сывороточное Fe, ферритин, ОЖСС, коэффициент насыщения трансферрина), отражающие абсолютную или относительную недостаточность микроэлемента. Для исключения дефицитных анемий у пациентов на диализе определяют уровни витаминов В12, фолиевой кислоты.
- Нефрологический комплекс. В рамках оценки почечной функции проводят ОАМ, исследование общего белка, креатинина, мочевины, пробу Реберга.
- Эритропоэтин. Снижение уровня сывороточного ЭПО при анемии почечного происхождения определяется во всех случаях, поэтому не является строго обязательным.
Для оценки состояния выделительной системы выполняют УЗИ и КТ почек, при необходимости – нефробиопсию. Чтобы исключить скрытое кровотечение из ЖКТ, как причину анемического синдрома, может потребоваться проведение гастроскопии, колоноскопии, исследование кала на скрытую кровь.

Дифференциальная диагностика
Анемию почечного генеза необходимо отличать от анемических синдромов, имеющих иную этиологию:
Лечение почечной анемии
Терапия нефрогенной анемии складывается из лечения основного заболевания и почечной недостаточности, коррекции анемического синдрома. Рекомендуется низкобелковая диета, умеренные физические нагрузки. Госпитализация требуется пациентам с выраженным снижением гемоглобина (Нb ≤ 75-70 г/л). Основные компоненты лечения почечной анемии включают:
- Нефропротективную терапию. Назначается с учетом причины ХБП (кортикостероиды при гломерулонефрите, антибиотики при инфекционном воспалении). При сопутствующей артериальной гипертензии показаны гипотензивные препараты, диуретики.
- Почечно-заместительную терапию. В терминальной стадии ХБП проводится перитонеальный диализ, гемодиализ. Решается вопрос о трансплантации почки.
- Коррекцию анемии. При проведении противоанемической терапии используют препараты железа (внутрь или внутривенно), фолиевой кислоты, инъекции цианокобаламина. При неэффективности другой антианемической терапии проводят переливание эритроцитарной массы.
- Эритропоэзстимулирующая терапия. Патогенетическим лечением почечной анемии является применение препаратов рекомбинантного человеческого эритропоэтина (рчЭПО) короткого и пролонгированного действия.
Формирование почечной анемии сопряжено с увеличением числа госпитализаций, повышенным риском кардиоваскулярных осложнений и смертности от них. Выявление патологии на ранней стадии, назначение соответствующей терапии и динамический контроль показателей крови позволяет минимизировать осложнения, повысить качество жизни. Пациентам с ХБП и сопутствующей почечной анемией необходимо пожизненное наблюдение.
Первичная профилактика заключается в своевременном лечении хронической почечной патологии и недопущении ее прогрессирования до почечной недостаточности. Вторичная профилактика включает своевременное выявление анемического синдрома и назначении ЭС-терапии.
2. Нефрогенная анемия: прогресс в понимании патофизиологии и потенциал новых подходов к безопасной терапии Айтбаев К.А., Муркамилов И. Т., Фомин В.В., Райимжанов З.Р., Реджапова Н.А.// Клиническая лабораторная диагностика. – 2017.
3. Факторы риска формирования нефрогенной анемии у детей/ Мазур Л.И., Маковецкая Г.А., Балашова Е.А.// Известия Самарского научного центра Российской академии наук. – 2009.
Читайте также:
