Первичные митохондриальные гепатопатии - клиника, диагностика
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
В последнее десятилетие не ослабевает интерес к проблеме лечения неалкогольной жировой болезни печени (НАЖБП). С морфологической точки зрения эта патология охватывает спектр поражений печени, характеризующихся жировой дистрофией гепатоцитов (с признаками воспаления или без них), возможностью развития и прогрессирования фиброза органа и исходом в цирроз.
Патогенез НАЖБП сложен и в значительной мере зависит от этиологического фактора и включает экзогенные и эндогенные механизмы. К экзогенным факторам относится увеличение всасывания из кишечника продуктов расщепления липидов и моносахаридов, являющихся предшественниками глицеридов. Эндогенные патогенетические механизмы включают развитие инсулинорезистентности тканей, усиление периферического липолиза (действие алкоголя, катехоламинов и др.), снижение утилизации свободных жирных кислот гепатоцитами, повышение синтеза липидов и дефицит белков. Одним из основных метаболических нарушений, лежащих в основе НАЖБП, является нарушение баланса цикла глюкоза/свободные жирные кислоты (СЖК). СЖК обладают прямой (детергентный эффект, генотоксичность) и опосредованной перекисным окислением липидов (ПОЛ) токсичностью, приводящей к ингибированию активности АТФ-аз, угнетению гликолиза, разобщению окислительного фосфорилирования и снижению синтеза АТФ.
В процессе оксидативного стресса отмечается чрезмерная мобилизация свободных ионов железа из ферритина, что увеличивает содержание гидроксильных радикалов. Свободные радикалы запускают реакции ПОЛ, а также продукцию провоспалительных цитокинов, включая ФНО-альфа, ИЛ-6 и ИЛ-8. Эти патологические реакции приводят к некрозам гепатоцитов и развитию воспалительной клеточной инфильтрации как в портальных трактах, так и в дольках. Продукты ПОЛ, продукты гибели гепатоцитов, ФНО-альфа и ИЛ-6 являются активаторами стеллатных (Ito) клеток. Их стимуляция сопровождается избыточной продукцией компонентов соединительной ткани с развитием перисинусоидального фиброза, а при длительном персистировании процесса - циррозом печени.
В последние годы возрастающее внимание уделяется роли гипоксии, фактически занимающей место промежуточного фактора между первым и вторым «толчками» в состоянии НАЖБП. Это предшествует развитию процессов липопероксидации и представляющей собой митохондриальную дисфункцию гепатоцитов в результате разобщения окисления и фосфорилирования. Кроме того, гипоксия может стать и непосредственным фактором риска развития НАЖБП, как, например, у больных с синдромом обструктивного апное во сне.
Независимо от причины гипоксии (нарушение воздушного потока при обструктивном апное, прямое разобщение окисления и фосфорилирования СЖК), гипоксические изменения в митохондриальном аппарате гепатоцитов носят сходный характер и проявляются увеличением объемной плотности митохондрий (ОПМ). Однако, несмотря на это, концентрация внутренних мембран митохондрий и общая протяженность внутренних мембран в одной митохондрии значительно снижаются. Поскольку последние содержат специфические белки, необходимые для осуществления процесса окислительного фосфорилирования, с помощью которого производится большая часть АТФ в клетке, становится очевидным, что это будет приводить к усугублению энергодефицита в клетках печени и прогрессированию поражения органа.
В условиях клеточной гипоксии гепатоцитов одним из перспективных подходов для инициальной терапии поражений печени в рамках НАЖБП является быстрое улучшение энергетического статуса клетки путем ослабления ингибирования реакций цикла Кребса за счет поддержания активности его сукцинатоксидазного звена. Это FAD-зависимое звено, позднее угнетающееся при гипоксии по сравнению с NAD-зависимыми оксидазами. Оно может определенное время поддерживать энергопродукцию в клетке при условии наличия в митохондриях субстрата окисления - сукцината (янтарной кислоты). Такое воздействие может рассматриваться как инициальная терапия пациентов с НАЖБП с последующим переходом на препараты базисной терапии, а наиболее обоснованным выбором является применение сукцинатсодержащего препарата Ремаксола. Это сбалансированный полиионный раствор, действие которого, в первую очередь, обусловлено янтарной кислотой. Дополнительно в его состав введены метионин, инозин и никотинамид.
Янтарная кислота в составе препарата оказывает антигипоксическое (поддержание активности сукцинатоксидазного звена) и непрямое антиоксидантное действие (сохранение пула восстановленного глутатиона). Кроме того, предполагается, что янтарная кислота может выступать как паракринный агент, оказывающий воздействие на перициты (клетки Ито) в печени через специфические рецепторы (GPR91).
Метионин активно включается в синтез холина, лецитина и других фосфолипидов. Кроме того, под влиянием метионинаденозилтрансферазы из метионина в организме образуется S-аденозилметионин (SAM). Экспериментальные данные показали, что ремаксол увеличивает уровень эндогенного SAM в печени.
За счет инозина достигается увеличение содержания общего пула пуриновых нуклеотидов, необходимых для ресинтеза не только макроэргов (АТФ и ГТФ), но и вторичных мессенджеров (ЦАМФ и цГМФ), а также нуклеиновых кислот. Никотинамид активирует НАД-зависимые ферментные системы.
Благодаря действию компонентов препарата происходит как поддержание энергетического обеспечения гепатоцитов, так и активация синтетических процессов в них. Клиническое его изучение показало, что он может быть использован как средство инициальной терапии благодаря выраженному антигипоксическому, непрямому антиоксидантному и репаративному действию, в том числе у больных с НАЖБП. У больных с неалкогольным стеатогепатитом при инициальной терапии Ремаксолом происходит достоверное уменьшение симптомов и биохимических показателей заболевания по сравнению с адеметионином, увеличение клубочковой фильтрации и снижение уровня креатинина [Стельмах В.В. и др., 2013].
Таким образом, наличие в патогенезе НАЖБП гипоксических изменений гепатоцитов позволяет, с одной стороны, рекомендовать универсальные подходы к инициальной терапии стеатозов и стеатогепатитов с использованием сукцинатсодержащих гепатотропных препаратов, а с другой, оставляет врачу простор в выборе средств этиопатогенетически ориентированной базисной терапии в соответствии с современными принципами доказательной медицины.
Первичные митохондриальные гепатопатии - клиника, диагностика
Прогрессирующий семейный внутрипеченочный холестаз (ПСВХ) - типы, диагностика
Желчные кислоты активно транспортируются через канальцевую мембрану гепатоцита. Этот процесс является определяющим для секреции желчи. Переход через канальцевую мембрану происходит благодаря специфическим белкам (например, АТФазам Р-типа), насосу экспорта желчных солей и протеину 3, обладающему мультирезистентностью к лекарственным препаратам.
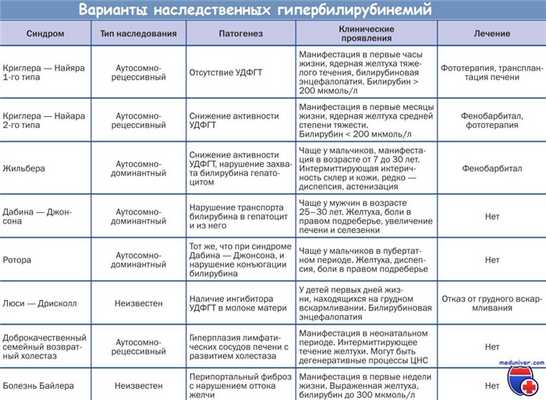
Прогрессирующий семейный внутрипеченочный холестаз (ПСВХ-1) (болезнь Байлера) является редкой сложной патологией, причиной которой служит мутация гена FIC1, кодирующего АТФазу Р-типа. Точная функция этого протеина неизвестна, но похоже, она связана с АТФ-зависимым транспортом фосфолипидов.
Патология заключается в снижении канальцевого транспорта желчной кислоты, которое приводит к образованию аномальной желчи и постепенному разрушению канальцевой мембраны, что обусловливает возникновение холестаза. К гистологическим признакам относят расширение просвета канальцев, вздутие канальцевой мембраны и потерю микроворсин.
Как правило, холестаз сочетается с нормальным уровнем гамма-глютамилтрансферазы сыворотки, что позволяет предположить наличие незначительного повреждения желчных протоков или полную их сохранность.
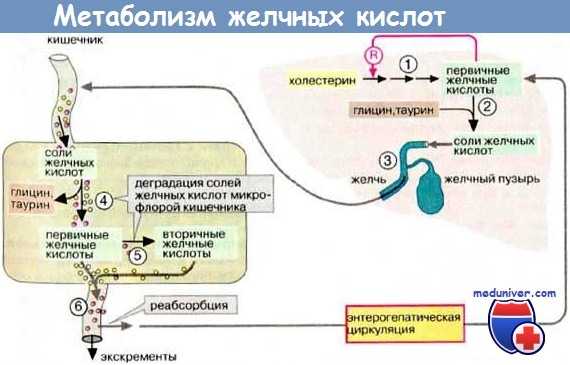
Прогрессирующий семейный внутрипеченочный холестаз (ПСВХ-2) обусловлен наличием мутации в насосе экспорта желчных солей, что приводит к почти полному отсутствию конъюгированных желчных кислот в желчи. Холестаз возникает в результате цитотоксического действия желчных кислот, которые накапливаются в гепатоцитах.
У младенцев с этим аутосомно-рецессивным заболеванием отмечают прогрессирующий холестаз, но, как и при болезни Байлера, отсутствие убедительных признаков повреждения желчных протоков при нормальном уровне гамма-глютамилтрансферазы сыворотки.
Прогрессирующий семейный внутрипеченочный холестаз (ПСВХ-3) представляет собой еще один редко встречающийся синдром, вызванный мутацией протеина 3, обладающего мультирезистентностью к лекарственным препаратам, и характеризующийся почти полным отсутствием фосфатидилхолина в желчи. При гистологическом исследовании печени выявляются пролиферация желчных протоков и воспалительные инфильтраты в портальных трактах.
У младенцев развивается ранняя желтуха, а также отмечается аномальное повышение уровня гамма-глютамилтрансферазы сыворотки, что свидетельствует о более выраженном повреждении желчных протоков. Несмотря на отсутствие длительных наблюдений, при всех перечисленных дефектах каникулярного транспорта желчи используют эмпирическую терапию урсодиоксихолевой кислотой.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Физиология:
Популярные разделы сайта:
Митохондриальные гепатопатии у детей
По мере достижений в диагностике недостаточности специфических ферментов в рамках сложных метаболических заболеваний стало понятно, что функциональные нарушения митохондрий — органелл, которые отвечают за обеспечение клеток энергией, — могут вести к развитию заболеваний. Гепатоциты, которые содержат много митохондрий для обеспечения энергией активных метаболических процессов, являются мишенью при подобных заболеваниях. Митохондриальные гепатопатии можно грубо разделить на три категории: нарушения окисления жирных кислот, нарушения окислительного фосфорилирования и синдромы уменьшения количества митохондрий.
Окислительное фосфорилирование включает окисление молекул — источников энергии кислородом с последующим сохранением энергии в виде АТФ. В процессе окисления происходит перенос восстанавливающих эквивалентов от дыхательных субстратов к кислороду с образованием АТФ посредством пяти полиферментных комплексов: восстановленный никотинамидадениндинуклеотидкофермент Q-редуктаза (комплекс I), кофермент Q-сукцинат-дегидрогеназа (комплекс II), кофермент Q-H2-цитохром С-редуктаза (комплекс III), цитохром с-оксидаза (комплекс IV) и АТФ-синтаза (комплекс V).
Описаны изолированные генетические нарушения окислительного фосфорилирования либо их сочетание с нарушением комплексов I, III, IV и V. К примеру, синдром Пирсона с поражением костного мозга и поджелудочной железы характеризуется панцитопенией, фиброзом поджелудочной железы, жировой дистрофией печени и Циррозом; развитие этого синдрома связано с существенными нарушениями комплекса I. Поскольку митохондриальные заболевания наследуются только по материнской линии, а пораженные и нормальные митохондрии могут беспорядочно сочетаться друг с другом (феномен гетероплазмии), проявления нарушенного окислительного фосфорилирования могут наблюдаться в одном органе (например, печени) либо в различных органах.
Кроме того, заболевания возможны в любом возрасте. Чаще всего они вызывают быстро развивающуюся печеночную недостаточность у новорожденных со смертельным исходом. В более позднем возрасте развиваются гепатомегалия и желтуха, неврологические проявления. Дефекты митохондриальной ДНК — самые распространенные мутации при заболеваниях, связанных с нарушением окислительного фосфорилирования. Нарушения того или иного ферментного комплекса окислительного фосфорилирования развиваются в результате мутаций ядерной и митохондриальной ДНК. К примеру, причиной недостаточности III комплекса ферментов служит дефект гена BCS1L ядерной ДНК; он проявляется поражением почечных канальцев, энцефалопатией и печеночной недостаточностью.
Диагностика мутаций генов окислительного фосфорилирования основана на анализе ферментов или оценке митохондриального дыхания в свежих и свежезамороженных образцах печени (применение последних методов весьма ограничено). Лечение симптоматическое. Трансплантация печени показана лишь в том случае, если заболевание ограничено лишь в пределах гепатоцитов.
Синдром уменьшения количества митохондрий редкое нарушение, которое характеризуется желтухой новорожденных и печеночной недостаточностью, обусловлено очень низким содержанием мтДНК в гепатоцитах. Оно вызываетизолированное поражение печени в периоде новорожденности. У детей с синдромом уменьшения количества мтДНК в первые несколько недель жизни развиваются лактат-ацидоз, прямая гипербилирубинемия и общие нарушения обмена веществ. Количество митохондрий в гепатоцитах не изменено либо даже повышено, но очень низкий уровень мтДНК (< 10 %) ведет к снижению активности окислительного фосфорилирования.
Нейрогепатопатия навахо — заболевание с аутосомно-рецессивным типом наследования, описанное только среди чистокровных индейцев навахо, также характеризуется снижением количества мтДНК и, вероятно, имеет сходный патогенез. Диагностика основана на выявлении ультраструктурных изменений в биоптате печени, включая изменения количества и размеров митохондрий, внешнего вида крист внутренней мембраны, а также на подсчете количества копий мтДНК. Лечение симптоматическое; трансплантация печени показана только при ее изолированном поражении.
Митохондриальная дисфункция при метаболическом синдроме
В последние годы особый интерес отечественных и зарубежных исследователей вызывает проблема профилактики и лечения жировой болезни печени как компонента метаболического синдрома. Значительное место в патогенезе жировой болезни печени занимают митохондриальные дисфункции. Этому вопросу был посвящен доклад заведующего кафедрой фармакологии и клинической фармакологии Санкт-Петербургской государственной химико-фармацевтической академии, д.м.н., профессора кафедры пропедевтики внутренних болезней Военно-медицинской академии (Санкт-Петербург) Сергея Владимировича ОКОВИТОГО, прозвучавший в рамках ежегодного конгресса «Гепатология сегодня».
- КЛЮЧЕВЫЕ СЛОВА: неалкогольная жировая болезнь печени, метаболический синдром, Ремаксол, стеатогепатит
В основе морфологических, биохимических и функциональных изменений при жировой болезни (ЖБП) печени лежат гиперпродукция свободных жирных кислот (СЖК), увеличение их поступления в печень, а также гиперактивация свободнорадикального окисления (СРО). На фоне усиления СРО возрастает интенсивность перекисного окисления липидов (ПОЛ). Избыточное отложение жира в гепатоцитах приводит к развитию жировой дистрофии. Гиперпродукция и окисление СЖК в митохондриях способствуют образованию свободных радикалов, которые подавляют выработку клеточных антиоксидантов. Следствием этого становятся окислительный стресс и клеточный энергодефицит.
Таким образом, при ЖБП избыточный пул свободных радикалов способствует повреждению сначала митохондриальных структур, затем клеточных мембран в целом, гибели клетки путем некроза или быстрой инициации апоптоза. Все это приводит к достаточно выраженному фибротическому повреждению органа, усугубляя гипоксию.
Тем временем активация свободнорадикальных процессов продолжается. В результате избытка СЖК, поступающих в печень в большом количестве, в частности, из жировой ткани, развиваются гипоксические изменения, усиливается тканевая гипоксия и митохондриальная дисфункция, гиперактивация СРО.
Данные процессы инициируются прежде всего за счет гипоксии, а не нарушения кровоснабжения и микроциркуляции в печени, поскольку в момент, когда включаются компенсаторные механизмы активации энергопродукции, запускается и продукция избыточного количества радикалов. Учитывая, что при ЖБП клетка существует в условиях энергодефицита, продукции естественных антиоксидантных систем не хватает для нейтрализации процесса. Начинается прогрессивное поражение печени с повреждением ее митохондрий.
Многие специалисты рассматривают гипоксию как один из ведущих факторов, влияющих на развитие ЖБП, поскольку при ЖБП промежуточным звеном между избыточным поступлением СЖК и развитием окислительного стресса является тканевая гипоксия. Именно гипоксические явления, сопряженные с дефицитом аденозинтрифосфата и нарушением митохондриального окисления, приводят к активации СРО, роль которого в патогенезе заболеваний печени сегодня хорошо известна. При этом во всех тканях происходят изменения вследствие индукции факторов, защищающих клетку от гипоксии.
Важнейшую роль при тканевой гипоксии играет кислородчувствительный протеиновый комплекс – гипоксия-индуцибельный фактор, который активируется в местах регуляции кислородных путей и обеспечивает быстрый ответ на гипоксию. Но этот же фактор будет отвечать и за неоплазию гепатоцита.
Факторы развития ЖБП усиливаются под действием митохондриальной дисфункции с нарушением митохондриального окислительного фосфорилирования, повреждением эндоплазматического ретикулума, изменением генной активности, в том числе генов, отвечающих за глюконеогенез, транспорт глюкозы, с одновременным увеличением синтеза провоспалительных цитокинов и нарушением в итоге углеводного и липидного обмена.
Гипоксия, независимо от типа (тканевая или интермиттирующая), приводит к появлению состояний, характерных для метаболического синдрома: инсулинорезистентности, нарушению функции жировой ткани, сердца, эндотелиальной дисфункции.
Развитие жировой дистрофии у пациентов с вирусными гепатитами, в том числе не употребляющих алкоголь, также тесно связано с митохондриальной дисфункцией. Место первичной репликации вируса гепатита C – митохондрии гепатоцитов. Он может вызвать митохондриальную дисфункцию, что повышает риск развития печеночной недостаточности, фиброзирования. На фоне митохондриальной дисфункции усугубляются стеатоз, инсулинорезистентность, апоптоз, фиброз печени.
Иногда к развитию ЖБП приводят мутации генов. В частности, это дефект в деацитилировании митохондриальных белков. Белки, которые в норме должны деацитилировать ряд мембранных белков митохондрий, практически не работают. В результате резко снижается активность метаболических ферментов, возрастают инсулинорезистентность, выраженность ожирения, стеатоза и воспаления, ЖБП быстро прогрессирует и развивается стеатогепатит 1 .
Перицеллюлярный фиброз у пациентов, имеющих гипоксические эпизоды, – необратимый фактор. Формируется перицеллюлярный фиброз с нарушением обменных процессов между клетками, образованием цирротических изменений и нарушением кровоснабжения с ухудшением микроциркуляции. Это приводит к развитию тяжелых осложнений и развитию перманентной гипоксии, которая будет сопровождаться неконтролируемым ростом СРО и в итоге спровоцирует гибель органа.
При гипоксии, развивающейся в случае ЖБП и фиброза, в клетке в первую очередь наступают изменения в митохондриях, за исключением жировых вакуолей, формирующихся еще ранее. Количество митохондрий не сопровождается увеличением плотности их внутренних мембран. При ЖБП и фиброзе возрастает объем митохондрий. Образуются гигантские митохондрии, заполняющие большую площадь клетки, но продуцирующие энергии меньше, чем совокупность неизмененных митохондрий в нормальной клетке. Развивается тяжелый энергодефицит.
Этиологические факторы возникновения митохондриальной дисфункции разнообразны: нарушение бета-окисления, прием лекарственных средств и алкоголя, действие вирусных агентов и др.
Активация сукцинат-оксидазного окисления в условиях гипоксии способствует коррекции физиологических процессов в клетке на уровне митохондрий – нормализует электрон-транспортную функцию дыхательной цепи, активирует ферменты. Это ненадолго облегчает поступление кислорода в клетку и восстанавливает аэробный энергетический обмен. Между тем активация сукцинат-оксидазного окисления не может длиться бесконечно, поскольку является временным компенсаторным механизмом.
В условиях дефицита антиоксидантного субстрата, активной работы цитохромов, которые начинают окислять избыток жирных кислот, усиливается процесс пероксидации. Возрастание активности провоспалительных ферментов и других факторов приводит к поддержанию и развитию воспалительного процесса.
В настоящее время ученые рассматривают подходы к компенсации митохондриальных нарушений с помощью методов биомедицины.
При традиционном способе коррекции митохондриальных нарушений при гипоксии современная медицина использует вещества, способные защитить клетку от гипоксии.
Сукцинатсодержащие препараты обладают антигипоксантным, антиоксидантным, мембраностабилизирующим и детоксицирующим действием. Экзогенно вводимый сукцинат (янтарная кислота) при гипоксии поддерживает активность сукцинатдегидрогеназного звена – ФАД-зависимого звена цикла Кребса, менее чувствительного к гипоксии по сравнению с НАД-зависимыми оксидазами. Окисление сукцината наиболее устойчиво к оксидативному повреждению. Это позволяет определенное время поддерживать энергопродукцию в клетке при наличии в митохондриях субстрата окисления, в данном звене – сукцината. Таким образом, превращение янтарной кислоты в организме связано с производством энергии, необходимой для обеспечения жизнедеятельности. Благодаря уникальным свойствам янтарная кислота считается универсальным гепатотропным препаратом для применения при различных поражениях печени как в лечебных, так и в лечебно-профилактических целях.
Сегодня на фармацевтическом рынке представлен отечественный препарат Ремаксол (компания-производитель «ПОЛИСАН»). Это не только сбалансированный полиионный инфузионный раствор. В его состав входят также физиологически активные компоненты – янтарная кислота, метионин, инозин и никотинамид. Препарат Ремаксол не только оказывает гепатопротекторный эффект, но и улучшает энергетическое обеспечение гепатоцитов, повышает устойчивость мембран гепатоцитов к ПОЛ, восстанавливает активность ферментов антиоксидантной защиты.
Эффективность применения препарата Ремаксол в терапии ЖБП обусловлена воздействием на основные механизмы развития повреждения печени, что позволяет корригировать митохондриальную дисфункцию, повреждение мембран гепатоцитов и окислительный стресс. Препарат Ремаксол может быть использован как средство инициальной терапии в рамках патогенетеческого лечения, а также при невозможности элиминации этиологического фактора. Указанные гепатопротекторные свойства Ремаксола делают его перспективным в лечении нарушений функции печени.
В последние годы особый интерес отечественных и зарубежных исследователей вызывает проблема профилактики и лечения жировой болезни печени как компонента метаболического синдрома. Значительное место в патогенезе жировой болезни печени занимают митохондриальные дисфункции. Этому вопросу был посвящен доклад заведующего кафедрой фармакологии и клинической фармакологии Санкт-Петербургской государственной химико-фармацевтической академии, д.м.н., профессора кафедры пропедевтики внутренних болезней Военно-медицинской академии (Санкт-Петербург) Сергея Владимировича ОКОВИТОГО, прозвучавший в рамках ежегодного конгресса «Гепатология сегодня».
Тем временем активация свободнорадикальных процессов продолжается. В результате избытка СЖК, поступающих в печень в большом количестве, в частности, из жировой ткани, развиваются гипоксические изменения, усиливается тканевая гипоксия и митохондриальная дисфункция, гиперактивация СРО. Данные процессы инициируются прежде всего за счет гипоксии, а не нарушения кровоснабжения и микроциркуляции в печени, поскольку в момент, когда включаются компенсаторные механизмы активации энергопродукции, запускается и продукция избыточного количества радикалов. Учитывая, что при ЖБП клетка существует в условиях энергодефицита, продукции естественных антиоксидантных систем не хватает для нейтрализации процесса. Начинается прогрессивное поражение печени с повреждением ее митохондрий.
Важнейшую роль при тканевой гипоксии играет кислородчувствительный протеиновый комплекс - гипоксия-индуцибельный фактор, который активируется в местах регуляции кислородных путей и обеспечивает быстрый ответ на гипоксию. Но этот же фактор будет отвечать и за неоплазию гепатоцита. Факторы развития ЖБП усиливаются под действием митохондриальной дисфункции с нарушением митохондриального окислительного фосфорилирования, повреждением эндоплазматического ретикулума, изменением генной активности, в том числе генов, отвечающих за глюконеогенез, транспорт глюкозы, с одновременным увеличением синтеза провоспалительных цитокинов и нарушением в итоге углеводного и липидного обмена.
Читайте также:
