Подагра при пороке сердца. Врожденные пороки сердца с клиникой подагры
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Пороки сердца: причины появления, симптомы, диагностика и способы лечения.
Определение
Порок сердца определяется как атипичное или аномальное строение его структур (камер, клапанов, крупных сосудов), являющееся следствием нарушений закладки и развития (врожденный порок сердца) либо разнообразных патологических изменений (приобретенный порок сердца). В результате формирования данной патологии нарушается работа сердца и формируется кислородная недостаточность органов и тканей организма, которая в конечном счете может привести к сердечной недостаточности.
Причины появления пороков сердца
У человека кровь, возвращающаяся к сердцу от всех органов и тканей (кровь, бедная кислородом), проходит через правое предсердие и затем через правый желудочек в легочную артерию, а оттуда поступает в легкие. В легких кровь обогащается кислородом, высвобождает углекислый газ и поступает в левое предсердие и левый желудочек, а оттуда перекачивается ко всем органам и тканям через аорту, а затем через артерии более мелкого калибра.
Работоспособность сердечной мышцы зависит от функционирования клапанов, которые при ее сокращении беспрепятственно пропускают кровь в следующий отдел, а при расслаблении не позволяют крови поступать обратно.
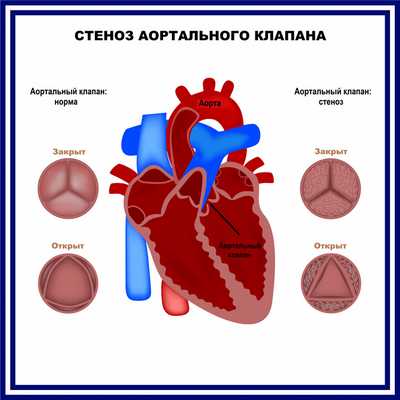
Врожденные пороки сердца весьма разнообразны. Описано более полутора сотен различных вариантов нетипичного строения сердца. Примерно один из 100 младенцев рождается с пороком сердца. Часто встречающимися патологиями сердца, диагностированными в младенчестве и детстве, являются дефекты межпредсердной и межжелудочковой перегородок (отверстия между камерами сердца). Нередко дефекты сочетаются с аномалиями клапанного аппарата сердца или крупных сосудов. Наиболее распространенным врожденным пороком сердца является двустворчатый аортальный клапан, который открывается при каждом сердечном сокращении, давая крови возможность течь от сердца ко всем органам. Нормальный аортальный клапан имеет три створки.
Двустворчатый аортальный клапан обычно не вызывает проблем в младенчестве или детстве, поэтому часто диагностируется только во взрослом возрасте.
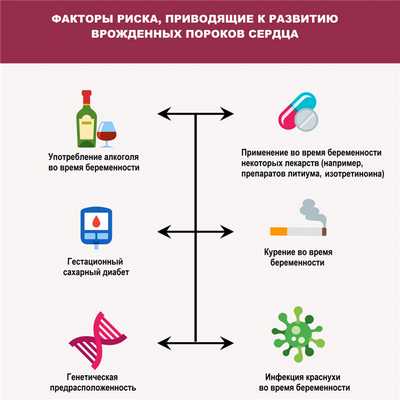
Среди причин развития врожденных пороков сердца выделяют генетические, экологические и инфекционные. Помимо этого, к их формированию могут приводить определенные заболевания (гестационный сахарный диабет, краснуха и системная красная волчанка) у матери, прием некоторых лекарственных препаратов, наркотиков и алкоголя во время беременности и другие факторы.
Приобретенные пороки – это аномалии и дефекты клапанов сердца, его отверстий или перегородок между камерами, отходящих от него сосудов, появившиеся в процессе жизни под воздействием морфологических и функциональных изменений в работе сердца. Митральный клапан страдает чаще, чем аортальный. Реже встречаются патологии трехстворчатого (трикуспидального) клапана и клапана легочной артерии. Заболевания могут манифестировать в любом возрасте под влиянием атеросклероза, кардиосклероза, ишемической, либо гипертонической болезни, ревматизма, системной патологии, травмы, сифилиса и некоторых других причин. Также к клапанным порокам сердца приводят дегенеративные изменения клапанов - при развитии заболевания нарушается их строение и функция, что вызывает перестройку гемодинамики, происходит перегрузка соответствующих отделов сердца, гипертрофия сердечной мышцы, нарушение кровообращения в сердце и в организме в целом.
Классификация заболевания
- пороки «белого» типа, когда нет тенденции к смешиванию артериальной и венозной крови;
- пороки «синего» типа – венозная кровь попадает в артериальное русло, вследствие чего формируется кислородная недостаточность.
- стеноз - в результате патологического процесса возникает деформация тканей клапана и сужается отверстие, через которое кровь поступает в следующий отдел сердца;
- недостаточность клапанов - несмыкание клапанов сердца из-за изменения формы, их укорочения в результате рубцевания пораженных тканей;
- комбинированные и сочетанные пороки сердца:
- комбинированные – при наличии и стеноза, и недостаточности одного клапана;
- сочетанные – при поражении сразу нескольких клапанов.
- дегенеративные, или атеросклеротические (встречаются в 5-6% случаев) - чаще эти процессы развиваются после 40-50 лет, когда происходит отложение кальция на створках пораженных клапанов, что приводит к прогрессированию порока;
- ревматические, формирующиеся на фоне ревматических заболеваний (80% случаев);
- пороки, возникающие как результат воспаления внутренней оболочки сердца (эндокардит);
- сифилитические (в 5% случаев).
Симптомы пороков сердца
К клиническим симптомам пороков сердца относятся одышка, слабость, быстрая утомляемость, отеки нижних конечностей, нарушение сна, перебои в работе сердца, аритмия (чаще тахикардия), изменение цвета кожи (синюшность или бледность), набухание вен шеи и головы, беспричинное беспокойство, давящая боль в области сердца (особенно при физических нагрузках) или между лопатками, в редких случаях - потеря сознания.
Специфические симптомы врожденных пороков сердца зависят от возраста пациента. Поскольку нормальная циркуляция богатой кислородом крови необходима для нормального роста и развития организма, у младенцев может наблюдаться затрудненное или учащенное дыхание, плохой аппетит, потливость или повышенная частота дыхания во время кормления, цианоз губ и/или кожи, необычная раздражительность или отставание в прибавке в весе.
У детей и подростков могут наблюдаться снижение переносимости физических нагрузок, головокружения, обмороки.
Большинство серьезных пороков сердца у детей выявляются на основании симптомов, которые замечают родители, а также на основании отклонений, обнаруживаемых при осмотре врачом. Нарушенный ток крови через сердце обычно проявляется сердечными шумами, которые можно услышать с помощью стетоскопа. Аномальные сердечные шумы зачастую бывают громкими или резкими. Однако в подавляющем большинстве случаев сердечные шумы, отмечаемые в детском возрасте, являются функциональными и не обусловлены пороками сердца.
Выраженность и характер симптомов зависят от расположения пораженного клапана. При пороках клапанов левой половины сердца (митрального и аортального) в первую очередь страдают легкие, так как в их сосудах застаивается кровь, что проявляется одышкой и кашлем. Кроме того, возникают признаки недостаточного кровоснабжения головного мозга и самого сердца, головокружение, обмороки, стенокардия. При наличии цианоза одной из наиболее распространенных патологий является тетрада Фалло (ограничение поступления крови в легкие).
![Стеноз аортального клапана.jpg]()
При нарушении работы клапанов правой половины сердца (трехстворчатого и клапана легочной артерии) происходит застой крови в сосудах большого круга кровообращения, поэтому страдают все органы кроме легких. Развиваются отеки голеней и стоп, асцит (скопление жидкости в брюшной полости), увеличение печени и другое.отставание в прибавке в весе.
Признаки приобретенных пороков зачастую сочетаются с другими заболеваниями сердца, в частности, с ишемической болезнью, что затрудняет их клиническую дифференциацию.
Диагностика пороков сердца
Диагностические мероприятия, проводимые с целью обнаружения порока сердца, требуют комплексного подхода, но всегда начинаются со сбора анамнеза: врач выясняет жалобы пациента, время и обстоятельства их проявления, интенсивность, наследственные факторы. Далее проводится физикальный осмотр, который включает визуальный осмотр, пальпацию, перкуссию (простукивание), аускультацию (выслушивание).
Лабораторные исследования, которые назначают при подозрении на порок сердца:
Подагра при пороке сердца. Врожденные пороки сердца с клиникой подагры
Подагра — общее заболевание организма, связанное с нарушенным обменом нуклеиновых кислот. Характеризуется резкими и повторными приступами артрита с сильными болями и отложением кристаллов мочекислого натрия в хрящах, сухожилиях, слизистых сумках суставов, иногда в коже, почках и мышцах.
При подагре концентрация мочевой кислоты в крови повышена до 6—7 мг в 100 мл крови (при норме 4 мг в 100 мл крови), причина этого до сих пор не известна (О. И. Сокольников, 1965).В возникновении подагры имеет значение нарушение пищевого режима, алкоголизм и возраст больных (старше 40 лет). Некоторые исследователи высказывают предположение о первичном значении аллергии. Заболевают подагрой преимущественно мужчины в возрасте старше 40—45 лет (О. И. Сокольников, 1965; М. Г. Астапенко и Э. Г. Пихлак, 1966).
Приступы подагры наряду с повышением мочевой кислоты сопровождаются нарушением электролитного равновесия и водного обмена. Характерным признаком является пониженное выделение 17-кетостероидов с мочой, составляющее у больных подагрой 3,2 мг в сутки, то есть 1/3 нормы.
По клинической картине подагра подразделяется на острую (подагрический артрит), хроническую и атипичную с поражением внутренних органов. При этом чаще всего отмечаются нарушения почечной деятельности с отложением уратов в мочевыводящих путях.
![подагра при пороке сердца]()
При истинной полицитемии подагра наблюдается в 5—9% случаев (Tiney и др., 1945; Vidibaek, 1950; Lawrence, 1955). При врожденных пороках сердца «синего» типа, сопровождающихся вторичной полицитемией, частота подагры, по данным Lommerwill (1961), составляет 2,2%, а по данным Levis (1961) —4,5%.
Впервые о приступе подагры у больной тетрадой Фалло, 25 лет, сообщил Talbot (1941). Позднее о заболевании подагрой у больного цианотическим пороком сердца, 50 лет, сообщили Lu с соавторами (1953); у больного с общим артериальным стволом, 25 лет, — Cameron (1961); у больного с комплексом Эйзенменгера, 25 лет, — Beruheim и Chabot (1963); у больного с триадой Фалло, 32 лет, — Slama с соавторами (1966).
Levis не нашел параллелизма между уровнем содержания мочевой кислоты в крови и заболеванием подагрой. Slama с соавторами полагают, что в возникновении подагры у «синих» больных играет роль недостаточное выведение мочевой кислоты наряду с выраженной по-лиглобулией. Авторы указывают, что у описываемой ими больной приступы подагры прекратились после хирургической коррекции порока.
В возникновении подагры у «синих» больных имеет значение недостаточное выведение мочевой кислоты в связи с заболеванием почек. Так, из 9 больных, описанных Sommerville, у 5 было первичное почечное заболевание, у 2 подтверждено гистологически. Ни у одного не было признаков подагрического заболевания почек.
Во всех описанных в литературе случаях клинически отмечалась характерная картина хронического подагрического артрита.
Таким образом, при цианотических пороках сердца подагра наблюдается в молодом возрасте при выраженной полиглобулии и гиперуринемии. Хирургическая коррекция порока сердца, устраняющая полиглобулию, и обусловленное ею повышенное содержание мочевой кислоты в крови считаются единственно радикальным лечением подагры.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.Механизмы развития абсцессов мозга при пороке сердца. Клиника и течение абсцессов мозга
До настоящего времени нет единого мнения о патогенезе абсцессов мозга при врожденных пороках сердца.
Нейрохирурги делят абсцессы мозга на метастатические, контактные и травматические. Абсцессы мозга при врожденных пороках сердца чаще представляют одну из разновидностей метастатических.О развитии их имеются две точки зрения: первая рассматривает абсцессы мозга как следствие парадоксальных эмболии инфицированными эмболиями (Ehni, Grain, 1952; Marande, 1952, и др.), однако эта теория не объясняет избирательного абсцедирования мозга у больных врожденными пороками сердца. Согласно второй, в результате эмболии или тромбоза сосудов головного мозга, развивающихся на фоне гипоксии, полицитемии и стаза, вначале образуются очаги инфаркта и размягчение мозга (очаги наименьшего сопротивления).
В дальнейшем в результате гематогенной инфекции происходит вторичное инфицирование с развитием абсцессов (Sancetta, Zimmerman, 1950; Roger с соавт., 1952; 3. Я. Лурье, 1958, и др.). Такие очаги размягчения в головном мозгу установили Наnnа (1941), Gluck, Hall, Stewenson (1952), В. Б. Гельфанд (1967) и др.
Источником метастазирования и парадоксальных эмболии могут явиться подострый септический эндокардит, тромбоз вен нижних конечностей или геморроидальных вен, бронхоэктатическая болезнь, отит, экстракция кариозных зубов, удаление миндалин и др.
![абсцесс мозга]()
В ряде случаев не удается обнаружить источника метастазирования. Возможно развитие контактных абсцессов мозга в результате перехода гнойной инфекции на мозг из воспалительных очагов, расположенных во внутреннем ухе и придаточных пазухах носа, а также асептических абсцессов (Weber, 1957; Raimondi с соавт., 1965).
Клиническое течение абсцесса мозга нейрохирурги делят на четыре периода: 1) начальный, соответствующий внедрению в мозговую ткань гнойной инфекции и характеризующийся общими симптомами: недомогание, вялость, снижение аппетита, повышение температуры тела; 2) латентный, соответствующий отграничению гнойного процесса в мозгу с образованием вокруг него соединительнотканной капсулы и характеризующийся улучшением общего состояния, исчезновением жалоб, нормализацией воспалительных изменений в крови и ликворе; 3) манифестный, характеризующийся воспалительными симптомами общего характера (повышение температуры, изменения крови), изменениями в спинномозговой жидкости, симптомами повышения внутрипочечного давления и очаговыми симптомами поражения мозга; 4) терминальный.
Диагностика абсцессов мозга у больных с врожденными пороками сердца трудна, так как отсутствуют характерные для воспалительного процесса изменения крови (Soulie, 1962).
Течение абсцесса мозга острое, со склонностью к прорыву в желудочки мозга. В некоторых случаях возможно хроническое волнообразное с периодическими обострениями.- Вернуться в оглавление раздела "Кардиология."
Кардиоваскулярный риск у больных подагрой и возможные пути его снижения
Для подагры характерен высокий кардиоваскулярный риск. В качестве иллюстрации приведено клиническое наблюдение пациента с подагрой с развитием фатального сердечно-сосудистого осложнения. Согласно рекомендациям, аллопуринол остается препаратом первой линии
Cardiovascular risk in patients with gout and possible ways to reduce it N. A. Magdeeva, I. A. Romanova, N. M. Nikitina
Gout is characterized by high cardiovascular risk. The article presents clinical case of poor outcome of a patient with gout with the development of a fatal cardiovascular complication. According to the latest recommendations, allopurinol is recommended as first-line urate-lowering therapy and its dosage should be adjusted according to renal function. If the serum uric acid target cannot be achieved with allopurinol, it should be replaced with febuxostat.The first experience of using febuxostat in our country demonstrates the possibility of its use in patients with severe disabling gout.
Подагра — системное заболевание, при котором в различных тканях откладываются кристаллы моноурата натрия и у лиц с гиперурикемией развивается воспаление, обусловленное внешнесредовыми и/или генетическими факторами [1]. Распространенность подагрического артрита в популяции достаточно высока и составляет 5–28 на 1000 мужчин и 1–6 на 1000 женщин, а число новых случаев в год — 1–3 на 1000 мужчин и 0,2 на 1000 женщин [2].
За последние десятилетия заболеваемость подагрой увеличилась в несколько раз [3]. Несмотря на подробное описание подагры уже в прошлом тысячелетии, данное заболевание остается одним из поздно диагностируемых процессов. По данным клиники терапии и профболезней им. Е. М. Тареева Первого МГМУ им. И. М. Сеченова, из 128 больных типичной подагрой более чем у половины диагноз был установлен крайне поздно, уже при далеко зашедшем поражении органов [4].
Интерес к проблеме подагры обусловлен не только ростом ее заболеваемости, но и обнаруженными взаимосвязями подагры, гиперурикемии и кардиоваскулярного риска [5]. Гиперурикемия играет важную роль в развитии артериальной гипертензии (АГ), сахарного диабета и является независимым предиктором сердечно-сосудистых заболеваний [6].
Патогенетические механизмы повышения сердечно-сосудистой заболеваемости и смертности у лиц с гиперурикемией и подагрой многообразны. Хроническое воспаление — один из факторов, который запускает и поддерживает процесс формирования атеросклеротической бляшки у больных с гиперурикемией и подагрой [7]. Окислительный стресс является еще одним из важных факторов, способствующих эндотелиальной дисфункции и повреждению сосудистой стенки, лежащих в основе развития сердечной недостаточности (СН), АГ, ишемической болезни сердца (ИБС) у больных ревматическими заболеваниями [8].
По нашим данным, совпадающим с данными литературы [9], пациенты с подагрой относятся к группе больных с высоким риском фатальных сердечно-сосудистых осложнений, что обусловлено имеющейся эндотелиальной дисфункцией (повышением антитромбогенной активности сосудистой стенки, повреждением сосудистой стенки, увеличением жесткости артерий). Традиционные факторы сердечно-сосудистого риска чаще встречаются у больных подагрой, чем в общей популяции. В нашем исследовании у 91% больных по данным суточного мониторирования артериального давления (АД) выявлялась АГ, у большинства больных подагрой (73,7%) выявлен суточный профиль с недостаточной степенью ночного снижения АД (non-dipper) [10]. У таких пациентов значительно повышена жесткость артерий, уровень С-реактивного белка (СРБ) (р < 0,05) [11].
В последние годы исследователи находят взаимосвязь также между наличием аортального стеноза и подагры, однако является ли подагра фактором риска либо маркером поражения клапанов сердца, еще только предстоит изучить [12]. Но несомненно, что поражение сердечно-сосудистой системы при подагре, наряду с артритом, является одним из основных клинических проявлений подагры, определяющим тяжесть течения и прогноз заболевания [13]. Сердечно-сосудистая заболеваемость и смертность превышают смертность от поражения почек у больных подагрой [14].
В качестве иллюстрации приводим клинический случай пациента с подагрой с развитием фатального сердечно-сосудистого осложнения.
Пациент К., 62 лет, житель Саратовской области, работал в течение 38 лет водителем. Страдал подагрой в течение 13 лет. Заболевание началось типично, с возникновения острых приступов артрита суставов стоп, включая первые плюснефаланговые суставы, суставы предплюсны, повторяющихся 3–4 раза в год. Приступы купировались приемом нестероидных противовоспалительных препаратов (НПВП) в течение нескольких дней. Через 3 года от начала заболевания обратился к ревматологу, выставлен диагноз подагры, назначен аллопуринол в дозе 200 мг/сутки, но пациент изначально демонстрировал низкую приверженность лечению. Аллопуринол принимал только лишь при рецидиве артрита, совмещал с приемом НПВП. Частота приступов артрита непрерывно увеличивалась, в течение последних 8 лет не было межприступных периодов. С 56-летнего возраста наблюдался максимально быстрый рост подкожных тофусов, что привело к деформации, обезображиванию конечностей, выраженному ограничению объема движений в суставах (кистей, стоп, коленных, голеностопных, лучезапястных, локтевых, плечевых). С 58 лет периодически отмечал повышение АД (максимально до 170 и 100 мм рт. ст.), однако постоянной антигипертензивной терапии не получал. Эпизодически принимал эналаприл 20 мг в сутки.
Был госпитализирован в ревматологическое отделение областной клинической больницы в апреле 2015 г. При осмотре: рост — 178 см, масса тела — 109 кг, ИМТ — 34,4 кг/м 2 .
Обращали на себя внимание подкожные образования (тофусы) в области ушных раковин, тыльной поверхности пальцев стоп, локтевых, коленных суставов, кистей, некоторые — больших размеров (рис.); болезненность, припухлость суставов кистей и стоп, голеностопных, коленных суставов; ограничение движений в них. Интенсивность боли в суставах по визуальной аналоговой шкале — 80 мм. По данным лабораторных исследований: сывороточный уровень мочевой кислоты (МК) крови — 740 мкмоль/л (целевой уровень 360 мкмоль/л), креатинина — 98,4 мкмоль/л, СРБ — 10,4 мг/л, СОЭ — 45 мм/ч. После купирования артрита была возобновлена терапия аллопуринолом 200 мг/сутки. Через 1 неделю после начала терапии сывороточный уровень МК снизился до 504,3 мкмоль/л. Из антигипертензивных препаратов пациент принимал лозартан 100 мг/сутки, амлодипин 5 мг/сутки. На этом фоне АД было в пределах 140 и 90 мм рт. ст. Пациент был выписан на амбулаторный этап с рекомендациями продолжить терапию, титровать дозу аллопуринола до достижения целевых значений МК, чего пациент не выполнял. Терапию получал нерегулярно.
В феврале 2016 г. по экстренным показаниям был госпитализирован в отделение неотложной кардиологии с клиникой острого коронарного синдрома. Несмотря на проводимую терапию в полном объеме, больной скончался через 14 часов после поступления в стационар от острого Q-инфаркта миокарда с локализацией в задней стенке левого желудочка.
Данное клиническое наблюдение не уникально, а скорее типично. Пациенты мужского пола среднего и пожилого возраста, имеющие метаболический синдром, тофусную подагру, без адекватной гиперурикемической терапии чрезвычайно часто погибают от сердечно-сосудистых осложнений.
В 2016 г. были опубликованы новые Европейские рекомендации по ведению пациентов с подагрой [15]. Одной из причин пересмотра ранее существующих рекомендаций явилось появление новых лекарственных препаратов. Так, в последние десятилетия для лечения острых приступов, наряду с НПВП и колхицином, стали применяться ингибиторы ИЛ-1, в качестве уратснижающих препаратов — непуриновые ингибиторы ксантиноксидазы (КОИ), урикозурики, препараты уриказы.
В нашей стране ингибиторы ксантиноксидазы представлены двумя классами препаратов — пуриновыми (аллопуринол, оксипуринол) и непуриновыми (фебуксостат, топироксостат).
Согласно последним рекомендациям, аллопуринол остается препаратом первой линии уратснижающей терапии при сохраненной функции почек. Если целевой уровень МК не может быть достигнут с помощью адекватной дозы аллопуринола, то препарат должен быть заменен на фебуксостат. Фебуксостат показан при непереносимости аллопуринола и является препаратом выбора при хронической болезни почек [15].
В результате крупных исследований были получены доказательства того, что эффективная уратснижающая терапия не только уменьшает риск развития новых приступов артрита и повышает качество жизни пациентов, но и снижает риск сердечно-сосудистых заболеваний, поражения почек и смертность [19].
В литературе имеются противоречивые данные в отношении протективного действия КОИ на сердечно-сосудистую систему [20]. Популяционное исследование в Великобритании показало, что прием аллопуринола при подагре отождествлялся с 19% снижением риска смерти [21]. Имеются данные о снижении выраженности эндотелиальной дисфункции на фоне приема аллопуринола у больных с высоким кардиоваскулярным риском [22].
В литературе обсуждается вопрос о возможном дозозависимом эффекте влияния аллопуринола на сердечно-сосудистый риск. Так, в работе А. Noman с соавт. (2010) аллопуринол в высоких дозах (600 мг/сутки) у пациентов со стенокардией показал себя в качестве эффективного антиишемического средства, а у пациентов с сердечной недостаточностью те же высокие дозы препарата двукратно снижали смертность [23]. Тогда как в более поздних работах имеется указание на нивелирование позитивного кардиоваскулярного эффекта аллопуринола в дозе, превышающей 300 мг в сутки [24], что может быть связано с повышением оксидативного стресса в условиях высокой концентрации метаболита аллопуринола — оксипуринола [25].
В 2018 г. в работе M. Bredemeier с соавт. представлен систематический обзор и метаанализ рандомизированных исследований [26], целью которого явился анализ случаев основных неблагоприятных сердечно-сосудистых событий, смертности (общей и сердечно-сосудистой) в рандомизированных контролируемых исследованиях с применением КОИ по сравнению с плацебо или отсутствием лечения. Анализ включал 81 статью (10 684 больных, 6434 пациенто-лет). Результаты показали, что назначение КОИ существенно не влияло на риск основных неблагоприятных сердечно-сосудистых событий (относительный риск (ОP) 0,71, 95% доверительный интервал (ДИ) 0,46–1,09) и смерти (ОР 0,89, 95% ДИ 0,59–1,33), но приводило к снижению риска общего числа (ОР 0,60, 95% ДИ 0,44–0,82), в том числе серьезных, сердечно-сосудистых событий (ОР 0,64, 95% ДИ 0,46–0,89) и АГ (ОР 0,54, 95% ДИ 0,37–0,80). Это касалось и больных с наличием сердечно-сосудистой патологии в анамнезе (ОР 0,42, 95% ДИ, 0,23–0,76).
У больных, получающих аллопуринол, был ниже риск развития инфаркта миокарда (ОР 0,38, 95% ДИ 0,17–0,83), АГ (ОР 0,32, 95% ДИ 0,18–0,58), общего числа (0,48, 0,31–0,75) и серьезных сердечно-сосудистых событий (ОР 0,56, 95% ДИ 0,36–0,86). Однако этот эффект нивелировался при повышении дозы аллопуринола выше 300 мг/сутки, что требует дальнейших исследований.
Кардиоваскулярные эффекты непуриновых ингибиторов ксантиноксидазы менее изучены. В результате селективного ингибирования двух форм ксантиноксидазы (окисленной и восстановленной) при приеме фебуксостата происходит снижение концентрации МК в сыворотке крови больного.
Описано влияние фебуксостата на инсулинорезистетнность (ИР), экспрессию высокочувствительного СРБ (вч-СРБ), что является важным как в терапии подагры, так и в снижении кардиоваскулярного риска [27]. В исследование J. Meng с соавт. было включено 42 пациента с подагрой и 20 испытуемых группы контроля, сопоставимых по полу и возрасту. Определяли уровень инсулина и глюкозы крови натощак, вч-СРБ. ИР оценивали с использованием индекса HOMA-IR. У пациентов с подагрой были более высокие показатели МК, инсулина, индекс НОМА-Ш и уровень вч-СРБ, чем у лиц группы контроля (р < 0,05). После 4, 12 и 24 недель лечения фебуксостатом концентрация МК и вч-СРБ значительно снизилась (р < 0,05). Уровень инсулина и индекс НОМА-IR несколько снизились после 4 недель терапии и значительно уменьшились через 12 и 24 недели лечения. Таким образом, фебуксостат позволяет эффективно контролировать уровень МК в сыворотке и повышает чувствительность к инсулину у пациентов с подагрой.
Непуриновые ингибиторы ксантиноксидазы обладают антиоксидантными свойствами за счет сокращения числа метаболитов пуринового метаболизма, улучшения функции эндотелия [28]. Существуют исследования, предполагающие преимущества фебуксостата перед аллопуринолом по устранению эндотелиальной дисфункции [28] и даже улучшение показателей у пациентов, получавших фебуксостат, по сравнению с аллопуринолом [29]. В то же время, согласно инструкции по медицинскому применению фебуксостата, применение препарата не рекомендуется у пациентов с ИБС или застойной СН, поскольку, согласно результатам долгосрочных широкомасштабных исследований, в группе пациентов, получающих фебуксостат, по сравнению с группой пациентов, получающих аллопуринол, отмечалось увеличение количества нарушений со стороны сердечно-сосудистой системы [30]. В группе фебуксостата отмечалось численно больше сердечно-сосудистых событий по композитной конечной точке «нефатальный инфаркт миокарда, нефатальный инсульт или сердечно-сосудистая смерть». Однако эти различия с группами аллопуринола не достигли статистической достоверности и не повторились в исследовании CONFIRMS [31].
В настоящее время продолжаются рандомизированные клинические исследования, способные оценить влияние фебуксостата на сердечно-сосудистый риск у больных с подагрой [32].
Таким образом, у больных подагрой повышен кардиоваскулярный риск. Адекватная уратснижающая терапия способна не только нормализовать уровень МК крови, но и улучшить жизненный прогноз пациентов с подагрой за счет снижения риска развития сердечно-сосудистых заболеваний. В представленном нами клиническом наблюдении отсутствие адекватной уратснижающей терапии явилось одним из факторов развития неблагоприятного исхода. Для уточнения механизмов и особенностей влияния различных ингибиторов ксантиноксидазы на сердечно-сосудистый риск требуются дальнейшие исследования.
Литература
Н. А. Магдеева, кандидат медицинских наук
И. А. Романова, кандидат медицинских наук
Н. М. Никитина 1 , доктор медицинских наук, профессорФГБОУ ВО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
Кардиоваскулярный риск у больных подагрой и возможные пути его снижения/ Н. А. Магдеева, И. А. Романова, Н. М. Никитина
Для цитирования: Лечащий врач № 9/2018; Номера страниц в выпуске: 82-85
Теги: подагрический артрит, сердечно-сосудистые осложнения, группа риска, гипертензия1. Гипертрофия правого желудочка при тетраде и пентаде Фалло. Гипертрофия при пороках сердца Фалло
2. Увеличение сердца при пентаде Фалло. Вес сердца при пороках Фалло
3. Гемодинамика при тетраде Фалло. Кровоток при пентаде Фалло
4. Триада Фалло. Кровоток и изменение сердца при триаде Фалло
5. Инфундибулярное сужение конуса правого желудочка. Трехкамерное сердце с двумя желудочками
6. Анатомия трикуспидальной атрезии. Виды трикуспидальной атрезии
7. Гипертрофия миокарда, гемодинамика при трикуспидальной атрезии. Атрезия правого желудочка
8. Транспозиция магистральных сосудов. Гипоплазия легочной артерии
9. Атрезия устья легочной артерии. Врожденные пороки сердца с уменьшением кровотока через легкие
10. Пороки сердца с увеличением кровотока через легкие и цианозом. Цианз при транспозиции магистральных сосудов1. Дефекты перегородок сердца. Открытый боталлов проток и облитерация артериального конуса
2. Инфундибулярное сужение артериального конуса. Сужение артериального конуса правого желудочка
3. Вес сердца при различных пороках. Влияние возраста на вес сердца при пороке
4. Влияние порока на вес сердца. Закономерности изменений сердца при врожденных пороках
5. Морфология дефекта межпредсердной перегородки. Гистология дефекта межпредсердной перегородки
6. Морфология дефекта межжелудочковой перегородки. Строение дефекта межжелудочковой перегородки
7. Коллагеновое кольцо при дефекте межжелудочковой перегородки. Строение суженного артериального конуса
8. Дополнительные выходные тракты правого желудочка. Морфология дополнительных выходных трактов правого желудочка
9. Морфология бородавчатого эндокардита. Эндокардит при врожденных пороках сердца
10. Клапанное сужение артериального конуса. Эластичность артериального конуса сердца
11. Генетические причины пороков сердца. Врожденные заболевания сердца
12. Дефекты межпредсердной и межжелудочковой перегородок. Генетические причины дефектов перегородок сердца
13. Причины нарушения ритма при дефектах перегородок сердца. Двухстворчатый аортальный клапан1. Систолическая перегрузка желудочков. Классификация сердечной недостаточности
2. Острая сердечная недостаточность при пороке сердца. Классификация СН при пороках сердца
3. Сердечная недостаточность в раннем детском возрасте. Одышка и хрипы в легких при пороках сердца
4. Сердечная недостаточность у грудных детей. Сердечная недостаточность у детей старшего возраста и взрослых
5. Сердечные гликозиды при СН. Дигоксин и дигитализация при сердечной недостаточности
6. Интоксикация сердечными гликозидами. Оперативное лечение порока сердца при сердечной недостаточности
7. Миокардиодистрофия. Дистрофия миокарда при пороках сердца
8. Перикардит при пороках сердца. Диагностика и лечение эксудативного и слипчивого перикардита
9. Нарушение ритма сердца и проводимости при пороках сердца. Внутрижелудочковая блокада при пороке сердца
10. Миграция водителя ритма при пороке сердца. Атрио-вентрикулярный ритм при пороке сердца2. Формирование общего артериального ствола. Формирование клапанов сердца
3. Фазы развития сердца. Теория филогенетического происхождения пороков сердца
4. Вирусная теория врожденных пороков сердца. Внешние факторы как причина врожденных пороков сердца
5. Эпидемиология врожденных пороков сердца. Частота врожденных пороков сердца
6. Классификация врожденных пороков сердца. Тетрада Фалло
7. Сужение аортального конуса при пороках сердца. Коронарные сосуды при врожденных пороках сердца
8. Сосуды Вьессана — Тебезия при тетраде Фалло. Клапанный стеноз легочной артерии
9. Врожденные дефекты перегородок сердца. Виды дефектов межпредсердной перегородки
10. Трехкамерное сердце. Дефект межжелудочковой перегородки2. Врожденная атрио-вентрикулярная блокада у детей. Приступ Морганьи—Эдемс—Стокса
3. Синдром Вольф — Паркинсон — Уайта (WPW) у детей. Аневризма легочной артерии и аорты при пороке сердца
4. Болезни легких у детей с пороком сердца. Частота повторных пневмоний при ВПС
5. Причины повторных пневмоний при пороке сердца. Патогенез повторных пневмоний у детей с ВПС
6. Хронические пневмонии у детей с пороком сердца. Легочная гипертензия и повторные пневмонии
7. Клиника повтороных пневмоний у детей. Течение повторных пневмоний при пороке сердца
8. Пример повторных пневмоний у ребенка. Хроническая пневмония при открытом артериальном протоке
9. Сочетание порока сердца и бронхоэктатической болезни. Зависимость частоты пневмоний от гипертензии в малом круге
10. Внешнее дыхание у детей при пороке сердца. Степень легочной гипертензии и хронические пневмонии2. Операция при сужении артериального конуса. Смертность при инфундибулотомии
3. Сердце при сужении артериального конуса. Морфология закрытой вальвулотомии по Броку
4. Результаты закрытых операций на сердце. Механизм инфудибулэктомии
5. Эффективность вальвулотомии. Опасность инфудибуляной резекции по методу Брока
6. Смертность при операции по поводу тетрады Фалло. Идеальная операция при тетраде Фалло
7. Суженный артериальный конус левого желудочка. Клапанное сужение артериального конуса левого желудочка
8. Операции на артериальном конусе левого желудочка. Некроз стенки аорты после ушивания
9. Преимущества открытой операции на артериальном конусе левого желудочка. Гипертрофия сердца при врожденных пороках
10. Локализация гипертрофии миокарда при пороках сердца. Особенности гипертрофии при врожденных и приобретенных пороках1. Соединительная ткань сердца при пороках. Коллагенизация сердца при врожденных пороках
2. Миофиброз при врожденных пороках. Компенсаторная гипертрофия миокарда
3. Механизмы фиброза миокарда при пороках. Сосуды сердца при врожденных пороках
4. Сосуды сердца при тетраде Фалло. Коронарные сосуды при сужении артериального конуса
5. Левый тип ветвления венечных артерий. Анастомозы коронарных сосудов при тетраде Фалло
6. Кровоснабжение гипертрофированных отделов сердца. Кровоснабжение сердца при врожденном пороке
7. Анастомозы между ветвями коронарных артерий. Застойное полнокровие при врожденных пороках сердца
8. Замыкающие артерии в сердце. Гистология замыкающих артерий при пороках сердца
9. Суданофилия мышечных волокон сердца. Дегенерация мышц желудочков при пороках сердца
10. Окислительный обмен в сердце. Микромиомаляции при врожденных пороках сердца1. Инфаркт миокарда у детей. Инфракт при врожденном пороке сердца
2. Пример инфаркта миокарда у ребенка. Инфаркт миокарда при тетраде Фалло
3. Пример инфаркта миокарда при триаде Фалло. Операция на сердце при инфаркте миокарда
4. Дополнительные сосуды сердца при пороке. Инфаркт миокарда после операции на врожденном пороке сердца
5. Причины инфаркта миокарда при врожденном пороке сердца. Кардиосклероз при врожденном пороке сердца
6. Диффузный кардиосклероза при пороках Фалло. Диффузный кардиосклероз при гипертрофии миокарда
7. Вес сердца при диффузном кардиосклерозе. Папиллярные мышцы при диффузном кардиосклерозе
8. Кардиосклероз у детей при пороках сердца. Механизмы склероза сердца у детей
9. Прогноз при диффузном кардиосклерозе у детей. Операция на сердце при кардиосклерозе
10. Сроки операции на сердце при врожденном пороке. Когда делать операцию при врожденном пороке сердца?1. Клиника инфаркта миокарда при пороке сердца. Течение инфаркта миокарда при пороке сердца
2. Инфаркты миокарда у детей. Пример инфаркта миокарда при пороке сердца
3. Микроинфаркты при пороке сердца. Боли в сердце при микроинфарктах
4. Частота болей в сердце при врожденных пороках. Ревмокардит при врожденных пороках сердца
5. Ревматизм при открытом артериальном протоке. Диагностика и течение ревматизма при врожденном пороке сердца
6. Легочная гипертензия при врожденном пороке сердца. Механизмы развития легочной гипертензии
7. Морфология легочной гипертензии. Частота легочной гипертензии при ВПС
8. Классификация легочной гипертензии. Клиника легочной гипертензии
9. Лечение пороков сердца с легочной гипертензией. Сердечная недостаточность при пороке сердца
10. Причины сердечной недостаточности при пороке сердца. Диастолическая перегрузка при пороке сердца2. Пример гипотиреоза при пороке сердца. Синдром Шершевского-Тернера при пороке сердца
3. Пример порока сердца при синдроме Шершевского-Тернера. Опухоли наподчечников при врожденном пороке сердца
4. Подагра при пороке сердца. Врожденные пороки сердца с клиникой подагры
5. Болезни органов кроветворения при пороке сердца. Метгемоглобиноз - метгемоглобинемия
6. Анемия при пороке сердца. Гипохромная анемия при цианотических пороках сердца
7. Синюшно-одышечные приступы при тетраде Фалло. Тромбоцитопении при пороке сердца
8. Лейкоз при врожденных пороках сердца. Парадоксальные эмболии и тромбозы сосудов мозга при пороке сердца
9. Кровоизлияния в мозг при коарктации аорты. Абсцессы мозга при врожденных пороках сердца
10. Механизмы развития абсцессов мозга при пороке сердца. Клиника и течение абсцессов мозга2. Комплекс Эйзенменгера. Трехкамерное сердце с двумя желудочками - отсутствие межпредсердной перегородки
3. Общий артериальный ствол. Гемодинамика при общем артериальном стволе
4. Пороки сердца с увеличенным кровотоком через легкие. Незаращение боталлова протока
5. Изолированный дефект межпредсердной перегородки. Гемодинамика при дефекте межпредсердной перегородки
6. Диффузное расширение общего ствола легочной артерии и незаращение овального окна. Болезнь Лютембахера
7. Дефект межжелудочковой перегородки с дефектом межпредсердной перегородки. Изолированный дефект межжелудочковой перегородки
8. Врожденное сужение артериального конуса левого желудочка. Сочетанные пороки сужения артериального конуса
9. Увеличение сердца при сужении артериального конуса. Гемодинамика при сужении артериального конуса
10. Болезнь Эбштейна. Анатомия и формы болезни Эбштейна1. Беременность при дефекте межпредсердной перегородки. Гемодинамика у беременных при ДМПП
2. Объем сброса крови при ДМПП. Прогноз беременности при дефекте межпредсердной перегородки
3. Дефект межжелудочковой перегородки. Морфология и гемодинамика при дефекте межжелудочковой перегородки
4. Стабилизация при дефекте межжелудочковой перегородки. Клиника и диагностика ДМЖП
5. Оценка гемодинамики при дефекте межжелудочковой перегородки. Оценка сброса крови при ДМЖП
6. Беременность при дефекте межжелудочковой перегородки. Течение беременности при ДМЖП
7. Атриовентрикулярный септальный дефект. Морфология и гемодинамика при атриовентрикулярном дефекте
8. УЗИ сердца при атриовентрикулярном дефекте. Стеноз выходного тракта правого желудочка и легочной артерии
9. Допплерография стеноза выходного тракта правого желудочка. Беременность при стенозе легочной артерии
10. Тетрада Фалло. Клиника и диагностика тетрады Фалло2. Цели диагностики при аномалии расположения сердца. Тип формирования сердца
3. Определение локализации желудочков сердца. Обследование при аномалиях сердца
4. Рентгенологическое исследование расположения сердца. Катетеризация сердца при аномалиях сердца
5. Ангиокардиография при аномалиях сердца. Анатомическое расположение сердца
6. Терминология расположения сердца. Термины транспозиции сосудов
7. Правосформированное праворасположенное сердце. Частота правосформированного праворасположенного сердца
8. Анатомия правосформированного праворасположенного сердца. Клиника правосформированного праворасположенного сердца
9. ЭКГ при правосформированном праворасположенном сердце. Электрокардиографические признаки правосформированного праворасположенного сердца
10. Рентгенолография при правосформированном праворасположенном сердце. Рентгенологические признаки правосформированного праворасположенного сердца2. Клиника и признаки транспозиции магистральных сосудов.
3. Лечение транспозиции магистральных сосудов. Операции при транспозици магистральных сосудов.
4. Критический стеноз легочной артерии. Патогенез критического стеноза легочной артерии.
5. Атрезия легочной артерии. Патогенез и кровообращение при атрезии легочной артерии.
6. Естественное течение атрезии легочной артерии. Признаки и клиника атрезии легочной артерии.
7. Атрезия легочной артерии с интактной межжелудочковой перегородкой.
8. Клиника и диагностика атрезии легочной артерии с интактной межжелудочковой перегородкой.
9. Тетрада Фалло. Виды и классификация тетрады фалло.
10. Течение тетрады фалло. Клиника и признаки тетрады фалло.2. Единственный желудочек и атрезия трикуспидального клапана у ребенка.
3. Гемодинамика при единственном желудочке у ребенка.
4. Диагностика единственного желудочка у ребенка. Лечение при единственном желудочке.
5. Аномалия Эбштейна. Анатомия аномалии эбштейна у ребенка.
6. Развитие аномалии эбштейна у ребенка. Диагностика аномалии Эбштейна.
7. Лечение аномалии эбштейна у ребенка. Операция при аномалии Эбштейна.
8. Сосудистое кольцо и слинг легочной артерии у ребенка.
9. Диагностика и лечение сосудистого кольца у ребенка.
10. Сердечная недостаточность у новорожденных. Причины и классификация сердечной недостаточности.Читайте также: