Показания для папиллотомии добавочного протока при расщепленной поджелудочной железе
Добавил пользователь Alex Обновлено: 29.01.2026
В настоящее время тактика лечения острого некротического панкреатита до конца не определена [4, 5, 7]. В частности, остается нерешенным вопрос о выборе метода декомпрессии желчевыводящей системы, хотя билиарная гипертензия при панкреонекрозе развивается довольно часто [1, 3]. Причиной может являться сдавление желчных протоков извне при развитии воспалительных инфильтратов. В других наблюдениях первичными оказываются патологические изменения билиарной системы, и развитие острого панкреатита происходит вследствие нахождения в ампуле большого сосочка двенадцатиперстной кишки (БСДК) конкремента, который перекрывает устье главного панкреатического протока (ГПП), создавая панкреатическую гипертензию. Со временем может произойти самостоятельное отхождение конкремента в двенадцатиперстную кишку с восстановлением свободного оттока желчи, однако воспалительные изменения в области устья ГПП поддерживают прогрессирование запущенных ранее механизмов повреждения поджелудочной железы. Иногда ущемленный конкремент может сместиться из ампулы сосочка назад и флотировать в просвете общего желчного протока.
Необходимость декомпрессии желчных путей является показанием к устранению препятствия оттоку желчи эндоскопическими методами либо к наложению холецистостомы. Однако рекомендации выполнения эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) при остром некротическом панкреатите довольно осторожны в связи с возможным в результате повышения давления в панкреатических протоках отрицательным влиянием на поджелудочную железу [2, 8, 10]. В настоящем исследовании была поставлена задача оценить эффективность и возможные отрицательные последствия ЭРХПГ при остром некротическом панкреатите и билиарной гипертензии. Для этого были проанализированы осложнения ЭРХПГ и проведена сравнительная оценка эффективности ЭРХПГ и холецистостомии у данной категории больных.
Материал и методы
В исследование были включены 40 больных острым некротическим панкреатитом и признаками билиарной гипертензии. Критерием исключения из исследования являлась алкогольная или посттравматическая этиология заболевания. Во всех наблюдениях наличие билиарной гипертензии было достоверно подтверждено после применения методов декомпрессии. Анализировали клинические результаты лечения, данные ультразвуковых исследований, компьютерной томографии, ЭРХПГ, фистулографии (при дренировании желчного пузыря) и лабораторные данные. Тяжесть состояния больных оценивали при поступлении в стационар по шкале тяжести физиологического состояния (ТФС), масштабы поражения брюшной полости - по индексу поражения брюшной полости (ИПБП) [6], выраженность синдрома системной вопалительной реакции (ССВР) - по критериям согласительной конференции 1991 г. [9] и тяжесть полиорганной недостаточности (ПОН) - по шкале Sepsis-related organ failure assessment (SOFA). Все пациенты получали комплексную консервативную терапию согласно принятым стандартам лечения. Основная и контрольная группы различались применением методов разрешения билиарной гипертензии. Пол, возраст и тяжесть состояния больных в группах были сопоставимы.
Основная группа состояла из 22 пациентов с острым некротическим панкреатитом, развившемся на фоне желчнокаменной болезни; в целях купирования желчной гипертензии им была выполнена ЭРХПГ с эндоскопической папиллосфинктеротомией (ЭПСТ) и ревизией желчных протоков, в 19 наблюдениях дополненная литоэкстракцией. В группе было 27% мужчин и 73% женщин в возрасте от 18 до 87 лет. Средний возраст составил 54,1±3,7 года. Тяжесть состояния у всех больных при поступлении в стационар по шкале ТФС не превышала 11 баллов, т.е. не было пациентов в крайне тяжелом состоянии.
Выполняя ЭРХПГ на фоне развившегося некротического панкреатита, придерживались нескольких правил. Срочность манипуляции определяли на основании наличия признаков острой окклюзии ампулы БСДК с учетом клинико-лабораторных и ультразвуковых данных, а также результатов эндоскопического осмотра БСДК. При наличии признаков острой окклюзии ЭРХПГ производили экстренно в ближайшие часы. В случае подозрения на холедохолитиаз без острой окклюзии ЭРХПГ выполняли после улучшения состояния пациента. На диагностическом этапе ЭРХПГ стремились к селективной канюляции устья общего желчного протока, избегая контрастирования ГПП, чтобы не вызвать дополнительного повреждения и инфицирования поджелудочной железы.
Для этих целей применяли нитиноловые струны-проводники, что позволяло облегчить не только селективную канюляцию, но и выполнение ЭПСТ с литоэкстракцией, значительно уменьшить травматизацию сосочка и тем самым снизить риск прогрессирования панкреонекроза. При выявлении ущемленного конкремента в ампуле не использовали канюляционный способ ЭПСТ, так как при этом можно травмировать слизистую в области устья ГПП. Производили рассечение «крыши» ампулы сосочка атипично с помощью игольчатого электрода в области наибольшего выбухания продольной складки. При необходимости такой разрез продлевали обычным способом. После удаления ущемленного конкремента выполняли контрастирование желчных протоков и при выявлении конкрементов - литоэкстракцию с помощью корзинки Дормиа.
В основной группе в 41% наблюдений ЭРХПГ была выполнена в 1-2-е сутки после госпитализации, в остальных наблюдениях - в более поздние сроки. Исходно при определении показаний к манипуляции конкременты общего желчного протока были четко выявлены только в 23% наблюдений. Еще у 63% больных была обнаружена дилатация желчных протоков без визуализации конкрементов, но в 14% наблюдений расширение протоков отсутствовало, и наличие препятствия в протоках заподозрено в связи с существенным повышением уровня билирубина крови за счет прямой фракции на фоне желчнокаменной болезни. После уточнения диагноза в ходе проведения ЭРХПГ выяснилось, что причиной развития билиарной гипертензии у 14% пациентов основной группы явились деформация и стеноз БСДК и у 86% - холедохолитиаз, причем синдром острой окклюзии терминального отдела общего желчного протока имел место только у 23% больных, а у 63% больных отмечались флотирующие конкременты общего желчного протока.
Контрольная группа состояла из 18 пациентов, которым в целях купирования билиарной гипертензии исходно было выполнено дренирование желчного пузыря. В группе было 39% мужчин и 61% женщин в возрасте от 24 до 79 лет. Средний возраст составил 52,8±3,6 года. Желчнокаменная болезнь имелась у 66% пациентов. Тяжесть состояния у всех больных при поступлении в стационар не превышала 11 баллов. При определении показаний к холецистостомии дилатация желчных протоков была выявлена в 80% наблюдений, причем конкременты общего желчного протока исходно не были выявлены ни в одном наблюдении, хотя при последующей фистулографии они диагностированы у 13% больных.
В 20% наблюдений ультразвуковые признаки расширения протоков отсутствовали, показанием к холецистостомии явилось повышение уровня билирубина крови за счет прямой фракции и значительное увеличение желчного пузыря. В последующем 2 больным в связи с получением при фистулографии данных о холедохолитиазе была выполнена ЭРХПГ с литоэкстракцией. У 10 пациентов, имевших конкременты желчного пузыря, холедохолитиаз при фистулографии выявлен не был. Возможно, имело место самостоятельное отхождение конкремента либо причиной билиарной гипертензии являлось сдавление общего желчного протока воспалительным инфильтратом. У пациентов, у которых исходно отсутствовало расширение желчных протоков и в последующем при фистулографии не было обнаружено внутрипротоковых изменений, наличие билиарной гипертензии подтверждалось большим количеством желчи, оттекающей по холецистостоме (600-900 мл в сутки).
Результаты и обсуждение
В 3 (13%) наблюдениях в период после выполнения эндобилиарного вмешательства имела место некоторая отрицательная динамика ультразвуковой картины, однако только в одном из них она сопровождалась клиническими и лабораторными признаками прогрессирования панкреонекроза. В 2 других наблюдениях уровень амилазы крови после выполнения ЭРХПГ, напротив, снизился, а лейкоцитоза, других признаков ССВР и отрицательной клинической динамики не было. Однозначно расценить такую динамику как отрицательные последствия ЭРХПГ возможно только в первом из описанных наблюдений.
Еще в 6 (25%) наблюдениях после выполнения ЭРХПГ имело место кратковременное повышение уровня амилазы, не сопровождавшееся прогрессированием острого некротического панкреатита. В 5 из этих 6 наблюдений повышение уровня амилазы было совсем небольшим - не более чем на 100 ед., в 1 произошло значительное повышение уровня амилазы - до 1779 ед. и содержания лейкоцитов крови до 13,5·109/л, однако уже через 2 сут эти показатели нормализовались, а при контрольном УЗИ отмечалась положительная динамика течения заболевания. У 71±9% больных после выполнения ЭРХПГ с ЭПСТ уровень амилазы крови достоверно снижался. Уровень амилазы мочи после выполнения ЭРХПГ, как правило, слегка повышался и составлял в среднем 750±170 ед., при том что в момент поступления этих больных в стационар он был в 13 раз выше и составлял 10 083±384 ед.
Таким образом, выполнение эндобилиарных ретроградных вмешательств больным острым некротическим панкреатитом действительно сопровождается риском дополнительного повреждения поджелудочной железы. Однако в большинстве наблюдений последствия ограничивались развитием транзиторной амилаземии, в то время как прогрессирование панкреонекроза, подтвержденное клиническими, лабораторными и инструментальными данными, отмечалось всего у 4±4% больных. При этом тяжелого течения острого некротического панкреатита с развитием ПОН после выполнения ЭРХПГ не наблюдалось.
В табл. 1 и 2 и на рис. 1-4 Рисунок 1. Динамика средних значений общего и прямого билирубина крови. Рисунок 2. Динамика средних значений амилазы крови и АСТ. Рисунок 3. Динамика средних значений лейкоцитов крови. Рисунок 4. Динамика средних значений гемоглобина и общего белка крови. представлена динамика средних значений различных показателей у больных. Общий билирубин крови, исходный уровень которого был значительно повышен, достоверно снизился на 18,9±6,2 мкмоль/л уже в 1-е сутки после ЭРХПГ и полностью нормализовался в течение 3-5 сут. Прямой билирубин в 1-е сутки достоверно снизился на 20,3±6,6 мкмоль/л и в течение 3-5 сут достиг уровня 6,6 мкмоль/л. Диаметр общего желчного протока, по данным УЗИ, через сутки после ЭРХПГ уменьшился на 3,2±0,5 мм, вернувшись к норме, длина желчного пузыря - на 21,3±4,1 мм. Имело место также быстрое и достоверное снижение уровня аминотрансфераз.
В среднем у больных произошли значительное снижение уровня амилазы крови в 1-е сутки после выполнения ЭРХПГ и полная нормализация этого показателя в течение 3-5 сут. Размеры головки поджелудочной железы достоверно уменьшились также уже в 1-е сутки. Сразу несколько снизились количество признаков ССВР и балльная оценка органных нарушений у больных. Достоверное снижение содержания лейкоцитов произошло не сразу, но к 3-5-м суткам их уровень практически нормализовался. Следует также отметить, что после выполнения ЭРХПГ отсутствовало значимое снижение уровней гемоглобина и общего белка крови. Все это свидетельствует о положительной динамике течения острого деструктивного панкреатита после устранения внутрипротоковых изменений, которые являлись и причиной нарушения оттока желчи, и причиной развития панкреонекроза.

После выполнения ЭРХПГ произошло полное купирование признаков билиарной гипертензии и в большинстве наблюдений отмечены достоверная положительная динамика течения острого некротического панкреатита, а также уменьшение поражения печени. Окончательно клинические результаты лечения были оценены при сравнении основной и контрольной групп. Результаты сравнения приведены в табл. 3 и на рис. 1-4. Исходно группы были сопоставимы по показателям, которые могут влиять на течение заболевания. При этом сравнительная оценка показала, что в основной группе были достоверно меньше масштабы поражения, летальность, частота гнойных осложнений и сроки госпитализации больных.
Разница в летальности составила 22±9%, частоте гнойных осложнений - 28±11%, сроках пребывания выздоровевших больных в стационаре - 22±6,4 сут. Масштабы поражения при дренировании желчного пузыря были выше на 4,4±0,9 балла. Динамика лабораторных показателей также свидетельствует о более высокой эффективности ЭРХПГ как в купировании желчной гипертензии, так и в непосредственном лечении панкреонекроза. После холецистостомии наблюдались более медленные темпы купирования желтухи, снижения уровня аминотрансфераз и амилазы крови. Кроме того, отсутствовала нормализация содержания лейкоцитов крови и наблюдалось снижение уровня гемоглобина (к 3-5-м суткам почти на 30 г/л по сравнению со значением до холецистостомии; p<0,002) и общего белка крови (к 3-5-м суткам почти на 9 г/л по сравнению со значением до холецистостомии; p<0,05). Следовательно, прогрессирование панкреонекроза при дренировании желчного пузыря обычно удавалось прервать в более поздние сроки, чем при выполнении ЭРХПГ с ЭПСТ и литоэкстракцией.
Полученные данные позволяют утверждать, что при остром некротическом панкреатите с билиарной гипертензией в целях ее устранения эффективно первичное выполнение ЭРХПГ с эндобилиарным вмешательством. Перенесение его на второй этап лечения - после купирования желтухи с помощью дренирования желчного пузыря - не приводит к улучшению результатов лечения. В то время как при первичном выполнении ЭРХПГ гнойных осложнений не было вовсе, а сроки госпитализации больных не превышали 30 сут, из двух наблюдений, в которых ЭРХПГ выполняли после наложения холецистостомы, в одном развился абсцесс сальниковой сумки, потребовавший повторных открытых операций, ИПБП составил 15 баллов, срок госпитализации - 50 сут.
Таким образом, проведенный анализ свидетельствует о высокой эффективности и низком риске развития тяжелых осложнений ЭРХПГ с ЭПСТ и литоэкстракцией при лечении больных острым некротическим панкреатитом с патологическими изменениями билиарной системы при соблюдении определенных мер предосторожности. Необходимо избегать контрастирования главного панкреатического протока, а при ущемлении конкремента в ампуле не использовать канюляционный способ ЭПСТ. Патологические изменения желчных протоков являются у этих пациентов причиной как билиарной гипертензии, так и острого панкреатита. В связи с этим ЭРХПГ не только эффективно устраняет желчную гипертензию, но и в большинстве наблюдений обеспечивает положительную динамику течения острого некротического панкреатита. В то же время дренирование желчного пузыря купирует механическую желтуху, но не устраняет имеющиеся у таких пациентов изменения желчных протоков. Вопрос об их устранении переносится на более поздние сроки, при этом в ряде наблюдений сохраняются причины прогрессирования панкреонекроза.
Мы считаем, что в тех ситуациях, в которых имеются данные о патологических изменениях желчных протоков как причине билиарной гипертензии у больного острым некротическим панкреатитом, предпочтительно выполнение не холецистостомии, а ЭРХПГ с ЭПСТ и (при необходимости) с литоэкстракцией. Вопрос о возможности выполнения ЭРХПГ пациентам с панкреонекрозом, поступающим в крайне тяжелом состоянии, с выраженными гемодинамическими и дыхательными нарушениями, в настоящем исследовании не рассматривался.
Показания для папиллотомии добавочного протока при расщепленной поджелудочной железе
Доступ и ход операции панкреатэктомии с сохранением двенадцатиперстной кишки по Beger'у
Используют либо двусторонний подрёберный доступ, либо верхнюю срединную лапаротомию. Сначала исследуют органы живота для исключения иной патологии. После этого сальник отделяют от поперечной ободочной кишки и осматривают шейку, тело и хвост поджелудочной железы. Мы предпочитаем выполнять расширенную мобилизацию двенадцатиперстной кишки по Кохеру, несмотря на то, что автор операции этого не производил.
Данное вмешательство идеально для больных с большими воспалительными инфильтратами в головке поджелудочной железы. Первый шаг при выполнении этой процедуры — исключение вероятности аденокарциномы головки поджелудочной железы. Для этого хирург должен выполнить пункционную биопсию подозрительного участка. После подтверждения диагноза хронического панкреатита выделяют верхнюю брыжеечную вену вдоль по нижнему краю шейки поджелудочной железы. Эту вену отделяют от тыльной поверхности шейки железы.
Сверху, вдоль верхнего края шейки железы находят воротную вену. Её также отделяют от тыльной поверхности железы, продолжая диссекцию до ранее выделенной верхней брыжеечной вены. Шейку поджелудочной железы обводят дренажем Пенроуза, после чего пересекают её диатермокоагулятором.
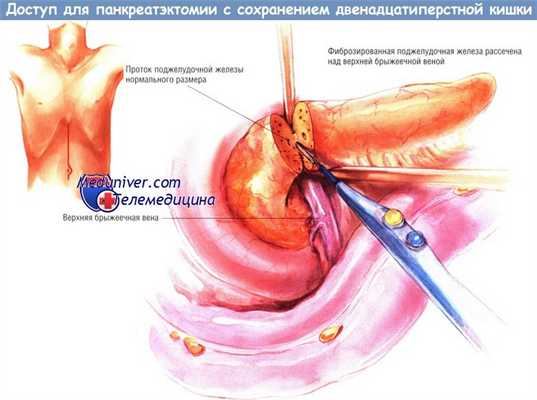
Воротную вену и верхние брыжеечные вены полностью отсекают от крючковидного отростка. Последний затем отделяют от верхней брыжеечной артерии. После того, как крючковидный отросток будет мобилизован на большом протяжении, проводят его резекцию вместе с головкой поджелудочной железы. При отсечении головки железы от подковы двенадцатиперстной кишки на поверхности последней оставляют «ободок» из панкреатической ткани шириной не более 4-5 мм. Для большей безопасности этой резекции рекомендуют расширенную мобилизацию двенадцатиперстной кишки с головкой поджелудочной железы, позволяющую хирургу поместить его левую руку кзади от крючковидного отростка.
Необходима большая осторожность, чтобы не повредить дистальный отдел общего желчного протока в процессе резекции железы.
Если ранее не выполнена холецистэктомия, мы выполняем её и проводим желчный катетер Фогарти в дистальном направлении через ампулу фатерова соска в двенадцатиперстную кишку, чтобы во время резекции головки поджелудочной железы чувствовать точное расположение желчного протока. Если холецистэктомия была выполнена ранее, нужно сделать холедохотомию и провести дилататор Бейкса в двенадцатиперстную кишку. Выполнять резекцию головки железы так, чтобы весь крючковидный отросток, шейка и большая часть головки были удалены, сложно. Преимущество этой операции перед процедурами Пуэстоу и Фрея в том, что её можно выполнить при узком панкреатическом протоке.
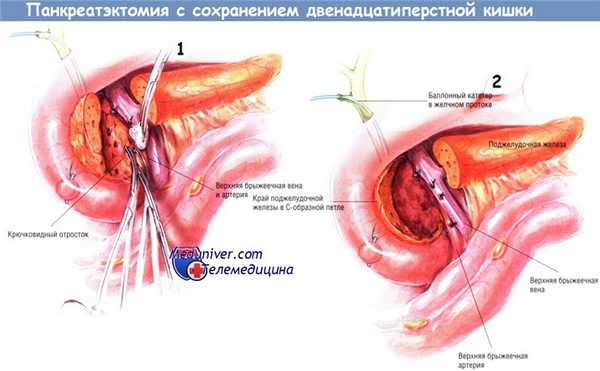
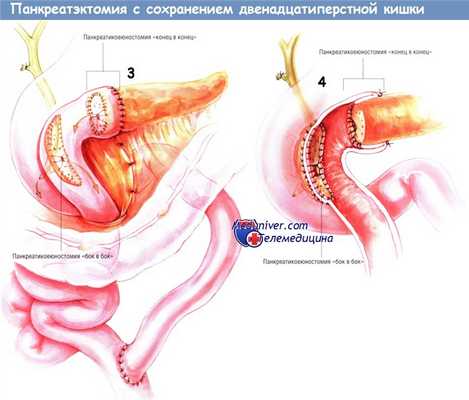
Реконструкцию производят при помощи Y-образного анастомоза по Ру с браншей из тощей кишки длиной 60 см. Создание такой бранши было описано ранее. Браншу проводят наверх через отверстие в брыжейке поперечной ободочной кишки и выполняют панкреатикоеюностомию «конец в конец» методом инвагинации, как это будет описано ниже. Сначала накладывают задний наружный ряд одиночных ламберовских швов шёлком № 3/0. После этого проводят внутренний непрерывный обвивной герметизирующий шов синтетической рассасывающейся нитью № 3/0, захватывающий стенку панкреатического протока.
Этот герметизирующий шов продолжают по передней поверхности анастомоза. Завершают соустье, инвагинируя поджелудочную железу в конец тонкой кишки рядом одиночных швов шёлком № 3/0.
По завершении этой панкреатоеюностомии выполняют панкреатикоеюноанастомоз «бок в бок» между «ободком» ткани поджелудочной железы, оставленным на подкове двенадцатиперстной кишки, и участком тощей кишки, лежащим чуть ниже панкреатикоеюностомы «конец в конец». Желательно, чтобы это соустье было сделано такими же двухрядными швами, как и панкреатикоеюноанастомоз «конец в конец».
Однако иногда (в зависимости от экспозиции) используют один ряд одиночных швов шёлком № 3/0. Если накладывают двухрядный анастомоз, панкреатический проток захватывают во внутренний ряд швов. Если же анастомоз получается однорядным, то одиночные узловые швы также должны захватывать стенку протока. Захватывая толщину головки поджелудочной железы, хирург должен стараться избегать ранения верхней и нижней панкреатодуоденальных аркад, лежащих в панкреатикодуо-денальной борозде сзади и спереди. Этого добиться нетрудно. Однако даже при конфликте с аркадами ишемия двенадцатиперстной кишки возникает редко.
Операция обеспечивает дренирование тела и хвоста поджелудочной железы в кишечную браншу, сформированную по способу Ру, а также иссечение большей части воспалённых тканей в головке поджелудочной железы. Небольшой остаток ткани железы в области подковы двенадцатиперстной кишки также дренируется в браншу тощей кишки. Многие авторы считают, что именно большой воспалительный инфильтрат в головке поджелудочной железы поддерживает хронический панкреатит, а потому операция и направлена на удаление этой воспалительной опухоли.
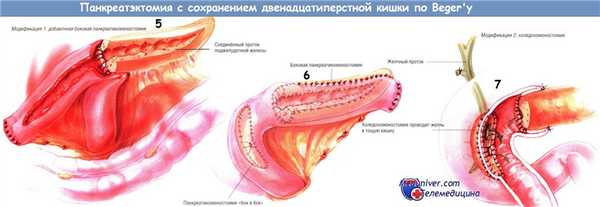
Если панкреатический проток расширен, но хирург считает, что больного не следует оперировать по методам Пуэстоу и Фрея, он может выполнить операцию Beger и дополнительно к резекции головки поджелудочной железы провести латеральную панкреатикоеюностомию. В идеале такой анастомоз должен быть двухрядным, причём внутренний шов должен быть непрерывным, рассасывающейся синтетической нитью № 3/0, а наружный — одиночным узловым, шёлком № 3/0. Остальную часть операции проводят по вышеописанной методике.
Некоторые больные хроническим панкреатитом имеют стеноз дистального отдела общего желчного протока различной выраженности, расположенный в участке, где желчный проток проходит в задней части головки поджелудочной железы. Он приводит к расширению желчного дерева, которое можно «разгрузить» через «ободок» панкреатической ткани, оставленный на подкове двенадцатиперстной кишки. Такой холедохоеюнальный анастомоз можно сформировать одновременно со вторым панкреатическим соустьем (панкреатикоеюностомией «бок в бок»).
Кроме того, эту модификацию можно применить, если неизбежно ранение желчного протока при резекции головки поджелудочной железы и сохранении двенадцатиперстной кишки. Однако мы предпочитаем при плотных стриктурах дистальной части общего желчного протока дополнять гепатикоеюностомией любую операцию по поводу хронического панкреатита.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Расщепленная поджелудочная железа
Расщепленная поджелудочная железа – порок развития, при котором на начальных этапах эмбриогенеза нарушается слияние протоковой системы органа, в результате чего основную функцию по дренированию железы берет на себя добавочный панкреатический проток. Заболевание часто не имеет клинических проявлений. При гипертензии добавочного потока может развиваться панкреатит, сопровождающийся интенсивной болью в верхних отделах живота, тошнотой, рвотой, диареей. Для установления точного диагноза проводят ЭРХПГ и МРХПГ. Бессимптомное течение болезни не требует лечения. При узком выводном отверстии панкреатического протока проводят его эндоскопическое или открытое расширение. Развитие панкреатита требует назначение диеты, спазмолитиков, ферментативных средств.
Общие сведения
Расщепленная (раздвоенная) поджелудочная железа относится к аномалиям протоковой системы, при которой доминирует добавочный (дорсальный) проток. Основной сброс секрета происходит через малый дуоденальный сосочек, а через большой сосок выводится оставшаяся часть секрета и желчь. В этом случае нарушается нормальное дренирование железы, возникает внутрипротоковая гипертензия, которая может привести к воспалению органа. Впервые заболевание подробно описано в середине ХIХ века в трудах австрийского анатома Й. Хиртля. Болезнь диагностируется у 4-11 % жителей планеты, чаще у людей европеоидной расы. Патология в равной степени встречается у лиц обоих полов. В большинстве случаев аномалия не влияет на экзокринную и эндокринную функции поджелудочной железы и не ухудшает качество жизни пациентов.
Причины
Причины болезни до конца не изучены. Данная аномалия развития поджелудочной железы формируется в период закладки органа, примерно на 30-й день эмбрионального развития. На этом этапе происходит нарушение дифференцировки панкреас на хвост, тело и головку. Существует предположение о наследственной природе болезни, однако достоверных исследований по данному вопросу нет. В процессе эмбриогенеза расщепленная поджелудочная железа может возникать под влиянием следующих факторов:
- Неблагоприятные экзогенные воздействия. Тератогенным эффектом обладают различные неблагоприятные факторы внешней среды, с которыми сталкивается женщина на протяжении беременности (радиоактивное облучение, химическое загрязнение воздуха и др.). Различные патологии внутриутробного развития может вызывать курение, употребление алкоголя и наркотических веществ, постоянное нервно-психическое напряжение будущей матери.
- Инфекционные заболевания. Перенесенные беременной инфекции (краснуха, герпес, сифилис, токсоплазмоз, листериоз и др.) оказывают влияние на дифференцировку и закладку органов плода.
- Прием некоторых медикаментов. Использование женщиной лекарственных средств, противопоказанных к приему в период беременности, могут вызывать аномалии развития органов ЖКТ плода.
Патогенез
Поджелудочная железа начинает формироваться с 4-5 недели гестации из дорсального и вентрального выпячиваний дуоденальной закладки. Основные этапы дифференцировки морфологических структур органа (головки, тела, хвоста, протоковой системы) приходятся на 6-12 недели внутриутробного развития. Окончательное формирование железы заканчивается к концу беременности. В антенатальном периоде панкреатический сок преимущественно выводится по дорсальному (добавочному) протоку в малый дуоденальный сосочек, тогда как вентральный (основной) выводной канал отводит небольшую часть секрета совместно с желчью в большой дуоденальный сосок.
После рождения процесс оттока сока поджелудочной железы меняется прямо противоположно. Протоковая система взрослого человека состоит из главного (Вирсунгова) выводного канала, который собирает около 70% панкреатического секрета из дольковых протоков, проходит в толще органа от хвоста до головки, где в него впадает добавочный (Санториниев) проток. Затем основной проток сливается с общим желчным, образуя печеночно-поджелудочную ампулу, и открывается в тонкий кишечник через большой (Фатеров) дуоденальный сосок. При аномалии сращения зародышевых листков, когда объединение протоков не происходит, доминирующим каналом остается добавочный, и сброс секрета продолжается через малый дуоденальный сосочек.
Классификация
Исходя из анатомической локализации и характера расщепления, в гастроэнтерологии выделяют несколько вариантов аномалии поджелудочной железы. Существует 4 вида расщепления органа:
- Полное. Является наиболее распространённой формой болезни и встречается в 70% случаев. Основная часть секрета дренируется в малый сосочек, а оставшийся панкреатический сок вместе с желчью выходит в 12-перстную кишку через Фатеров сосок. Крайней степенью аномалии является атрофия вентрального протока, при которой в малое дуоденальное отверстие выводится весь сок поджелудочной железы, а в большое - желчь. Данная форма встречается в 20-25 % случаев и наиболее часто вызывает панкреатит ввиду длительной внутрипротоковой гипертензии.
- Неполное. Расщепленный орган разделен на две части, протоки которых на определенном участке сообщаются друг с другом, но открываются в кишку посредствам двух изолированных отверстий. Распространённость данной аномалии - 5-6 %.
- Изолированное. Происходит формирование отдельно расположенного дорсального сегмента, который выводит желчь от передней части панкреас через малый дуоденальный сосочек. Основная часть желчи дренируется по Вирсунгову протоку в большое дуоденальное отверстие.
Симптомы расщепленной поджелудочной железы
У большинства пациентов заболевание протекает бессимптомно. Несоответствие диаметра малого сосочка и количества поступающего в него панкреатического сока приводит к нарушению оттока секрета и развитию обструктивного панкреатита. Спровоцировать острое воспаление органа может прием алкоголя, чрезмерное употребление жирной, острой, копченой пищи. Возникает опоясывающая боль в верхнем отделе живота, которая иррадиирует в позвоночник и усиливается через полчаса после приема пищи. Болезненные ощущения носят острый, режущий характер и не купируются спазмолитиками. Появляются диспепсические явления: сухость во рту, отрыжка, тошнота и рвота, диарея. Воспаление может сопровождаться повышением температуры тела, отсутствием аппетита, бледностью и синюшностью кожных покровов. Возможен переход острой формы болезни в хроническую.
Осложнения
Осложнения расщепленной поджелудочной железы встречаются редко. При длительном течении хронического обструктивного панкреатита с частыми приступами обострения может возникать обтурационная желтуха вследствие холестаза, реактивный реактивный гепатит, воспалительные заболевания желчных протоков и желчного пузыря (холангиты, холециститы). Затруднение оттока панкреатического сока способствует образованию панкреатических панкреатических кист и псеводокист. При неблагоприятном течении болезни может возникать панкреосклероз или панкреонекроз. Поражение островков Лангерганса ведет к развитию сахарного диабета.
Диагностика
Ввиду частого отсутствия признаков болезни выявление врожденной аномалии затруднено. Чаще всего обнаружение расщепленной поджелудочной железы является случайной находкой при плановом обследовании или при диагностике других заболеваний. Консультация гастроэнтеролога с проведением физикального осмотра и изучением анамнеза жизни информативна только при возникновении симптомов панкреатита. Для подтверждения диагноза необходимо провести следующие инструментальные исследования:
- Эндоскопическая ретроградная холангиопанкреатография(ЭРХПГ). Данный метод помогает визуализировать протоковую систему расщепленной железы (размер, количество, строение выводных каналов). Чаще всего при введении контраста в большой сосочек определяется короткий канал, а в малый – контрастируется вся сеть протоков железы.
- Магнитно-резонансная холангиопанкреатография (МРХПГ). Наиболее современный и малоинвазивный метод, который основывается на введении контрастного вещества в панкреатические протоки и холедох при проведении МР-исследования. Позволяет определить не только количество и размеры каналов, но оценить их работу.
При развитии панкреатита выполняют УЗИ поджелудочной железы, лабораторные исследования (ОАК, биохимический анализ крови, анализ кала). Проведение дифференциальной диагностики целесообразно при появлении симптомов воспаления органа. В этом случае патологию дифференцируют с острым острым панкреатитом другой этиологии, острым острым холециститом, пищевой токсикоинфекцией, перфорацией язвы желудка или двенадцатиперстной кишки и другими заболеваниями, имеющими схожую симптоматику.
Лечение расщепленной поджелудочной железы
При отсутствии клинических проявлений данная аномалия не нуждается в лечении. Нарушение оттока панкреатического секрета ввиду узости одного из сосочков требует хирургического вмешательства. В настоящее время хирурги отдают предпочтение эндоскопическому расширению устья выводящего канала. Для улучшения оттока секрета внутрь дорсального протока устанавливают пластиковый стент. При отсутствии эффекта от эндоскопической сфинктеротомии выполняют открытую операцию, в ходе которой рассекают ткани, расположенные вокруг малого сосочка.
Развитие острого панкреатита требует назначения спазмолитических, обезболивающих, ферментативных препаратов. Особую роль играет диетическое питание, которое предполагает отказ от жирной, жареной, острой пищи. Предпочтение следует отдавать вареным и запечённым постным блюдам. Лицам с данной аномалией панкреас следует отказаться от употребления алкогольных напитков.
Прогноз и профилактика
Прогноз при заболевании, как правило, благоприятный. В редких случаях развитие осложнений (панкреонекроз, холестаз) может повлечь за собой серьезные жизнеугрожающие последствия. Профилактика заключается в ведении здорового образа жизни, отказе от вредных привычек и соблюдении основ правильно питания. Важную роль играет предотвращение возникновения воспалительных изменений органа. Пациентам с расщеплением железы следует 1-2 раза в год проходить УЗИ брюшной полости.
Аберрантная поджелудочная железа ( Добавочная поджелудочная железа , Хористома , Эктопия поджелудочной железы )
Аберрантная поджелудочная железа — это гетеротопия панкреатической железистой ткани в стенке желудка, кишечника или других органах брюшной полости. Аномалия характеризуется скудными клиническими проявлениями с преобладанием диспепсических расстройств. Осложненные формы патологии манифестируют симптомокомплексом «острого живота», желудочно-кишечными геморрагиями. Диагностика основана на инструментальных методах: УЗИ, рентгенографии с пероральным контрастированием, ЭФГДС. Диагноз подтверждают патоморфологическим исследованием биоматериала. Бессимптомные аномалии лечения не требуют, при осложнениях в основном прибегают к хирургическим вмешательствам.
МКБ-10
В медицинской литературе аномалия имеет ряд синонимов: добавочная поджелудочная железа, хористома, эктопия ПЖ. Заболевание является самым частым пороком развития поджелудочной железы и выявляется у 0,2% пациентов в ходе оперативных вмешательств на органах брюшной полости. По данным аутопсий, гетеротопия встречается у 1,3% людей в популяции. Аномалия в 2 раза чаще наблюдается у мужчин. Преимущественно она обнаруживается случайно в возрасте 40-70 лет при инструментальном обследовании пищеварительной системы.
В современной гастроэнтерологии не существует единого мнения по поводу этиологических факторов. Большинство ученых утверждают, что патология возникает во внутриутробном периоде при сочетанном влиянии нескольких причин. К наиболее вероятным из них относят спонтанные генетические мутации, инфекции, перенесенные матерью во время беременности. Реже определяется связь аберрантной поджелудочной железы с приемом лекарств, обладающих тератогенным эффектом.
К факторам риска развития хористомы относят курение, употребление алкоголя и наркотических веществ беременной женщиной. Вероятность появления болезни увеличивается при проживании в экологически неблагоприятных регионах, воздействии ионизирующего излучения на ребенка в эмбриональном периоде внутриутробного развития. Риск формирования аберрантной ткани повышается при генетической предрасположенности — наличии различных аномалий у ближайших родственников.
Точный механизм образования аномалии до сих пор остается неясным. Наиболее вероятно, что аберрантная ткань — проявление атавизма в онтогенезе. Нарушение закладки и дифференцировки поджелудочной железы при антенатальном развитии приводит к аномальному расположению части органа. Сформированная добавочная железа имеет изолированное кровоснабжение и иннервацию, функционирует независимо от основной массы железистых клеток.
Хористомы различаются по анатомической локализации. Аберрантная ткань железы может располагаться в различных органах:
- двенадцатиперстной кишке (31,83%);
- стенке желудка (31,46%);
- тощей кишке (21,7%);
- подвздошной кишке (9,36%);
- брыжейке (3,37%);
- желчных ходах (1,49%).
Среди желудочных аберрантных ПЖ большинство (58,2%) располагается в привратнике. По макроскопическим признакам выделяют 4 формы: узловатую, полипозную, диффузную и смешанную.
Симптомы
Подавляющее большинство гетеротопий протекает бессимптомно и выявляется случайно при гастроэнтерологической диагностике, проведении операций в полости живота. Симптоматика обычно возникает при осложненном течении заболевания и определяется локализацией аберрантной поджелудочной железы. Начальными признаками являются неспецифические диспепсические расстройства: тяжесть в животе после приема пищи, тошнота, неустойчивость стула.
Клиническое проявление крупной аберрантной железы возможно уже в раннем детском возрасте. Беспокоит срыгивание после еды, периодически бывает обильная рвота створоженным молоком или частично переваренной пищей. Дети плохо едят, медленно набирают вес, отстают в физическом развитии. Во взрослом возрасте аномалия, как правило, протекает под маской хронического гастрита, панкреатита, холецистита.
Типичный симптом осложненных форм патологии — сильные боли в животе различной локализации. Часто встречается рвота с примесями слизи и желчи. При поражении желчевыводящих протоков выделяется обесцвеченный кал. Редко аберрантная поджелудочная железа манифестирует желудочно-кишечным кровотечением, которое проявляется кровавой рвотой или меленой.
Зачастую при хористоме наблюдается стеноз пилорического отдела желудка, что затрудняет продвижение пищи в тонкий кишечник. В компенсированной стадии питание и энергетический обмен практически не нарушены. На этапе декомпенсации характерны истощение больных, анемия и признаки авитаминозов. При расположении аберрантной ткани в тонком кишечнике существует вероятность развития острой кишечной непроходимости, требующей неотложной хирургической помощи.
Добавочные поджелудочные железы часто подвергаются воспалению и некрозу. Начинается асептическое либо гнойное поражение аберрантной ткани, которое чревато прободением стенки пораженного органа. При расплавлении сосудистых стенок может открыться профузное кровотечение. Наличие гетеротопии повышает риск возникновения язвенной болезни, механической желтухи. Наиболее опасное последствие вовремя не диагностированной хористомы — малигнизация.
Выявление аберрантной железистой ткани стандартными методами исследования затруднительно, поскольку внешне аномальные образования напоминают доброкачественную опухоль. Для верификации диагноза врач-гастроэнтеролог назначает инвазивные методики с последующим гистологическим подтверждением. При подозрении на гетеротопию поджелудочной железы диагностический поиск включает следующие исследования:
- УЗИ брюшной полости. При сонографии возможно обнаружение аберрантной ткани только большого объема, которая визуализируется в виде гиперэхогенных участков в нетипичных местах. Результаты УЗИ не позволяют установить природу объемного образования. Чтобы оценить кровоток в добавочной поджелудочной железе, рекомендована допплерография.
- Рентгенологические методы. При рентгенографии пассажа бария по ЖКТ гетеротопия выглядит как округлый дефект наполнения. При осложненной форме заболевания на фоне дефекта выявляют нишу или пятно бария. Аберрантную поджелудочную железу можно увидеть при компьютерной томографии ОБП.
- ЭФГДС. При эндоскопическом осмотре хорошо заметны хористомы, локализованные в желудке или начальных отделах 12-перстной кишки. Они имеют вид полипов или отдельных узлов, на поверхности которых зачастую есть устье выводного протока.
- Изучение биоптатов. Морфологический анализ образца тканей является решающим при диагностике хористом. По гистологическому строению добавочная железистая ткань может полностью соответствовать нормальной либо содержать отдельные элементы — островки Лангерганса, ацинусы или выводные протоки.
- Лабораторные методы. Анализы имеют вспомогательный характер. Для оценки внешнесекреторной функции поджелудочной железы определяют уровень амилазы, липазы и трипсина в крови. В образцах кала исследуют количество фекальной эластазы. В крови измеряют содержание глюкозы натощак, проводят глюкозотолерантный тест.
Лечение аберрантной поджелудочной железы
Консервативная терапия
В гастроэнтерологии есть успешный опыт применения аналогов гормона соматостатина. Эти препараты тормозят пролиферацию железистых клеток, препятствуют трансформации доброкачественной гетеротопии в опухолевый процесс. При недостаточной экзокринной функции поджелудочной ткани назначают заместительную ферментную терапию. Для устранения неприятных симптомов используют анальгетики, желчегонные препараты, прокинетики.
Хирургическое лечение
В абдоминальной хирургии целесообразность оперативного вмешательства при аберрантной поджелудочной железе остается предметом научных дискуссий. При бессимптомном течении и нормальном функционировании органа с железистой геторотопией больным требуется наблюдение. Возможность проведения операции решается индивидуально для пациентов со сниженной функциональной активностью основной ПЖ.
Абсолютными показаниями к выполнению радикального лечения считают осложненные варианты аберрантной аномалии. Рекомендована максимально экономная резекция в пределах здоровых тканей. При формировании стеноза привратника или кишечника обеспечивается хирургическая коррекция, при необходимости накладывается анастомоз. Обязательному удалению подлежат хористомы с высоким риском малигнизации.
Бессимптомные формы аберрантной ПЖ не представляют риска для здоровья и жизни человека, в таком случае прогноз считается благоприятным. Прогностически неблагоприятно расценивается появление осложнений со стороны желудка, кишечника, билиарной системы, быстрое увеличение размеров добавочной железы. Учитывая неясный этиопатогенез, специфические меры первичной профилактики не разработаны.
1. Аберрантная поджелудочная железа/ Ю.А. Кучерявый, И.В. Маев// Клинические перспективы в гастроэнтерологии, гепатологии. — 2005.
2. Аберрантная поджелудочная железа с локализацией в антральном отделе желудка/ С.А. Домрачев, М.А. Чиников// Вестник РУДН. — 2003.
3. Аберрантная поджелудочная железа у детей с патологией органов пищеварения/ И.Л. Бабий, Е.М. Платонова, И.Н. Федчук, Л.Л. Белова// Здоровье ребенка. — 2011.
4. Гетеротопия поджелудочной железы/ Е.Н. Самцов, М.В. Вусик, М.Б. Каракешишева// Сибирский онкологический журнал. — 2009.
Рак головки поджелудочной железы
Рак головки поджелудочной железы – полиморфная группа злокачественных новообразований, локализующихся преимущественно в области ацинусов и протоков головки поджелудочной железы (ПЖ). К основным клиническим проявлениям заболевания относят анорексию, сильное исхудание, интенсивные боли в животе, диспепсию, желтуху. Диагноз устанавливается на основании УЗИ, КТ и МРТ органов брюшной полости, ЭРХПГ, лапароскопии с биопсией, лабораторных методов диагностики. Лечение рака головки поджелудочной железы у 20% пациентов хирургическое с последующей химиотерапией и лучевой терапией; в остальных случаях лечение паллиативное.
Рак головки поджелудочной железы является самой агрессивной и прогностически неблагоприятной опухолью. Несмотря на то, что в последние годы изучению опухолей этой локализации посвящено множество исследований в области онкологии, гастроэнтерологии и хирургии, в 95% случаев рак ПЖ диагностируется на той стадии, когда выполнение радикального оперативного вмешательства невозможно.
Быстрое прогрессирование и метастазирование опухоли приводят к тому, что 99% пациентов погибают в течение пяти лет после постановки диагноза, а большая продолжительность жизни отмечается только у тех пациентов, кому диагноз был установлен на ранних стадиях заболевания. Рак головки ПЖ несколько чаще встречается у мужчин (соотношение мужского пола к женскому 8:6), средний возраст диагностики этого заболевания – 65 лет.
К раку головки поджелудочной железы приводят разнообразные факторы: алиментарные, токсико-химические, метаболические и др.:
- Нерациональное питание. Потребление большого количества жирной животной пищи стимулирует выработку панкреозимина, что вызывает гиперплазию клеток поджелудочной железы.
- Вредные привычки. Курение способствует попаданию в кровоток большого количества канцерогенов, повышает в крови уровень липидов, способствующих гиперплазии протокового эпителия. Алкоголизм повышает риск рака головки поджелудочной железы в 2 раза.
- Патология гепатобилиарной зоны. Сахарный диабет также удваивает риск развития рака ПЖ за счет гиперплазии эпителия протоков. Застой воспалительного секрета при хроническом панкреатите способствует мутации и последующей малигнизации клеток ПЖ. Вероятность развития рака ПЖ значительно выше у пациентов, страдающих хроническим калькулезным холециститом, желчнокаменной болезнью, постхолецистэктомическим синдромом. Рак желчевыводящих путей имеет одинаковые механизмы развития с раком поджелудочной железы.
- Токсическое воздействие. Последние исследования указывают на повышенный риск развития рака головки поджелудочной железы у работников промышленных производств (резиновое, химическое деревообрабатывающее).
Метастазирование рака головки поджелудочной железы осуществляется лимфо- и гематогенно, контактным путем (прорастая окружающие органы и ткани, желчевыводящие пути). Метастазы могут обнаруживаться в печени и почках, костях, легких, желчном пузыре и на брюшине.
Поражение головки поджелудочной железы наблюдается в 70% случаев рака ПЖ. Общепринятыми считаются классификация рака головки поджелудочной железы TNM, патогистологическая группировка по стадиям. В подавляющем большинстве случаев рак развивается из эпителия протоков поджелудочной железы, гораздо реже – из ее паренхиматозных тканей.
Рост опухоли может быть диффузным, экзофитным, узловым. Гистологически чаще всего диагностируют аденокарциному (папиллярный рак, слизистая опухоль, скирр), редко – анапластический и плоскоклеточный рак.
Симптомы рака головки ПЖ
Самым частым симптомом рака является боль (встречается более чем у 80% пациентов). Чаще всего болевой синдром служит первым признаком заболевания. Локализуется боль обычно в верхней половине живота, иррадиирует в верхнюю половину спины. Болевой синдром может быть обусловлен сдавлением опухолью нервов, желчных путей, а также обострением хронического панкреатита на фоне рака ПЖ.
К ранним признакам онкопатологии ПЖ также относят кахексию и диспепсические расстройства. Похудение обусловлено двумя факторами: в основном, прекращением продукции ферментов поджелудочной железы и расстройством пищеварения, в меньшей степени – опухолевой интоксикацией. Рак головки поджелудочной железы часто сопровождается диспепсическими расстройствами, такими как снижение аппетита вплоть до анорексии, тошнота и рвота, отрыжка, неустойчивость стула.
Более поздние симптомы заболевания обусловлены прорастанием опухоли поджелудочной железы в окружающие ткани и структуры. При раке головки ПЖ опухолевый рост может приводить к сдавлению общего желчного протока. У таких пациентов через несколько месяцев от начала заболевания появляются симптомы обтурационной желтухи: иктеричность кожи и слизистых, мучительный зуд, обесцвечивание кала и потемнение мочи, носовые кровотечения.
Нарушение оттока желчи по общему желчному протоку приводит к увеличению печени в размерах, но она остается безболезненной, плотно-эластической консистенции. Прогрессирование опухоли вызывает развитие асцита, инфаркта селезенки, кишечных кровотечений, инфаркта легких, тромбоза глубоких вен нижних конечностей.
На первой консультации гастроэнтеролога установить верный диагноз достаточно сложно. Для правильной диагностики необходимо проведение ряда лабораторных и инструментальных исследований:
- Анализы. В клиническом анализе крови возможно выявление высокого лейкоцитоза, тромбоцитоза. В биохимических пробах отмечается значительное повышение уровня прямого билирубина при нормальных значениях АсТ и АлТ. При анализе кала (копрограмме) пробы на уробилин и стеркобилин становятся отрицательными, регистрируется стеаторея и креаторея.
- Дуоденальное зондирование. В постановке диагноза поможет и дуоденальное зондирование с цитологическим исследованием сока ДПК – в нем выявляют раковые опухоли.
- Методы визуализации. Основные данные за рак головки поджелудочной железы получают при проведении ультрасонографии поджелудочной железы и желчных путей, МРТ поджелудочной железы, МСКТ органов брюшной полости, эндоскопической ретроградной холангиопанкреатографии. Данные методы исследований не только позволят точно определить локализацию и размеры опухоли, но и выявить расширение панкреатических и желчных протоков, метастазы в других органах.
- Эндоскопические исследования. На сегодняшний день одним из самых точных методов диагностики и стадирования рака головки ПЖ является эндоскопическое УЗИ – с его помощью можно точно определить стадию опухолевого роста, выявить поражение сосудов и регионарных лимфатических узлов. При затруднениях в постановке диагноза используется диагностическая лапароскопия.
- Биопсия. Возможно проведение пункционной биопсии поджелудочной железы с морфологическим исследованием биоптатов.

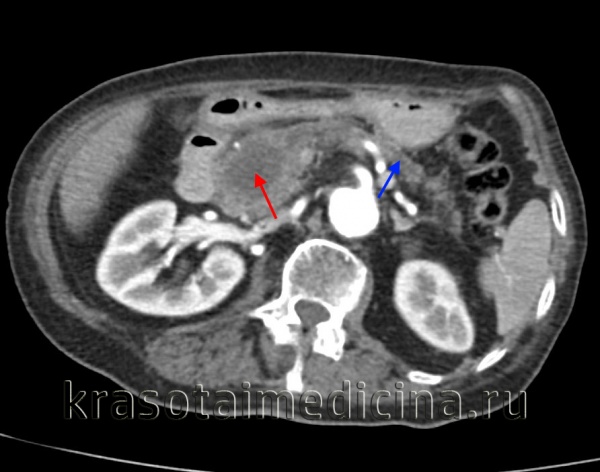
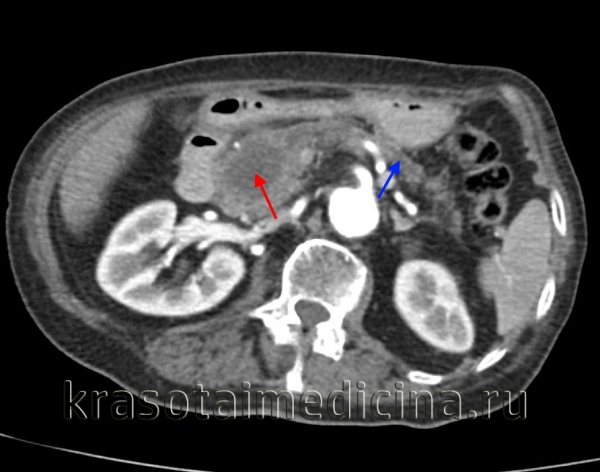
КТ ОБП/ЗП. Гиподенсная опухоль в головке поджелудочной железы (красная стрелка) на фоне расширения главного панкреатического протока и атрофии дистальных отделов железы (синяя стрелка).
Дифференциальная диагностика
Рак головки поджелудочной железы в ее ацинарной части чаще всего распространяется на двенадцатиперстную кишку и маскируется под язвенную болезнь ДПК, рубцовый стеноз пилорического отдела желудка. Кроме того, рак ПЖ следует дифференцировать с расслаивающей аневризмой аорты, гепатоцеллюлярной карциномой, эндокринными и доброкачественными опухолями ПЖ, закупоркой желчных протоков, острым и хроническим панкреатитом, стриктурами желчных протоков, холангитом, острым и хроническим холециститом.
Лечение рака головки поджелудочной железы
Для излечения пациентов с раком головки поджелудочной железы используют хирургические, химотерапевтические, радиологические и комбинированные методы. Наилучшим терапевтическим эффектом обладает оперативное вмешательство.
- Радикальные операции. На ранних стадиях основным методом хирургического лечения обычно служит панкреатодуоденальная резекция. Во время панкреатодуоденальной резекции удаляются окружающие сосуды, клетчатка, регионарные лимфоузлы. Гораздо реже могут выполняться сохраняющие функцию ЖКТ операции: резекция поджелудочной железы с сохранением привратниковой зоны, двенадцатиперстной кишки, желчевыводящих путей, селезенки.
- Паллиативные операции. На поздних стадиях рака выполняют операции, позволяющие устранить желтуху, улучшить продвижение пищевых масс по тонкому кишечнику, снять боли и восстановить функцию поджелудочной железы. Для достижения этих целей может потребоваться наложение обходных анастомозов или чрескожное чреспеченочное стентирование.
Противоопухолевая терапия
После проведенного оперативного лечения назначается лучевая терапия. Основные показания к радиологическому лечению – неоперабельный рак головки ПЖ с устраненной обтурацией желчных путей, местно-распространенные формы и рецидивы рака ПЖ. Лучевая терапия противопоказана при кахексии, сохраняющейся обтурационной желтухе, язвах ЖКТ любого генеза, прорастании сосудов опухолью, лейкопении.
В настоящее время исследования, посвященные поиску оптимальных химиопрепаратов для лечения рака ПЖ, еще не окончены. Однако результаты этих исследований говорят о том, что химиотерапия не может использоваться в качестве монолечения, ее назначение целесообразно только в виде предоперационной подготовки и для закрепления результатов операции. Комбинация химиотерапии и лучевого лечения в послеоперационном периоде позволяет добиться пятилетней выживаемости у 5% пациентов.
Рак головки поджелудочной железы является прогностически неблагоприятной опухолью, но прогноз зависит от размеров опухоли, поражения лимфоузлов и сосудов, наличия метастазов. Известно, что после радикальной операции химиолучевая терапия улучшает выживаемость в течение пяти лет. При наличии неоперабельного рака ПЖ изолированное использование химио- и лучевой терапии неэффективно. В целом, результаты любых методов лечения при наличии рака головки ПЖ неудовлетворительные. Профилактика рака головки поджелудочной железы заключается в отказе от курения и употребления алкоголя, переходе на низкокалорийную диету с большим количеством растительной клетчатки.
Читайте также:
