Показания для ПЦР (полимеразной цепной реакции) в гематологии
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Полимеразную цепную реакцию (ПЦР, PCR) изобрёл в 1983 году Кэри Мюллис (американский учёный). Впоследствии он получил за это изобретение Нобелевскую премию. В настоящее время ПЦР-диагностика является, одним из самых точных и чувствительных методов диагностики инфекционных заболеваний.
Полимеразная цепная реакция (ПЦР) — экспериментальный метод молекулярной биологии, способ значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (пробе).
В основе метода ПЦР лежит многократное удвоение определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). В результате нарабатываются количества ДНК, достаточные для визуальной детекции. При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце.
Кроме простого увеличения числа копий ДНК (этот процесс называется амплификацией), ПЦР позволяет производить множество других манипуляций с генетическим материалом (введение мутаций, сращивание фрагментов ДНК), и широко используется в биологической и медицинской практике, например, для диагностики заболеваний (наследственных, инфекционных), для установления отцовства, для клонирования генов, введения мутаций, выделения новых генов.
Специфичность и применение
ПЦР - метод молекулярной диагностики, ставший для ряда инфекций «золотым стандартом», проверен временем и тщательно апробирован клинически. Метод ПЦР позволяет определить наличие возбудителя заболевания, даже если в пробе присутствует всего несколько молекул ДНК возбудителя.
ПЦР позволяет диагностировать наличие долго растущих возбудителей, не прибегая к трудоёмким микробиологическим методам, что особенно актуально в гинекологии и урологии при диагностике урогенитальных инфекций, передающихся половым путем (ИППП).
- Исследование урогенитального тракта методом ПЦР на ИППП ;
Определение ДНК микроорганизмов, вызывающих наиболее распространенные инфекции передаваемые половым путем (ИППП) в вагинальных, цервикальных и уретральных сос.
- тест методом ПЦР на коронавирус Covid-19, мазок из носа и зева на определение РНК вируса SARS-CoV-2;
Для проведения исследования в медицинских офисах необходимо предъявить СНИЛС и документ удостоверяющий личность. Запись на исследование В случае по.
Особенно эффективен метод ПЦР для диагностики трудно культивируемых, некультивируемых и скрыто существующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях.
Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов. Методом ПЦР возможно выявление возбудителей не только в клиническом материале, полученном от больного, но и в материале, получаемом из объектов внешней среды (вода, почва и т. д.). В урологической и гинекологической практике - для выявления хламидиоза, уреаплазмоза, гонореи, герпеса, гарднереллёза, микоплазменной инфекции, ВПЧ - вирусов папилломы человека; в пульмонологии - для дифференциальной диагностики вирусных и бактериальных пневмоний, туберкулёза; в гастроэнтерологии - для выявления хеликобактериоза; в клинике инфекционных заболеваний - в качестве экспресс-метода диагностики сальмонеллёза, дифтерии, вирусных гепатитов В, С и G; в гематологии - для выявления цитомегаловирусной инфекции, онковирусов.
Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами - короткими синтетическими олигонуклеотидами длиной 18 - 30 букв. Каждый из праймеров сопоставим (комплементарен) с одной из цепей двуцепочечной матрицы, обрамляя начало и конец амплифицируемого участка.
После соединения (гибридизации) матрицы с праймером (отжиг), последний служит затравкой для ДНК-полимеразы при синтезе комплементарной цепи матрицы.
Проведение ПЦР
Для проведения ПЦР в простейшем случае требуются следующие компоненты:
- ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать;
- два праймера, комплементарные концам требуемого фрагмента;
- термостабильная ДНК-полимераза;
- дезоксинуклеотидтрифосфаты (A, G, C, T);
- ионы Mg2+, необходимые для работы полимеразы;
- буферный раствор.
ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0,1°C. Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Добавление специфичеких ферментов может увеличить выход ПЦР-реакции.
Ход реакции
Обычно при проведении ПЦР выполняется 20 - 35 циклов, каждый из которых состоит из трех стадий. Двухцепочечную ДНК-матрицу нагревают до 94 - 96°C (или до 98°C, если используется особенно термостабильная полимераза) на 0,5 - 2 минуты, чтобы цепи ДНК разошлись. Эта стадия называется денатурацией — разрушаются водородные связи между двумя цепями. Иногда перед первым циклом проводят предварительный прогрев реакционной смеси в течение 2 - 5 минут для полной денатурации матрицы и праймеров.
Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от праймеров и обычно выбирается на 4 - 5°С ниже их температуры плавления. Время стадии — 0,5 - 2 минут.
ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это — стадия элонгации. Температура элонгации зависит от полимеразы. Часто используемые полимеразы наиболее активны при 72°C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 10 - 15 мин.
Подготовка материала к исследованию и транспорт его в лабораторию
Для успешного проведения анализа важно правильно собрать материал у пациента и правильно провести его подготовку. Известно, что в лабораторной диагностике большинство ошибок (до 70%) совершается именно на этапе пробоподготовки. Для взятия крови в лаборатории ИНВИТРО в настоящее время применяются вакуумные системы, которые с одной стороны минимально травмируют пациента, а с другой - позволяют произвести взятие материала таким образом, что он не контактирует ни с персоналом, ни с окружающей средой. Это позволяет избежать контаминации (загрязнения) материала и обеспечивает объективность анализа ПЦР.
ДНК – дезоксирибонуклеиновая кислота - биологический полимер, один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. Основная роль ДНК в клетках — долговременное хранение информации о структуре РНК и белков.
РНК– рибонуклеиновая кислота - биологический полимер, близкий по своему химическому строению к ДНК. Молекула РНК построена из тех же мономерных звеньев - нуклеотидов, что и ДНК. В природе РНК, как правило, существует в виде одиночной цепочки. У некоторых вирусов РНК является носителем генетической информации. В клетке играет важную роль при передаче информации от ДНК к белку. РНК синтезируется на ДНК-матрице. Процесс этот называется транскрипцией. В ДНК имеются участки, где содержится информация, ответственная за синтез трех видов РНК, различающихся по выполняемым функциям: информационной или матричной РНК (мРНК), рибосомальной (рРНК) и транспортной (тРНК). Все три вида РНК тем или иным способом участвуют в синтезе белка. Однако информация по синтезу белка содержится только в мРНК.
Нуклеоти́ды - основная повторяющаяся единица в молекулах нуклеиновых кислот, продукт химического соединения азотистого основания, пятиуглеродного сахара (пентозы) и одной или нескольких фосфатных групп. Нуклеотиды, представленные в нуклеиновых кислотах, содержат одну фосфатную группу. Они называются по содержащемуся в них азотистому основанию - адениновый (A), содержащий аденин, гуаниновый (G) - гуанин, цитозиновый (C) - цитозин, тиминовый (Т) - тимин, урациловый (U) - урацил. В состав ДНК входят 4 типа нуклеотидов - A, T, G, C, в состав РНК также 4 типа - A, U, G, C. Сахаром в составе всех нуклеотидов ДНК является дезоксирибоза, РНК - рибоза. При образовании нуклеиновых кислот нуклеотиды, связываясь, образуют сахаро-фосфатный остов молекулы, по одну сторону которого находятся основания.
Праймер – котроткая ДНК, используемая для репликации матричной цепи. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы, обрамляя начало и конец амплифицируемого участка.
Показания для ПЦР (полимеразной цепной реакции) в гематологии
1. Вирусные инфекции как показание для ПЦР (полимеразной цепной реакции). Вирусы являются важными этиологическими факторами оппортунистических инфекций, возникающих у гематологических больных на фоне вторичного иммунодефицита и агранулоцитоза. Индикация этих вирусов (Herpes simplex, Herpes zoster, Cytomegalovirus и др.) затруднена в связи со сложностями их культивирования.
Внедрение ПЦР позволяет:
1) улучшить диагностику вирусных инфекций;
2) оценивать интенсивность репродукции вирусов в организме, что особенно актуально при лечении герпесвирусных инфекций у больных с вторичным иммунодефицитом (пациенты с острым лейкозом, пациенты после трансплантации костного мозга);
3) изучать роль вирусов как возможных этиологических факторов онкогематологических заболеваний;
4) проводить мониторинг посттрансплантационных лимфопролиферативных заболеваний, вызываемых вирусом Эпштейна-Барр.
2. Трансплантация гемопоэтических стволовых клеток как показание для ПЦР (полимеразной цепной реакции). Максимальная гистосовместимость донора и реципиента гемопоэтических стволовых клеток определяет успех аллогенной миелотрансплантации. Высокая надежность ПЦР сделала этот метод «золотым стандартом» для оценки генов системы HLA при миелотрансплантации от родственных доноров.
Благодаря внедрению ПЦР значительно улучшилось качество HLA-типирования при трансплантации аллогенных гемопоэтических клеток от неродственных доноров: выживаемость пациентов в течение года после миелотрансплантации увеличилась с 10-20% (при традиционном исследовании) до 70-80%. При аутологичной миелотрансплантации ПЦР позволяет выявлять контаминацию трансплантатов опухолевыми клетками и контролировать их очистку.
3. Генетически обусловленные заболевания системы крови как показание для ПЦР (полимеразной цепной реакции). При наследственных заболеваниях системы крови (гемоглобинопатии, врожденные нарушения гемостаза и др.) имеются генетические нарушения, которые могут быть выявлены с помощью ПЦР.
4. Онкогематологические заболевания как показание для ПЦР (полимеразной цепной реакции).

Онкогематология — приоритетная сфера применения ПЦР. Основными задачами в этой области являются:
1) выявление молекулярно-генетических маркеров онкогематологических заболеваний;
2) диагностика множественной лекарственной резистентности;
3) выявление минимальной резидуальной болезни после курса лечения, мониторинг и ранняя диагностика рецидивов заболевания.
Выявление маркеров онкогематологических заболеваний. Изменения в геноме выявляются при большинстве гемобластозов, причем многие нозологические формы характеризуются наличием специфических хромосомных транслокаций. Например, при различных вариантах неходжкинских лимфом закономерно выявляются: транслокации между хромосомами 14 и 18 (В-клеточные фолликулярные лимфомы), между хромосомами 8 и 14 (лимфома Беркитта), между хромосомами 11 и 14 (лимфомы из клеток мантийной зоны), между хромосомами 2 и 5 (анапластические крупноклеточные лимфомы); транслокации с участием хромосомы 3 (диффузные крупноклеточные лимфомы), хромосомы 9 (лимфоплазмоцитарные лимфомы), хромосомы 10 (кожные Т-клеточные лимфомы); трисомия хромосомы 3 (MALT-лимфомы).
Общей закономерностью для онкогенных транслокаций является проксимальное по отношению к точке транслокации расположение онкогена. Различные транслокации сопровождаются активацией определенных онкогенов, которые являются специфичными маркерами конкретных онкогематологических заболеваний. Так, молекулярно-генетической основой онкогенного потенциала транслокации t(14;18), выявляемой у большинства больных В-клеточными лимфомами, является сопоставление гена тяжелой цепи иммуноглобулина в хромосоме 14 с онкогеном bcl-2 в хромосоме 18.
При этом онкоген bcl-2 остается функционально активным, его усиленная экспрессия обнаруживается при ПЦР и является маркером этой группы неходжкинских лимфом.
Из онкогенов, активирующихся при онкогематологических заболеваниях, представляют интерес гены семейств myc и ras, контролирующие клеточный цикл. В частности, одним из признаков опухолевой прогрессии является появление дополнительных хромосомных транслокаций с участием онкогена с-тус.
Важным фактором, способствующим прогрессированию гемобластозов, является изменение экспрессии антионкогена р53. Нарушения структуры и/или экспрессии р53 выявляются практически у всех пациентов с признаками прогрессирования заболевания. В связи с этим ПЦР — метод выбора по сравнению с гистологическими исследованиями, при которых изменения обнаруживаются не более чем у 50% пациентов.
Диагностика множественной лекарственной резистентности. При лечении онкогематологических заболеваний большое значение имеет приобретение злокачественными клетками множественной лекарственной резистентности. До начала химиотерапии данный феномен выявляется у 2-3% больных, при повторных курсах лечения его частота достигает 60-70%. Основную роль в развитии множественной лекарственной резистентности играет ген mdr (multidrug resistance), меньшее значение имеют гены bcl-2 и р53. Изучение экспрессии генов mdr, bcl-2 и р53 с помощью ПЦР позволяет своевременно выявлять пациентов с резистентными к лечению формами онкогематологических заболеваний и корректировать программу лечения.
Выявление минимальной резидуальной болезни, мониторинг и ранняя диагностика рецидивов заболевания. При достижении полной ремиссии лейкозов и лимфом при стандартном обследовании (общий анализ крови, исследование миелограммы, компьютерная томография и т. д.) признаки заболевания отсутствуют, однако в организме остаются опухолевые клетки, количество которых достигает 107-108.
Рутинное цитогенетическое исследование во многих случаях недостаточно чувствительно. Основным методом, позволяющим выявить опухолевые клетки и диагностировать минимальную резидуальную болезнь, является ПЦР, чувствительность которой дает возможность обнаружить одну опухолевую клетку среди 105-106 нормальных. Оценка количества опухолевых клеток при выявлении минимальной резидуальной болезни с помощью ПЦР позволяет проводить мониторинг и прогнозировать рецидив заболевания задолго до появления его клинических признаков и данных лабораторных и инструментальных исследований.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Полимеразная цепная реакция (ПЦР) в гематологии - возможности
Основу современной молекулярно-генетической методологии составляет полимеразная цепная реакция (ПЦР), которая применяется в различных модификациях и обеспечивает эффективную амплификацию (многократное повторение) избранных последовательностей ДНК. Метод основан на правиле комплементарности: в процессе репликации матричной цепи напротив аденина в строящуюся комплементарную цепь всегда встраивается тимин, а напротив гуанина — цитозин. Любые другие нуклеотидные пары нарушают структуру ДНК и рассматриваются как мутации замены.
Полимеразная цепная реакция (ПЦР) — циклический процесс, при котором в каждом цикле происходит удвоение числа тестируемых молекул ДНК. В ходе реакции исследуемую молекулу ДНК денатурируют (разделяют нагреванием до 94-95 °С на две комплементарные цепи) в присутствии набора дезоксирибонуклеотидтрифосфатов и избытка так называемых праймеров — синтетических ДНК-олигонуклеотидов длиной 20-30 нуклеотидов, которые соединяются с цепями ДНК. Один из праймеров комплементарен 5'-концу первой цепи ДНК, другой — 3'-концу второй цепи ДНК.
Два типа праймеров гибридизуются с комплементарными последовательностями каждой из двух противоположных цепей ДНК и выполняют роль «затравок» ферментативного синтеза. Добавляемый в реакционную смесь фермент (термостабильная ДНК-полимераза — Taq-полимераза бактерии Thermus aquaticus) достраивает каждый праймер до конца исходной цепи ДНК, которой он комплементарен. Бактерия Thermus aquaticus живет в воде при температуре 75 С.
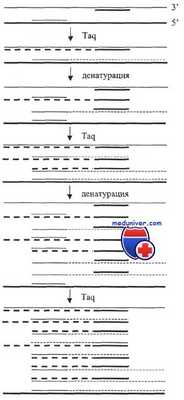
Схема полимеразной цепной реакции.
Примечание: Taq - термостойкая ДНК-полимераза; длинные сплошные линии — исходные последовательности ДНК; короткие линии — праймеры; пунктирные линии — последовательности, синтезированные Taq-полимеразой, комплементарные исходным.
Температурный оптимум для Taq-полимеразы составляет 72 °С, но она остается стабильной и активной и при 94 °С. Недостатком Taq-полимеразы является большое количество ошибок в конечном продукте (10-4) вследствие того, что она лишена редактирующей 3'->5' экзонуклеазной активности. В настоящее время коммерчески доступны более точные и термостабильные ДНК-полимеразы из бактерий Thermococcus litoralis и Pyrococcus species. Конечный продукт реакции в виде двух новых двуцепочечных ДНК вновь денатурируют при повышенной температуре и повторяют цикл амплификации.
Процесс удвоения повторяется 20-30 раз, до получения миллионов копий исходной молекулы ДНК. Детекцию результатов ПЦР проводят в гель-электрофорезе (с окраской фракции ДНК бромистым этидием, ярко светящимся в ультрафиолетовом свете), так как полученные фрагменты ДНК отличаются по размерам и/или нуклеотидной последовательности и, соответственно, электрофоретической подвижности. Таким образом, происходит избирательное (лимитированное нуклеотидными последовательностями праймеров) умножение специфических участков ДНК до концентрации, при которой они могут быть легко обнаружены и проанализированы.
Продолжительность каждого из трех этапов амплификации (денатурация ДНК, связывание с нею праймеров и репликация), температура и другие условия, при которых они происходят, подбираются индивидуально для каждого конкретного случая. Число циклов зависит от цели исследования.
Во избежание ложноположительных результатов ПЦР-анализа следует принимать меры по предотвращению перекрестной контаминации анализируемого материала, например попадания в него ДНК, заведомо содержащей искомую мутацию, используемой в качестве позитивного контроля. Чтобы избежать ложноотрицательных результатов, реакцию проводят и с другими генами, которые являются тканеспецифичными для данного образца.
Для количественного анализа генной экспрессии используется вариант ПЦР, который называется РТ-ПЦР (ретротранскриптазная ПЦР), в которой вместо геномной ДНК амплифицируют кДНК (комплементарную ДНК), синтезированную на РНК-матрице с помощью вирусного фермента обратной транскриптазы.
Для визуализации продуктов амплификации наилучшие результаты дает метод Southern blotting, который назван по имени его автора Е. М. Southern и применяется для различных целей. Фрагменты, полученные при ПЦР-амплификации или разрезании геномной ДНК рестриктазами, разделяют по размеру гель-электрофорезом. Затем гель накладывают на нитроцеллюлозный фильтр или нейлоновую мембрану и промывают буферным раствором по направлению к фильтру. При этом фрагменты ДНК переносятся на фильтр, где остается их отпечаток — «реплика». Фильтр с ДНК-репликами инкубируют в емкости со смесью индикаторных олигонуклеотидных зондов, комплементарных анализируемым последовательностям.
С этой целью обычно используют меченные радиоактивным фосфором или флюоресцентной меткой олигонуклеотидные зонды, которые в процессе инкубации гибридизуются с комплементарными им фрагментами ДНК на фильтре. После гибридизации на фильтр накладывают рентгеновскую пленку. На проявленной пленке остаются отпечатки в виде темных полос, по которым определяют количество и размер фрагментов ДНК, комплементарных соответствующим зондам. Если по такой же схеме анализируют РНК или белок, то соответствующие модификации называются Northern и Western blotting.
Видео методика и принципы ПЦР (полимеразной цепной реакции) в диагностике
ПЦР-тестирование: как работает метод ПЦР в диагностике
ПЦР – высокоточный метод диагностики и одно из самых главных открытий в области биологии за последние десятилетия. ПЦР-анализ применяется уже почти 40 лет и считается наиболее точным и чувствительным способом диагностики инфекционных заболеваний.
ПЦР – уникальный и универсальный метод, тест используется не только в клинической лабораторной диагностике, но также в биологии, криминалистике, археологии и многих других научных областях. Все, что нужно для проведения анализа – небольшое количество любого биоматериала пациента.
Суть метода ПЦР
ПЦР – полимеразная цепная реакция. Метод основан на обнаружении даже небольших концентраций искомого элемента диагностики. Для определения изначально крайне малых концентраций РНК или ДНК, которые необходимо определить в процессе проведения основного этапа исследования, используется метод искусственного увеличения количества РНК или ДНК. А поскольку они специфичны и строго индивидуальны для каждого микроорганизма или живого существа за счет уникальности последовательности нуклеотидов во фрагментах, ошибка в определении целевого ДНК или РНК исключена.
Генетическая информация любого живого организма записывается в ДНК. Эта молекула состоит из двух цепочек, сплетающихся в единую спираль. Некоторые вирусы (например, COVID-19) хранят свой код в РНК – одной нити нуклеотидов.
Для каждого организма, включая вирусы, бактерии и грибки, последовательность нуклеотидов уникальна. Ее можно сравнить с отпечатком пальца или сканом сетчатки глаза человека. Укороченные последовательности нуклеотидов, характерные для каждого вида патогена (возбудителя опасных заболеваний), хранятся в базах научных лабораторий в виде праймеров – отдельных участков ДНК, типичных для только конкретного возбудителя. Эти участки значительно короче любой молекулы ДНК. Такие праймеры присоединяются к ДНК возбудителя в пробе и под действием катализаторов многократно воспроизводят свои дубли. Этот процесс называются «репликация» – многократное увеличение, дублирование искомого участка до тех пор, пока он не станет доступен для определения. Процесс репликации возможен только при наличии в пробе ДНК возбудителя.
Преимущества метода ПЦР
- Высокая специфичность. Метод ПЦР определяет заданную последовательность нуклеотидов, присущую конкретному патогену. Таким образом, специфичность теста стремится к 100%. Исключен риск ложноположительных результатов.
- Чувствительность. Для ПЦР достаточно всего несколько молекул ДНК патогена (или даже уже неактивных – разрушенных вирусных частиц, сохранивших специфические участки ДНК в достаточном количестве), чтобы он был обнаружен в ходе исследования.
- Скорость проведения. Лаборатория получает результат ПЦР-теста через несколько часов, клиент – уже на следующий день. Скорость диагностики имеет принципиально важное значение для своевременного лечения. Например, при диагностике бактериальных инфекций классический посев занимает от нескольких дней, а с ПЦР-анализом пациент сможет принять меры и начать лечение уже через сутки.
- Универсальность. Для исследования подходит любой биоматериал: кровь, моча, сперма, мокрота, гной, жидкости из абсцессов и пр. Кроме этого, ПЦР применяется в самых разных областях науки и медицины, работая даже там, где другие методы бессильны.
- Диагностика латентных инфекций. ПЦР-диагностика определяет возбудителя инфекции даже в инкубационном периоде и при скрытом течении заболевания.
Какие есть недостатки
Единственный серьезный недостаток, связанный с методом полимеразной цепной реакции, - его высокая технологичность. Исследования ПЦР требуют строжайших соблюдений правил и серьезной оснащенности лабораторного комплекса. Не каждая лаборатория может позволить себе все необходимое оборудование.
Показания к проведению ПЦР-анализа
- Диагностика инфекционных заболеваний (гепатит, ВИЧ, TORCH-инфекции и огромное множество других видов патогенов).
- Урогинекология (диагностика инфекций, передающихся половым путем: хламидиоз, уреаплазма, микоплазма, кандиды, гарднерелла, герпесвирусы). Важное значение для женского и мужского здоровья играет ВПЧ – вирус папилломы человека. Доказано, что у женщин онкогенные штаммы этого вируса способны вызывать рак шейки матки.
- Неонатология. Существует целый ряд инфекций, способных поражать плод еще в материнской утробе. Среди них вирусы герпеса, токсоплазмы, краснухи. ПЦР-диагностика позволяет правильно определить тактику ведения и риски внутриутробной инфекции.
- Респираторные заболевания. Диагностика методом ПЦР стала в 2020 году актуальной как никогда и продемонстрировала свою незаменимость и эффективность. ПЦР-анализ – главный тест и «золотой стандарт» диагностики коронавирусной инфекции Sars-Cov-2 (COVID-19), ставшей причиной самой масштабной пандемии последних десятилетий.
- Генетика. Наследственные заболевания и отцовство также диагностируются при помощи метода ПЦР.
Подготовка к проведению ПЦР-теста
- Анализ сдается утром натощак. При этом ряд генетических исследований проводится в произвольное время, удобное пациенту.
- При сдаче анализа по мазку из ротоглотки необходимо выдержать интервал с приемом пищи и воды в 3-4 часа перед тестом.
- Перед анализом на венерические инфекции необходимо воздержаться от половой активности в течение суток.
- Перед анализом нельзя использовать никакие противовирусные препараты.
Как проводится ПЦР-анализ
- С обратной транскрипцией. Самый распространенный способ идентификации известной последовательности РНК, включающий амплификацию, определение патогена и его идентификации среди образцов, хранящихся в научной картотеке.
- Вложенная ПЦР (или «гнездовая») — используется для снижения количества неспецифичных продуктов реакции и имеет две стадии с использованием двух видов праймеров.
- Изотермические методы – не требуют повторяющихся температурных циклов, менее энергозатратны.
- Инвертированная ПЦР — применяется, если имеется только короткий фрагмент известной последовательности, но необходимо определить соседние последовательности после вставки ДНК в геном.
- ПЦР в реальном времени — метод, позволяющий определить не только присутствие целевой нуклеотидной последовательности в образце, но и измерять количество ее копий после каждого цикла амплификации, что дает возможность для проведения тестов с количественным результатом
Результаты ПЦР-теста
Результаты анализов, проведенных методом ПЦР, известны уже через один день. Иногда возможно проведение экстренного теста – его часто используют при оказании срочной медицинской помощи при госпитализации. Тогда срок готовности результата сокращается до считанных часов.
Результаты ПЦР-теста дадут точную информацию о том, какая инфекция была обнаружена. При количественном тестировании анализ определит также вирусную или бактериальную нагрузку на организм. В этом случае в результатах будет значиться титр обнаруженного патогена (его количество в одном миллилитре пробы). Количественный анализ особенно важен при диагностике заболеваний, спровоцированных условно-патогенными микроорганизмами, которые присутствуют в норме практически у каждого человека. Такие микроорганизмы представляют угрозу только при большой численности, а в остальных случаях мирно сосуществуют с носителем.
Анализ ПЦР — самый точный анализ на инфекции
Полимеразная цепная реакция (ПЦР) – это современный инструмент диагностики разнообразных инфекций, отличающийся высокой точностью. Анализ ПЦР позволяет определять возбудителей инфекционных заболеваний, опираясь на их генетический материал (РНК или ДНК). Биологическим материалом для исследования может служить кровь, мазок из половых органов, слюна и прочее.
Метод ПЦР был открыт в 1983. Его создатель Кэри Мюллис (США), за это открытие получил Нобелевскую премию в области химии. Уже за первые десять лет методика стала обязательным лабораторным исследованием во всем мире, получив признание ученых и врачей.
Медицинский центр Диана предлагает провести исследование по методике полимеразной цепной реакции в кратчайшие сроки и с высочайшим уровнем точности. Наша диагностическая база соответствует всем международным стандартам и требованиям.
Какие инфекции можно диагностировать методом ПЦР
На диагностику отправляют гинеколог, уролог или дерматолог. Анализ ПЦР дает возможность диагностировать большое число разнообразных инфекций. В эту группу попадают и скрытые, бессимптомные заболевания, находящиеся в инкубационном периоде:
С помощью метода ПЦР можно обнаружить:
- гепатит C, B;
- уреаплазмоз половых органов;
- ИППП – уреаплазмоз, трихомониаз, гарднереллез,;
- хламидиоз половых органов и дыхательных путей;
- микоплазмоз половых органов и дыхательных путей;
- бактериальный вагиноз;
- кандидоз половых органов;
- инфекционный мононуклеоз;
- туберкулез;
- сальмонеллез;
- туберкулез (легочные и внелегочные формы);
- листериоз, клещевые энцефалиты, болезнь Лайма;
- цитомегаловирусную, папилломавирусную, герпесную инфекцию;
- детские заразные болезни, выявляемые при беременности и до зачатия — краснуху, паротит, дифтерию, корь;
- ВИЧ.
При каждом из вышеперечисленных заболеваний, обнаруженным другим методом, желательно делать и ПЦР — исследование. Возбудители многих инфекций имеют несколько типов (штаммов), а более точная диагностика делает лечение эффективнее. Поскольку разные типы возбудителей обладают своими способами передачи инфекции, точное определение возбудителя помогает уберечь от заражения окружающих. Например, гепатитом А можно заразиться через общие предметы и посуду (болезнь грязных рук), а гепатитом С — только через кровь, медицинские инструменты и половые контакты. Это важно для тех, кто находится рядом с больным.
Суть метода полимеразной цепной реакции
Метод основан на выявлении возбудителя по участкам ДНК или РНК. ПЦР напоминает криминалистику, когда преступника находят по частичкам кожи или волосам, оставленным на месте преступления. Поскольку каждый живой организм имеет уникальную структуру ДНК или РНК. Метод позволяет безошибочно идентифицировать микроорганизм, даже если он присутствует в исследуемом материале в минимальных количествах.
ПРЦ подходит для выявления скрытого носительства, нетипичных, стертых и прочих форм заразных заболеваний. Диагностика отличается высокой точностью, поэтому практически не дает ошибок и ложных результатов. Анализ часто назначается, как дополнительное обследование, чтобы выявить конкретный тип вируса или микроба.
Достоинства и недостатки метода ПЦР
Анализ ПЦР – результативный диагностический инструмент, позволяющий врачу не только правильно определить тип инфекционного возбудителя в организме больного, но также и количество микробов. Эта особенность позволяет методу ПЦР эффективно обнаруживать и хронические инфекции, к примеру, вирусный гепатит.
Преимущества методики заключаются в следующих особенностях:
- Универсальность . Метод дает возможность определить все известные на сегодняшний день микроорганизмы, вне зависимости от вида исследуемого материала.
- Специфичность . ПЦР позволяет определить ДНК вируса или бактерии со 100% точностью, что не дает ни один другой способ диагностики.
- Чувствительность – даже один мельчайший «обломок» ДНК или РНК может быть обнаружен и идентифицирован, благодаря быстрой реакции образования копий.
- Оперативность – поставить диагноз на основании полимеразной цепной реакции можно уже через несколько часов после забора биологического материала, что дает возможность своевременно приступить к лечению заболевания.
- Возможность проведения количественного анализа . Эта особенность важна при выявлении болезней, вызванных условно-патогенной флорой (например, молочницы). Повышенное содержание грибков кандида в организме вызывает заболевание, а нормальное количество до 10 3 — 104 КОЕ/тамп. – нет.
Недостатки ПЦР-диагностики – это необходимость в высокотехнологичном оборудовании и высококвалифицированных специалистах. Для анализа нужен специальный бокс-ламинар, где поддерживается необходимая температура и обеспечивается чистота эксперимента.
Как сдать анализ ПЦР правильно: подготовка
Чтобы понять, как именно следует подготовиться к предстоящему анализу ПЦР, пациент должен обязательно уточнить у своего врача, какой именно биологический материал планируется взять. От этого непосредственно зависит подготовка.
- Выделения из половых органов, мазок из шейки матки или мочеиспускательного канала, моча – посредством исследования данных вариантов материала методом ПЦР эффективно диагностируются инфекции половых органов.
- Вирусный гепатит C, ВИЧ инфекция требуют взятие крови на анализ ПЦР.
- С помощью мазка из зева можно подтвердить или опровергнуть факт наличия инфекционного мононуклеоза.
Мазок у женщин
Для диагностики половых инфекций методом ПЦР у женщин, как правило, берут мазок из влагалища . При беременности действуют стандартные правила подготовки к анализу ПЦР.
- За пару дней до проведения ПЦР нужно отказаться от спринцеваний, средств интимной гигиены.
- За неделю до анализа на инфекции стоит перестать применять любые виды лекарственных препаратов, разумеется, если они не входят в программу подготовки к анализу ПЦР, прописанную врачом.
- За пару дней до обследования нужно начать воздерживаться от полового акта.
- Подмывание в день анализа ПЦР не нужно, гигиена половых органов проводится накануне вечером, используется только теплая вода.
- За пару часов до сдачи анализа мочиться нельзя.
Мазок у мужчин
Подготовиться к забору мазка из мочеиспускательного канала для проведения ПЦР несложно. Достаточно соблюдать изложенные ниже правила.
- За 2 суток до ПЦР обследования нужно начать воздерживаться от сексуальных отношений.
- Прием лекарств прекращается приблизительно за 7 дней до проведения анализа, если, конечно же, они не были специально назначены врачом.
- Гигиена половых органов должна проводиться накануне вечером, в день анализа ПЦР это делать не стоит.
- Рекомендуется не мочиться примерно 2-3 часа перед сдачей анализа.
Анализ крови
Если в процессе ПЦР анализа объектом изучения станет кровь пациента, правила подготовки к нему следующие.
- Оптимальное время для сдачи крови – утро, анализ нужно обязательно сдавать натощак (минимум 8 часов отсутствия пищи). Воду можно пить свободно.
- Отказ от алкоголя за сутки до ПЦР анализа, отказ от курения за час до него.
- Если здоровье допускает такой вариант, от приема лекарственных средств рекомендуется на время отказаться.
- Перед сдачей проб крови в обязательном порядке следует отдохнуть около 20 минут.
- Накануне ПЦР исследования совершенно исключены эмоциональные и физические перегрузки, они могут сказаться на результатах анализа.
Как проводится тест ПЦР?
Для исследования берется любая среда, в которой может находиться возбудитель, но чаще всего используются:
- Кровь сыворотка или плазма – для выявления множества возбудителей – вирусов гепатита B, C, D, G, герпеса, ВИЧ, цитомегаловируса;
- Моча и сок простаты – при диагностике ЗППП;
- Мокрота, плевральная жидкость, бронхоальвеолярный лаваж – для диагностики легочных и внелёгочных форм туберкулеза;
- Спинномозговая жидкость – для диагностики инфекций нервной системы;
- Околоплодная жидкость – для определения внутриутробных заражений;
- Мазок из зева – для выявления возбудителей инфекционного мононуклеоза и дифтерии;
соскобы и мазки со слизистых для диагностики ЗППП;
клетки слизистой желудка и желудочный сок — для выявления бактерии хеликобактер, вызывающей гастрит и язву.
При одном взятии материала можно обнаружить сразу нескольких возбудителей, попавших в организм. Такая универсальность избавляет пациента от дополнительных обследований и лишних трат.
Обнаружить и идентифицировать участки генетической информации удается при помощи специальных эталонных маркеров ДНК (праймеров) созданных для каждого известного возбудителя. Эталон позволяет найти «свой» фрагмент среди миллионов других. Если это происходит, запускается реакция полимеразной цепи.
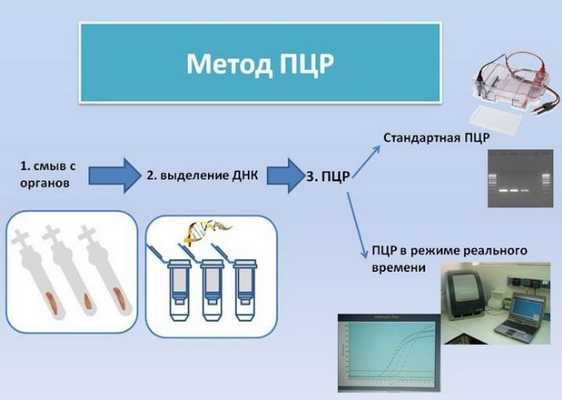
ПЦР—реакция делает огромное число копий выявленного участка генной информации (репликацию). Важно, что реплицируются только участки ДНК и РНК, необходимые для проведения анализа. Поэтому так важны чистота эксперимента и умение персонала обращаться с аппаратурой и образцами.
Цепная реакция протекает очень быстро, уже через два часа участок ДНК увеличивается в миллионы раз, что позволяет обнаружить и точно идентифицировать инфекцию. Для работы с эталонами пробирки помещают в специальный прибор. При помощи программы задается алгоритм, несколько раз меняющий температуру среды и влияющий на протекание реакции. Результат ПЦР виден сразу после окончания исследования.
Как расшифровать ПЦР анализ
Проведение ПЦР исследования позволяет не просто установить тип инфекции, присутствующий в организме больного, но и оценить его с количественной точки зрения (количество микробов). Расшифровка результатов количественного анализа ПЦР играет важную роль в обнаружении и проверке эффективности лечения большого числа хронических заболеваний, скажем гепатита C.
Результатом анализа ПЦР могут стать положительный и отрицательный ответы.
- Отрицательный результат. Следы инфекции не были выявлены в биологическом материале, который являлся объектом исследования в процессе анализа ПЦР. Как правило, на основании отрицательного результата можно полагать, что в организме действительно отсутствует инфекция.
- Положительный результат. Такой результат анализа ПЦР свидетельствует о том, что следы инфекционного заболевания присутствуют в биологическом материале пациента. Положительный результат анализа ПЦР характеризуется большой степенью точности.
Иногда инфицирование выявляется на фоне полного здоровья и отсутствия признаков заболевания. Некоторые больные считают, что анализ сделан неправильно, но реальная ситуация другая. Если ПЦР показала, что возбудитель в организме есть, значит, он там действительно находится. Просто инфекционные болезни никогда не начинаются сразу после заражения, имея инкубационный период различной продолжительности.
Скрытый период может продолжаться очень долго, например, при СПИДе – несколько лет, пока какие-то механизмы не подтолкнут вирусы к размножению. Возбудитель определяется в организме носителей и тех, кто не долечился. Очень часто переходят в скрытую (латентную) форму различные ЗППП. В этом случае может понадобиться дополнительная лабораторная диагностика.
Точность расшифровки результатов ПЦР анализа
Метод ПЦР, позволяющий выявлять достаточно большое число инфекций, характеризуется повышенной точностью, чувствительностью и специфичностью. Эти характеристики говорят о том, что с помощью исследования ПЦР можно:
- Максимально точно установить отсутствие или присутствие инфекционного возбудителя.
- Максимально точно определить конкретную разновидность инфекционного возбудителя (специфичность).
- Выявить инфекцию даже в том случае, когда она имеет скрытый характер. Речь идет о низком уровне присутствия в подвергаемом исследованию биологическом материале пациента ДНК микробов (чувствительность).
Преимущества метода ПЦР над иммуноферментным анализом и прочими иммунологическими инструментами выявления инфекции заключается в том, что он реже дает ошибочные результаты. То есть расшифровка анализа ПЦР значительно реже показывает отсутствие инфекционных микробов, если они есть в организме больного.
Кроме того, почти не бывает, чтобы расшифровка анализа выявляла наличие в организме несуществующей инфекции, то есть давала ложноположительные результаты.Разумеется, стопроцентно правильными результаты ПЦР назвать все же нельзя, поэтому необходимо обязательно дополнять это исследование другими методиками.
Читайте также:
