Показания для стереотаксической операции при гломусной опухоли и ее эффективность
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
ЛОР-клиника Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского, Москва
Кафедра болезней уха, горла и носа Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия, 119991
Отдел заболеваний уха, лаборатория патологической анатомии ЛОР-органов НКЦ оториноларингологии ФМБА России
Кафедра болезней уха, горла и носа Первого МГМУ им. И.М. Сеченова, Москва, Россия, 119991
Опыт хирургического лечения гломусных опухолей
Журнал: Вестник оториноларингологии. 2017;82(1): 15‑19
Цель исследования — определить особенности хирургического лечения и послеоперационного ведения пациентов с различными типами гломусной опухоли. Представлен опыт хирургического лечения 15 пациентов с гломусной опухолью височной кости различной степени распространенности и локализации. Сделан вывод о том, что объем дообследования и хирургического лечения зависит от распространенности новообразования. При опухолях типа В, С, D перед операцией необходимо выполнение эмболизации питающих сосудов.
Гломусные опухоли также известны как параганглиомы височной кости [1]. Это доброкачественные, медленно растущие, обильно васкуляризованные, локально инвазивные новообразования, развивающиеся из клеток паранганглиев, ассоциированных с симпатическими и парасимпатическими ганглиями. В области височной кости гломусные опухоли чаще всего локализуются в области луковицы яремной вены, а также на промонториальной стенке барабанной полости, исходя из тимпанального сплетения. Среди доброкачественных новообразований среднего уха гломусные опухоли занимают второе место после невриномы преддверно-улиткового нерва.
Анатомы и патоморфологи описывали гломусные тельца достаточно давно. В 1840 г. G. Valentin [2] в своих работах упоминает «ganglia tympanica», скопление хромаффинных клеток на промонториальной стенке барабанной полости. В 1878 г. W. Krause описал эту ткань как «glandulatympanica» (цит. по [3]). Позже S. Guild на большом гистологическом исследовании секционных образцов височных костей описал до 12 «гломусных формирований» вдоль хода нерва Якобсона в каждом ухе: они имели тенденцию группироваться в пределах барабанных канальцев, на базальном завитке улитки и в костном канале ниже processus cochleariformis и сухожилия мышцы, напрягающей барабанную перепонку [4]. Гломусную опухоль как гиперплазию гломусных телец впервые представил P. Masson [3] в 1924 г. В 1945 г. H. Rosenwasser [5] впервые описал пациента с диагностированной яремной гломусной опухолью. При этом H. Rosenwasser был первым, признавшим происхождение этих новообразований от гломусных телец луковицы яремной вены, и впервые предложил хирургическую технику удаления яремной гломусной опухоли. В дальнейшем F. Capps [6] выполнил мобилизацию и смещение лицевого нерва, окклюзию сигмовидного синуса и лигирование внутренней яремной вены на шее. M. Shapiro и D. Neues [7] при описании операции по удалению яремного гломуса, которая включала в себя мастоидэктомию, транспозицию лицевого нерва кпереди, лигирование внутренней яремной вены и снабжающих опухоль артериальных разветвлений на шее, подчеркивали значение управляемой гипотензии и гипотермии, предотвращающие неконтролируемое интраоперационное кровотечение.
Гломусные тельца или нехромаффинные параганглии — нормальные компоненты диффузной нейроэндокринной системы, сопровождающие черепномозговые нервы [2, 8, 9]. Функция большинства параганглиев, находящихся в голове и шее, неясна; существует одно исключение — каротидное тело, являющееся хеморецептором. Гломусные тельца среднего уха (glomustympanicum) также могут служить хеморецепторами, обеспечивающими регулирование перепадов давления в морфологических и анатомических структурах среднего уха [10]. В височной кости гломусные тельца сопровождают барабанный (или Якобсонов) нерв, ветвь языкоглоточного нерва, нерв Арнольда, ушную ветвь блуждающего нерва [8]. Паренхима параганглиев состоит из двух типов первичных клеток. Клетки I типа являются более распространенными и, как правило, круглыми с нечеткими границами. Клетки II типа имеют меньшие размеры и неправильную форму.
Большинство параганглиом основания черепа обнаруживаются по ходу барабанной ветви IX пары черепных нервов в адвентиции луковицы яремной вены (так называемый «яремный гломус»), в барабанных канальцах или по ходу малого каменистого нерва. Приблизительно 1—3% параганглиом производят катехоламины и могут быть локально инвазивными, но редко метастазируют [1, 11, 12]. Тимпанальные гломусные опухоли — параганглиомы среднего уха, растут из нерва Якобсона [13]. Термин «яремно-тимпанальный гломус» может быть использован, когда опухоль настолько большая, что нет возможности определить, откуда она исходит, или когда яремная гломусная опухоль распространяется в среднее ухо [14]. Новообразования обнаруживаются в 2—5 раз чаще у женщин, чем у мужчин [13].
Наследственной форме гломусной опухоли присущ аутосомно-доминантный тип наследования. Параганглиомы головы и шеи могут быть единственными или множественными. Множественные опухоли, как правило, встречаются при наследственных формах (в 30—40% наследственных случаев) [15].
Описано озлокачествление опухоли, что, вероятно, связано с мутациями генов P53 и p16INK4A [18]. Метастазирование гломусных опухолей при этом происходит примерно в 4% случаев [17,18]. Пропорциональное уменьшение доли клеток II типа и более слабое окрашивание клеток типа I, как было изучено, коррелируют с увеличением степени дифференцировки опухоли. Метастатическое поражение отличается от многоцентрового поражения в зависимости от местоположения. Метастазы обнаруживаются в легких, лимфатических узлах, печени, позвонках, ребрах и селезенке.
Этиология гломусных опухолей до сих пор остается неизвестной [14]. Однако анализ литературы, посвященной изучению спорадических случаев опухолей каротидных телец, показал более частое их распространение у людей, живущих на больших высотах над уровнем моря, и у людей с хронической обструктивной болезнью легких. Таким образом, в этиологии данных новообразований важную роль может играть хроническая гипоксия [19].
В настоящее время используются две обширные классификации гломусных опухолей, по Glasscock—Jackson [20] (табл. 1) и U. Fisch и D. Mattox [21] (табл. 2).

Таблица 1. Классификация по Glasscock—Jackson (1982 г.)

Таблица 2. Классификация по U. Fisch и D. Mattox (1988 г.)
«Золотым стандартом» лечения параганглиом является их хирургическое удаление, что особенно важно в ранние сроки опухолевого процесса, когда можно не только полностью удалить новообразование, но и улучшить качество жизни пациента, восстановив слух. Еще одним направлением лечения гломусных опухолей является лучевая терапия (гамма-нож). При отсутствии возможности полного удаления опухоли возможно сочетание хирургии и радиотерапии, замедляющей рост образования. При наличии противопоказаний к операции проводится только лучевая терапия [12, 17, 18].
Цель исследования — определить особенности хирургического лечения и послеоперационного ведения пациентов с различными типами гломусной опухоли.
Пациенты и методы
В клинике болезней уха, горла и носа Первого МГМУ им. И.М. Сеченова с 2014 г. по настоящее время находились 15 пациентов с гломусными опухолями среднего уха/височной кости типов А, В и С в возрасте от 27 до 63 лет (средний возраст — 47,2±11,6 года), 2 мужчин и 13 женщин. Распределение пациентов по распространенности новообразования в соответствии с классификацией U. Fisch и соавт. в модификации M. Sanna (2005 г.) представлено в табл. 3.

Таблица 3. Распределение пациентов по типу гломусной опухоли (классификация по U. Fisch, 1988)
Давность заболевания составляла от 2 до 8 лет (в среднем 5 лет). Частота встречаемости различных клинических проявлений гломусной опухоли у обследованных пациентов представлена в табл. 4.

Таблица 4. Клиническая симптоматика гломусных опухолей
Отоскопически выявлялось пульсирующее образование ярко-розового или красного цвета, прилежащее к барабанной перепонке, в некоторых случаях (3 пациента) барабанная перепонка отсутствовала, а новообразование выбухало в просвет слухового прохода.
При опухоли типа, А в дообследование включали МСКТ височных костей, а также аудиологическое исследование. При большей распространенности новообразования (тип В, С, D) всем пациентам обязательно проводили МСКТ и МРТ височных костей с контрастированием. Пример МРТ представлен на рисунке.
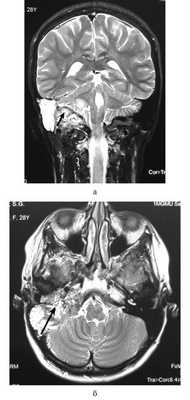
МРТ основания черепа. Гломусная опухоль c распространением в заднюю черепную ямку (стрелки). а — коронарная проекция; б — аксиальная проекция.
В некоторых случаях для уточнения взаимоотношений новообразования с внутренней сонной артерией проводили КТ или МР-ангиографию. Также пациенты были консультированы неврологом, отоневрологом и нейрохирургом. При опухолях типа В, С, D за сутки до предполагаемой операции выполняли селективную эмболизацию сосудов, питающих новообразование.
Результаты и обсуждение
В подавляющем большинстве случаев (14 пациентов) кровоснабжение опухоли осуществлялось из нескольких источников, преимущественно за счет ветвей восходящей глоточной и затылочной артерий. У 2 пациентов дополнительным источником кровоснабжения являлись ветви позвоночной артерии. У всех пациентов удалось добиться эмболизации всех ветвей, питающих опухоль, что позволило минимизировать интраоперационную кровопотерю, максимальный объем которой не превышал 500 мл. Кроме того, в ходе ангиографии уточнялись взаимоотношение новообразования с внутренней сонной артерией, аномалии строения последней, возможные дополнительные источники кровоснабжения из системы внутренней сонной артерии, проходимость внутренней яремной вены, сигмовидного синуса, а также исключали многоочаговость опухоли.
На этапе хирургического лечения проводили ревизию барабанной полости, при этом во всех случаях использовался заушный подход. При необходимости для лучшей визуализации гипотимпанума выполняли каналопластику, включающую снятие костных навесов, ограничивающих необходимый обзор. После удаления новообразования коагулировали питающие сосуды, располагавшиеся на промонториальной стенке или в области гипотимпанума. Оссикулярная система среднего уха у всех пациентов была интактна. В 4 случаях возникла необходимость проведения мирингопластики в связи с прорастанием новообразования в барабанную перепонку. При опухоли типа В дополнительно проводили вскрытие клеток сосцевидного отростка. При наличии гломусной опухоли яремной вены выполняли заушный разрез с переходом на шею, отступя 6 см от переходной складки с формированием надкостничного лоскута. После вскрытия всех клеток сосцевидного отростка, обнажения лицевого нерва с его последующим отведением кпереди выделяли и перевязывали яремную вену. Сигмовидный синус обнажали, перевязывали, а также дополнительно тампонировали с помощью гемостатических материалов. После перевязки сосудов новообразование удаляли вместе с частью яремной вены и сигмовидного синуса. У двух пациентов была обнаружена деструкция лицевого нерва гломусной опухолью на протяжении тимпанального и мастоидального отделов. В этом случае выполняли вставку фрагментов n. suralis или n. auriularis magnus. У одного пациента через 6 мес наблюдали постепенное восстановление функции лицевого нерва. Во втором случае отмечали слабую положительную динамику в виде уменьшения асимметрии лица в покое, что связано с длительным сроком пареза лицевого нерва до операции (более 2 лет).
При опухоли типа C во всех случаях новообразование интимно прилежало к твердой мозговой оболочке задней черепной ямки, в некоторых случаях при выделении опухоли отмечали линейные разрывы последней (5 пациентов). Проводили закрытие твердой мозговой оболочки фасцией височной мышцы с дополнительной герметизацией с помощью клея BioGlue («CryoLife, Inc.»). После чего послеоперационную полость заполняли жировой аутотканью, взятой с передней брюшной полости. У двух больных в послеоперационном периоде отмечали ликворею, которая в одном из случаев на 5-е сутки купировалась самостоятельно, в другом случае потребовалась установка люмбального дренажа, который был удален через 5 сут.
В послеоперационном периоде всем пациентам проводили антибиотикотерапию, системную гормональную терапию, симптоматическое лечение.
У пациентов с опухолью типа С и D (8 случаев) в послеоперационном периоде наблюдали парез лицевого нерва II — V степени по шкале Хаус—Брэкман. В послеоперационном периоде данной группе больных проводили лейкопластырное натяжение, лечебную гимнастику. Постепенное восстановление функции наблюдали в сроки от 10 дней до 7 мес.
Заключение
Гломусная опухоль, являясьдоброкачественной, обладает инвазивным ростом и может вызывать поражение черепных нервов, внутренней сонной артерии, головного мозга. До сих пор дискутабельным является преимущественный метод лечения данной группы новообразований, однако только с помощью хирургического лечения можно добиться полного удаления опухоли. Трудность локализации, близость к жизненно важным сосудисто-нервным образованиям, высокая степень васкуляризации, возможность распространения в полость черепа требуют мультидисциплинарного подхода с участием нейрохирургов, сосудистых хирургов, а также всестороннего предоперационного обследования данной группы пациентов и проведения эмболизации питающих сосудов. Не менее важным является выявление новообразования на ранней стадии и своевременное направление пациентов в высокоспециализированные стационары, для чего необходимо повышение информированности врачей поликлинического звена о данной патологии.
Конфликт интересов: авторы статьи подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Показания для стереотаксической операции при гломусной опухоли и ее эффективность
Стереотаксическая лучевая терапия используется для лечения большого числа внутричерепных опухолей, как доброкачественных, так и злокачественных. Для оториноларинголога она представляет интерес как метод лечения некоторых распространенных опухолей задней черепной ямки, в том числе акустических неврином, менингиом и гломусных опухолей. Далее мы кратко рассмотрим основные показания и исходы лечения для каждого из этих новообразований.
Акустические невриномы — это доброкачественные, медленнорастущие опухоли, которые происходят из шванновских клеток восьмого черепного нерва. На акустические невриномы приходится около 15% всех диагностированных внутричерепных опухолей.
Исторически существовало два направления в лечении этих больных: динамическое наблюдение и удаление с помощью микрохирургической техники. Стереотаксическая радиохирургия проводилась лишь пациентам, у которых имелись противопоказания к операции, а также в случаях рецидивирующей или остаточной опухоли как адъювантная терапия. Но в течение последних 20 лет появились надежные доказательства безопасности и эффективности этого метода лечения, поэтому на сегодняшний день акустические невриномы являются одним из самых распространенных показаний к стереотаксической радиохирургии.
Протоколы лечения, разработанные до 1992 года, подразумевали использование относительно высоких доз радиации, обычно изодозы составляли 16 Гр или больше. Показатели контроля опухолевого роста были превосходны, но число осложнений было также велико. У 21% пациентов развивался парез лицевого нерва, у 27% — онемение лица. С тех пор произошли значительные улучшения в технологиях визуализации и электронного подбора дозы, а сами дозы облучения снизились до 12-13 Гр. За счет этого удалось добиться значительного прогресса в результатах лечения.
Согласно последним исследованиям, при помощи гамма-ножа добиться контроля опухолевого роста удается в 91-98%. Под контролем опухолевого роста обычно понимают стабилизацию или уменьшение размера новообразования. Вероятность сохранения слуха в разных исследованиях приводится разная (50-78%), некоторые данные говорят о том, что в долгосрочной перспективе слух продолжает снижаться.
При использовании текущих предельных доз в 13 Гр или меньше паралич лицевого нерва возникает крайне редко. Временный парез отмечают примерно 1% больных. Аналогично, появление онемения или болей в области лица также встречается редко (1-4%). К менее распространенным осложнениям относят гидроцефалию (которая можно потребовать вентрикулоперитонеального шунтирования), судороги, и, крайне редко, радиационную малигнизацию. По всей видимости, риск этих осложнений выше при лечении крупных (больше 2,5 см) опухолей.
С целью сохранения слуха и предупреждения поражения черепных нервов были разработаны различные протоколы фракционированной стереотаксической лучевой терапии акустической невриномы. Применяют как гипофракционные режимы, подразумевающие проведение 3-6 сеансов, так и традиционные, вплоть до 30 сеансов. Несмотря на то, что теоретически стереотаксическая лучевая терапия должна обеспечивать наилучшие показатели контроля опухолевого роста, при сравнении традиционной фракционированной, гипофракционированной или нефракционированной стереотаксической терапии статистически значимой разницы выявить не удается.
И хотя первоначальные результаты исследований говорят в пользу безопасности и эффективности стереотаксической лучевой терапии, период наблюдения за больными в большинстве из этих работ был достаточно коротким. Даже спустя годы после лечения возможны отсроченный опухолевый рост, продолжающееся снижение слуха и поздние нейропатии черепных нервов. Очень важно, чтобы при исследовании исходов лечения состояние пациентов отслеживалось как можно дольше.
Оптимальная тактика лечения растущих акустических неврином небольшого и среднего размера до сих пор не разработана. Результаты микрохирургического и стереотаксического лечения опухолей размером до 3 см схожи. В таком случае оптимальный метод лечения будет во многом зависеть от предпочтений хирурга и возможностей лечебного учреждения, сопутствующих заболеваний и предпочтений пациента. Стереотаксическая лучевая терапия обычно не рекомендована при опухолях более 3 см и опухолях, сдавливающих ствол мозга, потому что в таком случае возрастает риск повреждения самого головного мозга.
Лучевая терапия остается надежным и безопасным методом лечения у пожилых пациентов, лиц с тяжелыми сопутствующими заболеваниями, а также у пациентов, нежелающих оперироваться. Также проведение адъювантной лучевой терапии показано при рецидивах и резидуальных опухолях.
Составление протокола лечения левосторонней акустической невриномы.
Отображен объем опухоли, линии 50% и 20% изодоз. Обратите внимание на контуры улитки и полукружных каналов.
Лечение планируется таким образом, чтобы минимизировать воздействие радиации на эти структуры.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Параганглиомы (гломусные опухоли) — это медленнорастущие, чаще всего доброкачественные гиперваскуляризованные опухоли нейроэндокринного происхождения. Опухоли каротидного гломуса происходят из параган-глионарных тканей адвентиции луковицы яремной вены. Поэтому они очень плотно контактируют с ЧН IX, X и XI.
Распространяясь по путям наименьшего сопротивления, через воздухоносные клетки гипотимпанума, окружающие сонную артерию и внутреннюю яремную вену, гломусные опухоли прорастают в яремное отверстие и заднюю черепную ямку. Лечение может быть как хирургическим, так и лучевым. Оптимальный метод лечения не определен, ведь эти опухоли находятся в крайне сложно устроенной области человеческого организма, в области основания черепа.
Также сложности возникают из-за гиперваскулярной природы опухоли и из-за того, что диагностируется она часто уже на поздней стадии. Микрохирургическое удаление позволяет добиваться крайне высоких показателей контроля опухолевого роста, до 90%. Но проведение хирургической операции на основании черепа сопряжено с большим риском осложнений и высокой летальности.
Традиционная фракционная лучевая терапия исторически доказала свою эффективность в обеспечении контроля опухолевого роста у больных, которым противопоказано проведение оперативного лечения. При назначении дозы в 45-55 Гр за 20-25 фракций добиться контроля опухолевого роста удается в 86-100% случаев. К сожалению, такое лечение также сопровождается значительным риском осложнений, включая остеорадионекроз, поражение черепных нервов, некроз паренхимы головного мозга.
В последние годы в лечении гломусных опухолей стали использовать различные техники стереотаксической радиохирургии (гамма-нож, модифицированные линейные ускорители, кибернож), чтобы добиться удовлетворительных результатов контроля опухолевого роста и снижения числа побочных эффектов лечения. Согласно результатам анализа объединенного массива данных нескольких исследований, стереотаксическая радиохирургия гамма-ножом со средней предельной дозой 15,3 Гр позволяла остановить рост опухоли в 91% случаев, число побочных эффектов минимально.
Средний период наблюдения за больными в этом исследовании составлял 40 месяцев. Согласно недавним данным, полученным при краткосрочных наблюдениях, превосходных результатов можно добиться за счет использования комбинированного подхода к лечению, когда после плановой субтотальной резекции пациенту проводится радиохирургическое лечение. Для того, чтобы лучше представлять себе все риски и преимущества того или иного метода, требуется проведение более длительных наблюдений.
До сих пор не существует единого мнения о том, какой метод лечения гломусных опухолей является оптимальным. Тем не менее, радиохирургия является превосходным выбором у пациентов преклонного возраста или с наличием тяжелых системных заболеваний, а также при двустороннем процессе. Также радиохирургия может выступать в качестве адъювантного лечения.
Микрохирургическое удаление показано в случае постепенного ухудшении неврологической симптоматики, развитии гидроцефалии и нарастании внутричерепного давления вследствие сдавления опухолью окружающих тканей. Относительными противопоказаниями к радиохирургии в качестве основного метода лечения считаются: отсутствие однозначно достоверного диагноза по данным КТ и МРТ; размер опухоли более 3 см; распространение опухоли за пределы основания черепа.
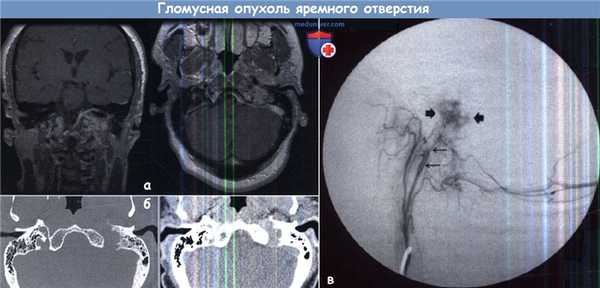
а - МРТ, на которой определяется крупная, дольчатая гетерогенная опухоль, интенсивно накапливающая контраст.
Центр опухоли находится в области левого яремного отверстия, рост деструктивный, с распространением в полость черепа до уровня мостомозжечкового угла и книзу до основания второго шейного позвонка.
б - Компьютерная томография височной кости и окружающих тканей, на которой определяется опухоль с инвазивным деструирующим ростом,
характерным для опухоли яремного гломуса, распространяющейся на основание черепа.
Опухоль разрушает левое яремное отверстие и левый подъязычный канал, прорастает в левую височную кость и левый затылочный мыщелок.
в - Артериограмма внутренней сонной артерии, вид сбоку, на котором определяется характерная сосудистая сеть гломусной опухоли (короткие стрелки).
Основные питающие сосуды идут из восходящей глоточной артерии (длинные стрелки).
Ключевые моменты:
• Стереотаксическая лучевая терапия может проводиться либо одноэтапно (такой метод лечения часто называют стереотаксической радиохирургией), либо в несколько этапов (фракционированная стереотаксическая лучевая терапия).
• Добиться значительного снижения числа побочных эффектов при проведении стереотаксического радиохирургического лечения акустической невриномы можно за счет уменьшения предельной дозы до 12-13 Гр.
• Согласно современным исследованиям, стереотаксическая лучевая терапия эффективна в лечении первичных и рецидивирующих акустических неврином малого и среднего размеров.
• Максимальный размер опухолей задней черепной ямки, при котором возможно изолированное применение лучевой терапии, составляет 3 см. Тем не менее, при более крупных опухолях стереотаксическую лучевую терапию можно использовать в сочетании с микрохирургическим удалением.
• Долгосрочный эффект стереотаксической лучевой терапии в отношении контроля опухолевого роста, сохранения слуха, риска поражений черепных нервов и малигнизации требует более подробного изучения в рамках крупных исследований.

Показания для стереотаксической операции при менингиоме и ее эффективность
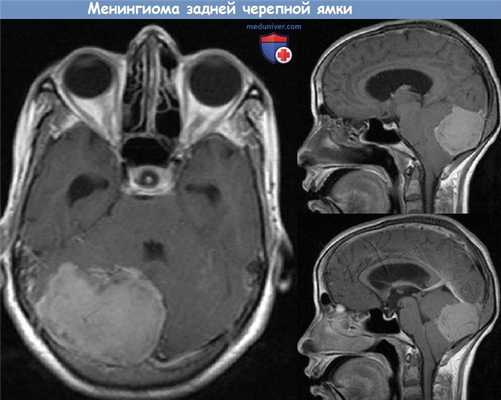
На менингиомы приходится порядка 25% всех интракраниальных опухолей, в 7-12% случаев они возникают в области задней черепной ямки. Обычно менингиомы представляют собой доброкачественные медленнорастущие опухоли, которые происходят из клеток менингеального эндотелия. Вызывать какие-либо симптомы обычно они начинают уже после того, как достигнут значительных размеров.
Оптимальным методом лечения остается полное удаление с использованием микрохирургической техники. К сожалению, полностью удалить менингиомы задней черепной ямки невероятно сложно, т.к. они находятся в непосредственной близости с важными сосудами и нервами. В публикациях приводятся различные сведения о частоте полного удаления (40-96%). Хирургическое удаление сопровождается большим риском осложнений (13-40%), смертности (0-13%) и рецидива (9-40%).
В последние годы стереотаксическая радиохирургия и стереотаксическая радиотерапия стали важными компонентами лечения менингиом задней черепной ямки и основания черепа, причем не только как адъювантная терапия при рецидиве или резидуальной опухоли, но также как полноценная замена традиционной открытой хирургии.
В обзоре опубликованных исследований показатели контроля опухолевого роста составляют 82-100%. Осложнения со стороны нервной системы встречаются менее чем в 10%. По сравнению с микрохирургическим удалением итоговый результат выглядит более благоприятным. К сожалению, длительность наблюдения за больными в большинстве исследований была относительно небольшой. Учитывая скрытое течение менингиом, для полноценного анализа отдаленных результатов лечения требуется длительное наблюдение.
Хирургическое лечение предпочтительно в том случае, если опухоль можно полностью удалить с минимальным риском осложнений. Другим показанием для оперативного лечения является декомпрессия, которая показана при прогрессировании неврологической симптоматики или сдавлении опухолью окружающих тканей. Также весьма ограничена роль лучевой терапии в лечении опухолей размером более 3 см.
Тем не менее, радиохирургическое лечение может проводиться после частичной резекции такой крупной опухоли. Обычно лучевая терапия показана пожилым больным с высоким риском внутриоперационных осложнений, пациентам, отказывающимся от операции, а также в случае рецидивирующей или резидуальной опухоли.

- Вернуться в оглавление раздела "отоларингология"
В течение последних десяти лет стереотаксическая лучевая терапия стала все чаще использоваться для лечения пациентов с акустическими невриномами и другими доброкачественными опухолями полости и основания черепа.
Добиться значительного улучшения результатов лечения стало возможным за счет внедрения новых методик лучевой диагностики, разработки новых систем доставки радиации и совершенствования программного обеспечения, которое рассчитывает дозу облучения.
Под стереотаксической лучевой терапией понимают использование мощного конформного излучения, которое доставляется к внутричерепной цели (опухоли) в форме множества точно откалиброванных пучков ионизирующей радиации. Целью стереотаксической лучевой терапии является подавление опухолевого роста с минимальным воздействием на окружающие здоровые ткани. Эта технология стала особенно полезна в лечении опухолей задней черепной ямки, где в непосредственной близости друг от друга расположено множество важнейших нервных и сосудистых образований, включая продолговатый мозг, мозжечок, улитку, преддверие, черепные нервы.
В стереотаксической лучевой терапии используются разные виды ионизирующего облучения. Лечение может проводиться либо одноэтапно (такой метод лечения часто называют стереотаксической радиохирургией), либо в несколько этапов (фракционированная стереотаксическая лучевая терапия).
Преимущество лучевой терапии заключается в том, что она позволяет добиваться значительного подавления опухолевого роста с минимальным числом побочных эффектов. Процедура является неинвазивной, ее можно выполнять в амбулаторных условиях. Основной недостаток заключается в том, что опухоль не устраняется полностью и продолжает существовать и после лечения. Следовательно, всегда имеется вероятность возобновления роста опухоли. Нам еще только предстоит изучить долгосрочные результаты и побочные эффекты стереотаксической лучевой терапии.
а) Виды излучения. Чаще всего в стереотаксической радиохирургии и стереотаксической лучевой терапии используют фотоны гамма-излучения и фотоны рентгеновского излучения. Фотоны гамма-излучения образуются при распаде радиоактивного атомного ядра, обычно кобальта 60. Фотоны рентгеновского излучения формируются в линейном ускорителе за счет столкновения ускоренных электронов с металлом. Пучки тяжелых заряженных частиц (т.е. протонов) также иногда используются в лучевой терапии за счет уникальных физических свойств.
К сожалению, доступность такого метода лечения и по сей день остается достаточно ограниченной, проводится оно только в некоторых специализированных центрах. Биологическая эффективность каждого из упомянутых выше источников излучения примерно одинакова.
б) Радиобиология. В клетках-мишенях под воздействием терапевтических доз радиации, повышается продукция свободных радикалов за счет активации эффекта комптоновского рассеяния. Первичным эффектом радиохирургии является запуск сосудистого фиброза, который приводит к снижению кровенаполнения опухоли. Имеются доказательства того, что использование более высоких доз радиации сопровождается непосредственным прямым повреждением клеток.
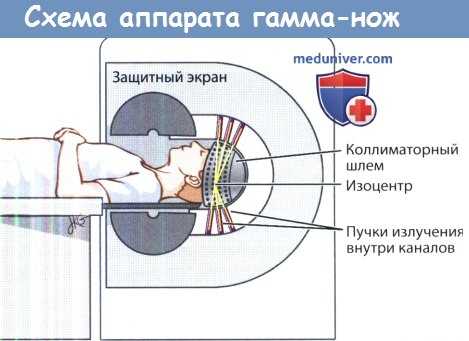
в) Гамма-нож. Установка гамма-ножа, разработанная Лекселлом в 1968 году, состоит из 201 полусферических источников пересекающихся гамма-лучей кобальта 60. Для того, чтобы сфокусировать каждый пучок в изоцентре образования, дополнительно используются защитные коллиматоры различных размеров. Изоцентром называется точка пространства, в которой пересекаются все пучки ионизирующего излучения; изоцентр устанавливается в пределах тканей, которые необходимо облучить.
Перед началом лечения к голове пациента жестко фиксируется стереотаксическая титановая координатная рама. Затем выполняется компьютерная томография (КТ) или магнитно-резонансная томография (МРТ), при необходимости выполняется слияние изображений КТ и МРТ. Титановая рама обеспечивает надежную иммобилизацию и позволяет откалибровать координаты цели в декартовой системе координат. Затем лечащая бригада локализует опухоль, а дозирующее программное обеспечение помогает разработать план подачи высоких доз лучевой терапии таким образом, чтобы максимально воздействовать на опухоль, но минимально на окружающие ткани.
В ходе планирования на нужном участке тканей размечается один или несколько изоцентров. Чтобы еще больше откалибровать конформность излучения относительно опухоли, делаются изменения в коллимационных отверстиях различного размера, корректируется размер изоцентров относительно друг друга.
Количество радиации, доставленное в рамках одной изодозы, измеряется в греях (Гр). К периферии опухоли происходит плавное снижение лучевой нагрузки. Во время планирования лечения этот градиент отображается как кривые изодоз, которые показывают, насколько процентов снизился объем облучения по сравнению с выписанной дозой. Обычно при лечении гамма-ножом к краям опухоли подается 50% от изначальной изодозы.
Когда планирование завершено, пациента укладывают, титановая рама фиксируется, на голову надевается коллиматорный кожух. После этого пациент перемещается внутрь аппарата. При этом необходимо убедиться в том, что целевая ткань остается в пределах изоцентра.
г) Линейные ускорители (LINAC). Существует альтернативная технология радиохирургии, основанная на работе линейных ускорителей. Эти системы основаны на действии ускоренных фотонов, которые находятся в ускорителе частиц, вращающимся вокруг головы пациента. За счет использования пучков энергии с различным расположением (дуги) достигается формирование конформной дозы облучения, которая доставляется к целевой ткани. Как и при работе гамма-ножа, доза, подающаяся на периферию опухоли, оказывается меньше, чем доза подающаяся к центру. При проведении традиционной однофракцинной стереорактической радиотерапии голову пациента требуется фиксировать при помощи рамы.
Некоторые линейные ускорители были модифицированы таким образом, чтобы стереотакические рамы можно было убирать и заменять быстрее и проще. Основное преимущество этих устройств заключается в том, что они позволяют проводить фракционную лучевую терапию, но при этом сохранять точность наведения за счет иммобилизации. Фракционная терапия позволяет добиваться более высоких показателей подавления опухолевого роста за счет того, что в течение нескольких сеансов на опухолевую ткань воздействует более высокая суммарная доза облучения, но при этом окружающие ткани остаются практически нетронутыми.
Это особенно важно при лечении опухолей больших размеров, а также опухолей, непосредственно прилегающих к головному мозгу, черепным нервам и улитке. Относительным недостатком этого метода лечения являются небольшие изменения в вычисляемом объеме опухоли между сессиями, поскольку стереотактическая рама постоянно снимается и перемещается.
д) Кибернож. Кибернож представляет собой инновационную безрамочную систему для проведения стереотаксической лучевой терапии, в которой легкий линейный ускоритель встроен в подвижный ротобизированный манипулятор. Отличие киберножа от других систем заключается в том, что поддержание ориентации осуществляется в режиме реального времени за счет постоянного анализа костной анатомии пациента. Роботизированный манипулятор вращает линейный ускоритель вдоль заранее определенных точек. Также кибернож использует неизоцентрический алгоритм планирования, который позволяет повысить конформность и гомогенность облучения.
Кроме того, лечение при помощи киберножа более комфортно для пациента, поскольку оно не требует использования жестких фиксационных систем. При помощи киберножа можно проводить фракционированное лечение.
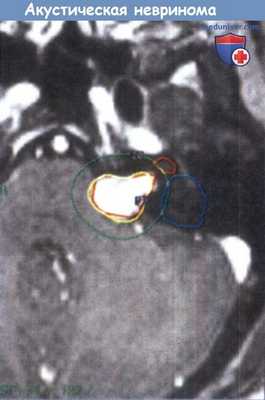
Составление протокола лечения левосторонней акустической невриномы.
Отображен объем опухоли, линии 50% и 20% изодоз. Обратите внимание на контуры улитки и полукружных каналов.
Лечение планируется таким образом, чтобы минимизировать воздействие радиации на эти структуры.
Читайте также:
