Посттрансляционная транслокация и транслоконы
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
В Translocon (широко известный как транслокатор или же канал транслокации) представляет собой комплекс белки связанный с перемещение из полипептиды через мембраны. [1] В эукариоты термин транслокон чаще всего относится к комплексу, который переносит зарождающиеся полипептиды с сигнальной последовательностью направленного действия во внутреннее (цистернальное или просветное) пространство эндоплазматический ретикулум (ER) из цитозоль. Этот процесс транслокации требует, чтобы белок пересек гидрофобный липидный бислой. Этот же комплекс используется также для интеграции зарождающихся белки в саму мембрану (мембранные белки ). В прокариоты подобный белковый комплекс транспортирует полипептиды через (внутреннюю) плазматическую мембрану или интегрирует мембранные белки. [2] Бактериальный патогены могут также собирать другие транслоконы в своих мембранах хозяина, что позволяет им экспортировать факторы вирулентности в свои клетки-мишени. [3]
В любом случае белковый комплекс формируется из Sec белки (Sec: секреторный), с гетротримерным Sec61 являясь каналом. [4] У прокариот комплекс гомологичных каналов известен как SecYEG. [5]
Содержание
Центральный канал
Канал транслокации представляет собой гетеротримерный белковый комплекс, называемый SecYEG у прокариот и Sec61 у эукариот. [6] Он состоит из субъединиц SecY, SecE и SecG. Структура этого канала в нерабочем состоянии была определена методом рентгеновской кристаллографии в археи. [5] SecY представляет собой субъединицу с крупными порами. На виде сбоку канал имеет форму песочных часов с воронками с каждой стороны. Внеклеточная воронка имеет небольшую «пробку», образованную из альфа-спираль. В середине мембраны находится конструкция, состоящая из порового кольца из шести гидрофобных аминокислот, которые выступают своими боковыми цепями внутрь. Во время транслокации белка пробка перемещается в сторону, и полипептидная цепь перемещается из цитоплазматической воронки через кольцо поры, внеклеточную воронку, во внеклеточное пространство. Гидрофобные сегменты мембранных белков выходят боком через боковые ворота в липидную фазу и становятся сегментами, пронизывающими мембрану. [5]
В Кишечная палочкаКомплексы SecYEG димеризуются на мембране. [7] У эукариот несколько копий Sec61 объединяются и образуют более крупный комплекс вместе с дополнительными компонентами, такими как олигосахарилтрансфераза комплекс, комплекс TRAP и мембранный белок TRAM (возможный шаперон). Для других компонентов, таких как сигнальная пептидаза комплекс и рецептор SRP неясно, в какой степени они только временно связываются с комплексом транслокона. [8]
Перемещение
Канал позволяет пептидам двигаться в любом направлении, поэтому для перемещения пептида в определенном направлении требуются дополнительные системы в транслоконе. Существует три типа транслокации: котрансляционная транслокация, которая происходит во время трансляции, и два типа посттрансляционной транслокации, которая происходит после транслокации, каждая из которых наблюдается у эукариот и бактерий. В то время как эукариоты разворачивают белок с BiP и использовать другие комплексы для транспортировки пептида, бактерии используют SecA АТФаза. [9]
Совместный перевод
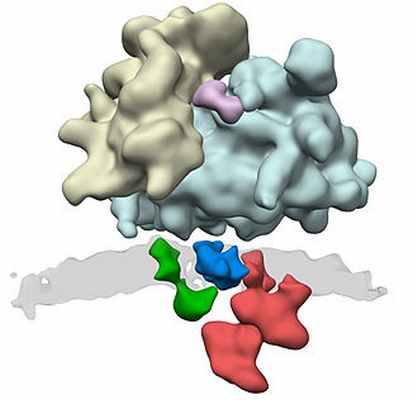
ЭР транслокон комплекс. Многие белковые комплексы участвуют в синтезе белка. Фактическое производство происходит в рибосомах (желтых и голубых). Через транслокон ER (зеленый: Sec61, синий: комплекс TRAP и красный: комплекс олигосахарилтрансферазы) вновь синтезированный белок транспортируется через мембрану (серый) внутрь ER. Sec61 является проводящим белок каналом, а OST добавляет сахарные фрагменты к формирующемуся белку.
При ко-трансляционной транслокации транслокон ассоциируется с рибосома так что растущая растущая полипептидная цепь перемещается из туннеля рибосомы в канал SecY. Транслокон (транслокатор) действует как канал через гидрофобную мембрану эндоплазматического ретикулума (после диссоциации SRP и продолжения трансляции). Возникающий полипептид проходит через канал в виде развернутой цепочки аминокислот, потенциально управляемой Броуновский храповик. После завершения трансляции сигнальная пептидаза отщепляет короткий сигнальный пептид от возникающего белка, оставляя полипептид свободным внутри эндоплазматического ретикулума. [10] [11]
У эукариот белки, которые должны быть перемещены в эндоплазматический ретикулум, распознаются сигнальная частица (SRP), который останавливает перевод полипептида рибосома в то время как он прикрепляет рибосому к рецептору SRP на эндоплазматическом ретикулуме. Это событие распознавания основано на конкретной N-концевой сигнальной последовательности, которая находится в нескольких первых кодонах синтезируемого полипептида. [9] Бактерии также используют SRP вместе с шапероном YidC, который похож на TRAM эукариот. [12] [9]
Транслокон также может перемещать и интегрировать мембранные белки в правильной ориентации в мембрану эндоплазматического ретикулума. Механизм этого процесса до конца не изучен, но включает распознавание и обработку транслоконом гидрофобных участков в аминокислотной последовательности, которым суждено стать трансмембранные спирали. Закрытый последовательностями остановки-переноса и открытый встроенными сигнальными последовательностями, вилка переключается между своим открытым и закрытым состояниями, чтобы разместить спирали в разных ориентациях. [9]
Пост-трансляционный
У эукариот посттрансляционная транслокация зависит от BiP и другие комплексы, в том числе SEC62 /SEC63 интегральный мембранный белок сложный. В этом режиме транслокации Sec63 помогает BiP гидролизовать АТФ, который затем связывается с пептидом и «вытягивает» его. Этот процесс повторяется для других молекул BiP, пока не пройдет весь пептид. [9]
В бактериях тот же процесс осуществляется «толкающей» АТФазой, известной как SecA, иногда с помощью комплекса SecDF на другой стороне, ответственной за вытягивание. [13] SecA-АТФаза использует механизм «толкни и сдвинь» для перемещения полипептида по каналу. В состоянии, связанном с АТФ, SecA взаимодействует посредством двухспирального пальца с подмножеством аминокислот в субстрате, проталкивая их (с гидролизом АТФ) в канал. Затем взаимодействие ослабевает, когда SecA входит в состояние, связанное с АДФ, позволяя полипептидной цепи пассивно скользить в любом направлении. Затем SecA захватывает следующий участок пептида, чтобы повторить процесс. [9]
ER-ретротранслокон
Транслокаторы также могут перемещать полипептиды (например, поврежденные белки, нацеленные на протеасомы ) из цистернального пространства эндоплазматического ретикулума в цитозоль. ER-белки деградируют в цитозоль к 26S протеасома, процесс, известный как деградация белков, связанная с эндоплазматическим ретикулумом, и поэтому должны транспортироваться по соответствующему каналу. Этот ретротранслокон все еще загадочен.
Первоначально считалось, что канал Sec61 отвечает за этот ретроградный транспорт, подразумевая, что транспорт через Sec61 не всегда является однонаправленным, но также может быть двунаправленным. [14] Однако структура Sec61 не поддерживает эту точку зрения, и предполагается, что несколько различных белков ответственны за транспорт из просвета ER в цитозоль. [15]
Смотрите также
Рекомендации
Нацеливание на белок - Protein targeting
Нацеливание на белок или же сортировка белков это биологический механизм, с помощью которого белки доставляются в соответствующие пункты назначения в ячейке или за ее пределами. Белки могут быть нацелены на внутреннее пространство органелла, различные внутриклеточные мембраны, плазматическая мембрана, или к внешней стороне ячейки через секреция. Этот процесс доставки осуществляется на основе информации, содержащейся в самом белке. Правильная сортировка имеет решающее значение для клетки; ошибки могут привести к заболеваниям.
Содержание
Сигналы прицеливания
Сигналы нацеливания - это фрагменты информации, которые позволяют клеточному транспортному механизму правильно позиционировать белок внутри или вне клетки. Эта информация содержится в полипептидная цепь или в свернутом протеине. Непрерывный участок аминокислота остатки в цепи, которые обеспечивают нацеливание, называются сигнальные пептиды или нацеленные пептиды. Существует два типа нацеливающих пептидов: преследовательности и внутренние нацеливающие пептиды. Предварительные последовательности нацеливающего пептида часто обнаруживаются на N-конце и состоят из 6-136 основных и гидрофобных аминокислот. В случае пероксисом нацеленная последовательность в основном находится на С-конце. Другие сигналы, известные как сигнальные патчи, состоят из частей, которые в первичная последовательность. Они становятся функциональными, когда складывание объединяет их на поверхности белка. Кроме того, модификации белков подобные гликозилирования могут вызывать нацеливание.
Транслокация белков
В 1970 г. Гюнтер Блобель провели эксперименты по перемещению белков через мембраны. Награжден орденом 1999 г. Нобелевская премия за его находки. [1] Он обнаружил, что у многих белков есть сигнальная последовательность, то есть короткое аминокислота последовательность на одном конце, которая функционирует как Почтовый индекс для органеллы-мишени. В перевод из мРНК в белок рибосома происходит в цитозоль. Если синтезированные белки «принадлежат» другой органелле, они могут транспортироваться туда одним из двух способов в зависимости от белка: ко-транслокационная транслокация (транслокация в процессе транслокации) и посттрансляционная транслокация (транслокация после процесса транслокации). перевода завершен).
Ко-трансляционная транслокация
Большинство белков, которые являются секреторными, мембраносвязанными или находятся в эндоплазматический ретикулум (ER), гольджи или же эндосомы использовать путь ко-трансляционной транслокации. Этот процесс начинается с N-терминала сигнальный пептид белка, распознаваемого частица распознавания сигнала (SRP) пока белок все еще синтезируется на рибосоме. Синтез приостанавливается, пока рибосомно-белковый комплекс переносится на Рецептор SRP на ER в эукариоты, а плазматическая мембрана в прокариоты. Там зарождающийся белок вставляется в транслокон, проводящий канал мембраносвязанного белка, состоящий из Комплекс транслокации Sec61 у эукариот, а гомологичные SecYEG комплекс у прокариот. В секреторных белках и типе I трансмембранные белки, сигнальная последовательность немедленно отщепляется от растущего полипептида, как только он был перемещен в мембрану ER (эукариоты) или плазматическую мембрану (прокариоты) посредством сигнальная пептидаза. Сигнальная последовательность мембранных белков типа II и некоторых политопных мембранных белков не отщепляется и поэтому называется сигнальными якорными последовательностями. Внутри ER белок сначала покрывается шаперонный белок чтобы защитить его от высокой концентрации других белков в ER, давая ему время складывать правильно. После сворачивания белок при необходимости модифицируется (например, с помощью гликозилирование ), затем транспортируется к Гольджи для дальнейшей обработки и направляется к органеллам-мишеням или удерживается в ЭР различными Удержание ER механизмы.
Аминокислотная цепь трансмембранные белки, которые часто трансмембранные рецепторы, проходит через мембрану один или несколько раз. Они вставляются в мембрану посредством транслокации, пока процесс не будет прерван последовательностью остановки-переноса, также называемой мембранным якорем или сигнально-якорной последовательностью. Эти сложные мембранные белки в настоящее время в основном изучены с использованием той же модели нацеливания, которая была разработана для секреторных белков. Однако многие сложные мульти-трансмембранные белки содержат структурные аспекты, которые не соответствуют модели. Семь трансмембранных рецепторов, связанных с G-белком (которые составляют около 5% генов у человека), в большинстве случаев не имеют амино-концевой сигнальной последовательности. В отличие от секреторных белков, первый трансмембранный домен действует как первая сигнальная последовательность, которая направляет их на мембрану ER. Это также приводит к перемещению аминоконца белка в просвет мембраны ER. Это, по-видимому, нарушает правило «ко-трансляционной» транслокации, которое всегда соблюдалось для белков млекопитающих, нацеленных на ER. Это было продемонстрировано с помощью опсин с экспериментами in vitro. [2] [3] Многое из механизмов трансмембранной топологии и фолдинга еще предстоит выяснить.
Посттрансляционная транслокация
Несмотря на то, что большинство секреторных белков транслоцируются совместно, некоторые из них транслируются в цитозоль и позже транспортируется в ER / плазматическую мембрану посттрансляционной системой. У прокариот для этого требуются определенные кофакторы, такие как SecA и SecB. Этому пути способствует Sec62 и Sec63, два мембраносвязанных белка. Комплекс Sec63 встроен в мембрану ER. Комплекс Sec63 вызывает гидролиз АТФ, что позволяет белкам-шаперонам связываться с открытой пептидной цепью и перемещать полипептид в просвет ER. Попадая в просвет, полипептидная цепь может правильно складываться. Это происходит только в развернутых белках, находящихся в цитозоле. [4]
Кроме того, белки, предназначенные для других целей, например митохондрии, хлоропласты, или же пероксисомы используйте специализированные посттрансляционные пути. Кроме того, белки, нацеленные на ядро, перемещаются после трансляции. Они проходят через ядерная оболочка через ядерные поры.
Сортировка белков
Митохондрии
Три митохондриальный внешняя мембрана рецепторы известны:
TOM70 Связывается с пептидами внутреннего нацеливания и действует как точка стыковки цитозольных шаперонов. TOM20 Связывает предследовательности TOM22 Связывает как предпоследовательности, так и пептиды внутреннего нацеливания
Канал ТОМ (TOM40 ) это катион специфический канал высокой проводимости с молекулярный вес из 410 кДа и поры диаметр 21Å.
Транслоказа-23 (TIM23) локализована в митохондриальная внутренняя мембрана и действует как порообразующий белок, который связывает белки-предшественники с его N-конец. TIM23 действует как транслокатор для препротеинов для митохондриального матрикса, внутренней митохондриальной мембраны, а также для межмембранного пространства. TIM50 связан с TIM23 на внутренней стороне митохондрий и, как было обнаружено, связывает пре-последовательности. TIM44 связан на стороне матрицы и обнаружен связывающимся с mtHsp70.
Транслоказа-препоследовательность 22 (TIM22) связывает препротеины, связанные исключительно с внутренней митохондриальной мембраной.
Митохондриальный матрикс Нацеливающие последовательности богаты положительно заряженными аминокислотами и гидроксилированными.
Белки нацелены на субмитохондриальные компартменты множеством сигналов и несколькими путями.
Нацелившись на внешнюю мембрану, межмембранное пространство, а внутренняя мембрана часто требует другой сигнальной последовательности в дополнение к последовательности нацеливания на матрикс.
Хлоропласты
Препротеин для хлоропласты может содержать последовательность импорта стромы или последовательность направленного действия на строму и тилакоид. Большинство препротеинов перемещается через комплексы Toc и Tic, расположенные внутри оболочки хлоропласта. В строме последовательность импорта стромы отщепляется и складывается, а также происходит внутрихлоропластная сортировка для тилакоиды продолжается. Белки, нацеленные на оболочку хлоропластов, обычно не имеют расщепляемой сортировочной последовательности.
И хлоропласты, и митохондрии
Многие белки необходимы в обоих митохондрии и хлоропласты. [5] Обычно пептид с двойным нацеливанием имеет промежуточный характер по сравнению с двумя специфическими пептидами. Направляющие пептиды этих белки имеют высокое содержание основных и гидрофобный аминокислоты, низкое содержание отрицательно заряженных аминокислоты. В них меньше аланина и больше лейцина и фенилаланина. Белки с двойной мишенью имеют более гидрофобный целевой пептид, чем митохондриальные и хлоропластные. Однако утомительно предсказать, является ли пептид двойной мишенью или нет, на основе его физико-химический характеристики.
Пероксисомы
Все пероксисомальный белки кодируются ядерными генами.
На сегодняшний день известно два типа Сигналы нацеливания на пероксисомы (PTS):
Сигнал нацеливания пероксисомы 1 (PTS1): С-концевой трипептид с консенсусной последовательностью (S / A / C) - (K / R / H) - (L / A). Самый распространенный PTS1 - это серин -лизин -лейцин (SKL). Большинство белков пероксисомального матрикса обладают сигналом типа PTS1.
Сигнал нацеливания на пероксисомы 2 (PTS2): нонапептид, расположенный рядом с N-концом, с консенсусной последовательностью (R / K) - (L / V / I) -XXXXX- (H / Q) - (L / A / F) (где X может быть любой аминокислотой ).
Есть также белки, которые не обладают ни одним из этих сигналов. Их транспорт может быть основан на так называемом «обратном» механизме: такие белки связываются с белками матрикса, обладающими PTS1, и вместе с ними перемещаются в пероксисомальный матрикс.
Болезни
Транспорт пероксисомального белка нарушен при следующих генетических заболеваниях:
У бактерий и архей
Как обсуждалось выше (см. транслокация белков ), большинство прокариотических мембраносвязанных и секреторных белков нацелены на плазматическую мембрану либо путем совместной трансляции, в котором используется бактериальный SRP, либо путем посттрансляционного пути, который требует SecA и SecB. На плазматической мембране эти два пути доставляют белки к транслокону SecYEG для транслокации. Бактерии могут иметь единственную плазматическую мембрану (Грамположительные бактерии ), или внутренняя мембрана плюс внешняя мембрана, разделенная периплазма (Грамотрицательные бактерии ). Помимо плазматической мембраны, у большинства прокариот отсутствуют связанные с мембраной органеллы, как у эукариот, но они могут собирать белки на различных типах включений, таких как газовые везикулы и накопительные гранулы.
Грамотрицательные бактерии
У грамотрицательных бактерий белки могут быть включены в плазматическую мембрану, внешнюю мембрану, периплазму или секретироваться в окружающую среду. Системы секретирования белков через внешнюю бактериальную мембрану могут быть довольно сложными и играть ключевую роль в патогенезе. Эти системы можно описать как секрецию типа I, секрецию типа II и т. Д.
Грамположительные бактерии
У большинства грамположительных бактерий определенные белки нацелены на экспорт через плазматическую мембрану и последующее ковалентное прикрепление к стенке бактериальной клетки. Специализированный фермент, сортировка, расщепляет целевой белок в характерном сайте узнавания рядом с С-концом белка, таком как мотив LPXTG (где X может быть любой аминокислотой), затем переносит белок на клеточную стенку. Обнаружено несколько аналогичных систем, которые также имеют сигнатурный мотив на внецитоплазматической поверхности, С-концевой трансмембранный домен и кластер основных остатков на цитозольной поверхности на крайнем С-конце белка. PEP-CTERM /экзосортаза система, обнаруженная у многих грамотрицательных бактерий, по-видимому, связана с внеклеточное полимерное вещество производство. Система PGF-CTERM / археосортаза А в археи относится к S-слой производство. Система GlyGly-CTERM / ромбосортаза, обнаруженная у Shewanella, Vibrio и некоторых других родов, по-видимому, участвует в высвобождении протеаз, нуклеаз и других ферментов.
Выявление мотивов нацеливания на белок в белках
Minimotif Майнер представляет собой инструмент биоинформатики, который выполняет поиск по запросам последовательности белка для известных мотивов последовательности, нацеленной на белок.
Таргетинг на белок
Таргетинг на белок или сортировка белков - это биологический механизм, с помощью которого белки транспортируются в соответствующие места назначения в клетке или вне ее. Белки могут быть нацелены во внутреннее пространство органеллы, различных внутриклеточных мембран, плазматической мембраны или снаружи клетки посредством секреции. Этот процесс доставки осуществляется на основе информации, содержащейся в самом белке. Правильная сортировка имеет решающее значение для клетки; ошибки могут привести к заболеваниям.
Содержание
- 1 Сигналы нацеливания
- 2 Транслокация белков
- 2.1 Ко-транслокационная транслокация
- 2.2 Посттрансляционная транслокация
- 3.1 Митохондрии
- 3.2 Хлоропласты
- 3.3 И хлоропласты, и митохондрии
- 3.4 Пероксисомы
- 3.5 Заболевания
- 4.1 Грамотрицательные бактерии
- 4.2 Грамположительные бактерии
Сигналы нацеливания
Сигналы нацеливания - это фрагменты информации, которые позволяют клеточным транспортным механизмам правильно позиционировать белок внутри или снаружи клетка. Эта информация содержится в полипептидной цепи или в свернутом белке. Непрерывный участок аминокислотных остатков в цепи, обеспечивающий нацеливание, называется сигнальными пептидами или нацеливающими пептидами. Существует два типа нацеливающих пептидов: преследовательности и внутренние нацеливающие пептиды. Предварительные последовательности нацеливающего пептида часто обнаруживаются на N-концевом удлинении и состоят из 6-136 основных и гидрофобных аминокислот. В случае пероксисом нацеленная последовательность в основном находится на С-конце. Другие сигналы, известные как сигнальные фрагменты, состоят из частей, которые отделены от основной последовательности . Они становятся функциональными, когда сворачивание сводит их вместе на поверхности белка. Кроме того, модификации белка, такие как гликозилирование, могут вызывать нацеливание.
Транслокация белков
В 1970 году Гюнтер Блобель провел эксперименты по перемещению белков через мембраны. За свои открытия он был удостоен Нобелевской премии 1999 года. Он обнаружил, что многие белки имеют сигнальную последовательность, то есть короткую аминокислотную последовательность на одном конце, которая функционирует как почтовый индекс для органеллы-мишени. трансляция мРНК в белок с помощью рибосомы происходит в цитозоле. Если синтезированные белки «принадлежат» другой органелле, они могут транспортироваться туда одним из двух способов в зависимости от белка: ко-транслокационная транслокация (транслокация в процессе трансляции) и посттрансляционная транслокация (транслокация после процесса транслокации). перевода завершен).
Ко-транслокационная транслокация
Большинство белков, которые являются секреторными, мембраносвязанными или находятся в эндоплазматическом ретикулуме (ER), golgi или эндосомы используют путь совместной транслокации. Этот процесс начинается с того, что N-концевой сигнальный пептид белка распознается частицей распознавания сигнала (SRP), в то время как белок все еще синтезируется на рибосоме. Синтез приостанавливается, пока комплекс рибосома-белок переносится к рецептору SRP на ER у эукариот и на плазматическую мембрану прокариот. Там зарождающийся белок вставляется в транслокон, мембранно-связанный белок, проводящий канал, состоящий из комплекса транслокации Sec61 у эукариот и гомологичного комплекса SecYEG у прокариот. В секреторных белках и трансмембранных белках типа I сигнальная последовательность немедленно отщепляется от формирующегося полипептида, как только он был перемещен в мембрану ER (эукариоты) или плазматическую мембрану (прокариоты) сигналом пептидаза. Сигнальная последовательность мембранных белков типа II и некоторых политопных мембранных белков не отщепляется и поэтому называется сигнальными якорными последовательностями. Внутри ER белок сначала покрывается белком-шапероном, чтобы защитить его от высокой концентрации других белков в ER, давая ему время для правильного раза. После сворачивания белок модифицируется по мере необходимости (например, путем гликозилирования ), затем транспортируется к Гольджи для дальнейшей обработки и направляется к его органеллам-мишеням или сохраняется в ER за счет различных удержаний ER механизмы.
Аминокислотная цепь трансмембранных белков, которые часто являются трансмембранными рецепторами, проходит через мембрану один или несколько раз. Они вставляются в мембрану посредством транслокации, пока процесс не будет прерван последовательностью остановки-переноса, также называемой мембранной якорем или сигнально-якорной последовательностью. Эти сложные мембранные белки в настоящее время в основном изучены с использованием той же модели нацеливания, которая была разработана для секреторных белков. Однако многие сложные мульти-трансмембранные белки содержат структурные аспекты, которые не соответствуют модели. Семь трансмембранных рецепторов, связанных с G-белком (которые составляют около 5% генов у человека), в большинстве случаев не имеют амино-концевой сигнальной последовательности. В отличие от секреторных белков, первый трансмембранный домен действует как первая сигнальная последовательность, которая направляет их на мембрану ER. Это также приводит к перемещению аминоконца белка в просвет мембраны ЭР. Это, по-видимому, нарушает правило «ко-трансляционной» транслокации, которое всегда соблюдалось для белков млекопитающих, нацеленных на ER. Это было продемонстрировано с опсином в экспериментах in vitro. Многое из механизмов трансмембранной топологии и фолдинга еще предстоит выяснить.
Посттрансляционная транслокация
Несмотря на то, что большинство секреторных белков транслоцируются совместно, некоторые из них транслируются в цитозоле, а затем транспортируются в ЭР / плазматическую мембрану посредством посттрансляционная система. У прокариот для этого требуются определенные кофакторы, такие как SecA и. Этому пути способствуют два мембраносвязанных белка и. Комплекс Sec63 встроен в мембрану ER. Комплекс Sec63 вызывает гидролиз АТФ, что позволяет белкам-шаперонам связываться с открытой пептидной цепью и перемещать полипептид в просвет ER. Попадая в просвет, полипептидная цепь может правильно складываться. Это происходит только в развернутых белках, которые находятся в цитозоле.
Кроме того, белки, нацеленные на другие места назначения, такие как митохондрии, хлоропласты или пероксисомы, используйте специализированные посттрансляционные пути. Кроме того, белки, нацеленные на ядро, перемещаются после трансляции. Они проходят через ядерную оболочку через ядерные поры.
Сортировка белков
Митохондрии
Большинство митохондриальных белков синтезируются как цитозольные предшественники, содержащие сигналы поглощения пептидов. Цитозольные шапероны доставляют препротеины к рецепторам, связанным с каналом в митохондриальной мембране. препротеин с препоследовательностью, нацеленной на митохондрии, связывается рецепторами и общей импортной порой (GIP) (рецепторы и GIP вместе известны как транслоказа внешней мембраны. или TOM) на внешней мембране. Препротеин перемещается через TOM в виде шпилечных петель. Препротеин транспортируется через межмембранное пространство небольшими TIM (которые также действуют как молекулярные шапероны ) к TIM23 или 22 (транслоказа внутренней мембраны) на внутренней мембране. В матрице нацеленная последовательность отщепляется mtHsp70.
Известны три митохондриальных внешней мембраны рецептора :
TOM70 Связывается с внутренними нацеливающими пептидами и действует как точка стыковки для цитозольных шаперонов. TOM20 Связывает пре-последовательности TOM22 Связывает как пре-последовательности, так и внутренние целевые пептиды
Канал TOM (TOM40 ) представляет собой канал катион с высокой проводимостью с молекулярной массой 410 кДа и диаметром пор 21Å.
Транслоказа-препоследовательность 23 (TIM23) локализована на внутренней мембране митохондрий и действует как порообразующий белок, который связывает белки-предшественники своим N-концом. TIM23 действует как транслокатор для препротеинов для митохондриального матрикса, внутренней митохондриальной мембраны, а также для межмембранного пространства. TIM50 связан с TIM23 на внутренней стороне митохондрий и, как было обнаружено, связывает пре-последовательности. TIM44 связывается на стороне матрицы и обнаруживает связывание с mtHsp70.. Транслоказа-препоследовательность 22 (TIM22) связывает препротеины, связанные исключительно с внутренней митохондриальной мембраной.
Нацеливающие последовательности митохондриального матрикса богаты положительно заряженными аминокислотами и гидроксилированными.
Белки попадают в субмитохондриальные компартменты множеством сигналов и разными путями.
Нацеливание на внешнюю мембрану, межмембранное пространство и внутреннюю мембрану часто требует другой сигнальной последовательности в дополнение к последовательности нацеливания на матрицу.
Хлоропласты
Препротеин для хлоропластов может содержать последовательность импорта стромы или последовательность направленного действия на строму и тилакоид. Большинство препротеинов перемещается через комплексы Toc и Tic, расположенные внутри оболочки хлоропласта. В строме последовательность импорта стромы отщепляется и сворачивается, а также продолжается внутрихлоропластная сортировка до тилакоидов. Белки, нацеленные на оболочку хлоропластов, обычно не имеют расщепляемой сортировочной последовательности.
И хлоропласты, и митохондрии
Многие белки необходимы как в митохондриях, так и в хлоропластах. Обычно пептид с двойным нацеливанием имеет промежуточный характер по сравнению с двумя специфическими пептидами. Нацеливающие пептиды этих белков имеют высокое содержание основных и гидрофобных аминокислот, низкое содержание отрицательно заряженных аминокислот. В них меньше аланина и больше лейцина и фенилаланина. Белки с двойной мишенью имеют более гидрофобный целевой пептид, чем митохондриальные и хлоропластные. Однако сложно предсказать, является ли пептид двойной мишенью или нет, основываясь на его физико-химических характеристиках.
Пероксисомы
Все пероксисомальные белки кодируются ядерными генами.
На сегодняшний день известно два типа сигналов нацеливания на пероксисомы (PTS):
Сигнал нацеливания на пероксисомы 1 (PTS1) : C-концевой трипептид с согласованной последовательностью (S / A / C) - (K / R / H) - (L / A). Наиболее распространенным PTS1 является серин - лизин - лейцин (SKL). Большинство белков пероксисомального матрикса обладают сигналом типа PTS1.
Направляющий сигнал пероксисомы 2 (PTS2) : нонапептид, расположенный рядом с N-концом, с консенсусной последовательностью (R / K) - (L / V / I) -XXXXX- (H / Q) - (L / A / F) (где X может быть любой аминокислотой).
Есть также белки, которые не обладают ни одним из этих сигналов. Их транспорт может быть основан на так называемом «обратном» механизме: такие белки связываются с белками матрикса, обладающими PTS1, и вместе с ними перемещаются в пероксисомальный матрикс.
Заболевания
Транспорт пероксисомальных белков нарушен при следующих генетических заболеваниях:
У бактерий и архей
Как обсуждалось выше (см. транслокация белков ), большинство прокариотических мембраносвязанных и секреторных белков нацелены на плазматическую мембрану либо путем совместной трансляции, в котором используются бактериальные SRP или посттрансляционный путь, требующий SecA и SecB. На плазматической мембране эти два пути доставляют белки к транслокону SecYEG для транслокации. Бактерии могут иметь одну плазматическую мембрану (грамположительные бактерии ) или внутреннюю мембрану плюс внешнюю мембрану, разделенную периплазмой (грамотрицательные бактерии ). Помимо плазматической мембраны, у большинства прокариот отсутствуют связанные с мембраной органеллы, как у эукариот, но они могут собирать белки на различных типах включений, таких как газовые везикулы и накопительные гранулы.
Грамотрицательные бактерии
У грамотрицательных бактерий белки могут быть включены в плазматическую мембрану, внешнюю мембрану, периплазму или секретироваться в окружающую среду. Системы секретирования белков через внешнюю бактериальную мембрану могут быть довольно сложными и играть ключевую роль в патогенезе. Эти системы могут быть описаны как секреция типа I, секреция типа II и т. Д.
грамположительные бактерии
У большинства грамположительных бактерий определенные белки нацелены на экспорт через плазматическую мембрану и последующее ковалентное прикрепление к стенке бактериальной клетки. Специализированный фермент, сортаза, расщепляет целевой белок в характерном сайте узнавания рядом с С-концом белка, таком как мотив LPXTG (где X может быть любой аминокислотой), а затем переносит белок в клетку. стена. Обнаружено несколько аналогичных систем, которые также имеют сигнатурный мотив на внецитоплазматической поверхности, С-концевой трансмембранный домен и кластер основных остатков на цитозольной поверхности на крайнем С-конце белка. Система PEP-CTERM / экзосортаза, обнаруженная у многих грамотрицательных бактерий, по-видимому, связана с образованием внеклеточного полимерного вещества. Система PGF-CTERM / археосортаза A в архее связана с продукцией S-слоя. Система GlyGly-CTERM / ромбосортаза, обнаруженная у Shewanella, Vibrio и некоторых других родов, по-видимому, участвует в высвобождении протеаз, нуклеаз и других ферментов.
Выявление мотивов нацеливания на белок в белках
Minimotif Miner - это инструмент биоинформатики, который выполняет поиск по запросам последовательности белков на предмет известных мотивов последовательности нацеливания на белок.
Посттрансляционная транслокация и транслоконы
Посттрансляционная транслокация и транслоконы
• Посттрансляционная транслокация происходит независимо от рибосом и SRP
• Посттрансляционная транслокация широко распространена у дрожжей и в меньшей степени у высших эукариот
• Посттрансляционные транслоконы по составу отличаются от котрансляционных транслоконов, однако они представляют собой одни и те же каналы
При котрансляционной транслокации адресование и инициация транслокации белка происходят на очень раннем этапе синтеза новообразованной цепи. Это предотвращает формирование в цитозоле нативной структуры белка, не способной к транслокации. Другой путь транслокации включает полный синтез белка в цитозоле, где его молекула не приобретает нативной структуры, и поэтому может быть транслоцирована.
Такая посттрансляционная транслокация особенно характерна для одноклеточных эукариот, но может происходить и у высших. Эта форма транслокации не зависит от SRP и рибосом и отличается от котрансляционной транслокации по способу реализации и по механизму.
Первым свидетельством в пользу существования второго пути адресования и транслокации было наблюдение о том, что многие белки дрожжей способны к транслокации in vitro, даже после того, как сошли с рибосом. В соответствии с этим наблюдением показано: клетки S. cerevisiae, где отсутствует SRP, жизнеспособны, и многие белки сохраняют способность к транслокации в таких клетках.
Сейчас стало очевидным, что в нормальных условиях для некоторых дрожжевых белков используется только один из двух путей транслокации, однако во многих случаях эффективно используются оба.
Посттрансляционная транслокация характеризуется отсутствием цитозольного фактора, узнающего сигнальные последовательности. Использование того или иного пути транслокации, по-видимому, определяется степенью гидрофобности сигнальной последовательности, которая предоставляет способность взаимодействовать с SRP.
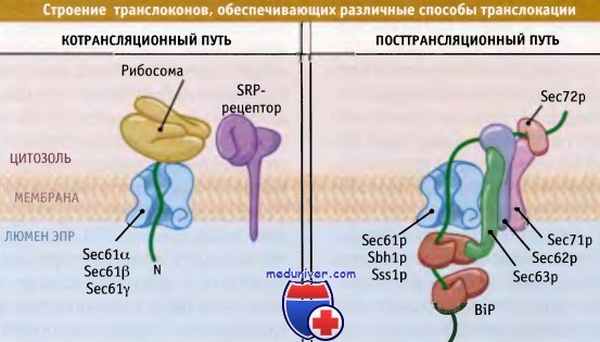
![Строение транслоконов]()
Различные белки взаимодействуют с одним и тем же каналом,
обеспечивая котрансляционную или посттрансляционную транслокацию.При отсутствии взаимодействия трансляция не задерживается, и белок подвергается адресованию и транслокации уже после окончания синтеза.
Одно из последствий быстрого адресования при котрансляционной транслокации заключается в том, что в цитозоле у субстратов транслокации не образуется нативной структуры. До адресования длина пептида, выходящего из рибосомы, недостаточна для образования нативной структуры, и вместе с тем нативная структура не может образоваться в ограниченном пространстве канала.
Напротив, образование нативной структуры в цитозоле у посттрансляционно транслоцируемых субстратов ингибируется при их взаимодействии с шаперонами семейства hsp70. Эти белки используют энергию гидролиза АТФ для обратимого связывания с посттрансляционно измененными белками, тем самым предотвращая образование их нативной структуры или их агрегацию. При этом белки получают возможность взаимодействовать с каналом.
В посттрансляционной транслокации не участвует такой компонент, как SRP, который узнает сигнальную последовательность до момента ее позиционирования на мембране. Вместо этого белок транспортируется к транслокону с участием мультибелкового комплекса, который является частью посттрансляционного транслокона. Так же как и котрансляционный транслокон, он содержит тримерный комплекс Sec61.
Однако в посттрансляционном транслоконе также присутствуют четыре других белка (Sec62p, Sec63p, Sec71p и Sec72p). Эти белки образуют субкомплекс, большие домены которого открываются в цитозоль и в люмен. Один или несколько этих доменов участвуют в адресовании субстратов, хотя его механизм пока остается невыясненным.
Предполагается, что для транслокации белков через внешнюю мембрану хлоропластов также используется центральный канал, связанный с дополнительными белками. В общем, такой способ переноса белков через мембрану дает возможность гибко регулировать процесс транслокации субстратов и не использовать отдельные каналы для каждого типа белков. Сходным образом регулируется экспрессия генов факторами транскрипции, которые связываются только с промоторами определенных генов, включая и выключая транскрипцию путем взаимодействия с комплексом РНК-полимеразы.
После позиционирования цепи на транслоконе сигнальная последовательность узнается канальными белками, так же как это имеет место при котрансляционной транслокации. Поскольку адресование не зависит от SRP, этот этап приобретает особую важность, так как должен гарантировать отсутствие транслокации белков цитозоля. Так же как и при контрансляционной транслокации, к открытию канала при посттрансляционном переносе приводит узнавание сигнальной последовательности.
По-видимому, способность канала, а не SRP узнавать посттрансляционно позиционированную сигнальную последовательность позволяет предполагать, что, хотя связывание последовательности определяется ее гидро-фобностью, на ее узнавание оказывают влияние другие, пока еще неизвестные факторы.
Хотя система посттрансляционной транслокации широко представлена в клетках S. cerevisiae, данные, свидетельствующие о ее функционировании у высших эукариот, носят менее очевидный характер. Эта форма транслокации пока продемонстрирована in vitro лишь для очень небольших субстратов. В этих случаях образование стабильной нативной структуры в цитозоле маловероятно. Действительно ли эти субстраты in vivo позиционируются посттрансляционно, достоверно не установлено.
Однако у высших эукариот обнаружены гомологи белков Sec62p и Sec63p. Таким образом, возможно, что либо посттрансляционная транслокация происходит несколько по-другому, либо каналы и набор белков используются для других нужд у высших эукариот.
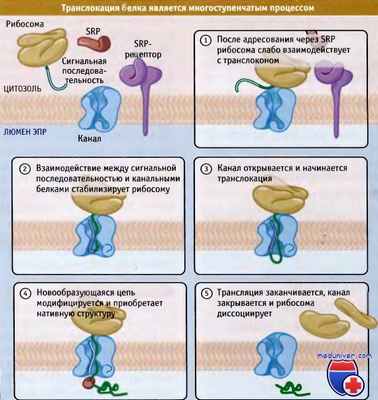
![Транслокация белка]()
Элонгация новообразующейся цепи в люмен ЭПР не происходит до тех пор,
пока канал не узнал сигнальную последовательность и плотно не связал рибосому.
Вскоре после начала транслокации происходит модификация белковой молекулы,
и она приступает к приобретению нативной структуры.Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Транслокон
Транслокно (также известные как транслокатор или транслокация канал ) представляет собой комплекс белков , ассоциированные с транслокацией из полипептидов через мембрану. [1] У эукариот термин транслокон чаще всего относится к комплексу, который транспортирует растущие полипептиды с целевой сигнальной последовательностью во внутреннее (цистернальное или просветное) пространство эндоплазматического ретикулума (ER) из цитозоля . Этот процесс транслокации требует, чтобы белок пересек гидрофобный липидный бислой. . Тот же комплекс также используется для интеграции возникающих белков в саму мембрану ( мембранные белки ). У прокариот подобный белковый комплекс транспортирует полипептиды через (внутреннюю) плазматическую мембрану или интегрирует мембранные белки. [2] В любом случае белковый комплекс формируется из белков Sec (Sec: секреторный), причем гетротримерный Sec61 является каналом. [3] У прокариот комплекс гомологичных каналов известен как SecYEG. [4]
В этой статье основное внимание уделяется естественным транслоконам клетки, но патогены также могут собирать другие транслоконы в мембранах своих хозяев, что позволяет им экспортировать факторы вирулентности в свои клетки-мишени. [5]
СОДЕРЖАНИЕ
Канал транслокации представляет собой гетеротримерный белковый комплекс, называемый SecYEG у прокариот и Sec61 у эукариот. [6] Он состоит из субъединиц SecY, SecE и SecG. Структура этого канала в неактивном состоянии была определена с помощью рентгеновской кристаллографии на архее . [4] SecY - субъединица крупной поры. На виде сбоку канал имеет форму песочных часов с воронками с каждой стороны. Внеклеточная воронка имеет небольшую «пробку», образованную из альфа-спирали. . В середине мембраны находится конструкция, образованная поровым кольцом из шести гидрофобных аминокислот, которые выступают своими боковыми цепями внутрь. Во время транслокации белка пробка перемещается в сторону, и полипептидная цепь перемещается из цитоплазматической воронки через кольцо поры, внеклеточную воронку, во внеклеточное пространство. Гидрофобные сегменты мембранных белков выходят боком через боковые ворота в липидную фазу и становятся сегментами, пронизывающими мембрану. [4]
У бактерий SecYEG образует комплекс с SecDF, YajC и YidC. [7] [8] У эукариот Sec61 образует комплекс с олигосахарилтрансферазным комплексом, TRAP-комплексом и мембранным белком TRAM (возможный шаперон). Для других компонентов, таких как комплекс сигнальной пептидазы и рецептор SRP, неясно, в какой степени они только временно связываются с комплексом транслокона. [9]
Канал позволяет пептидам двигаться в любом направлении, поэтому для перемещения пептида в определенном направлении требуются дополнительные системы в транслоконе. Существует три типа транслокации: котрансляционная транслокация, которая происходит во время трансляции, и два типа посттрансляционной транслокации, которая происходит после транслокации, каждая из которых наблюдается у эукариот и бактерий. В то время как эукариоты разворачивают белок с помощью BiP и используют другие комплексы для транспортировки пептида, бактерии используют SecA- АТФазу. [10]
![]()
ЭР транслокон комплекс. Многие белковые комплексы участвуют в синтезе белка. Фактическое производство происходит в рибосомах (желтых и голубых). Через транслокон ER (зеленый: Sec61, синий: комплекс TRAP и красный: комплекс олигосахарилтрансферазы) вновь синтезированный белок транспортируется через мембрану (серый цвет) внутрь ER. Sec61 является проводящим белок каналом, а OST добавляет сахарные фрагменты к формирующемуся белку.
При совместной транслокационной транслокации транслокон связывается с рибосомой, так что растущая растущая полипептидная цепь перемещается из туннеля рибосомы в канал SecY. Транслокон (транслокатор) действует как канал через гидрофобную мембрану эндоплазматического ретикулума (после диссоциации SRP и продолжения трансляции). Возникающий полипептид проходит через канал в виде развернутой цепочки аминокислот, потенциально управляемой броуновским храповым механизмом . После завершения трансляции сигнальная пептидаза отщепляет короткий сигнальный пептид от возникающего белка, оставляя полипептид свободным внутри эндоплазматического ретикулума. [11] [12]
У эукариот белки, которые должны быть перемещены в эндоплазматический ретикулум, распознаются частицей распознавания сигнала (SRP), которая останавливает трансляцию полипептида рибосомой, пока она прикрепляет рибосому к рецептору SRP на эндоплазматическом ретикулуме. Это событие распознавания основано на конкретной N-концевой сигнальной последовательности, которая находится в первых нескольких кодонах синтезируемого полипептида. [10] Бактерии также используют SRP вместе с шапероном YidC, который похож на TRAM эукариот. [13] [10]
Транслокон также может перемещать и интегрировать мембранные белки в правильной ориентации в мембрану эндоплазматического ретикулума. Механизм этого процесса до конца не изучен, но включает распознавание и обработку транслоконом гидрофобных участков в аминокислотной последовательности, которым суждено стать трансмембранными спиралями . Закрытый последовательностями остановки-переноса и открываемый встроенными сигнальными последовательностями, вилка переключается между своим открытым и закрытым состояниями, чтобы разместить спирали в разных ориентациях. [10]
У эукариот посттрансляционная транслокация зависит от BiP и других комплексов, включая интегральный мембранный белковый комплекс SEC62 / SEC63 . В этом режиме транслокации Sec63 помогает BiP гидролизовать АТФ, который затем связывается с пептидом и «вытягивает» его. Этот процесс повторяется для других молекул BiP до тех пор, пока весь пептид не будет протянут. [10]
У бактерий тот же процесс выполняется «толкающей» АТФазой, известной как SecA , иногда при содействии комплекса SecDF на другой стороне, ответственной за «вытягивание». [14] SecA-АТФаза использует механизм «толкни и сдвинь» для перемещения полипептида по каналу. В АТФ-связанном состоянии SecA взаимодействует посредством двухспирального пальца с подмножеством аминокислот в субстрате, проталкивая их (с гидролизом АТФ) в канал. Затем взаимодействие ослабевает, когда SecA входит в состояние, связанное с АДФ, позволяя полипептидной цепи пассивно скользить в любом направлении. Затем SecA захватывает следующий участок пептида, чтобы повторить процесс. [10]
Транслокаторы также могут перемещать полипептиды (например, поврежденные белки, нацеленные на протеасомы ) из цистернального пространства эндоплазматического ретикулума в цитозоль. ER-белки расщепляются в цитозоле протеасомой 26S , этот процесс известен как деградация белков, связанная с эндоплазматическим ретикулумом , и поэтому они должны транспортироваться по соответствующему каналу. Этот ретротранслокон до сих пор остается загадкой.
Первоначально считалось, что канал Sec61 отвечает за этот ретроградный транспорт, подразумевая, что транспорт через Sec61 не всегда является однонаправленным, но также может быть двунаправленным. [15] Однако структура Sec61 не поддерживает эту точку зрения, и предполагается, что несколько различных белков ответственны за транспорт из просвета ER в цитозоль. [16]
Читайте также: