Предраковые состояния желудка - диагностика кишечной метаплазии
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Атрофический гастрит тела желудка ассоциирован с развитием кишечной метаплазии и псевдопилорической метаплазии.
К настоящему моменту проведено мало проспективных исследований, оценивающих прогрессию псевдопилорической метаплазии в рак желудка.
Целью исследования было оценить связь между псевдопилорической метаплазией и развитием рака желудка у пациентов с атрофическим гастритом тела желудка.
Методы
В лонгитюдное когортное исследование включили пациентов с атрофическим гастритом тела желудка, у которых проводилось эндоскопическое наблюдение.
Пациенты были стратифицированы по наличию/отсутствию псевдопилорической метаплазии на момент включения в исследование.
В качестве основной конечной точки была выбрана неоплазия желудка.
Результаты
- 292 пациента с атрофическим гастритом тела желудка наблюдались на протяжении 4,2 лет (от 3 до 17 лет).
- Псевдопилорическая метаплазия была изначально диагностирована у 21,2% пациентов.
- Рак желудка диагностировали у 1,7% пациентов, желудочную дисплазию – у 1,4% пациентов.
- У этих пациентов (рак/дисплазия) кишечная метаплазия присутствовала изначально и сохранялась на протяжении всего периода наблюдения.
- Возраст до 50 лет (отношение шансов, 2,5), отсутствие пернициозной анемии (отношение шансов, 4.3) и отсутствие тяжелой атрофии тела желудка (отношение шансов, 2,3) были ассоциированы с псевдопилорической метаплазией без кишечной метаплазии тела желудка.
Заключение
Таким образом, у пациентов с атрофическим гастритом тела желудка с псевдопилорической метаплазией без кишечной метаплазии не повышен риск развития рака желудка или дисплазии желудка.
Псевдопилорическая метаплазия тела желудка у молодых пациентов в отсутствии пернициозной анемии и тяжелой атрофии тела желудка, ассоциирована с низким риском прогрессии заболевания.
Источник: Dilaghi Emanuele, Baldaro Francesca, Pilozzi Emanuela, et al. Pseudopyloric Metaplasia Is Not Associated With the Development of Gastric Cancer, The American Journal of Gastroenterology: 2021: 10.14309/ajg.0000000000001390.

Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Атрофический гастрит
Атрофический гастрит – это хронический гастрит типа А, при котором уменьшается количество желудочных желез, снижается кислотообразующая функция. Считается предраковым состоянием. Проявляется тяжестью и тупыми болями в желудке, тошнотой, изжогой, диспепсическими явлениями, анемией. Наиболее значимыми методами диагностики являются: гастроскопия с забором и гистологией биоптатов, различные исследования для определения наличия хеликобактерной инфекции. Менее информативны гастрография, УЗИ органов брюшной полости. Так как 90% атрофий желудка связаны с воздействием хеликобактерий, специфическое лечение включает в себя эрадикацию инфекции. Назначается заместительная и симптоматическая терапия, санаторное лечение и физиотерапия.
МКБ-10
Общие сведения
Атрофический гастрит – хроническое прогрессирующее воспаление слизистой желудка, в результате которого полностью утрачиваются обкладочные железы желудка, происходит постепенная атрофия с последующей метаплазией участков слизистой. Основным признаком, который указывает на высокую вероятность рака, является не вид перестройки клеток, а площадь процесса – при распространенности метаплазии на 20% площади слизистой желудка и более вероятность развития рака практически 100%.
По наблюдениям специалистов в сфере практической гастроэнтерологии, хронический атрофический гастрит в 13% случаев заканчивается развитием онкологической патологии. По сравнению с неатрофическим процессом вероятность такого осложнения при атрофическом гастрите в пять раз выше. Основной задачей гастроэнтерологов сегодня является разработка новых, простых и неинвазивных методов достоверной диагностики атрофии, а также ранней диагностики рака желудка. Замечено, что своевременная диагностика и полная эрадикация инфекционного процесса уже через пять лет приводят к восстановлению слизистой желудка и значительному уменьшению площади метаплазии.
Причины
Основными причинами развития атрофического гастрита являются длительно текущая хеликобактерная инфекция и аутоиммунный процесс, при котором собственные антитела повреждают G-клетки желудка (они являются основной составляющей обкладочных желез). Атрофии железистого эпителия могут способствовать различные сопутствующие заболевания и состояния: бесконтрольный прием медикаментов, алкоголизм, стрессы и выраженное физическое переутомление, различные профессиональные вредности, наследственные особенности работы ЖКТ, тяжелые фоновые заболевания.
Патогенез
H.pylori вызывает хроническое повреждение клеток, ослабляя местные защитные свойства слизистой желудка, что в результате позволяет токсинам и свободным радикалам беспрепятственно проникать в ткани и повреждать ядра клеток. В финале этого процесса клетки приобретают свойства нескольких типов тканей – так называемые гибридные клетки, которые имеют свойства предраковых. Данный процесс называется кишечной метаплазией. Вначале эти участки слизистой приобретают вид тонкокишечного эпителия, затем толстокишечного. Чем дальше зашел процесс метаплазии, тем больше вероятность развития аденокарциномы желудка. На сегодняшний день хеликобактерная инфекция включена в список биологических канцерогенов, ведь без надлежащего лечения она рано или поздно приводит к раку желудка.
Механизм развития аутоиммунного процесса несколько иной. При этом в организме из-за нарушения иммунитета начинают образовываться антитела, которые распознают собственные ткани желудка как чужеродные. Чаще всего антитела вырабатываются к G-клеткам и фактору Касла, который отвечает за всасывание витамина В12. Из-за этого постепенно снижается кислотность желудка, клетки перестраиваются и начинают производить слизь вместо соляной кислоты. В желудке перестают всасываться железо и витамины, развивается тяжелая пернициозная анемия. Если же аутоиммунному гастриту сопутствует хеликобактерная инфекция, предраковое состояние разовьется гораздо быстрее.
Симптомы атрофического гастрита
Патология развивается медленно, поражение при этом начинается со дна желудка, переходя на его тело, а затем и на остальную слизистую. В начале заболевания особой симптоматики может и не быть, что затрудняет диагностику и мешает раннему началу лечения. После развития полной клинической картины у пациента могут выявляться несколько симптомокомплексов.
Анемический синдром развивается из-за нарушения всасывания железа и витаминов (особенно В12, фолиевой кислоты) в полости желудка. Проявляется он выраженной слабостью, утомляемостью, сонливостью, постоянной усталостью (порой даже нарушается обычная деятельность пациента). Кожные покровы и слизистые бледнеют. Пациент отмечает постоянные боли в языке, жжение, слизистая языка становится лаковой. Также больной предъявляет жалобы на нарушения чувствительности в конечностях, обычно симметричные. Характерны сухие волосы и ломкие ногти, беспокоит одышка при незначительных нагрузках, колющие боли в сердце.
Диспепсический синдром проявляется выраженной тяжестью в эпигастрии, реже тупыми ноющими болями в верхней половине живота. Боли связаны с растяжением стенок желудка пищевыми массами из-за нарушений пищеварения. Также пациента беспокоят изжога (забрасывание кислого содержимого в пищевод), срыгивание (забрасывание пищи из желудка в ротовую полость), отрыжка (непроизвольный выход воздуха из желудка). Сопровождаются эти симптомы тошнотой, иногда рвотой, после которой боль в эпигастрии уменьшается. В рвотных массах – большое количество съеденной пищи, слизь, желчь. Аппетит значительно снижен.
Нарушения пищеварения распространяются на другие отделы ЖКТ – появляется дискомфорт в животе, стул становится неустойчивым – запоры сменяются поносами. По утрам во рту неприятный привкус, беспокоит постоянный запах изо рта. Язык обложен сероватым налетом, на нем видны отпечатки зубов. Нарушенное пищеварение и снижение аппетита могут приводить к потере веса, а при отсутствии лечения – к выраженной алиментарной дистрофии. Развивается полигиповитаминоз, который приводит к значительному снижению иммунитета, присоединению различных инфекций.
Диагностика
Сегодня все больше внимания уделяется ранней неинвазивной диагностике атрофического гастрита. Для этого врачами-гастроэнтерологами разработана специальная панель диагностики. При проведении обычной гастроскопии выявить очаги дисплазии эпителия, а тем более определить их площадь не представляется возможным. Из-за этого зачастую возникают ошибки, связанные как с гипердиагностикой, так и гиподиагностикой: площадь гиперплазии может быть оценена неправильно, а воспалительные изменения могут быть приняты за метаплазию эпителия. Для того, чтобы правильно оценить площадь измененного эпителия, взять биопсию из всех измененных участков, во время гастроскопии производится окрашивание слизистой (чаще всего метиленовым синим) – краситель хорошо воспринимается участками с кишечной метаплазией.
Специальная гематологическая панель Biohit позволяет быстро и эффективно определить степень метаплазии эпителия, атрофии слизистой и обкладочных желез, избежать ошибок диагностики. В этой панели исследуется уровень сывороточного пепсиногена, определяется соотношение пепсиногена 1 к пепсиногену 2, гистамина 17. Снижение этих показателей говорит о выраженной атрофии клеток железистого эпителия, а низкий уровень гастрина 17 говорит о гибели G-клеток желез желудка.
В то же время, повышение уровня гастрина 17 и пепсиногена 1 часто ассоциируется с хеликобактерной инфекцией. Значительное повышение уровня гастрина 17 чаще всего связано с аутоиммунным гастритом, при котором наблюдается ахлоргидрия или гипохлоргидрия, сохранена функция антрального отдела желудка. Если же в антральном отделе также имеются очаги атрофии (мультифокальная атрофия), то уровни всех этих показателей будут низкими. Данная панель имеет не менее 80% достоверности, используется на начальных этапах обследования и позволяет определиться с типом гастрита, его локализацией и причиной, выявить предраковое состояние и определить правильную тактику лечения.
В сравнении с гематологической панелью и эндоскопическим исследованием с забором биопсии, остальные методы диагностики атрофического гастрита менее информативны. Так, при гастрографии отмечается сглаженность складок слизистой и замедление перистальтики желудка, размеры его уменьшены. Такая же картина обнаруживается при проведении УЗИ желудка. Внутрижелудочная рН-метрия обнаруживает снижение кислотности желудочного сока. Для уточнения диагноза желательно проводить суточное измерение кислотности.
При подозрении на малигнизацию необходимо провести МСКТ органов брюшной полости для исключения опухолевого процесса. Также обязательно проводятся все необходимые исследования для выявления инфицированности H.pylori: ПЦР-диагностику хеликобактер, дыхательный тест, выявление в крови антител к хеликобактер.
Лечение атрофического гастрита
Основной задачей гастроэнтеролога является предупреждение дальнейшей кишечной метаплазии, раковой трансформации. При своевременном начале лечения атрофического гастрита уже через пять лет наступает значительное улучшение состояния эпителия. Обязательно назначается лечебная диета, которая на начальном этапе включает в себя химически, термически и механически щадящую пищу.
После нормализации состояния допускается употребление химически активных продуктов: разведенных соков (лимонный, капустный, клюквенный). Свежие фрукты из диеты исключаются, можно есть только бананы. К пище предъявляются особые требования – она должна быть теплой (нельзя принимать холодные и горячие продукты), приемы пищи должны быть частыми и дробными. Необходимо исключить спиртные напитки и курение.
При обнаружении хеликобактерной инфекции обязательным условием выздоровления является эрадикация инфекционного агента. Современные протоколы лечения предусматривают назначение двух- или трехкомпонентной схемы, включающей антихеликобактерные антибиотики, ингибиторы протонной помпы, препараты висмута. Только полное излечение от хеликобактерий может привести к восстановлению слизистой и снижению риска малигнизации.
Глюкокортикоидные гормоны при атрофическом гастрите назначаются только при развитии В12-фолиеводефицитной анемии. Также назначается симптоматическое лечение: заместительная терапия натуральным желудочным соком, ферментами, недостающими витаминами, препаратами железа. Для стимуляции секреции соляной кислоты необходимо пить минеральные воды с высоким содержанием солей, отвары трав (подорожник, полынь, фенхель), кислые соки, растворы лимонной и янтарной кислот.
Используются гастропротекторы (мизопростол, карбеноксолон), стимуляторы регенерации (облепиховое масло), обволакивающие средства на основе алюминия и висмута, препараты для улучшения перистальтики. Активно применяется физиотерапия: электрофорез с лекарственными препаратами, электро- и магнитотерапия, тепловые процедуры на область эпигастрия. Санаторно-курортное лечение вне периода обострения включает терапию минеральными водами на бальнеологических курортах.
Прогноз и профилактика
Прогноз атрофического гастрита хуже у пациентов возрастной группы старше 50 лет – в этом возрасте метапластические процессы развиваются гораздо быстрее и чаще приводят к малигнизации. Большое значение для полного выздоровления имеет раннее начало лечения, а также степень эрадикации инфекционного агента. Если при повторном обследовании после курса антихеликобактерной терапии в желудочном содержимом определяются микроорганизмы, то курс следует повторить. Профилактикой развития атрофического гастрита является ранняя диагностика и лечение H.pylori, соблюдение режима дня и рационального питания, гигиены рук для предотвращения инфицирования.
Кишечная метаплазия желудка
Кишечная метаплазия желудка – это нарушение клеточной дифференцировки, в результате чего на отдельных участках слизистой желудка появляется кишечный эпителий. Патология сопутствует хроническому атрофическому гастриту. Метаплазия желудка проявляется неспецифическими диспепсическими расстройствами: тяжестью в эпигастрии, ранним насыщением, периодическими болями в животе. Для диагностики назначают ЭФГДС с окраской метиленовым синим и забором биоптатов, тестирование на хеликобактерную инфекцию, лабораторные анализы (гастропанель). Лечение включает эрадикационную терапию H. pylori, симптоматические препараты с учетом клинической картины.

Кишечная (интестинальная) метаплазия является одной из наиболее актуальных проблем современной гастроэнтерологии и онкологии. Такое состояние может переходить в дисплазию — облигатную предраковую патологию гастральной слизистой. Истинная частота проблемы не установлена, поскольку она не имеет патогномоничных признаков и редко выявляется вовремя. Кишечная метаплазия желудка — это морфологическое понятие, которое отражает сущность патологических изменений в гастральной зоне, поэтому по общепринятой классификации пациенты имеют диагноз хронического гастрита.
Пусковым фактором развития кишечной метаплазии желудка является персистирование возбудителя H. pylori. Хеликобактерная инфекция становится причиной хронического гастрита, который со временем переходит в атрофическую форму и сопровождается замещением нормальных клеток слизистой оболочки желудка. При наличии H. pylori патологические изменения происходят одновременно в теле и антральном отделе органа, что является прогностически неблагоприятным.
Факторы риска
Не у всех пациентов с хеликобактерной инфекцией одинаково быстро развивается кишечная метаплазия, что указывает на наличие дополнительных факторов риска. К таковым относят психоэмоциональные стрессы, длительный стаж курения и злоупотребления алкоголем. На состояние слизистой желудка негативно влияет прием медикаментов, в частности антибиотиков, НПВС и кортикостероидов. К возможным провоцирующим факторам относят профессиональные вредности, генетическую предрасположенность, сопутствующие соматические болезни.
Механизм интестинальной метаплазии представляет собой комбинацию нескольких факторов: изменяющуюся экспрессию генов, воздействие эпигенетики, активизацию факторов роста и транскрипции. Патология сопровождается снижением синтеза желудочных муцинов (MUC1, MUC5AC) и выработкой интестинальных муцинов MUC2. В соответствии с этим выделяют полную форму метаплазии с типично кишечными муцинами и смешанный желудочно-кишечный вариант.
При кишечной метаплазии в стенке желудка определяются бокаловидные клетки, которые в норме присутствуют только в кишечнике. Изредка они дополняются клетками Панета, абсорбирующими клетками со щеточной каемкой. Происходит реорганизация эпителия, смещение пролиферативных зон от перешейка желудочных желез к их основанию, изменение стромальных клеток по кишечному типу. Клеточные элементы начинают выделять сиаломуцины и сульфомуцины.

Симптомы
Клинические проявления кишечной метаплазии желудка соответствуют хроническому гастриту и объединяются в синдром желудочной диспепсии. Они протекают с эпизодами обострения и ремиссии, которые могут быть спровоцированы погрешностями в питании или внешними стрессовыми факторами. Всего лишь 5% пациентов вовремя обращаются к врачу с такими симптомами, остальные предпочитают игнорировать их или проводить самолечение, что затрудняет своевременную диагностику патологии.
При метапластических изменениях гастральной слизистой пациенты предъявляют жалобы на тяжесть в желудке, ощущение переедания после употребления обычных объемов пищи. Состояние дополняется чувством раннего насыщения, вздутием и распиранием в верхних отделах живота. При сопутствующей хеликобактерной инфекции возможно появление желудочных болей по утрам натощак либо при длительном перерыве между приемами пищи в течение дня. Боли зачастую уменьшаются после еды.
В редких случаях нарушения пищеварения при хроническом гастрите с метаплазией дополняются тошнотой и рвотой. Больные также могут жаловаться на отрыжку воздухом, метеоризм, урчание в кишечнике. Расстройства стула не характерны для желудочной диспепсии, однако при длительном существовании патологии и вовлечении других отделов ЖКТ возможна диарея, запоры, неустойчивость стула. Из-за сокращения объема пищи и нарушения ее переваривания снижается масса тела.
Осложнения
Кишечная метаплазия является промежуточной стадией желудочного канцерогенеза. Процесс начинается с хронического гастрита, затем происходит атрофия и метаплазия, после чего возникает дисплазия — ключевое предраковое состояние с ежегодным риском прогрессирования в рак на уровне 6%. Прохождение этих этапов занимает несколько лет, но с учетом поздней обращаемости пациентов к врачу своевременная диагностика предраковых состояний — редкое явление в онкологии.
При атрофии слизистой желудка нарушаются процессы переваривания и всасывания пищи, прежде всего, витаминов и микроэлементов. Возникают множественные авитаминозы, которые клинически проявляются негативными изменениями кожи и ногтей, постоянной слабостью, ухудшением работоспособности и когнитивных функций. Характерно снижение иммунитета, повышенная восприимчивость к сезонным респираторным инфекциям. Нехватка железа и витамина В12 становится причиной анемии.
При кишечной метаплазии желудка требуется обследование у врача-гастроэнтеролога. В случае выявления диспластических процессов в слизистой оболочке пациента направляют на консультацию онколога. При первичном осмотре необходимо выяснить жалобы и анамнез заболевания, наличие факторов риска, семейный анамнез по раку желудка. Для диагностики патологии применяется ряд исследований:
- Гастроскопия. Эндоскопия желудка с биопсией из разных участков слизистой — «золотой стандарт» для подтверждения кишечной метаплазии. С целью быстрого определения локализации метапластических очагов при ФГДС вводится раствор метиленового синего. Полученные биоптаты подлежат гистологической диагностике для выявления бокаловидных и других типов клеток, характерных для кишечной стенки.
- Дополнительные методы визуализации. Для комплексной оценки состояния пищеварительного тракта гастроэнтерологу необходимы результаты УЗИ органов брюшной полости, рентгенографии ЖКТ с контрастированием. При неспецифических диспепсических жалобах и похудении у людей старшего возраста выполняется колоноскопия для исключения рака кишечника.
- Анализы наH. pylori. Для выявления хеликобактерной инфекции используют следующие методы: определение антител в крови методом ИФА, дыхательный уреазный тест, ПЦР кала. Наиболее информативным способом диагностики хеликобактериоза является исследование биоптатов слизистой желудка, полученных при ЭФГДС.
- Лабораторный комплекс. Помимо диагностики хеликобактерной инфекции, пациентам необходимо выполнить клинический и биохимический анализы крови, микроскопию кала, анализ кала на дисбактериоз. Обязательно проводится гастропанель с определением уровня пепсиногенов, базального и стимулированного гастрина.

Лечение кишечной метаплазии желудка
Тактика ведения пациента определяется с учетом провоцирующих факторов патологии, наличия сопутствующих заболеваний гастродуоденальной зоны. При подтвержденной хеликобактерной инфекции основным методом лечения является эрадикация возбудителя по 3-компонентной или 4-компонентной схеме. После уничтожения H. pylori удается достичь регресса кишечной метаплазии в антральном отделе желудка.
Для коррекции клинических последствий атрофии и метаплазии желудка требуется симптоматическая терапия. Она подбирается по индивидуальной схеме, которая включает заместительные препараты желудочного сока и пищеварительных ферментов, гастропротекторы, прокинетики. Для нормализации метаболических процессов показаны препараты железа, витаминно-минеральные комплексы. Ограниченную эффективность демонстрируют физиопроцедуры, санаторно-курортное лечение.
При метаплазии желудка не требуются малоинвазивные или хирургические вмешательства, поскольку такое состояние не является облигатным предраковым процессом. Возможность оперативного лечения рассматривается у пациентов с дисплазией, которая в 25-60% случаев вызывает рак желудка в течение последующих 5 лет жизни. В таких ситуациях рекомендована резекция пораженного участка без дополнительной биопсии.
Кишечная метаплазия – прогностически неблагоприятное состояние, поскольку она выступает маркером атрофии слизистой и одним из предикторов аденокарциномы желудка. Срок жизни пациентов зависит от своевременности ее выявления, успешности эрадикационной терапии, наличия участков дисплазии. Профилактика патологии включает ликвидацию внешних и внутренних факторов риска, скрининговую гастроскопию для пациентов из группы высокого риска по развитию рака желудка.
2. Оптимизация лечения заболеваний, ассоциированных с Helicobacter pylori: какими возможностями мы располагаем сегодня?/ Н.В. Харченко, Г.Д. Фадеенко, Ю.М. Степанов. – 2016.
3. Влияние Helicobacter pylori на морфологическое состояние слизистой оболочки желудка/ И.М. Павлович, А.В. Гордиенко, С.С. Бацков, Д.В. Лавренчук// Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях. – 2013. – №2.
4. Кишечная метаплазия слизистой оболочки желудка: от природы феномена к прогнозу/ С.И. Мозговой// Сибирский научный медицинский журнал. – 2009. – №3.
Предраковая патология желудка: современные стандарты и практические рекомендации эндоскопической диагностики и ведения больных
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Мы сейчас уже вошли во временное пространство, в котором должны быть активными участниками Сергей Владимирович Кашин и профессор Тору Ито из Японии.
Сергей Владимирович Кашин, доцент, кандидат медицинских наук:
Во время нашей презентации мы бы хотели очень кратко остановиться на тех шагах, которые предпринимает Российское эндоскопическое общество по созданию практических рекомендаций для врачей-эндоскопистов, посвященных четким инструкциям – что должен знать врач-эндоскопист о гастроэнтерологической патологии, предраковой патологии желудка, и какими инструкциями он должен руководствоваться. И мы надеемся, что наши усилия, безусловно, под руководством Гастроэнтерологической ассоциации и президента Гастроэнтерологической ассоциации приведут к тому, что в ближайшее время у нас появятся такие же инструкции, которые есть и в Японии, и в европейских странах. Итак, позвольте представить первый слайд. Рак желудка по-прежнему является глобальной проблемой мирового здравоохранения, ему уделяется очень много внимания.
В Южной Америке, в восточно-европейских странах, в России и в странах Азии, в Японии, в Китае по-прежнему очень высокие показатели заболеваемости раком желудка, и по прогнозам Международного агентства по изучению рака вы видите, что количество случаев рака желудка к 2030 году должно не уменьшиться, а возрасти. В нашей стране наметилась определенная положительная тенденция к снижению заболеваемости раком желудка, и по данным Института имени Герцена мы видим 16%-ное снижение показателей заболеваемости желудка за последние 10 лет. Несмотря на это, желудок занимает вторую строчку в структуре смертности от злокачественных новообразований в России. Это серьезные цифры, которые говорят о необходимости ранней диагностики. Как обстоят дела с ранней диагностикой рака желудка в нашей стране? Вы видите, что подавляющее большинство случаев рака желудка в России и в Ярославской области диагностируется слишком поздно. Вы видите на этом слайде, что подавляющее большинство случаев рака желудка в нашей стране, к сожалению, диагностируется на 4-й стадии опухолевого процесса, слишком поздно для эффективного лечения.
Что же происходит с диагностикой рака на ранней стадии? Вы видите, что ситуация, может быть, не такая благоприятная, как в Японии, где рак на первой и второй стадии диагностируется у половины пациентов, однако положительная тенденция наметилась в Ярославской области, где за последние 5 лет произошло значительное улучшение диагностики рака на ранних стадиях. Вы видите, что эти показатели более чем на 10% лучше, чем в Российской Федерации. Возможно, это усилие эндоскопии, возможно, это усилие гастроэнтерологов, которые постоянно участвуют в образовательных проектах по канцерпревенции, которые активно внедряет Российская гастроэнтерологическая ассоциация. И мне бы хотелось дальше очень коротко представить о том, что сделано за последние годы с участием европейских экспертов и японских экспертов в нашей стране. В 2012 году в июле была проведена конференция, которая проходила под эгидой Европейского общества гастроинтестинальной эндоскопии. Эта конференция была посвящена обсуждению Европейских рекомендаций по принципам диагностики, лечения и ведения пациентов с предраковыми состояниями и изменениями желудка.
В этой конференции приняли участие ведущие российские специалисты, а также профессор Тору Ито, как ведущий японский эксперт, и профессор Марио Рибейро, который является председателем Комитета по образованию Европейского эндоскопического общества. На этой конференции были представлены основные диагностические этапы, которые необходимо предпринять современному врачу-эндоскописту для того, чтобы своевременно обнаружить предраковые заболевания и ранние формы рака желудка. Ключевые вопросы Европейских рекомендаций были предложены для обсуждения нашим врачам-эндоскопистам: каким пациентам показано эндоскопическое наблюдение? Каков оптимальный диагностический подход к таким больным? И должны ли пациенты получать медикаментозные препараты для снижения риска развития рака желудка? Первый вопрос крайне важен для врачей-эндоскопистов, поскольку в нашей стране нет четких рекомендаций о том, кого необходимо обследовать и с какой кратностью необходимо выполнять исследования пациентам. Что касается спектра предопухолевой патологии, то вы видите на слайде, что такая патология делится на две основных составляющих – это предраковые состояния слизистой оболочки желудка и предраковые изменения.
К предраковым состояниям, которые могут служить фоном для развития рака, относятся атрофический гастрит с кишечной метаплазией, язвенная болезнь желудка, аденомы, болезнь Менетрие и резецированный желудок. «Предраковые изменения» – это термин, который был введен еще японцами в 1976 году. Он предполагает наличие диспластических изменений в слизистой оболочке желудка, то есть тех изменений, которые еще не являются раком, но, тем не менее, движутся в сторону развития уже злокачественной патологии. Роль диагностики таких состояний и изменений крайне важна, особенно необходимо обращать внимание на диагностику атрофического гастрита. И вы видите, на следующем слайде данные свидетельствуют об относительном риске развития рака желудка у пациентов с атрофическим гастритом, и чем более тяжелый атрофический гастрит, чем более выраженная атрофия – особенно это касается атрофического пангастрита – тем выше риск развития рака желудка у пациента.
Какова же тактика врача-эндоскописта в зависимости от его эндоскопических находок и результатов биопсии у пациентов с атрофическим гастритом? Мы попытаемся показать эту тактику вот в таком слайде, в котором наглядно будет объяснено, что делать врачу-эндоскописту у пациентов с различными формами атрофического гастрита. Если мы диагностируем атрофический гастрит без какой-либо дисплазии, то в этом случае контроль необходимо выполнять не чаще, чем один раз в 3 года после установления диагноза. Об этом свидетельствуют Европейские рекомендации, и, возможно, такая тактика необходима и в нашей стране. Если мы видим пациентов с атрофическим гастритом с дисплазией низкой степени, при отсутствии какого-либо видимого при эндоскопии патологического участка, подозрительного на рак, то в этом случае показано наблюдение и обязательное выполнение повторной эндоскопии в течение одного года после установления диагноза. В том случае, если мы у пациентов с атрофическим гастритом обнаружили при биопсии дисплазию высокой степени, и также нет видимого при эндоскопии патологического участка, подозрительного на ранний рак, то необходима в срочном порядке повторная гастроскопия, возможно, в экспертном центре, с множественными биопсиями и последующим наблюдением не реже, чем один раз в 6-12 месяцев, если повторно нам при биопсии не удается диагностировать рак желудка или повторно получить диагноз дисплазии высокой степени.
Этого пациента сегодня мы полчаса тому назад смотрели вместе с профессором, проводили контрольные исследования, и в этом случае гистологически мы обнаружили у пациента выраженную атрофию, выраженный атрофический гастрит с кишечной метаплазией. Вы видите на гистологическом препарате. Предыдущий слайд был 2010 год. При динамическом наблюдении такого пациента в 2012 году в антральном отделе желудка по передней стенке – это хорошо видно на правом крайнем слайде – была обнаружена опухоль, ранняя форма рака желудка, которая была удалена с помощью эндоскопических методик, и как раз данный пример демонстрирует, что пациента с тяжелым атрофическим пангастритом нельзя надолго выпускать из нашего поля зрения, необходимо такого пациента наблюдать и придерживаться более агрессивной тактики эндоскопического лечения. На следующем слайде показано исследование у этого пациента в 2013 году, где после выполненной эндоскопической операции по-прежнему сохраняются признаки выраженного атрофического гастрита, и такой пациент будет находиться у нас под эндоскопическим наблюдением, как минимум, ежегодно. Следующий короткий клинический пример свидетельствует как раз о важности диагностики видимых или невидимых при эндоскопии патологических участков.
Вот у этого пациента при эндоскопии был обнаружен небольшой участок размерами до 5 миллиметров в верхней трети тела желудка, примерно на 6-7 часах, который был подвергнут тотальной биопсии, и мы смогли у этого пациента обнаружить начальную стадию рака желудка. И вот очень интересный клинический пример, когда мы при эндоскопическом исследовании смогли увидеть патологический участок размером около 1 сантиметра в антральном отделе желудка, который при биопсии, при обычной стандартной биопсии не показал нам наличие рака, а показал наличие дисплазии разной степени выраженности. В этом случае было принято решение о выполнении эндоскопической операции, резекции патологического участка эндоскопической методикой, и после выполнения такой операции – она была выполнена в 2011 году при участии профессора Тору Ито – наши морфологи смогли подтвердить наличие высокодифференцированной аденокарциномы, которая расположена в пределах слизистого слоя стенки желудка.
Итак, каков же оптимальный диагностический и эндоскопический подход к выявлению предраковой патологии желудка и ранних форм рака? Существуют определенные диагностические критерии. Эти критерии хорошо знакомы нашим специалистам: врачи должны уделять больше внимания изменению цвета или структуры поверхности эпителия, уделять внимание диагностике демаркационной линии между патологическим участком и окружающей слизистой оболочкой. Однако в ряде случаев типичных критериев для наличия опухоли у пациентов нет, и современные Европейские рекомендации говорят о том, что стандартных эндоскопических методик стандартного осмотра в белом световом режиме недостаточно для точной диагностики и стадирования предраковых состояний и изменений слизистой оболочки желудка, поэтому во время каждого исследования врач должен использовать новые оптические технологии для диагностики таких изменений. Это узкоспектральная эндоскопия, это традиционная хромоскопия, как с применением оптического увеличения изображения, так и без него. И на следующем слайде представлен такой оптимальный диагностический алгоритм, который включает в себя несколько этапов выполнения эндоскопического исследования, о которых мы достаточно часто говорим на школах, проводимых Российской гастроэнтерологической ассоциацией, и этот алгоритм включает в себя подготовку слизистой оболочки, обязательную хромоскопию, применение уточняющих методик диагностики и обязательную биопсию.
Важным элементом такого исследования является создание стандартизированного протокола исследования, когда врач должен выполнить как минимум 20, а в клинике профессора Ито и более 30 снимков во время обследования желудка, что позволит врачу зафиксировать все зоны желудка. При таком подходе нет слепых участков при выполнении гастроскопии, и такой подход позволяет проводить контроль качества эндоскопических исследований и минимизировать риск диагностических ошибок в отношении предраковой патологии и ранних форм рака желудка. Как раз практическое применение такого алгоритма показано в следующем видеофрагменте. Первым этапом, вы видите, выполняется очищение поверхности слизистой оболочки от пенистого секрета и слизи с целью тщательной и детальной визуализации патологических изменений. Это важнейший этап современного эндоскопического исследования, и как раз мы вот сегодня с утра, проводя исследованием пациентам с предопухолевыми изменениями, как раз показывали молодым врачам и обсуждали с ними, насколько важен именно вот такой академичный подход к выполнению гастроскопии.
И вот вы видите, что слизистая оболочка полностью очищена от секрета и доступна детальному осмотру. Важным элементом современной гастроскопии является осмотр кардиального отдела желудка в различных световых режимах с целью диагностики рака проксимального отдела желудка и его кардиальной части, и мы знаем, что в последние годы показатели заболеваемости раком этой локализации растут. В этой зоне удается обнаружить кишечную метаплазию, тяжелую атрофию. Следующим важным элементом является детальное изучение всех патологических участков с целью установления более точного диагноза и проведения дифференциальной диагностики между доброкачественными и злокачественными изменениями. Вы видите, что у этого пациента множественные участки, имеющие отличную окраску от слизистой оболочки. Это зоны кишечной метаплазии. Они представлены более темными пятнами при специальном оптическом режиме, который подчеркивает не только контраст, но и позволяет выявить зоны с повышенной васкуляризацией. Затем, используя функцию оптического увеличения изображения, мы проводим осмотр каждого из этих участков, выполняем так называемую оптическую биопсию этих образований для того, чтобы выбрать наиболее подозрительные в отношении дисплазии или рака участки, и выбрать точки для выполнения биопсии.
Ну, и вот вы видите, что на фоне такого тяжелого атрофического гастрита мы обнаружили у пациента раннюю форму опухоли, которая имеет характерные признаки повреждений, и наличие нарушений структуры слизистой оболочки с наличием патологических сосудов. Таким образом, хромоскопия является базовой методикой диагностики атрофического гастрита и раннего рака желудка, узкоспектральная эндоскопия позволяет провести дифференциальную диагностику между доброкачественными и злокачественными изменениями. Вы видите, что в правой части слайда оптическое увеличение изображения позволяет установить наличие патологического сосудистого рисунка и провести дифференциальную диагностику раннего рака. И на следующем слайде показан последний важный диагностический этап современной гастроскопии – это обязательное выполнение биопсии. И об этом тоже необходимо помнить врачам-эндоскопистам, что практически каждое эндоскопическое исследование, проводимое с целью скрининга, должно завершаться выполнением биопсии из стандартных точек в антральном и фундальном отделах желудка.
Ну, и еще один важный момент, о котором мы сегодня уже говорили – это стандартизованный протокол «Описание обнаруженных изменений», который по европейским критериям является определенной страховкой для врача-эндоскописта от возможных пропусков явных предраковых изменений и ранних форм рака желудка. Третий вопрос, который активно обсуждают европейские специалисты, касается необходимости лечения пациентов с атрофическим гастритом. Мы тоже сегодня активно обсуждали этот вопрос с профессором Тору Ито, и точка зрения японских специалистов совпадает с теми основными принципами, которые предлагаются и Российской гастроэнтерологической ассоциацией, и исследованиями, проведенными в европейских странах. Эрадикация Helicobacter pylori, может быть, не приводит к существенному улучшению атрофических изменений слизистой оболочки, однако она позволяет замедлить процессы атрофии и тем самым замедлить движение атрофического гастрита в сторону развития злокачественной онкологической патологии.
И как раз следующий слайд, который предоставлен нам профессором Тору Ито, говорит о том, что в Японии принятые в 2009 году рекомендации по ведению пациентов с Helicobacter pylori ассоциированной патологии предлагают достаточно активную тактику по проведению эрадикации у пациентов без каких-либо язвенных дефектов, а у пациентов с атрофическим гастритом в клинике профессора Ито каждому пациенту, которому проведена гастроскопия, и у которого выявлен хронический гастрит, ассоциированный с инфекцией Helicobacter рylori, обязательно назначается проведение эрадикационной терапии. Эти рекомендации основаны на том, что большинство случаев атрофического гастрита в Японии связаны с инфекцией Helicobacter рylori, и большинство исследований отмечают положительное влияние эрадикации на степень атрофии. И на следующем слайде как раз представлены данные очень известного исследования, проведенного в 2002 году, при котором проведенная успешная эрадикационная терапия позволила уменьшить площадь очагов кишечной метаплазии, которую вы видите на слайде в виде темных пятен. Это просто черно-белый снимок кишечной метаплазии.
И проведение эрадикационной терапии позволило улучшить состояние слизистой оболочки и уменьшить площадь метаплазированного эпителия. У нас есть тоже опыт лечения таких пациентов, и вы видите, что у пациента в 2001 году был диагностирован тяжелый атрофический гастрит с кишечной метаплазией, была проведена эрадикационная терапия, и результаты последнего обследования, которое было выполнено в 2011 году, которые вы можете увидеть на нижней части слайда, свидетельствуют о том, что, безусловно, мы не получили значительной регрессии кишечной метаплазии, однако с помощью эрадикационной терапии нам удалось замедлить процессы атрофического гастрита и движения этого гастрита в сторону образования злокачественной патологии и оставить атрофические изменения на той стадии, на которой они были и 10 лет тому назад. Я очень коротко остановлюсь на следующем слайде, потому что он очень детально разбирался Татьяной Львовной Лапиной. Это стандартные схемы лечения инфекции Helicobacter рylori, которые утверждены рекомендациями Российской гастроэнтерологической ассоциации.
С моей точки зрения, необходимо более активно информировать врачей-эндоскопистов о стандартах лечения инфекции Helicobacter рylori и необходимо, конечно, информировать врачей о той тактике, которой должен придерживаться современный гастроэнтеролог после проведения эрадикационной терапии, а именно – долечивании хронического гастрита, и одним из элементов такого лечения является назначение цитопротекторов, цитопротективных препаратов, таких как «Де-Нол», которые активно используются в нашей повседневной практике, которые восстанавливают толщину и вязкость слоя желудочной слизи и, выполняя определенную цитопротективную функцию, оказывают своего рода антиоксидантный эффект. И завершить наше выступление нам бы хотелось слайдом с цитатой Владимира Трофимовича Ивашкина, который говорит о том, что канцерогенез – это длительный процесс, который дает врачу время и инструмент для выявления процессов, которые могут с высокой вероятностью привести к развитию рака. Это дает возможность врачу прервать эти изменения и предупредить развитие рака или же застать его на самой ранней стадии развития. Вот такими тезисами и такими инструкциями должен руководствоваться современный врач-эндоскопист для того, чтобы внести свой эффективный активный вклад в канцерпревенцию.
Предраковые состояния желудка - диагностика кишечной метаплазии
Особые формы гастрита: эозинофильный, гранулематозный, лимфоцитарный - диагностика
Эозинофильный гастрит возникает в дистальной части желудка, при этом характерны диспептические явления, а утолщенные складки антрального отдела могут вызывать обструкцию.
Кроме того, описывают случаи кровотечений, экссудативной энтеропатии и эозинофильного асцита. Могут быть вовлечены и другие отделы ЖКТ, однако эозинофилию периферической крови встречают редко.
Диагноз ставят на основании гистологического исследования желудка, при котором наиболее выраженные изменения обнаруживают в антральном отделе — характерны подслизистый отек и эозинофильный инфильтрат, включающий случайные гигантские клетки, который может проникать до серозной оболочки.
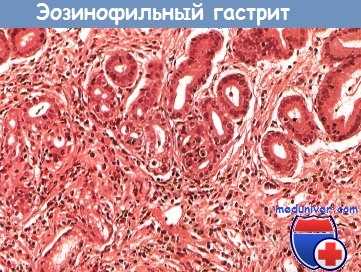
Микроскопическая картина эозинофильного гастрита. Эозинофильная инфильтрация стромы и желез, участок формирования эозинофильного микроабсцесса
Диагноз гранулематозного гастрита ставят путем исключения, так как изменения желудка при данном заболевании и при туберкулезе, саркоидозе, болезни Крона схожи. Однако системные проявления здесь отсутствуют, а больных, как правило, беспокоит только диспепсия.
Макроскопически определяют изъязвления, инфильтрацию и утолщение слизистой оболочки, приводящее к сужению пилорического отдела или изменениям, подобным инфильтративной форме рака [пластический линит (linitisplastica)]. Гистологически в слизистой оболочке желудка определяют гигантоклеточные гранулемы с признаками сопутствующего гастрита или без них.
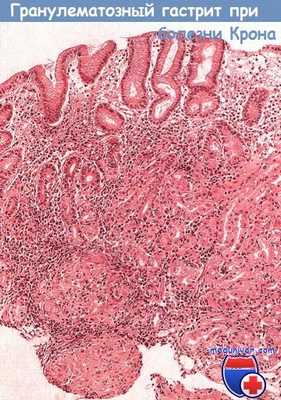
Микроскопическая картина гранулематозного гастрита при болезни Крона с поражением верхних отделов желудочно-кишечного тракта.
В области антрального отдела желудка определяются четкие неказеозные гранулемы, окруженные участками хронического воспаления в собственной пластинке слизистой оболочки
Лимфоцитарный гастрит также диагностируют гистологически, его клинические проявления неспецифичны, обычно не составляет труда дифференцировать это заболевание с лимфомой желудка.
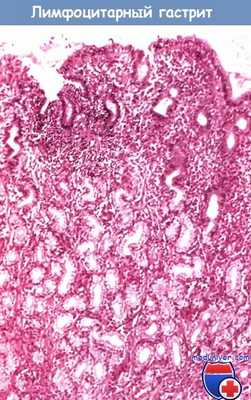
Микроскопическая картина лимфоцитарного гастрита антрального отдела желудка при малом увеличении.
В собственной пластинке слизистой оболочки определяется воспалительный инфильтрат умеренной плотности
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:
