Принципы и задачи замещающей инфузионной терапии
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Интраоперационная инфузионная терапия является неотъемлемым компонентом анестезиологического обеспечения хирургических вмешательств. Величина необходимой инфузии не может быть определена заранее как фиксированный объем растворов, она должна быть индивидуальной для каждого пациента [10]. Баланс жидкости во время оперативного вмешательства зависит от множества факторов, что крайне затрудняет его адекватную оценку. Известно, что стрессовый ответ на хирургическую операцию способствует задержке жидкости [11]. При обширных абдоминальных операциях ситуацию осложняет целый ряд дополнительных факторов: особенности предоперационной подготовки желудочно-кишечного тракта (ЖКТ), патофизиология основного заболевания, а также множество интраоперационных составляющих. Основными из них являются кровопотеря, вазодилатация, вызванная сосудорасширяющими препаратами (в частности, местными анестетиками при регионарной анестезии), и перспирация [14]. Стоит обратить внимание и на то, что стенка ЖКТ крайне плохо защищена от ишемического повреждения. Слизистая кишечника постоянно регенерирует, имеет высокую степень метаболической активности и, таким образом, является крайне уязвимой для ишемии. Так, для нарушения спланхнической перфузии достаточно 10-15% снижения внутрисосудистого объема [12]. Селективная вазоконстрикция мезентериальных артериол является одним из механизмов поддержания системного артериального давления (АД) в условиях гиповолемии, которая также может способствовать ишемическому повреждению органов ЖКТ [20].
В послеоперационном периоде дисфунция ЖКТ может проявляться различными клиническими состояниями - от угнетения перистальтики до нарушений усвоения энтерального питания. Не стоит забывать и про несостоятельность межкишечных анастомозов, которая в абдоминальной хирургии достоверно коррелирует с недостаточной доставкой кислорода [15]. Повреждение стенки ЖКТ вследствие гипоперфузии и ишемии ведет к потере ее барьерной функции с транслокацией эндотоксинов и микроорганизмов в системный кровоток, а также выделению большого количества провоспалительных медиаторов [7, 16]. Эти факторы могут вызывать развитие синдрома полиорганной недостаточности (СПОН) у пациентов, перенесших большие абдоминальные операции [17].
Гиперволемия, обусловленная недифференцированной волемической нагрузкой, также способствует повышению проницаемости капилляров и развитию отека тканей, что может послужить отправной точкой для возникновения порочного круга капиллярной утечки и СПОН [6]. Следует помнить, что сама по себе хирургическая травма сопровождается увеличением проницаемости капилляров и вызывает экстравазацию жидкости, при этом одновременная инфузионная терапия кристаллоидными растворами в объеме 5 мл/кг удваивает этот отек [3]. Реперфузионное повреждение и медиаторы воспаления также компрометируют сосудистый барьер, а ятрогенная гиперволемия способствует повреждению эндотелиального гликокаликса и вызывает массивное перемещение жидкости и белка в ткани [1, 9, 19].
Известно, что при проведении больших оперативных вмешательств на органах брюшной полости потери жидкости затрагивают преимущественно внутрисосудистый сектор, что может приводить к гиповолемии [8]. Широко применяемая эмпирическая инфузионная терапия основывается на данных рутинного мониторинга: контроля АД, частоты сердечных сокращений (ЧСС), центрального венозного давления (ЦВД), темпа диуреза. Эти параметры не являются надежными при оценке состояния волемического статуса, что затрудняет их использование для управления инфузионной терапией. При этом стратегия фиксированных объемов инфузионной терапии несет в себе риск либо перегрузки жидкостью, либо гиповолемии.
В последнее время широкое распространение получила концепция целенаправленной терапии (ЦНТ), которая позволяет индивидуализировать назначение растворов и использование вазоактивных препаратов на основании данных различных гемодинамических переменных. Установлено, что ЦНТ позволяет оптимизировать состояние внутрисосудистого сектора, тем самым поддерживая на должном уровне тканевую перфузию и оксигенацию, способствуя улучшению исходов после больших хирургических вмешательств [4, 18].
Для оценки волемического статуса у пациентов в условиях анестезии и искусственной вентиляции легких наиболее приемлемым показателем является вариабельность ударного объема (ВУО), позволяющая с хорошей чувствительностью и высокой специфичностью прогнозировать повышение сердечного выброса в ответ на инфузионную нагрузку [5]. Этот параметр может использоваться в качестве одного из основных при управлении инфузионной терапией с целью поддержания адекватного внутрисосудистого объема, что помогает обеспечивать стабильность гемодинамики, нормальную тканевую перфузию и доставку кислорода.
Наша цель - изучить влияние интраоперационной целенаправленной терапии, управляемой на основании мониторинга вариабельности ударного объема, на течение послеоперационного периода после хирургических вмешательств на органах ЖКТ.
Материал и методы
В проспективное исследование включены 28 пациентов, которым в плановом порядке были выполнены обширные оперативные вмешательства на органах ЖКТ по поводу злокачественных новообразований. Средний возраст пациентов составил 65,6±6,9 года. Состояние пациентов соответствовало II-III классам по шкале ASA. Оперативное вмешательство проводили в условиях сочетанной анестезии. Индукцию анестезии осуществляли пропофолом (1,5-2,0 мг/кг) и фентанилом (2 мкг/кг). Для миорелаксации использовали рокуроний. Анестезию поддерживали севофлюраном (минимальная альвеолярная концентрация 0,7-1,0) под контролем мониторинга глубины анестезии (биспектральный индекс в пределах 40-60) и эпидуральной аналгезией 0,2% раствором ропивакаина в сочетании с фентанилом.
При снижении САД до 60 мм рт.ст. болюсно вводили 5-10 мг эфедрина. Такие случаи расценивали как эпизоды гипотензии и подвергали анализу. Эпизоды постиндукционной гипотензии в обеих группах не учитывали, фиксировали только случаи после начала операции.
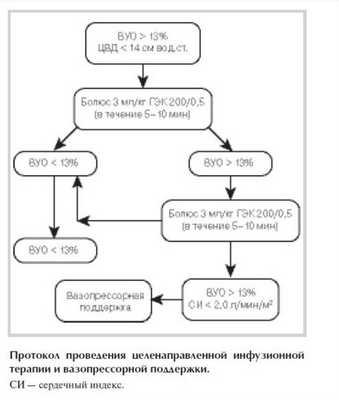
Протокол проведения инфузионной и вазопрессорной ЦНТ представлен на рисунке.
Параметры гемодинамики фиксировали на
4 этапах: I этап - до начала операции, непосредственно перед кожным разрезом, II этап - после вхождения в брюшную полость, III этап - после основного этапа операции (наложение анастомоза), IV этап - после ушивания апоневроза. Также на I и III этапах оценивали адекватность тканевой оксигенации на основании уровня лактата артериальной крови. В 1-е сутки после операции производили балльную оценку степени органной дисфункции по шкале SOFA. Дополнительно фиксировали частоту послеоперационных осложнений, сроки пребывания в отделении реанимации и интенсивной терапии (ОРИТ) и общее количество дней госпитализации, а также сроки восстановления функций ЖКТ.
До операции различий между группами по возрасту и функциональному статусу по ASA не было, объем и характер операций также не различались.
Полученные результаты обработаны статистически. Для каждого вариационного ряда рассчитывали среднюю арифметическую (М) и среднеквадратичное отклонение (σ). Достоверность различий результатов исследования оценивали с учетом t-критерия Стьюдента. Изменения считали достоверными, если величина р не превышала 0,05.
Результаты и обсуждение
Средняя продолжительность оперативного вмешательства была сопоставима в обеих группах. Объем интраоперационной кровопотери также достоверно не различался. Общий объем инфузии в пересчете на вес и длительность операции были выше у больных 1-й группы - соответственно 9,8±1,7 и 8,2±1,1 мл/кг/ч (р<0,05). Однако объем перелитых коллоидов был достоверно выше во 2-й группе - 536±74 мл против 429±63 мл в 1-й группе (р<0,05).
Параметры гемодинамики у обследованных пациентов представлены в табл. 1.
На I и II этапах исследования различий по изучаемым гемодинамическим параметрам между группами не выявили: значения ЧСС, САД и ЦВД не различались, что свидетельствовало об адекватности анестезии в условиях отсутствия значимых нарушений водного баланса. Уровень лактата на
I этапе также был сопоставим в обеих группах.
На III этапе исследования у пациентов 1-й группы отметили достоверное снижение САД по сравнению с предыдущим этапом, этот показатель также был ниже, чем у больных 2-й группы: 69,2±6,8 и 78,5±7,3 мм рт.ст. соответственно (р<0,05). На следующем этапе уровень САД возрастал, не отличался от исходных значений и не различался между обеими группами.
На III этапе исследования выявили повышение уровня ЦВД в обеих группах по сравнению с предыдущим этапом, кроме того, уровень ЦВД был достоверно выше у пациентов 2-й группы. Аналогичные различия между группами сохранялись и на IV этапе.
Уровень лактата в обеих группах находился в пределах референсных значений на всех этапах исследования. Однако в 1-й группе на III этапе значения лактата были достоверно выше, чем во 2-й, - 1,27±0,4 и 0,71±0,24 ммоль/л соответственно (р<0,05).
Различия в сроках госпитализации по группам не выявили, однако больные 1-й группы длительнее находились в ОРИТ, чем пациенты 2-й группы, - 3,2±0,9 и 1,2±0,3 дня соответственно (р<0,05).

У 7 пациентов 1-й группы и у 3 пациентов 2-й группы в 1-е сутки после операции регистрировали признаки органной дисфункции по шкале SOFA. Число больных, у которых развились осложнения, было меньше во 2-й группе - 2 против 6 в 1-й группе. Общее количество осложнений в послеоперационном периоде в 1-й группе было больше, чем во 2-й, - 10 и 2 соответственно (табл. 2 ). Это и определяло длительность их пребывания в ОРИТ.
Более низкие показатели частоты и степени органной дисфункции и меньшее количество осложнений во 2-й группе объяснялись оптимальной доставкой кислорода в интраоперационном периоде, достигнутой за счет адекватной тканевой перфузии. Об этом свидетельствует более низкий уровень лактата артериальной крови после основного (III) этапа операции во 2-й группе.
В интраоперационном периоде крайне важны момент возникновения дефицита внутрисосудистого объема, сопровождающегося гипоперфузией, и временные рамки, в которых этот дефицит удается корригировать. Без должного мониторинга подобные состояния верифицировать практически невозможно. Об этом свидетельствует тот факт, что у большинства пациентов в группе сравнения высокие показатели ВУО (что требовало болюсного введения коллоидов согласно протоколу) не сопровождались гипотензией, которая наряду с кровопотерей являлась одним из основных критериев для переливания коллоидов в контрольной группе. Соответственно в группе сравнения 11 пациентов получили инфузию коллоидов согласно протоколу ЦНТ, в то время как в контрольной группе коллоиды эмпирически использовали у 8 пациентов.
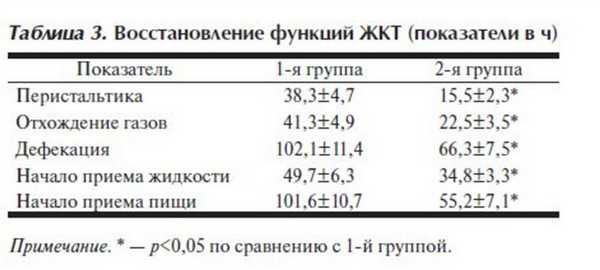
Восстановление функций ЖКТ происходило быстрее во 2-й группе (табл. 3 ). Временные интервалы до восстановления перистальтики, самостоятельного отхождения газов, самостоятельной дефекации, начала приема жидкости и перехода к полноценному питанию были существенно короче во 2-й группе. Это также объясняется более адекватной перфузией органов ЖКТ и, как следствие, оптимальной доставкой кислорода.
Таким образом, ВУО является приемлемым динамическим показателем для управления инфузионной терапией при больших абдоминальных операциях. Изменения в преднагрузке левого желудочка, вызванные колебаниями внутригрудного давления в условиях искусственной вентиляции легких, приводят к изменениям его ударного объема [2]. При гиповолемии изменения ударного объема наиболее выражены, поэтому вариабельность этого показателя - довольно чувствительный параметр для оценки состояния внутрисосудистого сектора [13]. Рутинные параметры мониторинга гемодинамики, оцененные в нашем исследовании, ожидаемо оказались малоинформативными в качестве индикатора внутрисосудистого объема, что отразилось на результатах.
ЦНТ, основанная на мониторинге ВУО, позволила оптимизировать не только количественную, но и структурную составляющие интраоперационной инфузионной терапии. При общем уменьшении объемов инфузии увеличилось количество коллоидных растворов. При этом адекватная инфузионная терапия сопровождается лучшей оксигенацией периферических тканей, о чем свидетельствует более низкий уровень лактата у больных, которым проводили ЦНТ.
Уменьшение числа послеоперационных осложнений и степени проявления органной дисфункции у пациентов 2-й группы обусловило сокращение сроков их пребывания в ОРИТ и стационаре. Восстановление нормального функционирования ЖКТ способствовало ранней активизации пациентов и более благоприятному течению послеоперационного периода.
Таким образом, целенаправленная инфузионная терапия сопровождается стабилизацией гемодинамики в интраоперационном периоде у пациентов, оперированных на органах брюшной полости.
Достижение целевых параметров гемодинамики с помощью инфузионной терапии способствует уменьшению количества осложнений в послеоперационном периоде и раннему восстановлению функции желудочно-кишечного тракта.
Принципы и задачи замещающей инфузионной терапии
Принципы и задачи поддерживающей инфузионной терапии. Расчет энергозатрат
Принципы поддерживающей терапии лежат в основе всех видов инфузионной терапии у детей. В целом они заключаются в том, что правильно проведенная поддерживающая терапия должна в точности компенсировать потери жидкости и воды (в состоянии покоя и нормотермии), тем самым сохраняя нормоволемию.
Объем вводимой жидкости рассчитывается таким образом, чтобы получить мочу с осмолярностью 280—310 мосм/л (то есть изотоничную) и удельным весом 1,010, не перенапрягая при этом почечные компенсаторные механизмы. Поддерживающая терапия подбирается исходя из уровня энергозатрат. Холидей и Сигар обнаружили, что суточные энергозатраты у детей можно приблизительно рассчитать по формуле: 100 ккал/кг для первых 10 кг + 50 ккал/кг для следующих 10 кг (до 20 кг) + 20 ккал/кг для следующих 60 кг (до 80 кг).
Потребность в воде составляет 100 мл на 100 ккал (помимо метаболической и поступающей с пищей воды), поэтому по этой же формуле можно рассчитать и объем поддерживающей инфузионной терапии. Например, для ребенка весом 14 кг объем поддерживающей терапии составляет 1000 мл (для первых 10 кг) + 50 мл/кг (для следующих 4 кг), что составляет 1200 мл/сут и соответствует энергозатратам 1200 ккал/сут. Аналогично рассчитывается и почасовая скорость введения жидкости: 40 мл/ч для первых 10 кг + 2 мл/кг/ч для следующих 4 кг, итого — 48 мл/ч.
У больных весом более 80 кг соотношение между весом и потребностями в воде отличается и применение данной формулы может дать завышенные результаты.
Стандартная поддерживающая инфузионная терапия возмещает только потери жидкости при испарении через легкие и кожу (так называемые скрытые потери), атакже через почки и ЖКТ. Однако в патологии возможны и другие пути потери воды и электролитов, называемые выходом в третье пространство. В таких случаях объем поддерживающей терапии увеличивают.
Потери воды с испарением через кожу и легкие называют скрытыми потерями, так как их объем сложно оценить. Около 2/3 скрытых потерь составляют потери через кожу, а 1/3 — через легкие. Испарение через легкие и дыхательные пути является одним из механизмов теплоотдачи и увлажнения вдыхаемого воздуха. Испарение с поверхности кожи также служит важнейшим механизмом теплоотдачи (надо отметить, что вода выделяется на поверхность кожи не только путем потоотделения). В обычных условиях на восполнение скрытых потерь приходится около трети объема поддерживающей инфузионной терапии.
Они выше у новорожденных (около 40%), ниже у подростков (около 25%) и существенно зависят от температуры и влажности окружающей среды. Скрытые потери увеличены при гипертермии, тахипноэ, нахождении вблизи источника тепла (в частности, обогревателя), а также в условиях сухой и жаркой окружающей среды. При температуре тела выше 38°С скрытые потери возрастают с каждым градусом на 12,5%. И, наоборот, при пониженной температуре тела или высокой влажности воздуха потери воды с испарением снижены.
Объем поддерживающей инфузионной терапии рассчитывают исходя из того, что моча должна быть изостенурической (с удельным весом 1,010) и изотоничной (с осмолярностью 280—310 мосм/л). На компенсацию почечных потерь приходится 2/3 объема поддерживающей инфузионной терапии. У детей младшего возраста диурез составляет примерно 2 мл/кг/ч. Когда нарушена концентрационная функция почек (например, при несахарном диабете, у недоношенных, больных серповидноклеточной анемией) или повышена почечная осмотическая нагрузка (например, при парентеральном питании), выделяется либо большое количество изотоничной мочи, либо гипотоничная моча; при этом следует соответственно увеличить объем вводимой жидкости.
При выделении концентрированной мочи (например, при гиперсекреции АДГ или сердечной недостаточности) объем вводимой жидкости снижают.
Состав инфузионных растворов подбирается таким образом, чтобы удовлетворялись энергетические потребности и потребность в электролитах (Na+, К+, Cl-). Эмпирическим путем выявлено, что на каждые 100 ккал или 100 мл жидкости требуется по 3 мэкв Na+ и Cl- и 2 мэкв К+. Такой состав способствует поддержанию гомеостаза и клеточного роста. Добавление 5 г глюкозы на каждые 100 мл жидкости позволяет восполнить дефицит энергии и предотвратить развитие кетоацидоза и распад белков.
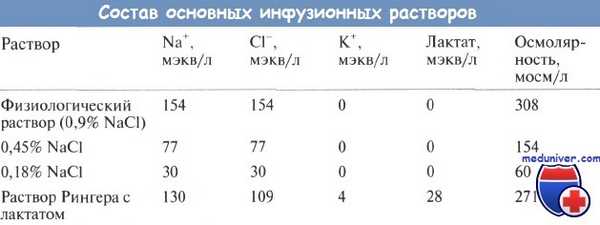
Таким образом, для поддерживающей инфузионной терапии рекомендуется использовать растворы, содержащие 30 мэкв/л натрия хлорида, 20 мэкв калия и 50 г/л глюкозы, например 0,18% NaCl с 5% глюкозы и 20 мэкв/л КО. Калий обычно добавляют в виде калия хлорида, из-за чего содержание хлора превышает расчетное, но не вызывает клинически значимой гиперхлоремии. Содержание натрия и хлора в различных растворах указано в таблице.
После введения рассчитанного количества жидкости следует оценить адекватность поддерживающей инфузионной терапии по изменению веса, сывороточной концентрации натрия и общему состоянию больного. Поддерживающая инфузионная терапия обеспечивает только 20% энергетических потребностей, поэтому больные, получающие только такую терапию, теряют в сутки от 0,5 до 1 % веса. Если количество вводимой жидкости меньше должного для поддерживающей терапии, а концентрация глюкозы в ней не увеличена, то потеря веса будет еще больше.
При правильном подборе поддерживающей инфузионной терапии сывороточная концентрация натрия составляет 130—140 мэкв/л. Повышение веса в сочетании со снижением сывороточной концентрации натрия или с появлением отеков указывает либо на введение избыточного количества жидкости, либо на нарушения выделения воды через легкие, кожу или почки, в том числе ятрогенного происхождения. Наоборот, быстрая потеря веса в сочетании с повышением сывороточной концентрации натрия и(или) постоянной тахикардией может быть обусловлена недостаточным введением или повышенным расходом жидкости; важно искать возможные причины такого повышенного расхода.
Таким образом, инфузионная терапия у детей требует непрерывного контроля за постоянно меняющимися клиническими и физиологическими показателями.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Современная инфузионная терапия. Достижения и возможности
Инфузионная терапия является неотъемлемой частью лечения различных категорий больных. О возможностях применения ее достижений в клинической практике рассказывает профессор-консультант Центра экстракорпоральной детоксикации (ВМедА), д-р мед. наук Альфред Львович Костюченко.
История
В начале 30-х годов XIX столетия английский врач Т. Latta в журнале "Lancet" опубликовал работу о лечении холеры внутривенным вливанием растворов соды.
10 июля 1881 года Landerer успешно провел вливание больному "физиологического раствора поваренной соли", обеспечив бессмертие этой инфузионной среде, с которой мировая медицинская практика вошла в XX век - век становления и развития инфузионной терапии.
1915 год - использован на практике кровезаменитель на основе желатины (Hogan) - первый из коллоидных кровезаменителей;
1940 год - внедрен в практику "Перистой", первый из кровезаменителей на основе синтетического коллоида поливинилпирролидона (Reppe, Weese и Несht);
1944 год - разработаны кровезаменители на основе декстрана (Gronwall и Ingelman). Последующие четверть века были эрой безраздельного господства декстрановых кровезаменителей;
1962 год - началось клиническое внедрение растворов гидроксиэтидированного крахмала (Thompson, Britton и Walton), однако настоящий расцвет эры ГЭК происходит только к концу 20-го столетия.
В 60-х годах, одновременно в США (Rabiner) и СССР в ЛИПКе (академик АН. Филатова с сотр.) ведутся работы по созданию кровезаменителей на основе очищенного от стромы человеческого гемоглобина. В результате в нашей стране создается клинически доступный препарат "Эригем", успешно использованный для кровезамещения во время операций на легких (ВМедА, академик И.С. Колесникова с сотр.).
1966 год - первые публикации по перфторуглеродам (ПФУ) как возможным искусственным переносчикам кислорода в организме человека (L.Clark, LF. Gollan).
1979 год - В СССР создан первый в мире, в последующем клинически апробированный, кровезаменитель на основе ПФУ - "Перфторан" (ГР. Граменицкий, ИЛ. Кунъянц, Ф.Ф. Белоярцев).
1992 год - введен в клиническую практику оригинальный кровезаменитель на основе полиэтиленгликоля - "Полиоксидин" (Петербургский НИИГПК, Л А Седова, ЛГ. Михайлова и др.).
1997 год - прошел клинические испытания созданный в Петербургском НИИГПК полимеризированный человеческий гемоглобин "Геленпол" (ЕА Селиванов с сотр.). Разрешен к медицинскому применению с 1998 года.
Сегодня повсеместно для лечения больных используется инфузионная терапия - вливание в организм больного больших количеств различных жидкостей в течение значительного времени.
Цели проведения инфузионной терапии разнообразны: от психологического воздействия на пациента (как же - ведь "ставится капельница!") и разведения до безопасного уровня необходимых сильнодействующих лекарственных средств до решения ряда задач реанимации и интенсивной терапии.
Именно последние - задачи реанимации и интенсивной терапии, возникающие перед врачом в конкретных клинических ситуациях - и определяют основные направления инфузионной терапии:
- волюмокоррекция - востановление адекватного объема циркулирующей крови (ОЦК) и нормализация ее состава при кровопотере;
- гемореокоррекция - нормализация гомеостатических и реологических свойств крови;
- инфузионная регидратация - поддержание нормальной микро- и макроциркуляции (в частности - при клинически отчетливой дегидратации);
- нормализация электролитного баланса и кислотно-основного равновесия;
- активная инфузионная дезинтоксикация;
- обменкорригирующие инфузии - прямое воздействие на тканевой метаболизм за счет активных компонентов кровезаменителя.
Волюмокоррекция
При кровопотере и для востановления адекватного ОЦК могут быть использованы инфузионные среды с различным волемическим эффектом.
Изотонические и изоосмотические электролитные растворы моделируют состав внеклеточной жидкости, обладают малым непосредственным волюмическим эффектом (не более 0.25 от объема введенной среды, даже при отсутствии гипопротеинемии), но являются предпочтительными при сочетании кровопотери и дегидратации.
В настоящее время из группы коллоидных кровезаменителей все большую популярность приобретают растворы гидроксиэтилкрахмала (ГЭК) - инфукол, рефортан, стабизол, ХАЭС-стерил. Они обладают высоким непосредственным волемическим эффектом (1.0 и более) и большим периодом полувыведения при относительно небольшом количестве побочных реакций.
Сохраняют свои клинические позиции волюмокорректоры на основе декстрана (полиглюкин, реополиглюкин, реоглюман, лонгастерил, реомакродекс, неорондекс) и желатины (желатиноль, модежель, гелофузин). Все больше внимания привлекает новый препарат на основе полиэтиленгликоля - полиоксидин. В интенсивной терапии для восстановления адекватного ОЦК используются препараты крови. Однако применение донорской плазмы значительно ограничено редкостью препарата, побочными реакциями, опасностью переноса вирусной инфекции. Поданным некоторых авторов, при внутривенном использовании человеческого сывороточного альбумина (ЧСА), из-за повышенной проницаемости эндотелия для альбумина, препарат быстро выходит из кровеносного русла в интерстициальное пространство, усиливая отек, в том числе в органах жизнеобеспечения (легкие, тонкая кишка).
Появляется все больше публикаций о преимуществах терапии острого дефицита ОЦК и шока так называемой низкообъемной гиперосмотичной волюмокоррекцией (НГВ). Она заключается в последовательном внутривенном введении гипертонического электролитного раствора (например, 7.5% раствора NaCl из расчета 4 мл/кг массы тела (МТ) больного) с последующей инфузией коллоидного кровезаменителя (например, 250 мл полиглюкина или рефортана) для закрепления эффекта перемещения в сосуды интерстициальной жидкости.
- рациональный доступ к сосудистой системе с помощью канюлирования или катетеризации сосудов или в целом к внутренней среде организма больного;
- техническое обеспечение - применение пассивного, гравитационного инфузионного тракта (системы) или активного - на основе насосов-инфузоров;
- медицинскими и коммерческими возможностями выбора инфузионной среды, соответствующей конкретной клинической задаче;
- контролем достигнутого эффекта с помощью клинико-лабораторных критериев, а в трудных случаях - с помощью мониторного наблюдения, позволяющего оценивать on line центральную гемодинамику, состояние жидкостных пространств организма больного, изменение микроциркуляции крови.
Вариантами подобной волюмокоррекции, кроме указанных веществ, могут быть гипертонический раствор смеси хлорида и ацетата натрия, реополиглюкин с добавлением маннитола (реоглюман) или гипертоническая плазма, донорская или аутологичная, заготовленная в ходе аппаратного плазмафереза во флаконы с лиофилизированным сорбитолом. Методами доказательной медицины установлено, что НГВ способствует:
быстрому и стойкому повышению АД и сердечного выброса на фоне шока;
Гемореокоррекция
Одновременно с волюмокоррекцией или без нее может использоваться инфузионная гемореокоррекция. В ее основе может лежать изоволемическая гемодилюция с извлечением части крови или без нее.
Для решения этой задачи ранее получили признание декстраны, особенно низкомолекулярные, а в настоящее время - растворы ГЭК. Значимые для клинического применения результаты получены при использовании кислородпереносящего кровезаменителя на основе фторированных углеродов перфторана. Его гемореокорригирующее действие определяется не только эффектом гемодилюции и повышением электрического распора между клетками крови, но и изменением вязкости крови и восстановлением микроциркуляции в отечных тканях.
Регидратация
Для инфузионной регидратации используются сбалансированные по основным электролитам и гипоосмотичные или изоосмотичные электролитные растворы: натрия хлорида, Рингера, ацесоль, лактосол и другие. При проведении регидратации можно использовать различные пути введения жидкости:
сосудистый (в условиях функциональной сохранности сердца и легких - лучше внутривенно, при перегрузке правого сердца и синдроме острого легочного повреждения (ОЛП) -предпочтительно внутриаортальный путь);
Для быстрой нормализации электролитного баланса и купирования внутриклеточных электролитных расстройств созданы специальные инфузионные среды (калия-магния аспарагинат, ионостерил, раствор Хартмана).
Для инфузионной коррекции некомпенсированных метаболических расстройств кислотно-основного равновесия применяют:
- ри ацидозе - растворы бикарбоната илилактата натрия, трисаминол, трометамоп:
- при алкалозе - разведенный на растворе глюкозы 1н. раствор HCl (например, при сочетании алкалоза и гипохпоремии), алкамин.
Детоксикация
Различают интракорпоральный способ активной детоксикации с применением инфузионной терапии и экстракорпоральный
(сорбционные и аферезные методы), который также не обходится без инфузионного сопровождения. Для интракорпоральной детоксикации используют:
- растворы глюкозы и/или кристаллоидов, обеспечивающие гемодилюцию (уменьшение повреждающего действия экзогенных и эндогенных токсических субстанций за счет их разведения) и улучшение кровоснабжения тканей и органов, что вызывает ускоренное вымывание токсических веществ;
При применении обеих групп инфузионных детоксикационных средств целесообразно использовать инфузионно-форсированный или медикаментозно-форсированный диурез, обеспечивающий высокий темп мочевыделения (оптимально 4-5 мл/кг МТ в час) на протяжении часов и суток.
Обменкорригирующая инфузия
Обменкорригирующая инфузия - прямое воздействие на тканевой метаболизм за счет активных компонентов кровезаменителя; по сути дела - направление инфузионной терапии, пограничное с медикаментозной терапией.
Первой в ряду обменкорригирующих инфузионных сред следует считать так называемую поляризующую смесь, предложенную французским патофизиологом А. Лабори как среду стрессовых ситуаций. Ее основу составлял раствор глюкозы с инсулином с добавлением солей калия и магния, что позволяло предотвращать развитие микронекрозов миокарда на фоне гиперкатехоламинемии.
Другим направлением следует считать полиионные среды, содержащие субстратные антигипоксанты - фумарат (мафусол, полиоксифумарин) и сукцинат (реамберин).
К обменкорригирующим инфузиям можно относить вливание перфторана и кислородпереносящих кровезаменителей на основе модифицированного гемоглобина - геленпола и гелевина, которые оптимизируют энергетический обмен в органах и тканях за счет повышения доставки к ним кислорода.
Благоприятная коррекция нарушенного обмена веществ достигается применением инфузионных гепатопротекторов. Они нормализуют не только метаболизм в поврежденных гепатоцитах, но и связывают маркеры летального синтеза при гепатоцеллюлярной несостоятельности, в частности, аммиак (гепастерил А). В некоторой степени к обменкорригирующим инфузиям можно отнести парентеральное искусственное питание. Купирование персистирующей белково-энергетической недостаточности и нутриционная поддержка больного достигается инфузиями специальных питательных сред.
Другие возможности
Определенное значение в интенсивной терапии имеют ситуации, в которых используют не плазмозамещающие свойства кровезаменителей. Например:
- использование перфторана для купирования ОЛП при травматической жировой эмболии или в остром периоде черепно-мозговой травмы, что позволяет уменьшить выраженность отека и набухания головного мозга;
- предотвращение капиллярной утечки внутрисосудистой жидкости при генерализованной инфекции средами на основе ГЭК;
- внутрисосудистое связывание воспалительных медиаторов и свободных радикалов (например, N0) растворами модифицированного гемоглобина.
Все это показывает, как далеко шагнула медицинская наука за 100 лет планомерного использования инфузионной терапии в клинической практике.
Инфузионная терапия: методика, способы, энтеральное и парентеральное питание, риски и осложнения
Критические состояния организма могут быть обусловлены недостатком жидкости и минеральных веществ в организме. При этом в первую очередь нарушается работа сердечно-сосудистой системы из-за гемодинамических расстройств.
Инфузионная терапия направлена на восстановление объема жидкости и концентрации электролитов в организме. Такой способ лечения часто применяется при инфекционных заболеваниях.
Что такое инфузионная терапия
Инфузионная терапия — внутривенное введение препаратов
Инфузионная терапия подразумевает непосредственное вливание лекарственных веществ внутривенным путем через иглу или катетер.
Как правило, такой способ введения направлен на восстановление постоянства внутренней среды организма. Также это эффективный способ терапии в случае, если оральный способ введения лекарств невозможен.
Заболевания, при которых обычно необходима инфузионная терапия, включают инфекции, обезвоживание, желудочно-кишечные патологии и отравления.
Было доказано, что при определенных болезнях внутривенный способ гидратации является более эффективным. Так, если у пациента постоянная рвота на фоне отравления, пероральное введение жидкости не представляется возможным.
Доставка воды, минеральных и питательных веществ, минующая желудочно-кишечный тракт, не лишена минусов. Как и любая другая инвазивная процедура, инфузионная терапия может стать причиной инфекционного процесса, воспаления вены и кровоизлияния.
Кроме того, для многих пациентов такой способ лечения может быть болезненным. Тем не менее внутривенное введение лекарств может быть незаменимым при критических состояниях. Ежегодно инфузионная терапия спасает жизни огромного количества людей.
Данный вид терапии был разработан в начале XIX века для лечения холеры. Обезвоженным пациентам вводили растворы соды внутривенным путем. Ближе к двадцатому веку большую эффективность показали растворы поваренной соли.
Позднее, на протяжении двадцатого века ученые разработали несколько видов заменителей крови, основанных на органических и неорганических искусственных компонентах.
Физиологические аспекты
Растворы для инфузионной терапии
Организм содержит огромное количество воды в составе крови, спинномозговой жидкости, внутриклеточных и внеклеточных компонентов. Поступление жидкости вместе с пищей и выделение воды через потовые железы и мочевыводящую систему позволяет поддерживать определенный баланс.
Различные заболевания могут значительно уменьшать объем жидкости и провоцировать опасные состояния. К наиболее опасным ситуациям относят неконтролируемую рвоту, усиленное мочеиспускание, диарею на фоне инфекций и непосредственную кровопотерю.
Клетки и органы страдают от недостатка воды по разным причинам. Во-первых, вода является универсальным растворителем и средой для важнейших внутриклеточных процессов. Во-вторых, в жидкости содержатся электролиты, необходимые для проведения электрических сигналов и обеспечения других важных процессов.
Таким образом, значительная потеря жидкости приводит к следующим основным нарушениям:
- Снижение кровяного давления на фоне недостаточного объема крови.
- Поражение нервной системы, обусловленное недостатком питательных и минеральных веществ.
- Клеточные изменения, связанные с нарушением осмотического баланса.
- Мышечная слабость из-за потери возможности сокращаться. Также наблюдается и в мышечной оболочке сердца.
Основными электролитами, необходимыми для работы сердца, являются натрий, калий, магний и кальций. Все эти вещества также вымываются из организма при рвоте, диарее, кровопотери и избыточном мочеиспускании. Дальнейшие изменения кислотно-щелочного баланса крови лишь усугубляют ситуацию.
Поступление питательных веществ и витаминов также имеет значение. При различных структурных и функциональных патологиях желудочно-кишечного тракта может быть ограничен как обычный способ питания, так и инструментальные способы введения пищевых субстратов. Длительный дефицит белка, углеводов и жиров становится причиной снижения массы тела и дистрофических процессов в органах.
Цели и задачи
Главной целью инфузионной терапии является поддержание постоянства внутренней среды организма. Это включает восстановление минеральных и питательных веществ, регидратацию и коррекцию кислотно-щелочного баланса.
Внутривенный способ терапии часто обусловлен нарушением функций желудочно-кишечного тракта, когда обычный способ питания не представляется возможным. Также при тяжелом обезвоживании для регидратации применяется только инфузионная терапия.
К второстепенным целям терапии относят дезинтоксикацию. Так, при тяжелых инфекционных заболеваниях и отравлениях в крови могут накапливаться вредные вещества, токсины, нарушающие функции тканей и органов.
Внутривенное замещение жидкостей ускоряет процесс удаления токсинов из организма и способствует скорейшему выздоровлению пациента.
При использовании инфузионной терапии должны быть учтены следующие главные принципы:
- Введение лекарственных компонентов необходимо для экстренного восстановления гомеостаза и ликвидации патофизиологических состояний.
- Терапия не должна усугублять состояние пациента.
- Строгий лабораторный контроль во избежание избыточного введения компонентов.
Соблюдение этих принципов делает такой способ терапии наиболее безопасным и эффективным.
Показания к применению

Инфузионная терапия имеет огромное значение в лечении
Как уже было сказано, основным показанием является нарушение баланса жидкости, минеральных и питательных веществ в организме.
При этом внутривенный способ доставки жизненно необходимых компонентов в кровь должен быть обусловлен неэффективностью других методов терапии.
Основные состояния, требующие внутривенных вливаний:
- Обезвоживание – резкий дефицит жидкости в организме. К признакам этого состояния относят сильную жажду, слабость, нарушение работы желудочно-кишечного тракта и различные неврологические нарушения. Критическим показателем является потеря более 20% жидкости.
- Инфекционные заболевания, сопровождающиеся обильной рвотой и жидким стулом. Как правило, это инфекции органов пищеварения, обусловленные попаданием токсинов, вирусов и бактериальных клеток вместе с пищей. Целью лечения является не только восстановление жидкостного баланса, но и удаление токсинов.
- Токсические поражения организма на фоне отравления, приема наркотиков и алкоголизма. Специальные растворы помогают нейтрализовать вредные вещества и вывести их из организма.
- Избыточное выделение мочи. Состояние может быть обусловлено электролитными нарушениями, поражением мочевыводящей системы, сахарным диабетом и другими патологиями.
- Значительная кровопотеря на фоне травм и патологий внутренних органов.
- Ожоговая болезнь, нарушающая баланс жидкости и электролитов в тканях.
- Психические заболевания, при которых пациент отказывается от приема пищи.
- Шоковые состояния, требующие реанимационных мероприятий.
Перед применением инфузионной терапии проводится тщательная лабораторная и инструментальная диагностика. Еще во время физического обследования пациента врачи могут выявить опасное состояние при появлении таких симптомов, как сухость кожи, нарушение дыхания и сухость слизистых оболочек.
С помощью анализов определяется концентрация электролитов в крови и наличие токсинов. По мере возобновления жидкостного и электролитного баланса врачи также контролируют лабораторные показатели.
Методика и способы
Для внутривенной инфузионной терапии обычно используется капельница. Длинная трубка соединена с упаковкой лекарственного раствора на штативе.
Перед введением препарата кожа в области прокола обрабатывается антисептиком и при необходимости используется жгут. Затем проводится венепункция, открытие зажима и настройка скорости поступления раствора.
Способ прокола вены может иметь разные показатели травматичности. Это может быть обычная игла или специальный катетер. Также методика терапии зависит от используемого сосуда. Раствор может быть введен в центральные или периферические вены.
С точки зрения уменьшения рисков предпочтительно использование подкожных вен, однако в некоторых случаях это невозможно. Также крайне редко применяется внутрикостный и артериальный доступ.
Врач определит, какой раствор необходим конкретному пациенту. Это может быть стандартный физиологический раствор, содержащий хлорид натрия, питательный раствор или заменитель крови. При этом специалист ориентируется на тяжесть состояния и лабораторные показатели крови.
Энтеральное и парентеральное питание
Инфузионная терапия должна проводится в строго стерильных условиях
Энтеральный способ доставки питательных веществ и жидкости в организм является естественным. Пищевые субстраты поступают в желудочно-кишечный тракт и всасываются через слизистую оболочку, попадая в кровеносные и лимфатические сосуды.
Парентеральное введение, к которому относится инфузионная терапия, предполагает непосредственную доставку жизненно важных компонентов в кровь. У каждого способа есть свои плюсы и минусы.
Показания для парентерального питания:
- Структурные патологии кишечника.
- Выраженное расстройство функций почек.
- Изменение длины кишечника после оперативных вмешательств.
- Ожоги.
- Недостаточная деятельность печени.
- Болезнь Крона и другие хронические воспалительные заболевания кишечника.
- Отказ от приема пищи из-за психических расстройств.
- Непроходимость отделов желудочно-кишечного тракта.
- Острая интоксикация.
Именно в перечисленных случаях парентеральный способ введения питательных веществ является предпочтительным и крайне необходимым. Как правило, в состав растворов входят белки, жиры, углеводы, вода, минеральные компоненты и витамины.
К возможным противопоказаниям относят воспалительные заболевания кровеносных сосудов.
Риски и осложнения
Несмотря на то, что соблюдение основных принципов инфузионной терапии обеспечивает высокие показатели безопасности, не исключено возникновение осложнений.
Основные побочные эффекты не отличаются от любой другой внутривенной терапии и включают образование подкожных гематом, возникновение инфекционных процессов и воспаление сосудов.
К дополнительным рискам, связанным непосредственно с инфузионной терапией и регидратацией, относят:
- Избыточное введение жидкости.
- Избыточное введение определенных электролитов. Это приводит к нарушению кислотно-щелочного баланса крови и расстройству функций органов.
- Аллергические реакции на компоненты раствора.
В большинстве случаев осложнения легко поддаются коррекции. Для устранения синяков и инфильтратов используются методы физиотерапии.
Местное воздействие тепла помогает устранять подкожные скопления крови. В домашних условиях можно использовать специальные компрессы. Инфекционные и аллергические процессы, в свою очередь, устраняются медикаментозным путем.
Таким образом, инфузионная терапия является одним из самых важных способов неотложной помощи при нарушении постоянства внутренней среды организма. Метод применяется в реанимационных, терапевтических и других отделениях больниц.
Максимум полезной информации об инфузионной терапии — в видеосюжете:
Инфузионная терапия

Данную терапию назначают при лечении различных заболеваний, например таких, как: отравление, поражение ЖКТ, обезвоживание, различные инфекции и т.д. Такой метод будет наиболее эффективен, например, если у пациента регулярная рвота. В этом случае введение лекарств или питательных препаратов перорально невозможно. Потеря жидкости может за короткий промежуток времени привести к множеству опасных последствий:
- снижение артериального давления, возникающее на фоне нехватки объема циркулирующей крови;
- клеточные изменения, возникающие на фоне патологического изменения осмотического баланса;
- поражения нервной и периферической системы из-за недостатка минеральных или питательных веществ;
- мышечная слабость, что особенно важно для функционирования сердца, мышцы которого попросту не смогут сокращаться.
Лекарственные средства, применяемые при использовании инфузионной терапии, насыщают организм электролитами. Основными электролитами для функционирования внутренних органов являются: натрий, калий, магний и кальций. Именно эти элементы первыми вымываются во время рвоты, диареи, сильного кровотечения.
Также очень важно при обезвоживании своевременное поступление в организм питательных веществ. Часто, введение пищи орально становится невозможным, возникающий дефицит белка приводит к запуску дистрофических процессов в организме. Инфузионная система доставляет все необходимые элементы для нормального функционирования организма в кровь, минуя все этапы процесса пищеварения.
Инфузионная терапия необходима для восстановления и поддержания в нормальном состоянии организма человека. В это понятие входит нормализация получения питательных веществ, регидратация и оперативная коррекция кислотно-щелочного баланса.
Второстепенной целью инфузионной терапии часто выступает экстренная дезинтоксикация. Часто при инфекционных заболеваниях в организме пациентов накапливаются токсины, способные нарушить функциональность внутренних органов или вызывать их серьезные повреждения. Использование инфузионных вливаний позволяет ускорить их вывод естественным путем. Это обеспечивается за счет процесса замещения жидкостей.
Важно учитывать и принципы инфузионной терапии:
Не должна оказывать негативное влияние на состояние больного.
Своевременное введение медикаментозных препаратов через инфузионную систему позволяет быстро восстановить гомеостаза и устранить патофизиологические состояния.
Проводится строгий контроль объемов введения жидкостей для исключения их переизбытка.

Система ТЕТ-А-ТЕТ для переливания крови с пластиковым шипом и иглой 18Gх1 1/2 (1,20*40 мм) Luer Slip (упаковка, 25 шт)

Средства индивидуальной защиты для инфекционных отделений

Виды спиртовых салфеток
Спиртовые салфетки – незаменимые медицинские изделия для антисептической обработки
Применение спанбонда в медицине
Спанбонд - нетканое полотно, получаемое из расплава полимера с последующим термоскреплением.
Читайте также:
- ВИЧ-миелопатия. Диагностика вич миелопатии. Лечение вич миелопатии.
- Гипердиагностика нейроциркуляторной дистонии. Дифференциация вегето-сосудистой дистонии с ИБС и гипертонической болезнью
- КТ, МРТ при болезни Гиппеля-Линдау
- Лучевая диагностика послеоперационной деформации позвоночника
- Классификация опущения молочной железы (птоза)
